体外分析诊断仪、循环肿瘤细胞分选富集的微流控芯片及方法与流程
1.本发明涉及细胞分选技术领域,特别是涉及一种体外分析诊断仪、循环肿瘤细胞分选富集的微流控芯片及方法。
背景技术:
2.癌症在全球正常死因中排名第二,每6人中就有1人死于癌症。肿瘤转移是引起癌症90%的死亡原因。肿瘤转移过程就是肿瘤细胞从原发灶或转移灶上脱落,在淋巴系统或外周血中循环,从而入侵远端的组织,并形成新的肿瘤灶,最终导致患者死亡。这些脱落下来的肿瘤细胞就称为循环肿瘤细胞(circulating tumor cell,ctc)。因而通过检查血液中循环肿瘤细胞的数量和种类,即可监测肿瘤病变的动态变化,评估治疗效果。对分离出来的循环肿瘤细胞进行免疫分型、基因组测序等分析,可以找到药物靶点,从而实现个性化精准治疗。循环肿瘤细胞对于肿瘤早期筛查也极为重要,肿瘤在1-2毫米时,影像学等手段很难检测出来。但是在很多中癌症的早期阶段,血液中就含有一定数量的循环肿瘤细胞。对于一些有高风险患者,定期的进行循环肿瘤细胞检测,有助于癌症的早发现,早治疗,避免病情恶化。
3.因此,从血液中分选和富集循环肿瘤细胞显得尤为重要,但是循环肿瘤细胞含量极低,通常情况下每毫升的血液中含1-10个循环肿瘤细胞,每毫升白细胞的含量为数百万个,红细胞含量为数十亿个,要分选和富集循环肿瘤细胞的难度如同大海捞针。针对分选和富集循环肿瘤细胞的技术大致分为:免疫磁珠法、密度梯度离心法、膜过滤法、微流控芯片技术。其中,传统的微流控芯片的流道循环肿瘤细胞与白细胞容易重叠,不利于循环肿瘤细胞的回收。
技术实现要素:
4.基于此,有必要针对上述的问题,提供一种体外分析诊断仪、循环肿瘤细胞分选富集的微流控芯片及方法,能有效避免循环肿瘤细胞与白细胞重叠,利于循环肿瘤细胞的回收。
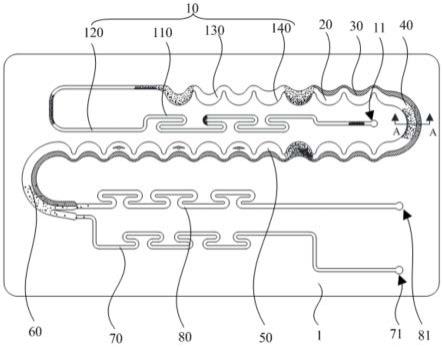
5.一种循环肿瘤细胞分选富集的微流控芯片,包括功能板,所述功能板的第一侧面上设有:
6.初选流道,与样本入口连通,用于使样本中的循环肿瘤细胞与白细胞初步聚集;及
7.精筛流道,与所述初选流道连通,所述精筛流道中远离循环肿瘤细胞聚集的一侧挖设有加深流道,所述加深流道沿所述精筛流道延伸方向设置且所述加深流道的深度大于所述精筛流道的深度。
8.上述循环肿瘤细胞分选富集的微流控芯片,将血液样本稀释后由样本入口通入初选流道,由于惯性升力、迪恩曳力等的受力影响,红细胞的直径较小,在初选流道中混乱无序的流动,而白细胞和循环肿瘤细胞的直径较大,在初选流道中作用力的平衡下,会初步聚
集成带,而后流入精筛流道内,循环肿瘤细胞刚聚体成细带,并靠近精筛流道内壁底部,而白细胞还未聚集于管道内壁底部,但白细胞和循环肿瘤细胞聚集的带靠得很近,通过在精筛流道中远离循环肿瘤细胞聚集的一侧挖设有加深流道,加深流道沿所述精筛流道延伸方向设置且所述加深流道的深度大于所述精筛流道的深度,打乱了精筛流道外壁附近的液体流动状态,使得惯性升力与迪恩曳力改变,破坏原有的平衡,从而使得白细胞能产生无序的运动状态,进而使得白细胞在精筛流道中分布更加均匀,避免白细胞聚体的带和循环肿瘤细胞重叠,同理红细胞也分布得更加均匀,既保证了不干扰循环肿瘤细胞的聚体,也防止了白细胞聚集于精筛流道内壁底部,便于后续把循环肿瘤细胞与白细胞分离开,利于循环肿瘤细胞的回收。
9.在其中一实施例中,所述加深流道的深度比所述精筛流道的深度大50μm-200μm;或者所述加深流道的深度比所述精筛流道的深度大70μm-120μm。
10.在其中一实施例中,所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比小于等于0.5;或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比小于等于0.07;或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比为0.045~0.065;或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比为0.05~0.06。
11.在其中一实施例中,所述功能板的第一侧面上还设有第一转弯流道,所述第一转弯流道的曲率半径大于所述精筛流道的曲率半径,所述第一转弯流道与所述精筛流道流通,所述加深流道对应地延伸至所述第一转弯流道中且位于远离循环肿瘤细胞聚集的一侧。
12.在其中一实施例中,所述功能板的第一侧面上还设有去除流道,所述去除流道与所述第一转弯流道远离精筛流道的一端连通,所述加深流道对应地延伸至所述去除流道中且位于远离循环肿瘤细胞聚集的一侧,所述去除流道中开设有贯穿所述去除流道壁面的分流孔。
13.在其中一实施例中,所述功能板的第一侧面上还设有第二转弯流道,所述第二转弯流道的曲率半径大于所述去除流道的曲率半径,所述第二转弯流道与所述去除流道远离所述第一转弯流道的一端连通,所述加深流道对应地延伸至所述第二转弯流道中且位于远离循环肿瘤细胞聚集的一侧。
14.在其中一实施例中,所述第二转弯流道远离所述去除流道的一端设有相互独立的回收流道与废液流道,所述回收流道与所述第二转弯流道中靠近循环肿瘤细胞聚集的一侧连通,所述废液流道与所述第二转弯流道中靠近加深流道的一侧连通。
15.在其中一实施例中,所述废液流道与所述回收流道流出的液体的占比为45%-65%:3%-20%;或者所述废液流道与所述回收流道流出的液体的占比为50%-60%:5%-10%。
16.在其中一实施例中,所述废液流道与所述回收流道呈往复回折结构。
17.在其中一实施例中,所述功能板的第二侧面上设有呈往复回折结构的缓冲流道,所述缓冲流道与所述分流孔连通。
18.在其中一实施例中,所述缓冲流道流出的液体的占比为30%-70%;或者所述缓冲流道流出的液体的占比为45%-60%。
19.在其中一实施例中,所述去除流道中对应所述分流孔入口处设有阻挡件,且所述
阻挡件位于所述分流孔远离所述加深流道的一侧,所述阻挡件沿所述去除流道的延伸方向的宽度大于所述分流孔的直径。
20.在其中一实施例中,沿所述去除流道的延伸方向依次设有多个分流孔,所述功能板的第二侧面上设有多个呈往复回折结构的缓冲流道,所述缓冲流道与所述分流孔一一对应连通;所述去除流道中对应所述分流孔入口处设有阻挡件,且所述阻挡件位于所述分流孔远离所述加深流道的一侧,所述阻挡件沿所述去除流道的延伸方向的宽度大于所述分流孔的直径。
21.在其中一实施例中,沿样本流动方向,多个所述分流孔与对应的所述加深流道的距离逐渐增大。
22.在其中一实施例中,沿样本流动方向,靠近所述第一转弯流道的分流孔对应的缓冲流道的长度大于其他缓冲流道的长度。
23.在其中一实施例中,所述初选流道包括依次连通的导入段、连接段及分选段,所述导入段远离所述连接段的一端与所述样本入口连通,所述导入段呈往复回折结构。
24.在其中一实施例中,所述连接段包括依次连通的第一直管段、第一弧形段、第二直管段、第二弧形段及第三直管段,第一直管段与所述导入段远离样本入口的一端连接,所述第三直管段与所述分选段连接。
25.在其中一实施例中,所述导入段的末端沿顺时针方向设置且与所述第一直管段连接。
26.在其中一实施例中,所述分选段包括依次连通的衔接段与主管段,所述衔接段与所述第三直管段连接,所述主管段与所述精筛流道连接,所述衔接段垂直其延伸方向上的宽度为a,所述主管段垂直其延伸方向上的宽度为b,a《b,所述分选段为宽度方向上不对称的波浪形通道。
27.在其中一实施例中,所述精筛流道及所述去除流道为正弦型弧形流道。
28.在其中一实施例中,所述的循环肿瘤细胞分选富集的微流控芯片还包括上盖板与下盖板,所述上盖板上开设有样本入口,且所述上盖板与所述功能板的第一侧面叠置连接,所述下盖板上开设有回收孔、废液孔及排出孔,且所述下盖板与所述功能板的第二侧面叠置连接,所述回收流道与所述回收孔连通,所述废液流道与所述废液孔连通,所述分流孔与所述排出孔连通。
29.一种循环肿瘤细胞分选富集的方法,包括如下步骤:
30.将经稀释后的血液样本由微流控芯片的样本入口通入,血液样本经过具有往复回折结构的初选流道后,血液样本中的循环肿瘤细胞与白细胞初步聚集,其中循环肿瘤细胞聚集成细带并靠近初选流道内壁底部,而白细胞还未聚集于初选流道内壁底部,红细胞分散于所述初选流道内;
31.将所述初选流道中的血液样本导入与精筛流道,所述精筛流道中远离循环肿瘤细胞聚集的一侧挖设有加深流道,血液样本中的循环肿瘤细胞聚集成细带并靠近精筛流道内壁底部,而白细胞处于无序运动状态且远离所述精筛流道内壁底部。
32.上述循环肿瘤细胞分选富集的方法,将血液样本稀释后由样本入口通入初选流道,由于惯性升力、迪恩曳力等的受力影响,红细胞的直径较小,在初选流道中混乱无序的流动,而白细胞和循环肿瘤细胞的直径较大,在初选流道中作用力的平衡下,会初步聚集成
带,而后流入精筛流道内,循环肿瘤细胞刚聚体成细带,并靠近精筛流道内壁底部,而白细胞还未聚集于管道内壁底部,但白细胞和循环肿瘤细胞聚集的带靠得很近,通过在精筛流道中远离循环肿瘤细胞聚集的一侧挖设有加深流道,加深流道沿所述精筛流道延伸方向设置且所述加深流道的深度大于所述精筛流道的深度,打乱了精筛流道外壁附近的液体流动状态,使得惯性升力与迪恩曳力改变,破坏原有的平衡,从而使得白细胞能产生无序的运动状态,进而使得白细胞在精筛流道中分布更加均匀,避免白细胞聚体的带和循环肿瘤细胞重叠,同理红细胞也分布得更加均匀,既保证了不干扰循环肿瘤细胞的聚体,也防止了白细胞聚集于精筛流道内壁底部,便于后续把循环肿瘤细胞与白细胞分离开,利于循环肿瘤细胞的回收。
33.在其中一实施例中,循环肿瘤细胞分选富集的方法还包括如下步骤:
34.将所述精筛流道中的血液样本导入曲率半径大于所述精筛流道的曲率半径的第一转弯流道内,血液样本中的循环肿瘤细胞聚集成细带进一步靠近第一转弯流道内壁底部;
35.将所述第一转弯流道中的血液样本导入具有分流孔的去除流道,血液样本中的红细胞与白细胞部分由所述分流孔流出所述去除流道,而血液样本中的循环肿瘤细胞聚集成细带并靠近去除流道内壁底部;
36.经所述去除流道后剩余的血液样本导入曲率半径大于所述去除流道的曲率半径的第二转弯流道,血液样本中的循环肿瘤细胞聚集成细带进一步靠近第二转弯流道内壁底部;
37.第二转弯流道靠近循环肿瘤细胞聚集的一侧连通有回收流道并对该侧的血液样本进行回收,另一侧连通有废液流道并对该侧的血液样本进行收集。
38.所述的循环肿瘤细胞分选富集的方法还包括如下步骤:
39.将所述回收流道回收的血液样本再次通入微流控芯片的样本入口,重复前述各步骤。
40.在其中一实施例中,所述的循环肿瘤细胞分选富集的方法,其中所述去除流道中对应所述分流孔入口处设有阻挡件,且所述阻挡件位于所述分流孔远离所述加深流道的一侧,所述阻挡件沿所述去除流道的延伸方向的宽度大于所述分流孔的直径,经所述分流孔流出的血液样本占比为30%-70%;经所述废液流道流出的血液样本占比为45%-65%。
41.一种体外分析诊断仪,包括主体及上述任一项所述的循环肿瘤细胞分选富集的微流控芯片,所述循环肿瘤细胞分选富集的微流控芯片能与所述主体配套使用。
42.在其中一实施例中,所述主体上设有用于安装所述循环肿瘤细胞分选富集的微流控芯片的芯片安装位、用于将样本、稀释液及裂解液混匀的混合腔体以及回收循环肿瘤细胞的回收腔体,所述混合腔体能与所述循环肿瘤细胞分选富集的微流控芯片的样本入口连通,所述回收腔体能与所述循环肿瘤细胞分选富集的微流控芯片中流出循环肿瘤细胞的回收孔连通。
43.在其中一实施例中,所述的体外分析诊断仪还包括动力系统及控制系统,所述控制系统用于控制动力系统将样本、稀释液及裂解液按特定比例注入混合腔体以及将混合腔体的混合液体以一定的流速通入所述循环肿瘤细胞分选富集的微流控芯片中。
44.在其中一实施例中,所述的体外分析诊断仪还包括第一控制阀,所述主体上还设
有清洗液腔体、样本腔体、稀释液腔体及裂解液腔体,所述清洗液腔体、样本腔体、稀释液腔体及裂解液腔体分别与所述动力系统连接,所述第一控制阀的一端与所述清洗液腔体、样本腔体、稀释液腔体及裂解液腔体的出口连接,另一端与所述混合腔体连接。
45.在其中一实施例中,所述的体外分析诊断仪还包括第二控制阀,所述第二控制阀的一端与所述混合腔体连接,另一端与所述回收腔体连接,所述回收腔体还与所述动力系统连接。
附图说明
46.图1为一实施例中循环肿瘤细胞分选富集的微流控芯片的上盖板的示意图;
47.图2为一实施例中循环肿瘤细胞分选富集的微流控芯片的功能板的第一侧面的示意图;
48.图3为一实施例中循环肿瘤细胞分选富集的微流控芯片的功能板的第二侧面的示意图;
49.图4为一实施例中循环肿瘤细胞分选富集的微流控芯片的下盖板的示意图;
50.图5为图2中沿剖面线a-a的剖视示意图;
51.图6为血液样本中循环肿瘤细胞、白细胞、红细胞在初选流道的导入段与连接段中的运动状态示意图;
52.图7为血液样本中循环肿瘤细胞、白细胞、红细胞在初选流道的分选段中的运动状态示意图;
53.图8为血液样本中循环肿瘤细胞、白细胞、红细胞在第一转弯流道中的运动状态示意图;
54.图9为血液样本中循环肿瘤细胞、白细胞、红细胞在去除流道中的运动状态示意图;
55.图10为血液样本中循环肿瘤细胞、白细胞、红细胞在第二转弯流道中的运动状态示意图;
56.图11为一实施例中体外分析诊断仪的示意图。
57.附图标记说明:
58.01、红细胞;02、白细胞;03、循环肿瘤细胞;1、功能板;10、初选流道;
59.11、进样孔;110、导入段;112、直管段;114、弯管段,116、长直管;118、
60.短直管,120、连接段;121、第一直管段;122、第一弧形段;123、第二直管
61.段;124、第二弧形段;125、第三直管段;130、分选段;132、衔接段;13、
62.第一弯管单元;13a、第一侧壁;13b、第二侧壁;14、第二弯管单元,14a、第
63.三侧壁;14b、第四侧壁;134、主管段;15、第三弯管单元;第五侧壁15a与
64.第六侧壁15b,16、第四弯管单元,16a、第七侧壁;16b、第八侧壁;20、精筛
65.流道;30、加深流道;40、第一转弯流道;50、去除流道;51、分流孔;52、
66.阻挡件;60、第二转弯流道;70、回收流道;71、第一流出孔;80、废液流道;
67.81、第二流出孔;90、缓冲流道;2、上盖板;21、样本入口;3、下盖板;31、
68.回收孔;32、废液孔;33、排出孔。
具体实施方式
69.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
70.请参阅图1-4,一实施例提供一种循环肿瘤细胞分选富集的微流控芯片,包括功能板1。进一步地,循环肿瘤细胞分选富集的微流控芯片还包括上盖板2与下盖板3。所述上盖板2与所述功能板1的第一侧面叠置连接,所述下盖板3与所述功能板1的第二侧面叠置连接,所述上盖板2上开设有样本入口21。
71.参照图2、6、7,功能板1的第一侧面上设有初选流道10与精筛流道20。初选流道10与样本入口21连通,用于使样本中的循环肿瘤细胞03与白细胞02初步聚集。精筛流道20与所述初选流道10连通,所述精筛流道20中远离循环肿瘤细胞03聚集的一侧挖设有加深流道30,所述加深流道30沿所述精筛流道20延伸方向设置且所述加深流道30的深度大于所述精筛流道20的深度。
72.将血液样本稀释后由上盖板2的样本入口21通入微流控芯片内,经功能板1上的进样孔11流入初选流道10。其中,进样孔11贯穿功能板1的第一侧面与第二侧面,且与样本入口21对应设置。由于惯性升力、迪恩曳力等的受力影响,参照图6,样本中的红细胞01的直径较小,在初选流道10中混乱无序的流动,而白细胞02和循环肿瘤细胞03的直径较大,在初选流道10中作用力的平衡下,会初步聚集成带再流入精筛流道20内,参照图7,此时循环肿瘤细胞03刚聚体成细带,并靠近精筛流道20内壁底部,而白细胞02还未聚集于流道内壁底部,但白细胞02和循环肿瘤细胞03聚集的带靠得很近,通过在精筛流道20中远离循环肿瘤细胞03聚集的一侧挖设有加深流道30,加深流道30沿所述精筛流道20延伸方向设置且所述加深流道30的深度大于所述精筛流道20的深度,打乱了精筛流道20外壁附近的液体流动状态,使得惯性升力与迪恩曳力改变,破坏原有的平衡,从而使得白细胞02能产生无序的运动状态,进而使得白细胞02在精筛流道20中分布更加均匀,避免白细胞02聚体的带和循环肿瘤细胞03重叠,同理红细胞01也分布得更加均匀,既保证了不干扰循环肿瘤细胞03的聚体,也防止了白细胞02聚集于精筛流道20内壁底部,便于后续把循环肿瘤细胞03与白细胞02分离开,利于循环肿瘤细胞03的回收。
73.参照图2、7,在其中一实施例中,所述精筛流道为不对称波浪形通道,其具有交替布设的大转弯和小转弯。在其他实施例中,所述精筛流道也可设置为直通道。
74.具体地,在其中一实施例中,所述精筛流道为具有矩形截面的不对称波浪形通道,该矩形截面的宽高比在通道的长度范围内变化导致形成单条聚集粒子流。
75.可选地,所述矩形截面的宽高比在8~30之间变化。在另一个实施例中,所述矩形截面的宽高比在11~23之间变化。
76.可选地,在其中一实施例中,所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比小于等于0.5。或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比小于等于0.07。或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比为0.045~0.065。或者所述精筛流道设计为循环肿瘤细胞的尺寸与水力直径之比为0.05~0.06。其中,水力直径dh定义为2wh/(w+h),参照图5、7;w和h为流道的宽度和高度。
77.进一步地,参照图2、8,在其中一实施例中,所述功能板1的第一侧面上还设有第一转弯流道40。所述第一转弯流道40的曲率半径大于所述精筛流道20的曲率半径,所述第一转弯流道40与所述精筛流道20流通,参照图5,所述加深流道30对应地延伸至所述第一转弯流道40中且位于远离循环肿瘤细胞03聚集的一侧。在加深流道30的作用下,使得白细胞02在第一转弯流道40中分布更加均匀,避免与循环肿瘤细胞03重叠。在精筛流道20连接了一个第一转弯流道40,由于第一转弯流道40的半径大,惯性升力的相对优势更加大。经过第一转弯流道40处时,流道中间流体受到的离心力最大,从而流向通道外侧边缘。靠近通道壁的流体流速最小,所受离心力也最小,从而受到中间流体的挤压。从而在第一转弯流道40的作用下,循环肿瘤细胞03能大限度地贴近管道内壁底部,为后续分选循环肿瘤细胞03和排出白细胞02做准备。
78.参照图2、5,可选地,所述加深流道30的深度比所述精筛流道20的深度大50μm-200μm。可选地,精筛流道的深度为100μm-200μm。优选地,所述加深流道30的深度比所述精筛流道20的深度大70μm-120μm。优选地,精筛流道的深度为110μm-150μm。图5为加深流道30在第一转弯流道40中的截面示意图,其中精筛流道20延伸至与第一转弯流道40连接,第一转弯流道40中对应也开设有加深流道30,加深流道30与第一转弯流道40的深度差h为50μm-200μm,优先70μm-120μm。既能保证循环肿瘤细胞03在精筛流道20或第一转弯流道40中能尽可能地靠近流道内壁底部流动,同时扰动加深流道30一侧的液体流动状态,避免白细胞02聚体的带和循环肿瘤细胞03重叠而影响后续循环肿瘤细胞03的回收率及纯度。
79.参照图2、6,在其中一实施例中,所述初选流道10包括依次连通的导入段110、连接段120及分选段130,所述导入段110远离所述连接段120的一端与所述样本入口21连通,所述导入段110呈往复回折结构。参照图6,样本进入导入段110的入口端时,红细胞01、白细胞02和循环肿瘤细胞03均匀的分布在流道中。红细胞01直径约为6-8μm和白细胞02直径约为8-12μm,循环肿瘤细胞03直径约为20-30μm。当液体流过导入段110的几个拐弯处时,白细胞02和循环肿瘤细胞03慢慢聚集,而红细胞01还是均匀的分布。随着流过越长的连接段120,白细胞02和循环肿瘤细胞03聚集的带越细,当液体流入快进入分选段130时,白细胞02和循环肿瘤细胞03聚集的带更加细,并且靠初选流道10的内壁。将导入段110设置为往复回折结构,不仅能起到缓冲流入血液样本的作用,可以使得液体流动状态更加稳定,而且血液样本流过导入段110及连接段120,便于循环肿瘤细胞03和白细胞02会在此流道中聚集成带。
80.相比分选段130,导入段110与连接段120为细长的流道。可选地,导入段110、连接段120的宽度为0.3mm-1.2mm。优选地,导入段110、连接段120的宽度为0.5mm-0.9mm。可选地,导入段110、连接段120的深度为0.06mm-0.3mm。优选地,导入段110、连接段120的深度为0.1mm-0.2mm。如此设置,使进入初选流道10的血液样本流速趋于平稳,同时使循环肿瘤细胞03和白细胞02能初步聚集成带,便于后续对循环肿瘤细胞03进行分选。
81.具体地,参照图6,一实施例中所述导入段110包括多个直管段112及多个弯管段114,两相邻直管段112之间通过一个弯管段114连接,最始端的直管段112通过进样孔11与样本入口21连通,最末端的弯管段114沿顺时针方向设置且与所述连接段120连接。如此设置使导入段110形成多个拐弯,使血液样本速度逐渐趋于平稳,起到缓冲效果,便于白细胞02和循环肿瘤细胞03初步聚集,加工难度相较螺旋形管道也更容易,芯片的整体尺寸可设计得更小。在其他实施例中,为实现缓冲的目的,导入段110也可设置成往复回折的“s”形或
者螺旋形等。其中导入段110最末端的弯管段114沿顺时针方向设置与所述连接段120连接,主要目的是为了使后续分选过程中循环肿瘤细胞03能始终聚集于流道的内壁所在的一侧。
82.在一实施例中,位于最始端的直管段112与最末端的弯管段114之间的直管段112包括交替设置的长直管116与短直管118,同一长直管116(如位于下方的长直管116)的两端均通过沿顺时针方向设置的弯管段114与两短直管118连接。或者同一长直管116(如位于上方的长直管116)的两端均通过沿逆时针方向设置的弯管段114与两短直管118连接。其中顺时针、逆时针是沿样本流动方向判断的。通过交替设置长直管116与短直管118,使直管段112在垂直样本流动的方向上呈多排设置,合理布置流道位置,利于缩小芯片的长度与宽度。
83.进一步地,所述长直管116与短直管118平行设置,沿样本流动方向,相邻两长直管116与位于该两长直管116之间的短直管118沿直管段112宽度方向间隔布置。长直管116与短直管118之间通过180
°
的弯管段114连接,长直管116与短直管118平行设置,在沿直管段112宽度方向直管段112成三排布置。
84.具体地,参照图6,位于最始端(导入段110的入口端)直管段112依次通过顺时针方向设置的弯管段114与逆时针方向设置的弯管段114与一长直管116连接。位于最末端直管段112依次通过逆时针方向设置的弯管段114与顺时针方向设置的弯管段114与所述连接段120连接。样本流入连接段120时呈顺时针方向流动,便于循环肿瘤细胞03初步聚集成带于流道的内壁一侧。
85.参照图2、6,在其中一实施例中,所述连接段120包括依次连通的第一直管段121、第一弧形段122、第二直管段123、第二弧形段124及第三直管段125,第一直管段121与所述导入段110远离样本入口21的一端连接,所述第三直管段125与所述分选段130连接。具体地,所述导入段110的末端沿顺时针方向设置且与所述第一直管段121连接,使循环肿瘤细胞03始终聚集在流道的内壁。连接段120起到连接导入段110与分选段130的作用,血液样本由导入段110末端沿顺时针方向依次流经第一直管段121、第一弧形段122、第二直管段123、第二弧形段124及第三直管段125,白细胞02和循环肿瘤细胞03聚集的带逐渐变细,当液体位于第三直管段125快进入分选段130时,白细胞02和循环肿瘤细胞03聚集的带更加细,并且靠管道的内壁。在其中一实施例中,所述第一弧形段122为沿顺时针方向设置的90
°
弧形段,所述第二弧形段124为沿顺时针方向设置的90
°
弧形段。第一直管段121与第三直管段125上下间隔设置,且第三直管段125位于第一直管段121上方。
86.进一步地,所述第一直管段121的延迟线与第三直管段125的延迟线之间围设形成第一区域126,所述导入段110在所述第一区域的范围内往复回折。通过合理布置流道各段的位置,充分利用芯片的体积,便于使芯片整体尺寸小型化,也便于白细胞02和循环肿瘤细胞03初步聚集成带。
87.参照图2、7,在其中一实施例中,所述分选段130包括依次连通的衔接段132与主管段134,所述衔接段132与所述第三直管段125连接,所述主管段134与所述精筛流道20连接,所述衔接段132垂直其延伸方向上的宽度为a,所述主管段134垂直其延伸方向上的宽度为b,a《b,所述分选段130为宽度方向上不对称的波浪形通道。为避免血液样本从细长的连接段120进入波浪形的分选段130时,流道的宽度突然变大较多,扰乱原来循环肿瘤细胞03的运动轨迹,避免破坏循环肿瘤细胞03原来靠内壁运动的轨迹,通过设置宽度小于主管段134
的衔接段132过渡到主管段134,起到缓冲作用,避免需要流过更多的波浪形的主管段134后才能使得循环肿瘤细胞03贴近流道内壁聚集成细带,也能缩短主管段134的长度。
88.参照图7,具体地,所述衔接段132包括交替设置的第一弯管单元13与第二弯管单元14,所述第一弯管单元13的曲率半径大于所述第二弯管单元14的曲率半径。所述主管段134包括交替设置的第三弯管单元15与第四弯管单元16,所述第三弯管单元15的曲率半径大于所述第四弯管单元16的曲率半径,最末端的第二弯管单元14与最始端的所述第三弯管单元15连接。其中a为所述第一弯管单元13垂直其延伸方向上的宽度,b为所述第三弯管单元15垂直其延伸方向上的宽度。衔接段132通过曲率半径大的第一弯管单元13与曲率半径小的第二弯管单元14交替连接形成,主管段134通过曲率半径大的第三弯管单元15与曲率半径小的第四弯管单元16交替连接形成。所述衔接段132垂直其延伸方向上的宽度主要指第一弯管单元13垂直其延伸方向上的宽度,所述主管段134垂直其延伸方向上的宽度主要指第三弯管单元15垂直其延伸方向上的宽度。根据细胞直径、流道高度和宽度、液体流速等因素,综合惯性升力、迪恩曳力等的受力分析,循环肿瘤细胞03靠近主管段134内壁底部,白细胞02也逐渐靠近主管段134内壁底部。可选地,b比a大0.4mm-1.2mm。优选地,b比a大0.7mm-0.9mm。
89.参照图7,进一步地,第一弯管单元13包括相对设置的第一侧壁13a与第二侧壁13b,所述第一侧壁13a与第二侧壁13b为非对称的曲面。第二弯管单元14包括相对设置的第三侧壁14a与第四侧壁14b,所述第三侧壁14a与第四侧壁14b为非对称的曲面。所述第三侧壁14a与所述第二侧壁13b连接,所述第四侧壁14b与所述第一侧壁13a连接。所述第三弯管单元15包括相对设置的第五侧壁15a与第六侧壁15b,所述第五侧壁15a与第六侧壁15b为非对称的曲面。第四弯管单元16包括相对设置的第七侧壁16a与第八侧壁16b,所述第七侧壁16a与第八侧壁16b为非对称的曲面。所述第五侧壁15a与所述第八侧壁16b连接,所述第六侧壁15b与第七侧壁16a连接。所述第一弯管单元13与第二弯管单元14朝不同的方向凸出设置,所述第三弯管单元15与第四弯管单元16朝不同的方向凸出设置,且所述第一弯管单元13与所述第三弯管单元15朝相同的方向凸出设置。如此设置非对称曲面,形成非对称惯性聚集,使循环肿瘤细胞在流道横截面中稳定位置(流道的内壁底部)聚焦形成一个带,形成聚焦流动,流向下游。
90.进一步地,所述第一侧壁13a的曲率半径小于所述第二侧壁13b的曲率半径,所述第五侧壁15a的曲率半径大于第六侧壁15b的曲率半径。从而使第一侧壁13a与第二侧壁13b之间的距离小于第五侧壁15a与第六侧壁15b之间的距离,实现流体由衔接段132到主管段134的缓冲。进一步地,所述第三侧壁14a的曲率半径小于所述第四侧壁14b的曲率半径。所述第七侧壁16a的曲率半径小于所述第八侧壁16b的曲率半径。
91.进一步地,参照图2、9,在其中一实施例中,所述功能板1的第一侧面上还设有去除流道50。所述去除流道50与所述第一转弯流道40远离精筛流道20的一端连通,所述加深流道30对应地延伸至所述去除流道50中且位于远离循环肿瘤细胞03聚集的一侧,所述去除流道50中开设有贯穿所述去除流道50壁面的分流孔51。血液继续在去除流道50中流动,流经分流孔51,循环肿瘤细胞03继续贴着去除流道50内壁底部运动,由于白细胞02和红细胞01在管道中分布较为均匀,部分白细胞02和红细胞01则从分流孔51流出,便于后续循环肿瘤细胞03的回收。
92.参照图2、8、9,由于随着液体从分流孔51流出,流道中液体的流速相对会变低,循环肿瘤细胞03运动轨迹会发生微小的变化,容易向着远离流道内壁的方向运动,循环肿瘤细胞03易靠近分流孔51,而通过在去除流道50之前衔接一个曲率半径大的第一转弯流道40,使循环肿瘤细胞03流过大弯的第一转弯流道40后,紧贴着流道内壁底部流动,避免循环肿瘤细胞03流入分流孔51,提高循环肿瘤细胞03的回收率。
93.参照图2、3,进一步地,在其中一实施例中,所述功能板1的第二侧面上设有呈往复回折结构的缓冲流道90,所述缓冲流道90与所述分流孔51连通。将缓冲流道90设计为往复回折结构,使流出去除流道50的液体状态稳定,避免去除流道50中剩余液体流动受到抖动干扰,影响后续循环肿瘤细胞03的回收。
94.其中,缓冲流道90的长短可以控制排出液体的多少。缓冲流道90的长度及结合分流孔51的位置来调节排出白细胞02和红细胞01的量及调控循环肿瘤细胞03的运动轨迹。一实施例中,分流孔51去除的白细胞02和红细胞01占比为30%-70%,优选45%-60%。同理分流孔51所流出的液体占比为30%-70%,最优范围为45%-60%。如此设置,使液体流出量小于70%,最后流速相对减小不超过70%以上,避免影响到循环肿瘤细胞03原来的运动轨迹,造成部分循环肿瘤细胞03难以被回收,导致最后的回收率下降。
95.参照图2、9,在其中一实施例中,所述去除流道50中对应所述分流孔51入口处设有阻挡件52,且所述阻挡件52位于所述分流孔51远离所述加深流道30的一侧,所述阻挡件52沿所述去除流道50的延伸方向的宽度大于所述分流孔51的直径。通过阻挡件52保护循环肿瘤细胞03不被流入分流孔51,由于白细胞02和红细胞01在流道中分布较为均匀,白细胞02和红细胞01则从分流孔51流出,垂直流入功能板1的第二侧面,流入缓冲流道90。
96.进一步地,所述阻挡件52凸出所述去除流道50的壁面设置,即阻挡件52所在位置的高度高于去除流道50其他位置,阻挡在循环肿瘤细胞03与分流孔51之间,避免循环肿瘤细胞03从分流孔51流出。所述阻挡件52靠近循环肿瘤细胞03聚集的一侧为弧形壁,且所述弧形壁的弯曲方向与所述去除流道50靠近循环肿瘤细胞03聚集的一侧侧壁的弯曲方向一致。阻挡件52靠近循环肿瘤细胞03聚集的一侧为弧形壁,与循环肿瘤细胞03聚集带匹配,使阻挡件52对循环肿瘤细胞03聚体的影响保持一致,避免扰乱循环肿瘤细胞03聚体。
97.可选地,所述阻挡件52与所述功能板1为一体成型结构,阻挡件52为去除流道50开设过程中预留的凸出部分形成。所述阻挡件52远离弧形壁的一侧中部绕所述分流孔51对应侧的外周设置。流向分流孔51的白细胞02与红细胞01被阻挡件52远离弧形壁的侧壁挡住,最终流入分流孔51。
98.参照图2、3、9,在其中一实施例中,沿所述去除流道50的延伸方向依次设有多个分流孔51,所述功能板1的第二侧面上设有多个呈往复回折结构的缓冲流道90,所述缓冲流道90与所述分流孔51一一对应连通。沿液体流动方向设置多个分流孔51对白细胞02和红细胞01进行多次去除,有利于后续循环肿瘤细胞03的回收,由于无需聚集白细胞02与红细胞01,流道的宽度和高度也可以设计得较宽,利于提高液体流速,提高分选效率。同时在所述去除流道50中各对应的分流孔51入口处设有阻挡件52,且所述阻挡件52位于所述分流孔51远离所述加深流道30的一侧,所述阻挡件52沿所述去除流道50的延伸方向的宽度大于所述分流孔51的直径,通过阻挡件52保护循环肿瘤细胞03不被流入分流孔51,白细胞02和红细胞01则从分流孔51流出,垂直流入功能板1的第二侧面,流入缓冲流道90。
99.参照图9,在其中一实施例中,沿样本流动方向,多个所述分流孔51与对应的所述加深流道30的距离l逐渐增大。随着液体的排出,白细胞02和红细胞01则会逐渐向远离加深流道30的一侧流动,对应沿样本流动方向,将所述分流孔51逐渐向远离加深流道30的方向设置,便于白细胞02和红细胞01从后续分流孔51流出。
100.在其中一实施例中,沿样本流动方向,靠近所述第一转弯流道40的分流孔51对应的缓冲流道90的长度大于其他缓冲流道90的长度。参照图3可以看出,第一个分流孔51对应的缓冲流道90的长度较其他的设计得更长,由于第一个分流孔51流入的液体量相对其他的分流孔51会更多,将缓冲流道90设计得更长,缓冲流道90能流出更多的液体,使流出的液体趋于平稳,避免对后续液体的流速造成影响,扰乱循环肿瘤细胞03的流动。
101.在其中一实施例中,所述精筛流道20及所述去除流道50为正弦型弧形流道。流体在弧形通道中流动时,呈抛物线流动的流体在通道中间速度最大。在经过通道转弯处时,微通道中间的流体因其流速最大而受到的离心力最大,从而流向弧形通道的外侧壁。靠近通道壁的流体流速最小,所受离心力也最小,从而受到中间高流速流体的挤压。为了保持流体中各处质量守恒,在垂直于流体流动的方向上,形成一对反向旋转且对称的涡流,分别位于通道横截面的上部和下部,由此产生迪恩涡流的二次流。迪恩涡流会对流体中的颗粒产生曳力作用,被称为迪恩曳力。在弧形通道中,流动的粒子会同时受到惯性升力和迪恩曳力的作用,这两种力的相对大小决定粒子在弯弧形通道中流动的聚焦流动情况。本实施例中,精筛流道20及去除流道50中由于惯性升力和迪恩曳力的作用,循环肿瘤细胞03在流道的内壁聚焦成一带。
102.进一步地,参照图2、10,在其中一实施例中,所述功能板1的第一侧面上还设有第二转弯流道60。所述第二转弯流道60的曲率半径大于所述去除流道50的曲率半径,所述第二转弯流道60与所述去除流道50远离所述第一转弯流道40的一端连通,所述加深流道30对应地延伸至所述第二转弯流道60中且位于远离循环肿瘤细胞03聚集的一侧。血液流过分流孔51后,白细胞02和红细胞01含量逐渐减少,同时流速也逐渐减小。通过衔接曲率半径大于所述去除流道50的曲率半径的第二转弯流道60,能起到稳定循环肿瘤细胞03的运动轨迹的作用,便于后续对循环肿瘤细胞03的回收。
103.参照图10,在其中一实施例中,所述第二转弯流道60远离所述去除流道50的一端设有相互独立的回收流道70与废液流道80,所述回收流道70与所述第二转弯流道60中靠近循环肿瘤细胞03聚集的一侧连通,所述废液流道与所述第二转弯流道60中靠近加深流道30的一侧连通。循环肿瘤细胞03紧贴第二转弯流道60内壁流入回收流道70,白细胞02和红细胞01流入废液流道80。在其中一实施例中,所述废液流道与所述回收流道70呈往复回折结构,起到稳定液体流动状态,防止液体后续从废液孔32、回收孔31跌落的过程中,影响了第二转弯流道60末端循环肿瘤细胞03的运动轨迹。
104.通过调节废液流道、回收流道70的长度和深度,可以调节两者的体积占比,从而调节去除白细胞02和红细胞01占比。在其中一实施例中,废液流道流出的液体占比为45%-65%,优先50%-60%。回收流道70流出的液体占比为3%-20%,优先为5%-10%。从回收孔31收集到的液体,循环肿瘤细胞03回收率可达到90%以上,白细胞02和红细胞01去除率在90%以上。将回收的液体再返回芯片循环过滤多次,能进一步提高白细胞02和红细胞01去除率,提高循环肿瘤细胞03的回收纯度。
105.参照图1-4,在其中一实施例中,所述上盖板2与所述功能板1的第一侧面粘接,所述下盖板3与所述功能板1的第二侧面粘接,使功能板1的第一侧面与第二侧面的各流道形成密封的通道。所述上盖板2上开设与功能板1的第一侧面的初选流道10连通的样本入口21,便于血液样本从样本入口21导入微流控芯片内。下盖板3上开设有回收孔31、废液孔32及排出孔33,所述分流孔51与所述排出孔33连通,部分白细胞02和红细胞01在去除流道50由分流孔51流向功能板1的第二侧面,并从下盖板3的排出孔33流出微流控芯片,所述回收流道70通过贯穿功能板第一侧面与第二侧面的第一流出孔71与所述回收孔31连通,分选出的循环肿瘤细胞03由下盖板3的回收孔31流出微流控芯片,所述废液流道通过贯穿功能板第一侧面与第二侧面的第二流出孔81与所述废液孔32连通,剩余的其他液体由下盖板3的废液孔32流出微流控芯片。
106.传统进行循环肿瘤细胞03分选和富集的微流控芯片基本都是pdms材质,这种芯片的成本昂贵,不能重复使用,导致每个测试的费用在数千元。但是全球大多数的癌症死亡都发生在中低收入国家,所以开发一款成本低廉的检测产品是很有必要。pdms芯片的加工工艺只能在单面设计管道,从而限制了其功能的开发。并且pdms芯片不利于制作较大和较深的管道,多层次的液体流动状态在此芯片中不能研究,pdms较小较细的管道也限制了芯片中液体的流速。
107.上述实施例中的微流控芯片材质不受限定,可以用pmma、pc、abs、玻璃等材质。本芯片可以重复使用,不需要抗原抗体,也不需要磁珠,从而大大的降低了成本。由于本芯片只聚集循环肿瘤细胞03,不聚集白细胞02和红细胞01,所以芯片中流道的高度和宽度可以较大,血液样本可以做大倍数的稀释,从而可以使得液体流速较大,也减少检测时间。
108.本芯片的设计策略为:循环肿瘤细胞03在芯片流道中聚集成细带,通过设计加深流道30,使白细胞02、红细胞01尽量在芯片中均匀分配,便于循环肿瘤细胞03的回收。芯片设计结合了不对称的惯性聚焦和迪恩涡旋等基本原理。同时采取了多层次的设计,有利于白细胞02的排出。芯片也采用多维的管道设计,有利于减少白细胞02挤压循环肿瘤细胞03在芯片中的运动轨迹。
109.另外,回收循环肿瘤细胞03的回收流道70的体积占比很少,废液流道的体积占比很大,因此就可以在回收肿瘤细胞的时候,间接去除了白细胞02和红细胞01。由于此芯片的循环肿瘤细胞03回收率高,所以可以多次过滤。从而整体上循环肿瘤细胞03的减少量较少,白细胞02在多次过滤后,几乎全部去除。
110.本技术一实施例还提供一种循环肿瘤细胞分选富集的方法,可采用上述任一实施例所述的循环肿瘤细胞分选富集的微流控芯片实现。本实施例的循环肿瘤细胞分选富集的方法包括如下步骤:
111.参照图1-4,s100:将经稀释后的血液样本由微流控芯片的样本入口21通入,血液样本经过具有往复回折结构的初选流道10后,血液样本中的循环肿瘤细胞03与白细胞02初步聚集,其中循环肿瘤细胞03聚集成细带并靠近初选流道10内壁底部,而白细胞02还未聚集于初选流道10内壁底部,红细胞01分散于所述初选流道10内。
112.s200:将所述初选流道10中的血液样本导入与精筛流道20,所述精筛流道20中远离循环肿瘤细胞03聚集的一侧挖设有加深流道30,血液样本中的循环肿瘤细胞03聚集成细带并靠近精筛流道20内壁底部,而白细胞02处于无序运动状态且远离所述精筛流道20内壁
底部。
113.将血液样本稀释后由样本入口21通入初选流道10,由于惯性升力、迪恩曳力等的受力影响,红细胞01的直径较小,在初选流道10中混乱无序的流动,而白细胞02和循环肿瘤细胞03的直径较大,在初选流道10中作用力的平衡下,会初步聚集成带,而后流入精筛流道20内,循环肿瘤细胞03刚聚体成细带,并靠近精筛流道20内壁底部,而白细胞02还未聚集于管道内壁底部,但白细胞02和循环肿瘤细胞03聚集的带靠得很近,通过在精筛流道20中远离循环肿瘤细胞03聚集的一侧挖设有加深流道30,加深流道30沿所述精筛流道20延伸方向设置且所述加深流道30的深度大于所述精筛流道20的深度,打乱了精筛流道20外壁附近的液体流动状态,使得惯性升力与迪恩曳力改变,破坏原有的平衡,从而使得白细胞02能产生无序的运动状态,进而使得白细胞02在精筛流道20中分布更加均匀,避免白细胞02聚体的带和循环肿瘤细胞03重叠,同理红细胞01也分布得更加均匀,既保证了不干扰循环肿瘤细胞03的聚体,也防止了白细胞02聚集于精筛流道20内壁底部,便于后续把循环肿瘤细胞03与白细胞02分离开,利于循环肿瘤细胞03的回收。
114.在其中一实施例中,循环肿瘤细胞分选富集的方法还包括如下步骤:
115.s300、将所述精筛流道20中的血液样本导入曲率半径大于所述精筛流道20的曲率半径的第一转弯流道40内,血液样本中的循环肿瘤细胞03聚集成细带进一步靠近第一转弯流道40内壁底部。参照图2、8、9,由于后续s400步骤液体会从分流孔51流出,流道中液体的流速相对会变低,循环肿瘤细胞03运动轨迹会发生微小的变化,容易向着远离流道内壁的方向运动,循环肿瘤细胞03易靠近分流孔51,而通过在去除流道50之前衔接一个曲率半径大的第一转弯流道40,使循环肿瘤细胞03流过大弯的第一转弯流道40后,紧贴着流道内壁底部流动,避免循环肿瘤细胞03流入分流孔51,提高循环肿瘤细胞03的回收率。
116.s400、将所述第一转弯流道40中的血液样本导入具有分流孔51的去除流道50,血液样本中的红细胞01与白细胞02部分由所述分流孔51流出所述去除流道50,而血液样本中的循环肿瘤细胞03聚集成细带并靠近去除流道50内壁底部。血液继续在去除流道50中流动,流经分流孔51,循环肿瘤细胞03继续贴着去除流道50内壁底部运动,由于白细胞02和红细胞01在管道中分布较为均匀,部分白细胞02和红细胞01则从分流孔51流出,便于后续循环肿瘤细胞03的回收。
117.s500、经所述去除流道50后剩余的血液样本导入曲率半径大于所述去除流道50的曲率半径的第二转弯流道60,血液样本中的循环肿瘤细胞03聚集成细带进一步靠近第二转弯流道60内壁底部。通过衔接曲率半径大于所述去除流道50的曲率半径的第二转弯流道60,能起到稳定循环肿瘤细胞03的运动轨迹的作用,便于后续对循环肿瘤细胞03的回收。
118.s600、第二转弯流道60靠近循环肿瘤细胞03聚集的一侧连通有回收流道70并对该侧的血液样本进行回收,另一侧连通有废液流道并对该侧的血液样本进行收集。循环肿瘤细胞03紧贴第二转弯流道60内壁流入回收流道70,白细胞02和红细胞01流入废液流道80。
119.在其中一实施例中,所述的循环肿瘤细胞分选富集的方法还包括如下步骤:
120.s700、将所述回收流道70回收的血液样本再次通入微流控芯片的样本入口21,重复前述各步骤s100-s600。回收的液体重复前述各步骤s100-s600循环过滤,能进一步提高白细胞02和红细胞01去除率,提高循环肿瘤细胞03的回收纯度。
121.在其中一实施例中,在去除流道50中对应所述分流孔51入口处设有阻挡件52,且
所述阻挡件52位于所述分流孔51远离所述加深流道30的一侧,所述阻挡件52沿所述去除流道50的延伸方向的宽度大于所述分流孔51的直径。阻挡件52阻挡在循环肿瘤细胞03与分流孔51之间,避免循环肿瘤细胞03从分流孔51流出。
122.进一步地,经所述分流孔51流出的血液样本占比为30%-70%。通过控制液体流出量,使制液体流出量小于70%,最后流速相对减小不超过70%以上,避免影响到循环肿瘤细胞03原来的运动轨迹,造成部分循环肿瘤细胞03难以被回收,导致最后的回收率下降。
123.进一步地,经所述废液流道流出的血液样本占比为45%-65%。通过调节废液流道、回收流道70的长度和深度,可以调节两者的体积占比,从而调节去除白细胞02和红细胞01占比。回收循环肿瘤细胞03的回收流道70的体积占比很少,废液流道的体积占比很大,因此就可以在回收肿瘤细胞的时候,间接去除了白细胞02和红细胞01。
124.参照图11,本技术一实施例还提供一种体外分析诊断仪,包括主体及上述任一项实施例所述的循环肿瘤细胞分选富集的微流控芯片,所述循环肿瘤细胞分选富集的微流控芯片能与所述主体配套使用。所述的循环肿瘤细胞分选富集的微流控芯片属于耗材,用于分选及富集血液中的循环肿瘤细胞03。对于同一血液样本,可对回收的循环肿瘤细胞03进行多次循环过滤,以提高最后回收的循环肿瘤细胞03的纯度。
125.在其中一实施例中,所述主体上设有用于安装所述循环肿瘤细胞分选富集的微流控芯片的芯片安装位、用于将样本、稀释液及裂解液混匀的混合腔体以及回收循环肿瘤细胞的回收腔体,所述混合腔体能与所述循环肿瘤细胞分选富集的微流控芯片的样本入口连通,所述回收腔体能与所述循环肿瘤细胞分选富集的微流控芯片中流出循环肿瘤细胞的回收孔连通。
126.在其中一实施例中,所述的体外分析诊断仪还包括动力系统及控制系统,所述控制系统用于控制动力系统将样本、稀释液及裂解液按特定比例注入混合腔体以及将混合腔体的混合液体以一定的流速通入所述循环肿瘤细胞分选富集的微流控芯片中。动力系统可以是气压泵或注射泵等。混合腔体具备磁力搅拌或通气混匀功能。进一步地,控制系统还用于控制动力系统预先把清洗液通入混合腔体和所述循环肿瘤细胞分选富集的微流控芯片,对连接管路、混合腔体及芯片进行清洗和排除气泡。然后控制系统再发出命令,控制动力系统把样本和稀释液、裂解液按一定的比例注入混合腔体,混匀腔体的液体被动力系统以一定的流速通入所述循环肿瘤细胞分选富集的微流控芯片。样本的混合液通过所述循环肿瘤细胞分选富集的微流控芯片后,循环肿瘤细胞就被分离进入回收腔体,其余的液体进入废液腔体。
127.在其中一实施例中,所述的体外分析诊断仪还包括第一控制阀,所述主体上还设有清洗液腔体、样本腔体、稀释液腔体及裂解液腔体,所述清洗液腔体、样本腔体、稀释液腔体及裂解液腔体分别与所述动力系统连接,所述第一控制阀的一端与所述清洗液腔体、样本腔体、稀释液腔体及裂解液腔体的出口连接,另一端与所述混合腔体连接。动力系统驱动样本腔体中的样本和稀释液腔体中的稀释液、裂解液腔体中的裂解液按一定的比例朝混合腔体流动,第一控制阀控制清洗液腔体、样本腔体、稀释液腔体及裂解液腔体与混合腔体的通断。
128.在其中一实施例中,所述的体外分析诊断仪还包括第二控制阀,所述第二控制阀的一端与所述混合腔体连接,另一端与所述回收腔体连接,所述回收腔体还与所述动力系
统连接。对于复杂的样本或需要纯度较高的样本,回收腔体的液体可以通过动力系统和第二控制阀被再次送入混合腔体中,再次和稀释液混匀,重新通入芯片进行第二次过滤,同理可以进行第三、四次过滤。可以得到纯度高的循环肿瘤。
129.在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”、“顺时针”、“逆时针”、“轴向”、“径向”、“周向”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
130.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
131.在本发明中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系,除非另有明确的限定。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
132.在本发明中,除非另有明确的规定和限定,第一特征在第二特征“上”或“下”可以是第一和第二特征直接接触,或第一和第二特征通过中间媒介间接接触。而且,第一特征在第二特征“之上”、“上方”和“上面”可是第一特征在第二特征正上方或斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”可以是第一特征在第二特征正下方或斜下方,或仅仅表示第一特征水平高度小于第二特征。
133.需要说明的是,当元件被称为“固定于”或“设置于”另一个元件,它可以直接在另一个元件上或者也可以存在居中的元件。当一个元件被认为是“连接”另一个元件,它可以是直接连接到另一个元件或者可能同时存在居中元件。本文所使用的术语“垂直的”、“水平的”、“上”、“下”、“左”、“右”以及类似的表述只是为了说明的目的,并不表示是唯一的实施方式。
134.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
135.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1