一种非洲猪瘟的重组腺病毒疫苗及其构建方法与流程
一种非洲猪瘟的重组腺病毒疫苗及其构建方法
1.本技术主张中国在先申请,申请号:2020106427557,申请日2020年7月6日的优先权;其所有的内容作为本发明的一部分。
技术领域
2.本发明涉及基因工程技术领域和免疫学领域,具体而言,涉及一种非洲猪瘟病毒的重组腺病毒疫苗及其构建方法。
背景技术:
3.非洲猪瘟(asf)是一种具有高度传染性的猪病毒病。在家猪中可导致接近100%的高死亡率。asf是由asf病毒(asfvirus,asfv)引起,asfv是一种较大的双链dna病毒,主要在巨噬细胞的细胞质中复制,具有20面体结构,直径为175~215nm,基因组全长170~190kb,含有151个开放阅读框,可编码150~200种蛋白,具有囊膜的双股线性dna病毒。构成asfv病毒粒子的结构蛋白有p30、p72、p49、p54、p220、p62、pb602l、cd2v蛋白等,基于一个或两个亚单位疫苗迄今未能诱导免疫强大到足以对疫苗接种者具有显著保护作用。
4.我国已于2018年发现asf疫情,带来了巨大的直接和间接经济损失。因此,迫切需要开发针对asfv的疫苗。有报道,asfv疫苗的先前的研究主要集中灭活疫苗和减毒疫苗。然而,灭活疫苗不能诱导有效的保护性应答;减毒疫苗的生物安全是其使用的主要限制因素,减毒毒株在我国是不允许研究的。然而在现阶段不能进行活病毒实验的情况下,需要提供疫苗以引发针对尽可能多的抗原的免疫应答。
5.因此需要开发新型的asfv疫苗。潜在的候选疫苗是活载体疫苗。与其他疫苗相比,活载体疫苗的优势体现在:(1)能主动感染靶组织或细胞,提高了外源基因进入细胞的效率;(2)载体自身有佐剂效应,能诱导细胞因子和趋化因子的产生;(3)多数能诱导长期的免疫应答。有利的是,需要用尽可能少的活载体输送尽可能多的病原体蛋白质。
6.活载体疫苗是指将病原体的蛋白质编码基因克隆到活病毒载体,然后用于免疫动物,在动物体内表达所述蛋白质,从而诱导针对所述蛋白质的免疫应答。腺病毒5型作为表达非洲猪瘟抗原蛋白的载体具有很多优势:
①
腺病毒表达载体是复制缺陷型的,只能在其独特的互补细胞系中生产制备,同时腺病毒无需整合进宿主细胞基因组中,目的基因在宿主细胞基因组外游离状态下表达,整合突变致癌可能性小,基因毒性低,制备疫苗安全性好;
②
重组的腺病毒载体可获得较高的滴度,利于大规模生产,工厂化效率高,生产成本低;
③
目前对腺病毒5型的结构、特性、功能的研究较为深入,腺病毒载体容易复制,操作简单,利于研究;
④
普通的一代腺病毒载体基因组敲除了6k的基因,能插入外源基因7.5k,具有较大的容量;
⑤
腺病毒相对稳定,经得起纯化、浓缩、保存。
7.现有技术报道了一些活载体疫苗。例如将asfv p32、p54、p72和pp62基因分别重组入人腺病毒ad5载体中进行“鸡尾酒”式免疫,获得了良好的抗原特异性ctl反应;之后他们又将asfv a151r、b119l、b602l、ep402rδprr、b438l和k205r-a104r共7个asfv抗原基因,重组入复制缺陷型腺病毒载体,通过“鸡尾酒”式混合免疫后能够诱导强烈体液免疫反应和细
id no.7所示的核苷酸序列。
16.非洲猪瘟病毒的抗原基因共计有160多种,发明人经过大量筛选实验,从中选出了20种免疫效果更强的抗原基因,分别为:p72、b602l、p30、p54、cp129r、mgf5l6l、cp312r、mgf110-4l、l8l、i215l、i73r、e146l、ep402r、ep153r、i177l、k205r、f317l、a151r、p34、pp62;这20种抗原基因根据基因片段大小,被分成五组,每组的4种抗原基因能在本发明提供的重组腺病毒载体pad5lcl3中得以共表达,即能在同一载体中完全独立表达四种抗原基因。这五组抗原基因疫苗(包括了5个重组腺病毒载体pad5lcl3)组成了完整的非洲猪瘟病毒疫苗,取得了非常好的免疫效果。本发明选取了l8l、i215l、i73r、e146l、ep402r四种抗原基因,可以很好地搭配组装在同一重组腺病毒载体中,从而得以完全独立表达这四种抗原基因。
17.研究证明,表e3区对于外源蛋白的表达水平不高,而在e1和e4区进行抗原基因的表达,表达水平更高,因此可以将四个抗原分别表达在e1区和e4区。
18.e3基因由于跟复制相关,需要敲除,让其复制缺陷;e3的作用是与腺病毒的免疫逃逸相关;敲除e3区可以增加腺病毒载体的容量;并使腺病毒载体能够正常包装。
19.另一方面,本发明还提供一种非洲猪瘟病毒的四种抗原基因共表达的重组腺病毒载体的构建方法,包含以下步骤:
20.1)利用crispr/cas9敲除腺病毒环状载体质粒的e1基因,引入swaⅰ酶切位点,融合后的片段与载体无缝克隆,再利用crispr/cas9敲除e3基因,再使用无缝克隆方式连接,获得缺失e1和e3基因的腺病毒载体质粒pad5。
21.2)再利用crispr/cas9敲除腺病毒环状载体质粒的e4基因,使用pcr扩增并引入i-scei酶切位点,再使用无缝克隆方法,获得缺失e1、e3和e4基因的腺病毒载体质粒pad5δe4。
22.在已经敲除了e1、e3基因的基础上,敲除e4基因,能提高腺病毒载体的容量,降低其免疫原性,同时可以在e4区域插入外源基因,外源基因可以在e4位置大量表达,而不影响腺病载体的包装。在e1、e4基因处表达外源基因,能避免多个外源基因在同一区域表达的相互干扰,更利于表达,同时减少了不必要的e4相关基因,降低了腺病毒的免疫原性,使腺病毒能较为长期得存在于宿主细胞中,使外源基因更长期表达。
23.e4区基因在免疫原性中起着关键作用,大量e4区域基因的表达会使宿主产生较为强烈的免疫反应,诱导抗体的产生,不利于是腺病毒载体在宿主中长期表达目的蛋白,因此在e4区域敲除不必要的基因可以降低腺病毒载体的免疫原性,使载体能够在较长时间内进行表达。
24.为了使e4基因能敲除完全,便于大载体质粒的连接,使用crispr/cas9方法将e4区域的上游fiber基因、以及e4的基因,进行敲除,使用pcr的方法扩增部分fiber以及引入i-scei单酶切位点,再使用gibson的无缝克隆方法,将多余切除的片段连接至载体上,重新获得e4敲除引进了i-scei单酶切位点的载体质粒。使用i-scei将载体质粒线性化,构建e4区域的穿梭质粒,使外源基因重组到e4区域,并在e4区域大量表达。
25.3)利用crispr/cas9敲除腺病毒环状载体质粒的e2a基因,并将e4区的orf6/7表达框放在敲除了e2a区的序列位置,再使用无缝克隆方法,获得缺失e1、e3、e4和e2a基因的腺病毒载体质粒pad5lcl3。
26.e4区域的orf1~orf5的序列进行敲除,保留e4 promoter、orf6、orf7、polya序列,并将其插入e2a位置,因此e4位置可以进行表达外源基因。同时还敲除了e2a区的dbp序列。腺病毒e2a基因是一个dna binding protein,与腺病毒的复制相关,敲除这个基因并不影响腺病毒的结构蛋白以及腺病毒的包装。dbp缺失可以阻止或极大减低回复突变。e2a和e4部分序列的敲除,增加了约3kb的载体容量。
27.研究发现腺病毒复制相关的基因为e1、e2、e3、e4,缺失这些基因,并不影响腺病毒结构蛋白的表达,不妨碍腺病毒的包装,但是会使腺病毒无法复制;因此构建这些复制相关的细胞系,能使敲除复制基因的复制缺陷型的腺病毒载体能够在其特有的细胞系中进行复制包装。同时,研究发现,只要表达腺病毒的e4基因中orf6或是orf3均能够代替整个e4基因,使敲除了e4的腺病毒能够复制包装。通过进一步对e4、e2a基因进行序列的研究分析,e4基因能够在e2a处表达。因此,本发明对e4基因进行序列分析,找出了e4的promoter、orf6/7、polya这几个基本元素,将其整合成一个完整的表达框,将其构建在敲除了e2a基因的序列位置,使orf6、orf7基因正常表达,最终获得了敲除e1、e3、e4、e2a,并将e4表达框置于e2a位置的复制缺陷型腺病毒5型载体,能在含有dbp序列的293td37细胞中进行复制包装。
28.研究发现,e4基因中含有orf1,2,3,4,5,6,7共7个表达框,其中orf6/7是不能缺失的,一旦缺失了,将会明显影响腺病毒的包装和抗原基因的表达,因此需要将orf6/7补回,同时为了获得更大的载体空间,需要将orf6/7在e2a处表达,从而制得容量更大、表达效果更好的腺病毒载体。
29.4)构建腺病毒e1区域穿梭质粒ps5e1,通过dna连接酶分别与l8lubiqutin、ires、i215l基因片段连接,构建非洲猪瘟腺病毒5型载体e1区域穿梭质粒ps5e1-l8lubiqutin-ires-i215l。
30.穿梭质粒ps5e1先与核糖体进入位点ires片段连接得到ps5e1-ires载体,再与i215l片段连接,得到ps5e1-ires-i215l,ps5e1-ires-i215l与l8lubiqutin片段进行酶切并连接,获得e1区域穿梭质粒ps5e1-l8lubiqutin-ires-i215l,并进行菌落pcr验证。
31.l8lubiqutin是通过在l8l上添加分子佐剂ubiqutin,形成l8lubiqutin,分子佐剂ubiqutin可以帮助提高疫苗的免疫应答反应。
32.5)构建腺病毒e4区域穿梭质粒ps5e4-egfp,i73rhbsag、2a、e146l基因通过融合pcr技术得到i73rhbsag-2a-e146l基因片段,通过对穿梭质粒ps5e4-egfp酶切,敲除egfp,并通过dna连接酶与i73rhbsag-2a-e146l无缝克隆连接,构建非洲猪瘟腺病毒5型载体e4区域穿梭质粒ps5e4-i73rhbsag-2a-e146l。
33.通过对e4的穿梭质粒ps5e4-egfp酶切,敲除egfp替换为ps5e4-i73rhbsag-2a-e146l为i73rhbsag、e146l通过2a序列连接。2a序列的加入是为了蛋白的裂解,ef1α启动子串联表达,2a序列又进一步裂解获得的cp312r、mgf4l抗原。
34.i73rhbsag是通过在i73r上添加分子佐剂hbsag,形成i73rhbsag,分子佐剂hbsag可以帮助提高疫苗的免疫应答反应。
35.6)将穿梭质粒ps5e1-l8lubiqutin-ires-i215l与腺病毒载体质粒pad5lcl3同源重组,得到腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l。
36.7)将穿梭质粒ps5e4-i73rhbsag-2a-e146l与腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l同源重组,获得四种抗原基因共表达的重组腺病毒载体
pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l,所述四种抗原基因共表达的重组腺病毒载体具有如序列表中seq id no.8所示的核苷酸序列。
37.现有的腺病毒载体构建普遍采用穿梭质粒,需要寻找单一的酶切位点。本发明创造性地采用crispr/cas9来构建重组腺病毒载体,通过比对,选择合适的e1、e3、e4、e2a敲除位点,根据e1、e3、e4、e2a序列的位置,敲除的基因碱基的数量,选择crispr位点,并设计了最佳的grna,从而完成重组腺病毒载体的构建。
38.进一步地,步骤1)所述的腺病毒环状载体质粒来源于在a549细胞中扩增野生型人腺病毒5型病毒,收集并浓缩病毒液,采用hirtvirual dna extract方法提取腺病毒5型基因组,使用cosmid方法将线性的腺病毒5型基因组构建成环状的腺病毒环状载体质粒。
39.进一步地,步骤3)所述的orf6/7表达框基因具有如序列表中seq id no.9所示的核苷酸序列;步骤4)所述的ires具有如序列表中seq id no.10所示的核苷酸序列;步骤5)所述的2a具有如序列表中seq id no.11所示的核苷酸序列。
40.进一步地,步骤4)所述的穿梭质粒ps5e1骨架采用puc origin、amp等基本元素,ad5左臂itr部分序列,右臂pix、piva2部分序列,以及cmv-mcs sv40 early polya;步骤5)所述的e4区域穿梭质粒ps5e4-egfp的骨架采用puc origin、amp等基本元素,ad5e4区域左臂itr序列,右臂部分fiber基因序列,以及ef1α-egfp-hbv polya基因;其中puc origin、amp等基本元素具有如序列表可见中seq id no.12所示的核苷酸序列,ef1α-egfp-hbv polya基因具有如序列表可见中seq id no.13所示的核苷酸序列。
41.穿梭质粒ps5e1的骨架由北京博迈德基因技术有限公司合成,合成采用puc origin、amp等基本元素(2796bp),ad5左臂itr部分序列(400bp),右臂pix、piva2部分序列(2100bp),以及cmv-mcs(944bp)sv40 early polya(160bp)。经pcr扩增和基因片段纯化后,进行无缝克隆连接,连接产物转化至感受态细胞,涂布氨苄抗性平板,培养后挑选阳性克隆进行酶切验证,获得腺病毒e1区域穿梭质粒ps5e1。
42.穿梭质粒ps5e4的骨架采用puc origin、amp等基本元素,ad5e4区域左臂itr序列(370bp),右臂部分fiber基因序列(1746bp),以及ef1α-egfp-hbv polya基因。经pcr扩增和基因片段纯化后,进行无缝克隆连接,连接产物转化至感受态细胞,涂布氨苄抗性平板,培养后挑选阳性克隆进行酶切验证,获得腺病毒e4区域穿梭质粒ps5e4-egfp。
43.进一步地,步骤6)穿梭质粒ps5e1-l8lubiqutin-ires-i215l与腺病毒载体质粒pad5lcl3同源重组,是通过paci和swai对穿梭质粒ps5e1-l8lubiqutin-ires-i215l和腺病毒载体质粒pad5lcl3进行酶切,酶切产物去磷酸化,omega ultra-sep gel extraction kit进行胶回收载体和片段,转化产物涂布平板,挑取菌落,进行xhoi酶切验证。
44.进一步地,步骤7)穿梭质粒ps5e4-i73rhbsag-2a-e146l与腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l同源重组,是通过paci和i-scei对穿梭质粒ps5e4-i73rhbsag-2a-e146l和腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l进行酶切,酶切产物去磷酸化,omega ultra-sep gel extraction kit进行胶回收载体和片段,转化产物涂布平板,挑取菌落,进行xhoi酶切验证。
45.另一方面,本发明提供一种重组腺病毒载体的包装方法,其特征在于,将权利要求1或2所述的重组腺病毒载体pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l用paci酶切,线性化后的质粒用于转染;转染由pcdna3.1+(hyg)-orf6-ires-dbp构建的293td37细胞,收
集细胞悬液,实现重组腺病毒包装。其中的293td37细胞株于2019年5月8日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:c201996,分类命名是人胚肾转化细胞ay293-td15,该细胞株包含腺病毒5型的e2a基因和e4-orf6/7基因,是通过将hek293细胞经过基因工程改造所获得,能用于包装缺失e2a基因和e4基因的二代重组腺病毒而形成完整的具有感染性的二代腺病毒颗粒。
46.进一步地,所述的一种重组腺病毒载体的包装方法,由以下步骤制得:
47.1)将pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l共表达重组腺病毒载体用paci酶切,线性化后的质粒用于转染;使用pei转染试剂转染293td37细胞;
48.2)转染后的293td37细胞于37℃,5%co2培养箱中培养72-96小时后收集细胞悬液,即为tp0代腺病毒;
49.3)tp0代腺病毒感染293td37细胞于37℃,5%co2培养箱中培养72小时,收集细胞悬液即tp1代腺病毒;
50.4)重复3),收集细胞悬液即tp2代腺病毒;
51.5)持续接毒直至tp4代腺病毒。
52.另一方面,本发明还提供了293td37细胞用于包装非洲猪瘟病毒四种抗原基因共表达的重组腺病毒载体的用途,其特征在于,所述四种抗原基因分别为l8lubiqutin、i215l、i73rhbsag和e146l,其中l8lubiqutin和i215l表达在e1区,i73rhbsag和e146l表达在e4区,构成四种抗原基因共表达的重组腺病毒载体pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l;其中,所述293td37细胞是由pcdna3.1+(hyg)-orf6-ires-dbp构建的,细胞株保藏编号为:cctcc no:c201996,保藏于中国典型培养物保藏中心。
53.本发明提供了一种非洲猪瘟病毒疫苗,所述疫苗是通过构建非洲猪瘟病毒四种抗原基因共表达的重组腺病毒载体,并经293td37细胞包装而获得。其中,非洲猪瘟病毒的四种抗原基因分别为l8lubiqutin、i215l、i73rhbsag和e146l。非洲猪瘟病毒四种抗原基因共表达的重组腺病毒载体的构建,主要通过crispr/cas9敲除腺病毒载体的e1、e3、e2a和e4基因,构建了e1、e4区域的穿梭质粒,分别用于表达l8lubiqutin和i215l、i73rhbsag和e146l基因,从而获得全新的腺病毒载体。本发明的有益效果主要体现在:
54.①
提供了全新的腺病毒5型载体crispr/cas9的构建方法,并选择了最佳敲除位点,设计了最佳grna,避免了过去载体构建用穿梭质粒敲除,需要找单一的酶切位点。
55.②
由于e4区基因在免疫原性中起着关键作用,大量e4区域基因的表达会使宿主产生较为强烈的免疫反应,诱导抗体的产生,不利于腺病毒载体在宿主中长期表达目的蛋白,本发明在e4区域敲除不必要的基因可以降低腺病毒载体的免疫原性,使载体能够在较长时间内进行表达。
56.②
本发明将e4区域的orf1~orf5的序列进行敲除,保留e4 promoter、orf6、orf7、polya序列,并将其插入e2a位置,因此e4位置可以进行表达外源基因。
57.③
本发明还进一步敲除了dbp(e2a)序列,dbp缺失可以阻止或极大减低回复突变。
④
e2a和e4部分序列的敲除,相对于一代载体,增加了约3kb的载体容量。
58.⑤
腺病毒载体的e2a、e4敲除,并将e4promoter-orf6/7-polya放于e2a区域,由此可以用e2a互补的细胞系进行包装,同时,外源基因可以在e1、e4区域同时表达而不相互干扰,目前该腺病毒疫苗在我们公司构建的互补细胞系—293td37细胞系中的拯救,该细胞系
能够持久的表达dbp蛋白。
59.⑥
本发明构建了e1、e4区域的穿梭质粒,用于e1、e4区域外源基因表达。
60.⑦
本发明经293td37细胞系包装制备得到的重组腺病毒病毒的滴度较高。
61.基于以上原则,本发明可以极大地提高腺病毒载体的疫苗的容量,使用在一个腺病毒载体上同时表达非洲猪瘟四个独立抗原的方式,增强对非洲猪瘟病毒的特异性免疫反应,可以使家猪获得更好的免疫保护。
附图说明
62.图1为实施例2的ad5-e4-up-grna裂解位点和pam位点示意图
63.图2为实施例2的ad5-e4-down-grna裂解位点和pam位点示意图
64.图3为实施例2的ad5-e4-up-grna、ad5-e4-down-grna以及cas9“双酶切”载体质粒电泳检测结果,其中泳道1为ad5-e4-up-grna、ad5-e4-down-grna以及cas9“双酶切”,m为marker
65.图4为实施例2含有部分敲除的fiber、itr片段扩增电泳检测结果,其中泳道1为fiber部分片段扩增结果,泳道2为itr部分片段扩增结果,m为marker
66.图5为实施例2的fiber-itr融合片段电泳检测结果,其中泳道1为fiber-itr融合片段,m为marker
67.图6为实施例2的菌落pcr验证电泳检测结果,其中泳道1-24为菌落,m为marker
68.图7为实施例2对图6的阳性克隆菌落质粒进行bamhi、xhoi酶切验证的电泳检测结果,其中1-5为bamhi酶切,6-10为xhoi酶切,1、10为pad5对照(为确实e4基因),m为marker
69.图8为实施例3的100k-grna裂解位点和pam位点示意图
70.图9为实施例3的protease-grna裂解位点和pam位点示意图
71.图10为实施例3的100k-grna、protease-grna以及cas9“双酶切”载体质粒电泳检测结果,泳道1为100k-grna、protease-grna以及cas9“双酶切”载体质粒结果,m为marker
72.图11为实施例3的100k、e4 orf6/7表达框、protease pcr扩增电泳检测结果,其中泳道1为e4orf6/7表达框,泳道2为100k,m为marker
73.图12为实施例3的100k、e4 orf6/7表达框、protease片段的融合pcr电泳检测结果,其中泳道1为片段100k、e4 orf6/7表达框、protease融合pcr产物,m为marker
74.图13为实施例3的菌落pcr验证电泳检测结果,其中泳道1-24为菌落,m为marker
75.图14为实施例3对图13的菌落挑取9、18、21、24号阳性克隆菌落进行xhoi酶切验证的电泳检测结果,其中泳道1为9号阳性克隆xhoi酶切,泳道2为18号阳性克隆xhoi酶切,泳道3为21号阳性克隆xhoi酶切,泳道4为24号阳性克隆xhoi酶切,泳道5为对照质粒pad5lcl3的xhoi酶切,m为marker
76.图15为实施例4的cmv-mcs和sv40 earlypolya片段扩增电泳检测结果,其中泳道1为cmv-mcs片段,泳道2为sv40 earlypolya片段,m为2000marker
77.图16为实施例4的cmv-mcs-sv40 earlypolya、puc、ad5右臂、ad5左臂扩增电泳检测结果,其中泳道1为cmv-mcs-sv40 earlypolya融合片段,泳道2为puc,泳道3为ad5右臂,泳道4为ad5左臂,m为2000marker
78.图17为实施例4的ps5e1骨架、ad5左臂、ad5右臂、cmv-mcs-sv40 earlypolya四个
片段连接产物转化感受态细胞菌落pcr验证电泳检测结果,其中泳道1-6为菌落,m为marker
79.图18为实施例4的选取图17中的1-6号菌落酶切验证的电泳检测结果,其中左1-6为质粒ps5e1ncoi单酶切,右1-6为质粒ps5e1 paci单酶切,m为15000bp marker
80.图19为实施例4的ires片段pcr扩增电泳检测结果,其中泳道1、2为ires片段pcr扩增产物,m为15000bp marker
81.图20为实施例4的片段ires与ps5e1载体酶切电泳检测结果,其中泳道1为片段ires ecorv、noti酶切,泳道2为ps5e1 ecorv、noti酶切,m为15000bp marker
82.图21为实施例4的ps5e1载体与ires片段连接产物转化感受态细胞菌落pcr验证电泳检测结果,其中1-9号为菌落,m为marker
83.图22为实施例4的ps5e1-ires质粒noti、ecorv酶切电泳检测验证,选取图21的2、6进行质粒提取,酶切验证,其中1号泳道为2号质粒noti、ecorv酶切鉴定,2号泳道为6号质粒noti、ecorv酶切鉴定
84.图23为实施例4的i215l与ps5e1-ires载体酶切电泳检测结果,其中泳道载体为ps5e1-ires,noti和xhoi双酶切,泳道i215l为片段i215l,noti和xhoi双酶切,m为15000bp、2000bp marker
85.图24为实施例4的i215l与ps5e1-ires连接产物转化感受态细胞菌落pcr验证电泳检测结果,其中1-11号为菌落,m为2000bp marker
86.图25为实施例4的ps5e1-ires-i215l质粒酶切电泳检测验证,选取图24中的5、6、7、8号菌落进行质粒提取,酶切验证,其中2号泳道为2号质粒酶切验证,9号泳道为9号质粒酶切验证,11号泳道为11号质粒酶切验证,m为marker
87.图26为实施例4的l8l和ubiqutin融合后的l8lubiqutin片段,并经胶回收纯化试剂盒纯化后的电泳检测结果,其中泳道1为l8lubiqutin片段,m为marker
88.图27为实施例4的片段l8lubiqutin与ps5e1-ires-i215l载体酶切产物电泳检测结果,其中泳道1为ps5e1-ires-i215l质粒;泳道2为ps5e1-ires-i215l质粒ecorv和bamhi酶切;泳道3为l8lubiqutin片段ecorv和bamhi酶切,m为15000bp marker
89.图28为实施例4的ps5e1-ires-i215l载体与l8lubiqutin连接产物转化感受态细胞菌落pcr验证电泳检测结果,其中1-24号为菌落,m为2000bp marker
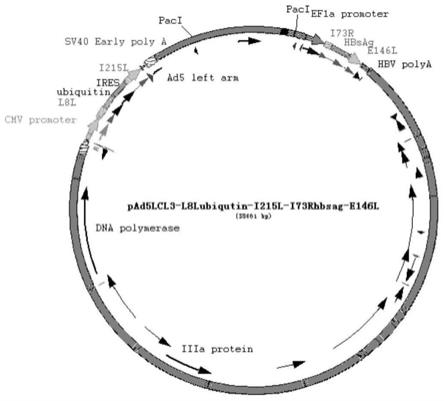
90.图29为实施例4的ps5e1-l8lubiqutin-ires-i215l质粒酶切电泳检测验证,其中4、6、9、14、17、18号泳道为选取图27中的4、6、9、14、17、18号菌落质粒bamhi、ecorv酶切鉴定,m为15000bp marker
91.图30为实施例5的ps5e4-egfp穿梭质粒左臂、ps5e4-egfp穿梭质粒右臂、ef1α-egfp-hbv、ps5e4-egfp穿梭质粒骨架扩增电泳检测结果,其中泳道1为ps5e4-egfp穿梭质粒左臂,泳道2为ps5e4-egfp穿梭质粒右臂,泳道3为ef1α-egfp-hbv,泳道4为ps5e4-egfp穿梭质粒骨架,m为2000marker
92.图31为实施例5的ps5e4-egfp穿梭质粒左臂、ps5e4-egfp穿梭质粒右臂、ef1α-egfp-hbv、ps5e4-egfp穿梭质粒骨架四个片段连接产物转化感受态细胞菌落pcr验证电泳检测结果,其中泳道1-20为菌落,m为marker
93.图32为实施例5的选取图30中的3、4、5、6号菌落酶切验证的电泳检测结果,其中1-4为3、4、5、6号阳性克隆paci单酶切,5-8为3、4、5、6号阳性克隆hindiii单酶切,m1、m3为
15000bp marker,m2为2000bp marker
94.图33为实施例5的融合pcr扩增i73rhbsag和2a-e146l片段的电泳检测结果,其中泳道1为i73rhbsag片段,泳道1为2a-e146l片段,m为2000bp marker
95.图34为实施例5的片段ps5e4-egfp载体酶切电泳检测结果,其中泳道1为片段ps5e4-egfp,bamhi和xhoi双酶切胶回收,m为15000bp marker
96.图35为实施例5的ps5e4-egfp胶回收载体与i73rhbsag片段、2a-e146l无缝克隆连接并转化感受态细胞菌落pcr验证电泳检测结果,其中1-12号为菌落,m为15000bp marker
97.图36为实施例5挑取图35的1、2、3号阳性克隆提取质粒进行bamhi、xhoi双酶切验证的电泳检测结果,其中泳道1、2、3分别为1、2、3号阳性克隆bamhi、xhoi双酶切验证,m为15000bp marker
98.图37为实施例6的pad5lcl3与ps5e1-l8lubiqutin-ires-i215l琼脂糖凝胶验证电泳检测结果,其中泳道1为pad5lcl3,泳道2为ps5e1-l8lubiqutin-ires-i215l
99.图38为实施例6的穿梭质粒ps5e1-l8lubiqutin-ires-i215l和腺病毒载体质粒pad5lcl3同源重组获得pad5lcl3-l8lubiqutin-ires-i215l质粒的电泳检测结果,其中泳道1-7为pad5lcl3-l8lubiqutin-ires-i215l克隆,m为15000bp marker
100.图39为实施例6挑取图38的6号阳性质粒转化至感受态细胞,提取质粒进行酶切验证检测结果,其中1号泳道为pad5lcl3-p72-ires-b602l质粒xhoi酶切,m为15000bp marker
101.图40为实施例6对穿梭质粒ps5e4-i73rhbsag-2a-e146l和腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l琼脂糖凝胶验证电泳检测结果,其中泳道1为ps5e4-i73rhbsag-2a-e146l,泳道2为pad5lcl3-l8lubiqutin-ires-i215l,m为15000bp marker
102.图41为实施例6的穿梭质粒ps5e4-i73rhbsag-2a-e146l和腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l同源重组获得重组腺病毒载体pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l质粒的电泳检测结果,其中泳道1-8为质粒,m为15000bp marker
103.图42为实施例6的挑取图41的2号阳性质粒转化至感受态细胞,提取质粒进行酶切验证检测结果,其中2号泳道为pad5lcl3-l8lubiqutin-i215l-i73hbsag-e146l质粒xhoi酶切,m为15000bp marker
104.图43为实施例7的tp0引起的293td37细胞照片
105.图44为实施例7的tp1引起的293td37细胞照片
106.图45为实施例7的tp2引起的293td37细胞照片
107.图46为实施例7的tp3引起的293td37细胞照片
108.图47为实施例7的tp4引起的293td37细胞病变照片
109.图48为实施例11用western blot检测非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73hbsag-e146l中l8lubiqutin和i215l蛋白结果示意图,其中泳道1为293空白细胞,泳道2、3为293td37细胞感染pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l的样品,m为marker
110.图49为pad5lcl3的载体图谱
111.图50为ps5e1的载体图谱
112.图51为ps5e1-l8lubiqutin-ires-i215l的载体图谱
113.图52为ps5e4-egfp的载体图谱
114.图53为ps5e4-i73rhbsag-2a-e146l的载体图谱
115.图54为pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l的载体图谱
116.图55为实施例12的pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l诱导的cd8+t细胞反应结果示意图
117.图56为实施例12的pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l诱导的cd4+t细胞反应结果示意图
118.图57为实施例12的肌肉注射pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l后细胞免疫反应代表图
119.图58为实施例12的空白对照免疫反应代表图
具体实施方式
120.下面结合附图对本发明的优选实施例作进一步详细描述,需要指出的是,以下所述实施例旨在便于对本发明的理解,而对其不起任何限定作用。
121.实施例1缺失e1和e3基因的腺病毒载体质粒的构建
122.在a549细胞中扩增野生型人腺病毒5型(vr-1516,基因序列ac_000008.1)病毒,收集并进行浓缩病毒液,采用hirtvirual dna extract方法提取腺病毒基因组,使用cosmid的方法将线性的had5基因组构建成环状的supercos-ad5载体质粒,利用crispr/cas9对had5腺病毒e1区域进行切除,设计grna如下:
123.had5-e1上游grna:
124.ggcgggaaaacugaauaagguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
125.had5-e1下游grna:
126.gagaugauccagucguagcguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
127.在had5 e1区域的上下游设计grna位点,切割后回收大片段载体,设计引物,通过融合pcr将itr,pix序列分别插入上、下游,并引入swai酶切位点,然后将融合后的片段与载体进行无缝克隆,获得e1敲除的supercos-ad5δe1腺病毒载体,而后对supercos-ad5δe1质粒进行e3区域的切除,设计grna如下:
128.had5-e3上游grna:
129.gcgggacauuucagaucggguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
130.had5-e3下游grna:
131.guaaggguacugcuaucggguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
132.在had5 e3区域的上下游设计grna位点,切割后回收大片段载体,后设计引物,对e3上下游过多切除的fiber,以及pviii序列进行融合pcr,使用无缝克隆的方式连接,获得缺失e1和e3基因,并引入swai酶切位点的腺病毒载体质粒pad5。
133.实施例2缺失e1、e3和e4基因的腺病毒载体质粒pad5δe4的构建
134.采用实施例1获得的已经敲除了e1、e3基因的载体质粒pad5,进一步敲除敲除e4基因,能提高腺病毒载体的容量,降低其免疫原性,并使用pcr的方法扩增部分fiber以及引入ndei单酶切位点,再使用gibson的无缝克隆方法,将多余切除的片段连接至载体上,获得缺失e1、e3和e4基因,并引入swai和i-scei酶切位点的载体质粒pad5δe4。
135.1、目的基因e4 crispr靶序列的选择
136.1)e4基因上游fiber基因crispr靶序列的选择
137.使用赛默飞geneart
tm
crispr search and design tool(thermofisher.com/crisprdesign)软件,输入fiber基因的前400个碱基,软件自动分析该400个碱基的序列,提供了6个潜在的crispr靶序列。考虑到e4基因敲除序列的长度,以及构建活载体的要求,选择gctactaaacaattccttcc作为靶向序列,最终获得的grna命名为ad5-e4-up-grna,裂解位点和pam位点如图1所示。
138.2)e4下游非编码序列crispr靶序列的选择
139.使用赛默飞geneart
tm
crispr search and design tool(thermofisher.com/crisprdesign)软件,输入e4下游的300个碱基,软件自动分析,提供了6个潜在的crispr靶序列,选择aggttcgcgtgcggttttct作为靶向序列,最终获得的grna命名为ad5-e4-down-grna,裂解位点和pam位点如图2所示。
140.2、ad5-e4-up-grna和ad5-e4-down-grna的dna扩增
141.1)ad5-e4-up-grna的dna模板设计
[0142]5’‑
taatacgactcactatagtactaaacaattccttccgttttagagctagaaatagcaagttaaaataaggctagtcc gttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’[0143]
2)ad5-e4-down-grna的dna模板设计
[0144]5’‑
taatacgactcactataggttcgcgtgcggttttctgttttagagctagaaatagcaagttaaaataaggctagtcc gttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’[0145]
3、设计扩增ad5-e4-up-grna和ad5-e4-down-grna的dna模板的上下游引物
[0146]
设计上下游引物分别进行pcr扩增ad5-e4-up-grna的dna模板和ad5-e4-down-grna的dna模板,使用geneart
tm precision grna synthesis kit试剂盒进行扩增。
[0147]
引物设计:
[0148]
ad5-e4-up-grna-forward:taatacgactcactatagtactaaacaattcct
[0149]
ad5-e4-up-grna-reverse:ttctagctctaaaacggaaggaattgtttagta
[0150]
ad5-e4-down-grna-forward:taatacgactcactataggttcgcgtgcggttt
[0151]
ad5-e4-down-grna-reverse:ttctagctctaaaacagaaaaccgcacgcgaac
[0152]
4、扩增ad5-e4-up-grna和ad5-e4-down-grna的dna模板
[0153]
1)准备0.3μm的ad5-e4-up-grna-forward/reverse引物混合工作液
[0154]
10μm的ad5-e4-up-grna-forward引物3ul,10μm的ad5-e4-up-grna-reverse引物3ul,补充水至100ul。
[0155]
2)准备0.3μm的ad5-e4-down-grna-forward/reverse引物混合工作液
[0156]
10μm的ad5-e4-down-grna-forward引物3ul,10μm的ad5-e4-down-grna-reverse引物3ul,补充水至100ul。
[0157]
3)pcr反应体系
[0158]
ad5-e4-up-grna的dna模板扩增的pcr反应体系为:phusion
tm high-fidelity pcr master mix(2
×
)12.5ul,tracr fragment+t7 primer mix 1ul,0.3μm ad5-e4-up-grna-forward/reverse引物混合工作液1ul,补水至25ul。
[0159]
ad5-e4-down-grna的dna模板扩增的pcr反应体系为:phusion
tm high-fidelity pcr master mix(2
×
)12.5ul,tracr fragment+t7 primer mix 1ul,0.3μm ad5-e4-down-grna-forward/reverse引物混合工作液1ul,补水至25ul。
[0160]
4)pcr程序
[0161]
起始变性98℃,10sec,1循环;变性98℃,5sec;退火55℃,15sec,32循环;延伸72℃,1min,1循环;保持4℃。
[0162]
5、体外转录获得ad5-e4-up-grna和ad5-e4-down-grna
[0163]
使用transcriptaid
tm enzyme mix对模板dna进行体外转录,获得ad5-e4-up-grna和ad5-e4-down-grna。
[0164]
体外转录获得ad5-e4-up-grna的反应体系为:ntp mix 8ul,e1a-grna dna模板6ul,5
×
transcriptaid
tm reaction buffer 4ul,transcriptaid
tm enzyme mix 2ul。于37℃孵育4小时后加入1ul的dnase i,于37℃孵育15分钟。
[0165]
体外转录获得ad5-e4-down-grna的反应体系为:ntp mix 8ul,e1b-grna dna模板6ul,5
×
transcriptaid
tm reaction buffer 4ul,transcriptaid
tm enzyme mix 2ul。于37℃孵育4小时后加入1ul的dnase i,于37℃孵育15分钟。
[0166]
体外转录获得ad5-e4-up-grna、ad5-e4-down-grna。
[0167]
6、体外转录产物的纯化
[0168]
1)将转录后的反应体系用无核酸酶水补充至200ul;
[0169]
2)加入100ul的binding buffer,充分混匀;
[0170]
3)加入300ul的乙醇(》96%),充分混匀;
[0171]
4)将混合液转移到the gene jet
tm rna purification micro column中,14000
×
g离心30-60秒,弃下液;
[0172]
5)加入700ul的wash buffer1(加入13ml乙醇),14000
×
g离心30-60秒,弃下液;
[0173]
6)加入700ul的wash buffer2(加入30ml乙醇),14000
×
g离心30-60秒,弃下液,重复上述步骤一次;
[0174]
7)14000
×
g空离60秒,将所有的洗脱液完全去除,将空管放置于1.5ml的收集管中;
[0175]
8)在柱子中心加入10ul的无核酸酶水,14000
×
g离心60秒收集grna。
[0176]
其中,wash buffer1和wash buffer2均为transcriptaid
tm enzyme mix试剂盒中的试剂,转录获得的ad5-e4-up-grna和ad5-e4-down-grna的rna序列如下所示:
[0177]
ad5-e4-up-grna:guacuaaacaauuccuuccguuuuagagcuagaaauagcaaguuaaaauaaggcuagucc guuaucaacuugaaaaaguggcaccgagucggugcuuuu
[0178]
ad5-e4-down-grna:gguucgcgugcgguuuucuguuuuagagcuagaaauagcaaguuaaaauaaggcuagucc guuaucaacuugaaaaaguggcaccgagucggugcuuuu
[0179]
7、crispr/cas9“酶切”[0180]
使用ad5-e4-up-grna、ad5-e4-down-grna和cas9双酶切实施例1获得载体质粒,反
应体系为cas9蛋白3μg,ad5-e4-up-grna 6μg,ad5-e4-down-grna 6μg,pad5-rebp载体质粒3μg,neb buffer 3.1 5ul,补充水至50ul。
[0181]
酶切反应于37℃孵育过夜。取3ul样品进行琼脂糖凝胶验证,实验结果电泳图如图3所示。泳道1为ad5-e4-up-grna、ad5-e4-down-grna以及cas9“双酶切”pad5载体质粒结果,出现了目的大小在2500bp-5000bp的片段,可见酶切结果正确。使用axygen胶回收试剂盒将载体进行纯化。
[0182]
8、获得含有部分敲除的fiber、itr片段并引入i-scei酶切位点,敲除使用含有敲除部分fiber的引物,扩增fiber片段并引入i-scei酶切位点
[0183]
1)片段fiber的扩增
[0184]
扩增引物:
[0185]
fiber-rh-f:gagtgctactaaacaattccttcctggacccagaatattgg
[0186]
fiber-iscei-itr-r:tggtgttattaccctgttatccctagcaattgaaaaataaacacgttg
[0187]
扩增序列为:
[0188]
tggtgttattaccctgttatccctagcaattgaaaaataaacacgttgaaacataacacaaacgattctttattcttgggcaatgtatgaaaaagtgtaagaggatgtggcaaatatttcattaatgtagttgtggccagaccagtcccatgaaaatgacatagagtatgcacttggagttgtgtctcctgtttcctgtgtaccgtttagtgtaatggttagtgttacaggtttagttttgtctccgtttaagtaaacttgactgacaatgttacttttggcagttttaccgtgagattttggataagctgataggttaggcataaatccaacagcgtttgtataggctgtgccttcagtaagatctccatttctaaagttccaatattctgggtccaggaaggaattgtttagtagcactc
[0189]
扩增体系为:10μm fiber-rh-f引物1ul;10μm fiber-iscei-itr-r引物1ul;模板pad5(100ng/ul)0.5ul;q5高保真酶25ul;补水至50ul。
[0190]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,10sec,35循环;延伸72℃,5min,1循环;保持4℃。扩增结果电泳图如图4所示,泳道1为fiber部分片段扩增结果,m为2000marker,可见扩增结果正确,使用axygen胶回收试剂盒将片段进行纯化。
[0191]
2)itr片段的扩增
[0192]
扩增引物:
[0193]
iscei-itr-f:tagggataacagggtaataacaccactcgacacggcac
[0194]
itr-rh-r:ggcgtaggttcgcgtgcggttttctgggtgttttttgtggactt
[0195]
扩增序列为:
[0196]
ggcgtaggttcgcgtgcggttttctgggtgttttttgtggactttaaccgttacgtcattttttagtcctatatatactcgctctgcacttggcccttttttacactgtgactgattgagctggtgccgtgtcgagtggtgttattaccctgttatcccta
[0197]
扩增体系为:10μm iscei-itr-f引物1ul;10μm itr-rh-r引物1ul;模板pad5(100ng/ul)0.5ul;q5高保真酶25ul;补水至50ul。
[0198]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,10sec,35循环;延伸72℃,5min,1循环;保持4℃。扩增结果如图4所示,泳道2为itr部分片段扩增结果,m为2000marker,可见扩增结果正确,使用axygen胶回收试剂盒将片段进行纯化。
[0199]
3)融合pcr获得fiber-itr的融合片段
[0200]
扩增体系为:10μm fiber-rh-f引物1ul,10μm fiber-iscei-itr-r引物1ul,模板pad5(100ng/ul)0.5ul,q5高保真酶25ul,补水至50ul。
[0201]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,20sec,35循环;延伸72℃,5min,1循环;保持4℃。扩增结果如图5所示,泳道1为fiber-itr的融合片段,m为2000marker,可见融合结果正确。使用axygen胶回收试剂盒将片段进行纯化。
[0202]
9、载体连接
[0203]
使用neb的gibson使fiber-itr片段与敲除e4后的载体质粒连接,连接体系如下所示:胶回收产物载体质粒片段100ng,胶回收产物fiber-itr片段50ng,gibson预混液10ul,补水至20ul。于50℃,孵育40分钟。
[0204]
10、转化
[0205]
取出卡那抗性培养基平板,将制备好的neb 10β感受态细胞放在冰上融化后,加入10ul连接产物,用移液器轻轻吸打均匀,在冰上放置30分钟;将离心管放置42℃水浴,热击90秒,利用卡那青霉素抗性筛选转化子。
[0206]
11、菌落pcr进行转化子筛选
[0207]
使用pcr扩增方式对转化子进行菌落pcr验证。
[0208]
设计菌落pcr的下游引物
[0209]
e4-cexu-f:agtgacgatttgaggaagttg
[0210]
e4-cexu-r:tcaattgcagaaaatttcaagtc
[0211]
反应体系为:10μm e4-cexu-f引物1ul,10μm e4-cexu-r引物1ul,q5高保真酶10ul,补水至20ul,挑取单克隆菌落于反应体系中。pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,20sec,35循环;延伸72℃,5min,1循环;保持4℃。进行琼脂糖凝胶电泳验证,如图6所示,除了2、8、11、17号,大部分菌落出现了阳性条带。
[0212]
12、质粒酶切验证
[0213]
挑取4个阳性克隆菌落,提取质粒,进行bamhi、xhoi酶切验证,酶切结果如图7所示,从图7可以看出,2-5号质粒bamhi、xhoi酶切结果均正确,同时测序结果正确,即获得了缺失e1、e3和e4基因的腺病毒载体质粒pad5δe4。
[0214]
实施例3缺失e1、e3、e4和e2a基因的腺病毒载体质粒pad5lcl3的构建
[0215]
1、目的基因e2a crispr靶序列的选择
[0216]
1)e2a基因上游100k基因crispr靶序列的选择
[0217]
使用赛默飞geneart
tm
crispr search and design tool(thermofisher.com/crisprdesign)软件,输入100k基因的前400个碱基,软件自动分析该400个碱基的序列,提供了6个潜在的crispr靶序列。考虑到e2a基因敲除序列的长度,以及构建活载体的要求,选择ataggtggcgttcgtaggca作为靶向序列,最终获得的grna命名为100k-grna,裂解位点和pam位点如图8所示。
[0218]
2)e2a下游非编码序列crispr靶序列的选择
[0219]
使用赛默飞geneart
tm
crispr search and design tool(thermofisher.com/
crisprdesign)软件,输入e4下游的300个碱基,软件自动分析,提供了6个潜在的crispr靶序列,选择taccccggtaataaggttca作为靶向序列,最终获得的grna命名为protease-grna,裂解位点和pam位点图9所示。
[0220]
2、100k-grna和protease-grna的dna扩增
[0221]
1)100k-grna的dna模板设计
[0222]5’‑
taatacgactcactatagaggtggcgttcgtaggcagttttagagctagaaatagcaagttaaaataaggctagtcc gttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’[0223]
2)protease-grna的dna模板设计
[0224]5’‑
taatacgactcactatagccccggtaataaggttcagttttagagctagaaatagcaagttaaaataaggctagtcc gttatcaacttgaaaaagtggcaccgagtcggtgctttt-3’[0225]
3、设计扩增100k-grna和protease-grna的dna模板的上下游引物
[0226]
设计上下游引物分别进行pcr扩增100k-grna的dna模板和protease-grna的dna模板,使用geneart
tm precision grna synthesis kit试剂盒进行扩增。
[0227]
1)引物设计
[0228]
100k-grna-foward:taatacgactcactatag aggtggcgttcgtag
[0229]
100k-grna-reverse:ttctagctctaaaac tgcctacgaacgccacct
[0230]
protease-grna-foward:taatacgactcactatag ccccggtaataaggt
[0231]
protease-grna-reverse:ttctagctctaaaac tgaaccttattaccgggg
[0232]
2)扩增100k-grna和protease-grna的dna模板
[0233]
①
准备0.3μm的100k-grna-forward/reverse引物混合工作液,包括10μm的100k-grna-forward引物3ul,10μm的100k-grna-reverse引物3ul,补充水至100ul。
[0234]
②
准备0.3μm的aprotease-grna-forward/reverse引物混合工作液,包括10μm的protease-grna-forward引物3ul,10μm的protease-grna-reverse引物3ul,补充水至100ul。
[0235]
③
pcr反应体系
[0236]
100k-grna的dna模板扩增的pcr反应体系为:phusion
tm high-fidelity pcr master mix(2
×
)12.5ul,tracr fragment+t7 primer mix 1ul,0.3μm 100k-grna-forward/reverse引物混合工作液1ul,补水至25ul。
[0237]
protease-grna的dna模板扩增的pcr反应体系为:phusion
tm high-fidelity pcr master mix(2
×
)12.5ul,tracr fragment+t7 primer mix 1ul,0.3μm protease-grna-forward/reverse引物混合工作液1ul,补水至25ul。
[0238]
④
pcr程序
[0239]
起始变性98℃,10sec,1循环;变性98℃,5sec;退火55℃,15sec,32循环;延伸72℃,1min,1循环;保持4℃。
[0240]
3、体外转录获得100k-grna和protease-grna
[0241]
使用transcriptaid
tm enzyme mix对模板dna进行体外转录,获得100k-grna和protease-grna。
[0242]
1)体外转录获得100k-grna、protease-grna
[0243]
体外转录获得100k-grna的反应体系为:ntp mix 8ul,100k-grna dna模板6ul,5
×
transcriptaid
tm reaction buffer 4ul,transcriptaid
tm enzyme mix 2ul。于37℃孵育4小时后加入1ul的dnase i,于37℃孵育15分钟。
[0244]
体外转录获得protease-grna的反应体系为:ntp mix 8ul,protease-grna dna模板6ul,5
×
transcriptaid
tm reaction buffer 4ul,transcriptaid
tm enzyme mix 2ul。于37℃孵育4小时后加入1ul的dnase i,于37℃孵育15分钟。
[0245]
2)体外转录产物的纯化
[0246]
将转录后的反应体系用无核酸酶水补充至200ul,加入100ul的binding buffer,充分混匀,加入300ul的乙醇(》96%),充分混匀,将混合液转移到the gene jet
tm rna purification micro column中,14000
×
g离心30-60秒,弃下液;加入700ul的wash buffer1(加入13ml乙醇),14000
×
g离心30-60秒,弃下液;加入700ul的wash buffer2(加入30ml乙醇),14000
×
g离心30-60秒,弃下液,重复上述步骤一次。14000
×
g空离60秒,将所有的洗脱液完全去除,将空管放置于1.5ml的收集管中,在柱子中心加入10ul的无核酸酶水,14000
×
g离心60秒收集grna。
[0247]
其中,wash buffer1和wash buffer2均为transcriptaid
tm enzyme mix试剂盒中的试剂,转录获得的100k-grna和protease-grna的rna序列如下所示:
[0248]
100k-grna:gagguggcguucguaggcaguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
[0249]
protease-grna:gccccgguaauaagguucaguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu
[0250]
4、crispr/cas9“酶切”[0251]
使用100k-grna、protease-grna和cas9双酶切实施例2获得的缺失e1、e3和e4基因的腺病毒载体质粒,反应体系为cas9蛋白3μg;100k-grna 6μg;protease-grna 6μg;实施例2获得的载体质粒3μg;neb buffer 3.1 5ul;补充水至50ul。
[0252]
上述酶切反应分别于37℃孵育过夜。取3ul样品进行琼脂糖凝胶验证,实验结果如图10所示。泳道1为100k-grna、protease-grna以及cas9“双酶切”载体质粒结果,出现了目的大小在1000-2500bp的片段,可见酶切结果正确。使用axygen胶回收试剂盒将载体进行纯化。
[0253]
5、获得含有部分敲除的100k、e4 orf6/7表达框、protease片段
[0254]
1)部分敲除的100k、e4 orf6/7表达框、protease片段的扩增
[0255]
①
部分敲除的100k扩增引物:
[0256]
100k-f:tgagaataggtggcgttcgtaggcaaggctgacatccgctatgg
[0257]
100k-orf6/7-r:tacaattcccaacacatacaagtttccttctcctataggcagaa
[0258]
扩增体系为:10μm 100k-f引物1ul;10μm 100k-orf6/7-r引物1ul;模板pad5δe4(100ng/ul)0.5ul;q5高保真酶25ul;补水至50ul。
[0259]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,20sec,35循环;延伸72℃,5min,1循环;保持4℃。
[0260]
②
e4 orf6/7表达框扩增引物:
[0261]
orf6/7-f:acttgtatgtgttgggaattgta
[0262]
orf6/7-r:atcgtttgtgttatgtttcaacg
[0263]
扩增体系为:orf6/7-f引物1ul;10μm orf6/7-r引物1ul;模板orf6/7表达框基因(100ng/ul)0.5ul;q5高保真酶25ul;补水至50ul。
[0264]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,10sec,35循环;延伸72℃,5min,1循环;保持4℃。
[0265]
③
部分敲除的protease片段的扩增
[0266]
orf6/7-protease-f:cccacccttgccgtctgcgccgtatcgtttgtgttatgtttcaacg
[0267]
protease-r:atggatcacaaccccaccatgaaccttattaccggggtaccca
[0268]
扩增体系为:10μm orf6/7-protease-f引物1ul;10μm protease-r引物1ul;模板pad5δe4(100ng/ul)0.5ul;q5高保真酶25ul;补水至50ul。
[0269]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,10sec,35循环;延伸72℃,5min,1循环;保持4℃。
[0270]
④
100k、e4 orf6/7表达框、protease pcr扩增结果如图11所示,其中泳道1为e4 orf6/7表达框,泳道2为100k,m为15000bpmarker
[0271]
可见扩增结果正确,使用axygen胶回收试剂盒将片段分别进行胶回收纯化。
[0272]
6、融合pcr获得100k、e4 orf6/7表达框、protease片段的融合片段
[0273]
扩增体系为:10μm 100k-f引物1ul;10μm protease-r引物1ul;模板100k胶回收产物(50ng/ul)1ul模板e4 orf6/7表达框胶回收产物(50ng/ul)1ul模板e4 orf6/7表达框胶回收产物(50ng/ul)1ul;q5高保真酶25ul;补水至50ul。
[0274]
pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,50sec,35循环;延伸72℃,5min,1循环;保持4℃。扩增结果如图12所示,其中泳道1为片段100k、e4 orf6/7表达框、protease融合pcr产物,可见扩增结果正确。使用axygen胶回收试剂盒将片段进行纯化。
[0275]
7、载体连接
[0276]
使用neb的gibson使100k、e4 orf6/7表达框、protease融合pcr胶回收产物与步骤4中敲除e2a后的载体连接,连接体系如下所示:胶回收产物敲除e2a后的载体片段100ng,胶回收产物100k、e4 orf6/7表达框、protease融合pcr片段50ng,gibson预混液10ul,补水至20ul。于50℃,孵育40分钟。
[0277]
8、转化
[0278]
取出卡那抗性培养基平板,将制备好的neb 10β感受态细胞放在冰上融化后,加入10ul连接产物,用移液器轻轻吸打均匀,在冰上放置30分钟;将离心管放置42℃水浴,热击90秒,利用卡那青霉素抗性筛选转化子。
[0279]
9、菌落pcr进行转化子筛选
[0280]
使用pcr扩增方式对转化子进行菌落pcr验证。
[0281]
设计菌落pcr的下游引物
[0282]
dbp-upsteam-f:gttgggctcgcatgtgccg
[0283]
dbp-downsteam-r:actcccatggatcacaaccc
[0284]
反应体系为:10μm dbp-upsteam-f引物1ul,10μm dbp-downsteam-r引物1ul,q5高保真酶10ul,补水至20ul,挑取单克隆菌落于反应体系中。pcr程序为:起始变性98℃,10sec,1循环;变性98℃,5sec;退火60℃,30sec;延伸72℃,20sec,35循环;延伸72℃,5min,
1循环;保持4℃。进行琼脂糖凝胶电泳验证,如图13所示,在9、18、21、24出现阳性条带。
[0285]
10、质粒酶切验证
[0286]
挑取9、18、21、24这4个阳性克隆菌落,提取质粒,进行xhoi酶切验证,酶切结果如图14所示,其中泳道1为9号阳性克隆xhoi酶切,泳道2为18号阳性克隆xhoi酶切,泳道3为21号阳性克隆xhoi酶切,泳道4为24号阳性克隆xhoi酶切,泳道5为对照质粒pad5lcl3的xhoi酶切。从图14可以看出,质粒xhoi酶切结果均正确,同时测序结果正确,即获得了缺失e1、e3、e4和e2a基因,并将e4区的orf6/7表达框放在敲除了e2a区的序列位置的pad5lcl3质粒,其载体图谱如图49所示。
[0287]
实施例4非洲猪瘟腺病毒5型载体e1区域穿梭质粒ps5e1-l8lubiqutin-ires-i215l的构建
[0288]
1、人类腺病毒5型载体e1区域穿梭质粒的构建
[0289]
穿梭质粒ps5e1的骨架采用puc origin、amp等基本元素(2796bp)(ps5e1骨架由北京博迈德基因技术有限公司合成),ad5左臂itr部分序列(355bp),右臂pix、piva2部分序列(2100bp),以及cmv-mcs(seq id no.14)(944bp)sv40 early polya(seq id no.15)(160bp)。
[0290]
1)引物设计
[0291]
puc-ad5-right arm-f:taatgcagctggcttatcgaaacgtggaatgcgagaccgtct
[0292]
ad5-right arm-cmv-r:acacacaagcagggagcagatacaagggtgggaaagaatatataag
[0293]
cmv-f:gtatctgctccctgcttgtg
[0294]
cmv-sv40-r:taaacaagttggggtgggcgaagtgatcagcgggtttaaacggg
[0295]
sv40-f:cttcgcccaccccaacttgt
[0296]
sv40-r:agaggtcgacggtatacagac
[0297]
sv40-ad5-left arm-f:tgtctgtataccgtcgacctctccgaaaaacacctgggcgagtctcc
[0298]
ad5-left arm-puc-r:acactatagaatacacggaattcttaattaaatcatcaataatataccttattttg
[0299]
puc-f:gaattccgtgtattctatagtgt
[0300]
puc-r:tttcgataagccagctgcatta
[0301]
2)目的片段的扩增
[0302]
①
以pcdna3.1(+)为模板(该质粒购自赛默飞公司),以cmv-f和cmv-sv40-r为引物,扩增ps5e1穿梭质粒的cmv启动子mcs片段;扩增体系:pcdna3.1(+)质粒50ng,10um cmv-f引物1ul,10um cmv-sv40-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、1min,35个循环;72℃,5min。
[0303]
②
以pcdna3.1(+)为模板(该质粒购自赛默飞公司),以sv40-f和sv40-r为引物,扩增ps5e1穿梭质粒的sv40-earlypolya片段;扩增体系:pcdna3.1(+)质粒50ng,10um sv40-f引物1ul,10um sv40-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、10sec,35个循环;72℃,5min。
[0304]
扩增产物琼脂糖验证如图15所示,其中泳道1为cmv-mcs片段,泳道2为sv40 earlypolya片段,m为2000marker。由图15可见,扩增结果正确。
[0305]
③
使用axygen胶回收试剂盒进行纯化。
[0306]
④
以博迈德公司合成的ps5e1骨架质粒为模板,以puc-f和puc-r为引物,pcr扩增ps5e1穿梭质粒骨架,扩增体系:ps5e1骨架质粒50ng,10um puc-f引物1ul,10um puc-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、1min20sec,35个循环;72℃,5min。
[0307]
⑤
以pad5lcl3质粒为模板,以sv40-ad5-left arm-f和ad5-left arm-puc-r为引物,扩增ps5e1穿梭质粒的左臂,扩增体系:pad5lcl3质粒50ng,10um sv40-ad5-left arm-f引物1ul,10um ad5-left arm-puc-r引物1ul,q5高保真酶20ul,补水至40ul。pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、20s,35个循环;72℃,5min。
[0308]
⑥
以pad5lcl3质粒为模板,以puc-ad5-right arm-f和ad5-right arm-cmv-r为引物,扩增ps5e1穿梭质粒的右臂,扩增体系:pad5lcl3质粒50ng,10um puc-ad5-right arm-f引物1ul,10um ad5-right arm-cmv-r引物1ul,q5高保真酶20ul,补水至40ul。pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、15s,35个循环;72℃,5min。
[0309]
⑦
以胶回收产物cmv-mcs为模板,以cmv-f和sv40-r为引物,扩增ps5e1穿梭质粒的cmv-mcs-sv40 earlypolya片段,扩增体系:pad5lcl3质粒50ng,10um cmv-f引物1ul,10um sv40-r引物1ul,q5高保真酶20ul,补水至40ul。pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、40s,35个循环;72℃,5min。
[0310]
扩增产物琼脂糖验证如图16所示,其中泳道1为cmv-mcs-sv40 earlypolya融合片段,泳道2为puc,泳道3为ad5右臂,泳道4为ad5左臂。
[0311]
3)片段的连接转化
[0312]
使用axygen胶回收试剂盒将片段进行纯化,然后使用博迈德公司无缝克隆试剂盒将ps5e1骨架、ad5左臂、ad5右臂、cmv-mcs-sv40 earlypolya这四个片段连接,连接体系为2
×
smealess cloning mix 10ul、ps5e1骨架片段50ng、ad5左臂50ng、ad5右臂50ng、cmv-mcs-sv40 polya 50ng、补水至20ul,50℃保温40分钟,获得连接产物质粒ps5e1。将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0313]
4)质粒的验证
[0314]
①
菌落pcr验证
[0315]
挑选菌落进行琼脂糖凝胶验证,结果如图17所示,出现阳性条带。
[0316]
②
酶切验证
[0317]
挑取阳性克隆置于5ml含有氨苄抗性lb液体培养基中培养12-15小时,提取质粒进行酶切验证,电泳结果如图18所示,其中左1-6为质粒ps5e1 ncoi单酶切,右1-6为质粒ps5e1 paci单酶切,m为15000bp marker,酶切结果正确,成功构建人类腺病毒5型载体e1区域穿梭质粒ps5e1,其载体图谱如图50所示。
[0318]
2、非洲猪瘟腺病毒5型载体穿梭质粒ps5e1-l8lubiqutin-ires-i215l构建
[0319]
1)ps5e1与ires片段的连接
[0320]
①
引物合成
[0321]
ires-ecorv-f:ccg gatatc tgtcgtcatcatccttatagtcc
[0322]
ires-noti-r:aaatat gcggccgc ggttgtggccattatcatcgtg
[0323]
②
扩增ires片段
[0324]
扩增体系:q5酶25ul,10um引物ires-ecorv-f 1ul,10um引物ires-noti-r 1ul,模
板ires模板2ul,补水至50ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、20s,35个循环;72℃,5min。扩增结果电泳检测如图19所示,其中泳道1、2为ires片段pcr扩增产物,m为15000bp marker,可见扩增结果正确。
[0325]
③
使用axygen pcr纯化试剂盒纯化ires片段。
[0326]
④
目的片段ires与ps5e1载体酶切
[0327]
酶切反应体系:载体ps5e1、ires片段~2ug,ecorv和noti各1ul;10
×
cutsmart buffer 5ul;补水至50ul;反应条件:37℃,30min;65℃,20min灭活;胶回收纯化。酶切产物电泳检测如图20所示,其中泳道1为片段ires ecorv、noti酶切,泳道2为ps5e1 ecorv、noti酶切,m为15000bp marker。
[0328]
⑤
ps5e1载体与ires片段连接
[0329]
连接体系:ps5e1(100ng);ires片段(载体:片段=1:5,摩尔比);t4 dna连接酶1ul;10
×
ligase buffer 1ul;补水至10ul。反应条件:室温,30min。将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0330]
⑥
菌落pcr验证
[0331]
扩增体系:q5酶10ul,10um引物ires-ecorv-f 1ul,10um引物ires-noti-r 1ul,补水至20ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、20s,35个循环;72℃,5min。进行电泳验证,如图21所示,其中1-9号为菌落,m为marker,由图21可见,2和6号出现阳性条带。
[0332]
⑦
质粒noti、ecorv酶切验证,选取2、6进行质粒提取,酶切验证,结果如图22所示,其中2号质粒noti、ecorv酶切鉴定,6号质粒noti、ecorv酶切鉴定,可见酶切结果正确。
[0333]
2)ps5e1-ires与i215l片段的连接
[0334]
①
引物合成
[0335]
i215l-noti-f:aaggaaaaaagcggccgcgccaccatggtgagcaggtttctgatc
[0336]
i215l-xhoi-r:catgctcgag tcaggcgtaatcgggcacat
[0337]
②
pcr扩增i215l片段
[0338]
扩增体系:q5酶25ul,10um引物i215l-noti-f 1ul,10um引物i215l-xhoi-r 1ul,模板i215l 1ul,补水至50ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、40s,35个循环;72℃,5min。
[0339]
③
使用axygen pcr纯化试剂盒纯化i215l片段。
[0340]
④
目的片段i215l与ps5e1-ires载体酶切
[0341]
酶切反应体系:载体ps5e1-ires、i215l片段~2ug,noti和xhoi各1ul;10
×
cutsmart buffer 5ul;补水至50ul。反应条件:37℃,30min;65℃,20min灭活。胶回收纯化。酶切产物电泳检测如图23所示,其中泳道载体为ps5e1-ires noti和xhoi双酶切,泳道i215l为片段i215l noti和xhoi双酶切,m为15000bp、2000bp marker。
[0342]
⑤
目的片段i215l与ps5e1-ires连接
[0343]
连接体系:ps5e1-ires(100ng);i215l片段(载体:片段=1:3摩尔比);t4 dna连接酶1ul;10
×
ligase buffer 1ul;补水至10ul。反应条件:室温,30min。将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0344]
⑥
菌落pcr验证
[0345]
扩增体系:q5酶10ul,10um通用引物cmv-f 1ul,10um引物i215l-xhoi-r 1ul,补水
至20ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、30s,35个循环;72℃,5min。进行电泳验证,如图24所示,其中1-11号为菌落,m为2000bp marker。由图24可见,1、2、5、6、7、8、11为阳性菌落。
[0346]
⑦
质粒酶切验证(noti和xhoi),选取5、6、7、8菌落进行质粒提取,酶切验证。结果如图25所示,均为阳性质粒。
[0347]
3)ps5e1-ires-mgf5l6l与片段l8lubiqutin的连接
[0348]
①
引物合成
[0349]
l8l-bamhi-f:cgcgatccgccaccatgggcaacagactgatcaag
[0350]
l8l-ubiqutin-r:aagggttttcacgaaaatctgcatggcgtagtcgggcacgtcgt
[0351]
ubiqutin-f:atgcagattttcgtgaaaaccc
[0352]
ubiqutin-ecorv-r:ccggatatc ttacttgtcttctggtttgttga
[0353]
②
pcr扩增l8lubiqutin片段
[0354]
扩增l8l片段
[0355]
扩增体系:q5酶25ul,引物l8l-bamhi-f 1ul,引物l8l-ubiqutin-r 1ul,模板l8l 2ul,补水至50ul;反应条件:98℃30s;98℃10s,68℃30s,72℃15s,35个循环;72℃5min。
[0356]
扩增ubiqutin片段
[0357]
扩增体系:q5酶25ul,引物ubiqutin-f 1ul,引物ubiqutin-ecorv-r 1ul,模板ubiqutin 2ul,补水至50ul;反应条件:98℃30s;98℃10s,68℃30s,72℃15s,35个循环;72℃5min。
[0358]
使用axygen胶回收纯化试剂盒纯化l8l、ubiqutin片段;
[0359]
融合pcr扩增l8lubiqutin片段
[0360]
扩增体系:q5酶25ul,上游引物l8l-bamhi-f、下游引物ubiqutin-ecorv-r模板片段l8l、片段ubiqutin各50ng,补水至50ul;反应条件:98℃;98℃5s,68℃30s,72℃30s,35个循环;72℃7min。
[0361]
③
使用axygen pcr纯化试剂盒纯化l8lubiqutin片段,融合后的l8lubiqutin片段如图26所示。
[0362]
④
目的片段l8lubiqutin与ps5e1-ires-i215l载体酶切
[0363]
酶切反应体系:载体ps5e1-ires-i215l、l8lubiqutin片段~2ug,ecorv和bamhi各1ul;10
×
cutsmart buffer 5ul;补水至50ul。反应条件:37℃,30min;65℃,20min灭活。胶回收纯化。酶切产物电泳检测如图27所示,其中泳道1为ps5e1-ires-i215l质粒;泳道2为ps5e1-ires-i215l质粒ecorv和bamhi酶切;泳道3为l8lubiqutin片段ecorv和bamhi酶切,m为15000bp marker。
[0364]
⑤
ps5e1-ires-i215l载体与l8lubiqutin片段连接
[0365]
连接体系:ps5e1-ires-i215l 100ng;l8lubiqutin片段50ng;t4 dna连接酶1ul;10
×
ligase buffer 1ul;补水至10ul。反应条件:室温,30min。将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0366]
⑥
菌落pcr验证
[0367]
扩增体系:q5酶10ul,10um通用引物cmv-f 1ul,10um引物ubiqutin-ecorv-r 1ul,补水至20ul;pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、40s,35个循环;72℃,5min;进
行电泳验证,如图28所示,其中1-24号为菌落,m为2000bp marker。
[0368]
⑦
质粒bamhi、ecorv酶切验证,选取4、6、9、14、17、18菌落进行质粒提取,酶切验证,结果如图29所示,bamhi、ecorv酶切鉴定,m为15000bp marker。由图29可见,酶切结果正确,成功构建非洲猪瘟腺病毒5型载体e1区域穿梭质粒ps5e1-l8lubiqutin-ires-i215l质粒,其载体图谱如图51所示。
[0369]
实施例5非洲猪瘟腺病毒5型载体e4区域穿梭质粒ps5e4-i73rhbsag-2a-e146l的构建
[0370]
1、人类腺病毒5型载体e4区域穿梭质粒的构建
[0371]
穿梭质粒ps5e4的骨架采用puc origin、amp等基本元素,ad5e4区域左臂itr序列(370bp),右臂部分fiber基因序列(1746bp),以及ef1α-egfp-hbv polya基因。
[0372]
1)基因合成
[0373]
ef1α-egfp-hbv polya基因由博迈德公司合成。
[0374]
2)引物设计
[0375]
puc-ad5e4-left arm-f:
[0376]
aggtgacactatagaatacacgttaattaaatcatcaataatataccttattttg
[0377]
ad5e4-left arm-ef1α-r:caatccccccttttcttttaaaaaacaccactcgacacggcac
[0378]
ef1α-f:ttttaaaagaaaaggggggattg
[0379]
ef1α-r:tagagccccagctggttcttt
[0380]
ef1α-ad5e4-right arm-f:ggaaagaaccagctggggctctagcaattgaaaaataaacacgttga
[0381]
ad5e4-right arm-puc-r:taatacgactcactatagggagacccaaaatgtaaccactgtgag
[0382]
puc-f:tctccctatagtgagtcgtatt
[0383]
puc-r:cgtgtattctatagtgtcacct
[0384]
orf6/7-protease-f:cgttgaaacataacacaaacgatacggcgcagacggcaagggtggg
[0385]
3)目的片段的扩增
[0386]
①
以ef1α-egfp-hbv基因合成片段为模板,以ef1α-f和ef1α-r为引物,扩增ps5e4-egfp穿梭质粒的ef1α-egfp-hbv polya片段;扩增体系:ef1α-egfp-hbv基因合成片段50ng,10um ef1α-f引物1ul,10um ef1α-r引物1ul,q5高保真酶20ul;补水至40ul。pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、40sec,35个循环;72℃,5min。
[0387]
②
以pad5lcl3为模板,以puc-ad5e4-left arm-f和ad5e4-left arm-ef1α-r为引物,扩增ps5e1穿梭质粒的左臂片段。扩增体系:pad5lcl3质粒50ng,10um puc-ad5e4-left arm-f引物1ul,10um ad5e4-left arm-ef1α-r引物1ul,q5高保真酶20ul;补水至40ul。pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、10sec,35个循环;72℃,5min。
[0388]
③
以pad5lcl3为模板,以ef1α-ad5e4-right arm-f和ad5e4-right arm-puc-r为引物,扩增ps5e4-egfp穿梭质粒的右臂片段;扩增体系:pad5lcl3质粒50ng,10um ef1α-ad5e4-right arm-f引物1ul,10um ad5e4-right arm-puc-r引物1ul,q5高保真酶20ul;补水至40ul。
[0389]
pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、40sec,35个循环;72℃,5min。
[0390]
④
以ps5e1质粒为模板,以puc-f和puc-r为引物,pcr扩增ps5e4-egfp穿梭质粒骨
架;扩增体系:ps5e1骨架质粒50ng,10um puc-f引物1ul,10um puc-r引物1ul,q5高保真酶20ul;补水至40ul。pcr程序为:98℃,10s;98℃、5s,60℃、30s,72℃、1min20sec,35个循环;72℃,5min。扩增产物琼脂糖验证如图30所示,其中泳道1为ps5e4-egfp穿梭质粒左臂,泳道2为ps5e4-egfp穿梭质粒右臂,泳道3为ef1α-egfp-hbv,泳道4为ps5e4-egfp穿梭质粒骨架,m为2000marker。由图30可见,扩增结果正确。
[0391]
4)使用axygen胶回收试剂盒纯化目的片段。
[0392]
5)片段的连接转化
[0393]
使用博迈德公司无缝克隆试剂盒将ps5e4-egfp穿梭质粒左臂、ps5e4-egfp穿梭质粒右臂、ef1α-egfp-hbv、ps5e4-egfp穿梭质粒骨架这四个片段连接,连接体系为2
×
smealess cloning mix 10ul、ps5e4-egfp穿梭质粒左臂片段50ng、ps5e4-egfp穿梭质粒右臂片段50ng、ef1α-egfp-hbv片段50ng、ps5e4-egfp穿梭质粒骨架片段50ng、补水至20ul,50℃保温40分钟;将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0394]
6)质粒的验证
[0395]
①
菌落pcr验证
[0396]
用引物puc-ad5e4-left arm-f/ef1α-r为引物菌落pcr扩增目的片段,琼脂糖凝胶验证,结果如图31所示,出现阳性条带。
[0397]
②
酶切验证
[0398]
挑取3、4、5、6号阳性克隆置于5ml含有氨苄抗性lb液体培养基中培养12-15小时,提取质粒进行酶切验证,电泳结果如图32所示,其中1-4为3、4、5、6号阳性克隆paci单酶切,5-8为3、4、5、6号阳性克隆hindiii单酶切,m1、m3:15000bp marker;m2:2000bp marker;酶切结果正确,测序正确;成功构建人类腺病毒5型载体e4区域穿梭质粒ps5e4-egfp,其载体图谱如图52所示。
[0399]
2、非洲猪瘟腺病毒5型载体e4区域穿梭质粒ps5e4-i73rhbsag-2a-e146l构建
[0400]
1)引物设计
[0401]
ps5e4-i73r-bamhi-f:ccaagctgtgaccggcgcctacggatccgccaccatggagacacagaag
[0402]
i73r-hbsag-r:agccgctggtggtgttctccatggcgtagtcaggcacatcgta
[0403]
hbsag-f:atggagaacaccaccagcggc
[0404]
hbsag-2a-r:tgaagttagtagctccgcttccgatgtacacccagaggcagaa
[0405]
2a-f:ggaagcggagctactaacttc
[0406]
2a-e146l-r:acaaagtctgttgttccgcccataggtccagggttctcctcca
[0407]
e146l-f:atgggcggaacaacagacttt
[0408]
e146l-ps5e4-xhoi-r:cgggtttaaacgggccctctagactcgagttagatgattctctgc
[0409]
2)目的片段i73r、hbsag、2a、e146l的扩增
[0410]
①
以i73r基因合成片段为模板,以ps5e4-i73r-bamhi-f和i73-hbsag-r为引物,扩增i73r片段;扩增体系:i73基因合成片段50ng,10um ps5e4-i73r-bamhi-f引物1ul,10um i73-hbsag-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、20sec,35个循环;72℃,5min。
[0411]
②
以hbsag基因合成片段为模板,以hbsag-f和hbsag-2a-r为引物,扩增hbsag片
段;扩增体系:hbsag基因合成片段50ng,10um hbsag-f引物1ul,10um hbsag-2a-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、20sec,35个循环;72℃,5min。
[0412]
③
以2a基因合成片段为模板,以2a-f和2a-e146l-r为引物,扩增2a片段;扩增体系:2a基因合成片段50ng,10um 2a-f引物1ul,10um 2a-e146l-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、20sec,35个循环;72℃,5min。
[0413]
④
以e146l基因合成片段为模板,以e146l-f和e146l-ps5e4-xhoi-r为引物,扩增e146l片段;扩增体系:e146l基因合成片段50ng,10um e146l-f引物1ul,10um e146l-ps5e4-xhoi-r引物1ul,q5高保真酶20ul;补水至40ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、30sec,35个循环;72℃,5min。
[0414]
使用axygen胶回收试剂盒纯化目的片段。
[0415]
4)融合pcr扩增i73rhbsag片段
[0416]
扩增体系:i73r胶回收片段50ng、hbsag胶回收片段50ng,10um ps5e4-i73r-hamhi-f引物1ul,10um hbsag-2a-r引物1ul,q5高保真酶25ul;补水至50ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、20sec,35个循环;72℃,5min。
[0417]
5)融合pcr扩增2a-e146l片段
[0418]
扩增体系:2a胶回收片段50ng、e146l胶回收片段50ng,10um 2a-f引物1ul,10um e146l-ps5e4-xhoi-r引物1ul,q5高保真酶25ul;补水至50ul;pcr程序为:98℃,10sec;98℃、5sec,60℃、30sec,72℃、30sec,35个循环;72℃,5min。融合结果如图33所示,其中泳道1为i73rhbsag片段,泳道1为2a-e146l片段,m为2000bp marker。
[0419]
6)ps5e4-egfp载体酶切
[0420]
酶切反应体系:载体ps5e4-egfp 2ug,bamhi和xhoi各1ul;10
×
cutsmart buffer 5ul;补水至50ul。反应条件:37℃,30min;65℃,20min灭活。axygen试剂盒胶回收纯化。
[0421]
7)使用axygen胶回收试剂盒纯化载体片段;
[0422]
胶回收结果如图34所示,其中泳道1为片段ps5e4-egfpbamhi、xhoi双酶切胶回收,m为15000bp marker。
[0423]
8)ps5e4-egfp胶回收载体与i73rhbsag片段、2a-e146l无缝克隆连接与转化
[0424]
连接体系:ps5e4-egfp胶回收产物(100ng),i73rhbsag片段(50ng),2a-e146l片段(50ng),2
×
smealess cloning mix 5ul,补水至10ul。反应条件:50℃,40min。将连接产物转化至dh5α感受态细胞,涂布于含有氨苄抗性的平板上,37℃培养12-16小时。
[0425]
9)质粒的验证
[0426]
①
菌落pcr验证
[0427]
用引物以ef1α2(jd)-f、hbv(jd)-r为引物,菌落pcr扩增目的片段,琼脂糖凝胶验证,结果如图35所示,其中1-12号为菌落,m为15000bp marker,均为阳性条带。
[0428]
②
酶切验证
[0429]
挑取1、2、3号阳性克隆置于5ml含有氨苄抗性lb液体培养基中培养12-15小时,提取质粒进行bmhi、xhoi双酶切验证;酶切结果如图36所示,其中泳道1、2、3为阳性克隆bamhi、xhoi双酶切验证,m为15000bp marker。酶切结果正确,测序正确,成功构建非洲猪瘟
腺病毒5型载体e4区域穿梭质粒ps5e4-i73rhbsag-2a-e146l,其载体图谱如图53所示。
[0430]
实施例6穿梭质粒ps5e1-l8lubiqutin-ires-i215l、ps5e4-i73rhbsag-2a-e146l与pad5lcl3重组构建pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l质粒
[0431]
1、穿梭质粒ps5e1-l8lubiqutin-ires-i215l与腺病毒载体质粒pad5lcl3的同源重组
[0432]
1)paci和swai对穿梭质粒ps5e1-l8lubiqutin-ires-i215l和腺病毒载体质粒pad5lcl3进行酶切,酶切反应体系如下:
[0433]
a、穿梭质粒ps5e1-l8lubiqutin-ires-i215l 3μg;paci 2ul;buffer cutsmart 4ul;补水至40ul。
[0434]
b、腺病毒载体质粒pad5lcl3 3ug;swai 2ul;buffer 3.1 4ul;补水至40ul。
[0435]
反应条件37℃,1h;65℃,20min灭活。
[0436]
取2ul琼脂糖凝胶验证,验证结果如图37所示,其中,泳道1为pad5lcl3,泳道2为ps5e1-l8lubiqutin-ires-i215l。
[0437]
2)酶切产物去磷酸化
[0438]
反应体系:酶切反应液37.5ul;去磷酸化酶1ul;去磷酸化buffer 5ul;补水至50ul。反应条件37℃,1h;65℃,5min灭活。
[0439]
3)使用omega ultra-sep gel extraction kit进行胶回收载体和片段。
[0440]
4)取100ng纯化后的穿梭质粒和100ng纯化后的腺病毒载体共转化bj5183感受态细胞,转化产物涂布含有kan的lb平板,37℃培养12~16h。
[0441]
5)挑取菌落于5ml含有kan的lb液体培养基中,37℃振荡培养12~16h,并提取质粒进行xhoi酶切验证;结果如图38所示,其中泳道1-7为pad5lcl3-l8lubiqutin-ires-i215l克隆,m:15000bp marker,从图38可以看出,6号和7号克隆酶切正确。
[0442]
6)将6号阳性质粒转化至dh5a感受态,挑取一个菌落于5ml含有kan的lb液体培养基中,37℃振荡培养12~16h,并提取质粒再次进行xhoi酶切验证,酶切结果如图39所示,其中1号泳道为pad5lcl3-l8lubiqutin-ires-i215l质粒xhoi酶切,m为15000bp marker,由图39可知,酶切结果正确,成功构建腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l。
[0443]
2、穿梭质粒ps5e4-i73rhbsag-2a-e146l与腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l同源重组获得pad5lcl3-l8lubiqutin-i215l-i73hbsag-e146l
[0444]
1)paci和i-scei对穿梭质粒ps5e4-i73rhbsag-2a-e146l和腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l进行酶切,酶切反应体系如下:
[0445]
a、穿梭质粒ps5e4-i73rhbsag-2a-e146l 3μg;paci 2ul;10
×
cutsmart buffer 4ul;补水至40ul。
[0446]
b、腺病毒载体质粒pad5lcl3-l8lubiqutin-ires-i215l 3ug;i-scei 2ul;buffer cutsmart 4ul;补水至40ul。
[0447]
反应条件37℃,1h;65℃,20min灭活。
[0448]
取2ul琼脂糖凝胶验证,验证结果如图40所示,其中泳道1为ps5e4-i73rhbsag-2a-e146l,泳道2为pad5lcl3-l8lubiqutin-ires-i215l。
[0449]
2)酶切产物去磷酸化
[0450]
反应体系:酶切反应液37.5ul;去磷酸化酶1ul;去磷酸化buffer 5ul;补水至
50ul。反应条件37℃,1h;65℃,5min灭活。
[0451]
3)使用omegaultra-sep gel extraction kit进行胶回收载体和片段。
[0452]
4)取100ng纯化后的穿梭质粒和100ng纯化后的腺病毒载体共转化bj5183感受态细胞,转化产物涂布含有kan的lb平板,37℃培养12~16h。
[0453]
5)挑取6个菌落于5ml含有kan的lb液体培养基中,37℃振荡培养12~16h,并提取质粒进行xhoi酶切验证,结果如图41所示,其中泳道1-8为质粒,m为15000bp marker,可以看出,1-8质粒均正确。
[0454]
6)将2号阳性质粒转化至dh5a感受态;挑取一个菌落于5ml含有kan的lb液体培养基中,37℃振荡培养12~16h,并提取质粒再次进行xhoi酶切验证;酶切结果如图42所示,2号泳道为pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l质粒xhoi酶切,m为15000marker,由图42可见,pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l构建成功,酶切结果正确,其载体图谱如图54所示。
[0455]
实施例7重组腺病毒的包装
[0456]
使用293td37细胞包装pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l质粒,操作步骤如下所示:
[0457]
准备293td37细胞:转染前一天准备细胞,将待转染的293td37细胞接种到6孔板中,0.5
×
106/孔,于37℃,5%co2静置培养24小时,转染当天细胞有40-50%汇合率。
[0458]
质粒pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l线性化:将待转染的质粒用paci酶切,于37℃孵育40min后,65℃灭活20min。
[0459]
转染:用100ul无血清培养基将线性化的2μg质粒和pei分别稀释;向pei稀释液中加入质粒稀释液,反复吸取5次或涡旋10秒钟混匀,室温下孵育10分钟后形成转染复合物。孵育过程中,从培养板上轻柔地吸出细胞培养液,加入新鲜的生长培养基2ml,10分钟后将转染复合物加到换了新鲜培养基的细胞中。
[0460]
细胞培养:将转染后的293td37细胞于37℃,5%co2培养箱中静置培养72-96小时;病毒质粒转染72-96小时后收集6孔板细胞悬液于1.5ml离心管中即tp0。
[0461]
持续接毒:将收集的细胞悬液在-80℃反复冻融3次,4℃、2000g离心10分钟,取上清500ul感染293td37细胞(293td37细胞需要提前一天准备),37℃、5%co2孵育60分钟,补充2ml的fbs的培养基,37℃、5%co2培养培养72小时,收集细胞悬液即tp1;重复之前的步骤,收集细胞悬液即tp2。持续接毒直至细胞出现病变。
[0462]
细胞病变:当293td37细胞培养从tp0至tp4后,细胞逐渐病变,直至tp4时293td37细胞完全病变。tp0至tp4引起的细胞病变情况分别如图43-47所示。
[0463]
实施例8非洲猪瘟多抗原重组腺病毒疫苗滴度的检测
[0464]
准备293td37细胞,取t75培养瓶中生长良好的细胞,弃上清,pbs洗细胞,用0.25%胰蛋白酶消化,再加入含有10%胎牛血清的dmem新鲜培养基10ml终止消化,然后吹打混匀,接种6孔板中(5
×
105活细胞/ml,每孔2ml),于37℃,5%co2二氧化碳培养箱中静置培养。24小时后,待细胞贴壁生长成单层细胞,弃去培养基,用无血清dmem维持液对重组的腺病毒作10-3
~10-6
倍连续稀释,每个稀释度接种2孔,每孔250ul,感染1小时后,弃上清,补充完全培养基,然后于37℃,5%二氧化碳培养箱中静置培养。24h后,弃上清,用pbs洗细胞,每孔1ml,弃pbs后,每孔加1ml冷甲醛固定,室温10min,弃甲醛,再用pbs冲洗细胞,每孔1ml,加腺病毒
抗体-fitc,每孔1ml,室温1h后,再次用pbs冲洗细胞,每孔1ml,两遍后每孔加1ml pbs,荧光显微镜下计数(200倍,10个连续视野)。计算:病毒滴度(ffu/ml)=平均数
×
1013
×4×
10
(-n)
。pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒的ffu为2.2
×
108ffu/ml,滴度较高。
[0465]
实施例9非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l稳定性的检测
[0466]
准备293td37细胞,取t75培养瓶中生长良好的细胞,弃上清,pbs洗细胞,用0.25%胰蛋白酶消化,再加入含有10%胎牛血清的dmem新鲜培养基10ml终止消化,然后吹打混匀,将293td37细胞种入6孔板中(5
×
105cells/ml,2ml/孔),室温孵育1小时使其贴壁,孵育后镜检其贴壁程度。用pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒颗粒进行感染,感染的滴度为5moi/孔。293td37细胞48小时后发生病变后,收集细胞,反复冻融3次后2000g离心,收集上清,将收集的上清检测ffu,后重新感染新的293td37细胞,直至30代。将收集的第5、10、15、20、25、30代次的病毒液进行检测,发现病毒的基因组仍然完整,说明复制缺陷型pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒能够在293td37细胞中稳定包装。
[0467]
实施例10非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l恢复突变(rca)的检测
[0468]
pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒rca检测,检测方法如下:
[0469]
1、准备pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒液,并测其病毒滴度,测定病毒颗粒浓度,病毒液加1%universal nuclease(universal nuclease 7.5~15units/ml病毒液)消化宿主细胞的dna,37℃水浴40min。用300kd的超滤离心管,经1000g,30min离心,1
×
pbs洗脱收集病毒颗粒,测a260,颗粒浓度=a260*1.1*10^12vp/ml。
[0470]
2、病毒感染,准备a549细胞的6孔板,每孔细胞为2.5
×
105/孔,弃培养基,pbs清洗一次,将腺病毒按照1
×
109vp/孔接种病毒,感染a549细胞,野生型腺病毒5型为对照,37℃,5%co2,1h后,弃去病毒液,补足5%完全培养基,37℃,5%co2培养48h。
[0471]
3、免疫染色,弃细胞上清,pbs表面冲洗细胞,用冰甲醛固定,放置-20℃,20min,1
×
pbs清洗三遍,每遍5min,每孔加入2ml 1%bsa-pbs溶液,放置摇床,孵育1h。弃去上清,加入腺病毒5型荧光抗体(1:500稀释),孵育1h,1
×
pbs清洗三遍,每遍5min。
[0472]
用10倍荧光显微镜观察,使用公式计算rca
[0473]
rca=(average positive cell field)
×
(374field/well)
×
(dilution factor))/total vps in 0.5ml viral sample
[0474]
判断标准为rca的水平<1rca/3
×
10
10
vp。经过统计pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l的rca的水平小于1rca/3
×
10
10
vp,说明本发明所制备的复制缺陷型pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒在293td37细胞中能够稳定包装,不会转化为野生型或转化为野生型的几率较低。
[0475]
实施例11非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l蛋白表达检测
[0476]
提前一天准备293td37细胞,置于12孔细胞培养板中,使用非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l病毒感染293td37细胞,48小时后细胞发生病变,收集全部的1ml细胞,使用pbs洗涤,制样,用于western blot检测;使用ha
的抗体检测目的蛋白,ha的抗体采购于abcam。其中l8lubiquitin融合蛋白,i215l蛋白具有ha标签,蛋白大小为32kda、26kda。实验结果如图48所示,泳道1为293空白细胞,泳道2、3为293td37细胞感染pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l的样品;可以清晰可见l8lubiquitin融合蛋白与i215l蛋白有正常表达,由此可见pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l疫苗能在293细胞中正常表达目的蛋白。
[0477]
实施例12非洲猪瘟多抗原重组腺病毒疫苗pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l小鼠模型上的免疫学评价
[0478]
疫苗细胞免疫反应检测
[0479]
10只spf级小鼠(6-8周龄),随机分成2组,每组5只。根据表1所示分组情况对小鼠进行pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l免疫。注射方式为:后大腿内侧肌肉注射;注射剂量:100ul。
[0480]
表1:疫苗免疫检测小鼠分组情况
[0481][0482]
免疫后14天处死小鼠,分离脾淋巴细胞,使用穿梭质粒ps5e1-l8lubiqutin-i215l和ps5e4-i73rhbsag-e146l转染的pk15细胞刺激培养6小时,同时加入蛋白分泌阻断剂阻断细胞因子分泌。6小时后,阻断fc受体,对死细胞和细胞表面分子标志物进行染色,细胞经固定和穿孔之后,对细胞内细胞因子进行染色。细胞表面标志物包括cd4、cd8,细胞内细胞因子包括ifnγ、il2。使用流式细胞仪(cyexpert)分析cd4+t细胞和cd8+t细胞经目的蛋白刺激后表达ifnγ、il2的水平。
[0483]
pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l诱导的cd8+t细胞和cd4+t细胞免疫反应如图55和图56所示,代表性结果如图57至图58所示,其中图57为肌肉注射pad5lcl3-l8lubiqutin-i215l-i73rhbsag-e146l后细胞免疫反应代表图,图58为空白对照免疫反应代表图。结果表示:小鼠免疫后14天,脾细胞经目的蛋白刺激后,cd8+t细胞,其表达的ifnγ、tnfα和il2水平均显著高于ad5载体对照组(control)(p《0.05)。cd4+t细胞经过刺激后,其表达的ifnγ、tnfα和il2水平均显著高于ad5载体对照组(control)(p《0.05)。细胞免疫反应检测结果说明肌肉注射免疫1*10^7ffu的腺病毒载体疫苗疫苗,可诱导其免疫的小鼠产生特异性细胞免疫反应。
[0484]
虽然本发明披露如上,但本发明并非限定于此。任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种更动与修改,因此本发明的保护范围应当以权利要求所限定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1