一种利用赤藓糖醇菌渣制备替代酵母类氮源的方法与流程
1.本发明属于发酵化工技术领域,具体为一种利用赤藓糖醇菌渣制备替代酵母类氮源的方法。
背景技术:
2.赤藓糖醇发酵结束后,发酵液高温灭菌后经陶瓷膜过滤后,将菌渣与发酵液分离,菌渣液一般直接当废水排掉或委托有资质的肥料公司处理做堆肥用;直接作为废水排掉使污水处理站处理难度加大,严重影响污水处理指标,为减少环境污染,专利cn104826366a公开了一种赤藓糖醇菌渣的处理方法,通过加入多种化合物按一定顺序对赤藓糖醇菌渣进行处理,达到高效固液分离效果,从而使污染物排放量减少。但目前公开的专利申请,只是通过低能耗、投资小的方法把赤藓糖醇菌渣拿出来,并未提及其循环再利用。
3.中国专利申请cn202111110553.9公开一种赤藓糖醇结晶废母液再利用方法,在赤藓糖醇结晶废母液中加入耶氏解脂酵母进行生物净化得到净化液,所述净化液通过过滤、树脂离子交换、浓缩结晶后提取出赤藓糖醇粗晶体和结晶废液1,所述结晶废液1通过脱色、纳滤、浓缩结晶后得到混合糖醇粗晶体和结晶废液2,所述结晶废液2回收至废母液中循环利用,特别的,将所述耶氏解脂酵母菌种进行固定化细胞处理。实质上,该份专利申请只是对赤藓糖醇结晶废母液进行整体循环利用,根本上没有对赤藓糖醇结晶废母液有效的利用,没有从根本上解决废弃资源的排放及污染环境问题。
技术实现要素:
4.针对上述技术缺陷,本发明提供一种利用赤藓糖醇菌渣制备替代酵母类氮源的方法。
5.为解决上述技术问题,本发明的技术方案是一种利用赤藓糖醇菌渣制备替代酵母类氮源的方法,包括赤藓糖醇菌渣预处理过程,所述的赤藓糖醇菌渣预处理步骤为:
6.a、将赤藓糖醇菌渣液经滤膜过滤,得到菌渣滤液;
7.b、将步骤a的菌渣滤液经离心机分离后,去除上清液,下层菌体用纯净水洗,菌体与水投料质量比1:5,得到菌体水洗液;
8.c、在菌体水洗液中加入0.1-1.0%(菌体折干重量)的溶解酶,然后在35-60℃下搅拌12-60h至菌体完全溶解得菌体溶解液;
9.d、将步骤c所得的菌体溶解液进行真空浓缩,浓缩至干物质含量25%~35%,得酵母类氮源;
10.进一步:在上述利用赤藓糖醇菌渣制备替代酵母类氮源的方法中,其所述步骤a的滤膜为陶瓷膜、氧化铝膜或pvc膜中的一种。
11.所述步骤a的滤膜的过滤精度为孔径0.05-1.4um。优选的过滤精度为孔径0.2um。
12.所述步骤b的菌体与水投料质量比为1:1-3。
13.所述步骤c的溶解酶是酵母抽提酶、葡聚糖酶中的一种或者两种。
14.所述的步骤c搅拌温度为40-50℃,搅拌时间为40-48h。
15.优选的,所述的步骤c中溶解酶是酵母抽提酶,所述酵母抽提酶的重量百分含量是0.2-0.5%(菌体折干重量)。
16.再进一步:在上述利用赤藓糖醇菌渣制备替代酵母类氮源的方法中,它还包括替代酵母类氮源的过程,所述替代酵母类氮源是指干物质等量替代发酵类产品发酵培养基中的酵母类氮源,所述的替代比例20%-50%。优选的所述的替代比例40-50%。
17.赤藓糖醇菌渣是酵母发酵产物,含有丰富的菌体蛋白、多种代谢产物及未被充分利用的营养物质,除作为肥料外,还可以挖掘更高的利用价值。一般的赤藓糖醇菌渣成分:水分75-95%,ph4-6,总氮2-7%,谷氨酸0.1%左右等,其成分跟市场上纯品型酵母抽提物成分相似(质量指标见gb/t 23530-2009)。
18.与现有技术相比,本发明提供了一种利用赤藓糖醇菌渣制备替代酵母类氮源的方法,包括赤藓糖醇菌渣预处理过程,所述的赤藓糖醇菌渣预处理步骤为:
19.a、将赤藓糖醇菌渣液经滤膜过滤,得到菌渣滤液;
20.b、将步骤a的菌渣滤液经离心机分离后,去除上清液,下层菌体用纯净水洗,菌体与水投料质量比1:5,得到菌体水洗液;
21.c、在菌体水洗液中加入0.1-1.0%(菌体折干重量)的溶解酶,然后在35-60℃下搅拌12-60h至菌体完全溶解得菌体溶解液;
22.d、将步骤c所得的菌体溶解液进行真空浓缩,浓缩至干物质含量25%~35%,得酵母类氮源。即赤藓糖醇菌渣经简单处理后制备菌体可用于发酵类产品发酵培养基中酵母类氮源的替代用,从而降低赤藓糖醇及相关产品的生产成本,同时减少了环境污染,实现清洁生产。
具体实施方式
23.下面结合具体实施例对本发明做进一步说明。以下操作中,未做详细说明的,均可按照分子生物学实验手册进行。
24.实例1:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经0.2um陶瓷膜过滤、离心机分离收集菌体3kg。取菌体500g(水分90%)加入1000ml纯净水、酵母抽提酶0.25g(菌体折干重量0.5%)、50℃自溶40小时,在真空度-0.085mpa下,浓缩至干物质33%、制备菌体60g。其他指标:ph值5.44,总氮6.07%,氨基氮2.40%,氨基氮转化率39.54%。
25.将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
26.1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
27.2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
28.种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
29.随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
30.3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
31.发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉2.5,赤藓糖醇菌体7.58,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
32.发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
33.批号周期h产率%转化率%备注b220610544.1921.85对照批b220611544.524.16试验批,50%代替
34.实例2:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经0.2um陶瓷膜过滤、离心机分离收集菌体2.9kg。取菌体500g(水分88%)加入1500ml水、酵母抽提酶0.18g(菌体折干重量0.3%)、45℃自溶46小时,在真空度-0.085mpa下,浓缩至干物质30%、制备菌体55g。其他指标:ph值5.32,总氮6.0%,氨基氮2.50%,氨基氮转化率38.05%。
35.将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
36.1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
37.2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
38.种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
39.随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
40.3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
41.发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉2.5,赤藓糖醇菌体8.33,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
42.发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
43.批号周期h产率%转化率%备注b220610544.1921.85对照批b220612524.7521.13试验批,50%代替
44.实例3:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经0.2um陶瓷膜过滤、离心机分离收集菌体3.1kg。取菌体500g(水分92%)加入500ml纯净水、酵母抽提酶0.08g(菌体折干重量0.2%)、40℃自溶48小时,在真空度-0.085mpa下,浓缩至干物质31%、制备菌体58g待用。其他指标:ph值5.45,总氮6.0%,氨基氮2.52%,氨基氮转化率38.10%。
45.将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
46.1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
47.2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
48.种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
49.随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
50.3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
51.发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉2.5,赤藓糖醇菌体8.06,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
52.发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
53.批号周期h产率%转化率%备注b220610544.1921.85对照批b220613544.2021.13试验批,50%代替
54.实例4:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经0.6um陶瓷膜过滤、离心机分离收集菌体2.9kg。取菌体500g(水分88%)加入1500ml纯净水、酵母抽提酶0.18g(菌体折干重量0.3%)、47℃自溶43小时,在真空度-0.085mpa下,浓缩至干物质30%、制备菌体57g待用。其他指标:ph值5.45,总氮6.12%,氨基氮2.52%,氨基氮转化率38.05%。
55.将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
56.1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
57.2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
58.种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
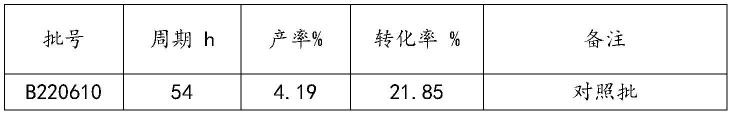
59.随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
60.3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
61.发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉2.5,赤藓糖醇菌体8.33,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
62.发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
[0063][0064][0065]
实例5:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经0.8um陶瓷膜过滤、离心机分离收集菌体3.1kg。取菌体500g(水分92%)加入500ml水、酵母抽提酶0.08g(菌体折干重量0.2%)、50℃自溶44小时,在真空度-0.085mpa下,浓缩至干物质32%、制备菌体60g待用。其他指标:ph值5.50,总氮6.10%,氨基氮2.50%,氨基氮转化率38.22%。
[0066]
将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
[0067]
1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
[0068]
2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
[0069]
种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
[0070]
随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
[0071]
3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
[0072]
发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉3,赤藓糖醇菌体6.25,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
[0073]
发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
[0074]
批号周期h产率%转化率%备注b220610544.1921.85对照批b220615524.1021.86试验批,40%代替
[0075]
实例6:50l规模赤藓糖醇发酵结束,发酵液加热至60℃保温15分钟进行灭菌处理后,经1.4um陶瓷膜过滤、离心机分离收集菌体3.3kg。取菌体500g(水分90%)加入800ml水、酵母抽提酶0.25g(菌体折干重量0.5%)、50℃自溶42小时,在真空度-0.085mpa下,浓缩至干物质32%、制备菌体58g。其他指标:ph值5.40,总氮6.0%,氨基氮2.50%,氨基氮转化率39.00%。
[0076]
将上述制备的赤藓糖醇菌体,用于腺苷产品发酵培养基中酵母类氮源酵母粉的替代用,具体如下:
[0077]
1)将活化的腺苷菌种接入到摇瓶发酵培养基中,作为一级种子液。
[0078]
2)二级种子培养:二级种子罐、培养基灭菌处理后,将一级种子液接入到50l二级种子罐中,初始定容30l。控制条件为:培养温度32℃,ph 7.0,罐压0.05mpa;通风量0.3vvm,搅拌转速150rpm;溶氧维持15%以上
[0079]
种子培养基g/l:葡萄糖粉20,酵母膏10,大豆蛋白胨2,磷酸二氢钾0.5,硫酸锰适量,硫酸亚铁适量;
[0080]
随着种子的培养,跟踪检测ph、光密度od增长情况,当od达到5.0移种至发酵罐。
[0081]
3)发酵培养:将菌种子液以10%接种量接入50l发酵罐中,初始定容31l。控制条件为:培养温度32℃、ph7.0,罐压0.05mpa;通风量0.5-1.2vvm,搅拌转速150-700pm,溶氧维持10%以上;当还原糖降至15g/l,通过流加50%浓度补糖维持罐内糖浓度,直至发酵结束。发酵过程监测ph、od、还原糖、产物含量等指标。
[0082]
发酵培养基g/l:葡萄糖粉80,酵母膏10,酵母粉2.75,赤藓糖醇菌体7.03,磷酸二氢钾1.5,硫酸铵1,硫酸锰、硫酸亚铁适量;
[0083]
发酵结束后,取发酵液离心,纸层析法测定上清液含量。试验结果具体如下:
[0084]
批号周期h产率%转化率%备注b220610544.1921.85对照批b220616544.0922.10试验批,45%代替
[0085]
从上述实施例1-6看出,赤藓糖醇菌渣通过本发明预处理过程,得到发酵培养基中酵母类氮源酵母粉的替代品,且这种替代比例在40-50%,最后使得腺苷产品的产率和转化率相当于原来(对照批)的技术水平,甚至优于原来(对照批)的技术水平,从而降低赤藓糖醇及相关产品的生产成本,同时减少了环境污染,实现清洁生产。
[0086]
显然,本发明实施例仅是为清楚地说明本发明所作的举例,而并非是对本发明实施方式的限定。在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1