立方纳米CeO2及其在邻氨基苯酚降解中的应用的制作方法与工艺
本发明属于水处理技术领域,具体涉及一种立方纳米二氧化铈(CeO2)及其作为模拟氧化酶在邻氨基苯酚降解中的应用。
背景技术:
酶是高效的生物催化剂,几乎参与生物体内所有的反应。酶具有高效性、专一性、多样性和温和性的特点。天然酶在医药、化工、食品加工、环境保护和农业中都有重大的实际应用。但天然酶具有易变性失活、价格昂贵、提纯困难、储存和使用成本高等缺点,这都限制了它们的广泛应用。因此,模拟天然酶对底物的分子识别和高效催化的模拟酶的研究成为当务之急。自2007年阎锡蕴研究小组首次发现四氧化三铁纳米颗粒具有过氧化物酶的催化活性以来,纳米材料模拟酶催化活性的探索立刻引起了高度关注。后来,人们陆续发现多种纳米材料如金纳米粒子、Co3O4、碳量子点、FeS、V2O5等也被发现具有类似过氧化物酶的活性,但这些模拟酶几乎都要以过氧化氢为氧化剂才能发生催化反应,这大大限制了这些材料潜在的应用前景。2009年,Perez团队发现CeO2纳米颗粒不需要过氧化氢的存在,就可以氧化底物,具有模拟氧化酶的活性,但是关于CeO2的应用尚缺少进一步研究。含酚废水是一种对人体危害相当严重并且又普遍存在的工业废水,对含酚废水的治理常见的处理方法有物理法、化学法和生物法等,但是都很难满足彻底降解去除的要求。2-氨基酚,俗称邻氨基苯酚,是一种应用比较广泛的精细化工中间体,在医药生产、染料制备、橡胶合成、饲料、石油等领域中具有较为广泛的用途;因而含有邻氨基苯酚的污染废水是一种较为典型的含酚废水。由于含有邻氨基苯酚的生产废水浓度高、色度深、难降解、可生化性差,具有很大的毒性,处理起来比较麻烦,一般的处理分类废水的方法都很难有效处理氨基酚废水。而新型的纳米模拟氧化酶的出现为含酚废水的处理提供了一种新的解决方案,但目前尚未见到较好地将两者结合的报道。
技术实现要素:
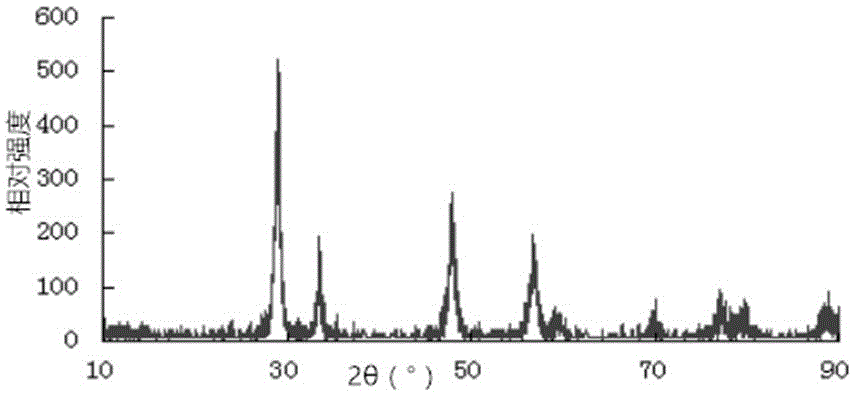
本发明提供了一种特定的立方纳米二氧化铈材料及其制备方法,并以此为基础提供了一种立方纳米二氧化铈作为模拟氧化酶在邻氨基苯酚降解中的应用的新的水处理方法。本发明所采取的技术方案详细介绍如下。一种立方纳米CeO2,采用以下步骤制备而成:(1)以Ce(NO3)3·6H2O作为铈源,以尿素作为沉淀剂,以CTAB(十六烷基三甲基溴化铵)作为表面活性剂;将Ce(NO3)3·6H2O、CTAB、尿素溶于去离子水中,超声波溶解,直到溶液变成无色透明状;各物料以摩尔比计,Ce(NO3)3·6H2O︰CTAB︰尿素=2.28~2.32:0.24~0.30:9.03~9.37;优选配比为,2.3:0.27:9.2;(2)将步骤(1)中溶液转移到内衬为聚四氟乙烯的不锈钢高压反应釜中,160℃~200℃反应18~36h,优选180℃反应24h,自然冷却到室温;(3)将步骤(2)中冷却后的反应液用离心,优选10000r/min离心5分钟,取出沉淀物,沉淀物用无水乙醇和去离子水交替洗涤3次,烘箱干燥,60℃~80℃干燥3~6h,优选70℃的干燥5h,得到氧化铈前驱体;(4)将步骤(3)中氧化铈前驱体在马弗炉里焙烧,400℃~600℃焙烧10~15h,优选500℃下焙烧12h,得到浅黄色粉末状立方纳米二氧化铈。所述立方纳米CeO2的制备方法,具体包括以下步骤:(1)以Ce(NO3)3·6H2O作为铈源,以尿素作为沉淀剂,以CTAB(十六烷基三甲基溴化铵)作为表面活性剂;将Ce(NO3)3·6H2O、CTAB、尿素溶于去离子水中,超声波溶解,直到溶液变成无色透明状;各物料以摩尔比计,Ce(NO3)3·6H2O︰CTAB︰尿素=2.28~2.32:0.24~0.30:9.03~9.37;优选配比为,2.3:0.27:9.2;(2)将步骤(1)中溶液转移到内衬为聚四氟乙烯的不锈钢高压反应釜中,160℃~200℃反应18~36h,自然冷却到室温;(3)将步骤(2)中冷却后的反应液用离心机离心,取出沉淀物,沉淀物用无水乙醇和去离子水交替洗涤并离心3次,在烘箱中60℃~80℃干燥3~6h得到氧化铈前驱体;(4)将步骤(3)中氧化铈前驱体在马弗炉里400℃~600℃焙烧10~15h,得到浅黄色粉末状立方纳米二氧化铈。所述立方纳米CeO2在邻氨基苯酚降解中的应用,立方纳米CeO2作为模拟酶发挥作用,应用时,具体配比为:当邻氨基苯酚浓度为10~70mg/L、20mL时,CeO2加入量为10~70mg,pH=2~10,0~300r/min、恒温振荡1~6h;优化配比为:当邻氨基苯酚浓度为40mg/L、20mL时,CeO2加入量不小于30mg,pH=3,25℃、225r/min恒温振荡3h。本发明提供了一种特定的立方纳米二氧化铈,此二氧化铈可以作为模拟酶从而催化降解并吸附邻氨基苯酚。本发明所提供的二氧化铈相比于天然氧化酶,其稳定性高、不易发生变性、适用范围广、易于存储和运输,且重复利用度高,而且同样具有高效的氧化酶催化活性,因而可以较好地替代现有的天热氧化酶的应用。本发明所提供的二氧化铈相比于其他过氧化物模拟酶,不需要过氧化氢作为氧化剂,因而使用方便,在邻氨基苯酚降解中,最高降解率可达70%以上。总体而言,本发明中的立方纳米二氧化铈,其制备工艺简单,可操作性强,且在邻氨基苯酚处理中具有较好地应用前景,因而具有较好的推广应用价值。附图说明图1为实施例1所制备立方形纳米CeO2的SEM图;图2为实施例1所制备立方形纳米CeO2的XRD光谱图;图3为实施例1所制备立方形纳米CeO2的FT-IR图;图4为实施例1所制备立方形纳米CeO2的TMB实验图,其中a为不加CeO2(无色),b为加CeO2(变蓝),c为加酸中止(变黄);图5为邻氨基苯酚浓度-吸光度标准曲线;图6为不同pH条件下邻氨基苯酚的吸收光谱图;图7为光照对于邻氨基苯酚降解率影响;图8为加入H2O2对降解率的影响;图9为振荡速率对降解率的影响;图10为pH对降解率的影响;图11为CeO2的添加量对降解率的影响;图12为震荡时间对降解率的影响;图13为邻氨基苯酚初始浓度对降解率的影响。具体实施方式下面结合实施例对本发明的技术方案进一步介绍如下。介绍具体实施例前,对本发明中所用部分物料及实验装置的情况简要介绍如下。本发明中所用物料均为实验室中常用实验药品,纯度为分析纯;所涉及到主要实验仪器有:扫描电子显微镜(SEM),Q250F,美国FEI公司;X射线衍射仪(XRD),XD-3,北京普析通用仪器有限责任公司;傅立叶变换红外光谱仪,NicoletiS10,美国ThermoFisherScientific公司;多参数分析仪,DZS-708,上海精密科学仪器有限公司;紫外可见分光光度计,T6新世纪,北京普析通用仪器有限责任公司。实施例1在介绍具体实施例前,首先对本发明中制备CeO2的技术原理简要介绍如下。本发明以Ce(NO3)3·6H2O作为铈源,以尿素作为沉淀剂,以CTAB作为表面活性剂,首先通过水热法制备CeO2的前驱体,然后再将此前驱体煅烧制备活得CeO2。具体反应机理如下:首先,在反应混合溶液中,尿素分解产生铵根离子与氰酸根离子:H2N-CO-NH2→NH4++OCN-;当在酸性条件下,氰酸根离子迅速发生如下反应:OCN-+2H++H2O→CO2+NH4+;当在中性或碱性条件下,将会发生如下反应:OCN-+OH-+H2O→NH3+CO32-;由于Ce3+具有弱碱性和高电荷性,将发生强烈的水合作用,具体地:Ce3+水解并与水分子或OH-络合:Ce3++yH2O→[Ce(OH)(H2O)n−1]2++H3O+;随着反应温度的升高与反应时间的加长,尿素的水解速度加快,CO32-与H3O+开始大量生成,最终获得CeO2前驱体:[Ce(OH)(H2O)n−1]2++CO32-=CeOHCO3(CeCO3OH)+(n-1)H2O;而前驱体CeOHCO3在500℃高温下会热分解生成CeO2:4CeCO3OH+O2→4CeO2+2H2O+4CO2。下面结合实施例对本发明所制备的立方纳米二氧化铈具体介绍如下。本实施例所提供的立方纳米二氧化铈,采用以下步骤制备而成:(1)将Ce(NO3)3·6H2O、CTAB(十六烷基三甲基溴化铵)、尿素溶于10mL的去离子水中,超声波溶解,直到溶液变成无色透明状;各物料具体用量为:Ce(NO3)3·6H2O︰CTAB︰尿素=2.3mmol:0.27mmol:9.2mmol;(2)将步骤(1)中溶液转移到20mL内衬聚四氟乙烯的不锈钢高压反应釜中,密封后,置于烘箱中,180℃反应24h,自然冷却到室温;(3)将步骤(2)中冷却后的反应液用10000r/min的离心机离心5分钟,取出沉淀物,沉淀物用无水乙醇和去离子水交替洗涤3次,在70℃的烘箱中干燥5h得到氧化铈前驱体;(4)将步骤(3)中氧化铈前驱体在500℃下的马弗炉里焙烧12h,得到浅黄色粉末状立方纳米二氧化铈。对于所制备的CeO2,发明人进一步进行了SEM形貌分析、XRD扫描、傅立叶变换红外分析等形态特征分析,相关过程简要介绍如下。SEM形貌分析SEM扫描时,具体设置为:高真空模式时,30kv时1.0nm、1kv时3.0nm;低真空模式时,30kv时1.4nm、3kv时3.0nm;环境真空模式时,30kv时2.5nm。放大倍数在高空模式下为14x-1000000x,放大倍数误差小于3%。结果如图1所示。CeO2的晶体形貌变化机理是:随着反应温度的升高,一方面反应体系中晶体过饱和度减小;另一方面,晶面更加趋于平滑,因为纳米颗粒的生长趋势一般是从一维趋向于三维发展,也就是说产物的粒径慢慢变小,当反应时间达到一定时,样品粒径的大小随着反应温度的升高而减少。从图1中可以看出,本实施例所制备的CeO2的粒径在200~300nm之间,属于纳米级材料。XRD分析X-射线衍射分析是确定物质的晶体结构、物相的分析,通过对样品的衍射峰位置和强度进行归一化后与标准粉末衍射PDF卡片比较可获得样品的晶相,从而实现样品的定性相分析。本实施例所制备CeO2样品的具体测试条件为:室温下采用弯品石墨单色仪和Cu的Kα射线(λ=0.154056nm),Ni滤光片,工作电压为36kV,工作电流为20mA,扫描速度2°/min,步长为0.02,扫描衍射角度2θ为10-90°。结果如图2所示。在图2中,峰的高低和宽窄代表着晶粒的大小和结晶度的高低,峰越窄越高,代表晶粒越大,结晶越完美;反之峰越宽越矮,可能是晶粒比较小,结晶较差导致的。从图2中可以看出,30度、35度、45度、58度处的峰都比较高,只有个别比较低矮,说明制备出的结晶度较高。FT-IR(傅立叶变换红外分光)分析采用溴化钾压片法对样品进行红外光谱采集。测试条件为:波数范围为4000-400cm-1,扫描次数为32次,分辨率为4。样品制备方法为:首先将二氧化铈粉末与溴化钾按一定比例进行研磨,然后进行压片,即可进行测试。结果如图3所示。在图3中,3300-3500cm-1的强吸收峰是由于样品表面物理吸附的水及结晶水中的O-H的伸缩振动引起的;1600cm-1附近的吸收峰可以归属于结晶水的-H弯曲振动;1300cm-1、1093cm-1及400cm-1附近的三个吸收峰对应于CeO2。CeO2模拟酶活性鉴定(TMB显色验证)采用TMB验证CeO2是否具有模拟酶活性。具体过程为:首先配制底物显色A液:醋酸钠13.6g、柠檬酸1.6g,蒸馏水加至500mL;配制显色底物B液:乙二胺四乙酸二钠0.2g、柠檬酸0.95g、甘油50mL,再取0.15gTMB溶于3mL无水乙醇溶液中,蒸馏水加至500mL;A液、B液注意避光保存;验证时,取A液、B液各0.5mL,加入5mgCeO2,混合均匀后,10min后观察显色情况。结果如图4所示。从图4中可以看出,CeO2能够与TMB作用,有蓝色反应,说明CeO2具有模拟氧化酶的活性。实施例2由于本发明中对于溶液中邻氨基苯酚浓度测定主要依据浓度与吸光度关系测定,因而本发明首先需要绘制邻氨基苯酚浓度与吸光度对应的标准曲线,具体过程如下:分别制备0mg/L、10mg/L、20mg/L、30mg/L、40mg/L、50mg/L、60mg/L、70mg/L的邻氨基苯酚溶液,以蒸馏水作为空白对照,调节检测波长为280nm,用紫外-可见分光光度计分别测定吸光度,并绘制标准曲线。结果如图5所示。在图5中,纵坐标Y表示吸光度(Abs),横坐标X代表溶液中邻氨基苯酚的质量浓度c(mg/L),另外由图可知,邻氨基苯酚的线性回归方程为Y=0.0346X-0.0144,线性相关系数R2=0.9991。由于不同pH条件下,邻氨基苯酚的吸收波长不同,因而为准确测定溶液中邻氨基苯酚的吸光度,发明人做了不同pH条件下邻氨基苯酚吸收波长测定工作,具体为:使用40mg/L的邻氨基苯酚溶液,用1cm的石英比色皿,以蒸馏水做空白参比,在紫外分光光度计上从波长190nm到330nm,每隔10nm测定一次吸光度,以波长为横坐标,吸光度为纵坐标,绘制邻氨基苯酚吸收光谱曲线,找出吸收峰所对应的吸收波长,如果有多个吸收波长,然后再比较哪个受pH影响比较小,从而选择最优吸收波长。结果如图6所示。从图6中可以看出,PH=2、PH=3、PH=4.5三个的吸收光谱图变化趋势相似。最大吸收峰所对应的波长分别为:230nm和275nm,波长为230nm时的吸收峰是由邻氨基苯酚上的氨基造成的,波长为275nm时受pH影响不大,因此可以作为最大吸收波长。邻氨基苯酚的去除率()按如下公式计算:;式中A0为初始吸光度,A为降解后吸光度。采用CeO2催化降解邻氨基苯酚时,由于可能受到溶液pH、CeO2用量、光照、邻氨基苯酚浓度等多个因素影响,因而需要探讨最佳反应配备,相关试验过程简要介绍如下。光对降解邻氨基苯酚的影响具体过程为:在四个50mL的锥形瓶中分别加入20mL浓度为40mg/L的模拟邻氨基苯酚废水,其中1号锥形瓶不加CeO2;2号锥形瓶加30mgCeO2;3号锥形瓶用锡箔纸包住,不加CeO2;4号锥形瓶用锡箔纸包住,加30mgCeO2,pH=2,然后放到恒温震荡器中25℃、300r/min振荡3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图7所示。从图7可以看出,有光和无光对降解率的影响不大,说明CeO2降解邻氨基苯酚不是光催化作用。H2O2对邻氨基苯酚降解的影响具体过程为:在五个锥形瓶中分别加入0、1、2、3、4、10mL质量分数15%的H2O2,然后每个锥形瓶中加入20mL浓度为40mg/L的邻氨基苯酚模拟废水和30mg的CeO2,pH=2,放入恒温震荡器中25℃、300r/min振荡反应3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图8所示。从图8可以看出,随着加入H2O2量的增加,降解率急速下降,说明CeO2中没有过氧根,降解作用不是过氧催化。震荡速率对降解邻氨基苯酚的影响具体过程为:在五个锥形瓶中分别加入20mL浓度为40mg/L的邻氨基苯酚模拟废水和30mgCeO2,pH=2,分别放在速率为0、75、150、225、300r/min的恒温振荡器中,25℃振荡反应3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图9所示。从图9中可以看出,随着速率的增大,降解率逐渐增高,最终趋于平衡。其原因在于,当转速增大时,溶解氧增多,由于纳米CeO2有着独特的储氧功能,当转速增大,纳米CeO2储氧越来越多,Ce3+变成Ce4+,使降解率增大。当速率为225r/min时降解率已达到最佳,此时降解率为58%。pH对降解邻氨基苯酚的影响具体过程为:在9个锥形瓶中分别加入20mL浓度为40mg/L的邻氨基苯酚模拟废水,分别调节pH为2、2.5、3、3.5、4、5、6、8、10,然后加入30mgCeO2,放到恒温震荡器中25℃、225r/min振荡3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图10所示。从图10中可以看出,pH在2—3时,随着PH的增大降解率升高,当pH大于3时,随着pH的增大,降解率越来越低。因此,当pH=3时,降解效果最好,此时降解率为64.9%。CeO2的投加量对降解邻氨基苯酚的影响具体过程为:在7个锥形瓶中分别加入20mL浓度为40mg/L的邻氨基苯酚模拟废水,然后分别加入10mg、20mg、30mg、40mg、50mg、60mg、70mg的CeO2,调节pH=3,25℃、225r/min恒温振荡3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图11所示。从图11中可以看出,随着投加量不断增加时,降解率先增加然后慢慢趋于平缓,当投加量大于30mg时,降解率几乎不变,保持为58%。因此,最佳投加量为30mg。震荡时间对降解邻氨基苯酚的影响具体过程为:在6个锥形瓶中加入20mL浓度为40mg/L的邻氨基苯酚模拟废水,然后加入30mg的CeO2,调节pH=3,25℃、225r/min恒温振荡,振荡时间分别设置为1h、2h、3h、4h、5h、6h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图12所示。从图12中可以看出,当震荡时间大于4h后,随着震荡时间的增加,降解率反而慢慢降低,可以说明CeO2不仅有氧化催化降解邻氨基苯酚,也存在吸附作用,当震荡时间过长时,吸附速率小于脱附速率,使降解率降低。因此,最佳震荡时间为3h,此时降解率为62.7%。初始浓度对降解邻氨基苯酚的影响具体过程为:在7个锥形瓶中分别加入20mL浓度为10、20、30、40、50、60、70mg/L的邻氨基苯酚模拟废水和30mgCeO2,调节pH=3,25℃、225r/min恒温振荡3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果如图13所示。从图13中可以看出,当浓度为40mg/L时,降解率是最好的,此时为68.4%。最优配比条件下邻氨基苯酚降解率在上述优化条件基础上,发明人进一步进行了实验验证,具体设置如下:在锥形瓶中加入20mL浓度为40mg/L的邻氨基苯酚模拟废水和30mgCeO2,调节pH=3,25℃、225r/min恒温振荡3h。反应结束后,砂芯漏斗过滤,测定吸光度计算降解率。结果表明,此时降解率可达71%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1