抗CXCR1组合物和方法与流程
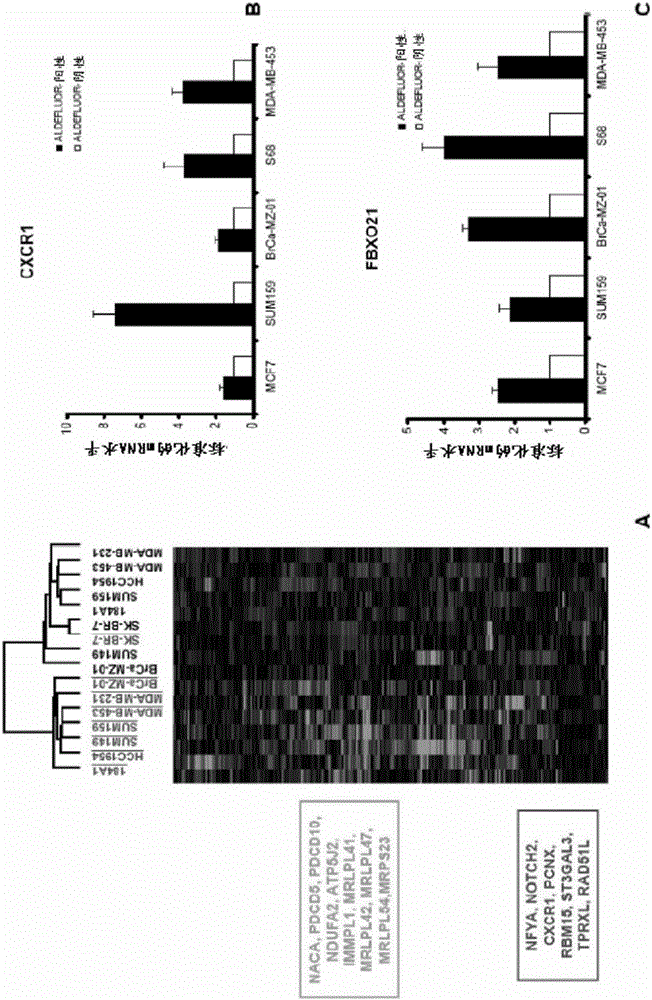
抗CXCR1组合物和方法本申请是国际申请日为2009年11月11日、国际申请号为PCT/US2009/064041、进入国家阶段的申请号为200980153571.6、发明名称为“抗CXCR1组合物和方法”的PCT申请的分案申请。相关申请的交叉引用本申请要求2008年11月11日提交的美国临时专利申请No.61/113,458的优先权,其内容全文在此以引用的方式并入。关于联邦资助的研究或开发的声明本发明的进行根据NIH所授予的拨款号CA66233、CA101860和5P30CA46592得到政府的支持。政府具有本发明中的某些权利。技术领域本发明提供了治疗癌症的方法,其通过单独施用或与其它化疗剂联合施用IL8-CXCR1途径抑制剂(例如,抗CXCR1抗体或Repertaxin),从而杀死受试者的非致肿瘤性和致肿瘤性癌细胞来进行。本发明还提供了用于检测患者的实体瘤干细胞的存在和分离患者的实体瘤干细胞的组合物和方法(例如,基于CXCR1或FBXO21的存在)。
背景技术:
癌症仍然是本国死亡率的第二原因,导致每年超过500,000例死亡。尽管在癌症检测和治疗上有进展,但癌症死亡率仍然较高。尽管在了解癌症的分子基础上有显著的进步,但此知识尚未转化为有效的治疗策略。特别地,乳腺癌是美国女性中最常见的癌症,九名女性中约有1名在其一生中患有乳腺癌。不幸的是,转移性乳腺癌仍然是不治之症。大多数患有转移性乳腺癌的女性死于该疾病。传统的治疗方法(放射疗法、化学疗法和激素疗法)虽然有用,但是已经受到抗治疗性癌细胞出现的限制。显然,通常需要新的方法来鉴别用于治疗转移性乳腺癌和癌症的靶物。
技术实现要素:
本发明提供了治疗癌症的方法,其通过单独施用或与其它化疗剂联合施用IL8-CXCR1途径抑制剂(例如抗CXCR1抗体或Repertaxin),从而杀死受试者的非致肿瘤性和致肿瘤性癌细胞来进行。本发明还提供了用于治疗患者的实体瘤干细胞和诊断患者的实体瘤干细胞的存在的组合物和方法(例如,基于CXCR1或FBXO21的存在)。在一些实施方案中,本发明提供了治疗癌症的方法,其包括:对受试者施用IL8-CXCR1途径拮抗剂和其它化疗剂。在某些实施方案中,本发明提供了减少或消除受试者的癌症干细胞和非致肿瘤性癌细胞的方法,包括:在某些条件下对受试者施用Repertaxin或其衍生物,从而杀死至少部分癌症干细胞和至少部分非致肿瘤性癌细胞。在其它实施方案中,本发明提供了减少或消除受试者的癌症干细胞和非致肿瘤性癌细胞的方法,其包括:在某些条件下对受试者施用IL8-CXCR1途径拮抗剂和其它化疗剂,从而杀死至少一部分癌症干细胞和至少一部分非致肿瘤性癌细胞。在具体的实施方案中,本发明提供了包含IL8-CXCR1途径拮抗剂和其它化疗剂的组合物或试剂盒。在某些实施方案中,IL8-CXCR1途径拮抗剂包含特异地阻断IL8与CXCR1结合的药剂。在一些实施方案中,所述药剂结合CXCR1(对CXCR1特异的),但是不结合CXCR2。在其它实施方案中,所述药剂结合CXCR1。在具体的实施方案中,所述药剂包含抗CXCR1抗体或抗体片段。在其它实施方案中,所述药剂包含Repertaxin或其衍生物。在其它实施方案中,其它化疗剂包含抗有丝分裂化合物。在某些实施方案中,抗有丝分裂化合物选自多西他赛(docetaxel)、多柔比星(doxorubicin)、紫杉醇(paclitaxel)、氟尿嘧啶、长春新碱、长春碱、诺考达唑、秋水仙碱、鬼臼毒素(podophyllotoxin)、斯的甘辛(steganacin)和考布他汀(combretastatin)。在其它实施方案中,抗有丝分裂化合物是长春花属生物碱(例如,长春新碱和长春碱);或苯并咪唑氨基甲酸酯类,诸如诺考达唑;或秋水仙碱或相关化合物,诸如鬼臼毒素、斯的甘辛或考布他汀;或紫杉烷(taxane),诸如紫杉醇和多西他赛。在某些实施方案中,其它化疗剂包含多西他赛。在具体的实施方案中,受试者患有一类癌症,在用化疗剂治疗时,患者的IL-8生成水平升高(例如,这引起运动性的癌症干细胞数目增加)。在一些实施方案中,受试者患有选自以下疾病的一类癌症:前列腺癌、卵巢癌、乳腺癌、黑素瘤、非小细胞肺癌、小细胞肺癌和食管腺癌。在其它实施方案中,本发明提供了检测实体瘤干细胞的方法,其包括:a)提供:i)自受试者的肿瘤采集的样本,和ii)对CXCR1蛋白或FBXO21蛋白(或表1的其它蛋白质)特异的抗体或抗体片段(或其它结合分子);以及b)在某些条件下使组织样本与抗体或抗体片段接触,从而检测CXCR1+或FBXO21+实体瘤干细胞的存在与否。在具体的实施方案中,抗体或抗体片段与信号分子缀合。在其它实施方案中,信号分子包含荧光分子。在其它实施方案中,信号分子包含在存在比色底物的情况下能够催化生色反应的酶。在某些实施方案中,所述方法进一步包括使样本与对抗体或抗体片段特异的二抗或二抗片段接触。在其它实施方案中,二抗或二抗片段包含信号分子。在具体的实施方案中,没有测定其它蛋白质或核酸以确定所述CXCR1或FBXO21+实体瘤干细胞的存在与否。在其它实施方案中,肿瘤选自前列腺癌肿瘤、卵巢癌肿瘤、乳腺癌肿瘤、黑素瘤、非小细胞肺癌肿瘤、小细胞肺癌肿瘤和食管腺癌肿瘤。在一些实施方案中,本发明提供了富集实体瘤干细胞群的方法,其包括:a)解离实体瘤以产生解离的细胞;b)使解离的细胞与结合CXCR1或FBXO21(或表1的其它蛋白质)的药剂接触;以及c)在某些条件下选择结合药剂的细胞,从而产生实体瘤干细胞的富集群。在某些实施方案中,没有采用其它药剂来产生实体瘤干细胞富集群。在一些实施方案中,肿瘤选自前列腺癌肿瘤、卵巢癌肿瘤、乳腺癌肿瘤、黑素瘤、非小细胞肺癌肿瘤、小细胞肺癌肿瘤和食管腺癌肿瘤。在其它实施方案中,药剂是抗体或抗体片段(例如,Fab片段)。在其它实施方案中,药剂与荧光染料或磁性颗粒缀合。在其它实施方案中,选择细胞通过流式细胞术、荧光激活细胞分选、淘洗、亲和柱分离或磁性选择来进行。在具体的实施方案中,本发明提供了通过本文中所描述的方法分离的实体瘤干细胞的富集群。在一些实施方案中,本发明提供了癌症干细胞的分离群,所述癌症干细胞是:a)致肿瘤性的;且b)CXCR1+或FBXO21+。在某些实施方案中,癌症干细胞是选自以下细胞的癌症干细胞:前列腺癌干细胞、卵巢癌干细胞、乳腺癌干细胞、皮肤癌干细胞、非小细胞肺癌干细胞、小细胞肺癌干细胞和食管腺癌干细胞。在其它实施方案中,所述细胞群包含至少60%癌症干细胞和小于40%非致肿瘤性肿瘤细胞。在其它实施方案中,与未分级的非致肿瘤性肿瘤细胞相比,所述癌症干细胞富集至少两倍(例如,2倍、3倍、4倍、5倍,...10倍,...100倍,...1000倍)。在一些实施方案中,本发明提供了用于自肿瘤获得包含癌症干细胞和非致肿瘤性肿瘤细胞的细胞组合物的方法,其中至少60%是致肿瘤性干细胞,且40%或更少是非致肿瘤性肿瘤细胞,该方法包括:a)自肿瘤获得肿瘤细胞的解离混合物;b)将肿瘤细胞的混合物分离成包含至少60%的癌症干细胞和40%或更少的非致肿瘤性肿瘤细胞的第一组分和缺乏癌症干细胞的肿瘤细胞第二组分,其中通过使混合物与针对CXCR1或FBXO21的药剂接触进行所述分离;以及c)通过i)连续注射到第一宿主动物来证明第一组分是致肿瘤性的,并通过连续注射到第二宿主动物来证明第二组分是非致肿瘤性的。在某些实施方案中,通过流式细胞术、荧光激活细胞分选(FACS)、淘洗、亲和层析或磁性选择来进行分离。在一些实施方案中,通过荧光激活细胞分选仪(FACS)分析来进行分离。在具体的实施方案中,本发明提供了用于为实体瘤患者选择治疗的方法,包括:(a)自患者获得样本;(b)确定样本中CXCR1+或FBXO21+实体瘤干细胞的存在;以及(c)为患者选择靶向CXCR1+或FBXO21+实体瘤干细胞的治疗(例如,选择使用抗CXCR1抗体或抗体片段)。在某些实施方案中,CXCR1+或FBXO21+实体瘤干细胞是选自以下细胞的癌症干细胞:前列腺癌干细胞、卵巢癌干细胞、乳腺癌干细胞、皮肤癌干细胞、非小细胞肺癌干细胞、小细胞肺癌干细胞和食管腺癌干细胞。在一些实施方案中,本发明提供了用于筛选化合物的方法,其包括:a)将包含CXCR1+或FBXO21+癌症干细胞的样本暴露于候选抗肿瘤化合物,其中所述候选抗肿瘤化合物包含CXCR1或FBXO21拮抗剂或IL8-CXCR1信号转导途径拮抗剂;以及b)检测响应化合物的细胞中的变化。在某些实施方案中,样本包含非黏附乳腺球(mammosphere)。在其它实施方案中,CXCR1或FBXO21拮抗剂或IL8-CXCR1信号转导途径拮抗剂包含抗体或抗体片段。在一些实施方案中,CXCR1拮抗剂是Repartaxin的衍生物。在其它实施方案中,所述检测包括检测致肿瘤性乳腺细胞的细胞死亡。在其它实施方案中,所述方法进一步包括将候选抗肿瘤剂鉴别为能够杀死致肿瘤性细胞及非致肿瘤性癌细胞。在一些实施方案中,本发明提供了用于测定测试化合物抑制实体瘤干细胞的肿瘤发生的能力的方法,其包括:a)获得富集的实体瘤干细胞,其中所述实体瘤干细胞:i)与未分级的肿瘤细胞相比富集至少两倍;以及ii)表达CXCR1或FBXO21;b)将第一组,而非第二组实体瘤干细胞暴露于测试化合物;c)将第一组实体瘤干细胞注射到第一宿主动物中,并将第二组实体瘤干细胞注射到第二宿主动物中;以及d)比较第一动物中的肿瘤(若存在的话)与第二动物中形成的肿瘤,以确定测试化合物是否抑制肿瘤形成。在具体的实施方案中,测试化合物是CXCR1或FBXO21抑制剂,或IL8-CXCR1抑制剂途径抑制剂。在其它实施方案中,本发明提供了用于测定测试化合物抑制实体瘤干细胞的肿瘤发生的能力的方法,其包括:a)获得包含至少60%实体瘤干细胞的样本,其中所述实体瘤干细胞表达CXCR1或FBXO21;b)将实体瘤干细胞注射到第一和第二宿主动物中;c)用测试化合物治疗第一宿主动物,而不用测试化合物治疗第二宿主动物;以及d)比较第一动物中的肿瘤(若存在的话)与第二动物中形成的肿瘤,以确定测试化合物是否抑制肿瘤形成。在其它实施方案中,测试化合物是CXCR1或FBXO21抑制剂或IL8-CXCR1途径抑制剂。附图说明图1示出来自乳腺癌细胞系(MDA-MB-453、SUM159)的ALDEFLUOR阳性细胞群具有癌症干细胞特性。A-B,G-H.对MDA-MB-453(A-B)和SUM159细胞(G-H)中的ALDH酶活性的代表性流式细胞术分析。如下述实施例1所描述,进行ALDEFLUOR测定。(C,I)ALDEFLUOR阳性群能够在NOD/SCID小鼠中生成肿瘤,这重现初始肿瘤的表型异质性。(F,L)对所注射的不同数目的细胞(对于MDA-MB-453:50,000个细胞、5,000个细胞和500个细胞,而对于SUM159:100,000个细胞、10,000个细胞、和1,000个细胞)及对每个群(ALDEFLUOR阳性、ALDEFLUOR阴性、未分离的)绘制肿瘤生长曲线。肿瘤生长动力学与肿瘤形成的潜伏期和大小和ALDEFLUOR阳性细胞的数目有关(F,L)。(D,J)ALDEFLUOR阳性细胞的注射部位的H&E染色,揭示肿瘤细胞的存在(D:MDA-MB-453ALDEFLUOR阳性细胞注射部位,和J:SUM59ALDEFLUOR阳性细胞注射部位)。(E,K)ALDEFLUOR阴性细胞注射部位仅含有残留的基质胶、凋亡细胞和小鼠组织(E:MDA-MB-453ALDEFLUOR阴性细胞注射部位,和K:SUM59ALDEFLUOR阴性细胞注射部位)。数据表示均值±SD。图2示出基于“癌症干细胞标签(signature)”对自乳腺细胞系分离的ALDEFLUOR阳性和ALDEFLUOR阴性群进行分类。图2A。基于413种基因表达标签的16种样本的分级聚类。每行数据矩阵表示基因,而每列表示样本。注意到对于16种样本中的15种,用413种基因分开ALDEFLUOR阳性(加下划线的名称)和阴性样本(不加下划线的名称)。标签中包含的一些基因通过其HUGO缩写来提及,如在“EntrezGene”中使用的(ALDEFLUOR阳性群中下调的基因以绿色标记,而ALDEFLUOR阳性群中上调的基因以红色标记)。图2B-C.为了确认基因表达结果,在ALDEFLUOR表型方面分选的一组5种乳腺癌细胞系中,通过定量RT-PCR来测量ALDEFLUOR阳性群中过表达的5种辨别者基因(CXCR1/IL8RA、FBXO21、NFYA、NOTCH2和RAD51L1)的表达。此图中呈现了CXCR1和FBXO21的定量RT-PCR表达水平。通过定量RT-PCR测量的基因表达水平确认使用DNA微阵列获得的结果,其中与ALDEFLUOR阴性群相比,ALDEFLUOR阳性群中的CXCR1和FBXO21mRNA水平升高(p<0.05)。图3示出IL8/CXCR1轴在调节乳腺癌干细胞中的作用。A.表达CXCR1的细胞包含在ALDEFLUOR阳性群中。通过FACS分离来自四种不同乳腺细胞系(HCC1954、SUM159、MDA-MB-453、BrCa-MZ-01)的ALDEFLUOR阳性和阴性群,固定,并通过免疫染色和FACS分析来分析CXCR1蛋白的表达。与ALDEFLUOR阴性群相比,ALDEFLUOR阳性细胞高度富集CXCR1阳性细胞。B.IL8处理对三种不同细胞系(HCC1954、SUM159、MDA-MB-453)的肿瘤球形成的影响。IL8处理以剂量依赖性方式提高原代和继代肿瘤球的形成。C.IL8处理对黏附条件中培养的四种不同细胞系的ALDEFLUOR阳性群的影响。在所分析的四种细胞系之每种中,IL8以剂量依赖性方式增加ALDEFLUOR阳性群(*p<0.05/**p<0.01,与对照组在统计学上显著性差异)。图4示出LDEFLUOR阳性细胞展现出升高的转移潜力。A.IL8/CXCR1轴参与癌症干细胞侵袭。对三种不同细胞系(HCC1954、MDA-MB-453、SUM159),使用血清或IL8作为引诱剂通过基质胶侵袭实验来评估IL8/CXCR1轴在侵袭中的作用。ALDEFLUOR阳性细胞比ALDEFLUOR阴性细胞具有大6至20倍的侵袭性(p<0.01)。在使用IL8(100ng/ml)作为引诱物时,观察到与血清作为引诱物相比,通过基质胶,显著增加的ALDEFLUOR阳性细胞侵袭(p<0.05)。比较而言,IL8对ALDEFLUOR阴性群的侵袭能力没有影响。B-M。ALDEFLUOR阳性群表现出升高的转移潜力。B-D.接种100,000个经萤光素酶感染的来自每组(ALDEFLUOR阳性、ALDEFLUOR阴性、未分离的)的细胞后以每周的时间间隔测量的标准化光子通量的量化。E-J。利用生物发光成像软件来检测转移(E、G、I:面朝下的小鼠;F、H、J:面朝上的小鼠)。接种有ALDEFLUOR阳性细胞的小鼠形成位于不同部位(骨、肌肉、肺、软组织)的数个转移,而且比接种有未分离的细胞的小鼠(每只小鼠形成不超过1个转移)表现出更高的光子通量发射。比较而言,接种有ALDEFLUOR阴性细胞的小鼠仅形成偶发性小转移,其局限于淋巴结。K-M.通过H&E染色,对由ALDEFLUOR阳性细胞注射导致的骨骼(K)、软组织(L)和肌肉(M)中的转移进行的组织学确认。图5示出CXCR1抑制对肿瘤细胞存活力(图5A)及对癌症干细胞存活力的影响(图5B)。图6示出Repertaxin处理诱导由FAS/FAS配体信号转导介导的旁观者效应,而且明确显示了通过添加FAS拮抗剂挽救由Repertaxin处理诱导的细胞生长抑制,而且用FAS激动剂处理的细胞与用Repertaxin处理的细胞表现出相似的细胞生长抑制。图7示出在没有Repertaxin处理(7A)和存在Repertaxin(7B)的情况中的FAK、AKT和FOXOA3活化。图8示出Repertaxin、多西他赛或其组合对一种乳腺癌细胞系(8A,SUM159)和自三名患者生成的三种人乳腺癌异种移植物(8B,MC1;8C,UM2;和8D,UM3)的影响。图9示出Repertaxin、多西他赛或组合处理对癌症干细胞群的影响,如通过对多种细胞系进行的ALDEFLUOR测定所评估,所述多种细胞系包括SUM159(9A)、MC1(9B)、UM2(9C)、UM3(9D)。图10示出Repertaxin、多西他赛或组合对植入继代NOD-SCID小鼠的乳腺脂肪垫中的连续稀释的原发性肿瘤(10A.SUM159、10B.MC1、10C.UM2、10D.UM3)的影响。图11示出Repertaxin治疗降低SUM159细胞系的转移潜力。图11A示出用心脏内施用的SUM159细胞接种后以每周的时间间隔测量的标准化光子通量的量化。使用生物发光成像来监测转移形成(11B:用盐水溶液治疗的小鼠;11C:用Repertaxin治疗的小鼠)。图12示出SUM159细胞的ALDEFLUOR阳性亚群与CXCR1阳性亚群(上部)或CXCR2阳性亚群(下部)之间的重叠的表示。B-C.将SUM159细胞在黏附条件中培养,并用Repertaxin(100nM)或两种对CXCR1(10μg/ml)或CXCR2(10μg/ml)特异的阻断抗体处理。3天后,使用ALDEFLUOR测定(B)来分析对癌症干细胞群的影响,处理5天后使用MTT测定(C)来评估细胞存活力。在用Repertaxin或抗CXCR1抗体处理后观察到ALDEFLUOR阳性群和细胞存活力的显著降低。比较而言,在抗CXCR2抗体的情况中没有观察到显著的效果。D.处理4天后,利用TUNEL测定来评估凋亡细胞数目。与主要存在活细胞(染色为蓝色)的对照相比,在经Repertaxin处理的细胞中检测出36%凋亡细胞(绿染色为绿色)。E-F.为了测定细胞死亡是否经由旁观者效应介导。对CXCR1阳性和CXCR1阴性群进行流式分选,并用多个浓度的Repertaxin处理每个群(D)。检测出CXCR1阳性和未分选群中的细胞存活力的降低,而在CXCR1阴性群中没有观察到影响(E)。利用来自用Repertaxin处理三天的CXCR1阳性细胞的经透析的条件化培养基(dCM)来处理分选的CXCR1阳性、CXCR1阴性或未分选的群。利用经透析的条件化培养基的连续稀释(对照、dCM1/4、dCM1/2、dCM3/4、dCM)。处理2天后,利用MTT测定来评估细胞存活力。在CXCR1阴性和未分离的群中都观察到细胞存活力的大幅降低,而在CXCR1阳性群中没有观察到影响(F)。图13示出来自SUM159细胞系的ALDEFLUOR阳性/CXCR1阳性和ALDEFLUOR阳性/CXCR1阴性细胞群的致肿瘤性。A.为所注射的不同数目的细胞(50,000个细胞、5,000个细胞、1,000个细胞和500个细胞)和每个群(ALDEFLUOR阳性/CXCR1阳性、ALDEFLUOR阳性/CXCR1阴性)绘制肿瘤生长曲线。这两种细胞群都生成肿瘤。肿瘤生长动力学与肿瘤形成的潜伏期和大小及注射的细胞数目有关。B-C.由ALDEFLUOR阳性/CXCR1阳性群生成的肿瘤在连续传代后重建初始肿瘤的表型异质性,而ALDEFLUOR阳性/CXCR1阴性群引起仅含有ALDEFLUOR阳性/CXCR1阴性细胞的肿瘤。我们移植这两种细胞群以用于三次传代。图14示出显示了CXCR1阻断对肿瘤球形成的影响。将SUM159和HCC1954细胞在黏附条件中培养,并用Repertaxin(100nM)、抗CXCR1阻断抗体(10μg/ml)或抗CXCR2阻断抗体(10μg/ml)处理三天。处理3天后,将细胞分开,并在悬浮液中培养。评估培养5天后形成的肿瘤球数目。这两种细胞系观察到相似的结果,其中与对照相比,在经Repertaxin和经抗CXCR1处理的条件中原代和继代肿瘤球形成显著减少。比较而言,抗CXCR2阻断抗体对肿瘤球形成没有影响。图15示出Repertaxin处理对SUM159、HCC1954和MDA-MB-453细胞系的细胞存活力的影响。将三种不同细胞系(SUM159、HCC1954、MDA-MB-453)在黏附条件中培养,并用Repertaxin(100nM)处理。在处理1、3和5天后使用MTT测定来评估细胞存活力。处理3天后,SUM159和HCC1954细胞系观察到细胞存活力的降低。然而,Repertaxin并不影响MDA-MB453细胞的存活力。图16示出CXCR1阻断对ALDEFLUOR阳性群的体外影响。A-B。将HCC1954(A)和MDA-MB-453(B)细胞在黏附条件中培养,并用Repertaxin(100nM)或两种对CXCR1(10μg/ml)或CXCR2(10μg/ml)特性的阻断抗体处理。3天后,使用ALDEFLUOR测定来分析对癌症干细胞群的影响。对于HCC1954,在用Repertaxin或抗CXCR1抗体处理后观察到ALDEFLUOR阳性群和细胞存活力的显著降低。比较而言,在抗CXCR2抗体的情况中没有观察到显著的影响(A)。对于MDA-MB-453,没有观察到对ALDEFLUOR阳性群的任何影响(B)。图17示出Repertaxin处理诱导由FAS/FAS配体信号转导介导的旁观者效应。A.为了测定由Repertaxin处理诱导的旁观者杀死效应是否由FAS配体介导,利用ELISA测定来测量培养基中的可溶性FAS配体水平。处理4天后,与未处理的对照相比,在用Repertaxin处理的细胞的培养基中检测出可溶性FAS配体增加大于4倍。B.通过RT-PCR来测量FAS配体mRNA的水平,并确认用Repertaxin处理后FAS配体生成增加。在用激活FAS信号转导的FAS激动剂处理4天后观察到相似的结果,其中与对照相比,FAS配体mRNA增加5倍。C.将SUM159细胞在黏附条件中培养,并单独用Repertaxin处理或用Repertaxin与抗FAS配体联合处理。抗FAS配体的添加部分地挽救由Repertaxin处理诱导的细胞生长抑制。用FAS激动剂处理的细胞表现出与单独Repertaxin处理的细胞相似的细胞生长抑制。D-E.分析单独用Repertaxin处理或用Repertaxin与抗FAS配体联合处理和FAS激动剂处理对CXCR1阳性和ALDEFLUOR阳性群的影响。抗FAS配体没有挽救由Repertaxin处理诱导的CXCR1阳性和ALDEFLUOR阳性群的大幅减少,而用FAS激动剂的处理分别产生10倍和3倍增加的CXCR1阳性和ALDEFLUOR阳性群的百分比。图18示出FAS激动剂对CXCR1阳性和CXCR1阴性细胞的影响。对CXCR1阳性和CXCR1阴性群进行流式分选,并用多个浓度的FAS激动剂处理每个群。检测出CXCR1阴性和未分选群的细胞存活力降低,而在CXCR1阳性群中没有观察到影响。图19示出对正常的乳腺干细胞/祖细胞群中的CXCR1蛋白表达的分析和IL-8处理对乳腺球形成的影响。A.通过FACS将来自从乳房复位成形术分离的正常乳房上皮细胞的ALDEFLUOR阳性和阴性群分离,固定,并通过免疫染色和FACS分析来分析CXCR1蛋白表达。与ALDEFLUOR阴性群相比,ALDEFLUOR阳性细胞高度富含CXCR1阳性细胞。B-C.IL8处理对乳腺球形成的影响。IL8处理以剂量依赖性方式提高原代乳腺球(B)和继代乳腺球(C)的形成。图20示出Repertaxin处理对正常的乳房上皮细胞的影响。A.将自乳房复位成形术分离的正常乳腺上皮细胞在黏附条件中培养,并用Repertaxin(100nM或500nM)或FAS激动剂(500ng/ml)处理。处理5天后,使用MTT测定来评估细胞存活力。即使在利用高浓度的Repertaxin(500nM)时,Repertaxin处理或FAS激动剂对黏附条件中培养的正常乳腺上皮细胞的存活力没有影响。B.通过Elisa测定在用Repertaxin处理的正常乳腺上皮细胞的培养基中评估可溶性FAS配体的水平。处理4天后,在来自经处理细胞的培养基中检测出可溶性FAS配体的增加。C.通过FACS分析来分析正常乳腺上皮细胞中的FAS/CD95表达。在黏附条件中培养的正常乳腺上皮细胞中没有检测出FAS/CD95表达。D.Repertaxin处理对乳腺球形成的影响。将正常的乳房上皮细胞在黏附条件中培养,并在4、8、11和15天期间用Repertaxin(100nM)处理。Repertaxin处理后,将细胞分开,并在悬浮液中培养。在经Repertaxin处理的条件中观察到乳腺球起始细胞的显著减少。图21示出Repertaxin处理对FAK、AKT和FOXO3a活化的影响。为了评估Repertaxin处理对CXCR1下游信号转导的影响,利用两种不同病毒构建体,一种经由PTEN-siRNA来敲除PTEN表达,而另一种导致FAK过表达(Ad-FAK)。A.将SUM159对照、SUM159PTEN-siRNA和SUM159Ad-FAK细胞在黏附条件中在没有或存在100nMRepertaxin的情况中培养2天,并通过Western印迹来评估FAK/AKT途径的激活。Repertaxin处理导致FAKTyr397和AKTSer473磷酸化的降低,而PTEN删除和FAK过表达阻断Repertaxin处理对FAK和AKT活性的影响。B.利用对CXCR1阳性细胞的免疫荧光染色,我们确认Repertaxin处理导致磷酸-FAK(膜染色为红色)和磷酸-AKT表达(胞质染色为红色)的消失。用抗FOXO3A的免疫荧光染色揭示FOXO3a(以红色)在未处理细胞中的胞质位置,而Repertaxin处理诱导FOXO3A向细胞核的再定位。比较而言,具有PTEN删除或FAK过表达的细胞在经Repertaxin处理的和未处理的细胞中都表现出高水平的磷酸-FAK、磷酸-AKT和胞质FOXO3A表达。在所有样本中,用DAPI(蓝色)对细胞核复染。C-D.分别利用MTT和ALDEFLUOR测定来评估Repertaxin对SUM159PTEN-siRNA和SUM159Ad-FAK细胞存活力及对癌症干细胞群的影响。处理3天后,具有PTEN删除或FAK过表达的细胞形成对Repertaxin的抗性(C)。Repertaxin处理没有改变ALDEFLUOR阳性SUM159PTEN敲除细胞的比例(D)。图22示出Repertaxin处理在HCC1954和MDA-MB-453细胞系中对FAK/AKT活化的影响。为了评估Repertaxin处理对CXCR1下游信号转导的影响,我们利用经由PTEN-siRNA敲除PTEN表达的慢病毒构建体。A.将HCC1954对照和HCC1954PTEN-siRNA细胞在黏附条件中在没有或存在100nMRepertaxin的情况中培养2天,并通过Western印迹来评估FAK/AKT途径的激活。Repertaxin处理导致FAKTyr397和AKTSer473磷酸化的降低,而PTEN删除阻断Repertaxin处理对FAK和AKT活性的影响。B.Repertaxin处理对含有PTEN突变的MDA-MB-453细胞系的细胞存活力没有任何影响。利用Western印迹分析,我们确认Repertaxin处理不干扰FAK/AKT途径。图23示出Repertaxin对HCC1954PTEN-siRNA细胞存活力的影响,其利用MTT测定来评估。处理3天后,具有PTEN删除的细胞形成对RepertaXin的抗性。图24示出通过定量RT-PCR测量的多西他赛或Repertaxin处理后FAS配体和IL-8mRNA表达。A-B.用Repertaxin(100nM)、FAS激动剂(500ng/ml)或多西他赛(10nM)处理黏附条件中培养的SUM159细胞。处理3天后,收集细胞,并提取RNA。多西他赛在SUM159细胞中诱导FAS配体(A)和IL-8(B)mRNA。在FAS激动剂或多西他赛处理后检测出升高4倍的IL-8mRNA水平(B)。图25示出对三种不同乳腺癌异种移植物中PTEN/FAK/AKT活化的评估。Western印迹分析揭示,这两种异种移植物呈现PTEN的表达和FAK/AKT途径的激活,如通过FAKTyr397和AKTSer473磷酸化所显示的。图26示出Repertaxin处理对乳腺癌干细胞群的体内影响。A-C.为了评估Repertaxin处理对肿瘤生长和癌症干细胞群的体内影响,利用乳腺癌细胞系(SUM159)和自三名患者生成的三种人乳腺癌异种移植物(MC1、UM2、UM3)。A.对于每种样本,将50,000个细胞注射到NOD/SCID小鼠的人源化乳腺脂肪垫中,并监测肿瘤大小。在肿瘤为约4mm时,开始Repertaxin(15mg/Kg)两次/天的s.c.注射达28天或一次/周I.P.注射多西他赛(10mg/Kg)或组合(Repertaxin/多西他赛)。该图显示了每种指定的处理过程前和期间的肿瘤大小(箭头,开始处理)。对每种样本观察到相似的结果,其中与对照相比,在经单独多西他赛处理或Repertaxin/多西他塞组合处理的组中肿瘤大小在统计学上显著减小,而对照肿瘤和用单独用Repertaxin处理的肿瘤的生长之间没有观察到差异。B-C.Repertaxin、多西他赛或组合处理对癌症干细胞群的评估,如通过ALDEFLUOR测定(B)和再移植到继代小鼠中(C)所评估的。与对照相比,经多西他赛处理的肿瘤异种移植物显示相似或增加百分比的ALDEFLUOR阳性细胞,而单独Repertaxin处理的或与多西他赛组合处理产生统计学上显著减少的ALDEFLUOR阳性细胞,其中与对照相比,癌症干细胞减少65%至85%(p<0.01)(B)。将自原发性肿瘤、未处理(对照)和经处理的小鼠获得的细胞的连续稀释移植到不接受进一步处理的继代NOD/SCID小鼠的乳腺脂肪垫中。对照和经多西他赛处理的原发性肿瘤在所有稀释度形成继发性肿瘤,而仅较高数目的自用Repertaxin或与多西他赛组合处理的原发性肿瘤获得的细胞能够形成肿瘤。此外,肿瘤生长显著延迟,而且所得的肿瘤在大小上显著小于对照或经多西他赛处理的肿瘤(C)。D.收集来自每组的异种移植物,并进行免疫组织化学染色以检测磷酸-FAK、磷酸-AKT、FOXO3A和ALDH1的表达。在对照和经多西他赛处理的肿瘤中检测出膜磷酸-FAK表达和胞质磷酸-AKT表达(箭头),而在单独用Repertaxin处理的或与多西他赛组合处理的肿瘤中没有检测到表达。单独用多西他赛或Repertaxin处理或组合处理的细胞中检测出核FOXO3A表达(褐色)。与对照和经多西他赛处理的肿瘤相比,在单独用Repertaxin处理或组合处理的肿瘤中检测出ALDH1表达的降低(箭头)。图27示出Repertaxin处理对乳腺癌干细胞群的体内影响。A-C.为了评估Repertaxin处理对肿瘤生长和癌症干细胞群的体内影响,利用乳腺癌细胞系(SUM159,A)和自不同患者生成的三种人乳腺癌异种移植物。对于每种样本,将50,000个细胞注射到NOD/SCID小鼠的人源化乳腺脂肪垫中,并监测肿瘤大小。在肿瘤为约4mm时,开始Repertaxin(15mg/Kg)两次/天的s.c.注射达28天或一次/周I.P.注射多西他赛(10mg/Kg)或组合(Repertaxin/多西他赛)。该图显示了每种指定的处理过程前和期间的肿瘤大小(箭头,开始处理)。对每种样本观察到相似的结果,其中与对照相比,在经多西他赛单独处理或Repertaxin/多西他塞组合处理的组中肿瘤大小在统计学上显著减小,而对照肿瘤和单独用Repertaxin处理的肿瘤的生长之间没有观察到差异。通过ALDEFLUOR测定和再移植到继代小鼠中来评估Repertaxin、多西他赛或组合处理对癌症干细胞群的影响。与对照相比,经多西他赛处理的肿瘤异种移植物显示了相似或增加百分比的ALDEFLUOR阳性细胞,而单独用Repertaxin处理或与多西他赛组合处理产生统计学上显著性减少的ALDEFLUOR阳性细胞,其中与对照相比,癌症干细胞减少65%至85%(p<0.01)。将自原发性肿瘤、未处理(对照)和经处理的小鼠获得的细胞的连续稀释移植到不接受进一步处理的继代NOD/SCID小鼠的乳腺脂肪垫中。对照和经多西他赛处理的原发性肿瘤在所有稀释度形成继发性肿瘤,而仅较高数目的自用Repertaxin或与多西他赛组合处理的原发性肿瘤获得的细胞能够形成肿瘤。肿瘤生长显著延迟,而且所得的肿瘤在大小上显著小于对照或经多西他赛处理的肿瘤。图28示出Repertaxin处理对乳腺癌干细胞群的影响,如通过CD44+/CD24-表型所评估。A-B.通过CD44+/CD24-细胞的存在评估Repertaxin、多西他赛或组合处理对癌症干细胞群的影响。在单独用多西他赛处理的残留的肿瘤中,我们一致地观察到百分比未改变或增加的CD44+/CD24-细胞,而单独用Repertaxin处理或与多西他赛组合处理导致CD44+/CD24-细胞群的减少。A.呈现了UM3异种移植物的流程图分析。B.对MC1、UM2和UM3观察到相似的结果。几乎所有SUM159细胞在所有处理条件下为CD44+/CD24-。图29示出Repertaxin处理降低全身性转移的形成。为了评估Repertaxin处理对转移形成的影响,用表达萤光素酶的慢病毒感染HCC1954(A)、SUM159(B)、MDA-MB-453(C)乳腺癌细胞系,并经由心脏内注射将250,000个经萤光素酶感染的细胞接种到NOD/SCID小鼠中。心脏内注射后12小时通过在28天期间一天两次s.c.注射盐水溶液或s.c.注射Repertaxin(15mg/kg)来治疗小鼠。使用生物发光成像来监测转移形成。接种后以每周的时间间隔测量的标准化光子通量的量化揭示对于接种有HCC1954或SUM159细胞的小鼠而言,与盐水对照相比,Repertaxin治疗的转移形成在统计学上显著降低(A-B)。比较而言,对于注射MDA-MB-453细胞的小鼠,Repertaxin治疗对转移形成没有任何影响。(C).对未用Repertaxin治疗的小鼠的骨和软组织中的转移通过H&E染色进行组织学确认(D)。图30示出单独用化学疗法治疗或与Repertaxin组合治疗的癌症干细胞中的IL-8/CXCR1信号转导。A.代表癌症干细胞中的潜在的IL-8/CXCR1细胞信号转导。IL-8结合后的CXCR1活化诱导粘着斑激酶(FAK)的磷酸化。活性FAK使AKT磷酸化,并激活调节干细胞自我更新的WNT途径和调节细胞存活的FOXO3A。FAK的活化通过抑制FADD(FAST信号转导的一种下游效应物)来保护癌症干细胞免于FAS配体/FAS介导的旁观者效应。在存在化学疗法的情况中,仅大量肿瘤细胞对处理敏感,并在凋亡过程中释放高水平的IL-8和FAS配体蛋白。乳腺癌干细胞经由IL-8介导的旁观者效应被刺激,并且对经由FAST配体介导的旁观者杀死效应有抗性。B.Repertaxin治疗阻断IL-8/CXCR1信号转导,而且抑制乳腺癌干细胞自我更新和存活。当组合Repertaxin治疗与化学疗法组合时,使癌症干细胞对由FAS配体介导的旁观者杀死效应敏感。定义为了便于理解本发明,下文定义了许多术语和短语:如本文中所使用的,术语“抗癌剂”、“常规的抗癌剂”或“癌症治疗药物”指癌症治疗(例如,在哺乳动物中)中使用的任何治疗剂(例如,化疗化合物和/或分子治疗性化合物)、放射疗法或手术干预。如本文中所使用的,术语“药物”和“化疗剂”指用于在生理系统(例如受试者、或体内、体外或离体细胞、组织和器官)中诊断、治疗或预防疾病或病理疾患的药理学活性分子。药物通过改变已经接受药物施用的活生物体、组织、细胞或体外系统的生理学来起作用。术语“药物”和“化疗剂”意在涵盖抗过度增殖和抗肿瘤化合物及其它生物治疗性化合物。“有效量”指足以实现有益的或期望的结果的量。有效量可以在一次或多次施用中施用。如本文中所使用的,术语“施用”指将药物、前药、抗体或其它药剂、或治疗性处理给予生理系统(例如,受试者或体内、体外或离体细胞、组织和器官)的行为。对人体施用的示例性路径可以经由眼(眼的)、口(口服)、皮肤(经皮)、鼻(鼻的)、肺(吸入的)、口腔粘膜(含服)、耳、通过注射(例如,静脉内、皮下、肿瘤内、腹膜内等)等。“共施用”指对生理系统(例如,受试者或体内、体外或离体细胞、组织和器官)施用不止一种化学剂或治疗性处理(例如,放射疗法)。各种化学药剂(例如IL8-CXCR1信号转导途径拮抗剂和其它化疗剂)的“共施用”可以是并发的,或者以任何时间次序或物理组合。如本文中所使用的,术语“消退”指与基础的非病原示例性受试者、细胞、组织或器官相比患病的受试者、细胞、组织或器官返回到非病理学,或病理学较小的状态。例如,肿瘤的消退包括肿瘤质量降低及一个或多个肿瘤的完全消失。如本文中所使用的,术语“体外”指人工环境和人工环境内发生的过程或反应。体外环境可以包括但不限于试管和细胞培养物。术语“体内”指天然环境(例如,动物或细胞)和天然环境内发生的过程或反应。如本文中所使用的,术语“细胞培养物”指细胞的任何体外培养物。此术语包括连续细胞系(例如,具有永生表型)、原代细胞培养物、有限细胞系(例如,未转化的细胞)和体外维持的任何其它细胞群,包括卵母细胞和胚胎。如本文中所使用的,术语“受试者”或“患者”指要通过本发明的方法治疗的生物体。此类生物体包括但不限于人和兽医动物(犬、猫、马、猪、牛、绵羊、山羊等)。在本发明的上下文中,术语“受试者”或“患者”一般指将要接受或者已经接受治疗的个体。如本文中所使用的,术语“诊断”指根据疾病的体征和症状或遗传分析、病理学分析、组织学分析等对疾病的识别。如本文中所使用的,术语“反义”根据特定RNA序列(例如,mRNA)互补的核酸序列(例如,RNA,硫代磷酸DNA)而使用。此定义包括天然的或合成的反义RNA分子,包括调节基因表达的分子,诸如小干扰RNA或微小RNA。本发明可以采用的一类反义序列是对CXCR1mRNA特异的类型。术语“测试化合物”或“候选化合物”指可用于治疗或预防疾病、病患、病症或身体功能紊乱,或者以其它方式改变样本的生理或细胞状态的任何化学实体、药剂、药物等。测试化合物包含已知的和潜在的治疗性化合物两者。可以通过使用本发明的筛选方法来确定测试化合物为治疗性的。“已知的治疗性化合物”指已经显示(例如,经由动物试验或对人施用的现有经验)在此类治疗或预防中有效的治疗性化合物。在优选的实施方案中,“测试化合物”是抗癌剂。在特别优选的实施方案中,“测试化合物”是诱导细胞凋亡的抗癌剂。如本文中所使用的,术语“抗原结合蛋白”指结合特定抗原的蛋白质。“抗原结合蛋白”包括但不限于免疫球蛋白,包括多克隆、单克隆、嵌合、单链和人源化抗体、Fab片段、F(ab’)2片段和Fab表达文库。使用本领域中已知的多种方法来制备多克隆抗体。为了制备抗体,可以通过注射与期望的表位对应的肽来使多种宿主动物免疫,所述宿主动物包括但不限于兔、小鼠、大鼠、绵羊、山羊等。在一个优选的实施方案中,将肽与免疫原性载体(例如,白喉类毒素、牛血清清白蛋白(BSA)或钥孔傶血兰蛋白(KLH))缀合。根据宿主物种,使用多种佐剂来提高免疫应答,包括但不限于弗氏(完全的和不完全的)、矿物凝胶(诸如氢氧化铝)、表面活性物质(诸如溶血卵磷脂)、Pluronic多元醇、聚阴离子、肽、油乳剂、钥孔傶血兰蛋白、二硝基酚和潜在有用的人佐剂诸如BCG(卡介苗)和短小棒杆菌(Corynebacteriumparvum)。对于制备单克隆抗体,可以使用通过培养物中的传代细胞系提供抗体分子生成的任何技术(参见例如Harlow和Lane,Antibodies:ALaboratoryManual,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY)。这些包括但不限于最初由和Milstein开发的杂交瘤技术(和Milstein,Nature,256:495-497(1975)),及三源杂交瘤(trioma)技术、人B-细胞杂交瘤技术(参见例如Kozbor等,Immun0l.Today,4:72(1983))和用于制备人单克隆抗体的EBV杂交瘤技术(Cole等,MonoclonalAntibodiesandCancerTherapy中,AlanR.Liss,Inc.,第77页-第96页(1985))。依照本发明,可以使所描述的用于制备单链抗体的技术(U.S.4,946,778;以引用的方式并入本文)适于根据需要制备特定的单链抗体。本发明的其它实施方案利用本领域中已知的用于构建Fab表达文库的技术(Huse等,Science,246:1275-1281(1989))以使得可以快速且容易地鉴别具有期望特异性的单克隆Fab片段。可以通过已知的技术来产生含有抗体分子的独特型(抗原结合区)的抗体片段。例如,此类片段包括但不限于:可以通过抗体分子的胃蛋白酶消化而生成的F(ab’)2片段;可以通过还原F(ab’)2片段的二硫键而生成的Fab’片段;和可以通过用木瓜蛋白酶和还原剂处理抗体分子而生成的Fab片段。可以通过本领域中已知的方法来分离编码抗原结合蛋白的基因。在抗体制备中,可以通过本领域中已知的技术(例如,放射性免疫测定、ELISA(酶联免疫吸附测定)、“三明治式”免疫测定法、免疫放射性测量测定、凝胶扩散沉淀素反应、免疫扩散测定、原位免疫测定(例如,使用胶体金、酶或放射性同位素标记物)、Western印迹、沉淀反应、凝集测定(例如凝胶凝集测定、血细胞凝集测定等)、补体结合测定、免疫荧光测定、蛋白A测定、和免疫电泳测定等)等来实现期望抗体的筛选。如本文中所使用的,术语“调控”指化合物影响(例如,促进或延迟)细胞功能(包括但不限于细胞生长、增殖、侵袭、血管发生、凋亡等)方面的活性。具体实施方式本发明提供了治疗癌症的方法,其通过单独施用或与其它化疗剂联合施用IL8-CXCR1途径抑制剂(例如,抗CXCR1抗体或Repertaxin),从而杀死受试者的非致肿瘤性和致肿瘤性癌细胞来进行。本发明还提供了用于治疗患者的实体瘤干细胞和诊断患者的实体瘤干细胞的存在的组合物和方法(例如,基于CXCR1或FBXO21的存在)。I.致肿瘤性癌细胞、ALDH、CXCR1和CXCR1抑制正常细胞进化成完全转化的细胞需要多个细胞过程的反调节(1,2)。依照经典的致癌作用模型,这些事件可以在任何细胞中发生。比较而言,“癌症干细胞假说”认为致癌转化的优先靶物是已经获得自我更新潜力的组织干细胞或早期祖细胞(3-6)。这些“肿瘤起始细胞”或“癌症干细胞”(CSC)继而通过其经历自我更新(即一种引导肿瘤发生和分化的过程)的能力来表征,这有助于肿瘤细胞异质性。已经利用原发性人肿瘤的异种移植物产生了支持癌症干细胞假说的最近证据。这些研究已经表明肿瘤由癌症干细胞组分引导形成的细胞层次构成。另外,最近的数据表明源自鼠和人组织的永生化细胞系也可以含有表现干细胞特性的细胞群。大多数这些研究基于体外特性,包括产克隆潜能、球形成和多谱系分化潜能(7-10)。利用异种移植物中永生化细胞系的功能移植的更有限的研究也已经表明此类层次的存在。这些研究一般利用Hoechst染料排除来鉴别所谓的“侧群(sidepopulation)”(SP)(7,9,11)。另外,还利用了使用原发性肿瘤异种移植物限定的细胞表面标志物(诸如CD44和CD133)来鉴别已建立细胞系中的相似群(7,8)。如下文实施例中所描述的,研究在源自人乳腺癌和未转化的乳腺细胞的一系列33种细胞系中干细胞标志物醛脱氢酶(ALDH)的表达。ALDH是负责氧化细胞内醛的解毒酶,而且认为其通过将视黄醛代谢成视黄酸而在干细胞分化中发挥作用(12,13)。通过荧光ALDEFLUOR测定所评估的ALDH活性已经成功地被用于分离多发性骨髓瘤和急性髓细胞样白血病(AML)中的癌症干细胞以及从脑肿瘤中分离癌症干细胞(14-16)。最近证明了,可以利用ALDH活性来从正常的人乳腺组织和乳腺癌中分离表现干细胞特性的细胞亚群(17)。自乳房复位成形术(reductionmammoplasty)组织中分离的ALDEFLUOR阳性群能够在人源化NOD/SCID小鼠的乳腺脂肪垫中重新组成导管肺泡样结构。此外,自人乳腺癌分离的ALDELFUOR阳性细胞具有干细胞特性,如通过其在连续传代后在NOD/SCID小鼠中重新组成肿瘤及产生初始肿瘤的表型异质性的能力所表明(17)。在下文的实施例中,证明了大多数乳腺癌细胞系含有表现癌症干细胞特性的具有独特分子谱的ALDEFLUOR阳性群。如下文实施例中所描述的,本发明实施方案的开发过程中进行的工作将CXCR1(其是炎性趋化因子IL8的受体)鉴别为癌症干细胞标志物。仅Aldefluor阳性群内的细胞表达CXCR1。此外,证明了此受体发挥功能性作用,因为重组IL8能够提高细胞系中的干细胞比例,如通过Aldefluor和球形成分析所测定。虽然已经报告了IL8与侵袭性乳腺癌有关,而且在患有转移性疾病的女性的血清中更高,但是认为本发明首次显示了IL8与其干细胞中的受体CXCR1之间的功能联系。如下文实施例中进一步所描述,证明了可以通过阻断这些细胞中的CXCR1受体来选择性靶向癌症干细胞。在实施例中所描述的一种方法中,用针对CXCR1而非针对另一种IL8受体CXCR2的单克隆抗体处理乳腺癌细胞。如通过Aldefluor阳性群减少所表明,此类处理选择性靶向癌症干细胞。显著地,发现,虽然CXCR1仅在非常小比例的细胞(例如,小于1%)中表达,但是所述CXCR1受体的阻断在大多数其它癌细胞中诱导细胞死亡,尽管它们缺乏CXCR1受体。已经阐明了介导IL对癌症干细胞的影响,并引起杀死其它细胞的此所谓“旁观者效应”的分子途径。IL8通过结合CXCR1,CXCR1继而激活粘着斑激酶Fak途径来刺激干细胞自我更新。这导致驱动干细胞自我更新的Akt活化。在癌症干细胞中阻断此途径时,Akt信号转导的减少引起Foxo转录因子的胞质隔离,导致Fas配体的合成增加。Fas配体由癌症干细胞分泌,并在含有Fas受体的周围细胞中诱导细胞死亡。虽然本发明不限于任何具体的机制,而且对机制的了解对于实施本发明不是必要的,但是认为CXCR1经由包括Fak和Akt的途径介导癌症干细胞自我更新,而且阻断此途径在癌症干细胞及周围肿瘤细胞中诱导细胞死亡。因此,在某些实施方案中,本发明提供了用于中断IL8-CXCR1途径(例如,用抗CXCR1抗体、抗FAK抗体或其它药剂)以治疗癌症的组合物和方法。因为IL8是一种参与组织炎症的趋化因子,所以先前在开发IL8信号转导抑制剂上有兴趣。已经开发出小分子抑制剂Repartaxin作为抗炎剂来潜在地减少心肌梗死和中风的并发症。Repartaxin已经引入了I期和II期临床试验中,而且已经表明具有很少的毒性。如下文实施例中所显示,Repartaxin(与抗CXCR1抗体一样)能够靶向癌症干细胞并且通过旁观者效应在周围细胞中诱导Fas配体fas介导的凋亡。重要的是,在肿瘤异种移植物中,Repartaxin加强了化学疗法的效果。此外。与化学疗法(其优先破坏肿瘤中的分化细胞而避免肿瘤干细胞)不同,Repartaxin能够靶向肿瘤干细胞。如实施例中所显示,这通过经Repartaxin治疗的肿瘤中的Aldefluor群减少和这些经治疗的肿瘤细胞在小鼠中形成继发性肿瘤的能力降低得到证明。还测试了Repartaxin对阻断转移的能力的影响。用萤光素酶标记肿瘤细胞,并将其注射到在实验用转移模型中。引入肿瘤细胞后1天,将一组动物单独置于Repartaxin上,而另一组没有治疗。Repartaxin显著降低转移的形成。本发明将IL8受体CXCR1鉴别为治疗癌症干细胞的靶物。小分子抑制剂Repartaxin抑制CXCR1和CXCR2。实施例证明,癌症干细胞中最重要的受体正是CXCR1。此外,实施例表明,细胞毒性化学疗法不能有效地治疗已确定的癌症可能不仅由于此疗法不能靶向癌症干细胞,另外还由于已证明肿瘤细胞毒性化学疗法治疗后IL8分泌升高。本实施例表明,CXCR1抑制剂的使用在能够特异地靶向癌症干细胞及阻断由细胞毒性化学疗法诱导的这些细胞的IL8刺激方面具有有益效果。靶向IL8-CXCR1途径不限于乳腺癌,而是可以在任何类型的癌症中采用。优选地,治疗的癌症类型是其中有IL8生成增加(例如与化学疗法有关)的证据的类型。已经显示化疗剂直接调节癌细胞中的IL8转录。紫杉醇在卵巢、乳腺和肺癌细胞系中增加IL8转录和分泌(Uslu等,2005,Int.J.Gynecol.Cancer,15:240-245;及Collins等,2000,Can.Imm.Immuno.,49:78-84,二者以引用的方式并入本文)。还有,对乳腺癌细胞施用阿霉素和5-氟-2’-脱氧尿苷(DeLarco等,2001,Can.Res.61:2857-2861,以引用的方式并入本文)、对口腔癌细胞施加5-FU(Tamatani等,2004,Int.,J.Can.,108:912:921,以引用的方式并入本文)、对小细胞肺癌细胞施加多柔比星(Shibakura等,2003,Int.J.Can.,103:380-386,以引用的方式并入本文)和对黑素瘤细胞施用达卡巴嗪(dacarbazine)(Lev等,2003,Mol.,Can.Ther.,2:753-763,以引用的方式并入本文)都导致CXCL8表达增加。因此,在某些实施方案中,本发明提供了用于靶向IL-CXCR1的药剂,其与化疗剂(例如,诸如在上述参考文献中所提及的那些)组合用于治疗患有如下的一种癌症的受试者,所述癌症包括但不限于前列腺癌、卵巢癌、乳腺癌、黑素瘤、非小细胞肺癌、小细胞肺癌和食管腺癌。本发明不限于治疗的癌症类型,反而包括但不限于纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨源性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏瘤(Ewing’stumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯氏肿瘤(WiIms’tumor)、宫颈癌、睾丸肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、黑素瘤、成神经细胞瘤和视网膜母细胞瘤。II.实体瘤干细胞癌症标志物的检测在一些实施方案中,本发明提供了用于检测干细胞癌症标志物(例如CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质)表达的方法。在一些实施方案中,直接测量表达(例如,在RNA或蛋白质水平)。在一些实施方案中,在组织样本(例如,活检组织)中检测表达。在其它实施方案中,在体液(例如,包括但不限于血浆、血清、全血、粘液和尿液)中检测表达。本发明进一步提供了用于检测标志物的面板(panel)和试剂盒。在一些实施方案中,使用干细胞癌症标志物的存在来向受试者提供预后。还使用所提供的信息来指导治疗过程。例如,若发现受试者具有指示实体瘤干细胞的标志物(例如,CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质),则可以在早期时间点开始其它疗法(例如,放射疗法),此时这些疗法很可能是有效的(例如,在转移前)。另外,若发现受试者患有不响应某些疗法的肿瘤,则可以避免此类疗法的费用和不便。在一些实施方案中,本发明提供了用于分析多种标志物(例如,CXCR1或FBXO21与CD44、CD24和ESA中至少一种的组合)的面板。面板允许同时分析与致癌作用和/或转移相关的多种标志物。根据受试者,可以单独或组合分析面板以提供最好的诊断和预后。使用任何合适的方法(包括但不限于描述于下面说明性实施例中的那些)通过筛选其预测值来选择面板上包含的标志物。1.RNA的检测在一些实施方案中,通过测量组织样本中相应mRNA的表达来检测实体瘤干细胞癌症标志物。可以通过任何合适的方法测定mRNA表达,这些方法包括但不限于在下文所公开的那些。人CXCR1核酸的登录号是NM_000634(以引用的方式并入本文),而人FBXO21的登录号是NM_033624(以引用的方式并入本文)。可以使用这些序列来设计引物和探针(以及siRNA序列)。在一些实施方案中,通过Northern印迹分析来检测RNA。Northern印迹分析涉及RNA的分离和互补的标记探针的杂交。在又一些实施方案中,通过与寡核苷酸探针杂交来检测RNA(或相应的cDNA)。使用用于杂交和检测的多种技术进行的多种杂交测定是可用的。例如,在一些实施方案中,利用TaqMan测定(PEBiosystems,FosterCity,CA;参见例如美国专利No.5,962,233和No.5,538,848,其中的每个以引用的方式并入本文)。在PCR反应过程中进行该测定。TaqMan测定利用AMPLITAQGOLDDNA聚合酶的5’-3’外切核酸酶活性。PCR反应中包含由具有5’-报告染料(例如,荧光染料)和3’-猝灭染料的寡核苷酸组成的探针。在PCR过程中,若探针结合其靶物,则AMPLITAQGOLD聚合酶的5’-3’核溶解活性在报告染料与猝灭染料之间切割探针。报告染料与猝灭染料的分离导致荧光性增加。信号随每个PCR循环而积累并且可以用荧光计进行监测。在又一些实施方案中,使用逆转录酶PCR(RT-PCR)来检测RNA的表达。在RT-PCR中,使用逆转录酶酶将RNA以酶促方式转化成互补的DNA或“cDNA”。然后,使用cDNA作为PCR反应的模板。可以通过任何合适的方法来检测PCR产物,所述方法包括但不限于凝胶电泳和用DNA特异性染料染色或与经标记的探针杂交。在一些实施方案中,利用定量逆转录酶PCR与标准化竞争性模板混合物法,其描述在美国专利5,639,606、5,643,765和5,876,978中(这些专利中的每个以引用的方式并入本文)。2.蛋白质的检测在其它实施方案中,通过测量相应蛋白质或多肽(例如CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质)的表达来检测干细胞癌症标志物的基因表达。可以通过任何合适的方法来检测蛋白质表达。在一些实施方案中,通过免疫组织化学来检测蛋白质。在其它实施方案中,蛋白质通过其结合针对该蛋白质的抗体来检测。人CXCR1蛋白的登录号是NP_000625(以引用的方式并入本文),而人FBXO21的登录号是NP_296373(以引用的方式并入本文)。下文描述了抗体的生成。通过本领域中已知的技术(例如放射性免疫测定法、ELISA(酶联免疫吸附测定法)、“三明治式”免疫测定法、免疫放射性测量测定、凝胶扩散沉淀反应、免疫扩散测定、原位免疫测定(例如,使用胶体金、酶或放射性同位素标记物)、Western印迹、沉淀反应、凝集测定(例如凝胶凝集测定、血细胞凝集测定等)、补体结合测定、免疫荧光测定、蛋白A测定和免疫电泳测定等)来检测抗体结合。在一个实施方案中,通过检测一抗上的标记物来检测抗体结合。在另一个实施方案中,通过检测二抗或药剂与一抗的结合来检测一抗。在又一个实施方案中,二抗是标记的。本领域中已知许多用于在免疫测定中检测结合的方法,并且它们在本发明的范围内。在一些实施方案中,利用自动化检测测定。用于免疫测定的自动化的方法包括描述在美国专利5,885,530、4,981,785、6,159,750和5,358,691中的那些,这些专利的每个以引用的方式并入本文。在一些实施方案中,结果的分析和呈现也是自动化的。例如,在一些实施方案中,利用基于与癌症标志物对应的一系列蛋白质的存在与否来产生预后的软件。在其它实施方案中,免疫测定描述在美国专利5,599,677和5,672,480中;这些专利的每个以引用的方式并入本文。3.cDNA微阵列技术cDNA微阵列由点样(通常使用机器人定位装置进行)于固体支持物(诸如玻璃显微镜载玻片)的已知位置上的多种(通常为数千种)不同cDNA组成。通常,通过质粒文库插入物的PCR扩增来获得cDNA,所述PCR扩增使用与质粒载体主链部分互补或者与序列已知的基因本身互补的引物进行。适合于生成微阵列的PCR产物的长度通常在0.5和2.5kB之间。可以选择来自任何目标文库的全长cDNA、表达序列标签(EST)或随机选择的cDNA。例如,如Hillier等,1996,6:807-828中所描述,EST是部分测序的cDNA。虽然一些EST对应于已知的基因,但是除了少量的3’和/或5’序列和可能衍生EST的mRNA的起源组织外,经常可获得非常少的关于任何特定EST的信息或没有该信息。如本领域普通技术人员应当领会的,一般地,cDNA含有足够的序列信息以独特地鉴别人基因组内的基因。此外,一般地,cDNA具有足够的长度以在实验的杂交条件下与从源自单一基因的mRNA获得的cDNA选择性、特异性或唯一地杂交。在典型的微阵列实验中,将微阵列与源自两种不同样本的差别标记的RNA、DNA或cDNA群杂交。最通常地,自目标细胞或组织分离RNA(总RNA或多聚A+RNA),并将其逆转录以生成cDNA。通常在逆转录过程中通过在反应混合物中掺入标记的核苷酸来进行标记。虽然可以使用各种标记物,但是最通常地,将核苷酸与荧光染料Cy3或Cy5缀合。例如,可以使用Cy5-dUTP和Cy3-dUTP。用一种荧光团标记源自一种样本(代表例如特定的细胞类型、组织类型或生长条件)的cDNA,而用第二荧光团标记源自第二样本(代表例如不同细胞类型、组织类型或生长条件)的cDNA。将相似量的来自两种样本的标记材料与微阵列共杂交。在用Cy5(其发红色荧光)和Cy3(其发绿色荧光)标记样本的微阵列实验的情况中,原始数据(使用能够定量检测荧光强度的检测仪通过扫描微阵列来获得)是荧光强度的比率(红色/绿色,R/G)。这些比率表示与微阵列上呈现的cDNA杂交的cDNA分子的相对浓度,并且因此反映与微阵列上所呈现的每种cDNA/基因对应的mRNA的相对表达水平。每项微阵列实验可以提供成千上万个数据点,每个表示两种样本中的特定基因的相对表达。对数据的适当组织和分析是至关重要的,而且已经开发出并入标准统计学工具的多种计算机程序以便于数据分析。一项用于组织基因表达数据的基础是将具有相似表达模式的基因一起集合成簇。用于对源自微阵列实验的数据进行层次聚类分析(hierarchicalclusteranalysis)和显示的方法描述在Eisen等,1998,PNAS95:14863-14868。如其中所描述,聚类可以与原始数据的图示组合,其中每个数据点用定量和定性表示所述数据点的颜色表示。通过将来自一大张数字表的数据转化成可见形式,此过程有助于对数据的直观分析。关于数学工具和/或聚类方法本身的其它信息和详情可以参见例如Sokal和Sneath,Principlesofnumericaltaxonomy,xvi,359,W.H.Freeman,SanFrancisco,1963;Hartigan,Clusteringalgorithms,xiii,351,Wiley,NewYork,1975;Paull等,1989,J.Natl.CancerInst.81:1088-92;Weinstein等1992,Science258:447-51;vanOsdol等,1994,J.Natl.CancerInst.86:1853-9;及Weinstein等,1997,Science,275:343-9。本发明中使用的实验方法的更多详情参见下文的实施例。描述用于制作和使用微阵列的方法的其它信息参见美国专利No.5,807,522,其以引用的方式并入本文。关于使用可商购的部件构建微阵列硬件(例如阵列仪(arrayer)和扫描仪)的指令。微阵列技术的其它讨论和用于制备样本并进行微阵列实验的方案参见例如,DNAarraysforanalysisofgeneexpression,MethodsEnzymol,303:179-205,1999;Fluorescence-basedexpressionmonitoringusingmicroarrays,MethodsEnzymol,306:3-18,1999;及M.Schena(编著),DNAMicroarrays:APracticalApproach,OxfordUniversityPress,Oxford,UK,1999。4.数据分析在一些实施方案中,使用基于计算机的分析程序来将通过检测测定产生的原始数据(例如,给定的一种或多种标志物的存在、缺失或量)转化为供临床医生用的有预测价值的数据。临床医生可以使用任何合适的手段来评估该预测数据。因此,在一些实施方案中,本发明提供了其它益处,即不可能进行遗传学或分子生物学方面的培训的临床医生不需要理解原始数据。数据以其最有用的形式直接呈现给临床医生。然后,临床医生能够立即利用信息以优化受试者的护理。本发明设想能够接受、加工和在进行测定的实验室、信息提供者、医学人员和受试者间传输信息的任何方法。例如,在本发明的一些实施方案中,自受试者获得样本(例如活检组织或血清或尿液样本),并将其提交给世界上任何地方(例如,在与受试者居住或信息最终使用的国家不同的国家)的谱分析服务(例如,医学机构的临床实验室,基因组谱分析企业等)以产生原始数据。在样本包含组织或其它生物学样本的情况中,受试者可以访问医学中心以使样本被获得,并发送到谱分析中心,或者受试者可以自己收集样本,并直接将其发送到谱分析中心。在样本包含先前测定的生物学信息的情况中,受试者可以将信息直接发送到谱分析服务(例如,可以通过计算机扫描含有信息的信息卡,并使用电子通信系统将数据传送到谱分析中心的计算机)。一旦被谱分析服务接收,对样本进行处理,并产生谱型(例如表达数据),其对于受试者想要的诊断或预后信息是特定的。然后,治疗临床医生以适合于解释的形式准备谱型数据。例如,准备的形式可以代表对受试者的诊断或风险评估连同特定治疗选项的推荐,而不是提供原始表达数据(例如,检查许多标志物)。可以通过任何合适的方法向临床医生显示数据。例如,在一些实施方案中,谱分析服务产生临床医生可以打印(例如,在护理点)的或可以在计算机监视器上向临床医生显示的报告。在一些实施方案中,首先在护理点或在区域机构分析信息。然后,将原始数据发送到中心处理机构以进一步分析和/或将原始数据转化为对临床医生或患者有用的信息。中心处理机构提供隐私(所有数据储存于具有统一安全方案的中心机构)、速度和数据分析一致性的优点。然后,中心处理机构可以控制受试者治疗后的数据的最终处理。例如,使用电子通信系统,中心机构可以将数据提供给临床医生、受试者或研究者。在一些实施方案中,受试者能够使用电子通信系统来直接评估数据。受试者可以基于结果来选择进一步的干预或咨询。在一些实施方案中,使用数据进行研究用途。例如,可以使用数据来进一步优化作为疾病的特定状态或阶段的有用指示物的标志物的入选或排除。5.试剂盒在又一些实施方案中,本发明提供了用于检测和表征癌症(例如,用于检测一种或多种标志物,或者用于调控由一种或多种标志物表达的肽的活性)的试剂盒。在一些实施方案中,除检测药剂和缓冲液外,试剂盒还含有对癌症标志物特异的抗体。在其它实施方案中,试剂盒含有对于检测mRNA或cDNA特异的试剂(例如,寡核苷酸探针或引物)。在一些实施方案中,试剂盒含有进行检测测定所必需的和/或足以进行检测测定的所有成分,包括所有对照、用于进行测定的指导和用于分析和呈现结果的任何必需的软件。本发明的另一个实施方案包括用于测试多核苷酸或蛋白质的存在的试剂盒。试剂盒可以包含例如,用于检测多肽的抗体或用于检测多核苷酸的探针。另外,试剂盒可以包含参照或对照样本;用于处理样本、进行测试和解释结果的说明;和进行测试所必需的缓冲液和其它试剂。在其它实施方案中,试剂盒包含用于检测实体瘤干细胞基因标签的一种或多种基因的表达的引物对。在其它实施方案中,试剂盒包含用于检测实体瘤干细胞基因标签的一种或多种基因的表达的cDNA或寡核苷酸阵列。6.体内成像在一些实施方案中,使用体内成像技术来显现动物(例如,人或非人哺乳动物)中癌症标志物的表达。例如,在一些实施方案中,使用对癌症标志物特异的经标记抗体来标记癌症标志物mRNA(例如,CXCR1或FBXO21mRNA)或蛋白质(例如CXCR1或FBXO21蛋白)。可以使用体内成像方法在个体中检测特异性结合且经标记的抗体,所述体内成像方法包括但不限于放射性核素成像、正电子成象术、计算机化轴向断层摄影术、X-射线或磁共振成像法、荧光检测和化学发光检测。下文描述了用于生成针对本发明的癌症标志物的抗体的方法。本发明的体内成像方法在诊断表达本发明的实体瘤干细胞癌症标志物的癌症中是有用的。使用体内成像来显现指示癌症的标志物的存在。此类技术允许不使用令人不快的活组织检查的诊断。本发明的体内成像方法也用于向癌症患者提供预后。例如,可以检测指示癌症干细胞的标志物的存在。可以进一步使用本发明的体内成像方法来检测身体其它部分中的转移癌。在一些实施方案中,将对CXCR1或FBXO21特异的药剂(例如抗体)进行荧光标记。将经标记的抗体导入受试者中(例如,口服或不经肠道)。使用任何合适的方法(例如,使用美国专利6,198,107中所描述的装置进行,该专利以引用的方式并入本文)来检测经荧光标记的抗体。在其它实施方案中,对抗体进行放射性标记。供体内诊断用的抗体的使用是本领域中公知的。Sumerdon等,(Nucl.Med.Biol17:247-254[1990])已经描述了一种经优化的抗体-螯合剂,使用铟-111作为标记物用于进行肿瘤放射免疫闪烁成像。Griffin等,(JClinOnc9:631-640[1991])已经描述了此制剂在检测怀疑患有胰腺癌的患者的肿瘤的用途。具有顺磁性离子的相似制剂作为标记物用于磁共振成像的用途是本领域中已知的(Lauffer,MagneticResonanceinMedicine22:339-342[1991])。所使用的标记物将取决于所选择的成像形态。可以使用放射性标记物(诸如铟-111、锝-99m或碘-131)进行平面扫描或单光子发射计算断层摄影术(SPECT)。也可以使用正电子发射标记物(诸如氟-19)进行正电子成象术(PET)。对于MRI,还可以使用顺磁性离子,诸如钆(III)或锰(II)。半衰期为1小时至3.5天的放射性金属可用于与抗体缀合,诸如钪-47(3.5天)、镓-67(2.8天)、镓-68(68分钟)、锝-99m(6小时)和铟-111(3.2天),其中镓-67、锝-99m和铟-111对于γ照相机成像是优选的,镓-68对于正电子成象术是优选的。用此类放射性金属标记抗体的一种有用的方法借助于双功能性螯合剂,诸如二乙烯三胺五乙酸(DTPA),如例如对于In-111和Tc-99m,由Khaw等(Science209:295[1980]),及由Scheinberg等(Science215:1511[1982])所描述的。也可以使用其它螯合剂,但是1-(对羧基甲氧基苄基)EDTA和DTPA的羧基碳酸酐是有利的,这是因为它们的使用允许基本上不影响抗体的免疫反应性的情况下的缀合。用于将DPTA与蛋白质偶联的另一种方法利用DTPA的环酐,如由Hnatowich等(Int.J.Appl.Radiat.Isot.33:327[1982])所描述的,用In-111标记白蛋白,但是可以使其适合于用于标记抗体。用Tc-99m标记抗体的一种合适的方法是Crockford等,(美国专利No.4,323,546,其以引用的方式并入本文)的预锡化法,所述方法不使用与DPTA的螯合。用Tc-99m标记免疫球蛋白的方法是由Wong等(Int.J.Appl.Radiat.Isot.,29:251[1978])所描述的方法,用于血浆蛋白质,而且最近由Wong等(J.Nucl.Med.,23:229[1981])成功应用于标记抗体。在与特定抗体缀合的放射性金属的情况中,同样期望在不破坏其免疫特异性的情况下将尽可能高比例的放射性标记物引入抗体分子中。可以通过在本发明的特定干细胞癌症标志物的存在下实现放射性标记来实现进一步改进,以确保抗体上的抗原结合位点将得到保护。在又一些实施方案中,利用体内生物光子成像(Xenogen,Almeda,CA)来进行体内成像。此实时体内成像利用萤光素酶。将萤光素酶基因并入细胞、微生物和动物中(例如,作为具有本发明癌症标志物的融合蛋白)。在有活性时,它导致发射光的反应。使用CCD照相机和软件来捕捉图像,并对其进行分析。III.抗体和抗体片段本发明提供了针对CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质的分离的抗体和抗体片段。抗体或抗体片段可以是特异性识别这些蛋白质的任何单克隆或多克隆抗体。在一些实施方案中,本发明提供了特异性结合CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质的单克隆抗体或其片段。在一些实施方案中,单克隆抗体或其片段是特异性结合这些蛋白质的嵌合或人源化抗体。在其它实施方案中,单克隆抗体或其片段是特异性结合这些蛋白质的人抗体。针对CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质的抗体在本文中所描述的实验、诊断和治疗方法中得到应用。在某些实施方案中,使用本发明的抗体来检测生物样本(诸如,例如患者活检组织、胸腔积液或血液样本)中癌症干细胞标志物蛋白质的表达。可以将活检组织切片,并使用例如免疫荧光或免疫组织化学来检测蛋白质。或者,分离来自样本的单个细胞,并通过FACS分析在固定的或活的细胞上检测蛋白质表达。此外,可以在蛋白质阵列上使用抗体以检测癌症干细胞标志物例如在肿瘤细胞上、在细胞溶解产物中或在其它蛋白质样本中的表达。在其它实施方案中,使用本发明的抗体来抑制肿瘤细胞生长,其通过在基于细胞的体外测定或体内动物模型中使抗体与肿瘤细胞接触来实现。在又一些实施方案中,使用抗体来治疗人患者的癌症,其通过施用治疗有效量的针对癌症干细胞标志物(例如,来自表1)的抗体来实现。可以通过任何已知的方法来制备多克隆抗体。可以通过多次皮下或腹膜内注射任选地与钥孔傶血兰蛋白(KLH)、血清白蛋白等缀合的相关抗原(纯化的肽片段、全长重组蛋白质、融合蛋白等)来使动物(例如兔、大鼠、小鼠、驴等)免疫,从而产生多克隆抗体,所述相关抗原在无菌盐水中稀释并与佐剂(例如,完全或不完全弗氏佐剂)组合以形成稳定的乳剂。然后,从如此免疫的动物的血液、腹水等中回收多克隆抗体。使收集的血液凝结,并倒出血清,通过离心澄清,并测定抗体效价。可以依照本领域中的标准方法从血清或腹水中纯化多克隆抗体,所述标准方法包括亲和层析、离子交换层析、凝胶电泳、透析等。可以使用诸如由Kohler和Milstein(1975)Nature256:495所描述的那些杂交瘤方法来制备单克隆抗体。使用杂交瘤方法,如上文所描述的那样使小鼠、仓鼠或其它合适的宿主动物免疫,以引发淋巴细胞生成将特异性结合免疫抗原的抗体。或者,可以在体外使淋巴细胞免疫。免疫后,将淋巴细胞分离,并使用例如聚乙二醇使其与合适的骨髓瘤细胞系融合以形成杂交瘤细胞,然后可以从未融合的淋巴细胞和骨髓瘤细胞中选择该杂交瘤细胞。然后,可以使用标准的方法(Goding,MonoclonalAntibodies:PrinciplesandPractice,AcademicPress,1986)在体外培养中或在动物体内作为腹水瘤增殖杂交瘤细胞,所述杂交瘤细胞生成特异性针对选定抗原的单克隆抗体,如通过免疫沉淀、免疫印迹或通过体外结合测定(诸如放射性免疫测定(RIA)或酶联免疫吸附测定(ELISA)所测定。然后,可以从培养基或腹水中纯化单克隆抗体,如上文对多克隆抗体所描述的。或者,如美国专利4,816,567中所描述,也可以使用重组DNA方法来生成单克隆抗体。使用特异性扩增编码抗体的重链和轻链的基因的寡核苷酸引物,诸如通过RT-PCR从诸如成熟的B细胞或杂交瘤细胞中分离编码单克隆抗体的多核苷酸,并使用常规的方法来测定其序列。然后,将编码重链和轻链的分离的多核苷酸克隆至合适的表达载体中,当将所述合适的表达载体转染到宿主细胞(诸如大肠杆菌细胞、猿COS细胞、中国仓鼠卵巢(CHO)细胞或不另外产生免疫球蛋白蛋白质的骨髓瘤细胞)中时,宿主细胞产生单克隆抗体。还有,可以自噬菌体展示文库中分离期望物种的重组单克隆抗体或其片段,如(McCafferty等,1990,Nature,348:552-554;Clackson等,1991,Nature,352:624-628;及Marks等,1991,J.Mol.Biol.,222:581-597)所描述。可以使用重组DNA技术以多种不同的方式进一步修改编码单克隆抗体的一种或多种多核苷酸以生成备选抗体。在一个实施方案中,例如小鼠单克隆抗体的轻链和重链的恒定域可以1)被例如人抗体的那些区域取代以生成嵌合抗体,或2)被非免疫球蛋白多肽取代以生成融合抗体。在其它实施方案中,将恒定区截短或除去以生成单克隆抗体的期望抗体片段。此外,可以使用可变区的定点或高密度诱变来优化单克隆抗体的特异性、亲和力等。在本发明的一些实施方案中,针对癌症干细胞标志物的单克隆抗体是人源化抗体。人源化抗体是可变区内含有来自非人(例如,鼠)抗体的最小限度序列的抗体。此类抗体在治疗上用以在对人受试者施用时降低抗原性和HAMA(人抗小鼠抗体)应答。实际上,人源化抗体通常是具有最小限度至没有非人序列的人抗体。人抗体是由人生成的抗体或具有与由人生成的抗体对应的氨基酸序列的抗体。可以使用本领域中已知的多种技术来生成人源化抗体。可以通过用具有期望特异性、亲和力和性能(capability)的非人抗体(例如小鼠、大鼠、兔、仓鼠等)的CDR取代人抗体的CDR来使抗体人源化(Jones等,1986,Nature,321:522-525;Riechmann等,1988,Nature,332:323-327;Verhoeyen等,1988,Science,239:1534-1536)。可以通过取代Fv框架区中的和/或被取代的非人残基内的其它残基来进一步修改人源化抗体以改善并优化抗体的特异性、亲和力和/或性能。可以使用本领域中已知的多种技术来直接制备人抗体。可以生成体外免疫的或自免疫个体分离的永生人B淋巴细胞,该免疫个体产生针对靶抗原的抗体(参见例如,Cole等,MonoclonalAntibodiesandCancerTherapy,AlanR.Liss,第77页(1985);Boemer等,1991,J.Immunol.,147(1):86-95;及美国专利5,750,373)。还有,可以自噬菌体文库选择人抗体,其中所述噬菌体文库表达人抗体(Vaughan等,1996,NatureBiotechnology,14;309-314;Sheets等,1998,PNAS,95;6157-6162;Hoogenboom和Winter,1991,J.Mol.Biol.,227:381;Marks等,1991,J.Mol.Biol.,222:581)。也可以在含有人免疫球蛋白基因座的转基因小鼠中生成人源化抗体,所述转基因小鼠在免疫后能够在没有内源性免疫球蛋白生成的情况中生成全部人抗体。此方法描述于美国专利5,545,807、5,545,806、5,569,825、5,625,126、5,633,425和5,661,016中。本发明还包括特异性识别癌症干细胞标志物的双特异性抗体。双特异性抗体是能够特异性识别并结合至少两种不同表位的抗体。双特异性抗体可以是完整的抗体或抗体片段。用于制备双特异性抗体的技术是本领域中常见的(Millstein等,1983,Nature305:537-539;Brennan等,1985,Science229:81;Suresh等,1986,MethodsinEnzymol.121:120;Traunecker等,1991,EMBOJ.10:3655-3659;Shalaby等,1992,J.Exp.Med.175:217-225;Kostelny等,1992,J.Immunol.148:1547-1553;Gruber等,1994,J.Immunol.152:5368;及美国专利5,731,168)。在本发明的某些实施方案中,例如,可能期望使用抗体片段,而非完整的抗体以提高肿瘤渗透。已知多种用于生成抗体片段的技术。传统上,经由对完整抗体的蛋白水解消化来产生这些片段(例如Morimoto等,1993,JournalofBiochemicalandBiophysicalMethods24:107-117及Brennan等,1985,Science,229:81)。然而,这些片段现在通常通过重组宿主细胞直接生成,如上文所描述的。因此,Fab、Fv和scFv抗体片段都可以在大肠杆菌或其它宿主细胞中表达,并自大肠杆菌或其它宿主细胞分泌,如此允许产生大量的这些片段。或者,此类抗体片段可以自上文所讨论的抗体噬菌体文库分离。抗体片段也可以是线性抗体,例如美国专利5,641,870中所描述的,而且可以是单特异性的或双特异性的。用于生成抗体片段的其它技术对于熟练从业人员将是显而易见的。特别在抗体片段的情况中,可能期望进一步修改抗体以延长其血清半衰期。这可以通过以下来实现,即例如通过抗体片段中合适区域的突变将补救受体结合表位引入抗体片段中或者将表位引入肽标签中,然后将所述肽标签与抗体片段在任一末端或在中间融合(例如,通过DNA或肽合成来进行)。本发明进一步包括与本文中所提出的嵌合、人源化和人抗体或其抗体片段基本上同源的变体和等同物。这些可以含有例如保守取代突变,即用相似的氨基酸取代一个或多个氨基酸。例如,保守取代指一种氨基酸用相同通用种类内的另一种氨基酸取代,诸如例如,一种酸性氨基酸用另一种酸性氨基酸取代,一种碱性氨基酸用另一种碱性氨基酸取代,或一种中性氨基酸用另一种中性氨基酸取代。保守氨基酸取代的意图是本领域中公知的。本发明还属于包含与细胞毒剂缀合的抗体的免疫缀合物。细胞毒剂包括化疗剂、生长抑制剂、毒素(例如,细菌、真菌、植物或动物起源的酶活性毒素或其片段)、放射性同位素(即放射性缀合物)等。可用于生成此类免疫缀合物的化疗剂包括例如,甲氨蝶呤、阿霉素、多柔比星、美法仑(melphalan)、丝裂霉素C、苯丁酸氮芥(chlorambucil)、柔红霉素或其它嵌合剂。可以使用的酶活性毒素及其片段包括白喉A链、白喉毒素的非结合活性片段、外毒素A链、蓖麻毒蛋白A链、相思豆毒蛋白A链、塑莲根毒蛋白(modeccin)A链、α-帚曲毒素、油桐(Aleuritesfordii)蛋白质、石竹素(dianthin)蛋白质、垂序商陆(Phytolacaamericana)蛋白质(PAPI、PAPII、和PAP-S)、苦瓜(momordicacharantia)抑制剂、麻疯树毒蛋白、巴豆毒蛋白、肥皂草(sapaonariaofficinalis)抑制剂、白树素(gelonin)、丝林霉素(mitogellin)、局限曲菌素(restrictocin)、酚霉素(phenomycin)、伊诺霉素(neomycin)和单端孢霉毒素(tricothecenes)。多种放射性核素可用于生成放射性缀合的抗体,包括212Bi、131I、131In、90Y和186Re。使用多种双功能性蛋白质偶联剂生成抗体与细胞毒剂的缀合物,这些双功能性蛋白质偶联剂诸如3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(SPDP)、亚氨基硫烷(IT)、亚氨酸酯的双功能衍生物(诸如盐酸二甲基己二酰亚胺化物HCL)、活性酯(诸如双琥珀酰亚胺辛二酸酯)、醛(诸如戊二醛)、二叠氮基化合物(诸如二(对叠氮苯甲酰基)己二胺)、二重氮衍生物(诸如二-(对二重氮苯甲酰基)-乙二胺)、二异氰酸酯(诸如甲苯2,6-二异氰酸酯)和双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)来。也可以使用抗体与一种或多种小分子毒素(诸如卡奇霉素(calicheamicin)、类美坦素(maytansinoid)、单端孢霉烯族毒素(trichothene)和CC1065以及具有毒素活性的这些毒素的衍生物)的缀合物。在一些实施方案中,本发明的抗体含有人Fc区,其被修改以增强效应器功能,例如抗原依赖性细胞介导的细胞毒性(ADCC)和/或补体依赖性细胞毒性(CDC)。这可以通过在抗体的Fc区中引入一种或多种氨基酸取代来实现。例如,可以在Fc区中引入一个或多个半胱氨酸残基以使得在此区域中形成链间二硫键,从而改善补体介导的细胞杀伤和抗体依赖性细胞毒性(ADCC)(Caron等,1992,J.ExpMed.176:1191-1195;Shopes,1992,Immunol.148:2918-2922)。也可以使用异双功能的交联剂来制备具有增强抗肿瘤活性的同二聚体抗体,如Wolff等,1993,CancerResearch53:2560-2565所描述。或者,可以设计具有双Fc区的抗体(Stevenson等,1989,Anti-CancerDrugDesign3:219-230)。IV.药物筛选在一些实施方案中,本发明提供了药物筛选测定(例如,以筛选抗癌药物)。本发明的筛选方法利用干细胞癌症标志物(例如,CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1、TBP和表1的其它蛋白质),其使用本发明的方法来鉴别。例如,在一些实施方案中,本发明提供了筛选CXCR1或FBXO21表达或活性改变(例如,提高或降低)的化合物的方法。在一些实施方案中,候选化合物是针对癌症标志物的反义制剂或siRNA制剂(例如,寡核苷酸)。在其它实施方案中,候选化合物是与本发明的干细胞癌症标志物特异结合的抗体。在某些实施方案中,使用本文中所描述的方法来筛选小分子化合物的文库。在一种筛选方法中,评估候选化合物改变干细胞癌症标志物表达的能力,方式是使化合物与表达干细胞癌症标志物的细胞接触,然后测定候选化合物对表达的影响。在一些实施方案中,通过检测细胞表达的癌症标志物mRNA水平来测定候选化合物对癌症标志物基因表达的影响。可以通过任何合适的方法来检测mRNA表达。在其它实施方案中,通过测量癌症标志物编码的多肽水平来测定候选化合物对癌症标志物基因表达的影响。可以使用任何合适的方法来测量所表达的多肽水平,所述方法包括但不限于本文中所公开的那些。在一些实施方案中,检测细胞生物学中的其它变化(例如,凋亡)。具体地,本发明提供了用于鉴别调控物,即候选或测试化合物或药剂(例如,蛋白质、肽、模拟肽、类肽、小分子或其它药物)的方法,该调控物与本发明的癌症标志物结合或者改变与本发明的癌症标志物有关的信号转导或功能、对例如干细胞癌症标志物表达或癌症标志物活性具有抑制(或刺激)影响或者对例如癌症标志物底物的表达或活性具有刺激或抑制影响。可以使用如此鉴别的化合物在治疗方案中直接或间接调控靶基因产物(例如,干细胞癌症标志物基因,诸如CXCR1或FBXO21)的活性、完善靶基因产物的生物学功能或者鉴别破坏正常靶基因相互作用的化合物。抑制癌症标志物活性或表达的化合物可用于治疗增殖性病症,例如癌症,特别是转移性癌症,或者消除或控制肿瘤干细胞以预防或降低癌症风险。在一个实施方案中,本发明提供了用于筛选作为癌症标志物蛋白质或多肽或其生物活性部分的底物的候选或测试化合物的测定。在另一个实施方案中,本发明提供了用于筛选与癌症标志物蛋白质或多肽或其生物活性部分结合或调控癌症标志物蛋白质或多肽或其生物活性部分的活性的测定。可以使用本领域中已知的组合文库方法中的多种方法之任一种来获得本发明的测试化合物,所述组合文库方法包括生物学文库;类肽文库(具有肽功能性,但具有新的、非肽主链的分子的文库,所述分子对酶促降解有抗性,但是然而其保留生物活性;参见例如Zuckennann等,J.Med.Chem.37:2678-85[1994]);空间可寻址平行固相或液相文库;需要解卷积的合成文库方法;“一珠一化合物”文库方法;和使用亲和层析选择的合成文库方法。生物学文库和类肽文库方法优选与肽文库一起使用,而其它四种方法可适用于化合物的肽、非肽寡聚物或化合物的小分子文库(Lam(1997)AnticancerDrugDes.12:145)。可在本领域找到用于合成分子文库的方法的例子,例如:DeWitt等,Proc.Natl.Acad.Sci.U.S.A.90:6909[1993];Erb等,Proc.Nad.Acad.Sci.USA91:11422[1994];Zuckermann等,J.Med.Chem.37:2678[1994];Cho等,Science261:1303[1993];Carrell等,Angew.Chem.Int.Ed.Engl.33.2059[1994];Carell等,Angew.Chem.Int.Ed.Engl.33:2061[1994];及Gallop等,J.Med.Chem.37:1233[1994]。化合物的文库可以存在于溶液中(例如Houghten,Biotechniques13:412-421[1992]),或在珠上(Lam,Nature354:82-84[1991])、芯片上(Fodor,Nature364:555-556[1993])、细菌或孢子上(美国专利No.5,223,409;以引用的方式并入本文)、质粒上(Cull等,Proc.Nad.Acad.Sci.USA89:18651869[1992])或噬菌体上(Scott和Smith,Science249:386-390[1990];DevlinScience249:404-406[1990];Cwirla等,Proc.NatI.Acad.Sci.87:6378-6382[1990];Felici,J.Mol.Biol.222:301[1991])。在一个实施方案中,测定是一种基于细胞的测定,其中使表达干细胞癌症标志物蛋白质或其生物活性部分的细胞与测试化合物接触,并测定测试化合物调控癌症标志物的活性的能力。可以通过监测例如酶活性的变化来实现对测试化合物调控干细胞癌症标志物活性的能力的测定。例如,细胞可以是哺乳动物起源的。也可以评估测试化合物调控与化合物(例如,干细胞癌症标志物底物)结合的癌症标志物的能力。这可以如下实现,即例如使化合物(例如,底物)与放射性同位素或酶标记物偶联,从而可以通过检测复合物中的被标记的化合物(例如,底物)来测定化合物(例如,底物)与癌症标志物的结合。或者,使干细胞癌症标志物与放射性同位素或酶标记物偶联以监测测试化合物调控与复合物中的癌症标志物底物结合的癌症标志物的能力。例如,可以用125I、35S、14C或3H直接或间接地标记化合物(例如,底物),并通过放射性发射的直接计数或者通过闪烁计数来检测放射性同位素。或者,可以用例如辣根过氧化物酶、碱性磷酸酶或萤光素酶来对化合物进行酶标记,并通过测定合适底物转化为产物来检测酶标记物。可以评估化合物(例如干细胞癌症标志物底物)在标记或不标记任何相互作用物的情况中与干细胞癌症标志物相互作用的能力。例如,可以使用微生理计来检测化合物在不标记化合物或癌症标志物的情况中与癌症标志物的相互作用(McConnell等Science257:1906-1912[1992])。如本文中所使用的,“微生理计”(例如,细胞传感仪)是使用光寻址电位传感器(LAPS)测量细胞酸化其环境的速率的分析仪器。可以使用此酸化速率的变化作为化合物与癌症标志物之间的相互作用的指标。在又一个实施方案中,提供一种无细胞测定,其中使癌症标志物蛋白质或其生物活性部分与测试化合物接触,并评估测试化合物与干细胞癌症标志物蛋白质或其生物活性部分结合的能力。要在本发明的测定中使用的癌症标志物蛋白质的生物活性部分包括参与与底物或其它蛋白质的相互作用的片段,例如,具有高表面可能性得分(highsurfaceprobabilityscore)的片段。无细胞测定涉及制备靶基因蛋白质与测试化合物的反应混合物,其条件和时间足以允许两种组分相互作用并结合,如此形成可以移除和/或检测的复合物。也可以例如使用荧光能量转移(FRET)来检测两个分子之间的相互作用(参见例如Lakowicz等,美国专利No.5,631,169;Stavrianopoulos等,美国专利No.4,968,103;这些专利的每个以引用的方式并入本文)。选择荧光团标记物选择使得第一供体分子发射的荧光能量会被第二“受体”分子上的荧光标记物吸收,继而,第二“受体”分子能够由于吸收的能量而发荧光。或者,“供体”蛋白质分子可以仅利用色氨酸残基的天然荧光能量。选择如下的标记物,其发射不同波长的光,使得“受体”分子标记物可以与“供体”的分子标记物区分。因为标记物间的能量转移效率与分隔分子的距离有关,所以可以评估分子间的空间关系。在分子间发生结合的情况中,测定中的“受体”分子标记物的荧光发射应当是最大的。可以经由本领域中公知的标准荧光测量检测手段(例如,使用荧光计)来方便地测量FRET结合事件。在另一个实施方案中,可以使用实时生物分子相互作用分析(BIA)来实现测定干细胞癌症标志物蛋白质与靶分子结合的能力(参见,例如Sjolander和Urbaniczky,Anal.Chem.63:2338-2345[1991]及Szabo等Curr.Opin.Struct.Biol.5:699-705[1995])。“表面等离振子共振”或“BIA”在不标记任何相互作用物(例如,BlAcore)的情况中实时检测生物特异性相互作用。结合表面上的质量变化(指示结合事件)导致表面附近的光折光率变化(表面等离振子共振(SPR)的光学现象),这会产生可作为生物分子间的实时反应的指标的可检测信号。在一个实施方案中,将靶基因产物或测试底物锚定到固相上。可以在反应结束时检测锚定到固相上的靶基因产物/测试化合物复合物。可以将靶基因产物锚定到固体表面上,并可以用本文中所讨论的可检测标记物直接或间接地标记测试化合物(其不被锚定)。可能需要对干细胞癌症标志物、抗癌症标志物抗体或其靶分子进行固定以便于分开复合与未复合形式的一种或两种蛋白质,以及适应测定的自动化。测试化合物与干细胞癌症标志物蛋白质的结合,或癌症标志物蛋白质在存在和没有候选化合物的情况中与靶分子的相互作用可以在任何适合于容纳反应物的容器中实现。此类容器的例子包括微量滴定板、试管和微离心管。在一个实施方案中,可以提供融合蛋白,其增加允许一种或两种蛋白质结合基质的域。例如,可以将谷胱甘肽-S-转移酶-癌症标志物融合蛋白或谷胱甘肽-S-转移酶/靶融合蛋白吸附到谷胱甘肽Sepharose珠(SigmaChemical,St.Louis,MO)或源自谷胱甘肽的微量滴定板上,然后将其与测试化合物或测试化合物和未吸附的靶蛋白或癌症标志物蛋白质组合,并在有助于复合物形成的条件(例如,在盐和pH方面的生理学条件)下温育混合物。温育后,清洗珠或微量滴定板孔以除去任何未结合的组分,在珠的情况中,使基质固定,直接或间接测定复合物,例如如上文所描述的。或者,可以自基质解离复合物,并使用标准的技术来测定癌症标志物结合水平或活性。用于将癌症标志物蛋白质或靶分子固定在基质上的其它技术包括使用生物素与链霉抗生物素蛋白的缀合。可以使用本领域中已知的技术(例如,生物素化试剂盒,PierceChemicals,Rockford,IL)由生物素-NHS(N-羟基-琥珀酰亚胺)制备生物素化的癌症标志物蛋白质或靶分子,并使其固定在经链霉抗生物素蛋白包被的96孔板(PierceChemical)的孔中。为了进行测定,将非固定的组分添加至含有锚定成分的包被表面。反应完成后,在各种条件下除去(例如,通过清洗进行)未反应的组分,使得所形成的任何复合物将会在固体表面上保持固定。可以以多种方式实现对锚定在固体表面的复合物的检测。在预先标记先前非固定组分的情况中,表面上检测到固定的标记物表面形成复合物。在不预先标记先前非固定组分的情况中,可以使用间接的标记物来检测锚定在表面上的复合物;例如,使用对固定组分特异的经标记抗体(继而,抗体可被直接标记或者用例如经标记的抗IgG抗体间接标记)。利用对干细胞癌症标志物蛋白质或靶分子有反应性,但不干扰干细胞癌症标志物蛋白质与其靶分子结合的抗体进行此测定。可以将此类抗体衍生至平板的孔,并通过抗体缀合将未结合的靶物或癌症标志物蛋白质固定在孔内。除了上文所描述的关于GST固定复合物的方法外,用于检测此类复合物的方法包括使用对癌症标志物蛋白质或靶分子有反应性的抗体对复合物进行的免疫检测,及依赖于检测与癌症标志物蛋白质或靶分子有关的酶活性的酶联测定。或者,可以在液相中进行无细胞测定。在此类测定中,通过多种标准技术之任一种使反应产物与未反应的成分分离,所述标准技术包括但不限于:差速离心(参见例如Rivas和Minton,TrendsBiochemSci18:284-7[1993]);层析(凝胶过滤层析、离子交换层析);电泳(参见例如Ausubel等编著CurrentProtocolsinMolecularBiology1999,J.Wiley:NewYork.);以及免疫沉淀(参见例如Ausubel等编著CurrentProtocolsinMolecularBiology1999,J.Wiley:NewYork)。此类树脂和层析技术是本领域技术人员已知的(参见例如HeegaardJ.Mol.Recognit11:141-8[1998];HageandTweedJ.Chromatogr.Biomed.Sci.Appl699:499-525[1997])。此外,如本文中所描述的,也可以方便地利用荧光能量转移检测结合,而不用从溶液进一步纯化复合物。测定可以包括使干细胞癌症标志物蛋白质或其生物活性部分和与癌症标志物结合的已知化合物接触以形成测定混合物,使测定混合物与测试化合物接触,并测定测试化合物与癌症标志物蛋白质相互作用的能力,其中测定测试化合物与癌症标志物蛋白质相互作用的能力包括与已知化合物相比,测定测试化合物优先与癌症标志物或其生物活性部分结合,或调控靶分子活性的能力。就细胞癌症标志物能在体内与一种或多种细胞或胞外大分子(诸如蛋白质)相互作用的方面来说,此类相互作用的抑制剂是有用的。可以使用同种的测定来鉴别抑制剂。例如,制备预先形成的靶基因产物与相互作用的细胞或胞外结合配偶体产物的复合物,从而标记靶基因产物或其结合配偶体,但是由标记物产生的信号由于复合物形成而猝灭(参见,例如美国专利No.4,109,496,以引用的方式并入本文,该专利利用此方法进行免疫测定)。加入与来自预先形成的复合物的种类之一竞争并将其取代的测试物质会导致产生高于背景的信号。这样,可以鉴别破坏靶基因产物-结合配偶体相互作用的测试物质。或者,可以在双杂交测定或三杂交测定中使用癌症标志物蛋白质作为“诱饵蛋白”(参见例如美国专利No.5,283,317;Zervos等,Cell72:223-232[1993];Madura等,J.Biol.Chem.268.12046-12054[1993];Bartel等,Biotechniques14:920-924[1993];Iwabuchi等,Oncogene8:1693-1696[1993];及BrentWO94/10300;每篇以引用的方式并入本文),以鉴别与癌症标志物结合或与癌症标志物(“癌症标志物结合蛋白”或“癌症标志物-bp”)相互作用并参与癌症标志物活性的其它蛋白质。通过癌症标志物蛋白质或靶物,此类癌症标志物-bp可以是信号激活剂或抑制剂,例如作为癌症标志物介导的信号转导途径的下游元件。也可以鉴别癌症标志物表达的调控剂。例如,使细胞或无细胞混合物与候选化合物接触,并相对于没有候选化合物情况中的干细胞癌症标志物mRNA或蛋白质表达水平评估癌症标志物mRNA或蛋白质的表达。当癌症标志物mRNA或蛋白质表达在候选化合物存在下大于其缺乏时,将候选化合物鉴别为癌症标志物mRNA或蛋白质表达的刺激物。或者,当癌症标志物mRNA或蛋白质的表达在候选化合物存在下小于(即,统计学上显著小于)其缺乏时,将候选化合物鉴别为癌症标志物mRNA或蛋白质表达的抑制剂。可以通过本文中所描述的用于检测癌症标志物mRNA或蛋白质的方法来测定癌症标志物mRNA或蛋白质表达的水平。本发明进一步属于通过上文所描述的筛选测定鉴别的新药剂(参见例如,下文关于癌症疗法的描述)。因而,在本发明的范围内的是,在合适的动物模型(诸如本文中所描述的那些)中进一步使用如本文中所描述那样鉴别的药剂(例如,癌症标志物调控剂、反义癌症标志物核酸分子、siRNA分子、癌症标志物特异性抗体或癌症标志物结合配偶体)来测定用此类药剂治疗的功效、毒性、副作用或作用机制。此外,通过上文所描述的筛选测定鉴别的新药剂可以例如用于如本文中所描述的治疗(例如,治疗患有癌症的人患者)。在某些实施方案中,本发明采用非黏附乳腺球来进行各个筛选步骤,包括用于筛选CXCR1或FBXO21信号转导途径拮抗剂的方法。非黏附乳腺球是一种体外培养系统,其允许原代人乳腺上皮干细胞和祖细胞以未分化状态增殖,这基于其在悬浮液中作为球形结构增殖的能力进行。非黏附乳腺球先前描述于Dontu等GenesDev.2003年5月15日;17(10):1253-70,及Dontu等,BreastCancerRes.2004;6(6):R605-15,两者都以引用的方式并入本文。这些参考的全文内容都以引用的方式并入,特别是用于教导非黏附乳腺球的构建和使用的内容。如Dontu等所描述的,乳腺球的特征在于由能够自我更新和多向分化的干细胞和祖细胞构成。Dontu等还描述了乳腺球含有能够在基质胶中的重建3-D培养系统中无性繁殖生成复杂的功能性导管-肺泡样结构的细胞。在某些实施方案中,采用以下示例性筛选方法。对于体外研究,可以用表达对照或CXCR1或FBXO21候选siRNA的任一种腺病毒构建体(m.o.i.为10至100)处理细胞3天或用小分子候选物(例如,PHA665752衍生物)(0.1-0.5uM)处理3天,并在未处理的和经处理的细胞中比较CXCR1+或FBXO21+细胞形成肿瘤球的能力。对于体内研究,可以用表达萤光素酶的慢病毒感染人乳腺癌细胞以监测肿瘤生长。可以将表达萤光素酶的癌细胞注射到乳腺组织中,并可以建立大小约0.5-0.7cm的肿瘤,每组5只动物。然后,可以用候选CXCR1或FBXO21抑制剂(每天i.v.30mg/kg/天持续7天)或载体对照治疗具有建立的肿瘤的动物。用表达对照或候选CXCR1或FBXO21siRNA的腺病毒(m.o.i.为100或500持续7天)的感染可用于进行平行研究。可以在第7天、第14天、第21天和第28天对动物成像以评估肿瘤大小,然后将其处死。可以在尸体解剖时进一步评估肿瘤大小,并对肿瘤的一部分进行染色以评估肿瘤组织学。可以收集剩余的肿瘤并分类以评估CXCR1或FBXO21阳性和CXCR1或FBXO21阴性细胞的百分比。为了验证候选CXCR1或FBXO21抑制剂的施用和候选CXCR1或FBXO21siRNA腺病毒感染抑制CXCR1或FBXO21信号转导功能,可以检查下游介导物(诸如Gab-1和ERK)的磷酸化(参见Chistensen等,CancerRes.,2003;63:7345-7355,以引用的方式并入本文)。V.癌症疗法在一些实施方案中,本发明提供了癌症疗法。在一些实施方案中,疗法靶向癌症标志物(例如,包括但不限于CXCR1或FBXO21和CXCR1或FBXO21信号转导途径中的蛋白质)。在一些实施方案中,可以使用任何已知的或以后开发的癌症干细胞疗法。例如,癌症干细胞治疗剂描述于美国专利6,984,522和7,115,360及申请WO03/050502、WO05/074633和WO05/005601,这些专利和申请的全文以引用的方式并入本文。抗体疗法在一些实施方案中,本发明提供了靶向表达本发明的干细胞癌症标志物的肿瘤的抗体。可以在本文中所公开的治疗方法中利用任何合适的抗体(例如,单克隆的、多克隆的或合成的)。在一些实施方案中,用于癌症疗法的抗体是人源化抗体。用于使抗体人源化的方法是本领域中公知的(参见例如,美国专利6,180,370、5,585,089、6,054,297和5,565,332;每个专利以引用的方式并入本文)。在一些实施方案中,治疗性抗体包含针对本发明的干细胞癌症标志物而生成的抗体,其中将抗体与细胞毒剂缀合。在此类实施方案中,生成肿瘤特异性治疗剂,其不靶向正常细胞,因此降低传统化学疗法的许多有害副作用。对于某些应用,预想治疗剂将是会充当对于附着抗体有用的药剂的药理剂,特别是细胞毒剂或在其它情况中为抗细胞剂,其具有杀死或抑制内皮细胞生长或细胞分裂的能力。本发明设想了可以与抗体缀合并以活性形式递送的任何药理剂的用途。示例性的抗细胞剂包括化疗剂、放射性同位素和细胞毒素。本发明的治疗性抗体可以包括多种细胞毒性部分,包括但不限于放射性同位素(例如,碘-131、碘-123、锝-99m、铟-111、铼-188、铼-186、镓-67、铜-67、钇-90、碘-125或砹-211);激素,诸如类固醇;抗代谢物,诸如胞嘧啶(例如阿拉伯糖苷、氟尿嘧啶、甲氨蝶呤或氨基蝶呤;蒽环霉素;丝裂霉素C);长春花生物碱(例如,秋水仙胺;依托泊苷;光神霉素);和抗肿瘤烷化剂,诸如苯丁酸氮芥或美法仑。其它实施方案可以包括诸如凝血剂、细胞因子、生长因子、细菌内毒素或细菌内毒素的脂质A部分之类的药剂。例如,在一些实施方案中,治疗剂将包括植物、真菌或细菌衍生的毒素,诸如A链毒素、核糖体灭活蛋白、α-帚曲霉素、曲霉菌素、局限曲菌素、核糖核酸酶、白喉毒素或假单胞菌外毒素,仅提及几个例子。在一些实施方案中,利用脱糖基化蓖麻毒蛋白A链。在任何情况下,提出,若需要,诸如这些的药剂可以以如下的方式与抗体成功地缀合,所述方式将允许它们在靶肿瘤细胞的位点处靶向、内在化、向血液成分释放或呈现,其根据需要使用已知的缀合技术来实现(参见例如Ghose等,MethodsEnzymol.,93:280[1983])。例如,在一些实施方案中,本发明提供了靶向本发明的干细胞癌症标志物的免疫毒素。免疫毒素是特异性靶向剂(通常为针对肿瘤的抗体或片段)与细胞毒剂(诸如毒素部分)的缀合物。靶向剂将毒素引导至携带靶抗原的细胞,并且由此选择性地杀死所述细胞。在一些实施方案中,治疗性抗体采用提供高体内稳定性的交联剂(Thorpe等,CancerRes.,48:6396[1988])。在其它实施方案中,特别是涉及治疗实体瘤的那些,将抗体设计为具有针对肿瘤血管系统的细胞毒性或抗细胞效果,其通过抑制血管内皮细胞的生长或细胞分裂来实现。此攻击意在导致肿瘤局部性血管崩溃(vascularcollapse),这对肿瘤细胞,特别是那些远离血管系统的肿瘤细胞剥夺氧和养分,最终导致细胞死亡和肿瘤坏死。在一些实施方案中,将基于抗体的治疗剂配制为如下文所描述的药物组合物。在一些实施方案中,施用本发明的抗体组合物导致癌症的可测量降低(例如,肿瘤缩小或消除)。VI.治疗组合物和施用可以通过任何有效的方法来施用含有依照本发明的肿瘤发生调节剂的药物组合物。例如,可以通过任何有效的方法来施用IL8-CXCR1信号转导途径拮抗剂,或充当IL8-CXCR1信号转导/应答途径中的蛋白质的拮抗剂的其它治疗剂。在本发明的某些实施方案中,治疗剂包含Repertaxin或其衍生物。在某些实施方案中,可以局部、眼内、非肠道、口服、鼻内、静脉内、肌肉内、皮下或通过任何其它有效的手段施用含有有效浓度的IL8-CXCR1信号转导途径拮抗剂的生理学适当溶液。特别是,可以通过针头以有效治疗靶组织的肿瘤细胞的量将IL8-CXCR1信号转导途径拮抗剂药剂直接注射到靶癌症或肿瘤中(例如,到乳腺组织中)。或者,存在于体腔(诸如眼、胃肠道、生殖泌尿道(例如,膀胱)、肺和支气管系统等)中的癌症或肿瘤可以经由用针头直接注射或经由置入患有癌症或肿瘤的中空器官中的导管或其它递送管来接受含有效浓度的IL8-CXCR1信号转导途径拮抗剂的生理学合适的组合物(例如,无菌的溶液,诸如盐水或磷酸盐缓冲液;悬浮液或乳剂)。可以使用任何有效的成像装置(诸如X-射线、声波图或光纤显现系统)来定位靶组织,并引导针头或导管。在另一个备选中,可以将含有有效浓度的IL8-CXCR1信号转导途径拮抗剂的生理学合适的溶液系统施用到全身血液循环中,以治疗不能直接到达或结构上分离的癌症或肿瘤。此类操作共同的目的是使IL8-CXCR1信号转导途径拮抗剂与靶肿瘤充分接触,以容许拮抗剂接触、转导或转染肿瘤细胞(这取决于药剂的性质)。在一个实施方案中,可以通过将悬浮液输注到充满流体的中空器官中,或者通过使悬浮液喷雾或雾化到充满空气的中空器官中来治疗存在于中空器官的表皮衬里(lining)中的实体瘤。因此,肿瘤细胞(诸如实体瘤干细胞)可以存在于肺支气管树的衬里、胃肠道的衬里、女性生殖道的衬里、生殖泌尿道、膀胱、胆囊中的上皮组织和易于与IL8-CXCR1信号转导途径拮抗剂接触的任何其它器官组织之中或之间。在另一个实施方案中,实体瘤可以位于中枢神经系统,诸如例如脊髓、脊髓根或脑的衬里之中或之上,使得脑脊液中灌注的IL8-CXCR1信号转导途径拮抗剂接触并转导所述空间中的实体瘤细胞。肿瘤学领域技术人员可以领会,可以通过直接注射到肿瘤中来对实体瘤施用拮抗剂,从而拮抗剂接触并影响肿瘤内部的肿瘤细胞。也可以使用由本发明所鉴别的致肿瘤细胞来生成抗癌细胞抗体。在一个实施方案中,方法涉及获得致肿瘤细胞或分离的致肿瘤性细胞的富集群;处理该群以阻止细胞复制(例如,通过辐射进行);并以诱导对实体瘤干细胞的免疫应答有效的量对人或动物受试者施用经处理的细胞。关于要注射或口服的细胞的有效剂量的指导,参见美国专利No.6,218,166、No.6,207,147和No.6,156,305,这些专利以引用的方式并入本文。在另一个实施方案中,方法涉及获得实体肿瘤肝细胞或分离的实体肿瘤肝细胞的富集群;使体外培养物中的肿瘤干细胞与来自要生成抗体的人受试者或宿主动物的免疫效应器细胞混合(依照本领域中已知的免疫学方法进行);自培养物中移除免疫效应器细胞;并将免疫效应器细胞以足以在动物中刺激免疫应答的剂量移植到宿主动物中。在本发明的一些实施方案中,将本发明的抗致肿瘤性治疗剂(例如IL8-CXCR1信号转导途径拮抗剂)与其它抗肿瘤疗法共施用。大量治疗剂可以和本发明一起使用。可以与本发明的药剂共施用,或者与本发明的药剂联合的任何治疗剂适合于在本发明的方法中使用。设想多种抗肿瘤例如,抗癌)剂用在本发明的某些实施方案中。适合于与本发明一起使用的抗癌剂包括但不限于诱导凋亡的药剂、抑制腺苷脱氨酶功能、抑制嘧啶生物合成、抑制嘌呤环生物合成、抑制核苷酸相互转化、抑制核糖核苷酸还原酶、抑制胸苷一磷酸(TMP)合成、抑制二氢叶酸还原、抑制DNA合成、与DNA形成加合物、损坏DNA、抑制DNA修复、插入DNA、使天冬酰胺脱氨、抑制RNA合成、抑制蛋白质合成或稳定性、抑制微管形成或功能等的药剂。在一些实施方案中,适用于本发明的组合物和方法的示例性抗癌剂包括但不限于:1)生物碱,包括微管抑制剂(例如,长春新碱、长春碱和长春地辛等)、微管稳定剂(例如,紫杉醇(TAXOL)和多西他赛等)和染色质功能抑制剂,包括拓扑异构酶抑制剂诸如表鬼臼毒素(例如,依托泊苷(VP-16)和替尼泊苷(VM-26)等)和靶向拓扑异构酶I的药剂(例如喜树碱和伊立替康(isirinotecan)(CPT-11)等);2)共价DNA结合剂(烷化剂),包括氮芥(例如,二氯甲基二乙胺、苯丁酸氮芥、环磷酰胺、异环磷酰胺和白消安(MYLERAN)等)、亚硝基脲(例如,卡莫司汀、洛莫司汀和司莫司汀等)和其它烷化剂(例如,达卡巴嗪、羟甲基三聚氰胺、塞替派和丝裂霉素等);3)非共价DNA结合剂(抗肿瘤抗生素),包括核酸抑制剂(例如,更生霉素(放线菌素D)等)、蒽环类(例如,柔红霉素(daunorubicin)(道诺霉素和Cerubidine)、多柔比星(阿霉素)和伊达比星(idarubicin)(去甲氧柔红霉素)等)、蒽二酮(例如,蒽环毒素类似物,诸如米托蒽醌等)、博来霉素(BLENOXANE)等和普卡霉素(光神霉素)等;4)抗代谢物,包括抗叶酸剂(例如甲氨蝶呤、FOLEX和MEXATE等)、嘌呤抗代谢物(例如,6-巯嘌呤(6-MP,PURINETHOL)、6-硫鸟嘌呤(6-TG)、硫唑嘌呤、无环鸟苷、更昔洛韦、氯脱氧腺苷、2-氯脱氧腺苷(CdA)和2’-脱氧助间型霉素(deoxycoformycin)(喷司他丁)等)、嘧啶拮抗剂(例如,氟嘧啶(例如5-氟尿嘧啶(ADRUCIL)、5-氟脱氧尿苷(FdUrd)(氟尿苷))等)和阿糖胞苷(例如CYTOSAR(ara-C)和氟达拉滨(fludarabine)等);5)酶,包括L-门冬酰胺酶和羟基脲等;6)激素,包括糖皮质素、抗雌激素(例如,他莫昔芬(tamoxifen)等)、非类固醇抗雄激素(例如,氟达拉滨(flutamide)等)和芳香酶抑制剂(例如,阿那曲唑(anastrozole)(ARIMIDEX)等);7)铂化合物(例如,顺铂和卡铂(carboplatin)等);8)与抗癌药、毒素、和/或放射性核素缀合的单克隆抗体等;9)生物反应修饰剂(例如,干扰素(例如,IFN-α等)和白介素(例如IL-2等)等);10)过继免疫疗法;11)造血生长因子;12)诱导肿瘤细胞分化的药剂(例如,全反式视黄酸等);13)基因疗法技术;14)反义疗法技术;15)肿瘤疫苗;16)针对肿瘤转移的疗法(例如,巴马司他(batimastat)等);17)血管发生抑制剂;18)蛋白体抑制剂(例如,VELCADE);19)乙酰化和/或甲基化的抑制剂(例如,HDAC抑制剂);20)NFκB的调控剂;21)细胞周期调节的抑制剂(例如,CDK抑制剂);22)p53蛋白功能的调控剂;和23)辐射。在癌症疗法背景中常规使用的任何溶瘤细胞剂(oncolyticagent)在本发明的组合物和方法中得到应用。例如,美国食品药物管理局(U.S.FoodandDrugAdministration)维持批准在美国使用的溶瘤细胞剂处方集。U.S.F.D.A.的国际对应局维持相似的处方集。表3提供了批准在美国使用的示例性抗肿瘤剂的列表。本领域技术人员应当领会,所有美国批准的化疗剂上要求的“产品标签”描述了关于示例性药剂的批准的适应症、剂量信息、毒性数据等。表3在本发明中,抗菌治疗剂也可以作为治疗剂使用。可以使用能够杀死、抑制或以其它方式削弱微生物生物体功能的任何药剂及预期具有此类活性的任何药剂。抗菌剂包括但不限于单独或组合使用的天然的和合成的抗生素、抗体、抑制性蛋白质(例如,防御素)、反义核酸、膜破裂剂等。实际上,可以使用任何类型的抗生素,包括但不限于抗细菌剂、抗病毒剂、抗真菌剂等。在又一些实施方案中,本发明提供了与能够特异地靶向特定细胞类型(例如,肿瘤细胞)的靶向剂结合的本发明化合物(和任何其它化疗剂)。一般地,与靶向剂结合的治疗性化合物经由靶向剂与细胞表面部分的相互作用而靶向癌细胞,所述细胞表面部分经由受体介导的内吞作用而被纳入细胞中。已知位于靶细胞(例如,肿瘤细胞)表面上的任何部分在本发明方面得到应用。例如,针对此部分的抗体将本发明的组合物靶向含有所述部分的细胞表面。或者,靶向性部分可以是针对细胞表面上存在的受体的配体或者反之亦然。类似地,也可以使用维生素来将本发明的治疗剂靶向至特定细胞。如本文中所使用的,术语“靶向性分子”指可用于将治疗性化合物靶向至目标细胞、组织和器官的化学基团及其部分。设想与本发明一起使用的各种类型的靶向性分子,包括但不限于信号肽、抗体、核酸、毒素等。另外,靶向性部分可以另外促进结合的化学化合物(例如,小分子)的结合或者促进化合物进入靶细胞、组织和器官中。优选地,依照其将结合的化合物选择性地递送至受试者、组织或细胞(包括特定的亚细胞位置和细胞器)内的靶位点的特异性、亲和力和功效来选择靶向性部分。各种效率问题影响着所有药物且特别是高细胞毒性药物(例如,抗癌药)的施用。特别重要的一个问题是确保所施用的药剂仅影响靶细胞(例如,癌细胞)、组织或器官。高细胞毒剂向非靶定细胞的非特异性或非有意递送可以引起严重的毒性问题。已经进行了许多尝试以设计用于解决与非特异性药物递送有关的问题的药物靶向方案。(参见例如,K.N.Syrigos和A.A.EpenetosAnticancerRes.,19:606-614(1999);Y.J.Park等,J.ControlledRelease,78:67-79(2002);R.V.J.Chari,Adv.DrugDeliv.Rev.,31:89-104(1998);及D.Putnam和J.Kopecek,Adv.PolymerSci.,122:55-123(1995))。已经使用了使靶向性部分诸如抗体和配体肽(例如,针对内皮细胞的RDG)与药物分子缀合以减轻与特定药物有关的一些伴随的毒性问题。化合物和抗癌剂可以在任何无菌的生物相容性药用载体中施用,所述生物相容性药用载体包括但不限于盐水、缓冲盐水、右旋糖和水。在一些实施方案中,本发明的药物组合物可以含有一种药剂(例如,抗体)。在其它实施方案中,药物组合物含有至少两种药剂(例如,抗体和一种或多种常规的抗癌剂)的混合物。在又一些实施方案中,本发明的药物组合物含有至少两种药剂,它们在下列一种或多种条件下对患者进行施用:以不同周期性、以不同持续时间、以不同浓度、通过不同施用路径等。在一些实施方案中,IL8-CXCR1信号转导途径拮抗剂在第二抗癌剂前施用,例如,抗癌剂施用前0.5、1、2、3、4、5、10、12或18小时,1、2、3、4、5或6天,1、2、3或4周。在一些实施方案中,IL8-CXCR1信号转导途径拮抗剂在第二抗癌剂后施用,例如,抗癌剂施用后0.5、1、2、3、4、5、10、12或18小时,1、2、3、4、5或6天,1、2、3或4周。在一些实施方案中,IL8-CXCR1信号转导途径拮抗剂和第二抗癌剂同时但按不同日程表施用,例如,每天施用IL8-CXCR1信号转导途径拮抗剂化合物,而一周一次、每两周一次、每三周一次或每四周一次施用第二抗癌剂。在其它实施方案中,一周一次施用IL8-CXCR1信号转导途径拮抗剂,而每天、一周一次、每两周一次、每三周一次或每四周一次施用第二抗癌剂。根据所治疗的疾患,配制本药物组合物的优选实施方案,并将其在全身或局部施用。用于配制和施用的技术可参见“Remington’sPharmaceuticalSciences”(MackPublishingCo,EastonPa.)的最近版本。合适的路径可以例如包括口服或经粘膜施用及胃肠外递送(例如,肌肉内、皮下、髓内、鞘内、心室内、静脉内、腹膜内或鼻内施用)。本发明设想依照可接受的药物递送方法和制备技术施用治疗剂和在一些实施方案中施用一种或多种常规的抗癌剂。例如,可以对受试者静脉内施用药学上可接受载体(诸如生理盐水)中的治疗性化合物和合适的抗癌剂。设想了用于细胞内递送药剂的标准方法(例如,经由脂质体递送)。此类方法是本领域普通技术人员所熟知的。在一些实施方案中,本发明的配制剂可用于胃肠外施用(例如,静脉内、皮下、肌肉内、髓内和腹膜内)。一些设想的抗癌剂(例如,治疗性多肽)的治疗性共施用也可以使用基因治疗剂和技术来实现。在本发明的一些实施方案中,对受试者单独施用治疗性化合物,或其与一种或多种常规的抗癌剂(例如,核苷酸序列、药物、激素等)组合施用或以组分任选地与赋形剂或其它药学上可接受载体混合的药物组合物施用。在本发明的优选的实施方案中,药学上可接受载体是生物学惰性的。在优选的实施方案中,使用本领域中公知的药学上可接受载体以适合于口服的剂量配制本发明的药物组合物。此类载体使药物组合物能够配制为片剂、丸剂、胶囊、糖衣丸、液体、凝胶、糖浆剂、膏剂、溶液、悬浮液等,受试者分别进行口或鼻摄取。口服使用的药物制剂可以如下获得,即组合活性化合物与固体赋形剂,任选地研磨所得的混合物,并在添加合适的助剂(若需要)后,将混合物加工成颗粒剂,以获得片剂或糖衣丸核。合适的赋形剂是碳水化合物或蛋白质充填剂诸如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;来自玉米、小麦、稻、马铃薯等的淀粉;纤维素,诸如甲基纤维素、羟丙基甲基纤维素或钠羧甲基纤维素;树胶,包括阿拉伯的和黄芪胶;和蛋白质,诸如明胶和胶原。若需要,可以添加崩解或增溶剂,诸如交联的聚乙烯吡咯烷酮、琼脂、藻酸或其盐,诸如海藻酸钠。在优选的实施方案中,临床医生或药理学领域的其他技术人员根据公知的药理学和治疗考虑因素(包括但不限于期望的治疗效果水平和可获得的治疗效果的实际水平)来改编剂量和施用方案。一般地,遵循用于施用化疗剂的公知药理学原理是可取的(例如,时间上超过50%且不超过每3-4个药剂半衰期时不改变剂量一般是可取的)。对于具有相对较少或无剂量相关毒性考虑的组合物,且在期望最大功效(例如,破坏癌细胞)的情况中,超过平均要求剂量的剂量不是不常见的。用于剂量的此方法通常称为“最大剂量”策略。在某些实施方案中,以每天1-40mg的剂量对受试者施用IL8-CXCR1信号转导途径拮抗剂(例如持续4-6周)。在某些实施方案中,对受试者施用15-70mg负荷剂量的IL8-CXCR1信号转导途径拮抗剂。在某些实施方案中,对受试者施用约35-45mg负荷剂量的IL8-CXCR1信号转导途径拮抗剂(例如经皮下),然后日剂量约10mg(例如经皮下),持续约4-6周。其它剂量考虑因素涉及为所施用的药剂计算合适的目标水平、药剂的积累和潜在毒性、抗性的刺激、功效的缺乏和描述药剂的治疗指数范围。在某些实施方案中,本发明设想使用滴定药剂施用的常规方法。一种常见的施用策略是在受试者中为药剂设置合理的目标水平。在一些优选的实施方案中,在受试者的血浆中测量药剂水平。然后,设计合适的剂量水平和频率以实现期望的药剂稳态目标水平。监测(例如,每小时、每天、每周等)药剂在受试者中的实际或平均水平,从而可以调节剂量水平或频率以维持目标水平。当然,所施用的一种或多种特定药剂的药动学和药效学(例如,生物利用度、清除或生物积累、生物分布、药物相互作用等)可以潜在地影响什么是被认为合理的目标水平,并且如此影响剂量水平或频率。目标水平剂量方法通常依赖于建立合理的治疗目的,其根据药剂在受试者中期望的范围(或治疗范围)限定。一般地,治疗范围的下限大致等于提供最大可能治疗效果的约50%的药剂浓度。治疗范围的上限通常根据药剂的毒性而非其功效而确定。本发明设想,特定药剂的治疗范围的上限会是小于5或10%的受试者表现出毒性副作用的浓度。在一些实施方案中,治疗范围的上限是下限的约两倍或更小。本领域技术人员应当理解,这些剂量考虑因素是高度可变的,而且在某种程度上是个别化的(例如,基于遗传素因、免疫学考虑因素、耐受性、抗性等)。因此,在一些实施方案中,药剂在特定受试者中的有效目标剂量水平可以比另一名受试者中的最佳值大1,...5,...10,...15,...20,...50,...75,...100,...200,...X%。相反,一些受试者在如下的剂量水平或频率时可能经受显著的副作用和毒性相关健康问题,所述剂量水平或频率远小于(1,...5,...10,...15,...20,...50,...75,...100,...200,...X%)通常在一些或大多数受试者中产生最佳治疗水平的那些。在缺乏更具体信息的情况中,经常在治疗范围中间设置目标施用水平。在优选的实施方案中,临床医生基于已知的药理学原理和等式来理性地设计个别化的剂量方案。一般地,临床医生基于药剂的各种药理学和药代动学特性的知识及关于药剂吸收和分布速率的信息来设计个别化的剂量方案,所述各种药理学和药代动学特性包括但不限于F(剂量的分数生物利用度)、Cp(血浆中的浓度)、CL(清除/清除率)、Vss(稳态时的药物分布容积)、Css(稳态时的浓度)和t1/2(药物半衰期)。对于这些变量的进一步解释和说明个别化剂量方案的计算的全部等式,本领域技术人员参考许多公知的药理学教材(例如,Goodman和Gilman,PharmaceuticalBasisofTherapeutics,第10版,Hardman等编著,2001)。本领域技术人员还会能够预期这些变量在个别受试者中的可能变动。例如,对F、CL和Vss,观察到的数值的标准偏差通常分别为约20%、50%和30%。可能的广泛变化参数在个别受试者中的实际效果是受试者中95%达到Css的时间和在目标水平的35和270%之间。对于具有低治疗指数的药物,这是不理想的宽范围。然而,本领域技术人员应当领会,一旦测量药剂的Cp(血浆中的浓度),便有可能直接估计F、CL和Vss的值。这使得临床医生可有效地微调特定受试者的剂量方案。在又一些实施方案中,本发明设想使用连续治疗药物监测技术来进一步调整个体的剂量方法和方案。例如,在一个实施方案中,使用Css数据来进一步改进CL/F的估计,并随后使用已知的药理学原理和等式来调整个体的维持剂量以实现期望的药剂目标水平。实际上,可以在剂量日程表期间的任何时间进行治疗药物监测。在优选的实施方案中,在剂量过程中的多个时间点,且特别在施用间歇剂量时进行检测。例如,不论所采用的剂量方法如何,可以在施用药剂的一秒、数秒、数分钟、数小时、数天、数周、数月等的分段内附随地进行药物监测(例如,间歇的剂量、负荷剂量、维持剂量、随机剂量或任何其它剂量方法)。然而,本领域技术人员应当领会,在药剂施用后迅速取样时,不可以容易地观察药剂效果和动力学的变化,因为药剂的血浆浓度变化可能被延迟(例如,由于缓慢的分布速率或其它药效学因素)。因而,药剂施用后即刻获得的受试者样本可能获得有限的或降低的值。在施用的预测稳态目标水平期间自受试者采集生物样本的主要目的是基于随后计算药剂的CL/F比率的修正估值来修改个体的剂量方案。然而,本领域技术人员应当领会,早期吸收后药物浓度通常不反映药剂清除。早期吸收后药物浓度主要由药剂的吸收速率、药剂分布的中央(而不是稳态)容积和分布速率规定。在计算治疗性长期维持剂量方案时,这些药动学特征中的每一项具有有限的值。因而,在一些实施方案中,当目的是治疗性长期维持剂量时,在已经施用先前的剂量后很久,且甚至更优选地在施用下一计划剂量前不久自目标受试者、细胞或组织获得生物样本。在又一个实施方案中,在治疗剂在各剂量间的时间间隔中被受试者几乎完全清除的情况中,则本发明设想在上一次施用后的多个时间点时,且更优选地在施用剂量后不久自受试者采集生物样本。VII.Repertaxin和其它小分子CXCR1抑制剂在某些实施方案中,本发明的方法、试剂盒和组合物采用CXCR1的小分子抑制剂。一种示例性的药剂是Repartaxin。在某些实施方案中,Repartaxin的体内剂量在每千克3和60mg之间(例如3...30...50...60mg/kg)。在具体的实施方案中,Repartaxin的剂量是每千克约30mg。下面示出了Repartaxin的化学式:在其它实施方案中,采用Repertaxin的衍生物。其它小分子CXCR1拮抗剂包括SB265610(GlaxoSmithKlineBeecham;Benson等,2000,151:196-197)及SCH527123(2-羟基-N,N-二甲基-3-{2-[[(R)-1-(5-甲基呋喃-2-基)丙基]氨基]-3,4-二氧环丁-1-烯基氨基}苯甲酰胺(SCH527123)、口服生物利用性CXCR2/CXCR1受体拮抗剂(ScheringPlough))。其它小分子抑制剂可以通过上文所描述的筛选方法来鉴别。实施例提供了以下实施例以演示并进一步例示本发明的某些优选的实施方案和方面,并且不应解释为限制其范围。实施例1CXCR1鉴别癌症干细胞本实施例描述了将CXCR1及其它蛋白质(例如,FBXO21)鉴别为癌症干细胞标志物。细胞培养。乳腺细胞系(BCL)获自ATCC(“http://WWW.lgcpromochem-atcc.com/common/catalog/cellBiology/cellBiologyIndex.cfm”)或获自S.Ethier(现在在“http://WWW.asterand.com/asterand/BIOREPOSITORY/hbreastcancercelllines.aspx”上可获得,SUM44、SUM52、SUM149、SUM159、SUM185、SUM190、SUM225、SUM229)、V.J.(BrCa-MZ-01)和V.Catros(S68)博士的实验室中开发的集合。除了MCF10A(其源自纤维囊性疾病)和HMEC衍生的184A1(其源自正常的乳腺组织)外,所测试的所有BCL源自癌瘤。使用推荐的培养条件来培养细胞系。用指数生长期的分汇合细胞进行所有实验。ALDEFLUOR测定和通过FACS来分离ALDH阳性群。在代表人乳腺癌的主要分子亚型的33种BCL中评估ALDH活性。使用ALDEFLUOR试剂盒(StemCelltechnologies,Durham,NC,USA)来分离具有高ALDH酶活性的群(17)。将自胰蛋白酶消化后的分汇合细胞系或自新鲜解离的异种移植物获得的细胞在含有ALDH底物(BAAA,每1x106个细胞为1μmol/l)的ALDEFLUOR测定缓冲液中悬浮,并于37℃温育40分钟。在每次实验中,在具有50mmol/L二乙基氨基苯甲醛(DEAB)(即一种特异的ALDH抑制剂)的相同条件下对细胞样本染色,作为阴性对照。使用FACStarPLUS(BectonDickinson)进行流式细胞术分选。以488nm激发ALDEFLUOR荧光,并使用标准的异硫氰酸荧光素(FITC)530/30带通滤波器来检测。对于异种移植的肿瘤,与抗H2Kd抗体(BDbiosciences,1/200,在冰上20分钟)温育,接着与用藻红蛋白标记的二抗(Jacksonlabs,1/250,在冰上20分钟)温育,以此来消除小鼠源的细胞。使用存活力方面经PI染色的细胞、经ALDEFLUOR染色的用DEAB处理的细胞和那些仅用二抗染色的细胞建立分类闸。在RNA序型分析或NOD/SCID小鼠注射前,使用BrCa-MZ-01和SUM159细胞系中的10,000个ALDEFLUOR阳性和阴性细胞的双重分选来检查分选群的纯度。对于这两种细胞系,分选的ALDEFLUOR阳性群含有超过98%的ALDEFLUOR阳性细胞,而在ALDEFLUOR阴性群中没有检测出ALDEFLUOR阳性细胞。NOD/SCID小鼠中的致肿瘤性。在NOD/SCID小鼠中评估ALDELFUOR阳性、阴性和未分离的SUM159、MDA-MB-453和BrCa-MZ-01细胞的致肿瘤性。在青春期前3周龄时将脂肪垫除去上皮,并通过注射人成纤维细胞(1∶1辐射的∶未辐射的,50,000个细胞/100μl基质胶/脂肪垫)来使其人源化,如所描述的(17)。在肿瘤为最大直径1.2cm时,依照脊椎动物研究用途条例(regulationsforuseofvertebrateanimalinresearch)对动物实施安乐死。将每个脂肪垫的一部分在福尔马林中固定,并包埋在石蜡中以用于组织学分析。通过ALDEFLUOR测定,接着分选和连续移植来评估另一部分。贴壁不依赖性培养。将来自184A1、SUM149和SUM159的ALDEFLUOR阳性、阴性和未分离的细胞在超低附着板(Corning,Acton,MA)中以低密度(5000个活细胞/ml)铺板为单细胞。在无血清乳腺上皮基础培养基(CambrexBioScience,Walkerville,MD)中将细胞培养3-7天,如所描述的(18)。在用向培养基中添加的不同剂量的IL8(GenWayBiotech,SanDiego,CA)处理后量化细胞形成球的能力。RNA提取。使用DNA/RNAAllPrepMaxi试剂盒依照制造商的说明(Qiagen,SampleandAssaytechnologies,TheNetherlands)自冷冻的ALDEFLUOR阳性和阴性细胞中提取总RNA。使用8种BCL进行转录分析:184A1、BrCa-MZ-01、HCC1954、MDA-MB-231、MDA-MB-453、SK-BR-7、SUM149和SUM159。通过变性甲醛琼脂糖凝胶电泳和微量分析(AgilentBioanalyzer,PaloAlto,CA)来控制RNA完整性。用DNA微阵列进行的基因表达谱分析。基因表达分析使用AffymetrixU133Plus2.0人寡核苷酸微阵列,其含有超过47,000种转录物和变体,包括38,500种充分表征的人基因。进行cRNA的制备、杂交、清洗和检测,如供应商所推荐的(http://WWW.affymetrix.com/index.affx)。使用Bioconductor及相关包(19)通过R中的RMA(稳健多芯片平均(RobustMultichipAverage))方法来分析表达数据,如所描述的(20,21)。RMA进行背景调整、分位数标准化和每种基因11个寡核苷酸的汇总。分析前,过滤方法从数据集除去具有低的且测量较差的表达的基因,如通过所有16种样本中次于100个单位的表达值所定义的,这保留25,285种基因/EST。应用第二滤器(其基于标准偏差(SD)的强度)进行无监督分析以排除在分析间显示低表达变化的基因。对经log2转化的数据计算SD,其中首先对最小数值压低至最小数值100个单位,即背景强度,保留具有优于0.5的SD的13,550种基因/EST。在13,550种基因上对16种ALDEFLUOR阳性、阴性细胞进行无监督分析。在分级聚类前,将经过滤的数据进行log2转化,并提交给聚类程序(22),其使用基因上中值居中的数据、Pearson相关性作为相似性度量和形心联接聚类来进行。使用TreeView程序(22)来展示结果。为了鉴别并分级区别ALDEFLUOR阳性和阴性群的基因,将Mann和WhitneyU检验应用于25,285种基因/EST,并使用假发现率(FDR,(23)来修正多重检验假设。通过分级聚类来分类样本,从而说明辨别者标签的分类权(classificationpower)。应用LOOCV以评估所鉴别分子标签的预测准确性和监督分析的有效性;一个接一个地排除每个样本,并通过使用未排除样本上限定的模型用线性判别分析(LDA,(24)来分类。实时RT-PCR。分选来自不同细胞系的ALDEFLUOR阳性和ALDEFLUOR阴性群后,使用RNeasyMini试剂盒(QIAGEN)来分离总RNA,并利用其在具有384孔区组模块和自动化附属物的ABI7900HT序列检测系统(AppliedBiosystems)中进行实时定量RT-PCR(qRT-PCR)测定。用于Taqman系统的引物和探针选自AppliedBiosystems网站。用于CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1和TBP的PCR引物对和发荧光探针的序列在AppliedBiosystems网站上可获得(CXCR1测定ID:Hs_00174146_mi;FBXO21测定ID:Hs_00372141_mi,NFYA测定ID:Hs_00953589_mi,NOTCH2测定ID:Hs_01050719_mi,RAD51L1测定ID:Hs00172522_mi,TBP测定ID:Hs_00427620_mi)。相对于内部标准TBP基因来计算CXCR1、FBXO21、NFYA、NOTCH2、RAD51L1的相对表达mRNA水平以标准化RNA质量和输入cDNA量的变化,如先前所描述(25)。侵袭测定。在用于12孔板(Corning,NY)的具有8um孔聚碳酸酯滤膜插入物的Transwell室中一式三份进行测定。用DMEM/F12中的30ul冰冷的1∶6基底膜提取物(基质胶,BD-Bioscience)包被滤膜,所述DMEM/F12于37℃温育1小时。将细胞添加至200ul无血清培养基中的上室。对于侵袭测定,将5000个细胞接种在经基质胶包被的滤膜上,并用600ul补充有10%人血清的培养基(Cambrex)或600ul补充有IL8(100ng/mL)的无血清培养基装满下室。温育48小时后,使用光学显微术来计算滤膜下侧上的细胞。血清条件下,将相对侵袭标准化为未分开的相应细胞系。慢病毒感染。对于萤光素酶基因转导,将来自HCC1954、MDA-MB-453和SUM159的70%汇合细胞与培养基中的1∶3沉淀的慢病毒上清液Lenti-LUC-VSVG(VectorCore,AnnArbor,MI)混合物一起温育过夜。次日,通过胰蛋白酶/EDTA收获细胞,并以1∶6的比率进行传代培养。温育1周后,依照ALDEFLUOR表型来分选细胞,并如下在每个分选群(ALDEFLUOR阳性和ALDEFLUOR阴性)中验证萤光素酶表达,即在培养基中添加2mlD-萤光素0.0003%(Promega,Madison,WI),并通过装置照相机系统(Xenogen,Alameda,CA)来计算光子通量。心脏内接种。用2%异氟烷/空气混合物麻醉6周龄NOD/SCID小鼠,并在心脏左心室中注射100μL缺乏Ca2+和Mg2+的无菌杜伯科氏(Dulbecco’s)PBS中的100,000个细胞。对于三种细胞系(HCC1954、MDA-MB-453、SUM159)之每种及对于每个群(ALDEFLUOR阳性、ALDEFLUOR阴性和未分选的),注射三只动物。生物发光检测。在接种前及接种之后每周评估初始生物发光。用2%异氟烷/空气混合物麻醉小鼠,并i.p.给予PBS中的单剂150mg/kgD-萤光素(Promega,Madison,WI)。然后,在施用D-萤光素后6分钟,再次麻醉动物。对于光子通量计数,将电荷耦合装置照相机系统(Xenogen,Alameda,CA)与鼻锥异氟烷递送系统和用于维持体温的加热台一起使用。在暴露2至12分钟后使用具有Xenogen成像系统的LivingImage软件来分析结果。信号强度量化为数据后处理过程中手工放置的目标一致区域内的所有检出的光子通量计数的总和。标准化的光子通量代表接种后每周检测出的光子通量与接种前检测出的光子通量的比率。统计学分析。结果呈现为对于每组的至少三个重复的单个实验的均值±SD。统计学分析使用SPSS软件(第10.0.5版)。对独立的样本用Fisher精确检验或单因素ANOVA或来计算样本组与分子参数之间的相关性。认为p值*0.05是显著的。大多数乳腺细胞系含有ALDEFLUOR阳性群。使用ALDEFLUOR测定(17)从代表乳腺癌的多样性分子亚型和特征的33种BCL中分离CSC(20)。发现,33种细胞系中有23种含有ALDEFLUOR阳性细胞群,其范围为0.2至几乎100%。所有16种基底/间充质BCL含有ALDEFLUOR阳性群,而12种腔BCL中有7种不含任何可检出的ALDEFLUOR阳性细胞(p=0.0006,Fischer精确检验)。ALDEFLUOR阳性细胞具有肿瘤球形成能力。先前报告了,乳腺上皮干细胞和祖细胞能够在贴壁不依赖性条件中存活并增殖,而且形成称作乳腺球的漂浮的球形集落(18)。来自乳腺肿瘤及细胞系的数据已经证明了,也可以分离癌症干细胞样细胞或癌症起始细胞,并在相似的测定中以“肿瘤球”增殖(26)。正常人乳腺中的所有乳腺球起始细胞包含在ALDEFLUOR阳性群内(17)。为了表征来自BCL的ALDEFLUOR阳性群,比较来自184A1、SUM149和SUM159的ALDEFLUOR阳性和阴性群形成肿瘤球的能力。在每种细胞系中,与ALDEFLUOR阴性细胞相比,ALDEFLUOR阳性群显示升高的肿瘤球形成能力。ALDEFLUOR阳性BCL细胞在体内具有癌症干细胞特性。为了测定BCL的分级组织,分析MDA-MB-453、SUM159和BrCa-MZ-01细胞系的ALDEFLUOR阳性和阴性群的干细胞特性。这三种BCL的ALDEFLUOR阳性群构成总细胞群的3.54±1.73%和5.49±3.36%之间(图1A-B,G-H;图2A-B)。如图1F,L中所显示的,肿瘤形成的大小和潜伏期与注射的ALDEFLUOR阳性细胞的数目相关。显著地,来自MDA-MB-453的500个ALDEFLUOR阳性细胞和来自SUM159的1,000个ALDEFLUOR阳性细胞能够形成肿瘤。在连续传代过程中维持肿瘤生成能力,这表明这些细胞的自我更新能力。比较而言,ALDEFLUOR阴性细胞不能生成肿瘤,虽然在注射50,000个ALDEFLUOR阴性MDA-MB-453细胞时产生有限的生长。脂肪垫切片的H&E染色确认由ALDEFLUOR阳性细胞形成的肿瘤含有恶性细胞,而在ALDELFUOR阴性细胞注射部位处仅看到残留的基质胶、凋亡细胞和小鼠组织(图1E,K)。与具有癌症干细胞特征的ALDEFLUOR阳性群一致,由此群形成的肿瘤以相似的ALDEFLUOR阳性和阴性细胞比率重现初始肿瘤的表型异质性(图1C,I)。这表明ALDEFLUOR阳性细胞能够自我更新,生成ALDEFLUOR阳性细胞,并能够分化,生成ALDEFLUOR阴性细胞。在将BrCa-MZ-01细胞分成ALDEFLUOR阳性和阴性组分时,这两者都能够生成肿瘤。由ALDEFLUOR阳性群生成的肿瘤由重现初始肿瘤的表型异质性的ALDEFLUOR阳性和阴性细胞组成。比较而言,由ALDEFLUOR阴性细胞生成的肿瘤引起缓慢生长的肿瘤,其仅含有ALDEFLUOR阴性细胞。与要连续移植的ALDEFLUOR阳性细胞的能力形成对比,ALDEFLUOR阴性肿瘤的连续传代产生降低的肿瘤生长,在三次传代后没有生长。这提示BrCa-MZ-01细胞的ALDEFLUOR阳性组分含有具有干细胞特性的细胞,而ALDEFLUOR阴性细胞含有能够经历有限生长但不能自我更新的祖细胞。ALDELFUOR阳性和阴性细胞群的基因表达谱。为了测定自不同BCL分离的ALDEFLUOR阳性细胞是否表达共同的一组“癌症干细胞”基因,使用Affymetrix全基因组寡核苷酸微阵列来分析自8种BCL(184A1、BrCa-MZ-01、HCC1954、MDA-MB-231、MDA-MB-453、SK-BR-7、SUM49和SUM159)分离的ALDEFLUOR阳性和阴性细胞群。非监督分级聚类(其应用于16种样本和13,550种经过滤基因/EST)没有分开ALDEFLUOR阳性和阴性群。取而代之,ALDEFLUOR阳性和阴性群与亲本细胞系一起聚类。这提示克隆细胞系之间的mRNA转录物差异代替ALDEFLUOR阳性和ALDEFLUOR阴性细胞之间的差异。这进一步提示,仅有限数目的基因在推定的癌症干细胞与其后代间差别表达。为了测定哪些基因区别ALDEFLUOR阳性和阴性群,将Mann和WhitneyU检验应用于除具有低的且测量较差的表达的那些基因外的所有基因,即25,285个探针组。此检验在FDR修正后鉴别并分级区别ALDEFLUOR阳性与阴性细胞群的413种基因/EST。表1中显示了28种与独特基因对应的过表达基因,而表2中显示了最经常表达不足的基因。表1上调基因表2下调基因通过用413种差别表达的基因/EST来分类16种ALDEFLUOR阳性和阴性样本,从而说明此区别性标签的分类权。分级聚类分级16种样本中的15种(图2A)。已知在干细胞生物学中发挥作用的许多基因在ALDEFLUOR阳性群中受到上调(表1),包括NFYA、NOTCH2、PCNX、RBM15、ST3GAL3和TPRXL。其它基因编码在干细胞功能上具有推定的或未表征的作用的蛋白质,诸如ARID1B、RAD51L1和趋化因子受体CXCR1/IL8RA(27)。ALDEFLUOR阳性群中表达不足的基因参与细胞分化、凋亡、RNA剪接和线粒体代谢。为了提高分析的严格性,将Mann和Whitney分析的阈值提高至风险0.5,并获得区别ALDELFLUOR阳性和阴性群的49种基因/EST的列表(表1-2中具有星号的基因)。凭借此列表,所有ALDEFLUOR阳性细胞(除了SK-BR-7外)聚集在一起。这49种基因/ESTS中,45种对应于鉴别的独特基因;这45种仅有3种在ALDEFLUOR阳性组中过表达,而42种表达不足。表征的过表达基因编码F框蛋白FBXO21和CXCR1/IL8RA。表达不足的基因包括编码线粒体蛋白质(MRPL41、MRPL42、MRPL47、MRPL54、MRPS23、IMMP1L)及分化(NACA)和前mRNA剪接因子(LSM3、前mRNA加工因子PRPF39和PRPF4B)的那些。风险为0.5%的弃一法交叉验证(LOOCV)评估鉴别者分子标签的预测准确性,并且用此“癌症干细胞标签”在正确的种类中预测88%的样本,这确认监督分析。定量RT-PCR评估确认ALDEFLUOR阳性细胞中的CXCR1和FBXO21的显著增加。对ALDEFLUOR阳性群中过表达的5种鉴别基因(CXCR1/IL8RA、FBXO21、NFYA、NOTCH2和RAD51L1)进行定量RT-PCR分析。通过ALDEFLUOR测定来分选谱分析中使用的3种细胞系(BrCa-MZ-01、MDA-MB-453、SUM159)和两种另外的腔细胞系(MCF7、S68),并分别处理ALDEFLUOR阳性和阴性群,用于定量RT-PCR分析。图2B和C中呈现了CXCR1和FBXO21的定量RT-PCR表达水平。通过定量RT-PCR测定的基因表达水平确认使用DNA微阵列获得的结果,其中与ALDEFLUOR阴性群相比,ALDEFLUOR阳性群中的CXCR1和FBXO21mRNA水平升高(p<0.05)。IL8促进癌症干细胞自我更新。谱研究提示,IL8受体CXCR1/IL8RA在ALDEFLUOR阳性细胞群中一致表达。为了确认此关联,在ALDEFLUOR阳性和阴性群中通过流式细胞术测量CXCR1/IL8RA的蛋白质表达。将来自4种不同细胞系的ALDEFLUOR阳性和阴性群通过FACS来分离、固定,并用经藻红蛋白标记的CXCR1单克隆抗体染色。如图3A所示,与ALDEFLUOR阴性群相比,ALDEFLUOR阳性细胞在CXCR1阳性细胞中高度富集。为了测定IL8信号转导在干细胞功能中是否是重要的,用人重组IL8处理4种BCL以测定其对癌症干细胞群的影响,如通过肿瘤球形成和通过ALDH酶活性所测量的。如图3B所示,IL8的添加以剂量依赖性方式提高原代和继代肿瘤球的形成。此外,IL8在4种所分析的BCL之每种中以剂量依赖性方式增加ALDEFLUOR阳性群(图3C)。这说明“CSC标签”鉴别可在干细胞功能中发挥作用的途径的能力。IL8/CXCR1轴参与癌症干细胞侵袭。已经报道IL8/CXCR1轴在癌症干细胞侵袭中发挥作用(28,29)。使用血清作为引诱物,利用基质胶侵袭测定以检查来自三种不同细胞系(HCC1954、MDA-MB-453、SUM159)的ALDEFLUOR阳性和阴性细胞群的侵袭能力。如图4A所示,表明ALDEFLUOR阳性细胞侵袭通过基质胶比ALDEFLUOR阴性群高6至20倍(p<0.01)。在作为化学引诱物使用时,IL8(100ng/ml)提高ALDEFLUOR阳性细胞的侵袭(p<0.05)(图4A)。与其对ALDEFLUOR阳性细胞的影响形成对比,IL8对ALDEFLUOR阴性细胞的侵袭能力没有任何影响。这些结果表明,癌症干细胞表现出侵袭行为,而且IL8促进此过程。ALDEFLUOR阳性细胞具有提高的转移潜力。已经提出,CSC在癌症转移中发挥至关重要的作用(30,31)。上述实验证明,与ALDEFLUOR阴性细胞相比,ALDEFLUOR阳性细胞具有提高的侵袭能力。为了确定ALDEFLUOR阳性与转移能力之间的关系,用萤光素酶慢病毒报告系统感染HCC1954、MDA-MB-453和SUM159。使用ALDEFLUOR测定来分选经萤光素酶感染的细胞,并通过心脏内注射导入NOD/SCID小鼠中。注射来自每个群的100,000个细胞的悬浮液,并通过生物发光成像来评估转移。接种有ALDEFLUOR阳性细胞的小鼠在不同部位形成转移,而且相比接种有未分离的细胞的小鼠(每只小鼠形成不超过一次转移)或接种有ALDEFLUOR阴性细胞的小鼠(其仅形成限于淋巴结的偶发转移),接种有ALDEFLUOR阳性细胞的小鼠表现出更高的光子通量发射(图4B-J)。组织学切片确认这些部位处的转移存在(图4K-M)。如此,BCL的转移能力主要由ALDEFLUOR阳性群中含有的CSC介导。肿瘤在由CSC驱动的细胞分级中组织的假设具有癌症生物学的基础含意及用于癌症早期检测、预防和治疗的临床含意。CSC的证据很大程度上依赖于初始和早期传代异种移植物模型(32-34)。然而,建立乳腺肿瘤异种移植物的成功率特别对于某些分子亚型还是很低。与原发性肿瘤形成对比,细胞系以无限量获得,而且仅为分子分析提供癌瘤性群,而没有正常组织和间质。在乳腺癌中,已经生成了大量的永生化细胞系,其代表原发性人乳腺癌中发现的不同分子亚型(2,20)。然而,关于这些细胞系能够如何接近地重现人乳腺癌生物学的基础问题仍然存在。细胞系中的干细胞的体内证据。最近的研究已经提示了,虽然可以通过克隆衍生细胞系,但是它们含有代表细胞分化的不同阶段的细胞分级。数项研究已经利用标志物(诸如CD44+/CD24-)来鉴别乳腺癌细胞系内的CSC。然而,其效用受到如下观察结果的限制,即细胞系内百分比较大的细胞经常表达这些假定的干细胞标志物。例如,基础乳腺癌细胞系中大于90%的细胞表现CD44+/CD24-表型。实际上,CD44+/CD24-表型没有分离这些细胞系的致肿瘤性群(Ginestier等Cell干细胞1:555-567.,其内容全文以引用的方式并入)。一种备选方法已经使用来自细胞系的SP。然而,利用Hoechst染色的功能研究受到此药剂的毒性限制(35)。还有SP内不含功能性干细胞活性的证据(36)。通过ALDEFLUOR测定评估的ALDH活性自多种癌症中分离具有干细胞特性的细胞(14,37)。在本实施例中,证明33种BCL(主要是基底细胞系)中有23种含有ALDEFLUOR阳性群。ALDEFLUOR阳性群在一些腔BCL中的缺乏可以表明这些腔BCL源自ALDEFLUOR阴性祖细胞。本实施例利用NOD/SCID小鼠中的体内测定来证明ALDEFLUOR阳性群的干细胞特性。通过NOD/SCID小鼠中的连续传代来证明自我更新,而通过ALDEFLUOR阳性而非ALDEFLUOR阴性细胞再生初始肿瘤的细胞异质性的能力来证明分化。乳腺癌干细胞标签。利用8种乳腺细胞系,本实施例鉴别出413种基因,其表达区别ALDEFLUOR阳性和阴性细胞。此标签含有已知在干细胞生物学中发挥作用的许多基因。ALDEFLUOR阳性群中过表达的基因包括Notch同系物2(NOTCH2)(其调节乳腺干细胞的自我更新和分化(18,38))、NFYA(已知其调节干细胞的自我更新和分化(39,40))、pecanex同系物PCNX、RBM15/OTT(其在造血干细胞中发挥多效性作用(41),而且经由NOTCH信号转导来影响髓样分化(42))、参与胚胎发育的同源框样因子TPRXL、ST3GAL3(其编码与胚胎发育及肾和胃致癌作用有关的阶段特异性胚胎抗原-4合酶(43))。显著地,阶段特异性胚胎抗原-4蛋白(SSEA-4)在干细胞群中表达,诸如人脐带血中的CXCR4+/CD133+/CD34+/lin-干细胞和静止乳腺干细胞(44)。ALDEFLUOR阳性群中表达不足的基因参与细胞分化、凋亡和线粒体氧化。它们包括编码下列蛋白质的基因:与初生多肽相关的复合物α亚基NACA、编程性死亡蛋白PDCD5和PDCD10、线粒体核糖体蛋白L41(MRPL41)(其经由BCL2和半胱天冬酶经由P53依赖性和不依赖性方式诱导凋亡)和参与线粒体加工诸如线粒体中的氧化磷酸化(NDUFA2、ATP5J2、IMMP1L)和蛋白质合成(MRPL42、MRPL47、MRPL54、MRPS23)的蛋白质。CSC中的凋亡基因的下调可以在这些细胞对辐射和化学疗法的抗性方面发挥作用(45,46)。ALDH1A1没有鉴别为ALDEFLUOR阳性标签中的差别表达基因。然而,对个别BCL的基因表达谱的检查揭示,虽然一些显示ALDH1A1在ALDEFLUOR阳性群中的差别表达,但其它显示ALDH1A3(即一种不同ALDH同种型)在此群中的差别表达。这提示不同ALDH同种型的表达可以有助于ALDEFLUOR阳性表型。从趋化因子至“干细胞因子(stemokine)”。CXCR1(一种IL8受体)的表达在多种癌症中是升高的(47-50)。虽然IL8表达与ER阴性乳腺癌有关(51),但是先前尚未报道此趋化因子在干细胞功能中发挥作用。其在调节生长和转移方面的含义在雄激素依赖性前列腺癌中得到完善建立(52)。此外,IL8的表达水平经由VEGF生成和血管生成与致肿瘤性和转移有关(53,54)。以三种方式验证基因表达数据。第一种,定量RT-PCR分析确认在来自谱分析中包含和不包含的细胞系的ALDEFLUOR阳性群中CXCR1mRNA显著升高。第二种,使用流式细胞术证明,仅在ALDEFLUOR阳性群内找到含有CXCR1的细胞。第三种,重组IL8提高乳腺球形成和ALDEFLUOR阳性细胞在BCL中的百分比。如此,IL8/CXCR1轴似乎调节乳腺干细胞增殖或自我更新。因为内皮和基质细胞分泌IL8,所以此趋化因子似乎在介导肿瘤干细胞与肿瘤微环境间的相互作用中发挥作用。最近的研究已经提示了白介素/趋化因子在调节CSC中的作用(55,56)。这包括IL6在乳腺CSC中和IL4在介导结肠CSC的化学抗性中的作用(56-59)。这些因子可能参与炎症与癌症之间的关联。这还包括CCL5(RANTES),即一种由间充质干细胞分泌的趋化因子的作用,其充当旁分泌分子,而且增强乳腺癌细胞运动性、侵袭和转移(55)。转移的根源。CSC可能负责介导肿瘤转移。首先通过使用前列腺癌的转基因小鼠模型和癌症患者中的转移性和原发性肿瘤的比较谱鉴别产生的11种基因标签中的干细胞基因来提示CSC与转移之间的联系(60)。此标签也是多种癌症类型中的疾病复发、治疗后死亡和远距离转移的一种有力的预测物。本实施例已经证明了,ALDEFLUOR阳性细胞比ALDEFLUOR阴性细胞更具转移性,而且IL8(先前报道其在肿瘤转移中发挥作用)促进优先表达IL8受体CXCR1的癌症干细胞的侵袭和趋化性。自细胞系分离转移癌干细胞的能力应当便于研究癌症干细胞介导肿瘤转移的分子机制。实施例2CXCR1抑制和组合疗法本实施例描述了用于测试CXCR1抑制对肿瘤细胞的影响的多种方法,以及CXCR1抑制与抗有丝分裂剂(多西他赛)的组合。CXCR1抑制对细胞生长和对SUM159细胞系的ALDEFLUOR阳性群的影响。将SUM159细胞系在黏附条件中培养,并使用CXCR1/CXCR2抑制剂Repertaxin或两种对CXCR1或CXCR2特异的阻断抗体来处理细胞。处理4天后,使用MTT测定来分析对细胞生长的影响(图5A),并使用ALDEFLUOR测定来分析对癌症干细胞群的影响(图5B)。在用Repertaxin或CXCR1阻断抗体处理的细胞中观察到超过95%的细胞生长抑制,而对用CXCR2阻断抗体处理的细胞没有观察到效果(图5A)。有趣的是,对ALDEFLUOR阳性群观察到相似的效果,其中用Repertaxin和CXCR1阻断抗体处理的细胞中的ALDEFLUOR阳性群分别降低80%和50%(图5B)。Repertaxin处理诱导由FAS/FAS配体信号转导介导的旁观者效应将SUM159细胞系细胞在黏附条件中培养,然后单独用Repertaxin处理或与FAS拮抗剂组合处理。有趣的是,通过Repertaxin处理诱导的细胞生长抑制通过添加FAS拮抗剂(来自BDpharmingen的抗/Fas配体(产品目录编号556371))而得到部分挽救。此外,用FAS激动剂处理的细胞与用Repertaxin处理的细胞表现出相似的细胞生长抑制。这些结果表明Repertaxin处理诱导由FAS/FAS配体信号转导介导的旁观者效应。Repertaxin处理对FAK、AKT和FOXOA3活化的影响。为了评估Repertaxin处理对CXCR1下游信号转导的影响,在2天期间内,在没有或存在100nMRepertaxin的情况中将SUM159细胞在黏附条件中培养,并用针对p-FAK、p-AKT和FOXOA3的抗体通过免疫荧光来染色。在未处理的细胞中(图7A),检测出30%的表达p-FAK的细胞和10%的表达p-AKT的细胞表现失活,而用Repertaxin处理的细胞表现p-FAK和p-AKT的完全失活(图7B)。未处理的SUM159细胞呈现80%的细胞的胞质中FOXOA3呈阳性。有趣的是,用Repertaxin处理的SUM159细胞呈现80%的细胞的细胞核中FOXOA3呈阳性。从胞质至细胞核的FOXOA3细胞定位变化表明FOXOA3蛋白的活化。用Repertaxin、多西他赛或组合治疗后的肿瘤生长曲线使用一种乳腺癌细胞系(8A,SUM159)和自不同患者生成的三种人乳腺癌异种移植物(8B,MC1;8C,UM2;和8D,UM3)来评估Repertaxin、多西他赛或其组合的效果。对于每种样本,将50,000个细胞注射到被监测肿瘤大小的NOD-SCID小鼠的乳腺脂肪垫中。在肿瘤大小为约4mm时开始注射。将Repertaxin一天两次注射(15mg/Kg)28天或一周一次注射,将多西他赛I.P.注射(10mg/Kg),或者采用组合(Repertaxin/多西他赛)。图8显示了每种指定处理过程前和期间的肿瘤大小(箭头,开始处理)。对每种样本(SUM159、MC1、UM2、UM3)观察到相似的结果,其中与对照相比,在单独用多西他赛治疗或组合Repertaxin/多西他赛治疗时肿瘤大小在统计学上显著降低(p<0.01),而在对照肿瘤和用Reperataxin治疗的肿瘤的生长之间没有观察到显著的差异。通过ALDEFLUOR测定评估Repertaxin、多西他赛或组合处理对癌症干细胞群的影响通过ALDEFLUOR测定来评估ALDH活性,用于分析用Repertaxin、多西他赛或组合处理的每种肿瘤(9A.SUM159,9B.MC1,9C.UM2,9D.UM3)中的癌症干细胞群大小。对每种样本观察到相似的结果。与对照相比,经多西他赛处理的肿瘤异种移植物显示相似或增加百分比的ALDEFLUOR阳性细胞,而与对照相比,单独用Repertaxin或与多西他赛组合处理产生统计学上显著减少的ALDEFLUOR阳性细胞及少65%至85%的癌症干细胞(p<0.01)。通过植入继代小鼠评估Repertaxin、多西他赛或组合处理对癌症干细胞群的影响。将自未处理(对照)和用Repertaxin、多西他赛或组合处理的原发性肿瘤获得的细胞(10A.SUM159,10B.MC1,10C.UM2,10D.UM3)的连续稀释植入继代NOD-SCID小鼠的乳房脂肪垫中。经对照和多西他赛处理的所有稀释的原发性肿瘤形成继发性肿瘤,而仅较高浓度的用Reperatxin或与多西他赛组合处理的原发性肿瘤能够形成延迟的继发性肿瘤,其在大小上比经对照和多西他赛处理的肿瘤显著更小(p<0.01)。此外,对于4种样本中的3种(SUM159、UM2、UM3),1000和100个用组合初始处理的细胞不能形成继发性肿瘤。Repertaxin处理降低SUM159细胞系的转移潜力用表达萤光素酶的慢病毒感染SUM159细胞系,并在NOD/SCID小鼠的心脏中接种250,000个经萤光素酶感染的细胞。将小鼠分成两组。心脏内注射后12小时,通过在28天期间每天两次s.c.注射盐水溶液或s.c.注射Repertaxin(15mg/kg)来治疗两组小鼠。使用生物发光成像来监测转移形成(11B:用盐水溶液治疗的小鼠;11C:用Repertaxin治疗的小鼠)。接种后以每周的时间间隔测量的标准化光子通量的量化揭示,与用Repertaxin治疗的小鼠组相比,用盐水溶液治疗的小鼠组中的转移形成在统计学上显著升高(11A)。实施例3通过CXCR1阻断来处理癌症干细胞本实施例经由体外测定和小鼠模型证明CXCR1抑制对肿瘤细胞的影响。乳腺组织的解离。将100-200g来自乳房复位成形术的正常乳腺组织用手术刀切碎,酶促解离,并将单细胞在悬浮液中培养以生成乳腺球或者在胶原基底上黏附条件中培养以诱导细胞分化(Dontu等GenesDev.17:1253-1270.,其内容全文以引用的方式并入本文)。细胞培养。使用推荐的培养条件来培养乳腺癌细胞系(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。用Repertaxin(Sigma-Aldrich)、抗人CXCR1小鼠单克隆抗体(克隆42705,R&Dsystems)、抗人CXCR2小鼠单克隆抗体(克隆48311,R&Dsystems)、抗人CD95小鼠单克隆抗体(克隆DX2,BDPharmingen)(作为FAS信号转导激动剂)、抗人FAS配体小鼠单克隆抗体(克隆NOK-1,BDpharmingen)(作为FAS信号转导拮抗剂使用),或用多西他赛(Taxotere,Sanofi-Aventis)在黏附条件中处理乳腺癌细胞系。细胞存活力。对于MTT测定,将细胞以每孔5,000个细胞在黏附条件中分配在96孔板中。1天后,开始用Repertaxin处理。通过在每孔中添加20μlMTT溶液(5mg/mL在PBS中)在不同时间点时评估Repertaxin处理对细胞存活力的影响。然后,将细胞于37℃温育1小时,接着将50μLDMSO添加至每孔。在荧光分析仪(Spectrafluor,Tecan)中以560nm测量吸光度。对于TUNEL测定,将细胞以每孔50,000个细胞在黏附条件中分配在6孔板中。1天后,开始用Repertaxin处理。4天处理后评估凋亡细胞的数目。将细胞在3.7%甲醛中固定,并利用TACSTdT试剂盒(R&Dsystems)来染色。用DAPI/antifade(Invitrogen)对细胞核进行复染。用荧光显微镜(Leica,Bannockborn,IL,USA)检查切片,其中凋亡细胞以绿色检出。ALDEFLUOR测定。使用FACStarPLUS(BectonDickinson),使用ALDEFLUOR试剂盒(StemCelltechnologies)来分离具有高ALDH酶活性的群,如先前所描述的(Ginestier等CellStemCell1:555-567.,其内容全文以引用的方式并入本文)。为了从异种移植的肿瘤中清除小鼠起源的细胞,用抗H2Kd抗体(BDbiosciences,1/200,在冰上20分钟)对细胞群染色,接着用经藻红蛋白(PE)标记的二抗(Jacksonlabs,1/250,在冰上20分钟)染色。ELISA测定。为了测量用或不用Repertaxin处理的细胞的培养基中分泌的可溶性FAS配体的水平,利用人sFAS配体Elisa(BenderMedsystems)。使用450nm作为主波长在分光光度计上读取吸光度。Western印迹。将细胞在Laemmli缓冲液中溶解,并加载到SDS-聚丙烯酰胺凝胶上。将印迹与在TBST(含有0.1%Tween20和2%BSA)中稀释的各自的一抗于4℃温育过夜,或于室温温育2小时。清洗印迹,并与合适的二抗(GEHealthcare,UK)一起温育,并使用SuperSignalWestPico化学发光底物(Pierce)来检测。免疫染色。对于免疫荧光染色,于-20℃用95%甲醇将分选的CXCR1阳性细胞固定10分钟。在PBS中对细胞进行再水合,并于室温与各自的抗体一起温育1小时。所使用的一抗是P-FAK(1∶50,CellSignalingTechnology)、P-AKT(1∶300,CellSignalingTechnology)和FOXO3a(1∶250,CellSignalingTechnology)。然后,清洗载玻片,并与缀合有PE的二抗(Jacksonlabs)一起温育30分钟。用DAPI/antifade(Invitrogen)对细胞核进行复染并盖上盖玻片。用荧光显微镜(Leica,Bannockborn,IL,USA)检查切片。在石蜡切片上进行免疫组织化学以检测ALDH1(1∶100,BDbiosciences)、P-FAK、P-AKT、FOXO3a表达(Ginestier等Am.JPathol.161:1223-1233.,其内容全文以引用的方式并入本文)。利用Histostainplus试剂盒(Zymedlaboratories)进行染色。使用二氨基联苯胺(DAB)或3-氨基-9-乙基咔唑(AEC)作为色原,并用苏木精对切片进行复染色。动物模型。在NOD/SCID小鼠中评估ALDELFUOR阳性/CXCR1阳性和ALDEFLUOR阳性/CXCR1阴性SUM159细胞的致肿瘤性(Ginestier等Cell干细胞1:555-567.,其内容全文以引用的方式并入本文)。利用SUM159细胞系和自三名不同患者生成的3种原发性人乳腺癌异种移植物(MC1、UM2、UM3)来测定Repertaxin处理对肿瘤生长的功效(Ginestier等CellStemCell1:555-567.,其内容全文以引用的方式并入本文)。将来自这些肿瘤的细胞同位移植到NOD/SCID小鼠的人源化的清除过的脂肪垫(clearedfat-pad)中,而不进行体外培养。如先前所描述的(Ginestier等CellStemCell1:555-567.,其内容全文以引用的方式并入本文)制备脂肪垫。将来自每种异种移植物的50,000个细胞注射到NOD/SCID小鼠的人源化脂肪垫中,并监测肿瘤生长。在肿瘤大小为约4mm时,开始单独用Repertaxin(s.c.,15mg/Kg,一天两次,在28天期间)、单独用多西他赛(i.p.,10mg/Kg,一周一次,在4周期间)、组合(Repertaxin/多西他赛)治疗或用盐水注射对照组(i.p.,一周一次及s.c.一天两次,在28天期间)。在肿瘤为最大直径约1.5cm时,对动物实施安乐死,以避免肿瘤坏死,并依照脊椎动物研究用途条例。将所注射的每个脂肪垫的一部分在福尔马林中固定,并在石蜡中包埋,用于组织学分析。将剩余部分的肿瘤细胞再移植到继代NOD/SCID小鼠中。利用细胞的连续稀释来进行再移植,其中为每种经处理的肿瘤注射10,000、1,000和100个细胞。贴壁不依赖性培养。将在黏附条件中经Repertaxin(100nM)、抗CXCR1抗体(10μg/ml)或抗CXCR2(10μg/ml)处理的BCL解离,并在超低附着板(Corning,Acton,MA)中以低密度(5000个活细胞/ml)铺板为单细胞。如先前所描述(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)培养细胞。将解离原代肿瘤球后的随后培养物在超低附着板上以5000个活细胞/ml的密度铺板。在第一(原代肿瘤球)和第二(继代肿瘤球)传代后对细胞形成肿瘤球的能力进行量化。RNA提取和qRT-PCR。处理SUM159细胞后,使用RneasyMini试剂盒(QIAGEN)来分离总RNA,并利用其在ABI7900HT序列检测系统中进行实时定量RT-PCR(qRT-PCR)测定。用于Taqman系统的引物和探针选自AppliedBiosystemswebsite(wwwdotappliedbiosystems.com)(FAS配体测定ID:Hs_00899442_mi;IL8测定ID:Hs_00174103_mi、TBP测定ID:Hs_00427620_mi)。相对于内部标准TBP基因来计算FAS配体和IL8的相对表达mRNA水平以标准化RNA质量和输入cDNA量的变化,如先前所描述的(Ginestier等Clin.CancerRes.12:4533-4544.,其内容全文以引用的方式并入本文)。流式细胞术分析。进行CD44/CD24/Lin染色(Ginestier等CellStemCell1:555-567.,其内容全文以引用的方式并入本文)。利用经抗CD95标记的APC(1∶20,BDbiosciences)来进行CD95/FAS染色。对于CXCR1和CXCR2染色,一抗抗CXCR1(1∶100,克隆42705,R&Dsystems)和抗CXCR2(1∶100,克隆48311,R&Dsystems)后,进行经PE标记的二抗抗小鼠(稀释1∶250,JacksonLabs)染色。用1μg/mlPI(Sigma)对新鲜细胞染色5分钟以检测存活力。病毒感染。生成两种不同慢病毒构建体,分别用于表达萤光素酶基因(Lenti-LUC-VSVG)(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)和用于抑制PTEN表达(Lenti-PTEN-SiRNA-DsRed)(Korkaya等PLoSBiolog.7:e1000121.,其内容全文以引用的方式并入本文)。所有慢病毒构建体均由密歇根大学载体(UniversityofMichiganVector)制备。还利用用于过表达FAK的腺病毒构建体(Ad-FAK-GFP)(Luo等CancerRes.69:466-474.,其内容全文以引用的方式并入本文)。如先前所描述(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文),用不同载体进行细胞感染。通过测量DsRed或GFP表达细胞来验证感染效率。心脏内接种。用2%异氟烷/空气混合物麻醉6周龄NOD/SCID小鼠,并在心脏左心室中注射100μL缺乏Ca2+和Mg2+的无菌杜伯科氏PBS中的250,000个细胞。对于三种细胞系(HCC1954、MDA-MB-453和SUM159)中的每种及对于每种治疗(盐水或Repertaxin),注射6只动物。心脏内注射后12小时,按每天两次对小鼠开始Repertaxin注射或对对照注射盐水。生物发光检测。在接种前和接种后每周评估初始生物发光。如先前所描述(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)进行生物发光检测程序。标准化的光子通量代表接种后每周检测出的光子通量与接种前检测出的光子通量的比率。CXCR1表达将癌症干细胞群细分。鉴别调节癌症干细胞(CSC)的信号转导途径提供细胞群中潜在的治疗性靶物。已经鉴别出基于基因表达谱的乳腺CSC标签,其含有可能参与乳腺CSC调节途径的数种基因(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。在乳腺CSC群中过表达的基因中,CXCR1,即结合促炎性趋化因子IL-8/CXCL8的一种受体,表现为一种有希望的候选物,因为重组IL-8刺激乳腺CSC的自我更新(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。利用流式细胞术,测量在乳腺CSC群中的CXCR1蛋白表达,如通过人乳腺癌细胞系HCC1954、MDA-MB-453和SUM159的ALDELFUOR测定所评估的。NOD/SCID小鼠异种移植物中具有功能性干细胞特性的细胞包含在ALDEFLUOR阳性细胞群内(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。CXCR1阳性群(其代表小于总群的2%)几乎仅包含在ALDEFLUOR阳性群内(参见图12A和表4)。表4.还评估CXCR2表达。CXCR2是一种也能结合IL-8/CXL8的受体,尽管与CXCR1相比具有降低的亲和力。与CXCR1阳性细胞形成对比,CXCR2阳性细胞在ALDEFLUOR阳性和ALDEFLUOR阴性群间均匀分布(参见图12A)。为了根据CXCR1表达确定癌症干细胞群的分级结构,对ALDEFLUOR阳性/CXCR1阳性和ALDEFLUOR阳性/CXCR1阴性细胞群进行分选,并注射到NOD/SCID小鼠中(参见图13)。这两种细胞群都生成肿瘤。肿瘤生长动力学与肿瘤形成的潜伏期和大小及所注射细胞的数目有关。由ALDEFLUOR阳性/CXCR1阳性群生成的肿瘤在连续传代后重建初始肿瘤的表型异质性,而ALDEFLUOR阳性/CXCR1阴性群生成仅含有ALDEFLUOR阳性/CXCR1阴性细胞的肿瘤。这些结果提示,CSC细胞分级依照CXCR1表达来组织,然而,这两种细胞群表现出相似的致肿瘤性能力。CXCR1阻断在体外降低乳腺癌干细胞群。用Repertaxin(100nM),即一种CXCR1/2抑制剂,处理三种不同细胞系,以评估CXCR1阻断对乳腺CSC群的影响(Bertini等Proc.Natl.Acad.Sci.U.SA101:11791-11796.,其内容全文以引用的方式并入本文)。对于SUM159,在处理三天后,观察到ALDEFLUOR阳性细胞的比例降低5倍(参见图12B)。在用抗CXCR1阻断抗体处理SUM159细胞后观察到相似的效果。比较而言,在用抗CXCR2阻断抗体处理后没有观察到效果,表明Repertaxin对ALDEFLUOR阳性群的效果是由CXCR1介导的。来自乳腺肿瘤及细胞系的数据表明也可以将癌症干细胞样细胞或癌症起始细胞分离,并在悬浮培养中以“肿瘤球”增殖(Ponti等CancerRes.65:5506-5511.,其内容全文以引用的方式并入本文)。用Repertaxin或用抗CXCR1阻断抗体处理三天后,在将细胞分开并在悬浮液中培养时,与对照相比,观察到原代和继代肿瘤球形成减少8倍。比较而言,抗CXCR2阻断抗体对肿瘤球形成没有影响(参见图14)。出乎意料的是,在用Repertaxin处理5天后,如通过MTT测定所评估,我们观察到整个细胞群的存活力的大幅降低,其中仅3%的细胞仍然存活(参见图12C)。在抗CXCR1阻断抗体而不是抗CXCR2阻断抗体的情况中观察到相似的结果,如此表明此效果依赖于CXCR1阻断。Repertaxin的此效果被延迟,其中细胞存活力的损失在处理后三天开始(参见图15A)。Repertaxin处理对HCC1954乳腺癌细胞系诱导相似的影响,而对含有PTEN突变的MDA-MB-453细胞没有观察到影响(Hollestelle等CancerRes.5:195-201.,其内容全文以引用的方式并入本文)(参见图14、图15B-C和图16)。利用TUNEL测定,在用Repertaxin处理4天后对SUM159细胞染色,并观察到由于诱导凋亡,细胞存活力的大幅降低,其中在Repertaxin处理后检测出36%的凋亡细胞(参见图12D)。结果表明CXCR1阻断导致乳腺CSC群的减少,接着在剩余的大量肿瘤群中诱导大幅凋亡。CXCR1阻断经由旁观者效应在CXCR1阴性细胞中诱导细胞死亡。观察结果,即Repertaxin或抗CXCR1阻断抗体诱导大量细胞死亡,尽管CXCR1阳性群占总细胞群的小于2%,表明XCR1阳性细胞中的CXCR1阻断经由旁观者效应而诱导CXCR1阴性细胞死亡。用Repertaxin处理分选的CXCR1阳性和CXCR1阴性群(参见图12E)。Repertaxin在3天内降低CXCR1阳性群中的细胞存活力,而在CXCR1阴性群中没有观察到影响。Repertaxin在未分离的细胞中诱导大量细胞死亡。Repertaxin对未分离的和CXCR1阳性群的细胞存活力的影响是剂量依赖性的(参见图12E)。结果与靶向CXCR1阳性群,继而经由旁观者效应诱导CXCR1阴性细胞死亡的Repertaxin处理一致。为了测定此效应是否由Repertaxin诱导的可溶性因子介导,在Repertaxin处理三天后自CXCR1阳性群收集条件培养基,并利用具有3.5KDa排阻的膜对此培养基进行透析以自培养基中除去Repertaxin,而保留大于3.5KDa的分子。透析的条件培养基在CXCR1阴性和未分离的群两者中而不是在CXCR1阳性群中诱导细胞存活力的大幅降低(参见图12F)。这些结果证明CXCR1阳性群中的CXCR1阻断经由可溶性不可透析的因子在CXCR1阴性群中诱导细胞死亡。虽然CXCR1阳性群对Repertaxin敏感,但是它对可透析的死亡因子有抗性。由CXCR1阻断诱导的旁观者效应是由FAS配体/FAS信号转导介导的。FAS配体/FAS相互作用在不同生理状态(诸如乳腺退化)中或者在组织损伤(包括由化学疗法诱导的)条件中激活(Chhipa等JCellBiochem.101:68-79.,Song等JClin.Invest106:1209-1220.,其内容全文以引用的方式并入本文)。使用ELISA测定来测定可溶性FAS配体在经Repertaxin处理的SUM159细胞的培养基中的水平以评估FAS配体/FAS相互作用在介导由CXCR1阻断诱导的凋亡旁观者效应中的作用。观察到与未处理的细胞相比,用Repertaxin处理四天的细胞的培养基中的可溶性FAS配体升高超过5倍(参见图17A)。通过RT-PCR确认通过测量FAS配体mRNA水平得到的Repertaxin处理对FAS配体的转录调节(参见图17B)。与未处理的细胞相比,观察到经Repertaxin处理的细胞中FAS配体mRNA水平升高4倍。用激活FAS信号转导的FAS激动剂处理后观察到相似的结果,表明FAS配体是产生正反馈回路的FAS信号转导的靶物。如通过流式细胞术所测定,100%的SUM159细胞表达FAS蛋白。用FAS激动剂处理SUM159细胞再现在Repertaxin处理情况中观察到的具有细胞存活力大幅降低的杀死效应(参见图17C)。抗FAS配体阻断抗体部分地逆转Repertaxin处理对细胞存活力的影响,其中与单独用Repertaxin处理的情况中仅3%的细胞存活相比,44%的细胞在Repertaxin和抗FAS配体抗体处理后仍然存活(参见图17C)。结果表明,由Repertaxin诱导的大量细胞死亡是归因于FAS配体/FAS途径介导的旁观者效应。用FAS激动剂处理SUM159细胞导致CXCR1阳性和ALDEFLUOR阳性细胞的百分比分别增加10倍和3倍(参见图17D/E和图18)。抗FAS配体没有挽救Repertaxin对这两种群的影响(参见图17D/E),这表明含有CXCR1阳性群的ALDEFLUOR阳性群虽然对CXCR1阻断直接敏感,这继而诱导这些细胞的FAS配体生成,但是它对FAS配体/FAS促凋亡信号转导有抗性。比较而言,ALDEFLUOR阴性的大量细胞群不表达CXCR1,但是对FAS配体介导的细胞死亡敏感。FAS配体/FAS信号转导在乳腺退化过程中发挥重要的作用(Song等JClin.Invest106:1209-1220.,其内容全文以引用的方式并入本文)。检查CXCR1阻断对自乳房复位成形术获得的人正常乳腺上皮细胞的影响。如在乳腺癌细胞系中观察到的,CXCR1阳性正常乳腺细胞几乎仅包含在ALDEFLUOR阳性群内(参见图19A)。为了测定IL-8信号转导在正常的乳房干细胞/祖细胞功能中是否重要,用人重组IL-8处理悬浮培养的正常乳腺上皮细胞,并测定其对CSC群的影响,如通过乳腺球形成所测量的(Dontu等GenesDev.17:1253-1270.,其内容全文以引用的方式并入本文)。IL-8的添加以剂量依赖的方式提高原代和继代乳腺球的形成(参见图19B),表明IL-8/CXCR1轴可能参与调节正常乳腺干细胞/祖细胞的增殖或自我更新。用Repertaxin或FAS激动剂处理对黏附条件中培养的正常乳腺上皮细胞的存活力没有影响,即使是利用高浓度的Repertaxin(500nM)时(参见图16A)。然而,如对乳腺癌细胞系所观察到的,在用Repertaxin处理的正常乳腺上皮细胞的培养基中检测出可溶性FAS配体的增加(参见图20B)。此观察结果可以通过这些条件下培养的正常上皮细胞中没有FAS表达来解释(参见图20C)。这与证明FAS在乳腺中的表达仅发生在哺乳后的退化过程期间的研究一致(Song等JClin.Invest106:1209-1220.,其内容全文以引用的方式并入本文)。与其缺乏对正常乳腺上皮细胞的大量群的影响形成对比,Repertaxin显著降低这些细胞的乳腺球形成(参见图20C)。这些结果表明,IL-8/CXCR1轴在正常的和恶性的乳腺上皮干细胞/祖细胞群的调节和存活中发挥重要的作用。经由由FAS配体介导的旁观者效应影响大量细胞群的能力可以与这些细胞中的FAS表达水平有关。CXCR1阻断对癌症干细胞的影响是由FAK/AKT/FOXO3A途径介导的。CXCR1经由参与粘着斑激酶(FAK)磷酸化的信号转导途径来起作用,所述粘着斑激酶(FAK)磷酸化导致AKT的活化(Waugh等Clin.CancerRes.14:6735-6741.,其内容全文以引用的方式并入本文文)。为了评估CXCR1阻断对FAK和AKT活化的影响,通过对三种不同细胞系进行的Western印迹来测量FAK和AKT磷酸化蛋白质的水平。对于SUM159和HCC1954,与未处理的细胞相比,我们在经Repertaxin处理的细胞中检测到FAKTyr397和AKTSer473磷酸化的降低,表明epertaxin效果可以由FAK/AKT途径介导(参见图21A和图22)。MDA-MB453对Repertaxin处理有抗性的观察结果可以通过存在激活PI3K/AKT途径的PTEN突变(919G>A)来解释(Hollestelle等Mol.CancerRes.5:195-201.,其内容全文以引用的方式并入本文)。在MDAMB453细胞系中Repertaxin处理后没有检测到FAKTyr397和AKTSer473磷酸化的修饰(参见图22)。为了确认FAK/AKT途径在介导CXCR1阻断的效果中的功能性作用,使用两种病毒构建体,一种经由PTENshRNA敲除PTEN表达,而另一种导致FAK过表达。PTEN经由其脂质磷酸酶而拮抗PI3-K/AKT信号转导(Vivanco等Nat.Rev.Cancer2:489-501.,其内容全文以引用的方式并入本文)。PTEN敲除导致AKT活化,如通过AKTSer473磷酸化升高所证明(参见图21A和图22)。PTEN敲除阻断Repertaxin处理对FAK和AKT活性的影响,FAK过表达也阻断Repertaxin的影响,而且诱导FAK和AKT的活化,其通过FAKTyr397和AKTSer473磷酸化的表达增加来测量。这些结果表明CXCR1阻断效果是由FAK/AKT信号转导介导的。利用对CXCR1阳性细胞的免疫荧光染色确认,与未处理的细胞相比,Repertaxin处理导致磷酸-FAK和磷酸-AKT表达的显著降低(参见图21B)。AKT经由导致胞质FOXO3A隔绝的磷酸化事件来调节forkhead转录因子FOXO3A的活性(Brunet等Mol.CellBiol.21:952-965.,其内容全文以引用的方式并入本文)。比较而言,未磷酸化形式的FOXO3A运输到细胞核,在那里它充当调节FAS配体合成的转录因子(Jonsson等Nat.Med.11:666-671.),其内容全文以引用的方式并入本文。Repertaxin经由FAS配体介导的旁观者效应来诱导细胞死亡;通过免疫荧光染色来检查Repertaxin对此信号转导途径的影响。FOXO3A以胞质定位存在于未处理细胞中,但是在Repertaxin处理后穿梭到细胞核(参见图21B)。这表明CxCR1阻断经由抑制FAK/AKT途径来诱导FOXO3A活性。通过免疫荧光来检测,具有PTEN删除或FAK过表达的细胞在经Repertaxin处理的和未处理的细胞中都表现出高水平的磷酸-FAK和磷酸-Akt表达。如通过FOXO3A的胞质位置所显示,Repertaxin处理在具有PTEN删除或FAK过表达的细胞中没有诱导FOXO3A活化(参见图21B)。由于FAK/AKT途径的组成性激活,具有PTEN删除或FAK过表达的细胞表现出对Repertaxin处理的抗性。具有PTEN删除或FAK过表达的细胞在Repertaxin处理的情况中没有表现出任何细胞存活力降低。已经提出,AKT信号转导在CSC的生物学中发挥关键性的作用(参见图21B和图22)(Dubrovska等Proc.Natl.Acad.Sci.U.SA106:268-273.,Korkaya等PLoSBiolog.7:e1000121.,Yilmaz等Nature441:475-482.,其内容全文以引用的方式并入本文)。FAK/AKT途径的激活阻断Repertaxin对CSC群的影响,如通过用抑制剂处理后ALDELFUOR阳性群的维持所显示(参见图21B)。所有结果表明CXCR1阻断直接影响FAK/AKT/FOXO3A途径。Repertaxin处理抑制AKT信号转导,其对于CSC活性是至关重要的,而且随后诱导由CSC生成的FAS配体介导的对大量肿瘤细胞的旁观者效应。Repertaxin处理在体内减少乳腺癌干细胞群。最近的证据表明,乳腺CSC对化学疗法和辐射是相对有抗性的,而且可能有助于治疗后的肿瘤再生长(Phillips等JNatl.CancerInst.98:1777-1785.,Yu等Cell131:1109-1123.,Li等JNatl.CancerInst.100:672-679.,其内容全文以引用的方式并入本文)。CSC原理提示,临床结果的显著改善将要求有效地靶向CSC群(Reya等Nature414:105-111.,其内容全文以引用的方式并入本文)。在通过化学疗法靶向大量肿瘤细胞时,在凋亡过程期间合成并分泌数种因子。在这些因子中,FAS配体通过介导旁观者杀死效应来放大化学疗法效果(Chhipa等JCellBiochem.101:68-79.,其内容全文以引用的方式并入本文)。化学疗法也可以在受损伤的细胞中诱导IL-8生成。常用的化疗剂多西他赛在SUM159细胞中诱导IL-8和FAS配体mRNA(参见图10a/B)。在FAS激动剂处理后我们也检测到IL-8mRNA水平升高4倍(参见图10B)。我们已经显示了IL-8能够调节CSC群。这表明对细胞毒性化学疗法增加Repertaxin可以阻断此效果,而且靶向癌症干细胞群。使用SUM159细胞系和自三名不同患者生成的三种原发性人乳腺癌异种移植物(MC1、UM2、UM3)来探测Repertaxin处理对肿瘤生长的功效。将来自这些肿瘤的细胞同位移植到NOD/SCID小鼠的人源化清洁脂肪垫中,而不进行体外培养。对于这些异种移植物中的每种,CSC群仅包含在ALDEFLUOR阳性群内(Ginestier等CellStemCell1:555-567.,Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。在每种肿瘤中,CXCR1阳性群几乎仅包含在此ALDEFLUOR阳性群内(参见表5),而且PTEN/FAK/AKT途径被激活(参见图25)。表5将来自每种异种移植物的50,000个细胞注射到NOD/SCID小鼠的人源化脂肪垫中,并监测肿瘤生长。在肿瘤大小为约4mm时,用单独用Repertaxin(15mg/Kg,一天两次,在28天期间)、单独用多西他赛(10mg/Kg,一周一次,在4周期间)或用这两种药物的组合开始治疗。与盐水注射的对照比较肿瘤生长。对于每种异种移植物,观察到由多西他赛治疗或Repertaxin/多西他赛组合诱导的对肿瘤生长的显著抑制(参见图26A和图27)。单独用Repertaxin治疗对肿瘤生长具有中度影响。在治疗4周后,处死动物,并利用ALDEFLUOR测定来分析残留的肿瘤。与未治疗的对照相比,单独用多西他赛治疗的残留的肿瘤含有百分比未改变或增加的ALDELFUOR阳性细胞(参见图26B和图27)。比较而言,单独用Repertaxin治疗或与多西他赛组合治疗减少ALDEFLUOR阳性群超过75%(参见图26B和图27)。通过免疫组织化学来确认不同异种移植物中的ALDH1表达的结果。与未治疗的肿瘤相比,在经Repertaxin治疗的肿瘤中检测出ALDH1阳性细胞的减少,而在用单独用多西他赛治疗的肿瘤中,ALDH1阳性细胞的百分比未改变或增加(参见图26D)。评估CD44+/CD24-细胞在这些肿瘤中的存在。先前已显示了乳腺癌干细胞中表达标志物(AlHajj等Proc.Natl.Acad.Sci.U.SA100:3983-3988.,其内容全文以引用的方式并入本文)。测量CD44+/CD24-表型与CXCR1表达之间的重叠。CXCR1阳性细胞存在于CD44+/CD24-细胞群和表达CD24或CD44阴性的细胞群中(参见表6)。表6在单独用多西他赛治疗的残留的肿瘤中,观察到百分比未改变或增加的CD44+/CD24-细胞,而单独用Repertaxin治疗或与多西他赛组合治疗导致CD44+/CD24-细胞群减少(参见图28)。功能性体内测定提供了评估治疗后剩余的CSC的肿瘤起始和自我更新能力的直接测试,所述功能体内测定包括将来自经治疗的肿瘤的细胞再次移植到继代NOD/SCID小鼠中。源自对照或经多西他赛治疗的动物的所有稀释度的肿瘤细胞在继代NOD/SCID小鼠中显示相似的肿瘤再生长。比较而言,具有或没有多西他赛的Repertaxin治疗在继代受体中降低肿瘤生长(参见图26C)。在注射相等数目的细胞时,与来自对照或经多西他赛治疗的动物的细胞相比,那些来自经Repertaxin治疗的动物的细胞显示肿瘤生长降低2-5倍(参见图26C)。对于每种异种移植物模型,自用Repertaxin和多西他赛组合治疗的动物获得的1000或100个肿瘤细胞不能在NOD/SCID小鼠中形成任何继发性肿瘤(参见图26C、图27和表7)。这些研究证明,Repertaxin治疗特异性靶向并减少CSC群。表7Repertaxin治疗抑制FAKMKT信号转导且而在体内活化FOXO3A。通过治疗后的每种异种移植物的免疫组织化学来检查磷酸-FAK和磷酸-AKT的表达。在来自对照和经多西他赛治疗的肿瘤的50%的细胞中检测出膜性磷酸-FAK表达,而在单独用Repertaxin治疗或与多西他赛组合治疗的肿瘤中消除磷酸-FAK表达(参见图26D)。对磷酸-AKT表达观察到相似的结果,其中在未治疗的肿瘤中70%的细胞表达磷酸-AKT,在经多西他赛治疗的肿瘤中有20%的磷酸-AKT阳性细胞,而在单独用Repertaxin治疗或与多西他赛组合治疗的肿瘤中完全抑制磷酸-AKT表达(参见图26D)。在来自单独用多西他赛治疗、单独用Repertaxin治疗和用Repertaxin/多西他赛组合治疗的肿瘤的细胞中检测出核FOXO3A。这些体内数据与体外数据一致,而且确认Repertaxin治疗抑制FAK/AKT信号转导,而且激活FOXO3A。Repertaxin治疗降低全身性转移的形成。为了测定Repertaxin是否降低全身性转移,我们用萤光素酶慢病毒报告系统感染HCC1954、MDA-MB-453和SUM159乳腺癌细胞系,并通过心脏内注射将细胞导入NOD/SCID小鼠中。注射每种细胞系的250,000个细胞的悬浮液,并通过生物发光成像每周一次监测转移形成。心脏内注射后12小时,通过Repertaxin注射或对对照注射盐水每天对小鼠进行两次治疗。注射有HCC1954和SUM159细胞的小鼠的Repertaxin治疗显著降低转移形成,其中与未治疗的小鼠相比,经治疗的小鼠的光子通量发射更低(参见图29A/B)。组织学切片确认转移存在于未治疗动物中的数个部位(参见图29D)。Repertaxin治疗在注射有MDA-MB-453细胞的小鼠中对转移形成没有任何作用(参见图29C)。光子通量发射和形成转移的动物数目在经Repertaxin治疗和未治疗的这两组中是相似的。此结果与如下的数据一致,即所述数据将MDA-MB-453描述为由于PTEN突变的存在而对Repertaxin有抗性的细胞系。这些结果表明用药剂(诸如Repertaxin)的CXCR1阻断能够降低由CSC群介导的转移(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。在本发明实施方案的开发过程中进行的实验表明,具有干细胞特性的细胞亚组分驱动肿瘤生长和转移(Visvader等Nat.Rev.Cancer8:755-768.,其内容全文以引用的方式并入本文)。依靠其对目前的治疗形式的相对抗性,这些细胞可以促成治疗抗性和复发(Reya等Nature414:105-111.,其内容全文以引用的方式并入本文)。本发明提供了一种基于阻断CXCR1细胞因子受体(其在乳腺癌干细胞上表达)以有效地靶向癌症干细胞群并改善治疗结果的方法。在本发明实施方案的开发过程中在许多系统中进行的实验已经证明细胞因子网络在肿瘤发生中发挥重要的作用。存在有这些细胞因子中的数种能调节干细胞行为的证据。IL-4能够调节胰腺癌干细胞的自我更新,而IL-6能够调节结肠癌和乳腺癌中的癌症干细胞(Todaro等CellStemCell1:389-402.,Sansone等JClin.Invest117:3988-4002.,其内容全文以引用的方式并入本文)。先前已经证明了IL-8在介导肿瘤侵袭和转移中的作用(Waugh和Wilson.CancerRes.14:6735-6741.,Inoue等Clin.CancerRes.6:2104-2119.,其内容全文以引用的方式并入本文)。另外,IL-8在脑中的伤口愈合过程中提高神经干细胞的自我更新(Beech等JNeuroimmunol.184:198-208.,其内容全文以引用的方式并入本文)。将肺癌干细胞描述为表达趋化因子受体CXCR1(Levina等PLoS.ONE.3:e3077.,其内容全文以引用的方式并入本文)。在本发明实施方案的开发过程中进行的实验证明,CXCR1阳性群几乎仅包含在乳腺癌细胞系和原代异种移植物及正常乳腺细胞中的ALDEFLUOR阳性群内。趋化因子受体在ALDEFLUOR阳性乳腺癌细胞群中过表达(Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。在乳腺癌中,IL-8在肿瘤微环境中由多种细胞类型生成,所述多种细胞类型包括炎性细胞、血管内皮细胞、肿瘤相关成纤维细胞和间充质干细胞(Waugh等Clin.CancerRes.14:6735-6741.,其内容全文以引用的方式并入本文)。细胞因子网络介导这些细胞类型之间的相互作用,因此癌症干细胞可以经由IL-8受体CXCR1的阻断来靶向。利用体外测定,证明CXCR1而不是CXCR2(一种备选的IL-8受体)阻断减少乳腺癌干细胞群。然后诱导缺乏CXCR1表达的整个剩余细胞群中的凋亡。除CXCR1阻断抗体外,在实施方案开发过程中进行的实验证明Repertaxin(一种CXCR1/2抑制剂)通过靶向CXCR1阳性群来诱导相似的效果。与其对CXCR1表达癌症干细胞群的直接影响形成对比,Repertaxin对缺乏CXCR1表达的大量肿瘤细胞群没有直接影响。这表明CXCR1阳性细胞中的CXCR1阻断经由旁观者效应诱导CXCR1阴性细胞中的细胞死亡。本文中所描述的实验证明,FAS配体/FAS途径是此旁观者杀死效应的介导物。此现象解释Repertaxin治疗在整个细胞群中诱导大量凋亡中的功效,尽管CXCR1阳性群代表细胞群的小于1%。通过抗FAS配体抗体对旁观者杀死的有效阻断来表明FAS配体的作用。在本发明实施方案的开发过程中进行的实验表明,相似的细胞因子相互作用可以发生在暴露于细胞毒性化学疗法的肿瘤中。化学疗法可以在分化的肿瘤细胞中直接诱导细胞凋亡及诱导这些死亡中的细胞生成FAS配体,这继而经由FAS介导的旁观者效应来诱导周围肿瘤细胞的凋亡。伴随FAS配体的生成,这些受损伤的细胞还在类似乳房退化或伤口愈合的过程中分泌升高水平的IL-8。退化的乳腺中通常就是这样,此IL-8可以刺激乳腺癌干细胞及保护它们免于凋亡。这可有助于临床前模型(4)和新辅助临床试验(5)中在化学疗法后观察到的癌症干细胞的相对增加。图30中显示了化学疗法对肿瘤的凋亡和自我更新途径的影响。为了测定CXCR1阻断是否可以在内体靶向乳腺癌干细胞,比较Repertaxin和细胞毒剂多西他赛对NOD/SCID小鼠中的癌症干细胞区室和肿瘤生长的影响。多西他赛是目前用于治疗患有乳腺癌的女性的最有效的化疗剂之一。通过ALDEFLUOR测定和NOD/SCID小鼠中的连续移植来评估癌症干细胞群。利用这些测定,确定单独化学疗法治疗导致癌症干细胞群无变化或相对增加。比较而言,单独用Repertaxin治疗或与化学疗法一起治疗显著减少癌症干细胞群。尽管肿瘤起始群显著减少,单独使用Repertaxin没有导致显著的肿瘤缩小。Repertaxin和化学疗法的组合导致肿瘤大小及癌症干细胞群的显著减小。将这些药剂组合以靶向癌症干细胞和大量肿瘤细胞群使这些治疗的功效最大化。为了阐明Repertaxin的作用机制,分析CXCR1的下游途径。确认CXCR1、FAK与AKT之间的相互作用。CXCR1阻断经由FAK和AKT活化而特异性起作用。在本发明实施方案开发过程中进行的实验表明,AKT活化经由GSK3β的磷酸化来调节正常的和恶性的乳腺干细胞自我更新,所述GSK3β的磷酸化导致WNT途径的激活(Korkaya等PLoSBiolog.7:e1000121,其内容全文以引用的方式并入本文)。这些结果表明具有PTEN敲除的细胞为什么对Repertaxin有抗性。AKT的其它功能是经由forkhead转录因子FOXO3A的磷酸化来调节细胞存活。FOXO3A的AKT磷酸化导致其胞质隔离。比较而言,证明CXCR1阻断导致AKT活化降低,这导致FOXO3A在细胞核中的移位,其中FOXO3A在细胞核中诱导许多基因,包括FAS配体(Jonsson等Nat.Med.11:666-671.,其内容全文以引用的方式并入本文)。经由CXCR1阻断诱导的FAS配体继而造成观察到的旁观者杀死效应(参见图30)。除了其在CXCR1信号转导中的作用外,FAK经由整联蛋白受体来介导细胞与胞外基质组分的相互作用(Waugh等Clin.CancerRes.14:6735-6741.,通其内容全文以引用的方式并入本文)。FAK信号转导在转基因模型中在调节正常的和恶性的小鼠乳腺干细胞的自我更新中发挥作用(Luo等CancerRes.69:466-474.,其内容全文以引用的方式并入本文)。FAK活化还通过阻断FADD和RIP介导的凋亡来促进细胞存活(Kurenova等Mol.CellBiol.24:4361-4371.,Xu等JBiol.Chem.275:30597-30604.,其内容全文以引用的方式并入本文)。这为癌症干细胞群对FAS/FAS配体诱导的凋亡的抗性提供了一种解释。已经证明了,乳腺癌干细胞在肿瘤侵袭和转移中发挥重要的作用(Croker等JCellMol.Med.2008,Charafe-Jauffret等CancerRes.69:1302-1313.,其内容全文以引用的方式并入本文)。本文中显示,IL-8和CXCR1也在这些过程中发挥重要的作用。利用Repertaxin分析CXCR1阻断对实验性转移的形成的影响。表明继心脏内注射乳腺癌细胞之后施用时,CXCR1阻断降低转移形成。利用Repertaxin的临床研究已经证明了毒性的缺乏。针对干扰细胞因子调节环(诸如IL-8和CXCR1)的策略代表用于靶向乳腺癌干细胞的方法。参考文献下列参考文献的内容全文以引用的方式并入本文,如同完全在本文中提出。1.HanahanDandWeinbergRA.Thehallmarksofcancer.Cell2000;100:57-70.2.NeveRM,ChinK,FridlyandJetal.Acollectionofbreastcancercelllinesforthestudyoffunctionallydistinctcancersubtypes.CancerCell2006;10:515-527.3.BonnetDandDickJE.Humanacutemyeloidleukemiaisorganizedasahierarchythatoriginatesfromaprimitivehematopoieticcell.Nat.Med.1997;3:730-737.4.GlinskyGV.Stemcelloriginofdeath-from-cancerphenotypesofhumanprostateandbreastcancers.StemCellRev.2007;3:79-93.5.JaiswalS,TraverD,MiyamotoT,AkashiK,LagasseE,andWeissmanIL.ExpressionofBCR/ABLandBCL-2inmyeloidprogenitorsleadstomyeloidleukemias.Proc.Natl.Acad.Sci.U.S.A2003;100:10002-10007.6.KrivtsovAV,TwomeyD,FengZetal.TransformationfromcommittedprogenitortoleukaemiastemcellinitiatedbyMLL-AF9.Nature2006;442:818-822.7.ChristgenM,BallmaierM,BruchhardtH,vonWasielewskiR,KreipeH,andLehmannU.IdentificationofadistinctsidepopulationofcancercellsintheCai-51humanbreastcarcinomacellline.Mol.CellBiochem.2007;306:201-212.8.FillmoreCMandKuperwasserC.Humanbreastcancercelllinescontainstem-likecellsthatself-renew,giverisetophenotypicallydiverseprogenyandsurvivechemotherapy.BreastCancerRes.2008;10:R25.9.KondoT,SetoguchiT,andTagaT.Persistenceofasmallsubpopulationofcancerstem-likecellsintheC6gliomacellline.Proc.Natl.Acad.Sci.U.S.A2004;101:781-786.10.SetoguchiT,TagaT,andKondoT.Cancerstemcellspersistinmanycancercelllines.CellCycle2004;3:414-415.11.PatrawalaL,CalhounT,Schneider-BroussardR,ZhouJ,ClaypoolK,andTangDG.Sidepopulationisenrichedintumorigenic,stem-likecancercells,whereasABCG2+andA.CancerRes.2005;65:6207-6219.12.ChuteJP,MuramotoGG,WhitesidesJetal.Inhibitionofaldehydedehydrogenaseandretinoidsignalinginducestheexpansionofhumanhematopoieticstemcells.Proc.Natl.Acad.Sci.U.S.A2006;103:11707-11712.13.DuesterG.FamiliesofretinoiddehydrogenasesregulatingvitaminAfunction:productionofvisualpigmentandretinoicacid.Eur.JBiochem.2000;267:4315-4324.14.CheungAM,WanTS,LeungJCetal.AldehydedehydrogenaseactivityinleukemicblastsdefinesasubgroupofacutemyeloidleukemiawithadverseprognosisandsuperiorNOD/SCIDengraftingpotential.Leukemia2007;21:1423-1430.15.CortiS,LocatelliF,PapadimitriouDetal.Identificationofaprimitivebrain-derivedneuralstemcellpopulationbasedonaldehydedehydrogenaseactivity.StemCells2006;24:975-985.16.PearceDJ,TaussigD,SimpsonCetal.Characterizationofcellswithahighaldehydedehydrogenaseactivityfromcordbloodandacutemyeloidleukemiasamples.StemCells2005;23:752-760.17.GinestierC,HurMH,Charafe-JauffretEetal.ALDH1IsaMarkerofNormalandMalignantHumanMammaryStemCellsandaPredictorofPoorClinicalOutcome.CellStemCell2007;1:555-567.18.DontuG,AbdallahWM,FoleyJMetal.Invitropropagationandtranscriptionalprofilingofhumanmammarystem/progenitorcells.GenesDev.2003;17:1253-1270.19.IrizarryRA,HobbsB,CollinFetal.Exploration,normalization,andsummariesofhighdensityoligonucleotidearrayprobeleveldata.Biostatistics.2003;4:249-264.20.Charafe-JauffretE,GinestierC,MonvilleFetal.Geneexpressionprofilingofbreastcelllinesidentifiespotentialnewbasalmarkers.Oncogene2006;25:2273-2284.21.FinettiP,CerveraN,Charafe-JauffretEetal.Sixteen-kinasegeneexpressionidentifiesluminalbreastcancerswithpoorprognosis.CancerRes.2008;68:767-776.22.EisenMB,SpellmanPT,BrownPO,andBotsteinD.Clusteranalysisanddisplayofgenome-wideexpressionpatterns.Proc.Natl.Acad.Sci.U.S.A1998;95:14863-14868.23.ReinerA,YekutieliD,andBenjaminiY.Identifyingdifferentiallyexpressedgenesusingfalsediscoveryratecontrollingprocedures.Bioinformatics.2003;19:368-375.24.HuaJ,BalagurunathanY,ChenYetal.Normalizationbenefitsmicroarray-basedclassification.EURASIP.JBioinform.Syst.Biol.2006;43056.25.GinestierC,CerveraN,FinettiPetal.Prognosisandgeneexpressionprofilingof20q13-amplifiedbreastcancers.Clin.CancerRes.2006;12:4533-4544.26.PontiD,CostaA,ZaffaroniNetal.Isolationandinvitropropagationoftumorigenicbreastcancercellswithstem/progenitorcellproperties.CancerRes.2005;65:5506-5511.27.RingeJ,StrassburgS,NeumannKetal.Towardsinsitutissuerepair:humanmesenchymalstemcellsexpresschemokinereceptorsCXCR1,CXCR2andCCR2,andmigrateuponstimulationwithCXCL8butnotCCL2.JCellBiochem.2007;101:135-146.28.HughesL,MaloneC,ChumsriS,BurgerAM,andMcDonnellS.Characterisationofbreastcancercelllinesandestablishmentofanovelisogenicsubclonetostudymigration,invasionandtumourigenicity.Clin.Exp.Metastasis2008.29.ItohY,JohT,TanidaSetal.IL-8promotescellproliferationandmigrationthroughmetalloproteinase-cleavageproHB-EGFinhumancoloncarcinomacells.Cytokine2005;29:275-282.30.GuptaGP,PerkJ,AcharyyaSetal.IDgenesmediatetumorreinitiationduringbreastcancerlungmetastasis.Proc.Natl.Acad.Sci.U.S.A2007;104:19506-19511.31.LiF,TiedeB,MassagueJ,andKangY.Beyondtumorigenesis:cancerstemcellsinmetastasis.CellRes.2007;17:3-14.32.AlHajjM,WichaMS,Benito-HernandezA,MorrisonSJ,andClarkeMF.Prospectiveidentificationoftumorigenicbreastcancercells.Proc.Natl.Acad.Sci.U.S.A2003;100:3983-3988.33.LiC,HeidtDG,DalerbaPetal.Identificationofpancreaticcancerstemcells.CancerRes.2007;67:1030-1037.34.Ricci-VitianiL,LombardiDG,PilozziEetal.Identificationandexpansionofhumancolon-cancer-initiatingcells.Nature2007;445:111-115.35.MontanaroF,LiadakiK,SchiendaJ,FlintA,GussoniE,andKunkelLM.DemystifyingSPcellpurification:viability,yield,andphenotypearedefinedbyisolationparameters.Exp.CellRes.2004;298:144-154.36.StinglJ,EirewP,RicketsonIetal.Purificationanduniquepropertiesofmammaryepithelialstemcells.Nature2006;439:993-997.37.MatsuiW,HuffCA,WangQetal.Characterizationofclonogenicmultiplemyelomacells.Blood2004;103:2332-2336.38.FarnieGandClarkeRB.Mammarystemcellsandbreastcancer--roleofNotchsignalling.StemCellRev.2007;3:169-175.39.KrsticA,MojsinM,andStevanovicM.RegulationofSOX3geneexpressionisdrivenbymultipleNF-Ybindingelements.Arch.Biochem.Biophys.2007;467:163-173.40.ZhuJ,ZhangY,JoeGJ,PompettiR,andEmersonSG.NF-Yaactivatesmultiplehematopoieticstemcell(HSC)regulatorygenesandpromotesHSCself-renewal.Proc.Natl.Acad.Sci.U.S.A2005;102:11728-11733.41.RaffelGD,MercherT,ShigematsuHetal.Ottl(Rbm15)haspleiotropicrolesinhematopoieticdevelopment.Proc.Natl.Acad.Sci.U.S.A2007;104:6001-6006.42.MaX,RendaMJ,WangLetal.Rbm15modulatesNotch-inducedtranscriptionalactivationandaffectsmyeloiddifferentiation.Mol.CellBiol.2007;27:3056-3064.43.PeifferI,EidP,BarbetRetal.Asub-populationofhighproliferativepotential-quiescenthumanmesenchymalstemcellsisunderthereversiblecontrolofinterferonalpha/beta.Leukemia2007;21:714-724.44.VilladsenR,FridriksdottirAJ,Ronnov-JessenLetal.Evidenceforastemcellhierarchyintheadulthumanbreast.JCellBiol.2007;177:87-101.45.HambardzumyanD,BecherOJ,andHollandEC.Cancerstemcellsandsurvivalpathways.CellCycle2008;7.46.JaganiZandKhosravi-FarR.Cancerstemcellsandimpairedapoptosis.Adv.Exp.Med.Biol.2008;615:331-344.47.MaxwellPJ,GallagherR,SeatonAetal.HIF-1andNF-kappaB-mediatedupregulationofCXCR1andCXCR2expressionpromotescellsurvivalinhypoxicprostatecancercells.Oncogene2007;26:7333-7345.48.MurphyC,McGurkM,PettigrewJetal.Nonapicalandcytoplasmicexpressionofinterleukin-8,CXCR1,andCXCR2correlateswithcellproliferationandmicrovesseldensityinprostatecancer.Clin.CancerRes.2005;11:4117-4127.49.TrentinL,MiorinM,FaccoMetal.Multiplemyelomaplasmacellsshowdifferentchemokinereceptorprofilesatsitesofdiseaseactivity.Br.JHaematol.2007;138:594-602.50.VarneyML,JohanssonSL,andSinghRK.DistinctexpressionofCXCL8anditsreceptorsCXCR1andCXCR2andtheirassociationwithvesseldensityandaggressivenessinmalignantmelanoma.Am.JClin.Pathol.2006;125:209-216.51.FreundA,ChauveauC,BrouilletJPetal.IL-8expressionanditspossiblerelationshipwithestrogen-receptor-negativestatusofbreastcancercells.Oncogene2003;22:256-265.52.InoueK,SlatonJW,EveBYetal.Interleukin8expressionregulatestumorigenicityandmetastasesinandrogen-independentprostatecancer.Clin.CancerRes.2000;6:2104-2119.53.BalbayMD,PettawayCA,KuniyasuHetal.Highlymetastatichumanprostatecancergrowingwithintheprostateofathymicmiceoverexpressesvascularendothelialgrowthfactor.Clin.CancerRes.1999;5:783-789.54.KimSJ,UeharaH,KarashimaT,MccartyM,ShihN,andFidlerIJ.Expressionofinterleukin-8correlateswithangiogenesis,tumorigenicity,andmetastasisofhumanprostatecancercellsimplantedorthotopicallyinnudemice.Neoplasia.2001;3:33-42.55.KarnoubAE,DashAB,VoAPetal.Mesenchymalstemcellswithintumourstromapromotebreastcancermetastasis.Nature2007;449:557-563.56.SchaferZTandBruggeJS.IL-6involvementinepithelialcancers.JClin.Invest2007;117:3660-3663.57.TodaroM,AleaMP,DiStefanoABetal.Coloncancerstemcellsdictatetumorgrowthandresistcelldeathbyproductionofinterleukin-4.CellStemCell2007;1:389-402.58.LandiS,BottariF,GemignaniFetal.Interleukin-4andinterleukin-4receptorpolymorphismsandcolorectalcancerrisk.Eur.JCancer2007;43:762-768.59.SansoneP,StorciG,TavolariSetal.IL-6triggersmalignantfeaturesinmammospheresfromhumanductalbreastcarcinomaandnormalmammarygland.JClin.Invest2007;117:3988-4002.60.GlinskyGV,BerezovskaO,andGlinskiiAB.Microarrayanalysisidentifiesadeath-from-cancersignaturepredictingtherapyfailureinpatientswithmultipletypesofcancer.JClin.Invest2005;115:1503-1521.61.GolubTR,SlonimDK,TamayoPetal.Molecularclassificationofcancer:classdiscoveryandclasspredictionbygeneexpressionmonitoring.Science1999;286:531-537.将上述说明书中所提及的所有出版物和专利以引用的方式并入本文。本发明的所述方法和系统的各种修改和变化在不背离本发明范围和精神的前提下对于本领域技术人员会是显而易见的。虽然已经结合具体的优选实施方案描述了本发明,但是应当理解,如要求保护的本发明不应过度受限于此类具体的实施方案。实际上,对于相关领域技术人员显而易见的用于实施本发明的所述模式的各种修改意图在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1