多指标联合诊断卵巢癌和/或非卵巢来源的恶性肿瘤的系统的制作方法
本发明涉及肿瘤诊断领域中一种多指标联合诊断卵巢癌和/或非卵巢来源的恶性肿瘤的系统。
背景技术:
目前临床上卵巢癌(卵巢恶性肿瘤)检查的方式主要有:(1)物理检查、(2)血清肿瘤标志物检测、(3)细胞学或者组织学病例诊断(金标准)。肿瘤学标志物的检测具有可重复性、简便、成本低、灵敏度高、特异性高、与肿瘤大小或者分期密切相关、能进行治疗效果的监测等特点。CA125(糖类抗原125)是临床上应用最为广泛的卵巢癌肿瘤标志物。虽然较其他的肿瘤标志物有较高的灵敏性,但是由于盆腔炎症、子宫内膜异位症、子宫肌瘤时CA125也均可升高,其特异性较低。除了CA125人们还找到了许多对于诊断卵巢癌有价值的肿瘤标志物,但是单独检测一个标志物很难对肿瘤达到良好的诊断效果。肿瘤标志物存在于肿瘤细胞的表面或细胞内,也会存在于正常人的组织或者体液中,但含量很少。但是,在肿瘤患者体内,随着肿瘤的发生发展、肿瘤相关基因的激活和失活,其编码的蛋白可以在肿瘤患者的组织、体液和排泄物中检出。
液态悬浮芯片技术(液态悬浮芯片法)又称流式荧光检测技术、微球悬浮列阵技术、液相芯片分析技术等。它将荧光微球编码技术、流式细胞技术、激光技术、计算机技术、高速信号处理技术有机地整合在一起,此技术可以完成蛋白、核酸的同时检测。
CXCL1为黑色素瘤生长激活因子,由趋化因子生长调节基因l编码,属于趋化因子CXC家族。CXCLl由人黑色素瘤细胞分泌,具有有丝分裂特性,与恶性黑色素瘤发病机制有关。CXCLl在巨噬细胞,中性粒细胞和上皮细胞中表达,并表现中性粒细胞趋化活性。
趋化因子配体18(C-C motif chemokine ligand 18,CCL18)基因是趋化因子超家族中CC类基因,即靠近氨基端的前两个C间没有插入其他氨基酸,又称为β类趋化因子。CCL18定位于人染色体17q11.2,即人CC趋化因子的位置。
TM4SF1(TAL6,transmembrane 4L6family member 1,跨膜蛋白4L6家族成员1)是TM4SF家族的一个远亲,TM4SF家族有25个成员。TAL6与人角蛋白细胞的迁移有关。
C1D(DNA绑定蛋白1,nuclear nucleic acid-binding protein C1D)基因编码的是一个保守的DNA绑定蛋白,C1D基因及蛋白在许多哺乳动物细胞及组织中表达,生理水平的C1D蛋白是无害的但对于细胞的生存却至关重要,当C1D蛋白在细胞中的水平达到一个临界值后可诱导细胞凋亡,因此C1D的表达在转录及转录后水平受到极为严格的调控。
TIZ(TRAF6-inhibitory zinc finger protein,抑制肿瘤凋亡相关因子6的锌指蛋白,zinc finger protein 573(ZNF573))是TRAF6的细胞内绑定分子,当与TRAF6共同表达时可抑制TRAF6对核转录因子-kappa B(NF-kappa B)和c-Jun氨基末端激酶(c-Jun N-terminal kinase)的诱导活化,TIZ还可抑制NF-kappa B受体催化的信号。TIZ通过调节TRAF6的信号活性而在破骨细胞分化过程中起重要作用。
FXR1(Fragile X related gene 1,脆性X智力迟钝相关基因1)是脆性X智力迟钝相关基因家族中的一员,它们都有RNA绑定、与多聚核糖体相关、在核与胞浆间穿梭的生理功能,FXR1定位于3q28。基因结构分析及生物学功能研究显示,FXR1有两个不均一核糖核蛋白K区域(heterogeneous nuclear ribonucleoprotein K homology,KH)和一个RGG盒,在体外可与人工RNA同聚物结合,FXR1P与大部分核糖体60S亚单位有关。
技术实现要素:
本发明所要解决的技术问题是如何更好地诊断卵巢癌、Ⅰ期卵巢癌和/或Ⅱ期卵巢癌、浆液性卵巢癌和/或乳腺癌、肝癌或肺癌。
为了解决上述问题,本发明提供了辅助诊断卵巢癌和/或非卵巢来源的恶性肿瘤的系统。
本发明所提供的辅助诊断卵巢癌和/或非卵巢来源的恶性肿瘤的系统,包括检测血清中六种蛋白质含量的系统,所述六种蛋白质为CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体;所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
为了解决上述问题,本发明还提供了检测血清中上述六种蛋白质含量的系统在制备辅助诊断卵巢癌和/或非卵巢来源的恶性肿瘤的系统中的应用,所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
上述系统和应用中,所述卵巢癌可为Ⅰ期卵巢癌和/或Ⅱ期卵巢癌。
上述系统和应用中,所述卵巢癌可为浆液性卵巢癌。
上述系统和应用中,所述检测血清中六种蛋白质含量的系统包括通过液态悬浮芯片法或ELISA法检测所述六种蛋白质的含量所需的试剂和/或仪器。
上述系统和应用中,所述检测血清中六种蛋白质含量的系统包括A1)、A2)或A3):
A1)CCL18抗体、CXCL1抗体,能与机体C1D IgG型自身抗体发生特异反应的物质、能与机体TM4SF1IgG型自身抗体发生特异反应的物质、能与机体FXR1IgG型自身抗体发生特异反应的物质和能与机体TIZ IgG型自身抗体发生特异反应的物质;
A2)CCL18抗体包被的微球、CXCL1抗体包被的微球,能与机体C1D IgG型自身抗体发生特异反应的物质包被的微球、能与机体TM4SF1IgG型自身抗体发生特异反应的物质包被的微球、能与机体FXR1IgG型自身抗体发生特异反应的物质包被的微球和能与机体TIZ IgG型自身抗体发生特异反应的物质包被的微球;
A3)CCL18抗体包被的酶标板、CXCL1抗体包被的的酶标板,能与机体C1D IgG型自身抗体发生特异反应的物质包被的的酶标板、能与机体TM4SF1IgG型自身抗体发生特异反应的物质包被的酶标板、能与机体FXR1IgG型自身抗体发生特异反应的物质包被的的酶标板和能与机体TIZ IgG型自身抗体发生特异反应的物质包被的酶标板。
上述系统和应用中,所述能与机体C1D IgG型自身抗体特异反应的物质可为C1D蛋白或其任一片段,所述能与机体TM4SF1IgG型自身抗体发生特异反应的物质可为TM4SF1或其任一片段,所述能与机体FXR1IgG型自身抗体发生特异反应的物质可为FXR1蛋白或其任一片段,所述能与机体TIZ IgG型自身抗体发生特异反应的物质可为TIZ或其任一片段。
为了解决上述问题,本发明还提供了辅助诊断上皮性卵巢癌和/或非卵巢来源的恶性肿瘤的系统。
本发明所提供的辅助诊断上皮性卵巢癌和/或非卵巢来源的恶性肿瘤的系统,包括检测血清中四种蛋白质含量的系统,所述四种蛋白质为C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体;所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
为了解决上述问题,本发明还提供了检测血清中四种蛋白质含量的系统在制备辅助诊断上皮性卵巢癌和/或非卵巢来源的恶性肿瘤的系统中的应用,所述四种蛋白质为C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体;所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
上述系统和应用中,所述检测血清中四种蛋白质含量的系统包括通过液态悬浮芯片法或ELISA法检测所述四种蛋白质的含量所需的试剂和/或仪器。
上述系统和应用中,所述检测血清中四种蛋白质含量的系统包括B1)、B2)或B3):
B1)能与机体C1D IgG型自身抗体发生特异反应的物质、能与机体TM4SF1IgG型自身抗体发生特异反应的物质、能与机体FXR1IgG型自身抗体发生特异反应的物质和能与机体TIZ IgG型自身抗体发生特异反应的物质;
B2)能与机体C1D IgG型自身抗体发生特异反应的物质包被的微球、能与机体TM4SF1IgG型自身抗体发生特异反应的物质包被的微球、能与机体FXR1IgG型自身抗体发生特异反应的物质包被的微球和能与机体TIZ IgG型自身抗体发生特异反应的物质包被的微球;
B3)能与机体C1D IgG型自身抗体发生特异反应的物质包被的的酶标板、能与机体TM4SF1IgG型自身抗体发生特异反应的物质包被的酶标板、能与机体FXR1IgG型自身抗体发生特异反应的物质包被的的酶标板和能与机体TIZ IgG型自身抗体发生特异反应的物质包被的酶标板。
上述系统和应用中,所述能与机体C1D IgG型自身抗体特异反应的物质可为C1D蛋白或其任一片段,所述能与机体TM4SF1IgG型自身抗体发生特异反应的物质可为TM4SF1或其任一片段,所述能与机体FXR1IgG型自身抗体发生特异反应的物质可为FXR1蛋白或其任一片段,所述能与机体TIZ IgG型自身抗体发生特异反应的物质可为TIZ或其任一片段。
为了解决上述问题,本发明还提供了诊断卵巢癌和/或非卵巢来源的恶性肿瘤的方法。
本发明所提供的诊断卵巢癌和/或非卵巢来源的恶性肿瘤的方法,包括检测来自待诊断患者的离体血清中六种蛋白质含量,根据所述六种蛋白质含量结合待诊断患者的临床症状诊断待诊断患者是否患有卵巢癌和/或非卵巢来源的恶性肿瘤;所述六种蛋白质为CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体;所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
为了解决上述问题,本发明还提供了诊断上皮性卵巢癌和/或非卵巢来源的恶性肿瘤的方法。
本发明所提供的诊断上皮性卵巢癌和/或非卵巢来源的恶性肿瘤的方法,包括检测来自待诊断患者的离体血清中四种蛋白质含量,根据所述四种蛋白质含量结合待诊断患者的临床症状诊断待诊断患者是否患有上皮性卵巢癌和/或非卵巢来源的恶性肿瘤;所述四种蛋白质为C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体;所述非卵巢来源的恶性肿瘤为乳腺癌、肝癌或肺癌。
上文中,所述血清可为人血清,所述机体可为人。
本申请中,C1D IgG型自身抗体针对的抗原是蛋白质C1D,TM4SF1IgG型自身抗体针对的抗原是蛋白质TM4SF1,FXR1IgG型自身抗体针对的抗原是FXR1,TIZ IgG型自身抗体针对的抗原是FXR1。
实验证明,液态悬浮芯片法联合检测血清CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这六种指标联合诊断人上皮性卵巢癌的敏感性和特异性分别为100%和96.7%,ELISA法检测血清CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量联合诊断上皮性卵巢癌的敏感性和特异性分别为96.1%和95.1%,两种检测方法的批内变异系数、批间变异系数均控制在12%以内,CUTOFF值验证结果95%以上的检测结果在CUTOFF值的范围。联合检测血清CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这六种指标联合诊断卵巢癌的敏感性和特异性为90.4%和98.1%,联合检测血清中C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这四种指标联合诊断上皮性卵巢癌的诊断的敏感性和特异性为75.7%和96.6%;联合检测血清CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这六种指标联合诊断浆液性卵巢癌的阳性率为77.61%,显著高于单独检测CA125诊断浆液性卵巢癌的阳性率67.16%。联合检测血清CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这六种指标联合诊断卵巢癌、乳腺癌、肝癌、肺癌患者中诊断的阳性率分别为94.9%、82.5%、77.5%、72.5%,对卵巢癌、乳腺癌、肝癌、肺癌患者诊断的ROC曲线下面积分别为0.983、0.960、0.918、0.938,说明检测六个指标联合诊断其他恶性肿瘤也有较高的诊断率。联合检测血清中C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量和TIZ IgG型自身抗体含量这四种指标联合诊断上皮性卵巢癌、乳腺癌、肝癌、肺癌的阳性率分别为85.2%、55.0%、52.5%、60.0%,对上皮性卵巢癌、乳腺癌、肝癌、肺癌患者诊断的ROC曲线下面积分别为0.905、0.865、0.873、0.891,检测四个指标联合诊断其他恶性肿瘤也有较高的诊断率。
附图说明
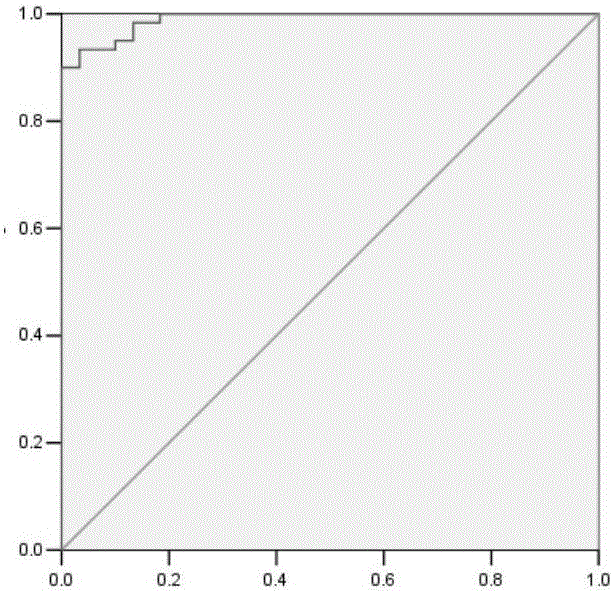
图1为ELISA法联合检测六种指标ROC曲线。
图2为液态悬浮芯片法联合检测六种指标ROC曲线。
图3为液态悬浮芯片法联合检测六指标诊断卵巢恶性肿瘤的ROC曲线。
图4为检测临床血清样本中的CA125含量诊断卵巢恶性肿瘤的ROC曲线。
图5为液态芯片法联合检测六指标诊断上皮性卵巢癌的ROC曲线。
图6为检测临床血清样本中的CA125含量诊断上皮性卵巢癌的ROC曲线。
图1-图6中,横坐标为1-特异度,纵坐标为灵敏度。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
1、融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ的制备
1.1、C1D、CCL18、CXCL1、TM4SF1、FXR1、TIZ原核表达载体的构建
采用Trizol试剂一步法提取卵巢组织(来源于广西医科大学附属肿瘤医院妇瘤科手术切除卵巢浆液性囊腺癌患者标本,并经病理确诊)总RNA,并逆转录得到cDNA模板,PCR扩增C1D蛋白编码基因、CCL18基因、CXCL1基因、TM4SF1基因、FXR1蛋白编码基因和TIZ基因。将纯化回收的PCR产物与pET SUMO(美国Invitrogen公司)连接,将连接产物转化Mach1TM-T1R感受态细胞(美国Invitrogen公司),将经过转化后的细胞在筛选培养基(含50μg/ml kanamycin的LB液体培养基)中培养,用pET SUMO自带引物以重组质粒为模板,进行行PCR反应鉴定转化子。将经过PCR验证已成功连接的菌液送北京诺赛基因组研究中心有限公司测序。将用核苷酸序列如GenBank Accesion Number NM_006333.3(Update Date是2015年3月15日)的第93-518位所示的人C1D蛋白编码基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-C1D,该人C1D蛋白编码基因编码氨基酸序列如GenBank Accesion Number NP_006324.1(Update Date是2015年3月15日)第1-141位所示的人C1D蛋白;pET-SUMO-C1D表达融合蛋白SUMO-C1D蛋白(由SUMO和C1D蛋白融合而成)。将用核苷酸序列如GenBank Accesion Number NM_002988.3(Update Date是2016年3月3日)的第132-341位所示的人CCL18基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-CCL18,该人CCL18基因编码氨基酸序列如GenBank Accesion Number NP_002979.1(Update Date是2016年3月3日)第21-89位所示的人CCL18;pET-SUMO-CCL18表达融合蛋白SUMO-CCL18(由SUMO和CCL18融合而成)。将用核苷酸序列如GenBank Accesion Number NM_001511.3(Update Date是2016年3月3日)的第182-403位所示的人CXCL1基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-CXCL1,该人CXCL1基因编码氨基酸序列如GenBank Accesion Number NP_001502.1(Update Date是2016年3月3日)第35-107位所示的CXCL1;pET-SUMO-CXCL1表达融合蛋白SUMO-CXCL1(由SUMO和CXCL1融合而成)。将用核苷酸序列如GenBank Accesion Number NM_014220.2(Update Date是2015年3月15日)的第235-843位所示的人TM4SF1基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-TM4SF1,该人TM4SF1基因编码氨基酸序列如GenBank Accesion Number NP_055035.1(Update Date是2015年3月15日)第1-202位所示的人TM4SF1;pET-SUMO-TM4SF1表达融合蛋白SUMO-TM4SF1(由SUMO和TM4SF1融合而成)。将用核苷酸序列如GenBank Accesion Number NM_005087.3(Update Date是2016年2月19日)的第241-2106位所示的人FXR1蛋白编码基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-FXR1,该人FXR1蛋白编码基因编码氨基酸序列如GenBank Accesion Number NP_005078.2(Update Date是2016年2月19日)第1-621位所示的人FXR1蛋白;pET-SUMO-FXR1表达融合蛋白SUMO-FXR1(由SUMO和FXR1蛋白融合而成)。将用核苷酸序列如GenBank Accesion Number NM_152360.3(Update Date是2015年3月15日)的第503-2326位所示的人TIZ基因插入pET SUMO的653和654位之间且保持pET SUMO的其它序列不变得到的重组表达载体命名为pET-SUMO-TIZ,该人TIZ基因编码氨基酸序列如GenBank Accesion Number NP_689573.3(Update Date是2015年3月15日)第1-607位所示的人TIZ,pET-SUMO-TIZ表达融合蛋白SUMO-TIZ(由SUMO和TIZ融合而成)。
1.2融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ的表达
将pET-SUMO-C1D、pET-SUMO-CCL18、pET-SUMO-CXCL1、pET-SUMO-TM4SF1、pET-SUMO-FXR1和pET-SUMO-TIZ这六个重组表达载体分别单独转化大肠杆菌BL21(DE3)感受态细胞,获得重组大肠杆菌。将转入pET-SUMO-C1D的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-C1D,将转入pET-SUMO-CCL18的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-CCL18,将转入pET-SUMO-CXCL1的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-CXCL1,将转入pET-SUMO-TM4SF1的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-TM4SF1,将转入pET-SUMO-TM4SF1的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-FXR1,将转入pET-SUMO-TIZ的重组大肠杆菌命名为BL21(DE3)/pET-SUMO-TIZ。
将BL21(DE3)/pET-SUMO-C1D、BL21(DE3)/pET-SUMO-CCL18、BL21(DE3)/pET-SUMO-CXCL1、BL21(DE3)/pET-SUMO-TM4SF1、BL21(DE3)/pET-SUMO-FXR1和BL21(DE3)/pET-SUMO-TIZ这六个菌株分别单独接种于含50μg/ml卡那霉素的LB液体培养基(在LB液体培养基中加入卡那霉素至卡那霉素的浓度为50μg/ml得到的培养基)中,37℃水平振摇培养(200-250rpm)养至0D600值(以含50μg/ml卡那霉素的LB液体培养基为空白对照)达到0.5时,加入IPTG至体系中IPTG的浓度为1mM进行诱导表达。上述诱导表达均是用1mM的IPTG在37℃诱导5-6小时。
由于诱导细菌表达的蛋白可能以可溶性或包涵体蛋白形式存在,两种存在形式的蛋白需采用两种不同的方式进行蛋白的纯化,所以为了验证目的蛋白的存在形式,将诱导并碎裂后的BL21(DE3)/pET-SUMO-C1D、BL21(DE3)/pET-SUMO-CCL18、BL21(DE3)/pET-SUMO-CXCL1、BL21(DE3)/pET-SUMO-TM4SF1、BL21(DE3)/pET-SUMO-FXR1和BL21(DE3)/pET-SUMO-TIZ菌液离心,分别取上清和沉淀,用pET-SUMO的特异性抗体His-tag(小鼠His-tag一抗)进行Western-Blot检测。结果显BL21(DE3)/pET-SUMO-C1D、BL21(DE3)/pET-SUMO-CCL18和BL21(DE3)/pET-SUMO-CXCL1在菌液碎裂以后的上清液里有目的蛋白条带,而BL21(DE3)/pET-SUMO-TM4SF1、BL21(DE3)/pET-SUMO-FXR1和BL21(DE3)/pET-SUMO-TIZ在菌液碎裂以后的沉淀里有目的蛋白的条带。SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ以包涵体蛋白形式存在。
1.3融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ的纯化
采用镍螯合柱亲和层析法从BL21(DE3)/pET-SUMO-C1D、BL21(DE3)/pET-SUMO-CCL18和BL21(DE3)/pET-SUMO-CXCL1的菌液碎裂以后的上清液中纯化目的蛋白,从BL21(DE3)/pET-SUMO-TM4SF1、BL21(DE3)/pET-SUMO-FXR1和BL21(DE3)/pET-SUMO-TIZ菌液碎裂以后的沉淀里纯化包涵体蛋白并进行复性,得到目的蛋白。将上述目的蛋白进行SDS-PAGE检测。结果表明纯化后的目的蛋白均为单一的目的条带,从BL21(DE3)/pET-SUMO-C1D的菌液碎裂以后的上清液中纯化得到融合蛋白SUMO-C1D;从BL21(DE3)/pET-SUMO-CCL18的菌液碎裂以后的上清液中纯化得到融合蛋白SUMO-CCL18;从BL21(DE3)/pET-SUMO-CXCL1的菌液碎裂以后的上清液中纯化得到融合蛋白SUMO-CXCL1;从BL21(DE3)/pET-SUMO-TM4SF1菌液碎裂以后的沉淀里纯化包涵体蛋白并进行复性得到融合蛋白SUMO-TM4SF1;从BL21(DE3)/pET-SUMO-FXR1菌液碎裂以后的沉淀里纯化包涵体蛋白并进行复性得到融合蛋白SUMO-FXR1;从BL21(DE3)/pET-SUMO-TIZ菌液碎裂以后的沉淀里纯化包涵体蛋白并进行复性得到融合蛋白SUMO-TIZ。
其中,包涵体蛋白的复性方法如下:
①洗脱后的蛋白液放入透析卡中;
②将透析卡放入装有1×PBS缓冲液中(加入1%氧化型和0.5%的还原型谷胱甘肽),4℃搅拌透析复性;
③每两小时换液一次,共换液四次,收集复性后的蛋白。
为了进一步验证所纯化的蛋白是否为融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ,将纯化的目的蛋白用His-tag抗体(小鼠His-tag一抗)进行Western-Blot检测,结果显示纯化的目的蛋白即实验所需的融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ。
2、多指标联合诊断上皮性卵巢癌液态悬浮芯片的制备
本实验通过摸索合适的条件成功的建立了液态悬浮芯片法检测血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体含量的体系,并分别用液态悬浮芯片法和ELISA法检测了30例体检正常妇女、30例卵巢良性肿瘤患者、60例上皮性卵巢癌患者血清内CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的水平。比较两种方法在诊断上皮性卵巢癌中的优劣。
2.1材料
2.1.1血清资料
血清标本均来自广西医科大学附属肿瘤医院妇瘤科2003年9月至2012年12月住院并经病理学检查确诊的卵巢肿瘤患者及2008年普查时的正常健康妇女。其中卵巢上皮性癌60例(恶性组),临床分期按国际妇产科联盟(FIGO,2004)标准,Ⅰ-Ⅱ期16例,Ⅲ-Ⅳ期44例;浆液性42例,黏液性18例;中位年龄46.7岁(13岁-73岁)。卵巢良性肿瘤组30例(良性组),卵巢黄素囊肿3例,卵巢巧克力囊肿13例,卵巢成熟畸胎瘤12例,卵巢黄体囊肿2例,患者中位年龄岁32.4(11岁-50岁)。正常健康妇女(对照组)30例,心肺、肝功均正常,既往无卵巢疾患,妇科检查及盆腔B超检查未发现异常,中位年龄34.4岁(25岁-45岁)。
2.1.2抗原、抗体
2.1.3主要试剂配制
(1)0.03MPB缓冲液:称取2.839Na2HPO4,1.369g KH2pO4定容至1L,调节pH至7.2。
(2)PB:0.0lM磷酸盐缓冲液:
PBS(pH 7.4):调节PB溶液的pH值至7.4,加水至IL。分装后高压蒸汽20min,或过滤除菌,保存于室温。
(3)SA-PE稀释液:PBS(pH7.4),1%BSA。
2.1.4主要仪器
2.2、液态悬浮芯片检测方法
2.2.1抗原、抗体的制备及脱盐
2.2.1.1抗原、抗体制备
将步骤1纯化的目的蛋白(融合蛋白SUMO-C1D、SUMO-CCL18、SUMO-CXCL1、SUMO-TM4SF1、SUMO-FXR1和SUMO-TIZ)先用超滤管超滤浓缩。
2.2.1.2抗原、抗体脱盐
(1)平衡柱子:用PBS(pH 7.4)平衡PD-10柱;
(2)上样:在柱子平衡后,将样品加到柱子;
(3)洗脱:样品全部进入柱子内后,柱顶加入水或适宜缓冲液洗脱;
(4)洗脱后,用Eppendorf小管每管收集1ml,SDS-PAGE鉴定是否有目的蛋白,并用BCA法测蛋白浓度。
2.2.2生物素化CCL18多克隆抗体和生物素化CXCL1多克隆抗体的制备
(1)将待生物素化的CCL18多克隆抗体、CXCL1多克隆抗体用PBS(pH 7.4)稀释到1mg/ml;
(2)用PBS(pH 7.4)对蛋白质充分透析;
(3)用1mlDMSO溶解N-羟基琥珀酰亚胺生物素(NHSB)1mg;
(4)向1ml蛋白质溶液加入120μl NHSB溶液;
(5)在室温下持续搅拌,保温2-4h;
(6)加入9.6μL1mol/L NH4Cl在室温下搅拌10min;
(7)将上述混合液加入到透析卡中,PBS液体4℃搅拌透析,以除去游离的生物素;得到生物素化CCL18多克隆抗体和生物素化CXCL1多克隆抗体。
2.2.3 BCA法测蛋白浓度
用BCA法测蛋白浓度。
2.2.4抗原、抗体包被微球反应
实验中所选择的微球为BIO-RAD公司生产Bio-Plex磁性聚苯乙烯磁性微球,Bio-Plex悬液芯片的核心技术是把微小的颗粒亦称微球(bead或microsphere)分别染成不同的荧光色,然后再把针对不同检测物的蛋白质或寡核苷酸探针以共价的方式耦联到不同颜色的磁珠上,磁珠直径为6.5um。磁珠的制作过程按照严格的搭配比例掺入两种不同的红色分类荧光染料,根据比例不同可以把球型基质分类为100种,从1到100进行编号。实验中选了了六种不同编号微球。本实验中的各种缓冲液均为BIO-RAD公司磁性微球配套使用的缓冲液,包括微球活化液、微球清洗液、微球储存液等,保证了实验过程中反应缓冲体系的稳定性及可靠性。
用CCL18单克隆抗体溶液(溶剂是PBS(pH 7.4),溶质是CCL18单克隆抗体,该溶液的浓度是8μg/mL)包被62号微球,得到CCL18(62号微球);用CXCL1单克隆抗体溶液(溶剂是PBS(pH 7.4),溶质是CXCL1单克隆抗体,该溶液的浓度是8μg/mL)包被34号微球,得到CXCL1(34号微球);用融合蛋白SUMO-C1D溶液(溶剂是PBS(pH 7.4),溶质是融合蛋白SUMO-C1D,该溶液的浓度是12μg/mL)包被29号微球,得到C1D(29号微球);用融合蛋白SUMO-C1D溶液(溶剂是PBS(pH 7.4),溶质是融合蛋白SUMO-C1D,该溶液的浓度是12μg/mL)包被29号微球,得到C1D(29号微球);用融合蛋白SUMO-TM4SF1溶液(溶剂是PBS(pH 7.4),溶质是融合蛋白SUMO-TM4SF1,该溶液的浓度是8μg/mL)包被37号微球,得到TM4SF1(37号微球);用融合蛋白SUMO-FXR1溶液(溶剂是PBS(pH 7.4),溶质是融合蛋白SUMO-FXR1,该溶液的浓度是4μg/mL)包被52号微球,得到FXR1(52号微球);用融合蛋白SUMO-TIZ溶液(溶剂是PBS(pH 7.4),溶质是融合蛋白SUMO-TIZ,该溶液的浓度是8μg/mL)包被55号微球,得到TIZ(55号微球)。
2.2.5液态悬浮芯片法检测血清自身抗原(CCL18和CXCL1)和血清自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)含量
(1)将CCL18(62号微球)、CXCL1(34号微球)、C1D(29号微球)、TM4SF1(37号微球)、FXR1(52号微球)和TIZ(55号微球)这6种偶联好的微球用Assay Buffer(溶质是BSA,溶剂是PBS(pH 7.4),溶质的质量百分浓度是1%)稀释至6×104个/ml浓度(3000个/孔);
(2)1400rpm震荡稀释后微球30秒,每孔加入50μl;
(3)清洗微球;
(4)用Assay Buffer稀释待检测人血清;
(5)每孔加入50μl稀释后的待检测人血清,空白孔加入Assay Buffer作为对照,将表达自身抗原(CCL18和CXCL1)和自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)的血清作为阳性对照;
表达自身抗原(CCL18和CXCL1)和自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)的血清通过ELISA法鉴定:将CCL18单克隆抗体、CXCL1单克隆抗体、融合蛋白SUMO-C1D、SUMO-TM4SF1、SUMO-FXR1或SUMO-TIZ分别包被96孔板,按照下述ELISA实验步骤操作,分别取5例正常、5例卵巢良性病变、14例卵巢癌血清做为待检测血清。将正常、良性卵巢肿瘤患者血清A450值与卵巢癌患者血清A450值比较,明显升高的卵巢癌患者血清为表达自身抗原(CCL18和CXCL1)和自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)的血清(也称CCL18、CXCL1抗原和C1D、TM4SF1、FXR1、TIZ抗体阳性血清),每个样本重复3个。
(6)避光室温1100rpm震荡30秒,700rpm震荡孵育1小时;
(7)运行清洗工作站MAG3×程序清洗微球;
(8)用Assay Buffer稀释生物素标记检测抗体(生物素化CCL18多克隆抗体、生物素化CXCL1多克隆抗体和生物素化羊抗人IgG-Fc);
(9)每孔加入对应的稀释的生物素标记检测抗体;
(10)避光室温1100rpm震荡30秒,700rpm震荡孵育30分钟;
(11)运行清洗工作站MAG3×程序清洗微球;
(12)用Assay Buffer将Streptavidin-PE(SA-PE)(100×)稀释成1×浓度;
(13)每孔加入50μl稀释后的SA-PE;
(14)避光室温1100rpm震荡30s,700rpm震荡孵育15分钟;
(15)运行清洗微球;
(16)每孔加入125μl Assay Buffer重悬微球;
(17)放于平板摇床上,1100rpm震荡1分钟;
(18)送入Bio-Plex仪器检测。
根据标准曲线对待检测人血清中的CCL18和CXCL1进行定量,对待检测人血清中的以下四种自身IgG型抗体进行定量:C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体。标准曲线的制备方法如下:用Assay Buffer配制SUMO-CCL18和SUMO-CXCL1浓度分别为100000ng/ml10000ng/ml、1000ng/ml、100ng/ml、10ng/ml、1ng/ml、100pg/ml、10pg/ml、1pg/ml、0pg/ml的标准品溶液。配制-系列浓度的100000ng/ml 10000ng/ml、1000ng/ml、100ng/ml、10ng/ml、1ng/ml、100pg/ml、10pg/ml、1pg/ml、0pg/ml标准品IgG蛋白(抗人C1D、抗人TM4SF1、抗人FXR1或抗人TIZ)以绘制样品检测剂量-反应的标准曲线,取直线范围之内的标准品做标准曲线。
2.3ELISA法检测血清自身抗原(CCL18和CXCL1)和血清自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)含量
(1)用抗原包被96孔酶标板,每孔加入100uL,37度2h;用PBS(pH 7.4)溶解溶质(融合蛋白SUMO-C1D、SUMO-TM4SF1、SUMO-FXR1或SUMO-TIZ),得到包被液,用该包被液包被96孔板,各包被液中溶质的浓度均为2ug/mL。
(2)甩尽包被液并拍干,按200μl/孔的量用洗板液洗板3次,每次振荡5分钟(洗涤液:PBS+0.5%吐温20)。
(3)加入封闭液(含BSA的PBS溶液)在37度封闭lh;SUMO-C1D包被板所用的封闭液的溶质是BSA,溶剂是PBS(pH 7.4),溶质的质量百分浓度是3%;SUMO-TM4SF1包被板所用的封闭液的溶质是BSA,溶剂是PBS(pH 7.4),溶质的质量浓度是5%;SUMO-FXR1包被板所用的封闭液的溶质是小牛血清,溶剂是PBS(pH 7.4),溶质的体积浓度是1%;SUMO-TIZ包被板所用的封闭液的溶质是脱脂奶粉,溶剂是PBS(pH 7.4),溶质的质量浓度是3%。
(4)拍干,按200μl/孔的量用洗板液洗板3次,每次振荡5分钟。
(5)将待检测血清用PBS(pH 7.4)稀释100倍后加到已包被的板上,每孔100μl。用PBS(pH 7.4)作为阴性对照,用表达自身抗原(CCL18和CXCL1)和血清自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)的血清作为阳性对照。37℃温育1小时。用洗液洗3次,加辣根过氧化物酶标兔抗人IgG,用PBS(pH 7.4)稀释,稀释度为1:40000,每孔100μl,37℃温育1小时。
(6)洗液洗3次,甩干。
(7)加入TMB显色液100ul每孔。
(8)加终止液,测定A450值。
将标准品IgG蛋白(抗人C1D、抗人TM4SF1、抗人FXR1或抗人TIZ)用PBS(pH 7.4)稀释成不同的浓度,按照上述步骤包被、洗板、封闭、与二抗反应、终止、测A450,根据包被浓度与相应的A450值绘制曲线,选取线性范围的包被浓度制作标准曲线,得到ELISA法检测血清C1D、TM4SF1、FXR1、TIZ IgG型自身抗体标准曲线。根据标准曲线对待检测人血清中的C1D、TM4SF1、FXR1、TIZ IgG型自身抗体进行定量,采用血清CCL18、CXCL1ELISA检测试剂盒检测血清自身抗原CCL18和CXCL1。
2.4液态悬浮芯片法与ELISA法分别进行六种指标联合检测的准确度和精密度比较
分别用2.2.5的液态悬浮芯片法和2.3的ELISA法检测血清自身抗原(CCL18和CXCL1)和血清自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)含量,每个检测指标重复检测20个复孔作为评价两种检测方法的批内变异系数,每个检测指标重复检测20天作为评价两种检测方法的批间变异系数。
采用SPSS13.0统计学软件进行统计分析,计量资料采用t检验,和方差分析,两种方法Logistic回归分析,绘制受试者工作曲线(ROC曲线),以P<0.05为有统计学意义。
2.4.1液态悬浮芯片法与ELISA检测法分别进行多指标联合检测的准确度比较
将检测结果绘制各自的ROC曲线,根据ROC曲线确定每个检测因子在诊断卵巢癌时判定阳性的CUTOFF值。ROC曲线是反映敏感性和特异性连续变量的综合指标,它对所有可能的阈值作计算显示敏感度和特异度之间相互关系,以FPR(1-特异度,1-specificity)为横坐标,TPR(灵敏度,sensitivity)为纵坐标,绘制ROC曲线,通过改变诊断界点,获得多对TPR与FPR值,从而能动态的、客观的反应诊断系统的效能,通过计算ROC曲线下面积AUC(Area Under the Curve,AUC)来评价诊断效率,曲线下面积越大,诊断准确性越高。
分别用2.2.5的液态悬浮芯片法和2.3的ELISA法检测六种指标(血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体)含量,通过Logisti回归分析计算出液态悬浮芯片法和ELISA法诊断上皮性卵巢癌的阳性预测值,根据阳性预测值分别绘制两种方法联合检测六种指标的ROC曲线(图1和2),以约登指数最大的诊断点为最佳诊断点,高于此界值定义为诊断阳性,低于此界值定义为阴性。分别计算两种方法联合诊断各自的阳性和阴性诊断例数,用四个表法比较两者进行多指标联合检测的准确度。结果用液态悬浮芯片法和ELISA法检测联合检测六种指标对上皮性卵巢癌诊断的ROC曲线下面积分别为0.990和0.984,液态悬浮芯片法和ELISA法联合检测六种指标诊断的准确度分别为98.33%和95.33%(表1),两者比较差异有统计学意义(P=0.02)。说明液态悬浮芯片法联合检测血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的准确度高于ELISA法。
表1、液态悬浮芯片法和ELISA法联合检测六种指标准确度的比较
液态悬浮芯片准确度:98.33%,ELISA准确度:95.33%,χ2=39.31,P=0.02
2.4.2液态悬浮芯片法与ELISA法分别进行六种指标联合检测的精密度比较
为了评价液态悬浮芯片法与ELISA法对上皮性卵巢癌诊断的精密度,以两种方法的批内变异系数和批间变异系数来进行精密度的评价。取正常血清、良性、卵巢癌患者血清各1例分别用2.2.5的液态悬浮芯片法和2.3的ELISA法检测六种指标(血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体)含量,每个检测指标重复检测20个复孔作为评价两种检测方法的批内变异系数(表2和3)。每个检测指标重复检测20天作为评价两种检测方法的批间变异系数(表4和5)。结果显示液态悬浮芯片法对血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体检测的精密度高于ELISA法。
表2两种方法批内变异系数(n=20)
表3两种方法批内变异系数(n=20)
表4两种方法批间变异系数(n=3,20天)
表5两种方法批间变异系数(n=3,20天)
表2-表5中,CCL18表示血清CCL18,CXCL1表示血清CXCL1,C1D表示血清C1D IgG型自身抗体,TM4SF1表示血清TM4SF1IgG型自身抗体,FXR1表示血清FXR1IgG型自身抗体,TIZ表示TIZ IgG型自身抗体。芯片表示2.2.5的液态悬浮芯片法,Elisa表示2.3的ELISA法。
通过检测本实验中液态悬浮芯片法进行六种指标联合检测诊断卵巢癌的准确度为98.33%;为了评价液态悬浮芯片法对上皮性卵巢癌诊断的精密度,以检测样本的批内变异系数(室内质控)和批间变异系数(室间指控)来进行精密度的评价,结果对于同一个样本同一时间检测的20个复孔、同一样本的重复检测20天的变异系数均小于12%。说明本实验建立的液态悬浮芯片检测体系对上皮性卵巢癌诊断的准确度高、误差小、稳定性好。
2.5液态悬浮芯片法与ELISA检测法分别进行六种指标联合检测的敏感性、特异性和同一致比较
2.5.1液态悬浮芯片法与ELISA检测法分别进行六种指标联合检测的敏感性、特异性比较
分别用2.2.5的液态悬浮芯片法和2.3的ELISA法检测六种指标(血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体)含量,通过Logisti回归分析计算出液态悬浮芯片法和ELISA法诊断上皮性卵巢癌的阳性预测值,根据阳性预测值分别绘制两种方法联合检测六种指标的ROC曲线,以约登指数最大的诊断点为最佳诊断点,高于此界值定义为诊断阳性,低于此界值定义为阴性。分别计算两种方法联合诊断各自的阳性和阴性诊断例数,用四个表法比较两者进行多指标联合检测的敏感度和特异度。结果液态悬浮芯片法联合检测血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量联合诊断上皮性卵巢癌的敏感性和特异性分别为100%和96.7%,ELISA法联合检测血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量联合诊断上皮性卵巢癌的敏感性和特异性分别为96.1%和95.1%(表6和表7)。液态悬浮芯片法和ELISA法联合检测的阳性似然比、阴性似然比、阳性预测值、阴性预测值、误诊率、漏诊率见表7,说明液态悬浮芯片法诊断上皮性卵巢的性能高于ELISA法。
表6液态悬浮芯片法和ELISA法联合检测六种指标灵敏度和特异度的比较
注:液态悬浮芯片表示2.2.5的液态悬浮芯片法,ELISA表示2.3的ELISA法。
表7液态悬浮芯片法和ELISA法联合检测六种指标诊断性能的比较
注:液态芯片表示2.2.5的液态悬浮芯片法,ELisa表示2.3的ELISA法。
2.5.2液态悬浮芯片法与ELISA检测法分别进行六种指标联合检测的同一性比较
将液态悬浮芯片法与ELISA法检测的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量做相关性分析,结果表明两种方法检测血清CCL18的相关系数为0.908,血清CXCL1的相关系数为0.928,血清C1D IgG型自身抗体的相关系数为0.896,血清TM4SF1IgG型自身抗体的相关系数为0.910,血清FXR1IgG型自身抗体相关系数为0.911,血清TIZ IgG型自身抗体的相关系数为0.887。说明两种检测方法的同一性好。
2.6液态悬浮芯片法与ELISA法分别进行六种指标联合检测的CUTOFF值验证
选取1例阳性表达血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的标本稀释至CUTOFF值附近,用2.2.5的液态悬浮芯片法与2.3的ELISA法检测的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量,重复检测20次。若95%以上结果落在临界范围(即CUTOFF值加减20%)则认为该CUTOFF值设定可靠。结果由表8所示,用液态悬浮芯片法与ELISA法检测的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量的CUTOFF值95%以上检测值均落在正常检测范围内。
表8液态悬浮芯片法与ELISA检测法CUTOFF值验证
液态悬浮芯片法将六种指标联合检测的敏感度、特异度均高于ELISA法。进一步验证两种法检测对联合诊断的同一性,结果两种方法有良好的同一性,但是液态悬浮芯片法较ELISA法有更大的检测范围。
综上所述,本实验成功的建立了液态悬浮芯片法联合检测血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体含量的检测体系,与传统的ELISA法相比,其灵敏度、特异度均高于ELISA法,且此检测方法联合检测六种指标对上皮性卵巢癌有高精密度、误差小及稳定性好的特点。
3、多指标联合检测卵巢癌的临床验证
本部分通过临床多样本的检测研究联合检测血清CCL18、CXCL1抗原、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体,并与应用较为广泛的卵巢癌标志物CA125比较,分别研究联合检测六指标和CA125对恶性盆腔包块诊断的价值和诊断性能、比较联合检测盒CA125对卵巢恶性肿瘤诊断的优劣性。
研究中发现六指标联合检测联合诊断不能很好的诊断出器官特异性肿瘤(卵巢癌和非卵巢癌),在其他恶性肿瘤血清中也会升高,在临床使用六指标检测时如果结合临床表现及其他辅助检查对卵巢来源和非卵巢来源的恶性肿瘤诊断效果会更好。但是,联合检测C1D、TM4SF1、FXR1、TIZ IgG型血清自身抗体对上皮性卵巢恶性肿瘤的阳性率明显高于其他恶性肿瘤,可以较好的区分上皮性卵巢恶性肿瘤与其他恶性肿瘤,如果结合临床症状和其他检查效果会更好。联合检测血清六指标诊断早期卵巢癌的效果好于检测自身抗体谱和CA125。联合检测六个指标对浆液性卵巢癌诊断好于CA125,联合检测六个指标对卵巢癌病理分级上与CA125差别不大。
3.1临床样本资料
血清标本均来自广西医科大学附属肿瘤医院妇瘤科2003年9月至2009年10月住院并经病理学检查确诊的盆腔包块患者及2008年普查时的正常健康妇女。其中卵巢恶性肿瘤119例(恶性组),临床分期按国际妇产科联盟(FIGO,2004)标准,Ⅰ-Ⅱ期37例,Ⅲ-Ⅳ期82例;浆液性67例,黏液性33例,其它5例;中位年龄48.5岁(16岁-75岁)。卵巢良性肿瘤组(盆腔良性包块组)(良性组)204例,子宫肌瘤42例,子宫腺肌症15例,输卵管结核4例,输卵管积水4例,输卵管囊肿7例,巧克力囊肿33例,黄体囊肿5例,黄素囊肿3例,成熟畸胎瘤42例,浆液性囊腺瘤20例,粘液性囊腺瘤18例,阔韧带肌瘤3例,其他18例;患者中位年龄43.6岁(15岁-59岁)。正常健康妇女(正常组)120例,心肺、肝功均正常;既往无卵巢疾患、无乳腺疾病、无肝脏疾病、无肺脏疾病史;妇科检查及盆腔B超检查未发现异常、胸片及腹部B超未发现异常;中位年龄41.5岁(21岁-70岁)。乳腺癌组乳腺癌女性患者40例,血清标本均来自广西医科大学第一附属医院胃肠腺体外科2007年8月至2009年2月住院并经病理学检测确诊的女性乳腺癌患者,所有确诊患者其临床分期和病理学分型均符合UICC乳腺癌诊治标准。Ⅰ-Ⅱ期27例,Ⅲ-Ⅳ期13例;浸润性导管癌34例,浸润性小叶癌5例,髓样癌1例;中位年龄56.7岁(20岁-75岁)。肝癌组肝癌女性患者40例,血清标本均来自广西医科大学附属肿瘤医院肝胆外科2009年3月至2010年9月住院并经病理学检测确诊的女性肝癌患者,所有确诊患者其临床分期和病理学分型均符合全国肝癌学术会议(2001)制定的原发性肝癌的临床诊断与分期标准;Ⅰ-Ⅱ期28例,Ⅲ-Ⅳ期12例;肝细胞癌37例,肝内胆管癌3例;中位年龄55.9岁(38岁-87岁)。肺癌组肺癌女性患者40例,血清标本均来自广西医科大学附属肿瘤医院胸瘤科2007年4月至2009年3月住院并经病理学检测确诊的女性肺癌患者,所有确诊患者其临床分期和病理学分型均符合UICC肺癌诊治标准;Ⅰ-Ⅱ期18例,Ⅲ-Ⅳ期22例;鳞癌22例,腺癌16例,小细胞肺癌2例;中位年龄54.3岁(22岁-68岁)。采血后4℃放置2小时,完全凝固后,2000rpm/min离心15分钟,吸取血清分装后-80℃保存。
表9、血清标本临床资料
3.2方法
3.2.1液态悬浮芯片法检测临床血清样本
采用2.2.5的液态悬浮芯片法检测临床血清样本中的血清自身抗原(CCL18和CXCL1)和血清自身IgG型抗体(C1D抗体、TM4SF1抗体、FXR1抗体和TIZ抗体)含量。
3.2.2液态悬浮芯片诊断恶性盆腔包块的诊断模型建立
使用SPSS13.0进行统计学处理,随机将研究对象分为模型创建组和模型验证组。对模型创建组使用基于最大似然估计的向前逐步回归法筛选变量,建立Logistic回归模型。将建立的诊断模型分别进行数学验证和临床验证。
3.2.3统计学方法
采用SPSS13.0软件进行Logistic回归分析建立卵巢癌诊断模型,计量资料以t检验,单因素方差分析进行统计学处理,以P<0.05为有统计学意义,绘制受试者工作特性(ROC)曲线,寻找灵敏度和特异度最佳的诊断阈值。
3.3、结果
3.3.1血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体在不同患者体内的含量
用液态悬浮芯片法检测了563例(正常健康妇女血清120例,卵巢良性肿瘤204例,卵巢恶性肿瘤119例,乳腺癌40例,肝癌40例,肺癌40例)血清样本中CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量,各指标在血清内的含量如表10所示:
(1)C1D IgG型自身抗体:正常组与良性组比较P1=0.082,正常组与恶性组比较P1=0.000,良性组与恶性组比较P1=0.000;正常组与乳腺癌组比较P1=0.001;正常组与肝癌组比较P1=0.007;正常组与肺癌组比较P1=0.029。可见血清内C1D IgG型自身抗体含量恶性组高于正常组和良性组,正常组和良性组无差别;乳腺癌组、肝癌组、肺癌组高于正常组。
(2)TM4SF1IgG型自身抗体:正常组与良性组比较P2=0.001,正常组与恶性组比较P2=0.000,良性组与恶性组比较P2=0.000;正常组与乳腺癌组比较P2=0.001;正常组与肝癌组比较P2=0.003;正常组与肺癌组比较P2=0.000。可见血清内TM4SF1IgG型自身抗体含量恶性组高于正常组和良性组,良性组高于正常组;乳腺癌组、肝癌组、肺癌组高于正常组。
(3)TIZ IgG型自身抗体:正常组与良性组比较P3=0.134,正常组与恶性组比较P3=0.000,良性组与恶性组比较P3=0.000;正常组与乳腺癌组比较P=0.000;正常组与肝癌组比较P=0.035;正常组与肺癌组比较P=0.009。可见血清内TIZ IgG型自身抗体含量恶性组高于正常组和良性组,正常组和良性组无差别;乳腺癌组、肝癌组、肺癌组高于正常组。
(4)FXR1IgG型自身抗体:正常组与良性组比较P4=0.611,正常组与恶性组比较P4=0.000,良性组与恶性组比较P4=0.000;正常组与乳腺癌组比较P4=0.000;正常组与肝癌组比较P4=0.000;正常组与肺癌组比较P4=0.000。可见血清内FXR1IgG型自身抗体含量卵巢恶性肿瘤组高于正常和良性组,正常组和良性组无差别;乳腺癌、肝癌、肺癌高于正常组。
(5)CCL18:正常组与良性组比较P5=0.008,正常组与恶性组比较P5=0.000,良性组与盆腔恶性组比较P5=0.000;正常组与乳腺癌组比较P5=0.000;正常组与肝癌组比较P5=0.002;正常组与肺癌组比较P5=0.002。可见血清内CCL18含量卵巢恶性肿瘤组高于正常组和良性组,良性组高于正常组;乳腺癌组、肝癌组、肺癌组高于正常组。
(6)CXCL1:正常组与良性组比较P6=0.001,正常组与恶性组比较P6=0.000,良性组与恶性组比较P6=0.000;正常组与乳腺癌组比较P6=0.000;正常组与肝癌组比较P6=0.000;正常与肺癌组比较P6=0.001。可见血清内CXCL1含量卵巢恶性肿瘤组高于正常组和良性组,良性组高于正常组;乳腺癌组、肝癌组、肺癌组高于正常组。
以上结果说明检测血清样本中血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量可以判断卵巢、乳腺、肝、肺肿瘤的良恶性。
表10、各指标在不同患者血清内的含量
P1:正常组与良性组比较;P2:正常组与恶性组比较;P3:良性组与恶性组比较;P4:正常组与乳腺癌组比较;P5:正常组与肝癌组比较;P6:正常组与肺癌组比较。CCL18表示血清CCL18含量,CXCL1表示血清CXCL1含量,C1D表示血清C1D IgG型自身抗体含量,TM4SF1表示血清TM4SF1IgG型自身抗体含量,FXR1表示血清FXR1IgG型自身抗体含量,TIZ表示TIZ IgG型自身抗体含量。
3.3.2液态悬浮芯片检测各个指性标诊断恶肿瘤的ROC曲线及诊断性能比较
3.3.2.1液态悬浮芯片检测各个指标诊断恶性肿瘤的ROC曲线下面积
用液态悬浮芯片法检测了563例(正常健康妇女血清120例,卵巢良性肿瘤204例,恶性239例:卵巢恶性肿瘤119例、乳腺癌40例、肝癌40例、肺癌40例)血清样本中CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量。根据检测得到的血清内血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体含量,分别绘制各个指标对恶性肿瘤诊断的ROC曲线,结果单独检测各个指标对恶性肿瘤诊断的ROC曲线下面积分别为0.917、0.913、0.762、0.727、0.830、0.865(表11)。
表11、液态芯片法单独检测各指标诊断恶性肿瘤ROC曲线下面积
表11中,CCL18表示血清CCL18含量,CXCL1表示血清CXCL1含量,C1D表示血清C1D IgG型自身抗体含量,TM4SF1表示血清TM4SF1IgG型自身抗体含量,FXR1表示血清FXR1IgG型自身抗体含量,TIZ表示TIZ IgG型自身抗体含量。
3.3.2.2液态悬浮芯片检测各个指标诊断恶性肿瘤诊断性能比较
根据绘制的ROC曲线上约登指数最大的点为诊断点(CA125:35U/ml,CCL18:145.09ng/ml,CXCL1:144.71pg/ml、C1D:112.65pg/ml、TM4SF1:132.85ng/ml、FXR1:121.26ng/ml、TIZ:176.54ng/ml),此时单独检测血清内CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体对恶性肿瘤诊断的敏感度和特异度分别是69.09%和87.09%、72.2%和87.76%、53.73%和84.79%、73.68%和86.32%、47.55%和83.00%、65.22%和83.19%。阳性似然比、阴性似然比、误诊率、漏诊率如表12所示,可见单独检测各个指标对恶性肿瘤诊断的诊断效果均不是很理想。
表12、液态芯片法检测六指标诊断恶性肿瘤的诊断性能比较
表11中,CCL18表示血清CCL18含量,CXCL1表示血清CXCL1含量,C1D表示血清C1D IgG型自身抗体含量,TM4SF1表示血清TM4SF1IgG型自身抗体含量,FXR1表示血清FXR1IgG型自身抗体含量,TIZ表示TIZ IgG型自身抗体含量。
3.3.3液态悬浮芯片诊断肿瘤的模型建立
由于单独检测各个指标对恶性肿瘤的诊断性能并不理想,本研究拟采用联合检测血清内CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量,研究联合检测各个指标联合诊断盆腔恶性肿瘤的诊断价值。
3.3.3.1联合检测六指标联合诊断卵巢癌的模型的建立及验证
3.3.3.1.1联合检测六指标联合诊断卵巢癌的模型的建立
Logistic主要应用于临床的诊断,根据危险因素预测某种疾病发生的概率。本实验主要是通过检测临床血清样本(59例卵巢恶性肿瘤、102例盆腔良性包块、60例正常健康妇女血清)血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量进行Logistic模型筛选,研究液态悬浮芯片联合检测的六种指标对盆腔恶性肿瘤的诊断意义,建立Logistic回归模型。通过SPSS软件的Logistic回归模块,单独对六种指标进行Logistic逐步筛选法筛选出判断对卵巢恶性肿瘤诊断有意义的因子,结果六种指标均是可以判断肿瘤良恶性的因子。然后采用最大似然估计分析表法得出六种指标相互作用的参数估计,标准差和各个参数的Wald检验结果,最后根据这些参数,得出盆腔恶性肿瘤的诊断模型及P值(联合检测六指标联合诊断卵巢癌的模型及P值):
Logit(P)=-11.151+0.008×C1D+0.011×TM4SF1+0.011×TIZ-0.008×FXR1+0.021×CCL18+0.20×CXCL1
P=exp(-11.151+0.008×C1D+0.011×TM4SF1+0.011×TIZ-0.008×FXR1+0.021×CCL18+0.20×CXCL1)/(1+exp(-11.151+0.008×C1D+0.011×TM4SF1+0.011×TIZ-0.008×FXR1+0.021×CCL18+0.20×CXCL1))
P为估计概率值,P大于等于0.5时预报为恶性,P小于0.5时预报为良性。
其中,C1D表示血清内C1D IgG型自身抗体含量,单位是pg/ml;
TM4SF1表示血清内TM4SF1IgG型自身抗体的含量,单位是ng/ml;
TIZ表示血清内TIZ IgG型自身抗体的含量,单位是ng/ml;
FXR1表示血清内FXR1IgG型自身抗体的含量,单位是ng/ml;
CCL18表示血清内CCL18的含量,单位是ng/ml;
CXCL1表示血清内CXCL1的含量,单位是pg/ml;
3.3.3.1.2六指标诊断盆腔恶性肿瘤的模型的验证
(1)数学验证:获得Logistic回归模型的参数估计以后需要对模型进行检验,包括对回归系数的检验及拟合优度的检验。应用Omnibus Tests of Model Coefficients对模型的归系数进行的卡方检验,是否显著相关,模型系数检验结果P=0.000,回归系数通过检验。最大似然估计值-2Loglikelihood范围在(0,正无穷大),一般观察此值是否随步数变化递增或递减,以判断方程收敛情况。所以,-2LL可用于检验Logistic回归的显著性。-2LL反映了在模型中包括了所有自变量后的误差,用于处理因变量无法解释的变动部分的显著性问题,又称为拟合劣度卡方统计量。当-2LL的实际显著性水平大于给定的显著性水平α时,因变量的变动中无法解释的部分是不显著的,意味着回归方程的拟合程度越好。本模型中-2Loglikelihood卡方值为141.933,大于临界卡方值12.592,说明模型拟合度好。Hosmer and Lemeshow Test是一个方程拟合度检验,假设拟合无偏差,查看P值,如果P>0.05,说明应该接受结果,即认同拟合方程与真实的方程基本没有偏差,也就是说这个P值越大越好,本模型Hosmer and Lemeshow Test的P=0.828。以上结果说明本模型可作为六种指标联合标志物联合诊断盆腔恶性肿瘤的可能性。
(2)临床验证:采用2.2.5的液态悬浮芯片法检测临床血清样本(剩余的60例卵巢恶性肿瘤、102例盆腔良性包块、60例正常健康妇女血清)中的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量联合诊断卵巢恶性肿瘤进行上述联合检测六指标联合诊断卵巢癌的模型的验证。采用2.2.5的液态悬浮芯片法检测临床血清样本(剩余的60例卵巢恶性肿瘤、102例盆腔良性包块、60例正常健康妇女血清)中的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量联合检测诊断卵巢恶性肿瘤(简称液态芯片法联合检测六指标联合诊断卵巢恶性肿瘤)ROC曲线下面积0.982(如图3),电化学发光法检测临床血清样本中的CA125诊断卵巢恶性肿瘤的的ROC曲线下面积是0.916(如图4)。液态芯片法联合检测六指标联合诊断卵巢恶性肿瘤(表12中简称“联合”)和电化学发光法检测临床血清样本中的CA125诊断卵巢恶性肿瘤(表12中简称“CA125”)的准确度、敏感度、特异度、阳性预测值、阴性预测值、LR+、LR-、漏诊率、误诊率如表13,可见诊断模型对于盆腔恶性肿瘤的诊断性能好于CA125。
表13、Logistic回归模型验证分析液态芯片法联合检测六指标诊断性能的比较
3.3.3.2联合检测四指标联合诊断上皮性卵巢癌的模型的建立及验证
采用2.2.5的液态悬浮芯片法检测临床血清样本中的血清C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量联合诊断上皮性卵巢癌。
3.3.3.2.1Logistic回归分析建立联合检测四指标联合诊断上皮性卵巢癌的模型
采用2.2.5的液态悬浮芯片法检测临床血清样本(55例卵巢上皮性癌(上皮性卵巢癌)、102例盆腔良性包块、60例正常健康妇女血清)中的血清C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量(简称四种指标)进行Logistic模型筛选,研究液态悬浮芯片联合检测的四种指标联合诊断盆腔恶性肿瘤的意义,建立Logistic回归模型。通过SPSS软件的Logistic回归模块,单独对四种指标进行Logistic逐步筛选法筛选出判断对卵巢恶性肿瘤诊断有意义的因子,结果四种指标均是可以判断肿瘤良恶性的因子。然后采用最大似然估计分析表法得出四种指标相互作用的参数估计,标准差和各个参数的Wald检验结果,最后根据这些参数,得出上皮性卵巢癌的诊断模型(联合检测四指标联合诊断上皮性卵巢癌的模型及P值):
Logit(P)=-5.137+0.013×C1D+0.14×TM4SF1+0.06×TIZ-0.06×FXR1
P=exp(-5.137+0.013×C1D+0.14×TM4SF1+0.06×TIZ-0.06×FXR1)/(1+exp(-5.137+0.013×C1D+0.14×TM4SF1+0.06×TIZ-0.06×FXR1))
P为估计概率值,P大于等于0.5时预报为恶性,P小于0.5时预报为良性。
其中,C1D表示血清内C1D IgG型自身抗体含量,单位是pg/ml;
TM4SF1表示血清内TM4SF1IgG型自身抗体的含量,单位是ng/ml;
TIZ表示血清内TIZ IgG型自身抗体的含量,单位是ng/ml;
FXR1表示血清内FXR1IgG型自身抗体的含量,单位是ng/ml。
3.3.3.2.2Logistic回归分析建立联合检测四指标联合诊断上皮性卵巢癌的模型验证
(1)数学验证:获得Logistic回归模型的参数估计以后需要对模型进行检验,包括对回归系数的检验及拟合优度的检验。应用Omnibus Tests of Model Coefficients对模型的回归系数进行的卡方检验,是否显著相关,模型系数检验结果P=0.000,回归系数通过检验。本模型中-2Loglikelihood卡方值为299.989大于临界卡方值9.488,说明模型拟合度好。本模型Hosmer and Lemeshow Test的P=0.734。以上结果说明本模型可作为四种指标联合标志物诊断上皮性卵巢癌的可能性。
(2)临床验证:采用2.2.5的液态悬浮芯片法检测临床血清样本(剩余的50例上皮性卵巢恶性肿瘤、102例盆腔良性包块、60例正常健康妇女血清)中的血清C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量进行上述联合检测四指标联合诊断上皮性卵巢癌的模型的验证(简称液态悬浮芯片联合检测四指标联合诊断上皮性卵巢癌)。液态悬浮芯片联合检测四指标联合诊断上皮性卵巢癌的ROC曲线下面积0.928(如图5),电化学发光法检测临床血清样本中的CA125诊断上皮性卵巢癌ROC曲线下面积是0.910(如图6)。液态悬浮芯片联合检测四指标联合诊断上皮性卵巢癌(表14中简称“联合”)和电化学发光法检测临床血清样本中的CA125诊断上皮性卵巢癌(表14中简称“CA125”)准确度、敏感度、特异度、阳性预测值、阴性预测值、LR+、LR-、漏诊率、误诊率如表14,可见液态悬浮芯片联合检测四指标诊断上皮性卵巢癌对于上皮性卵巢癌的诊断性能好于CA125。
表14、Logistic回归模型验证分析联合检测四指标诊断上皮性卵巢癌诊断性能的比较
3.3.3.3六指标联合检测诊断卵巢和非卵巢恶性肿瘤及四指标联合检测(自身抗体谱)诊断卵巢上皮性恶性肿瘤
3.3.3.3.1六指标联合诊断卵巢和非卵巢恶性肿瘤
采用2.2.5的液态悬浮芯片法检测临床血清样本(119例卵巢恶性肿瘤、40例乳腺癌、40例肝癌、40例肺癌患者血清)中的血清CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体和TIZ IgG型自身抗体的含量(简称液态悬浮芯片法联合检测六指标),根据上述联合检测六指标联合诊断卵巢癌的模型及P值评价液态悬浮芯片法联合检测六指标在卵巢癌及其他肿瘤中的阳性率。结果见表15和表16,液态悬浮芯片法联合检测六指标在卵巢癌、乳腺癌、肝癌、肺癌患者中诊断的阳性率分别为94.9%、82.5%、77.5%、72.5%,液态悬浮芯片法联合检测六指标对卵巢癌、乳腺癌、肝癌、肺癌患者诊断的ROC曲线下面积分别为0.983、0.960、0.918、0.938,说明联合检测六个指标对其他恶性肿瘤的诊断也有较高的诊断率。
虽然液态悬浮芯片法联合检测六指标不能很好的诊断出器官特异性肿瘤(卵巢癌和非卵巢癌),在其他恶性肿瘤血清中也会升高,在临床使用液态悬浮芯片法联合检测六指标检测时如果结合临床表现及其他辅助检查对卵巢来源和非卵巢来源的恶性肿瘤诊断效果会更好。
表15、液态悬浮芯片法检测联合检测六指标对恶性肿瘤阳性率
表16、液态悬浮芯片法检测联合检测六指标对恶性肿瘤的诊断性能
3.3.3.3.2自身抗体谱诊断上皮性卵巢癌诊断性能比较
采用2.2.5的液态悬浮芯片法检测临床血清样本(105例上皮性卵巢癌、40例乳腺癌、40例肝癌、40例肺癌患者血清)中的血清C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量(简称液态悬浮芯片法联合检测四指标或自身抗体谱检测),根据上述联合检测四指标联合诊断上皮性卵巢癌的模型及P值评价联合四指标检测在其他肿瘤中的阳性率。液态悬浮芯片法联合检测四指标在上皮性卵巢癌、乳腺癌、肝癌、肺癌患者中的阳性率分别为85.2%、55.0%、52.5%、60.0%(表17和18)。液态悬浮芯片法联合检测四指标对上皮性卵巢癌、乳腺癌、肝癌、肺癌患者诊断的ROC曲线下面积分别为0.905、0.865、0.873、0.891,联合检测四个指标对上皮性卵巢恶性肿瘤的阳性率明显高于其他恶性肿瘤,如果结合临床表现,联合检测四个指标可以较好的区分上皮性卵巢恶性肿瘤与其他恶性肿瘤,如果结合临床症状和其他检查效果会更好。
表17、液态悬浮芯片法联合检测四指标对恶性肿瘤阳性率
表18、液态悬浮芯片法检测联合检测四指标对恶性肿瘤的诊断性能
3.3.3.4六指标联合检测、自身抗体谱检测、CA125检测在诊断早期(Ⅰ-Ⅱ期)卵巢恶性肿瘤的ROC曲线及诊断性能的比较
3.3.3.4.1六指标联合检测、自身抗体谱检测、CA125检测在诊断早期(Ⅰ-Ⅱ期)卵巢恶性肿瘤的ROC曲线下面积比较
采用2.2.5的液态悬浮芯片法检测204例卵巢良性肿瘤患者和37例Ⅰ-Ⅱ期卵巢恶性肿瘤患者血清样本中六指标(CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量、TIZ IgG型自身抗体含量)、自身抗体谱(血清C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体)含量,分别绘制各个指标单独检测及六指标、自身抗体谱联合检测对Ⅰ-Ⅱ卵巢恶性肿瘤诊断的ROC曲线。电化学发光法检测临床血清样本中的检测血清CA125的含量绘制CA125检测对Ⅰ-Ⅱ卵巢恶性肿瘤诊断的ROC曲线。结果表明单独检测CCL18含量、CXCL1含量、C1D IgG型自身抗体含量、TM4SF1IgG型自身抗体含量、FXR1IgG型自身抗体含量、TIZ IgG型自身抗体含量单独诊断Ⅰ-Ⅱ卵巢恶性肿瘤和单独检测CA125含量单独诊断Ⅰ-Ⅱ卵巢恶性肿瘤的ROC曲线下面积分别为0.848、0.896、0.737、0.809、0.784、0.857、0.706,可见单独检测各指标对Ⅰ-Ⅱ期卵巢恶性肿瘤诊断效果均不高。联合检测六指标联合诊断Ⅰ-Ⅱ期卵巢恶性肿瘤的ROC曲线下面积是0.976,联合检测自身抗体谱联合诊断Ⅰ-Ⅱ期卵巢恶性肿瘤诊断的ROC曲线下面积是0.929,说明联合检测六个指标对Ⅰ-Ⅱ期卵巢恶性肿瘤的诊断效果好于检测自身抗体谱和单独检测CA125。
3.3.3.4.2六指标联合检测、自身抗体谱检测、CA125检测在诊断早期(Ⅰ-Ⅱ期)卵巢恶性肿瘤的性能的比较
根据ROC曲线进一步分析单独检测血清CA125的含量和联合检测六指标、联合检测抗体谱对Ⅰ-Ⅱ期卵巢性恶性肿瘤的诊断性能。以最大约登指数作为诊断值(CA125:35U/ml,联合检测六指标:0.213,联合检测抗体谱:0.311)计算诊断效能。由表19可见单独检测血清CA125的含量对卵巢恶性肿瘤诊断的灵敏度和特异度分别是29.7%和74.2%,联合检测六指标对Ⅰ-Ⅱ卵巢恶性肿瘤联合诊断的敏感度和特异度分别是69.37%和93.58%,联合检测自身抗体谱对Ⅰ-Ⅱ卵巢恶性肿瘤诊断的敏感度和特异度分别是60.29%和80.31%。分别计算阳性似然比和阴性似然比及误诊率和漏诊率,结果表明液态芯片法联合检测六指标阳性似然比高于CA125,而阴性似然比低于CA125;误诊率和漏诊率均低于CA125。可见联合检测血清六指标联合诊断Ⅰ-Ⅱ期卵巢癌的效果好于检测自身抗体谱和CA125。
表19、CA125和液态芯片法联合检测六指标及抗体谱对I-II期卵巢恶性肿瘤诊断性能的比较
3.3.3.5液态悬浮芯片联合检测六指标对浆液性卵巢癌的诊断价值
采用2.2.5的液态悬浮芯片法检测67例浆液性卵巢癌患者血清中的CCL18、CXCL1、C1D IgG型自身抗体、TM4SF1IgG型自身抗体、FXR1IgG型自身抗体、TIZ IgG型自身抗体的含量(简称液态悬浮芯片法联合检测六指标),根据上述联合检测六指标联合诊断卵巢癌的模型及P值评价液态悬浮芯片法联合检测六指标在浆液性卵巢癌患者血清中的阳性率,电化学发光法检测临床血清样本中的67例浆液性卵巢癌患者血清中的CA125含量在浆液性卵巢癌患者血清中的阳性率,结果显示:液态悬浮芯片法联合检测六指标联合诊断浆液性卵巢癌的阳性率为77.61%(67例浆液性卵巢癌患者,检测出52例阳性),单独检测CA125诊断浆液性卵巢癌的阳性率为67.16%(67例浆液性卵巢癌患者,检测出45例阳性),两者比较差异有统计学意义(P=0.008)。说明液态悬浮芯片法联合检测六指标对浆液性卵巢癌诊断好于CA125。众所周知上皮性卵巢癌单克隆抗体是由浆液性卵巢癌细胞株OVCA133所产生的,所以CA125对浆液性卵巢癌敏感,对卵巢癌的诊断有重要意义,通过研究发现联合检测六指标对浆液性卵巢癌的诊断具有更高的价值。
- 还没有人留言评论。精彩留言会获得点赞!