基于表面等离子体激元共振检测蛋白激酶的方法与流程
本发明涉及一种用于蛋白激酶检测的表面技术,特别涉及基于表面等离子体激元共振检测蛋白激酶的方法,属于化学领域。
背景技术:
蛋白质的磷酸化在细胞增殖与分化、细胞间的信息传递、基因表达等方面具有决定性作用。蛋白激酶是一种能够催化蛋白质发生磷酸化反应的酶。研究表明,一些重大疾病(如糖尿病、阿尔茨海默病、癌症、代谢综合征等)的发生与蛋白激酶的含量和活性变化密切相关。因此蛋白激酶的检测在这些重大疾病的诊断和治疗研究等方面具有重要意义。目前用于检测蛋白激酶的方法主要有放射性同位素法、荧光法、电化学和质谱法等,但这些方法耗时耗力、分析检测成本较高,且需要对酶催化基底(通常是腺苷三磷酸ATP)进行标记。介于磷酸化反应在研究生命活动及疾病防治中的重大作用,建立一种低成本、简单快速、适于在一般实验室或临床中分析测定蛋白激酶含量的方法是科学研究的热点之一。表面等离子体激元共振(Surface Plasmon Resonance,SPR)技术是通过测定超薄金属吸附层的变化来研究生物分子之间相互作用的一种表面技术。它在动力学研究、定量分析等方面具有灵敏、快速、无需标记、实时监测等独特的优势,在蛋白质及核酸等生物分子检测方面具有广阔的应用前景。最常使用的检测体系是利用抗体分子捕获目标蛋白质,通过抗原-抗体作用实现蛋白质的定量检测。然而,抗体的制备成本较高、稳定性较差,它在SPR芯片表面的固定方式及空间定位取向会严重影响抗原-抗体的相互作用。在蛋白质磷酸化过程中,蛋白激酶对底物的识别(通常是与底物蛋白中某一多肽片段的相互作用)是磷酸化反应的关键步骤。基于这种催化反应的特性及蛋白激酶与底物相互作用的特点,与底物蛋白中发生磷酸化反应的多肽片段结构类似的多肽分子往往是抑制蛋白激酶活性的有效抑制剂,它能够与蛋白激酶发生较强的作用,但不会发生磷酸化反应。例如,含有RRNAI结构片段的多肽分子是抑制蛋白激酶A活性的有效抑制剂,它能够与蛋白激酶A的催化部分发生较强的作用。相对于抗体,多肽分子具有制备成本低、稳定性较好、序列可控等优点。所以,蛋白激酶的多肽类抑制剂有望取代抗体,成为一种新型的能够识别蛋白激酶的靶点分子。基于多肽这种识别能力的表面技术尚未见报道,因此,采用多肽作为蛋白激酶受体,开发研制一种用于蛋白激酶高灵敏和选择性检测的表面传感技术是十分必要的。另外,生物分子在基底上的固定方式及覆盖密度、蛋白质在传感器表面的非特异性吸附是表面传感技术要解决的关键问题。早期的生物分子固定方式是通过物理吸附作用直接将生物分子固定到金膜或银膜表面,然而,这种吸附作用不仅容易导致生物分子变性或活性丧失,还容易使得分析样品与基底产生很强的非特异性吸附。含特殊基团的自组装膜或生物功能膜基底能够使得生物分子保持活性,同时还能够降低非特异性吸附。最成功的自组装膜是在金膜上修饰含巯基或二硫键的分子,这种自组装膜是依据金和巯基之间强的金硫键而形成的。依据巯基分子另一端基团(通常是羧基或者胺基)的反应活性,可以通过合适的交联剂,将生物分子固定于基底表面。SPR技术中常用的自组装膜主要包括巯基羧酸、羧甲基葡聚糖、聚乙烯醇、聚赖氨酸、链霉亲和素、三乙酸氨等。然而,这些自组装膜也存在一些不足之处,例如:制备过程复杂、成本较高、防止蛋白质的非特异性能力较差等。
技术实现要素:
本发明的目的在于提供一种基于表面等离子体激元共振检测蛋白激酶的方法。
本发明所提供的基于表面等离子体激元共振检测蛋白激酶的方法,包括以下步骤:A:采用金膜作为感应层,所述的金膜在使用之前先用无水乙醇浸泡10分钟,超声清洗5分钟,再用二次水冲洗干净,并用N2吹干,清洗干净后,用H2火焰在金片表面退火,先预热,在将金膜与H2火焰呈45度角均匀退火30秒,用以清洁表面,去除表面非特异性吸附的物质;
B:将步骤A处理后的金膜在氨基酸序列如SEQ ID NO :1的多肽P1溶液中浸泡12小时,多肽P1的氨基酸序列为CPPPPTTYADFIASGRTGRRNAIHD,然后将金膜用二次水冲洗干净、N2吹干,再将上述金膜在氨基酸序列如SEQ ID NO :2的多肽P2溶液中浸泡2 小时封闭未反应的金表面,多肽P2的氨基酸序列为CPPPP,再依次用DMSO、二次水冲洗干净金膜表面后用N2吹干,制得的P1多肽、P2修饰的传感金膜密封存储在-18℃下备用;
C:将步骤C制得的多肽P1、多肽P2修饰的传感金膜置于SPR仪器上,当入射光从棱镜向金属薄膜传播时,入射角大于临界角的时候,则会全内反射,产生消逝波,消逝波会诱发金属表面产生等离子体,当消逝波和等离子体的波矢量相同时,二者发生共振,全反射条件破坏,入射光能量被金属表面电子吸收,光波能量变成金属表面电子的运动,导致反射光的能量急剧下降,因此反射光谱上出现共振峰,共振峰即反射强度最低值,此时对应的入射角即为共振角,因为金膜表面的结构或厚度的变化表现为共振角度的变化,当基线稳定后,对应一个共振角度,即SPR响应信号,在上述的传感金膜上流动注射蛋白激酶,当蛋白激酶与金膜表面的多肽结合后,会产生一个新的共振角度,共振角的大小即为SPR响应信号,进一步的,当蛋白激酶作用于金膜表面后,再流动注射NaOH溶液,可以破坏多肽与蛋白激酶之间的相互作用,SPR响应值降低至初始大小,从而使得芯片再生。
本发明在蛋白激酶识别肽的氮端引入一个半胱氨酸残基(C)和四个刚性较强的脯氨酸残基(PPPP),多肽通过半胱氨酸残基中的巯基与金膜之间的Au-S作用被固定于金膜表面,四个刚性较强的脯氨酸残基使得多肽能够直立于金膜表面,从而有利于多肽与蛋白激酶的相互作用。同时,为了防止血清中其它蛋白质在芯片表面的非特性吸附,本发明采用五肽CPPPP封闭未反应的金膜表面,有利于防止蛋白质的非特异性吸附,同时不影响蛋白激酶与识别肽的相互作用。本发明涉及的多肽固定方法具有步骤简单、成本低、效果好等优点。本发明中的SPR传感技术具有灵敏快速、步骤简单、无需标记、传感芯片可再生、实时监测等优点;本发明中采用的蛋白激酶的受体是多肽分子,相对于传统的受体(抗体),多肽具有制备简单、成本低、稳定性好等优点;本发明中多肽的固定方法操作简单、成本低,并且能够有效防止蛋白质的非特异性吸附。
附图说明
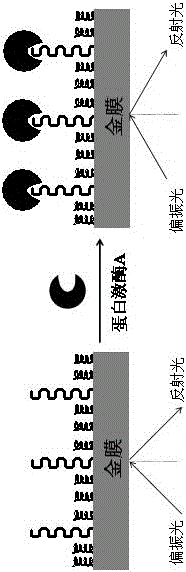
图1.是SPR技术检测蛋白激酶A的实验原理图。
图2是 流动注射蛋白激酶A到不同传感金膜表面的SPR响应曲线图。
图3是SPR传感金膜的再生性研究。
图4是SPR响应值与蛋白激酶A浓度之间的线性关系图。
图5是SPR动力学曲线。
图6是在传感金膜表面注射不同蛋白质的SPR响应信号。
具体实施方式
了更充分地解释本发明的实施,提供本发明的实施实例。这些实施实例仅仅是对该工艺的阐述,不限制本发明的范围,本发明中用以下实施例说明,但不限于下述实施例,任何变化实施都包含在本发明的技术范围内。本发明中各种缩写所代表的物质分别为:CPPPPTTYADFIASGRTGRRNAIHD:P1多肽的氨基酸序列,CPPPP:P2多肽的氨基酸序列,TCEP:三(2-羧乙基)膦,PBS:磷酸盐缓冲液,SPR:表面等离子体激元共振。mM、µM、nM均为浓度单位,分别代表10-3 mol/L、10-6 mol/L、10-9 mol/L。以下实施例以蛋白激酶A作为待测蛋白激酶进行具体阐述。对附图进一步的解释,图1中,代表多肽P1/P2修饰的金膜,代表蛋白激酶A,为了清晰表示,图中分子均未按实际比例给出。图2中曲线a为在多肽P1/P2修饰的金膜表面流动注射蛋白激酶A的SPR曲线,曲线b为在多肽P2修饰的金膜表面流动注射蛋白激酶A的SPR曲线。图2中载液的流速是10 µL/min。图3是多肽P1/P2修饰的金膜经NaOH溶液再生不同次数后再流动注射蛋白激酶A的SPR响应信号。图4为SPR响应信号与蛋白激酶A浓度的线性关系图,蛋白激酶A的浓度依次为0.1, 1, 5, 10和20 nM。图5中的实线是在多肽P1/P2修饰的金膜表面流动注射三个不同浓度的蛋白激酶A的SPR响应曲线,虚线是根据测试结果模拟出来的SPR动力学曲线,蛋白激酶A的浓度依次为12.5、25和50 nM,载液的流速是30 µL/min。图6是在多肽P1/P2修饰的金膜表面流动注射牛血清蛋白(1),免疫球蛋白G(2),凝血酶(3),溶菌酶(4),蛋白激酶A(5)的SPR响应信号大小。蛋白激酶A的浓度为20 nM,1~4的浓度均为0.1 mg/mL。
实施例1
SPR传感芯片的制备,步骤如下:
(1)50 nm厚度的金膜购自美国Biosensing Instrument公司。该公司的金膜的基本构成是在18 mm × 18 mm的载玻片上,先镀上2 nm厚的Cr金属膜,用以增强金和玻璃之间的结合力,然后镀上50 nm厚的金作为感应层;
(2)金膜在使用之前先用无水乙醇浸泡10分钟,超声5分钟,再用二次水冲洗干净,并用N2吹干;
(3)清洗干净后,用H2火焰在金片表面退火,先预热,再以45度角度H2火焰均匀退火30秒,用以清洁表面,消除非特异性吸附;
(4)多肽P1用二次水溶解至1 mM,然后用10 mM pH 7.2 的PBS溶液稀释至10 µM,多肽P2用DMSO溶解至5 mM,然后用10 mM pH 7.2 的PBS溶液稀释至0.5 mM,TCEP用水溶解至10 mM;
(5)将干净的金膜在5 mL 10 mM包含50 µM TCEP和10 µM多肽P1的PBS溶液中浸泡12小时,然后将金膜用二次水冲洗干净、N2吹干。再将上述金膜在浓度为10 µM的多肽P2溶液中浸泡4小时,封闭未反应的金表面。金膜表面依次用1% DMSO、二次水冲洗干净,再用N2吹干。制得的多肽P1/P2修饰的金膜密封存储在-18℃冰箱中备用;
(6)多肽P2修饰的金膜的制备步骤为:将干净的金膜在浓度为0.5 mM的多肽P2溶液中浸泡4小时,再依次用1% DMSO、二次水冲洗干净,最后用N2吹干。制得的多肽P2修饰的金膜密封存储在-18℃冰箱中待用。
实施例2:
蛋白激酶A在实施例1中的金膜表面的特异性和非特异性作用,步骤如下:
(1)蛋白激酶A用10 mM pH 7.2 PBS缓冲液稀释;
(2)将制备好的P1/P2修饰的金膜置于SPR仪器上,当基线稳定后,流动注射25 nM的蛋白激酶A溶液,记录SPR响应信号,直到平稳。载液是10 mM pH 7.2的PBS缓冲液,流速是10 µL/min;
(3)将制备好的P2修饰的金膜置于SPR仪器上,当基线稳定后,流动注射25 nM的蛋白激酶A溶液,记录SPR响应信号,直到平稳。载液是10 mM pH 7.2的PBS缓冲液,流速是10 µL/min;
(4)比较在不同金膜表面流动注射蛋白激酶A溶液的SPR响应信号,如图2所示:蛋白激酶A在多肽P1/P2修饰的金膜表面产生了较强的SPR响应信号,这是由蛋白激酶A和多肽P1之间的特异性相互作用所致。蛋白激酶A在多肽P2修饰的金膜表面几乎没有SPR响应信号,表明蛋白激酶A在P2修饰的金膜表面没有非特异性吸附作用。这说明多肽P2能够封闭未反应的金表面,从而有效防止非特异性吸附。
实施例3:传感芯片的再生,步骤如下:
(1)蛋白激酶A用10 mM,pH 7.2 PBS缓冲液稀释;
(2)将制备好的P1/P2修饰的金膜置于SPR仪器上,当基线稳定后,流动注射25 nM的蛋白激酶A溶液,记录SPR响应信号,直到平稳。载液是10 mM pH 7.2的PBS缓冲液,流速是10 µL/min;
(3)在步骤(2)的检测通道中注射50 mM NaOH溶液,流速是10 µL/min,将结合到传感金膜表面的蛋白激酶A洗脱,使得传感金膜再生,直到SPR信号达到注射蛋白激酶A之前的大小,为下一个样品的检测做准备;
(4)向步骤(3)得到的表面上注射与步骤(2)中同一浓度的蛋白激酶A溶液,记录SPR信号,直到基线平稳,与步骤(2)中信号强度进行比较;
(5)重复步骤2-4,比较SPR信号变化。从图3可以看出,多肽P1/P2修饰的金膜经过3次再生后,SPR响应信号几乎没变化,说明该传感金膜可以再生重复利用,从而降低了分析成本、节约了检测时间。经过8次再生循环后,SPR响应信号降低了10.5%。
实施例4:SPR响应值与蛋白激酶A浓度的关系,步骤如下:
(1)蛋白激酶A用10 mM pH 7.2 PBS缓冲液稀释至不同浓度;
(2)将多肽P1/P2修饰的金膜置于SPR仪器上,流动注射一定浓度的蛋白激酶A溶液,记录SPR响应信号,直到平稳。载液是10 mM pH 7.2的PBS缓冲液,流速是10 µL/min;
(3)在步骤(2)的检测通道中注射50 mM NaOH溶液,将结合到传感金膜表面的蛋白激酶A洗脱,使得传感金膜再生,为下一个样品的检测做准备;
(4)在步骤(3)的检测通道中注射另一浓度的蛋白激酶A溶液,记录SPR响应信号,直到平稳;
(5)重复步骤2-4,记录SPR响应信号。不同浓度的蛋白激酶A与传感金膜接触后,结合到表面的蛋白激酶A数量不同,因此引起SPR响应信号也不同。以蛋白激酶A浓度为横坐标,SPR响应值为纵坐标,得到标准曲线图。从图4中可以看出,在0.1 ~ 20 nM的浓度范围内,SPR响应信号与蛋白激酶A浓度成线性关系。当蛋白激酶A浓度高于20 nM之后,SPR响应信号随蛋白激酶A浓度增加而增加的幅度减小,不在该线性范围内,这是由于蛋白激酶A在传感金膜表面的吸附量达到了一定饱和度,不利于蛋白激酶A与金膜表面的多肽相互作用。
实施例5:SPR动力学分析,步骤如下:
(1)蛋白激酶A用10 mM pH 7.2 PBS缓冲液稀释;
(2)将制备好的P1/P2修饰的金膜分别置于SPR仪器上,当基线稳定后,分别流动注射12.5、25和50 nM的蛋白激酶A溶液,记录SPR响应信号,直到平稳。载液是10 mM pH 7.2的PBS缓冲液,流速是30 µL/min;
(3)采用SPR系统的Srubber程序对上述测试结果进行动力学分析,如图5所示,动力学模拟曲线(虚线)与实际测定的曲线(实线)吻合性较好,计算得出多肽P1与蛋白激酶A的作用系数为13.8 nM。
实施例6: 传感金膜的选择性分析,步骤如下:
(1)所有的蛋白质均是用10 mM pH 7.2 PBS缓冲液配制稀释;
(2)将多肽P1/P2修饰的金膜置于SPR仪器上,分别流动注射不同的蛋白质溶液,直到基线平稳,记录SPR响应值。如图6所示,其它蛋白质在多肽P1/P2修饰的金膜表面引起的SPR响应信号相比于蛋白激酶A产生的信号可以忽略不计,说明该传感技术对蛋白激酶A的选择性较好,可以用于蛋白激酶A的检测。图中蛋白质为:1-牛血清蛋白,2-免疫球蛋白G,3-凝血酶, 4-溶菌酶,5-蛋白激酶A。蛋白激酶A的浓度为20 nM,1~4的浓度均为0.1 mg/mL。
在详细说明本发明的实施方式之后,熟悉该项技术的人士可清楚地了解,在不脱离上述申请专利范围与精神下可进行各种变化与修改,凡依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均属于本发明技术方案的范围,且本发明亦不受限于说明书中所举实例的实施方式。
SEQUENCE LISTING
<110> 安阳师范学院
<120> 基于表面等离子体激元共振检测蛋白激酶的方法
<130> 2010
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 25
<212> PRT
<213> 人工序列
<400> 1
Cys Pro Pro Pro Pro Thr Thr Tyr Ala Asp Phe Ile Ala Ser Gly Arg
1 5 10 15
Thr Gly Arg Arg Asn Ala Ile His Asp
20 25
<210> 2
<211> 5
<212> PRT
<213> 人工序列
<400> 2
Cys Pro Pro Pro Pro
1 5
- 还没有人留言评论。精彩留言会获得点赞!