一种软木塞中多种异氰酸酯类化合物的检测方法与流程
本发明属于分析检测领域,具体涉及一种软木塞中多种异氰酸酯类化合物的检测方法。
背景技术:
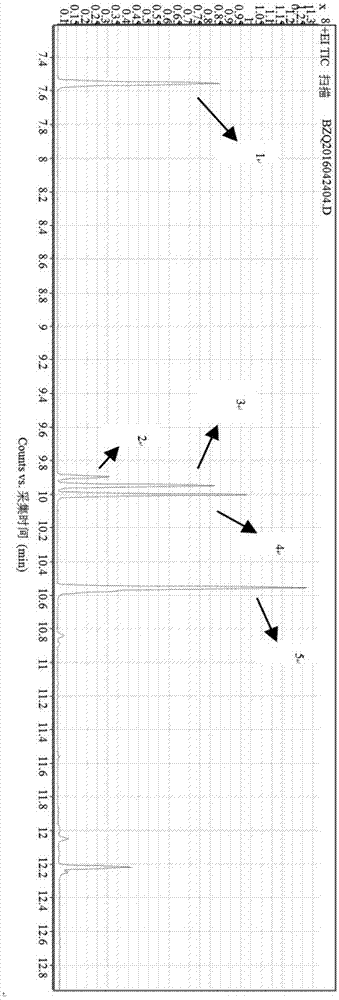
:软木有独有的特性,是瓶装固体、液体食品与油类封口最理想的材料。软木塞粗分有两类:天然软木塞和复合软木塞。天然软木塞密封性特好,对保护瓶内的食品有很好的作用;而复合软木塞则是用生产天然软木塞的下脚料胶合而成的,虽价格比天然软木塞便宜许多,但其密封性特差。由于利益的驱使,据不完全统计,我国90%的瓶装固体、液体食品与油类生产企业,使用的却尽是复合软木塞。使用复合软木塞贮藏的食品,不仅有品质变坏之险,据研究,复合软木塞中的粘合剂―胶水会迁移至食品当中,对人体造成危害。复合软木塞中的粘合剂的种类较多,我国90%的具塞存储食品使用的是聚氨酯胶黏剂(PU)粘合软木塞,由异氰酸酯组成。对于软木制品中粘合剂聚氨酯类的相关要求,我国目前针对与食品接触竹木制品的法规还不够健全,对于与食品接触竹木制品中异氰酸酯类的测试方法以及指标没有具体的规定,GB/T23778-2009《酒类及其他食品包装用软木塞》中也只是对软木塞的感官、氧化剂残留量等作出指标及试验方法要求。虽然欧洲理事会对食品接触材料软木塞质量安全(如:硅有机化合物、表面添加剂、颜料和防腐剂等)提出了相关的要求,但对于使用对于软木制品中粘合剂聚氨酯类的相关要求,也仅在韩国聚氨酯溶出试验中规定:异氰酸酯≤0.1mg/L。而我国目前针对与食品接触竹木制品的法规主要的测试项目参考GB19790.2-2005竹筷中的有毒有害物质。偏重微生物指标(大肠菌群、致病菌、霉菌)、二氧化硫、邻苯基苯酚、噻苯咪唑、联苯以及抑霉唑的含量等。本课题对软木塞中多种有毒有害物质(以影响软木塞质量安全的粘合剂为研究对象),进行系列检测技术研究分析,以异氰酸酯五种(2,6-甲苯二异氰酸酯、2,4-甲苯二异氰酸酯、六亚甲基二异氰酸酯、环己基异氰酸酯、1,5-萘二异氰酸酯)为代表物质,利用高端的仪器设备,寻求合适的检测方法,进一步降低检出低限,这既是现代高速发展检测技术的需要,也填补了国内检测方法空白,为检验监管提供科学依据,为引导企业走上科学质管的道路,增强企业对产品质量和市场竞争的技术基础保证能力。技术实现要素:为解决上述为题,提供一种检测结果准确性较高的方法,本发明提供一种异辛烷浸泡处理软木塞,浸泡液于40℃水浴旋转蒸发仪中浓缩至1mL以下,异辛烷定容至1mL,使用气相色谱三重四级杆串联质谱联用仪进行分析,采用MRM采集模式,外标法定量的检测方法。具体方案如下:一种软木塞中多种异氰酸酯类化合物的检测方法,所述检测方法包括如下步骤:步骤1:待测样品分析步骤:使用异辛烷浸泡软木塞,将异辛烷浸泡液在40℃水浴旋转蒸发仪减压蒸发,将异辛烷浸泡液浓缩至1mL以下,浓缩液用异辛烷定容至1mL,待测;步骤2:异氰酸酯类标准工作曲线制备:制备2,6-甲苯二异氰酸酯、2,4-甲苯二异氰酸酯、六亚甲基二异氰酸酯、环己基异氰酸酯、1,5-萘二异氰酸酯的标准工作曲线;步骤3:用气相色谱三重四极杆串联质谱联用仪对样品进行分析:色谱条件:(a)色谱柱:DB-17MS柱(30m×250mm×0.25μm),或相当者;(b)载气:He,(c)进样口温度:240℃;(d)柱温:初始温度40℃,以10℃/min升至150℃,再以25℃/min升至280℃,保持3分钟;(e)进样量:1.0μL;(h)柱流量:1.60mL/min;(i)进样模式:脉冲不分流;步骤4:外标法定量。优选的,所述步骤2中异氰酸酯类标准工作曲线制备的具体方法如下:异氰酸酯类储备液:准确称取2,6-甲苯二异氰酸酯、2,4-甲苯二异氰酸酯、六亚甲基二异氰酸酯、环己基异氰酸酯各0.01g,置于10mL的容量瓶中,异辛烷定容至刻度,并充分摇匀;该储备液各组分的浓度为1000mg/L;异氰酸酯类标准工作液:将所述储备液稀释,得到浓度为0.005mg/L、0.01mg/L、0.05mg/L、0.10mg/L、0.50mg/L浓度的混合标准工作曲线。优选的,所述异辛烷的规格为色谱纯。优选的,所述步骤3中气相色谱三重四级杆串联质谱联用仪的质谱条件如下:(a)溶剂延迟:4min;(b)接口温度:280℃;(c)离子源温度:230℃;(d)四级杆温度:150℃;(e)电子能量:70ev。优选的,所述异氰酸酯类储备液制备过程中称量的分析天平精确至0.1mg。优选的,所述气相色谱三重四级杆串联质谱联用仪配EI源。结果计算食品模拟物试液中异氰酸酯浓度的计算;食品模拟物试液中异氰酸酯的浓度c按式(1)计算;c—食品模拟物试液中异氰酸酯的浓度,单位为毫克每升或毫克每千克(mg/L或mg/kg);y—异氰酸酯的峰面积比值;b—标准工作曲线的截距;a—标准工作曲线的斜率。异氰酸酯迁移量的计算;由(1)得到的食品模拟物中异氰酸酯浓度,按GB5009.156进行迁移量的计算,得到食品接触材料及制品中异氰酸酯的迁移量。计算结果保留至小数点后两位。本方法的检测低限为0.01ug/kg~0.1ug/kg;添加水平为0.005ug~0.5ug时,回收率为89.81%~104.5%。本发明的有益效果:与传统的检测方法相比,方法的使用提高了检测结果的准确性,极大程度避免了假阳性结果的出现,降低了误判风险的发生。附图说明图1为异氰酸酯类化合物的标准谱图,其中1为环己基异氰酸酯,2为2,4-甲苯二异氰酸酯,3为2,6-甲苯二异氰酸酯,4为六亚甲基二异氰酸酯,5为1,5-二异氰酸酯。具体实施方式下面对本发明的具体实施方式作进一步说明:实施例1前处理提取溶剂的选择本发明比较了异辛烷、乙酸乙酯、二氯甲烷与乙腈四种溶剂,乙腈对于后四种目标物的溶解是令人满意的,但对于1,5-萘二异氰酸酯较难溶解,1,5-萘二异氰酸酯超声(5min)可溶于二氯甲烷中,而对于异辛烷、乙酸乙酯与二氯甲烷,三种溶剂的提取效果接近,考虑到迁移实验的特点,有异辛烷提取的模式,当使用异辛烷为提取溶剂时,可以省去溶剂转换的损失,所以本发明选用异辛烷为提取溶剂,所以本发明选用异辛烷为标准溶液曲线的配制溶剂。实施例2程序升温初始温度的选择本发明选取了40℃,60℃,80℃,100℃四个温度点作为程序升温初始温度,在其它条件一致的情况下比较0.5ug/ml混合待测物的色谱分析情况,实验发现,当温度升高,化合物的峰形钝化,2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯与六亚甲基二异氰酸酯越难分离,所以,本发明选择40℃温度点作为程序升温初始温度。实施例3升温速率的选择根据异氰酸酯类化合物的物理性质,本实验以初始温度为40℃,以10℃/min快速升温至100℃,以40℃/min快速升温至170℃,再分别以15℃/min、25℃/min与35℃/min升至280℃,保持1.0min测定,1.0ml/min流速,在其它条件一致的情况下比较0.5ug/ml混合待测物的色谱情况,实验发现,以15℃/min的升温速率检测,待测物的峰宽增大,峰形包样化;以25℃/min的升温速率检测,五种目标物分离完好,峰形尖锐;以35℃/min的升温速率检测,五种目标物中,2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯与六亚甲基二异氰酸酯难以完全分离;所以选用25℃/min为本发明的升温速率。实施例4流速的选择根据异氰酸酯类化合物的物理性质,本实验以初始温度为40℃,以10℃/min快速升温至100℃,以40℃/min快速升温至170℃,再以25℃/min升至280℃,保持1.0min测定,比较流速分别为0.8ml/min、1.0ml/min、1.2ml/min,在其它条件一致的情况下比较0.5ug/ml混合待测物色谱情况,流速0.8ml/min时,峰形展宽,出峰时间延后;流速1.0ml/min时,五种目标物分离完好,峰形尖锐;流速1.2ml/min时,2,4-甲苯二异氰酸酯、2,6-甲苯二异氰酸酯与六亚甲基二异氰酸酯重叠;考虑到出峰快速,化合物出峰的峰形不拖尾,在灵敏度达到检测要求的情况下,选用1.0℃/min为本发明的流速。实施例5色谱柱的选择(GC/MS/MS)本实验选用了DB-5MS(30m*250um*0.25um)、VF-WAXms(30m*250um*0.25um)与DB-17MS(30m*250um*0.25um)三种不同极性的色谱柱进行比较,在尝试改变色谱条件的情况下,DB-5MS仍然无法将2,4-甲苯二异氰酸酯与2,6-甲苯二异氰酸酯这两种同分异构体分离;同样,VF-VFMS的分离效果也不理想;而使用了DB-17MS柱,2,4-甲苯二异氰酸酯与2,6-甲苯二异氰酸酯这两种同分异构体分离效果明显,可满足实验要求,所以本实验选用DB-17MS色谱柱为分析柱。实施例6进样口温度的选择本发明选取了100℃,160℃,200℃,240℃,280℃五个温度点作为进样口气化温度,在其它条件一致的情况下比较0.5ug/ml混合待测物的响应值与色谱分析图,进样口温度100℃时,1,5-二异氰酸酯在12.219min出峰,响应值非常低,所以排除100℃为进样口温度;其他各进样口温度的谱图中的五种化合物峰形良好:上述160℃,200℃,240℃,280℃四个温度点,各取三平行响应值的平均值比较如下表1:表1实验分析表:取上述温度点160℃,200℃,240℃,280℃五个温度点作为进样口气化温度,240℃时的响应值最高,本方法选取240℃作为进样口温度。实施例7进样模式的选择为减少目标物质在进样口的分解,提高检测灵敏度,使样品能更集中经过进样口进入色谱柱进行检测分析,本方法选用脉冲无分流进样模式。本实验以初始温度40℃,以10℃升至150℃,在以25℃升至280℃,保持3分钟测定,流速为1.0ml/min,在选择不分流进样模式与脉冲不分流进样模式两种情况下,比较0.5ug/ml混合待测物的响应值,取三平行平均值比较如下表2:表2实验发现,脉冲不分流模式进样比不分流模式进样响应值高,如此有利于提高检测灵敏度,因而本发明选择脉冲不分流模式为实验的进样模式。实施例8建立方法的MRM分析模式设置不同碰撞能量,选择子离子与优化的能量以建立方法的MRM分析模式。能量设置选择CID5、CID10、CID15与CID20,分析不同碰撞能量下各级离子的最优响应,选取最优碰撞能量与子离子。分析实验数据,各碰撞能量下的响应值如下表3:表3由以上表3数据分析可得各化合物母离子与子离子的碰撞能量为下表4所示:表4实施例9软木塞中异氰酸酯类的检测1试剂与仪器1.1异辛烷:色谱纯。1.2异氰酸酯类储备液(1000mg/L):准确称取2,6-甲苯二异氰酸酯、2,4-甲苯二异氰酸酯、六亚甲基二异氰酸酯、环己基异氰酸酯各0.01g(精确到0.1mg),置于10mL的容量瓶中,异辛烷定容至刻度,并充分摇匀。该储备液各组分的浓度为1000mg/L。1.3异氰酸酯类标准工作液:可将标准储备液稀释,可得到浓度为0.005mg/L、0.01mg/L、0.05mg/L、0.10mg/L、0.50mg/L浓度的混合标准工作曲线。1.4气相色谱三重四级杆串联质谱联用仪:配EI源。1.5分析天平:精确至0.1mg。1.6旋转蒸发仪:用于减压浓缩。2样品分析步骤2.1浸泡:按照欧盟中浸泡条件(6dm2/L)或国标浸泡条件(2mL/cm2)对软木塞样品进行浸泡;2.2提取:使用异辛烷模拟液进行迁移实验;2.3浓缩:异辛烷浸泡液,40℃水浴旋转蒸发仪浓缩至1mL以下;2.4定容:浓缩液异辛烷定容至1mL,待测。3测定3.1仪器工作条件:(1)色谱条件:(a)色谱柱:DB-17MS柱(30m×250mm×0.25μm),或相当者;(b)载气:He,(c)进样口温度:240℃;(d)柱温:初始温度40℃,以10℃/min升至150℃,再以25℃/min升至280℃,保持3分钟;(e)进样量:1.0μL;(h)柱流量:1.60mL/min;(i)脉冲不分流;(2)质谱条件:(a)溶剂延迟:4min,(b)接口温度:280℃;(c)离子源温度:230℃;(d)四级杆温度:150℃;(e)电子能量:70ev;(f)MRM模式:见上表4。4结果计算食品模拟物试液中异氰酸酯浓度的计算食品模拟物试液中异氰酸酯的浓度c按式(1)计算。c—食品模拟物试液中异氰酸酯的浓度,单位为毫克每升或毫克每千克(mg/L或mg/kg);y—异氰酸酯的峰面积比值;b—标准工作曲线的截距;a—标准工作曲线的斜率。异氰酸酯迁移量的计算由(1)得到的食品模拟物中异氰酸酯浓度,按GB5009.156进行迁移量的计算,得到食品接触材料及制品中异氰酸酯的迁移量。计算结果保留至小数点后两位。5异氰酸酯类标准工作曲线方程异氰酸酯类标准工作曲线方程如下表5所示:表5序号化合物方程相关系数R21环己基异氰酸酯Y=1.00×105X+307.271.00022,4-甲苯二异氰酸酯Y=4.25×105X-6.49×1030.99532,6-甲苯二异氰酸酯Y=8.82×105X-5.06×1030.9994六亚甲基二异氰酸酯Y=1.43×105X-5731.00051,5-二异氰酸酯Y=6.77×105X-7.85×1030.9976检出限、精密度与回收率本方法的检测低限为0.01ug/kg~0.1ug/kg;添加水平为0.005ug~0.5ug时,回收率为89.81%~104.5%.检出限的测定:取一空白样品,添加不同浓度的标准溶液,按上述色谱质谱测定其信噪比值,见下表6:表6精密度:使用样品进行六次重复性实验并计算其相对标准偏差(RSD),见下表7:表7表7结果分析上述相对标准偏差(RSD)较低。回收率:目标物质的平均回收率为89.81%~104.5%,用于不含目标物质的样品作为空白试样,添加三个浓度水平的加标回收实验,见表8:表8可见本发明方法有较为理想的精密度与加标回收率,可满足实验需求。7标准谱图见附图1。其中1为环己基异氰酸酯;2为2,4-甲苯二异氰酸酯;3为2,6-甲苯二异氰酸酯;4为六亚甲基二异氰酸酯;5为1,5-二异氰酸酯。根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1