利用三维重组成像技术分析拟南芥根尖细胞结构的方法与流程
本发明涉及一种植物单细胞光学显微整体成像方法,尤其涉及一种植物单细胞三维整体成像方法,属于细胞结构分析领域。
背景技术:
拟南芥(Arabidopsis thaliana)又名鼠耳芥,阿拉伯芥,阿拉伯草。属被子植物门,双子叶植物纲,十字花科植物,其基因组大约为12500万碱基对和5对染色体,是目前已知植物基因组中最小的。拟南芥是自花受粉植物,基因高度纯合,用理化因素处理突变率很高,容易获得各种代谢功能的缺陷型。由于有上述这些优点,所以拟南芥是进行遗传学研究的好材料,被科学家誉为“植物中的果蝇”,是一种应用广泛的模式生物,全世界有超过六千家实验室正在对拟南芥的生长发育及其对环境应答的过程开展深入研究。
目前对于拟南芥根尖细胞结构的分析,主要有毛细管电泳、微流控芯片、多种光学显微镜(荧光显微镜、聚焦荧光显微镜、全内反射荧光显微镜、多光子荧光显微镜、荧光相关显微镜、近场扫描光学显微镜等)、扫描电化学显微镜、质谱成像、原子力显微镜、扫描隧道显微镜图像分析、阿达玛变换显微光谱及成像、肿瘤电化学及免疫分析、动力学分析、荧光及发光探针、纳米技术以及实时动态检测等。其中荧光显微镜是以紫外线为光源,用以照射被检物体,使之发出荧光,然后在显微镜下观察物体的形状及其所在位置。荧光显微镜用于研究细胞内物质的吸收、运输、化学物质的分布及定位等。然而,由于拟南芥幼苗的根尖非常细小,一般的根尖细胞显微成像只能直接拿实物在光学显微镜下观察,而且是根的纵向光学切片观察,得到的结果不准确(因为有相邻细胞遮挡的问题)。
技术实现要素:
本发明的目的是针对现有技术中存在的问题,提供一种利用三维重组成像技术分析拟南芥根尖细胞结构的方法,以提高图像的分辨率,保证研究对象结构真实性的呈现。
本发明利用三维重组成像技术分析拟南芥根尖细胞结构的方法,包括以下工艺步骤:
(1)拟南芥根尖的固定:将新鲜拟南芥籽苗迅速放入事先配好的4%多聚甲醛溶液中,室温孵育30min;而后转移至预冷的10%甘油中,放至干燥器中,真空抽气30min;之后放入4℃保存。
(2)拟南芥根尖的冰冻切片:在预先速冻好的样品托上涂一块较厚(2~3cm)的OCT包埋胶,待胶冻住后用刀片修出一个方形台;将之前固定的根尖依次同向摆放在台子上,迅速用另一层包埋胶盖住根尖;待包埋胶冻住后,再用刀片修块,整体铲下包埋有样品的胶块,确定根尖向外;最后将根尖向外的胶块粘在样品托上以0.3µm的步距切片。
(3)显微镜成像:先使用正置荧光显微镜ImagerA1在低倍镜下挑选出目的切片,再使用共聚焦激光显微镜 LSM 510进行拍照。物镜为:Plan-Neofluar×20/0.5、Plan-Neofluar×63/1.4和oilPlan-Neofluar×100/1.4 oil。滤光片设置为:检测DAPI时,激发光405nm,发射光420nm-470nm;检测FITC时,激发光488nm,发射光505nm-555nm。光学切片厚度0.3µm,扫描均值为2,图片以1024×1024格式保存。使用Carl Zeiss AIM软件和Olympus Fluoview Ver.1.6软件进行图像的拍摄和分析。
(4)Image J图像处理
在Image J中打开连续的纤维切层图像,使用Image → Duplicate…按钮挑选感兴趣的图层,另存为命名后的文件以备后期分析使用;如果感兴趣的是一组图层,则需使用Image → Stacks → Z Project →Projection挑选出相邻的多层图像;
区域相对荧光强度的分析:使用多边形框选按钮框选出感兴趣的目标区域,使用Analysis → Measure 得到此区域的平均荧光强度;如果要测量同一坐标线上各个点的荧光强度,则使用Analysis → Plot Profile 完成;
使用Process → FFT → Bandpass Filter 进行图像的过滤处理,一般将Filter Large Structure Down to 设定为40;
使用Process → Filters → Gaussian Blur → Sigma设定高斯变换参数,进行数据平滑处理,一般Sigma设为1。
(5)三维细胞结构生物影像显微重组
在Imaris 6.2软件切面视图中打开图像文件,在主工具栏中选择Surpass模式,打开Display Adjustment的高级设置,阈值范围在45-200之间;研究对象在视图区域内显示;
创建一个文件(Create-Ship automatic creation),编辑(Edit manually),改变指针模式为Select,按住Shift键,并点击鼠标在想要的第一个位置上,插入点,移动鼠标至下一个点,按住Shift键,并点击鼠标插入下一个点,如此继续,绘制显微切层上研究区域的轮廓。从上到下,完成所有囊括研究对象的显微切层图像单独多边形的绘制;
使用Calculate Surface计算研究对象的轮廓表面,然后点击Create Surfaces按钮创建表面对象。(可以使用Volume Over Time)点击Mask Properties中的Mask All按钮,将其它不感兴趣的表面对象区域掩盖。这样就得到了只有研究对象细胞的三维图像文件。
依照上面的方法将所有感兴趣的细胞进行三维图像重组。依次打开所需的文件遮罩层,点击SnapShot调整位置后进行拍照、录像后进行分析。
本发明相对现有技术具有以下优点:
1、本发明将观察手段改进为对有拟南芥根进行纵向冰冻切片后,得到仅含有根冠部位的根部横切,10µm的切片厚度大大降低了显微镜Z轴分辨率对成像真实性的影响;在根的横切面上使用光学显微镜进行高密度的扫描后成像,这样可以得到更为细致、全面的根尖细胞结构;
2、优化显微拍摄的条件,减小拍摄步进至小于0.4µm,降低Pinhole值以确保计算的光学切片厚度小于0.8µm,保证了画面的细腻程度,扫描范围包含了一个中柱细胞从上至下的全部结构;可以得到更为细致的显微镜成像图片,有效减少了非焦平面杂散光对图像的影响,提高了图像的分辨率,保证了研究对象结构真实性的呈现;
3、利用这三维图像重组技术,更加直观、准确的确定细胞内部内质网结构。
附图说明
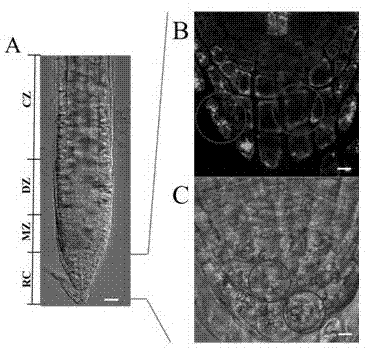
图1为拟南芥根的DIC图及内质网和淀粉体分布;
图2为 HDEL:DR5和KDEL:DR5拟南芥纵向剖面图;
图3为拟南芥根尖纵切荧光切层图;
图4为 HDEL-GFP内质网荧光三维重组图。
具体实施方式
1.实验材料
1.1植物材料
拟南芥Columbia 0型 北京师范大学生命科学学院韩生成教授惠赠
拟南芥DR5:HDEL 中国科学院植物研究所林金星教授惠赠
拟南芥DR5:KDEL 中国科学院植物研究所乐捷教授惠赠
1. 3主要试剂、耗材
MS培养基 PhytoTech
Propidium iodide Sigma
OCT冰冻切片包埋剂 Leica
Triton X-100 北京鼎国昌盛生物技术有限责任公司
0.22um PVDF filter Millipore
1.4主要仪器设备
CM3050S冰冻切片机 Leica
正置荧光显微镜ImagerA1 Carl Zeiss
共聚焦激光显微镜 LSM 510 Carl Zeiss
激光共聚焦显微镜-FV300 Olympus
智能光照培养箱-GZH-268B 杭州汇尔仪器设备有限公司
真空干燥器MZ250-1 北京中镜科仪技术有限公司
Multitern I恒温水浴锅 LKB&Pharmacia
Image J 图像分析软件 National Institutes of Health
ZEN2009图像分析软件 Carl Zeiss
1. 5主要试剂的配制
PBS缓冲液:将8.0g NaCl、0.2g KCl、2.9g Na2HPO4•12H2O和0.2g KH2PO4,加入3dH2O 定容至1L,pH7.4。
PEM缓冲液:将100mM Pipes、1mM EGTA和1mM MgCl2,加入3dH2O定容至1L,pH6.9。
0.8%MS平板培养基:4.41gMS培养基粉末、8g蔗糖和8g琼脂粉,加入3dH2O定容至1L,pH5.8, 高压灭菌121℃15min。
固定液:
4%多聚甲醛固定液:水浴加热PBS或PEM 至60℃,4g多聚甲醛溶于100ml PBS中。充分溶解后放至室温过滤,置于4℃预冷,使用前现配。
FAA固定液:50ml无水乙醇、5ml冰醋酸、10ml甲醛和35ml ddH2O。
2.实验方法
2.1拟南芥的种植
将装入1.5mlEP管的拟南芥种子加入1ml ddH20润洗,70%乙醇消毒1分钟。
吸去70%乙醇,加10%次氯酸钠8min,不时摇晃。
每5min用ddH20漂洗1次,共5次,不时摇晃。
转入提前配好的0.8%的MS琼脂糖培养基中,用枪头使种子分散均匀,封好培养皿放入4℃冰箱春化48h,而后将密封的培养皿垂直放置于温箱培养(温箱条件:22℃ ,8h光照、16h黑暗,弥散光培养),并保证每个皿内具备相同的饱和蒸汽压。
当籽苗长出4片子叶时,即可将拟南芥转移至营养土中培养,移苗前一天将加有30%蛭石的营养土放入小盆中,加水润湿过夜。移苗后前3天盖膜保湿培养,之后定期加水培养至采样或收获。
2.2 拟南芥根尖的固定
将新鲜拟南芥籽苗迅速放入事先配好的4%多聚甲醛溶液中,室温孵育30min;而后转移至预冷的10%甘油中,放至干燥器中,真空抽气30min;之后放入4℃保存。
2.3拟南芥根尖的冰冻切片
在预先速冻好的样品托上涂一块较厚(2~3cm)的OCT包埋胶,待胶冻住后用刀片修出一个方形台;将之前固定的根尖依次同向摆放在台子上,迅速用另一层包埋胶盖住根尖;待包埋胶冻住后,再用刀片修块,整体铲下包埋有样品的胶块,确定根尖向外;最后将根尖向外的胶块粘在样品托上以0.3µm的步距切片。
2.4显微镜成像
先使用正置荧光显微镜ImagerA1在低倍镜下挑选出目的切片,再使用共聚焦激光显微镜 LSM 510进行拍照。物镜为:Plan-Neofluar×20/0.5、Plan-Neofluar×63/1.4和oilPlan-Neofluar×100/1.4 oil。滤光片设置为:检测DAPI时,激发光405nm,发射光420nm-470nm;检测FITC时,激发光488nm,发射光505nm-555nm。光学切片厚度0.3µm,扫描均值为2,图片以1024×1024格式保存。使用Carl Zeiss AIM软件和Olympus Fluoview Ver.1.6软件进行图像的拍摄和分析。
在Image J中打开连续的纤维切层图像,使用Image → Duplicate…按钮挑选感兴趣的图层,另存为命名后的文件以备后期分析使用;如果感兴趣的是一组图层,则需使用Image → Stacks → Z Project →Projection挑选出相邻的多层图像;
区域相对荧光强度的分析:使用多边形框选按钮框选出感兴趣的目标区域,使用Analysis → Measure 得到此区域的平均荧光强度;如果要测量同一坐标线上各个点的荧光强度,则使用Analysis → Plot Profile 完成;
使用Process → FFT → Bandpass Filter 进行图像的过滤处理,一般将Filter Large Structure Down to 设定为40;
使用Process → Filters → Gaussian Blur → Sigma设定高斯变换参数,进行数据平滑处理,一般Sigma设为1。
2.6三维细胞结构生物影像显微重组
在Imaris 6.2软件切面视图中打开图像文件,在主工具栏中选择Surpass模式,打开Display Adjustment的高级设置,阈值范围在45-200之间。研究对象在视图区域内显示。
创建一个文件(Create-Ship automatic creation),编辑(Edit manually),改变指针模式为Select,按住Shift键,并点击鼠标在想要的第一个位置上,插入点,移动鼠标至下一个点,按住Shift键,并点击鼠标插入下一个点,如此继续,绘制显微切层上研究区域的轮廓。从上到下,完成所有囊括研究对象的显微切层图像单独多边形的绘制。
使用Calculate Surface计算研究对象的轮廓表面,然后点击Create Surfaces按钮创建表面对象。(可以使用Volume Over Time)点击Mask Properties中的Mask All按钮,将其它不感兴趣的表面对象区域掩盖。这样就得到了只有研究对象细胞的三维图像文件。
依照上面的方法将所有感兴趣的细胞进行三维图像重组。依次打开所需的文件遮罩层,点击SnapShot调整位置后进行拍照、录像。
3、三维细胞结构生物影像分析
图1为拟南芥根的DIC图及内质网和淀粉体分布。A为拟南芥根的DIC显微图。根据拟南芥生理发育情况将其根划分成:根冠(RC)、等轴分裂区(MZ)、远端伸长区(DZ)和中央伸长区(EZ)。Bar =100µm。B为 DR5:HDEL拟南芥根冠荧光图。绿色荧光显示内质网。a为一个中柱细胞,它的内质网分布在细胞的周围;b为一个周围细胞,它的内质网弥散的分布于整个细胞中。C为DR5:HDEL拟南芥根冠DIC图。突起的圆形颗粒为淀粉体。c为一个中柱细胞,它所包含的淀粉体沉积于细胞底部;d为一个周围细胞,它所包含的淀粉体占据了整个细胞空间。Bar =10µm。由图1可见,根冠顶端细胞在生长过程中起到保护根尖结构的作用,它们很容易脱落。根尖中柱细胞中的淀粉体清晰可见,它们占据了细胞大约二分之一以上的区域。当根的生长方向与重力方向一致时,淀粉体沉积在细胞的底部(C-c);当根的生长方向偏离重力方向时,淀粉体沿着重力的方向沉降至其新的物理学底部。淀粉体不仅存在于中柱细胞内,周围细胞也含有淀粉体,但是它们并没有沉积在细胞的底部,而是弥散的分布在细胞内,它们数目众多、体积很大,几乎占据了细胞的所有空间(C-d)。当我们使用一个内质网标志性多肽HDEL(GFP标记)作为探针,活体观察拟南芥内质网分布时发现,中柱细胞内质网荧光清晰的分布于细胞的四周,特别是中柱细胞的底部有大量荧光聚集。细胞上部靠近细胞核的部位荧光强度也很高,这是因为内质网是发源于细胞核膜造成的。很多中柱细胞的近轴侧和远轴侧呈现出荧光强度的差异(B-a)。周围细胞并没有内质网荧光的特征性聚集,它们的内质网荧光或弥散、或点状散在分布于细胞的各个部位。此外,当光学切层到达根中央轴的位置时,根冠和等轴分裂区之间的静止区有非常显著的荧光聚集,这也为我们寻找内质网轴向差异时提供了参照点。
图2为 HDEL:DR5和KDEL:DR5拟南芥纵向剖面图。使用同一拍摄条件得到的光学图像,KDEL:DR5荧光亮度不如HDEL:DR5,细胞轮廓更清晰,更能体现内质网在中柱细胞内“杯状”的分布特点。左侧图中的绿色荧光显示内质网的分布情况,右侧图为左侧荧光切层对应的DIC图像。Bar=10µm。图2显示,将两种新鲜的拟南芥籽苗分别镜下观察(保持等渗环境)它们的荧光强度及分布特点,结果发现多肽HDEL(GFP标记)作为探针的植株荧光亮度更高,内质网结构更清晰,在通过拟南芥根中心的纵轴剖面上的荧光强度,HDEL:DR5明显优于KDEL:DR5植株,更重要的是,HDEL(GFP标记)作为探针标记的拟南芥根的两侧中柱细胞内质网较多的呈现出两侧的荧光差异,而KDEL(GFP标记)作为探针标记的植株由于荧光强度过于微弱,难以确认是否有荧光的差异表现。我们决定选用短肽HDEL(GFP标记)作为探针标记的拟南芥材料作为实验工具,进行下一步的研究。
图3为拟南芥根尖纵切荧光切层图。箭头所指为中央髓部和静止区存在荧光的富集;两个圆圈定的是S2层轴向对称的两个中柱细胞,它们的荧光呈现了近轴侧多、远轴侧少的特点。Bar =10µm。图3所示,中柱细胞内质网荧光分布存在着近轴和远轴侧的强度差异,有的中柱细胞内质网荧光远轴侧甚至有荧光的缺失现象(图3圆圈所示)。而且中间层,即S2区中柱细胞这种差异最为明显,相关研究表明,S2区的中柱细胞是感受重力的最有效区域。内质网荧光的差异分布初步证实了我们之前的假说,即内质网可能是重力“感受器”,这就使淀粉体压迫不同结构的内质网从而产生不同生物学信号成为可能。
为了更直观的体现,进而证明内质网的这种差异特征,我们随机挑选了部分中柱细胞进行了三维细胞结构的重组。细胞三维重组技术对图片的要求很高,首先,所获得的光学切层必须包括整个目的细胞,通过优化拍摄条件保证每张图片的质量,获得细腻程度较高的图像;其次,由于目的细胞的生物学形态具有复杂性和多变性,要在每张光学切层上手动勾选目的细胞轮廓(每个细胞大概25张图片左右),排除其它细胞荧光的干扰,确保重组图像的真实性;再次,荧光阈值的设定是技术的关键,一定要选择目的细胞中最暗的点作为荧光的最小值,才能真实的、最大程度的显示中柱细胞内质网的分布特点。在进行了大量的摸索后,我们根据内质网上显示的GFP绿色荧光得到了下面的拟南芥根中柱细胞三维重组结构(图4)。从细胞的顶部、内侧和外侧呈现了中柱细胞三维重组结构,左侧为荧光图像,右侧为模拟动画图像,箭头所示为根的中轴,指向茎尖。模拟动画图像中的颜色由蓝色向红色显示内质网荧光逐渐加强,中柱细胞外侧和上部存在空洞。Bar=10µm。三维重组后的拟南芥中柱细胞内质网在近轴侧和远轴侧所表现出的荧光差异更为明显,甚至可以看到细胞顶部和侧部的空洞。一方面,印证了前人关于中柱细胞内质网“杯状”分布的观点;另一方面,更加直观的证明了中柱细胞内质网的非对称性,为内质网可能是重力“感受器”提供了结构上的有力证据。重组的结果与前期实验结果一致,进一步验证了中柱细胞内质网非对称的特点。
- 还没有人留言评论。精彩留言会获得点赞!