毛细管电泳结合UPLC‑MS分析PQQ对儿茶酚胺神经递质调节作用的研究方法与流程
吡咯并喹呤醌(PQQ)对儿茶酚胺神经递质的调节作用的研究方法,属于生物分析技术领域。
背景技术:
去甲肾上腺素(NE)和肾上腺素(E),是人体内一类重要的儿茶酚胺神经递质(结构式见下)。其结构中含有多个羟基活性基团。
儿茶酚胺神经递质由肾上腺髓质嗜铬细胞以及元嗜铬细胞分泌,在中枢神经内广泛分布,是中枢神经系统中极为重要的信息传递者。正常含量的儿茶酚胺在人体的神经系统和心血管系统等多种生理功能平衡中起着极其重要的调节作用,直接影响人体的代谢水平。某些代谢障碍会引起儿茶酚胺含量发生改变,从而导致重要疾病发生。例如重性抑郁症患者脑内NE含量明显增高,嗜铬细胞瘤患者血内NE水平升高。E对糖代谢有明显影响,应激引起交感神经-肾上腺髓质系统兴奋,E持续大量的释放,引起血糖升高。应激也可通过神经传导直接作用胰腺,抑制胰岛素的分泌。有研究发现慢性应激使大鼠血浆E含量升高。检测生物体内儿茶酚胺的浓度对上述严重疾病的临床诊断具有重要的参考价值。
吡咯并喹呤醌(PQQ)是一种氧化还原酶辅基,主要分布于原核生物以及部分植物和哺乳动物之中,对N-甲基-D-天冬氨酸受体(NMDAR)介导的兴奋性神经毒性具有调节作用。PQQ在神经精神疾病方面,具有较重要的研究前景。它具有较强的自由基清除功能。本研究室在前期研究中发现PQQ中的共轭醌键与氨基酸类神经递质中的氨基发生共轭反应而对神经递质的平衡具有潜在的调节功能。近来本课题组在抑郁症动物模型研究中采用PQQ干预后进行行为学评价发现一定剂量的PQQ对抑郁症具有明显的抑制作用。PQQ具有多个羧基的特殊化学结构,易与生物体内的多种活性物质发生反应;而儿茶酚胺结构中含有多个羟基活性基团。本发明拟通过体外研究PQQ与NE及 E 的反应,并通过测量慢性应激抑郁症模型鼠、以及给予一定剂量PQQ用药后脑内儿茶酚胺的含量变化,并通过UPLC-MS确证PQQ与NE发生反应生成PQQNE,探讨PQQ在抑郁症中对儿茶酚胺的调节作用,为研究PQQ在抑郁症神经保护方面的作用机制提供重要的研究价值,对疾病的诊断和预防治疗有重要意义。
越来越多的研究显示儿茶酚胺在疾病发生及进展过程中扮演了重要角色,科研工作者逐渐关注儿茶酚胺类物质的作用机制,这就需要提供快速精确的分析方法。目前报道的儿茶酚胺类物质的检测方法各种各样,其中主要以高效液相色谱方法为主,结合电化学、荧光或质谱检测器测定。这些方法各有优劣,比较常用的是高效液相色谱-电化学检测,但由于生物样本中干扰因素较多,而这些方法并不能彻底消除干扰,因而在临床应用中受到限制。
毛细管电泳方便快速,样品量少,具有高效灵敏的特点而受到广大分析工作者的重视。有文献报道毛细管电泳-间接电致化学发光检测尿中儿茶酚胺的含量,但每实验2 h必须更新电致化学发光溶液。另有文献报道采用异硫氰酸荧光素(FITC)对E和NE进行衍生,采用毛细管电泳加光纤发光二极管诱导荧光检测器测定尿中NE和E的含量,这些方法均需要特殊的检测器才能完成检测。
技术实现要素:
本发明的目的是要通过研究PQQ与儿茶酚胺的反应来研究PQQ对儿茶酚类神经递质的调节作用,除了要检测儿茶酚胺外还必须能检测PQQ与儿茶酚胺反应产物。脑内儿茶酚胺含量极低,本发明采用阳离子固相萃取对脑组织进行提取,测定了慢性应激抑郁模型鼠脑内儿茶酚胺含量的变化及PQQ与儿茶酚胺反应产物变化,使PQQ与NE、E及产物达到较好的分离,可以同时检测NE、E的含量,并采用UPLC-MS对PQQ与儿茶酚胺反应产物进行鉴别,结果发现PQQ与NE发生反应生成PQQNE,而与E不发生反应。慢性应激抑郁模型组在额叶及海马NE含量显著升高,而给予一定剂量PQQ组NE含量显著降低,E含量各组无显著差异。PQQ对儿茶酚胺神经递质的调节可能主要通过调节NE,而对E不具有调节作用。对研究抑郁症疾病机理及抑郁症靶向药物研究具有指导意义,相关研究未见报道。
与去甲肾上腺素反应
木发明的技术方案:一种毛细管电泳结合UPLC-MS分析PQQ对儿茶酚胺神经递质调节作用的研究方法,步骤为:
(1)毛细管选择及预处理:
选用未涂层的42cm×50µm石英毛细管柱;新毛细管先依次用甲醇冲洗10min,去离子水冲洗5min,1mol/L NaOH溶液冲洗30min,去离子水冲洗5min,最后再用运行缓冲液冲洗15min;每次进样前,用去离子水及运行缓冲液各冲洗2min;
运行缓冲液及样品溶液均用0.22µm微孔针头过滤器过滤;运行缓冲液当日配制。运行缓冲液为:40mmol/L 四硼酸钠,pH=9.0;
(2)毛细管电泳分析条件:
检测波长是260nm,进样方式为压力进样(20psi,5.0 s),分离电压为25kv, 毛细管柱温25℃。二极管阵列PDA检测器检测。
UPLC-MS分析条件:UPLC型号 AcQuity H uplc@,质谱检测器SQ Detector 2,柱子:ACQUiTY UPLC@BEH C18(2.1×100mm,1.7µm)。色谱条件:流动相A:H2O+0.1%TFA,B:CH3OH,梯度洗脱,5/95(B/A体积比)5min,75/25(25min),m/z:50-800,流速:0.3mL/min。
(3)缓冲体系和缓冲液浓度的选择
分别选择磷酸盐缓冲体系和硼酸缓冲体系进行实验,发现硼酸体系优于磷酸体系。硼酸根能与邻位顺式羟基形成配位离子,从而提高分离度。分别配制四硼酸钠浓度为20、30、40、50、60 mmol/L进行试验。结果发现,选择40 mmol/L时基线平滑、分离度相对较好且有合适的保留时间。
(4)pH值的影响
pH值会影响电动色谱中带电组分迁移的速度。在本实验中,PQQ与NE均具有电离性,生成物PQQNE电离性明显减弱。要将三者有效分离,溶液的pH是关键因素。我们选择40 mmol/L的四硼酸钠缓冲溶液,分别调pH为3.0、5.0、7.0、9.0、11.0、13.0。结果表明,当pH值较小时,分离时间较长;增加缓冲溶液的pH值,分离时间缩短,当pH值在9.0时,峰型较好,分离效果也较好。因此,选择40 mmol/L、pH9.0的四硼酸钠缓冲溶液较为合适。
(5)电压的选择
电压作为分离的动力,在毛细管电泳分离中起着重要的作用。选择在10、15、20、25、30kv电压下的分离情况,当电压低于20kv时,分离时间延长,当电压大于25kv时,分离时间缩短,但分离度降低,且基线不稳定。实验中选择25kv最为理想。
(6)PQQ与NE、E反应液的分离检测及UPLC-MS鉴别
称取一定量的PQQ、NE和E,分别用pH 7.0磷酸盐缓冲液溶解,配制成1mM的PQQ、NE、E溶液;按摩尔比为1:1混合PQQ和NE得反应液A,PQQ和E混合得反应液B,PQQ与NE和E一起混合得反应液C;避光,于37℃水浴孵育24h。
PQQ与NE反应液UPLC-MS产物PQQNE质谱图如图1所示。PQQ与NE反应后产物PQQNE的质谱图显示M=481,482.22为M+1峰,483.36为M+2峰,464.24为M-OH峰。PQQNE分子量481,PQQ的羧基和NE的氨基去掉一份子水得到了酰胺。PQQ与E反应液只检测到PQQ的分子离子峰,未能检测到产物的分子离子峰。由于E分子结构上氨基上的氢被甲基取代,阻碍了其反应。
(7)生物样本处理
(7.1)脑组织样品处理
脑组织称重,每克脑组织加入1.5mL组织裂解液,匀浆,离心15min(15000rpm/4℃),取上清液,再离心15min,得上清液,加入等体积的PCA沉淀剂,4℃冰浴放置10min后,再离心15min。所得脑组织液a备用。
组织裂解液为:1.2M K2HPO4+2M EDTA-2Na;
PCA沉淀剂为:0.1M高氯酸;
(7.2)固相萃取提取脑组织样品
SPE萃取小柱(Generik PCX)用1 mL甲醇活化,1mL去离子水平衡,将脑组织液a上样,用2mL去离子水,2mL甲醇冲洗,抽干,用1mL甲酸/甲醇(体积比4/96)洗脱,N2吹干,所得残渣用0.1%甲酸水溶液溶解后进行毛细管电泳分析和UPLC-MS分析。
(8)标准曲线制备
准确吸取NE、E储备液,用空白脑组织液a分别配成NE浓度为0.02、0.1、0.5、2.5、12.5、62.5μmoL.L-1系列含药脑组织液;E浓度为0.1、0.5、2.5、12.5、62.5、312.5μmoL·L-1系列含药脑组织液。与空白脑组织液a分别以(7.2)方法处理后进样分析,所得NE、E峰面积扣除相应的空白脑组织液a峰面积为纵坐标(Y),NE、E浓度(X)为横坐标,进行回归分析。得回归方程为Y= 6250315X + 4672.8(R2 = 0.9998)(NE),线性范围0.02~62.5μmoL·L-1;Y= 862932X + 2036.2(R2 = 0.9996)(E),线性范围0.1~312.5μmoL·L-1。检出限分别为0.1nmoL·L-1(NE)和0.2nmoL·L-1(E)(S/N=3)。迁移时间和峰面积的相对标准偏差(RSD)分别小于0.68%和1.06%。
(9)回收率及精密度测定
(9.1)提取回收率测定
取经处理后的空白脑组织液A,精确配制同时含NE和E,浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按(7.2)方法处理后进行毛细管电泳分析。
含药脑组织液经过固相萃取所得的峰面积与相应浓度未经固相萃取提取的标准液直接进样所得的峰面积比值计算得到提取回收率。
(9.2)方法回收率:精确配制同时含NE和E,浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按上述(7.2)方法处理后分析。用标准曲线计算出NE和E的浓度,与理论浓度比值计算得到方法回收率。
(9.3)精密度试验
精确配制同时含NE和E,高、中、低3种浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按上述(7.2)方法处理后在确定的色谱条件下于同一天内连续进样5次,根据峰面积计算精确度。
本发明的有益效果:本发明通过体外研究PQQ与NE及 E 的反应,并通过测量抑郁症模型鼠、以及给予一定剂量PQQ用药后脑内儿茶酚胺的含量变化,并通过UPLC-MS确证PQQ与NE发生反应生成PQQNE,探讨PQQ在抑郁症中对儿茶酚胺的调节作用,为研究PQQ在抑郁症神经保护方面的作用机制提供重要的研究价值,对疾病的诊断和预防治疗有重要意义。
本发明采用阳离子固相萃取对脑组织进行提取,测定了慢性应激抑郁模型鼠脑内儿茶酚胺含量的变化及PQQ与儿茶酚胺反应产物变化,使PQQ与NE、E及产物达到较好的分离,可以同时检测PQQ、NE和E的含量,并采用UPLC-MS对PQQ与儿茶酚胺反应产物进行鉴别,结果发现PQQ与NE发生反应生成PQQNE,而与E不发生反应。慢性应激抑郁模型组在额叶和海马NE含量显著升高,而给予一定剂量PQQ组NE含量显著降低,E含量各组无显著差异。PQQ对儿茶酚胺神经递质的调节可能主要通过调节NE,而对E不具有调节作用。对研究抑郁症疾病机理及抑郁症靶向药物研究具有指导意义。
附图说明
图1 PQQ对照品毛细管电泳色谱图。
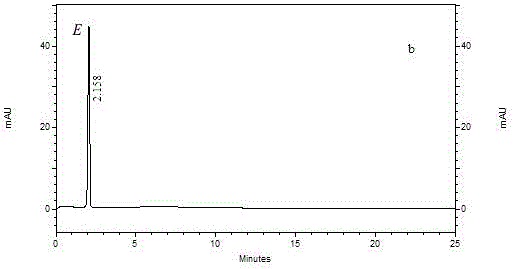
图2 E对照品毛细管电泳色谱图。
图3 NE对照品毛细管电泳色谱图。
图4 PQQ、NE、E混合反应液反应24h后的毛细管电泳色谱图。
图5 PQQ与NE反应液UPLC-MS产物PQQNE质谱图(M=481,482.22为M+1峰,483.36为M+2峰,464.24为M-OH峰)。
具体实施方式
实施例1
(1)毛细管选择及预处理:
选用未涂层的42cm×50µm石英毛细管柱;新毛细管先依次用甲醇冲洗10min,去离子水冲洗5min,1mol/L NaOH溶液冲洗30min,去离子水冲洗5min,最后再用运行缓冲液冲洗15min;每次进样前,用去离子水及运行缓冲液各冲洗2min;
运行缓冲液及样品溶液均用0.22µm微孔针头过滤器过滤;缓冲液当日配制;
运行缓冲液为:40mmol/L 四硼酸钠,pH=9.0。
(2)毛细管电泳分析条件:
检测波长是260nm,进样方式为压力进样(20psi,5.0 s),分离电压为25kv, 毛细管柱温25℃。二极管阵列PDA检测器检测。
UPLC-MS分析条件:UPLC型号 AcQuity H uplc@,质谱检测器SQ Detector 2,柱子:ACQUiTY UPLC@BEH C18 (2.1×100mm,1.7um)。色谱条件: 流动相A:H2O+0.1%TFA,B:CH3OH,梯度洗脱,5/95(B/A)5min----75/25(25min),m/z:50-800,流速:0.3mL/min。
(3)缓冲体系和缓冲液浓度的选择
分别选择磷酸盐缓冲体系和硼酸缓冲体系进行实验,发现硼酸体系优于磷酸体系。分别配制四硼酸钠浓度为20、30、40、50 和60 mmol/L进行试验。结果发现,选择40 mmol/L时基线平滑、分离度相对较好且有合适的保留时间。
(4)pH值的影响
pH值会影响电动色谱中带电组分迁移的速度。在本实验中,PQQ与NE均具有电离性,生成物PQQNE电离性明显减弱。要将三者有效分离,溶液的pH是关键因素。我们选择40 mmol/L的四硼酸钠缓冲溶液,分别调pH为3.0、5.0、7.0、9.0、11.0、13.0。结果表明,当pH值较小时,分离时间较长;增加缓冲溶液的pH值,分离时间缩短,当pH值在9.0时,峰型较好,分离效果也较好。因此,选择40 mmol/L、pH9.0的四硼酸钠缓冲溶液较为合适。
(5)电压的选择
电压作为分离的动力,在毛细管电泳分离中起着重要的作用。选择在10、15、20、25、30kv电压下的分离情况,当电压低于20kv时,分离时间延长,当电压大于25kv时,分离时间缩短,但分离度降低,且基线不稳定。实验中选择25kv最为理想。
(6)PQQ与NE、E反应液的分离检测及UPLC-MS鉴别
称取一定量的PQQ、NE和E,分别用pH 7.0磷酸盐缓冲液溶解,配制成1mM的PQQ、NE和E溶液;按摩尔比为1:1混合PQQ和NE得反应液A,PQQ和E混合得反应液B,PQQ与NE和E一起混合得反应液C;避光,于37℃水浴孵育24h。
PQQ与NE反应液UPLC-MS产物PQQNE质谱图如图1所示。PQQ与NE反应后的质谱图显示M=481,482.22为M+1峰,483.36为M+2峰,464.24为M-OH峰。PQQNE分子量481,PQQ的羧基和NE的氨基去掉一份子水得到了酰胺。PQQ与E反应液只检测到PQQ的分子离子峰,未能检测到产物的分子离子峰。由于E分子结构上氨基上的氢被甲基取代,阻碍了其反应。
(7)生物样本处理
(7.1)脑组织样品处理
脑组织称重,每克脑组织加入1.5mL组织裂解液,匀浆,离心15min(15000rpm/4℃),取上清液,再离心15min,得上清液,加入等体积的PCA沉淀剂,4℃冰浴放置10min后,再离心15min。所得脑组织液a备用。
组织裂解液为:1.2M K2HPO4+2M EDTA-2Na;
PCA沉淀剂为:0.1M高氯酸。
(7.2)固相萃取提取脑组织样品
SPE萃取小柱(Generik PCX)用1 mL甲醇活化,1mL去离子水平衡,将脑组织液a上样,用2mL去离子水,2mL甲醇冲洗,抽干,用1mL甲酸/甲醇(4/96)洗脱,N2吹干,所得残渣分别用缓冲液和0.1%甲酸水溶液溶解后进行毛细管电泳分析和UPLC-MS分析。
(8)标准曲线制备
准确吸取NE、E储备液,用空白脑组织液a分别配成NE浓度为0.02、0.1、0.5、2.5、12.5、62.5μmoL·L-1系列含药组织液;E浓度为0.1、0.5、2.5、12.5、62.5、312.5μmoL·L-1系列含药组织液。与空白组织液a分别以(7.2)方法处理后进样分析,所得NE、E峰面积扣除相应的空白组织液a峰面积为纵坐标(Y),浓度(X)为横坐标,进行回归分析。得回归方程为Y= 6250315X + 4672.8(R2 = 0.9998)(NE),线性范围0.02~62.5μmoL·L-1;Y= 862932X + 2036.2(R2 = 0.9996)(E),线性范围0.1~312.5μmoL·L-1。检出限分别为0.1nmoL·L-1(NE)和0.2 nmoL·L-1(E)(S/N=3)。迁移时间和峰面积的相对标准偏差(RSD)分别小于0.68%和1.06%。
(9)回收率及精密度测定
(9.1)提取回收率测定
取经处理后的空白脑组织液a,精确配制同时含NE和E,浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按(7.2)方法处理后进行毛细管电泳分析。含药脑组织液经过固相萃取所得的峰面积与相应浓度未经固相萃取提取的标准液直接进样所得的峰面积比值计算得到提取回收率。
(9.2)方法回收率:精确配制同时含NE和E,浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按上述方法处理后分析。用标准曲线计算出NE和E的浓度,与理论浓度比值计算得到方法回收率。
(9.3)精密度试验
精确配制同时含NE和E,高、中、低3种浓度分别为0.5、5.0、50μmoL·L-1的含药脑组织液各5份,按上述方法处理后在确定的色谱条件下于同一天内连续进样5次,根据峰面积计算精密度。
表1回收率及精密度测定
表2大鼠脑组织NE、E含量测定(±s, n=6, ng/g)
与正常组比较, *P < 0.05, **P < 0.01; 与抑郁模型组比较, #P < 0.05, ##P < 0.01。
- 还没有人留言评论。精彩留言会获得点赞!
- 微波碱水解5-甲基-5-(3,4-二甲氧基苄基)乙内酰脲制备甲基多巴的方法
- 酸直接水解5-甲基-5-(3,4-二甲氧基苄基)乙内酰脲制备甲基多巴的方法
- 可用于治疗帕金森症的儿茶酚胺衍生物的制作方法
- 类固醇类的孕烯醇酮及其同分异构体在制备治疗高血压药物中的应用的制作方法
- 用作皮质儿茶酚胺能神经传递调节剂的3-苯基-3-甲氧基-吡咯烷衍生物的制作方法
- 用作皮质儿茶酚胺能神经传递调节剂的新3-苯基-氮杂环丁烷衍生物的制作方法
- 调节儿茶酚胺合成、释放并增强免疫机能的药物组合物的制作方法
- 作为儿茶酚胺前体药物的苯乙胺和稠环变体及其用途的制作方法
- 一种提高蚕豆花左旋多巴含量的方法
- 作为儿茶酚胺前体药物的苯乙胺和稠环变体及其用途的制作方法