使用经掩蔽的半抗原在福尔马林固定石蜡包埋的组织中的蛋白质邻近测定的制作方法
相关申请的交叉引用
本申请要求2016年2月29日提交的美国临时专利申请第62/301,489号的申请日的权益,以及2015年8月28日提交的美国临时专利申请第62/211,590号的申请日的权益,其公开内容在此通过引用整体并入本申请。
所公开的实施方案涉及检测样本中的靶标(target),包括位于样本近侧的靶标。所公开的实施方案还提供了使用经掩蔽的半抗原(cagedhapten)或经掩蔽的半抗原缀合物检测福尔马林固定石蜡包埋的组织中的蛋白质二聚体的邻近测定法(proximityassay)。
工业实用性
本申请在化学和诊断领域具有工业实用性。
背景技术:
免疫组织化学(ihc)是指使用对特定抗原具有特异性的抗体对生物样品中的抗原诸如蛋白质进行检测、定位和/或定量的方法。ihc提供了确切地识别特定蛋白质位于组织样品内何处的实质性优点。这也是检查组织本身的有效方式。原位杂交(ish)是指检测、定位和定量核酸的方法。ihc和ish两者均可在各种生物样品诸如组织(例如新鲜冷冻的、福尔马林固定的、石蜡包埋的组织)和细胞学样品上进行。靶标的识别可使用各种标记(例如,生色、荧光、发光,放射性测量标记)来检测,而不管靶标是核酸还是抗原。为了在临床环境中强有力地检测、定位和定量靶标,识别事件的扩增是期望的,因为确信检测低丰度细胞标志物的能力对于诊断目的变得越来越重要。例如,响应于单个抗原检测事件,在标志物位点沉积数百或数千个标记分子,通过扩增,增强了所述检测识别事件的能力。
蛋白质-蛋白质相互作用网络是生物系统的标志。蛋白质-蛋白质相互作用形成信号通路,其调节正常细胞和癌细胞的细胞功能的各个方面。已经开发了用于检测蛋白质-蛋白质相互作用的方法,诸如细胞外生长因子激活之后的瞬时受体酪氨酸激酶二聚化和复合物形成;然而,这些方法不是特别设计用于福尔马林固定石蜡包埋(ffpe)的组织。
对于已知在癌症生物学中是重要决定因素的生物标志物而言,询问特定分子间相互作用的存在和分布的能力在新的诊断能力的背景下是高度感兴趣的并且用于确定药物开发背景下的治疗效果。在冷冻和石蜡包埋的组织上探测和记录分子相互作用分布的能力仍然无法获得;已经提出了解决这个问题的替代技术,尽管在实际使用中解决方案没有被证明是有效和可靠的。
olinkab最近开发了邻近连接测定法。这是在福尔马林固定石蜡包埋的组织上原位检测蛋白质-蛋白质相互作用的唯一已知商业产品。邻近连接测定技术使用dna连接酶来产生挂锁环形dna模板,以及用于滚环扩增的phi29dna聚合酶。这些酶是昂贵的。而且,这些酶不适用于自动化系统和方法。由于这些原因,邻近连接测定法通常不被认为可用于商业应用。
技术实现要素:
申请人开发了一种检测位于样品近侧的靶标的优良方法。在本申请的一个方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)形成第二靶标-暴露酶-抗体缀合物复合物;(b)形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(c)使第一靶标-经掩蔽的半抗原-抗体缀合物复合物的经掩蔽的半抗原暴露,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(d)使样品与第一检测试剂接触,以标记第一靶标-暴露的半抗原-抗体偶联物复合物或第一靶标;和(e)检测经标记的第一靶标-暴露的半抗原-抗体偶联物复合物或经标记的第一靶标。
在一些实施方案中,所述第一检测试剂包含(i)对第一靶标-暴露半抗原-抗体缀合物复合物的暴露半抗原具有特异性的二级抗体,二级抗体缀合于第一酶,从而使得二级抗体用第一酶标记第一靶标-暴露半抗原-抗体缀合物复合物;和(ii)第一酶的第一底物。在一些实施方案中,所述第一底物为生色底物或荧光底物。在一些实施方案中,所述第一检测试剂包含扩增组分,以使用多个第一报告蛋白部分标记第一靶标-暴露半抗原-抗体缀合物复合物的暴露酶。在一些实施方案中,所述多个第一报告蛋白部分为半抗原。在一些实施方案中,所述第一检测试剂进一步包含对多个第一报告蛋白部分具有特异性的二级抗体,每个二级抗体缀合于第二报告蛋白部分。在一些实施方案中,所述第二报告蛋白部分选自扩增酶或荧光团。在一些实施方案中,所述第二报告蛋白部分为扩增酶并且其中所述第一检测试剂进一步包含扩增酶的第一生色底物或荧光底物。在一些实施方案中,所述方法进一步包括使样品与对第二靶标-暴露酶-抗体缀合物复合物的暴露酶具有特异性的第二底物接触和检测对应于第一底物与暴露酶之间反应的产物的信号。
在本申请的另一方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)形成第二靶标-暴露酶-抗体缀合物复合物;(b)形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(c)暴露第一靶标-经掩蔽的半抗原-抗体缀合物复合物的经掩蔽的半抗原,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(d)进行信号扩增步骤,以使用多个报告蛋白部分标记第一靶标-暴露半抗原-抗体缀合物复合物;和(e)检测多个报告蛋白部分。
在一些实施方案中,所述多个报告蛋白部分为半抗原;并且其中所述方法进一步包括向多个第一报告蛋白部分引入二级抗体,每个二级抗体缀合于第二报告蛋白部分。在一些实施方案中,所述第二报告蛋白部分为扩增酶并且其中所述方法进一步包括引入扩增酶的生色底物或荧光底物。在一些实施方案中,所述方法进一步包括检测样品中靶标的总量。
在本申请的另一方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)形成第二靶标-暴露酶-抗体缀合物复合物;(b)形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(c)进行脱掩蔽步骤,从而使得第二靶标-暴露酶-抗体缀合物复合物的暴露酶与第一靶标-经掩蔽的半抗原-抗体缀合物复合物的酶底物部分反应,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(d)使样品与第一检测试剂接触,以标记第一靶标-暴露半抗原-抗体缀合物复合物或第一靶标;和(e)检测经标记的第一靶标-暴露半抗原-抗体缀合物复合物或经标记的第一靶标。
在一些实施方案中,所述脱掩蔽步骤包括改变样品的温度。在一些实施方案中,所述脱掩蔽步骤包括更改样品的ph。在一些实施方案中,所述脱掩蔽步骤包括引入一个或多个洗涤步骤。在一些实施方案中,所述脱掩蔽步骤包括添加暴露酶的辅因子。在一些实施方案中,所述方法进一步包括检测样品中靶标的总量。
在本申请的另一方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)使样品与对第一靶标具有特异性的经掩蔽的半抗原-抗体缀合物接触,以形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(b)使样品与对第二靶标具有特异性的暴露酶-抗体缀合物接触,以形成第二靶标-暴露酶-抗体缀合物复合物,其中选择暴露酶-抗体缀合物的暴露酶,从而使得其能够与经掩蔽的半抗原-抗体缀合物的酶底物部分反应,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(c)使样品与第一检测试剂接触,以标记第一靶标-暴露半抗原-抗体缀合物复合物或第一靶标;和(d)检测经标记的第一靶标-暴露半抗原-抗体缀合物复合物或经标记的第一靶标。
在一些实施方案中,经掩蔽的半抗原-抗体缀合物的经掩蔽的半抗原衍生自选自以下的半抗原:dcc、生物素、硝基吡唑、噻唑磺酰胺、苯并呋咱和2-羟基喹喔啉。在一些实施方案中,暴露酶-抗体缀合物的暴露酶选自碱性磷酸酶、b-葡萄糖苷酶、b-半乳糖苷酶、b-葡糖醛酸糖苷酶、脂肪酶、硫酸酯酶、酰胺酶、蛋白酶、硝基还原酶、β-内酰胺酶、神经氨酸酶和尿素酶。在一些实施方案中,所述第一检测试剂包含(i)对第一靶标-暴露半抗原-抗体缀合物复合物的暴露半抗原具有特异性的二级抗体,所述二级抗体缀合于第一酶,从而使得二级抗体使用第一酶标记第一靶标-暴露半抗原-抗体缀合物复合物;和(ii)第一生色底物或荧光底物。在一些实施方案中,所述第一酶不同于暴露酶。在一些实施方案中,所述第一酶为过氧化物酶。在一些实施方案中,所述第一生色底物选自3,3’-二氨基联苯胺(dab)、3-氨基-9-乙基咔唑(aec)、hrp-silver和酪胺-色原。在一些实施方案中,所述方法进一步包括使样品与对第二靶标-暴露酶-抗体缀合物复合物的暴露酶具有特异性的第一生色底物或荧光底物接触,其中所述第一和第二生色底物不同。在一些实施方案中,所述第一检测试剂包含扩增引入第一靶标-暴露半抗原-抗体缀合物复合物的标记的量的组分。在一些实施方案中,所述第一靶标为pd-1或pd-l1中的一个,并且所述第二靶标为pd-1或pd-l1中的另一个。
在本申请的另一方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)使样品与第一检测探针接触,所述第一检测探针包含经掩蔽的半抗原-抗体缀合物或暴露酶-抗体缀合物中的一个;(b)使样品与第二检测探针接触,所述第二检测探针包含经掩蔽的半抗原-抗体缀合物或暴露酶-抗体缀合物中的另一个;(c)使样品至少与第一检测试剂接触,以标记形成的暴露半抗体-抗体缀合物靶标复合物;(d)检测来自经标记的暴露半抗原-抗体缀合物靶标复合物的信号。
在一些实施方案中,所述方法进一步包括检测样品中靶标的总量。在一些实施方案中,所述第一检测试剂包含扩增组分,以使用多个第一报告蛋白部分标记第一靶标-暴露半抗原-抗体缀合物复合物的暴露酶。在一些实施方案中,所述多个第一报告蛋白部分为半抗原。在一些实施方案中,所述第一检测试剂进一步包含对多个第一报告蛋白部分具有特异性的二级抗体,每个二级抗体缀合于第二报告蛋白部分。在一些实施方案中,所述第二报告蛋白部分选自扩增酶或荧光团。在一些实施方案中,所述第二报告蛋白部分为扩增酶并且其中所述第一检测试剂进一步包含扩增酶的第一生色底物或荧光底物。在一些实施方案中,所述方法进一步包括脱掩蔽步骤。
在本申请的另一方面,提供了一种用于分析样品以确定第一靶标是否与第二靶标邻近的方法,所述方法包括:(a)使样品与对第一靶标具有特异性的经掩蔽的半抗原-抗体缀合物接触,以形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(b)使样品与对第二靶标具有特异性的暴露酶-抗体缀合物接触,以形成第二靶标-暴露酶-抗体缀合物复合物,其中选择暴露酶-抗体缀合物的暴露酶,从而使得其能够与经掩蔽的半抗原-抗体缀合物的酶底物部分反应,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(c)使样品与特异性结合于第一靶标-暴露半抗原-抗体缀合物复合物的第一标记缀合物接触,其中所述第一标记缀合物包含不同于暴露酶的第一酶;(d)使样品与包含第一潜在反应性部分和第一生色或荧光部分的第一信号传导缀合物接触;和(e)检测来自第一生色或荧光部分的信号,所述第一信号指示邻近的第一和第二靶标。
在一些实施方案中,所述方法进一步包括使样品与包括第二潜在反应性部分和第二生色或荧光部分的第二信号传导缀合物接触,其中所述第一和第二生色或荧光部分提供不同的信号。在一些实施方案中,进一步包括检测来自第一生色部分的信号,所述来自第二生色或荧光部分的信号指示总蛋白。
在本申请的另一方面,提供了经掩蔽的半抗原,其具有式(i):
其中
y选自羰基反应性基团、胺反应性基团和巯基反应性基团;
x为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
a为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;和
'掩蔽基团'包含酶底物并且任选包含离去基团,其中所述离去基团部分包含经取代或未经取代的5元、6元或7元芳族环或杂环。
在一些实施方案中,所述5元、6元或7元芳族环或杂环取代有选自以下的部分:卤素、具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;和支化或非支化、经取代或未经取代的具有1-4个碳原子的烷基。在一些实施方案中,所述掩蔽基团具有式(ii)的结构:
其中
r1独立选自h、f、cl、br、i、-o-甲基、-o-乙基、-o-正丙基、-o-异丙基、-o-正丁基、-o-仲丁基或-o-异丁基;具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;具有1-4个碳原子且任选取代有n或s的烷基;氰基;和羧基;和
r2为酶底物。
在一些实施方案中,所述酶底物选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,所述掩蔽基团具有式(iib)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,每个r1基团不同。
在一些实施方案中,掩蔽基团具有式(iic)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,每个r1基团不同。
在一些实施方案中,所述掩蔽基团具有式(iid)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。
在一些实施方案中,每个r1基团不同。在一些实施方案中,x具有式(iiia)的结构:
其中d和e各自独立为4-18范围内的整数;q为键、o、s或n(rc)(rd);ra和rb独立地为h、c1-c4烷基、f、cl或n(rc)(rd);和rc和rd独立地为ch3或h。在一些实施方案中,d和e各自独立为1-24范围内的整数。
在一些实施方案中,所述经掩蔽的半抗原选自:
在本申请的另一方面,提供了(i)特异性结合实体和(ii)经掩蔽的半抗原的缀合物,所述经掩蔽的半抗原包括任一种本申请引用的经掩蔽的半抗原。在一些实施方案中,所述经掩蔽的半抗原具有式(i)的结构:
其中
y选自羰基反应性基团、胺反应性基团和巯基反应性基团;
x为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
a为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;和
'掩蔽基团'包含酶底物并且任选包含离去基团,其中所述离去基团部分包含经取代或未经取代的5元、6元或7元芳族环或杂环。
在一些实施方案中,所述缀合物的特异性结合实体为抗体。在一些实施方案中,所述缀合物具有式(iv)的结构:
其中z为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子,
a为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
q为0或1;和
n为1-25范围内的整数。
在一些实施方案中,所述掩蔽基团为5元、6元或7元芳族环或杂环,其任选取代有选自以下的部分:卤素、具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;和支化或非支化、经取代或未经取代的具有1-4个碳原子的烷基。
在一些实施方案中,所述掩蔽基团具有式(ii)的结构:
其中
r1独立选自h、f、cl、br、i、-o-甲基、-o-乙基、-o-正丙基、-o-异丙基、-o-正丁基、-o-仲丁基或-o-异丁基;具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;具有1-4个碳原子且任选取代有n或s的烷基;氰基;和羧基;和
r2为酶底物。
在一些实施方案中,所述酶底物选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。
在一些实施方案中,所述掩蔽基团具有式(iib)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,每个r1基团不同。
在一些实施方案中,所述掩蔽基团具有式(iic)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,r1基团不同。
在一些实施方案中,所述掩蔽基团具有式(iid)的结构:
其中r2选自磷酸酯基、酯基、酰胺基、硫酸酯基、糖苷基、脲基和硝基。在一些实施方案中,每个r1基团不同。
在一些实施方案中,所述抗体为二级抗体。在一些实施方案中,所述抗体为一级抗体。在一些实施方案中,所述一级抗体对选自以下的靶标具有特异性:pd-l1/cd80(b7-1);ctla-4/cd80(b7-1);ctla-4/cd86(b7-1);pd-l2/pd-1;erbb家族(her1(egfr)、her2、her3、her4)的任意组合;dna混合匹配修复蛋白(mlh1、mlh3、msh2、msh3、msh6、pms1和pms2)的任意组合;翻译后修饰(ptm)-磷酸化蛋白(抗-磷酸化酪氨酸/磷酸化丝氨酸/磷酸化苏氨酸/磷酸化组氨酸抗体与任意对所关注的靶标具有特异性的抗体组合);和ptm-泛素化蛋白。
在本申请的另一方面,提供了一种用于在样品中检测多个靶标的方法:(a)使样品与对第一靶标具有特异性的经掩蔽的半抗原-抗体缀合物接触,以形成第一靶标-经掩蔽的半抗原-抗体缀合物复合物;(b)使样品与对第二靶标具有特异性的暴露酶-抗体缀合物接触,以形成第二靶标-暴露酶-抗体缀合物复合物,其中选择暴露酶-抗体缀合物的暴露酶,从而使得其能够与经掩蔽的半抗原-抗体缀合物的酶底物部分反应,以形成第一靶标-暴露半抗原-抗体缀合物复合物;(c)使样品与第一检测试剂接触,以标记第一靶标-暴露半抗原-抗体缀合物复合物或第一靶标;(d)使样品与对于第三靶标具有特异性的第一检测探针接触,以形成第三靶标-检测探针复合物;(e)使样品与第二检测试剂接触,以标记第三靶标-检测探针复合物;(f)检测经标记的第一靶标-暴露半抗原-抗体缀合物复合物或经标记的第一靶标;和(g)检测经标记的第三靶标-检测探针复合物。在一些实施方案中,所述方法进一步包括检测样品中的总蛋白。在一些实施方案中,所述第一检测探针包括抗体。在一些实施方案中,所述第一检测探针包括核酸探针。在一些实施方案中,所述方法进一步包括使样品与对于第四靶标具有特异性的第二检测探针接触,以形成第四靶标-检测探针复合物。在一些实施方案中,所述方法进一步包括在使样品与第二检测探针接触之前使暴露酶失活。在一些实施方案中,所述方法进一步包括在使样品与探针接触以标记第三靶标和第二检测试剂之前使第一和第二靶标复合物失活。
附图说明
专利或申请文件含有至少一张彩色附图。具有彩色附图的专利或专利申请公开的副本将根据要求提供给有关机关(office),并支付必要的费用。
图1a图示说明未掩饰的半抗原的实施方案。
图1b图示说明经掩蔽的半抗原的实施方案。
图1c图示说明与半抗原偶联的掩蔽基团的结构。
图2是图示说明包含碱性磷酸酶(与靶标2结合)的暴露酶-抗体缀合物与经掩蔽的半抗原-抗体缀合物(与靶标1结合)之间相互作用的示意图,其中暴露酶-抗体缀合物的暴露酶与经掩蔽的半抗原-抗体缀合物的酶底物部分(由于靶标1和靶标2相互邻近)反应以提供可被检测到的相应的未掩饰半抗原(unmaskedhapten)。
图3是图示说明暴露酶-抗体缀合物(与靶标2结合)和经掩蔽的半抗原-抗体缀合物(与靶标1结合)的示意图,其中两个靶标彼此不紧密邻近,使得暴露酶-抗体缀合物的暴露酶不与经掩蔽的半抗原-抗体缀合物的酶底部分相互作用,因此经掩蔽的半抗原仍然被掩饰并且不能被检测到。
图4提供图示说明检测样品中蛋白质二聚体和/或总蛋白质的步骤的流程图。
图5是图示说明ihc染色方案的实施方案的示意图,其中用chq标记的二级抗体检测单一抗原。
图6a是用chq标记且用ap处理的二级抗体检测前列腺组织上psa的图像。
图6b是用chq标记且没有ap处理的二级抗体(阴性对照)缺少检测前列腺组织上psa的另一图像。
图6c是用天然hq标记的二级抗体检测前列腺组织psa的另一图像。
图7a是用dab染色测量的β-连环蛋白的总蛋白质的图像。
图7b是用dab染色测量的具有正邻近性的蛋白质的图像。
图7c是用dab染色测量的e-钙粘蛋白的总蛋白质的图像。
图8a是在ffpe扁桃体组织上用dab染色测量的egfr的总蛋白质的图像。
图8b是在ffpe扁桃体组织上不存在dab染色时测量的没有邻近性的共定位蛋白质的图像。
图8c是在ffpe扁桃体组织上用dab染色测量的e-钙粘蛋白的总蛋白质的图像。
图9a是在ffpe乳房组织上用dab染色测量的具有邻近性的共定位蛋白质的图像。
图9b是通过在ffpe乳房组织上不存在dab染色测量的没有接近性的共定位蛋白的另一图像。
图10a是基于二级抗体上经掩蔽的半抗原标记的数目的信号强度的图像。
图10b是基于二级抗体上经掩蔽的半抗原标记的数目增加的信号强度增加的另一图像。
图11a是用hrp-silver染色测量的邻近性信号检测的图像。
图11b是用hrp-purple色原染色测量的邻近性信号检测的另一图像。
图12是图示说明两种蛋白(靶标1和靶标2)紧密邻近性和总蛋白质(靶标2)的多重检测的示意图。
图13a是显示用hrp-dab检测邻近蛋白质的图像。
图13b是显示用hrp-silver检测邻近蛋白和用ap-yellow检测总蛋白质的图像。
图14是显示用hrp-purple检测邻近信号和用ap-yellow检测总蛋白质的图像。
图15图示说明经掩蔽的半抗原的结构,并指出了可与经掩蔽的半抗原的酶底物部分反应的特定酶。
图16提供了在ffpe非小细胞肺癌(nsclc)病例(箭头=pd-l1/pd-1邻近性信号)中用hrp-purple色原染色测量的pd-1和pd-l1蛋白质的邻近性信号检测的图像。
图17提供了用hrp-purple色原染色测量的pd-1和pd-l1蛋白的邻近性信号检测的图像,以及ffpe扁桃体中用ap-yellow检测的pd-1的总蛋白(箭头=pd-l1/pd-1邻近性信号;虚线圆圈=pd-1蛋白质信号)。
图18提供了pd-1和pd-l1蛋白质的邻近性信号检测的阴性对照的图像,其中在ffpe扁桃体中省略pd-1抗体并且未观察到信号。
图19提供了在ffpe扁桃体用hrp-purple色原染色测量的pd-1和pd-l1蛋白的接近信号检测和用ap-yellow测量的cd8的多重染色图像(箭头=pd-l1/pd-1邻近性信号;虚线圆圈=cd8蛋白质信号)。
图20a是用dab染色测量的her2总蛋白质的图像。
图20b是用dab染色测量的具有正邻近性的her2/her3蛋白质的图像。
图20c是用dab染色测量的her3总蛋白质的图像。
具体实施方式
本申请公开了经掩蔽的半抗原及其合成方法。本申请还公开了包含经掩蔽的半抗原的缀合物。如本申请将更详细描述的,所述经掩蔽的半抗原偶联物可用于检测组织样品中的近侧抗原。本申请描述了这些和其他实施方案。
定义
除非上下文另外明确指出,否则本申请使用的单数术语"一"、"一个"和"该"包括复数指代。类似地,除非上下文另外明确指出,否则词语"或"旨在包括"和"。术语"包括"被包含性地定义,使得"包括a或b"意指包括a、b或者a和b。
术语"包含(comprising)"、"包括(including)"、"具有(having)"等可互换使用并且具有相同的含义。类似地,"包含(comprises)"、"包括(includes)"、"具有(has)"等可互换使用并且具有相同的含义。具体而言,每个术语被定义为与"包含"的通用美国专利法定义一致,并且因此被解释为意指"至少以下"的开放术语,并且也被解释为不排除附加的特征、限制、方面等。因此,例如,"具有组分a、b和c的设备"意指该设备包括至少组分a、b和c。类似地,短语"涉及步骤a、b和c的方法"意指该方法包括至少步骤a、b和c。此外,虽然这些步骤和过程可按照特定顺序在本申请中概述,但是本领域技术人员将认识到,排序步骤和过程可以变化。
本申请使用的碱性磷酸酶(ap)是通过破坏磷酸酯-氧键并且暂时形成中间体酶-底物键而去除(通过水解)并转移磷酸酯基有机酯的酶。例如,ap将萘酚磷酸酯(底物)水解为酚类化合物和磷酸酯。酚与无色的重氮盐(色原)偶联,生成不溶性有色偶氮染料。
本申请使用的术语"抗体",偶尔缩写为"ab",是指免疫球蛋白或免疫球蛋白样分子,包括例如但不限于iga、igd、ige、igg和igm、其组合以及任何脊椎动物(例如,在哺乳动物诸如人类、山羊、兔和小鼠)免疫应答期间产生的类似分子和特异性结合感兴趣分子(或一组高度类似的感兴趣的分子)的抗体片段,从而基本排除与其他分子的结合。抗体还指包含至少特异性识别和结合抗原表位的轻链或重链免疫球蛋白可变区的多肽配体。抗体可由重链和轻链组成,每个重链和轻链具有可变区,称为可变重(vh)区和可变轻(vl)区。总之,vh区和vl区负责结合由抗体识别的抗原。术语抗体还包括完整的免疫球蛋白以及本领域公知的变体和部分。
本申请使用的短语"抗体缀合物"是指与一个或多个标记(直接或间接)缀合的那些抗体,其中抗体缀合物对特定靶标是特异性的,并且其中标记能够(直接或间接)检测,诸如用二级抗体(抗标记抗体)检测。例如,抗体缀合物可诸如通过聚合物连接基和/或间隔基与半抗原偶联,并且可借助于半抗原间接检测抗体缀合物。作为一个替代实例,抗体缀合物可诸如通过聚合物连接基和/或间隔基与色原偶联,并且可直接检测抗体缀合物。抗体缀合物进一步在美国公开第2014/0147906号和美国专利第8,658,389;8,686,122;8,618,265;8,846,320;和8,445,191号中公开。作为另一个实例,术语"抗体缀合物"包括与酶偶联的那些抗体,例如,hrp或ap。
本申请使用的术语"抗原"是指可被特异性体液或细胞免疫的产物(诸如抗体分子或t细胞受体)特异性结合的化合物、组合物或物质。抗原可以是任何类型的分子,包括例如半抗原、简单的中间代谢物、糖(例如寡糖)、脂质和激素以及大分子诸如复合碳水化合物(例如多糖)、磷脂、核酸和蛋白质。
本申请使用的术语"生物样品"可以是获自任何活有机体、由其排泄或由其分泌的任何固体或流体样品,所述有机体包括但不限于,单细胞有机体(诸如细菌、酵母、原生动物和变形虫等)、多细胞有机体(诸如植物或动物,包括来自健康或表面上健康的人类受试者或受到待诊断或调查的病症或疾病(诸如癌症)侵袭的人类患者的样品)。例如,生物样品可以是获自例如血液、血浆、血清、尿液、胆汁、腹水、唾液、脑脊髓液、水性或玻璃体液或任何身体分泌物、漏出液、渗出液(例如获自脓肿或任何其他感染或炎症部位的流体),或获自关节(例如正常关节或受疾病侵袭的关节)的流体。生物样品也可以是获自任何器官或组织的样品(包括活检或尸检标本,诸如肿瘤活检),或者可包括细胞(不管是原代细胞还是培养细胞)或由任何细胞、组织或器官适应的介质/培养基(medium)。在一些实例中,生物样品是核提取物。在某些实例中,样品是质量控制样品,诸如所公开的细胞沉淀部分样品之一。在其他实例中,样品是测试样品。本领域普通技术人员可使用本领域已知的任何方法来制备样品。样品可获自常规筛查的受试者或疑似患有病症诸如遗传异常、感染或瘤形成的受试者。所公开的方法的所述实施方案也可应用于不具有遗传异常、疾病、病症等的样品,称为"正常"样品。样品可包括可被一个或多个检测探针特异性结合的多个靶标。
本申请使用的术语"生色团(chromophore)"是指对其颜色负责的分子或分子的一部分(例如发色底物)。当分子吸收可见光的某些波长并透射或反射其他光时,就会产生颜色。在可见光谱范围内的两个不同分子轨道之间具有能量差的分子可吸收可见光,并因此适当地表征为生色团。入射在生色团上的可见光可被吸收,从而将电子从基态分子轨道激发至激发态分子轨道。
本申请使用的术语"缀合物"是指共价连接较大构建体的两个或更多个分子或部分(包括大分子或超分子分子)。在一些实施方案中,缀合物包括与一个或多个其他分子部分共价连接的一个或多个生物分子(诸如肽、蛋白质、酶、糖、多糖、脂质、糖蛋白和脂蛋白)。
本申请使用的术语"偶联"或"偶合"是指将一个分子或原子与另一个分子或原子结合、键合(例如共价键合)或连接。
本申请使用的术语"可检测部分"是指可产生指示样品中标记的存在(即定性分析)和/或浓度(即定量分析)的可检测(诸如视觉上、电子或其他方面)信号的分子或材料。可通过任何已知或尚未发现的机制(包括光子的吸收、发射和/或散射(包括无线电频率、微波频率,红外频率,可见频率和紫外频率光子))产生可检测信号。可检测部分的实例包括生色、荧光、磷光和发光分子和材料。
本申请使用的术语"表位"是指抗原决定簇,诸如分子上具有抗原性,即引发特异性免疫应答的连续或非连续的肽序列。抗体结合特定的抗原表位。
本申请使用的辣根过氧化物酶(hrp)是可与经标记分子缀合的酶。当与适当的底物温育时,它产生经标记分子的有色、荧光或发光衍生物,使其被检测和定量。hrp在电子供体存在下起作用,首先形成酶底物复合物,然后起到氧化电子供体的作用。例如,hrp可作用于3,3'-二氨基联苯胺盐酸盐(dab)以产生可检测的颜色。hrp还可作用于经标记的酪胺缀合物或酪胺样反应性缀合物(即阿魏酸(ferulate)、香豆素(coumaric)、咖啡酸(caffeic)、肉桂酸(cinnamate)、多巴胺等)以沉积用于酪胺信号放大(tsa)的有色或荧光或无色可检测部分。
本申请使用的术语"多路复用(multiplex、multiplexed或multiplexing)"是指同时地、基本同时地或依次地检测样品中的多个靶标。多路复用可包括单独地及以任何和全部组合来鉴定和/或定量多个不同的核酸(例如,dna、rna、mrna、mirna)和多肽(例如蛋白质)。
本申请使用的术语"一级抗体(primaryantibody)"是指与组织样品中的靶标蛋白抗原特异性结合的抗体。一级抗体通常是用于免疫组织化学程序的第一抗体(firstantibody)。
本申请使用的术语"二级抗体(secondaryantibody)"在申请中是指与一级抗体特异性结合的抗体,从而在一级抗体与随后的试剂(例如标记、酶等)之间形成桥(如果有的话)。二级抗体通常是用于免疫组织化学程序的第二抗体(secondantibody)。
本申请使用的术语"特定结合实体"是指特定结合对的成员。特异性结合对是一对分子,其特征在于它们彼此结合以基本上排除与其他分子的结合(例如,特异性结合对可具有比生物样品中结合对的两个成员中的任一个与其他分子的结合常数大至少103m-1、104m-1105m-1的结合常数)。特异性结合部分的具体实例包括特异性结合蛋白(例如抗体、凝集素、抗生物素蛋白诸如链霉亲和素和蛋白a)。特异性结合部分还可包括被这些特异性结合蛋白特异性结合的分子(或其部分)。
本申请使用的术语"靶标"是指存在、位置和/或浓度被确定或可被确定的任何分子。靶标分子的实例包括蛋白质、表位、核酸序列和半抗原,诸如与蛋白质共价键合的半抗原。通常使用特异性结合分子和可检测标记的一种或多种缀合物来检测靶标分子。
本申请使用的术语"酪胺信号放大"或"tsa"是指酶介导的检测方法,其利用过氧化物酶(诸如辣根过氧化物酶)的催化活性原位产生靶标分子(诸如蛋白质或核酸序列)的高密度标记。tsa通常涉及三个基本步骤:(1)将特异性结合成员(例如抗体)结合至靶标,随后用第二过氧化物酶标记的特异性结合成员对特异性结合成员进行二次检测;(2)通过过氧化物酶活化经标记的酪胺衍生物(例如半抗原标记的酪胺)的多个拷贝;和(3)将所得高度反应性的酪胺残基共价偶联至邻近过氧化物酶-靶标相互作用位点的残基(例如蛋白质酪氨酸残基的酚部分),导致半抗原向近端沉积(扩散和反应性介导)至靶标。在tsa的一些实例中,涉及更多或更少的步骤;例如,可依次重复tsa方法来增加信号。可使用进行tsa的方法和用于进行tsa的商业试剂盒和试剂(参见,例如,具有tsatm的ampmap检测试剂盒,目录号760-121,ventanamedicalsystems,tucson,ariz;invitrogen;tsa试剂盒号t-20911,invitrogencorp,carlsbad,calif.)。其他酶催化的、半抗原或信号传导连接的反应性物种可替代地使用,因为它们可能变得可用。
经掩蔽的半抗原
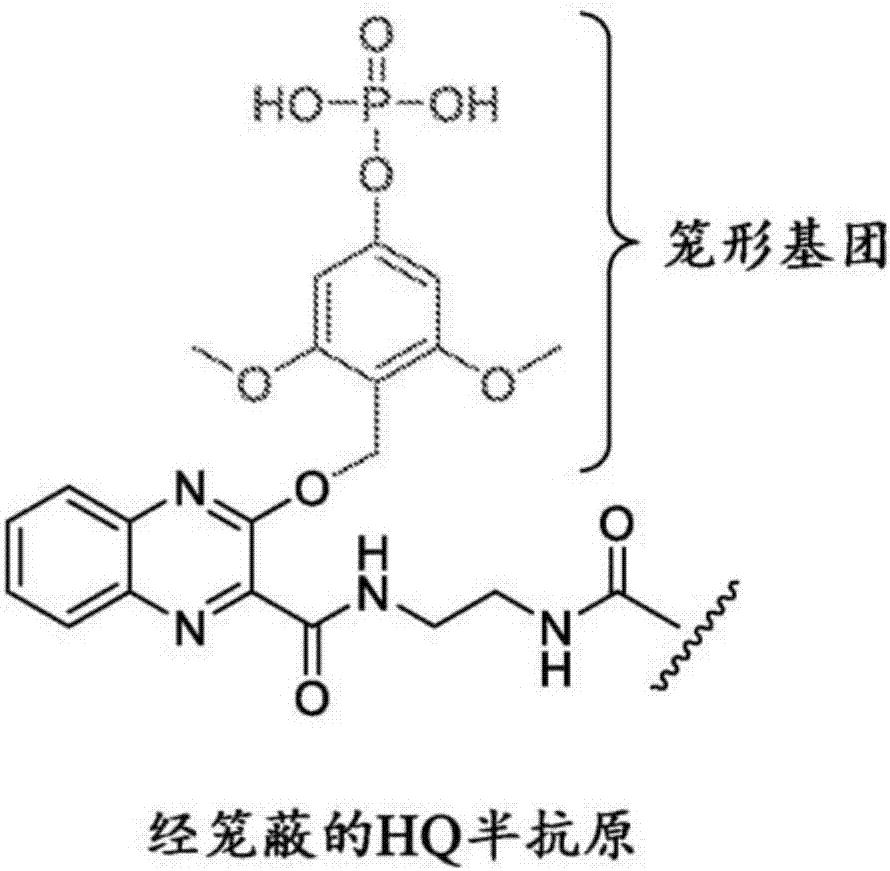
本申请的一个方面是"经掩蔽的半抗原",诸如图1b所示。如本领域技术人员将认识到的,半抗原是针对其已经产生抗半抗原抗体的小分子。"经掩蔽的半抗原"是一种半抗原,其结构已经被修饰,使得合适的抗半抗原抗体不再识别该分子并且不发生结合事件。实际上,半抗原的身份被"掩饰(masked)"或"保护"。本申请公开的经掩蔽的半抗原已经设计成酶可切割的掩蔽基团,使得通过酶处理释放各自的半抗原(即未掩蔽或未掩饰的半抗原)以再生天然半抗原(参见例如图2,其经酶处理说明经掩蔽的半抗原的暴露)。因此,在适当的酶存在下,经掩蔽的半抗原被暴露,并且抗半抗原抗体自由地与其结合。
在一些实施方案中,本申请的经掩蔽的半抗原具有式(i)的结构:
其中
x为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
a为基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
y为能够与另一基团形成共价键的反应性基团;和
"半抗原"和"掩蔽基团"如本申请所述;和
q为0或1。
在一些实施方案中,所述掩蔽基团为包含两个共价键合组分的酶可裂解部分,即(i)离去基团部分,和(ii)酶底物部分,如式(ia)所示。
在其他实施方案中,the掩蔽基团仅包含酶底物部分,其直接或间接偶联至式(ib)的半抗原:
合适的酶底物(和作用于它们的酶)的实例包括但不限于磷酸酯基团(由碱性磷酸酶作用);酯基团(由脂肪酶作用);硫酸酯基团(由硫酸酯酶作用于);糖苷基团(作用于糖基化酶);酰胺基团(由酰胺酶或蛋白酶作用);脲基团(由脲酶作用);和硝基基团(由硝基还原酶作用)。
在一些实施方案中,所述离去基团包含5元、6元或7元芳族环或杂环,其中所述环的任何位置可经取代或未经取代。在一些实施方案中,所述离去基团为经取代或未经取代的具有1、2或3个选自o、n或s的杂原子的5元、6元或7元杂环。在一些实施方案中,所述离去基团选自经取代或未经取代的呋喃、吡咯、噻吩、咪唑、吡唑、噁唑、异噁唑、噻唑、吡啶、吡嗪、嘧啶、哒嗪、三嗪、2h-吡喃、4h-吡喃、2h-噻喃、4h-噻喃、噁嗪或噻嗪。在一些实施方案中,所述5元、6元或7元芳族环或杂环取代有卤素、具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;或具有1-4个碳原子的支化或非支化、经取代或未经取代的烷基,其本身可包含一个或多个选自o、n或s的杂原子和/或其可取代有一个或多个卤素。在一些实施方案中,所述离去基团可取代有硝基、氰基或羧基。
在一些实施方案中,所述掩蔽基团具有式(ii)的结构:
其中
每个r1独立选自h、f、cl、br、i、-o-甲基、-o-乙基、-o-正丙基、-o-异丙基、-o-正丁基、-o-仲丁基或-o-异丁基;具有1-4个碳原子的-s-烷基;具有1-4个碳原子的-o-烷基;具有1-4个碳原子的-n(h)-烷基;具有1-6个碳原子的-n-(烷基)2;具有1-4个碳原子且任选取代有n或s的烷基;氰基;和羧基。
r2为酶底物。
在一些实施方案中,每个r1基团是相同的。在其他实施方案中,每个r1基团是不同的(即每个r1包含不同的部分)。例如,第一r1基团可包含卤素,而第二r1可包含烷基。
尽管式(ii)描述了包含6个碳原子的六元芳族环,但本领域技术人员将会理解,一个或多个杂原子(例如o、n或s)可被芳族环的一个或多个碳原子取代。
在一些实施方案中,任何离去基团离去的能力取决于半抗原的电子。在一些实施方案中,某些半抗原的电子学(electronics)需要给电子基团以鼓励离去基团能力。在其他实施方案中,半抗原需要吸电子基团。例如,取决于被掩蔽的官能团的pka,一些半抗原需要在掩蔽基团的离去基团上添加给电子基团,而其他则可能需要吸电子基团。不希望受到任何特定理论的限制,认为具有高pka值的半抗原官能团倾向于需要给电子基团。这很可能是因为一旦离去基团被排除,该位置的给电子基团能够通过感应或共振效应直接稳定离去基团的正电荷。这种情况的一个实例是掩蔽的hq,在没有给电子基团的情况下,离去基团不会在没有过高的反应温度(约100℃)的情况下离去。另一方面,据信对于具有低pka值的半抗原官能团,可能需要吸电子基团。这很可能是因为一旦离去基团被排除,半抗原官能团上产生的负电荷具有如此高的稳定性,使得在离去基团上可能需要不稳定的电子力来帮助稳定经掩蔽的半抗原对抗水解。据信吸电子基团可能使离去基团上的正电荷不稳定,从而使经掩蔽的半抗原对水解更稳定。
取代基r1和r2可位于沿相对于使掩蔽基团偶联到半抗原的基团的式(ii)的环的任何位置。在一些实施方案中,r2位于使掩蔽基团偶联到半抗原上的基团的对位,如式(iia)所示:
在式(iia)化合物的其它实施方案中,取代基r1可独立地位于基团r2的邻位或间位。在一些实施方案中,式(iia)的每个r1基团是不同的,即每个r1基团包含不同的部分。
在进一步的实施方案中,所述掩蔽基团具有式(iib)的结构:
在一些实施方案中,式(iib)的每个r1基团是不同的,即每个r1基团包含不同的部分。
在又进一步的实施方案中,所述掩蔽基团具有式(iic)的结构:
在一些实施方案中,式(iic)的每个r1基团是不同的,即每个r1基团包含不同的部分。
在又进一步的实施方案中,所述掩蔽基团具有式(iid)的结构:
在一些实施方案中,式(iid)的每个r1基团是不同的,即每个r1基团包含不同的部分。
不希望受任何特定理论的束缚,据信掩蔽基团的水解稳定性和离去基团能力当偶联到不同半抗原时可能是不同的。例如,在相对于磷酸酯的间位上安装-ome基团的掩蔽基团被认为是为2-羟基喹喔啉(hq)半抗原提供稳定性和反应性的良好混合物,但被认为比安装在硝基吡唑(np)半抗原上时所期望的相对更不稳定。这通过以下方式弥补:使用其中-ome基团安装在相对于磷酸酯基团的邻位的掩蔽基团。同样,不希望受任何特定理论的束缚,据信hq半抗原和掩蔽基团之间形成的o-苄基键比np和掩蔽基团之间形成的n-苄基键更稳定。这通过类似地以下方式弥补:一旦磷酸酯被裂解,在hq半抗原上引入与苄基邻位的-ome基团来帮助"推动"电子穿过环并断开键。np半抗原相对更不稳定,并且因此不需要相同的"推动"。
再次,并且不希望受任何特定理论的束缚,据信不具有-ome基团的掩蔽基团可能需要非常高的温度来拆解(disassemble)。然而,具有与磷酸酯邻位的-ome基团的掩蔽基团可能需要适度的温度才能拆解;而具有与磷酸酯间位的-ome基团的掩蔽基团在室温可能会拆解。不希望受任何特定理论的束缚,据信可通过向苄基位添加一个或两个额外的脂族基团来增加稳定性,同时也增加反应性。据信这可在空间上保护苄基免遭水解,同时还在拆解时产生更稳定的2°或3°苄基碳正离子。
如本申请所述,当酶与掩蔽基团的酶底物部分相互作用时,掩蔽基团经历电子变化,使得掩蔽基团从经掩蔽的半抗原中分离,得到非掩蔽半抗原或非掩饰半抗原。图2说明在碱性磷酸酶与掩蔽基团的磷酸酯酶底物部分相互作用时掩蔽hq半抗原内发生的电子变化。如本领域普通技术人员将会理解的,在其他经掩蔽的半抗原系统中发生类似的电子变化。
在一些实施方案中,半抗原包括但不限于吡唑类(例如硝基吡唑);硝基苯基化合物类;苯并呋咱类;三萜类;脲类(例如苯基脲);硫脲类(例如苯基硫脲);鱼藤酮和鱼藤酮衍生物;噁唑类(例如噁唑磺酰胺);噻唑类(例如噻唑磺酰胺);香豆素和香豆素衍生物;和环木脂素类。半抗原的另外的非限制性实例包括噻唑类;硝基芳基类;苯并呋喃类;三萜类;和环木脂素类。
半抗原的具体实例包括二硝基苯基、生物素、地高辛(digoxigenin)和荧光素及其任何衍生物或类似物。其他半抗原述于美国专利第8,846,320;8,618,265;7,695,929;8,481,270;和9,017,954,其公开内容通过引用整体并入本申请。
如上所述,x可以是键;或包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子并且任选具有一个或多个选自o、n或s的杂原子的脂族基团的基团。在一些实施方案中,x可包括羰基、胺、酯、醚、酰胺、亚胺、硫酮或巯基。在其他实施方案中,x可包括一个或多个选自胺、羰基、酯、醚、酰胺、亚胺、硫酮或巯基的末端基团。
在一些实施方案中,x具有式(iiia)的结构:
其中d和e各自独立为4-18范围内的整数;q为键、o、s或n(rc)(rd);ra和rb独立地为h、c1-c4烷基、f、cl或n(rc)(rd);和rc和rd独立地为ch3或h。在一些实施方案中,d和e各自独立为1-24范围内的整数。
在其他实施方案中,x具有式(iiib)所示的结构:
其中d和e各自独立为1-24范围内的整数;q为键、o、s或n(rc)(rd);和rc和rd独立地为ch3或h。在其他实施方案中,q为o。
在又其他实施方案中,'连接基'具有式(iiic)所示的结构:
其中d和e各自独立为1-24范围内的整数。在一些实施方案中,d为2且e的范围为2-24。
在又其他实施方案中,x可包括一个或多个烯化氧或peg基团(例如peg2-peg24)。本领域的普通技术人员将会理解,随着氧原子的数目增加,化合物的亲水性也可能增加。
不希望受任何特定理论的束缚,据信连接基长度可能影响邻近信号。例如,制备包含peg8、peg4和不含peg连接基的经掩蔽的半抗原,并进行测试。连接基的长度越长,我们在e-cad和b-cat的控制二聚体系统上看到的信号就越多。虽然"更多的信号"似乎总是有用的,在这种情况下,这不是因为我们在共同定位但已知不形成二聚体的蛋白标志物(ki67和bcl6)上测试时也观察到信号。我们发现不使用peg连接基消除了共定位控制系统上的信号,同时仍然在已知的二聚体控制系统上提供一些信号。结果是,一些经掩蔽的半抗原实施方案不包括peg基团。
如本申请所述,a为基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子并且任选具有一个或多个选自o、n或s的杂原子的脂族基团。在一些实施方案中,a具有式(iiid)的结构:
其中d和e各自独立为2-15范围内的整数;q为键、o、s或n(rc)(rd);ra和rb独立地为h、c1-c4烷基、f、cl或n(rc)(rd);和rc和rd独立地为ch3或h。在一些实施方案中,d和e各自独立为1-12范围内的整数。
在一些实施方案中,反应性基团y为羰基反应性基团。合适的羰基反应性基团包括肼、肼衍生物和胺。在其他实施方案中,反应性基团y为胺反应性基团。合适的胺反应性基团包括活性酯,诸如nhs或磺基-nhs、异硫氰酸酯、异氰酸酯、酰基叠氮化物、磺酰氯、醛、乙二醛、环氧化物、环氧乙烷、碳酸酯、芳基卤化物,亚氨酸酯、酸酐等。在又一些实施方案中,反应性基团y为巯基反应性基团。合适的巯基反应性基团包括不可聚合的michael受体、卤代乙酰基(诸如碘代乙酰基)、烷基卤化物、马来酰亚胺,氮杂环丙烷、丙烯酰基、乙烯基砜,苯醌,可经历亲核取代的芳族基团诸如氟代苯基(诸如四氟苯和五氟苯基团)和二硫化物基团诸如吡啶基二硫化物基团和用ellman试剂活化的硫醇。
以下提供经掩蔽的半抗原的具体实例,包括掩蔽7-(二乙基氨基)香豆素-3-羧酸(dcc)、掩蔽生物素、掩蔽硝基吡唑、掩蔽噻唑磺酰胺(ts)和掩蔽苯并呋咱(bf)。以下每个经掩蔽的半抗原包含碱性磷酸酶的底物。
经掩蔽的半抗原的其他实例,包括作用于经掩蔽的半抗原的酶底物部分的特定酶,提供于图15中。
经掩蔽的半抗原的合成
经掩蔽的半抗原可根据本领域普通技术人员已知的任何方法合成。例如,可从经取代的4-羟基苯甲醛开始制备掩蔽基团。经取代的4-羟基苯甲醛的羟基可被磷酸酯基团取代,随后还原醛并且通过appel反应用卤素取代所得苄醇。然后可通过卤素取代的掩蔽基团与半抗原在碱性条件下的反应将掩蔽基团安装在感兴趣的半抗原上(如果半抗原含有多个亲核基团,则可能需要保护化学以选择所需的掩蔽位置)。然后可使用三甲基溴硅烷使掩蔽基团的经保护的磷酸基团脱保护,随后使经掩蔽的半抗原与反应性基团(即马来酰亚胺)反应以促进与抗体的缀合。
"经掩蔽的hq半抗原"的合成(参见图1b)示于实施例1和方案3。"经掩蔽的np半抗原"的合成示于以下方案1。
方案1:以经取代的4-羟基苯甲醛起始的掩蔽np半抗原的合成。
经掩蔽的半抗原的缀合物
本申请提供了包含经掩蔽的半抗原的新颖缀合物。在一些实施方案中,经掩蔽的半抗原与特异性结合体缀合,例如抗体或核酸探针。在其他实施方案中,经掩蔽的半抗原与抗体缀合,如式(iv)所示:
其中
a为基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-15个碳原子的脂族基团,并且任选具有一个或多个选自o、n或s的杂原子;
q为0或1;
n为1-25范围内的整数,和
z为键或基团,所述基团包含支化或非支化、经取代或未经取代、饱和或不饱和的具有1-30个碳原子并且任选具有一个或多个选自o、n或s的杂原子的脂族基团。在一些实施方案中,z包括具有式(iiia)、(iiib)或(iiic)中任一种的结构的基团。
在一些实施方案中,n为1-8范围内的整数。在其他实施方案中,n为1-6范围内的整数。在又其他实施方案中,n为1-4范围内的整数。在进一步的实施方案中,n为2-5范围内的整数。在又进一步的实施方案中,n为3。在更进一步的实施方案中,n为4。
在一些实施方案中,所述经掩蔽的半抗原与一级抗体缀合(例如与对β-连环蛋白具有特异性的抗体缀合的经掩蔽的半抗原)。在其他实施方案中,所述经掩蔽的半抗原与二级抗体缀合(例如与对抗-β-连环蛋白具有特异性的抗体缀合的经掩蔽的半抗原)。
经掩蔽的半抗原可与抗体的任何部分偶联。适用于共价修饰的抗体的三个官能团包括(i)胺(-nh2),(ii)巯基(-sh)和(iii)碳水化合物残基。如此,本申请公开的任何经掩蔽的半抗原可与胺残基,巯基残基和碳水化合物残基或其任何组合偶联。在一些实施方案中,经掩蔽的半抗原与抗体的fc部分偶联。
经掩蔽的半抗原缀合物的合成
本申请的缀合物可根据本领域普通技术人员已知的任何方式合成。
在一些实施方案中,经掩蔽的半抗原与抗体的巯基缀合。在一些实施方案中,通过用还原剂诸如二硫苏糖醇(dtt)或二硫赤藓糖醇(dte)处理抗体,首先将巯基引入抗体。对于温和的还原剂,诸如dte或dtt,利用约1mm至约40mm的浓度(例如,约5mm至约30mm或约15mm至约25mm的浓度)向抗体中引入有限数量的巯基(诸如约2个至约6个),同时保持抗体完整(其可通过尺寸排阻层析确定)。在用还原剂处理之后,引入过量带有巯基反应性基团(例如马来酰亚胺基团)的经掩蔽的半抗原以形成各自的经掩蔽的半抗原-抗体缀合物。
在其他实施方案中,经掩蔽的半抗原与抗体的fc部分缀合。在一些实施方案中,首先将抗体的fc部分氧化形成醛,随后将经掩蔽的半抗原通过经掩蔽的半抗原上的反应性官能团与抗体的经氧化的fc部分(例如具有羰基反应性基团,诸如酰肼基团)偶联。
在又另一实施方案中,经掩蔽的半抗原与抗体的赖氨酸残基缀合。如以下合成方案(方案2)所示,在一些实施方案中,首先用过量的traut试剂(2-亚氨基硫代环戊烷盐酸盐)处理抗体,然后羰基过量的适当官能化的经掩蔽的半抗原(例如带有巯基反应性基团诸如马来酰亚胺基团的经掩蔽的半抗原)。
方案2:说明抗体("ab")上的氨基与traut试剂反应,接着所得中间体与掩蔽hq马来酰亚胺偶联的合成方法学。
合成后,可通过诸如尺寸排阻色谱法(sec)纯化缀合物,然后诸如通过凝胶电泳和/或uv-vis表征。
经掩蔽的半抗原抗体缀合物的检测
在一些实施方案中,利用检测试剂来检测经掩蔽的半抗原偶联物或经掩蔽的半抗原偶联物与靶标的复合物。在一些实施方案中,所使用的检测试剂对于任何经掩蔽的半抗原-缀合物的经掩蔽的半抗原相应的各自未掩饰的半抗原具有特异性。因此,术语"各自未掩饰的半抗原"或"未掩饰的半抗原"是指已经与适当的暴露酶"未掩蔽"以揭示"天然"半抗原的经掩蔽的半抗原,即与经掩蔽的半抗原的酶底物部分反应的暴露酶。至少在图2中进一步描述了"未掩蔽"或"未掩饰"的步骤。如本申请将描述的,检测试剂还可包括设计用于增加信号的组分,例如信号扩增组分或信号扩增试剂盒。
在一些实施方案中,对未掩饰半抗原具有特异性的检测试剂是对经掩蔽的半抗原缀合物的未掩饰半抗原具有特异性的二级抗体,即抗-未掩饰半抗原抗体,并且其自身与可检测部分缀合。"可检测部分"是可产生可检测(诸如视觉上、电子或其他方面)信号的分子或材料,所述信号指示样品中经掩蔽的半抗原-抗体缀合物和/或暴露酶-抗体缀合物的存在(即定性分析)和/或浓度(即定量分析)。可通过任何已知或尚未发现的机制(包括光子的吸收、发射和/或散射(包括无线电频率、微波频率、红外频率、可见频率和紫外频率光子))产生可检测信号。
在一些实施方案中,抗-未掩饰半抗原抗体的可检测部分包括使一种物质转化成另一种物质以提供可检测差异(诸如通过使无色物质转化成有色物质或反之亦然,或通过产生沉淀物或增加样品浊度)的生色、荧光、磷光和发光分子和材料、催化剂(诸如酶),可通过抗体-半抗原结合相互作用使用额外的可检测标记的抗体缀合物检测的半抗原,以及顺磁性和磁性分子或材料。当然,可检测部分本身也可被间接检测到,例如如果可检测部分是半抗原,则对可检测部分具有特异性的另一种抗体可用于检测可检测部分,如本领域普通技术人员已知的。
在一些实施方案中,所述为掩饰半抗原抗体包括选自以下的可检测部分:cascadeblue乙酰基叠氮化物;dapoxyl磺酸/羧酸dy-405;alexafluor405cascadeyellow吡啶基噁唑琥珀酰亚胺酯(pympo);pacificbluedy-415;7-羟基香豆素-3-羧酸dyq-425;6-fam亚磷酰胺;luciferyellow;alexafluor430dabcylnbd氯化物/氟化物;qsy35dy-485xl;cy2dy-490;oregongreen488alexafluor488bodipy493/503c3dy-480xl;bodipyflc3bodipyflc5bodipyfl-xdyq-505;oregongreen514dy-510xl;dy-481xl;6-羧基-4',5'-二氯-2',7'-二甲氧基荧光素琥珀酰亚胺酯(joe);dy-520xl;dy-521xl;bodipyr6gc3赤藓红异硫氰酸酯;5-羧基-2',4',5',7'-四溴砜荧光素alexafluor5326-羧基-2',4,4',5'7,7'-六氯荧光素琥珀酰亚胺酯(hex);bodipy530/550c3dy-530;bodipytmr-xdy-555;dyq-1;dy-556;cy3dy-547;dy-549;dy-550;alexafluor555alexafluor546dy-548;bodipy558/568c3若丹明红-xqsy7bodipy564/570c3bodipy576/589c3羧基-x-若丹明(rox);alexafluor568dy-590;bodipy581/591c3dy-591;bodipytr-xalexafluor594dy-594;羧基萘荧光素dy-605;dy-610;alexafluor610dy-615;bodipy630/650-x食用色素亮蓝;alexafluor633alexafluor635琥珀酰亚胺酯;dy-634;dy-630;dy-631;dy-632;dy-633;dyq-2;dy-636;bodipy650/665-xdy-635;cy5alexafluor647dy-647;dy-648;dy-650;dy-654;dy-652;dy-649;dy-651;dyq-660;dyq-661;alexafluor660cy5.5dy-677;dy-675;dy-676;dy-678;alexafluor680dy-679;dy-680;dy-682;dy-681;dyq-3;dyq-700;alexafluor700dy-703;dy-701;dy-704;dy-700;dy-730;dy-731;dy-732;dy-734;dy-750;cy7dy-749;dyq-4;和cy7.5。
荧光团属于几种常见的化学类别,包括香豆素类、荧光素类(或荧光素衍生物和类似物)、若丹明类、试卤灵类、发光团类和花青类。荧光分子的额外实例可在molecularprobeshandbook—aguidetofluorescentprobesandlabelingtechnologies,molecularprobes,eugene,or,thermofisherscientific,第11版中找到。在其他实施方案中,荧光团选自呫吨衍生物、花青衍生物、方酸衍生物、萘衍生物、香豆素衍生物、噁二唑衍生物、蒽衍生物,芘衍生物,噁嗪衍生物,吖啶衍生物,芳基次甲基衍生物和四吡咯衍生物。在其他实施方案中,所述荧光部分选自cf染料(购自biotium)、draq和cytrak探针(购自biostatus)、bodipy(购自invitrogen)、alexafluor(购自invitrogen)、dylightfluor(例如dylight649)(购自thermoscientific,pierce)、atto和tracy(购自sigmaaldrich)、fluoprobes(购自interchim)、abberior染料(购自abberior)、dy和megastokes染料(购自dyomics)、sulfocy染料(购自cyandye)、hilytefluor(购自anaspec)、seta、setau和square染料(购自setabiomedicals)、quasar和calfluor染料(购自biosearchtechnologies)、surelight染料(购自apc,rpepercp,phycobilisomes)(columbiabiosciences)、及apc、apcxl、rpe、bpe(购自phyco-biotech,greensea,prozyme,flogen)。
在其他实施方案中,抗-未掩饰的半抗原抗体与酶缀合。在这些实施方案中,除了用于解除掩饰的酶之外(例如暴露酶-抗体缀合物的暴露酶,如本申请进一步所述),可使用任何与相关抗-未掩饰的半抗原抗体缀合的酶产生最终邻近信号。在一些实施方案中,合适的酶包括但不限于辣根过氧化物酶、碱性磷酸酶、酸性磷酸酶、葡萄糖氧化酶、神经氨酸酶、β-半乳糖苷酶、β-葡糖醛酸糖苷酶或β-内酰胺酶。在其他实施方案中,酶包括氧化还原酶或过氧化物酶(例如hrp)。在这些实施方案中,与抗-未掩饰的半抗原抗体缀合的酶催化生色底物、共价半抗原、共价荧光团、非共价色原和非共价荧光团转化成反应性部分,所述反应性部分标记邻近靶标或直接在靶标上的样品。
生色化合物/底物的具体非限制性实施例包括二氨基联苯胺(dab)、4-硝基苯基磷酸酯(pnpp)、坚牢红、溴氯吲哚基磷酸酯(bcip)、硝基四氮唑蓝(nbt)、bcip/nbt、ap橙、ap蓝、四甲基联苯胺(tmb)、2,2'-连氮基-二-[3-乙基苯并噻唑啉磺酸酯](abts)、邻联茴香胺、4-氯萘酚(4-cn)、硝基苯基-β-d-半乳吡喃糖苷(onpg)、邻苯二胺(opd)、5-溴-4-氯-3-吲哚基-β-半乳吡喃糖苷(x-gal)、甲基伞形酮基-β-d-半乳吡喃糖苷(mu-gal)、对硝基苯基-α-d-半乳吡喃糖苷(pnp)、5-溴-4-氯-3-吲哚基-β-d-葡糖苷酸(x-gluc)、3-氨基-9-乙基咔唑(aec)、品红、碘硝基四氮唑(int)、四氮唑蓝和四氮唑紫。dab,在过氧化物酶和过氧化氢存在下被氧化,导致在酶活性部位沉积棕色、醇不溶性沉淀物。
在一些实施方案中,生色底物是包含潜在反应性部分和生色部分的信号传导缀合物。在一些实施方案中,所述信号传导缀合物的潜在反应性部分被配置为经历催化活化以形成可与样品或与其它检测组分共价结合的反应性物种。催化活化由一种或多种酶(例如氧化还原酶和过氧化物酶,如辣根过氧化物酶)驱动,并导致形成反应性物种。这些反应性物种能够与邻近其发生的生色部分(即靠近酶)反应。信号传导缀合物的具体实例在美国专利公开第2013/0260379号中公开,其公开内容通过引用整体并入本申请。
其它底物包括在第5,583,001号美国专利、第2012/0171668号美国申请公开和pct/ep2015/0533556中提出的底物,其公开内容在此通过引用整体并入本申请。如以上引用的参考文献所述,与tsa或qm缀合物偶联的合适生色底物或荧光底物包括n,n'-双羧基戊基-5,5'-二磺酸基-吲哚-二羰花青(cy5)、4-(二甲基氨基)偶氮苯-4'-磺酰胺(dabsyl)、四甲基若丹明(tamra)和若丹明110(若丹明)。
在一些实施方案中,选择生色底物、荧光底物或信号传导缀合物,使得任何生色部分的峰值可检测波长不彼此重叠并且易于被病理学家或光学检测器(例如扫描仪)检测到。在一些实施方案中,选择发色部分,使得不同生色部分的峰值波长相隔至少约50nm。在其他实施方案中,选择生色部分,使得不同生色部分的峰值波长相隔至少约70nm。在另一实施方案中,选择生色部分,使得不同生色部分的峰值波长间隔至少约100nm。
在又进一步的实施方案中,选择生色部分,使得当引入到组织标本时,生色部分提供不同的颜色(例如黄色、蓝色、洋红色)。在一些实施方案中,选择生色部分,使得它们彼此之间提供良好的对比,例如光学可识别的颜色的分离。在一些实施方案中,选择生色部分,使得当彼此邻近放置时,提供与单独观察时生色部分中的任一个的信号或颜色不同的信号或颜色。
使用经掩蔽的半抗原缀合物的邻近检测
如将在本申请中更详细描述的,本申请使得能够检测彼此非常邻近的蛋白质二聚体或蛋白质。蛋白质-蛋白质相互作用的非限制性实例包括彼此之间的her1/2/3/4蛋白质中的任一种;pd-1与pd-l1;和/或pd-l2、egfr(her1)及其任何相关配体(areg、ereg)。
不希望受任何特定理论的束缚,据信所公开的邻近测定比仅测量蛋白质-蛋白质相互作用更普遍。实际上,所公开的测定允许测量结合部分的邻近性。实际上,结合部分(例如抗体)可针对它们之间具有最小距离或没有距离的靶标。这样的实例可包括信号传导事件,如蛋白质的磷酸化。在这种情况下,如果一种抗体针对蛋白质上的表位(例如her2),并且第二抗体针对所有磷酸化酪氨酸,则邻近信号将代表所有磷酸化的her2蛋白质。这种类型的测定比相互作用的蛋白质对更加二元化(是/否)。
在一些实施方案中,该测定法能够检测具有5000nm或更小邻近性的蛋白质二聚体或蛋白质。在其他实施方案中,该测定法能够检测邻近2500nm或更低的蛋白质二聚体或蛋白质。在又其他实施方案中,该测定法能够检测具有1000nm或更小邻近性的蛋白质二聚体或蛋白质。在进一步的实施方案中,该测定法能够检测具有500nm或更小邻近性的蛋白质二聚体或蛋白质。
本领域技术人员将理解,经掩蔽的半抗原偶联物可用于单纯测定法(检测蛋白质二聚体或蛋白质邻近性)和多重测定法(检测蛋白质二聚体或蛋白质邻近性和检测总蛋白质)。"总蛋白质"是指任何给定蛋白质的正常ihc可视化,而邻近信号是参与给定相互作用的该蛋白质的部分。例如,并且在pd-1/pd-l1测定的情况下,邻近信号将仅可视化pd-1和pd-l1之间的相互作用,而总蛋白质信号将使样品中的所有pd-1可视化。将邻近性的打分表示为分子,并且将总蛋白质的打分表示为分母,可给出参与相互作用的pd-1的分数或百分比。这对于检测干扰蛋白质-蛋白质相互作用的活性药物成分的诊断是重要的,其中蛋白质的表达不如相互作用蛋白质的数量重要。如上所述,这被认为适用于磷酸化,其中不是仅仅接受磷酸化信号的任意打分,而是可定量多少百分比的给定蛋白质被磷酸化。
参考图4,蛋白质二聚体的检测发生在两个一般阶段。在第一阶段中,在步骤150中用抗体缀合物标记样品。在第二阶段中,在步骤160中使样品与第一检测试剂和任选的第二检测试剂接触。
在一些实施方案中,首先在步骤100中使样品与对靶标具有特异性的暴露酶-抗体缀合物接触,以形成靶标-暴露酶-抗体缀合物复合物。随后,在步骤110中样品与经掩蔽的半抗原-抗体缀合物(诸如式(iii)和对另一靶标具有特异性的那些)接触,以形成靶标-经掩蔽的半抗原-抗体缀合物复合物。本领域技术人员将会理解,选择与经掩蔽的半抗原-抗体缀合物的酶底部分反应的暴露酶。本领域技术人员还将认识到,步骤100和110可以任何顺序进行或可同时进行。在一些实施方案中,在引入经掩蔽的半抗原-抗体缀合物之前或同时引入可逆的酶抑制剂。例如,在一些实施方案中,经掩蔽的半抗原-抗体缀合物可用磷酸盐缓冲液配制。
如本申请所述,经掩蔽的半抗原-抗体缀合物的经掩蔽的半抗原部分能够变得不被掩饰以提供各自的未掩饰半抗原,即天然半抗原。如图2所示,如果第一靶标101与第二靶标102充分邻近,则经掩蔽的半抗原-抗体缀合物103a将被提供在暴露酶-抗体缀合物104邻近处(邻近处标记为105)使得暴露酶-抗体缀合物104的暴露酶可与经掩蔽的半抗原-抗体缀合物103a的酶底物反应。这又导致形成第一靶标未被掩饰的半抗原-抗体缀合物复合物(103b)。如图2所示,第一靶标未被掩饰的半抗原-抗体缀合物复合物(103b)能够与其他特异性结合实体结合或被其识别(例如二级抗体106)。
在一些实施方案中,所述方法还包括一个或多个"脱掩蔽步骤",其中改变载玻片上的条件以增强酶活性。在测定的抗体缀合物结合部分期间,当缀合物过量时,采取步骤以防止经掩蔽的半抗原的偶然"脱掩蔽",这会导致假阳性结果。这些步骤包括添加可逆的酶抑制剂(例如防止酶对掩蔽基团的作用)。例如,在碱性磷酸酶(ap)的情况下,这些抑制剂可包括磷酸盐、苯丙氨酸和edta,其据信能够通过不同的机制降低酶活性。在一些实施方案中,通过洗涤除去未结合的抗体缀合物,则有必要改变载玻片上的条件以有利于最佳的酶活性,从而发生"脱掩蔽"。每种脱掩蔽的酶都有自己的最佳条件(缓冲液、盐、辅因子、温度)。选择包括洗涤步骤、改变载玻片上存在的溶液或试剂的ph、添加辅因子或温度变化(例如约37℃至约50℃范围内的温度)的步骤中任一个的"脱掩蔽步骤"增强酶的活性并促进"脱掩蔽",而不干扰抗体缀合物的特异性结合。例如,并且在ap的情况下,使用洗涤除去残留的抑制剂(例如磷酸盐),还使用缓冲剂增加活性(例如tris,调节ph至大于约8),和添加辅因子(例如镁)。在一些实施方案中,这些条件中的每一个都在整个测定的情况下被优化,例如ap的活性通过添加浓度为1mm至1m的镁离子而得到增强。然而,在镁离子的浓度大于100mm时,抗体结合受到影响,所以这限制了可添加的量。可优化步骤的另一实例是"脱掩蔽"步骤的温度。酶解步骤之后的"脱掩蔽"事件由热力学驱动,并且可通过加热来加速。然而,温度高于60℃可对酶活性和抗体缀合物结合均产生负面影响。
另一方面,如图3所示,如果第一靶标101不足以邻近第二靶标102,则经掩蔽的半抗原-抗体缀合物103a将不会被提供在暴露酶-抗体缀合物104邻近处(邻近处标记为108)。在这种情况下,暴露酶不会与经掩蔽的半抗原-抗体缀合物103a的酶底物反应,因此经掩蔽的半抗原将仍处于被掩饰或受保护的状态,即不能被其他特定结合实体结合或被其识别。
参考图2、4和12,在一些实施方案中,然后样品在步骤120与第一检测试剂(106)接触,第一检测试剂对第一靶标未掩饰半抗原-抗体缀合物复合物的未掩饰半抗原(103b)具有特异性。在一些实施方案中,所述第一检测试剂包含对未掩饰半抗原(103b)具有特异性的二级抗体(106),即抗-未掩饰半抗原抗体。在一些实施方案中,抗-未掩饰的半抗原抗体(106)与可检测部分(例如在图2和12中,可检测部分是hrp酶,其中hrp酶作用于底物诸如银生色底物(111))缀合。当然,本领域技术人员应当理解,如果第一靶标未被掩饰的半抗原-抗体缀合物复合物的天然或未掩饰半抗原(103b)由暴露酶-抗体缀合物(104)的暴露酶揭露。因此,如果第一和第二靶标(101和102)以及因此抗体缀合物(103a和104)彼此极为邻近,则仅在第一步骤140检测到来自第一检测试剂(106)的可检测部分的信号(107)。在本申请中,检测到的信号(107)代表极为邻近的蛋白质二聚体或蛋白质/靶标。
在一些实施方案中,可进行扩增步骤以增加可检测信号。例如,可引入扩增组分来进一步标记第一靶标未掩饰的半抗原-抗体缀合物的未掩饰半抗原与额外的报告蛋白部分,例如额外的半抗原或其他"可检测部分"。举例而言,可引入与扩增半抗原缀合的(或其他实施方案中,与酶缀合的)抗-未掩饰半抗原抗体以使用多个扩增半抗原标记第一靶标未掩饰半抗原-抗体缀合物的未掩饰半抗原。随后,可引入各自与可检测部分缀合的抗-扩增半抗原抗体。在一些实施方案中,抗-扩增半抗原抗体与酶缀合,其中酶作用于引入的底物以产生信号(例如生色底物或荧光底物以产生视觉信号)。本申请所述的每种tsa和qm缀合物均可用于任何扩增步骤。在一些实例中,使用optiview扩增试剂盒(ventanamedicalsystems,inc.,tucson,ariz.,catalogno.760-099)进行信号扩增。
本领域技术人员将会理解,暴露酶-抗体缀合物的暴露酶可起到两种作用,即(i)暴露或揭示经掩蔽的半抗原;和(ii)与另一种底物反应(例如生色底物或荧光底物),使得可检测到与未掩饰半抗原(即未掩饰半抗原-抗体缀合物复合物)产生的信号无关的信号。因此,目前公开的系统允许两种蛋白质之间的邻近性在蛋白质之一的总蛋白质染色的背景下可视化。不希望受任何特定理论的束缚,据信在另一种蛋白质染色的背景中复用邻近性检测的能力是允许具有快速、引导的载玻片读取的可能性的特征(即,仅查找总蛋白质内的邻近信号)或定量与另一蛋白质相互作用的蛋白质百分比的能力(对邻近性测定打分的方法)。
再次参照图2、4和12,在引入第一检测试剂(106)之后,可任选地在步骤130中将包括第二可检测部分(109)的第二检测试剂引入到样品中,使得可检测到总蛋白质。在一些实施方案中,第二可检测部分提供不同于第一可检测部分(107)的信号(112)。在一些实施方案中,第二可检测部分包含暴露酶的底物,例如提供黄色信号的生色底物(109)。在其他实施方案中,第二可检测部分包含信号传导缀合物。本领域技术人员还将认识到,步骤120和130可以任何顺序进行或可同时进行。
在一些实施方案中,用酶失活组合物预处理生物样品以使内源性过氧化物酶活性基本上或完全失活。例如,一些细胞或组织含有内源性过氧化物酶。使用hrp缀合的抗体可导致高的非特异性背景染色。通过用本申请公开的酶失活组合物对样品进行预处理,可减少这种非特异性背景。在一些实施方案中,仅用过氧化氢预处理样品(约1重量%至约3重量%适当预处理溶液)以降低内源性过氧化物酶活性。一旦内源性过氧化物酶活性降低或失活,可添加检测试剂盒,随后如上所述使存在于检测试剂盒中的酶失活。所公开的酶失活组合物和方法也可用作使内源酶过氧化物酶活性失活的方法。
在一些实施方案中,如果标本是包埋于石蜡中的样品,则可使用适当的脱石蜡流体将样本脱石蜡。在废物去除器去除脱石蜡流体后,可将任何数量的物质连续施加到标本上。所述物质可用于预处理(例如蛋白质交联、暴露核酸等)、变性、杂交、洗涤(例如严格洗涤)、检测(例如使视觉或标志物分子与探针连接)、扩增(例如扩增蛋白质、基因等)、复染、盖玻片等。
自动化
本申请的测定和方法可为自动化的并且可与标本加工设备组合。标本加工设备可以是自动化设备,诸如由ventanamedicalsystems,inc.销售的benchmarkxt仪器和symphony仪器。ventanamedicalsystems,inc.是许多公开了用于进行自动化分析的系统和方法的美国专利的受让方,包括第5,650,327、5,654,200、6,296,809、6,352,861、6,827,901和6,943,029号美国专利,以及第20030211630和20040052685号美国公开专利申请,其中每个通过引用整体并入本申请。或者,可手动加工标本。
标本加工设备可将固定剂应用于标本。固定剂可包括交联剂(诸如醛,例如甲醛、多聚甲醛和戊二醛,以及非醛交联剂)、氧化剂(例如金属离子和络合物,诸如四氧化锇和铬酸)、蛋白质变性剂(例如乙酸、甲醇和乙醇)、未知机制的固定剂(例如氯化汞、丙酮和苦味酸)、组合试剂(例如carnoy固定剂、methacarn、bouin流体、b5固定剂、rossman流体和gendre流体)、微波和其他固定剂(例如排除体积固定和蒸气固定)。
如果标本是包埋于石蜡中的样品,则可使用适当的脱石蜡流体以标本处理设备将样本脱石蜡。在废物去除器去除脱石蜡流体后,可将任何数量的物质连续施加到标本上。所述物质可用于预处理(例如蛋白质交联、暴露核酸等)、变性、杂交、洗涤(例如严格洗涤)、检测(例如使视觉或标志物分子与探针连接)、扩增(例如扩增蛋白质、基因等)、复染、盖玻片等。
标本处理设备可将大范围的物质应用于标本。这些物质包括但不限于染色剂、探针、试剂、漂洗剂和/或调理剂。这些物质可以是流体(例如,气体、液体或气体/液体混合物)等。流体可以是溶剂(例如极性溶剂、非极性溶剂等),溶液(例如水溶液或其他类型的溶液)等。试剂可包括但不限于染色剂、润湿剂、抗体(例如单克隆抗体、多克隆抗体等)、抗原回收流体(例如水基或非水基抗原修复溶液、抗原回收缓冲液等)等。探针可以是分离的核酸或分离的合成寡核苷酸,其与可检测标记连接。标记可包括放射性同位素、酶底物、辅因子、配体、化学发光或荧光剂、半抗原和酶。
在加工标本之后,用户可将带有标本的载玻片运送到成像设备。本申请使用的成像设备是明视野成像仪载玻片扫描仪。一个明视野成像仪是由ventanamedicalsystems,inc.销售的iscancoreotm明视野扫描仪。在自动化实施方案中,成像设备是标题为"imagingsystemandtechniques"的第pct/us2010/002772号国际专利申请(第wo/2011/049608号专利公开)所公开或2014年2月3日提交的标题为"imagingsystems,cassettes,andmethodsofusingthesame"的第2014/0178169号美国专利申请所公开的数码病理学装置。第pct/us2010/002772号国际专利申请和第2014/0178169号美国专利申请公开通过引用以其实体并入。在其他实施方案中,所述成像设备包括与显微镜偶联的数码相机。
复染
复染是在样品已经被染色剂染色后对样品进行后处理以检测一个或多个靶标的方法,使得其结构可在显微镜下更容易地可视化。例如,在盖玻片之前任选使用复染剂以使免疫组织化学染色更明显。复染剂与原染色剂颜色不同。许多复染剂是公知的,诸如苏木精、曙红、甲基绿、亚甲蓝、giemsa、阿尔新蓝和核坚牢红。dapi(4',6-二脒基-2-苯基吲哚)是可以使用的荧光染料。
在一些实例中,可将多于一种染色剂混合在一起以产生复染剂。这提供了灵活性和选择染色剂的能力。例如,可为具有特定属性但尚未具有不同期望属性的混合物选择第一染色剂。第二染色剂可添加到混合物,其表现出缺少的期望属性。例如,可将甲苯胺蓝、dapi和滂胺天蓝混合在一起形成复染剂。
检测和/或成像
所公开的实施方案的某些方面或全部可以是自动化的,并且通过计算机分析和/或图像分析系统来促进。在一些应用中,测量精确的颜色或荧光比率。在一些实施方案中,利用光学显微镜进行图像分析。某些公开的实施方案涉及获取数码图像。这可通过使数码相机与显微镜偶联来完成。使用图像分析软件分析获得的染色样品的数码图像。可用几种不同的方式测量颜色或荧光。例如,颜色可被测量为红色、蓝色和绿色值;色调、饱和度和强度值;和/或通过使用光谱成像相机测量特定波长或波长范围。样品也可定性和半定量评价。定性评估包括评估染色强度、鉴定阳性染色细胞和参与染色的细胞内区室,和评价总体样品或载玻片质量。对测试样品进行单独的评价,并且该分析可包括与已知平均值的比较,以确定样品是否表示异常状态。
试剂盒
在一些实施方案中,本申请的经掩蔽的半抗原缀合物可用作"检测试剂盒"的一部分。通常,任何检测试剂盒可包含一种或多种经掩蔽的半抗原缀合物和用于检测一种或多种经掩蔽的半抗原缀合物的检测试剂。
检测试剂盒可包含含有经掩蔽的半抗原缀合物的第一组合物和含有对第一组合物具有特异性的检测试剂的第二组合物,使得可经检测试剂盒检测经掩蔽的半抗原缀合物。在一些实施方案中,检测试剂盒包含多个经掩蔽的半抗原缀合物(诸如在缓冲液中混合在一起),其中检测试剂盒还包含对多个经掩蔽的半抗原偶联物中的每一种具有特异性的检测试剂。
当然,根据进行手动或自动靶标检测的需要,任意试剂盒可包含其他试剂,包括缓冲剂;复染剂;酶失活组合物;脱石蜡溶液等。试剂盒还可包含使用试剂盒的任何组分的说明书,包括将试剂盒组分应用于组织样品以实现检测其中一个或多个靶标的方法。
样品和靶标
样品包括生物组分,并且通常怀疑包括一种或多种感兴趣的靶标分子。靶标分子可在细胞的表面上,并且细胞可在混悬液中,或在组织切片中。靶标分子也可以是细胞内的,并且在细胞裂解或探针穿透细胞时检测。本领域的普通技术人员将会理解,检测样品中的靶标分子的方法将根据所使用的样品和探针的类型而变化。收集和制备样品的方法是本领域已知的。
可使用本领域普通技术人员在本领域中已知的任何方法制备用于本申请公开的方法和组合物的样品,诸如组织或其他生物样品。样品可获自常规筛查的受试者或疑似患有诸如遗传异常、感染或瘤形成的病症的受试者。所公开的方法的所描述的实施方案也可应用于不具有遗传异常、疾病、病症等的被称为"正常"样品的样品。除了其他方面,这样的正常样品可用作与其他样品比较的对照。可出于许多不同目的分析样品。例如,样品可用于科学研究或用于疑似疾病的诊断,或作为治疗成功、存活等的预后指标。
样品可包括可被探针或报道蛋白分子特异性结合的多个靶标。靶标可以是核酸序列或蛋白质。贯穿本申请,当提及靶标蛋白质时,应当理解,与该蛋白质相关的核酸序列也可用作靶标。在一些实例中,靶标是来自病原体诸如病毒、细菌或细胞内寄生虫的蛋白质或核酸分子,诸如来自病毒基因组。例如,可从与疾病有关的靶标核酸序列(例如与之相关、因果牵连等)产生靶标蛋白质。
靶标核酸序列的大小可变化很大。不受限制,核酸序列可具有可变数目的核酸残基。例如,靶核酸序列可具有至少约10个核酸残基,或至少约20、30、50、100、150、500、1000个残基。类似地,靶标多肽的大小可变化很大。不受限制,靶标多肽将包含至少一个结合肽特异性抗体或其片段的表位。在一些实施方案中,该多肽可包含至少两个结合肽特异性抗体或其片段的表位。
在具体的非限制性实例中,靶标蛋白由与赘生物(例如癌症)相关的靶标核酸序列(例如,基因组靶核酸序列)产生。在赘生性细胞中,尤其是在癌细胞,诸如b细胞和t细胞白血病、淋巴瘤、乳腺癌、结肠癌、神经癌等中,已经鉴定了许多染色体异常(包括易位和其他重排、扩增或缺失)。因此,在一些实例中,靶标分子的至少一部分由在样品中细胞的至少一个亚群中扩增或缺失的核酸序列(例如,基因组靶标核酸序列)产生。
已知癌基因负责几种人类恶性肿瘤。例如,涉及位于染色体18q11.2的断点区域的syt基因的染色体重排在滑膜肉瘤软组织肿瘤中是常见的。例如,可使用具有不同标记的探针来鉴定t(18q11.2)易位:第一探针包括由从syt基因向远侧延伸的靶标核酸序列产生的fpc核酸分子,并且第二探针包括从延伸3'或靠近syt基因的靶标核酸序列产生的fpc核酸。当在原位杂交程序中使用对应于这些靶标核酸序列(例如,基因组靶标核酸序列)的探针时,在syt基因区缺乏(18q11.2)的正常细胞表现出两种融合(由极为邻近的两个标记产生)信号,反映syt的两个完整副本。具有t(18q11.2)的异常细胞表现出单一融合信号。
在其他实例中,选择由核酸序列(例如,基因组靶标核酸序列)产生的靶标蛋白质,其是在恶性细胞中缺失(丢失)的肿瘤抑制基因。例如,位于染色体9p21上的p16区(包括d9s1749、d9s1747、p16(ink4a)、p14(arf)、d9s1748、p15(ink4b)和d9s1752)在某些膀胱癌中缺失。涉及染色体1(包括例如shgc57243、tp73、egfl3、abl2、angptl1和shgc-1322)的短臂的远端区域以及染色体19(包括例如man2b1、znf443、znf44、crx、gltscr2和gltscr1)的中心体周围区域(例如19p13-19q13)的染色体缺失是中枢神经系统某些类型的实体瘤的特征性分子特征。
提供前述实例仅用于说明的目的,而不是限制性的。与赘生性转化和/或生长相关的许多其他细胞遗传学异常是本领域普通技术人员已知的。已经与赘生性转化相关并且可用于所公开的方法中的由核酸序列产生的靶标蛋白(例如,基因组靶标核酸序列),还包括egfr基因(7p12;例如genbanktm登录号nc—000007,核苷酸55054219-55242525)、c-myc基因(8q24.21;例如genbanktm登录号nc—000008,核苷酸128817498-128822856)、d5s271(5p15.2)、脂蛋白脂肪酶(lpl)基因(8p22;例如genbanktm登录号nc—000008,核苷酸19841058-19869049)、rb1(13q14;例如genbanktm登录号nc—000013,核苷酸47775912-47954023)、p53(17p13.1;例如genbanktm登录号nc—000017,补充,核苷酸7512464-7531642))、n-myc(2p24;例如genbanktm登录号nc—000002,补充,核苷酸151835231-151854620)、chop(12q13;例如genbanktm登录号nc—000012,补充,核苷酸56196638-56200567)、fus(16p11.2;例如genbanktm登录号nc—000016,核苷酸31098954-31110601)、fkhr(13p14;例如genbanktm登录号nc—000013,补充,核苷酸40027817-40138734),以及例如:alk(2p23;例如genbanktm登录号nc—000002,补充,核苷酸29269144-29997936)、ig重链,ccnd1(11q13;例如genbanktm登录号nc—000011,核苷酸69165054.69178423)、bcl2(18q21.3;例如genbanktm登录号nc—000018,补充,核苷酸58941559-59137593)、bcl6(3q27;例如genbanktm登录号nc—000003,补充,核苷酸188921859-188946169)、malf1,ap1(1p32-p31;例如genbanktm登录号nc—000001,补充,核苷酸59019051-59022373)、top2a(17q21-q22;例如genbanktm登录号nc—000017,补充,核苷酸35798321-35827695)、tmprss(21q22.3;例如genbanktm登录号nc—000021,补充,核苷酸41758351-41801948)、erg(21q22.3;例如genbanktm登录号nc—000021,补充,核苷酸38675671-38955488);etv1(7p21.3;例如genbanktm登录号nc—000007,补充,核苷酸13897379-13995289)、ews(22q12.2;例如genbanktm登录号nc—000022,核苷酸27994271-28026505);fli1(11q24.1-q24.3;例如genbanktm登录号nc—000011,核苷酸128069199-128187521)、pax3(2q35-q37;例如genbanktm登录号nc—000002,补充,核苷酸222772851-222871944)、pax7(1p36.2-p36.12;例如genbanktm登录号nc—000001,核苷酸18830087-18935219)、pten(10q23.3;例如genbanktm登录号nc—000010,核苷酸89613175-89716382)、akt2(19q13.1-q13.2;例如genbanktm登录号nc—000019,补充,核苷酸45431556-45483036)、mycl1(1p34.2;例如genbanktm登录号nc—000001,补充,核苷酸40133685-40140274)、rel(2p13-p12;例如genbanktm登录号nc—000002,核苷酸60962256-61003682)和csf1r(5q33-q35;例如genbanktm登录号nc—000005,补充,核苷酸149413051-149473128)。
在其他实例中,靶标蛋白选自与疾病或病症相关的病毒或其他微生物。细胞或组织样品中病毒或微生物来源的靶标核酸序列(例如,基因组靶标核酸序列)的检测指示有机体的存在。例如,靶标肽、多肽或蛋白质可选自致癌或致病病毒、细菌或细胞内寄生虫(诸如恶性疟原虫(plasmodiumfalciparum)和其他疟原虫种,利什曼原虫(种)(leishmania(sp.))、隐孢子虫(cryptosporidiumparvum)、溶组织内阿米巴(entamoebahistolytica)和蓝氏贾第鞭毛虫(giardialamblia),以及弓形虫(toxoplasma)、艾美球虫(eimeria)、泰勒虫(theileria)和巴贝细虫(babesia)种)。
在一些实例中,靶标蛋白由来自病毒基因组的核酸序列(例如,基因组靶标核酸序列)产生。示例性的病毒和相应的基因组序列(genbanktm括号中的参考序列登录号)包括人腺病毒a(nc—001460)、人腺病毒b(nc—004001)、人腺病毒c(nc—001405)、人腺病毒d(nc—002067)、人腺病毒e(nc—003266)、人腺病毒f(nc—001454)、人星状病毒(nc—001943)、人bk多瘤病毒(v01109;gi:60851)、人博卡病毒(nc—007455)、人冠状病毒229e(nc—002645)、人冠状病毒hku1(nc—006577)、人冠状病毒nl63(nc—005831)、人冠状病毒oc43(nc—005147)、人肠道病毒a(nc—001612)、人肠道病毒b(nc—001472)、人肠道病毒c(nc—001428)、人肠道病毒d(nc—001430)、人红病毒v9(nc—004295)、人泡沫病毒(nc—001736)、人疱疹病毒1(单纯疱疹病毒1型)(nc—001806)、人疱疹病毒2(单纯疱疹病毒2型)(nc—001798)、人疱疹病毒3(水痘带状疱疹病毒)(nc—001348)、人疱疹病毒41型(巴尔病毒1型)(nc—007605)、人疱疹病毒42型(巴尔病毒2型)(nc—009334)、人疱疹病毒5ad169株(nc—001347)、人疱疹病毒5merlin株(nc—006273)、人疱疹病毒6a(nc—001664)、人疱疹病毒6b(nc—000898)、人疱疹病毒7(nc—001716)、人疱疹病毒8m型(nc—003409)、人疱疹病毒8p型(nc—009333)、人免疫缺陷病毒1(nc—001802)、人免疫缺陷病毒2(nc—001722)、人偏肺病毒(nc—004148)、人乳头瘤病毒-1(nc—001356)、人乳头瘤病毒-18(nc—001357)、人乳头瘤病毒-2(nc—001352)、人乳头瘤病毒-54(nc—001676)、人乳头瘤病毒-61(nc—001694)、人乳头瘤病毒-cand90(nc—004104)、人乳头瘤病毒rtrx7(nc—004761)、人乳头瘤病毒10型(nc—001576)、人乳头瘤病毒101型(nc—008189)、人乳头瘤病毒103型(nc—008188)、人乳头瘤病毒107型(nc—009239)、人乳头瘤病毒16型(nc—001526)、人乳头瘤病毒24型(nc—001683)、人乳头瘤病毒26型(nc—001583)、人乳头瘤病毒32型(nc—001586)、人乳头瘤病毒34型(nc—001587)、人乳头瘤病毒4型(nc—001457)、人乳头瘤病毒41型(nc—001354)、人乳头瘤病毒48型(nc—001690)、人乳头瘤病毒49型(nc—001591)、人乳头瘤病毒5型(nc—001531)、人乳头瘤病毒50型(nc—001691)、人乳头瘤病毒53型(nc—001593)、人乳头瘤病毒60型(nc—001693)、人乳头瘤病毒63型(nc—001458)、人乳头瘤病毒6b型(nc—001355)、人乳头瘤病毒7型(nc—001595)、人乳头瘤病毒71型(nc—002644)、人乳头瘤病毒9型(nc—001596)、人乳头瘤病毒92型(nc—004500)、人乳头瘤病毒96型(nc—005134)、人副流感病毒1(nc—003461)、人副流感病毒2(nc—003443)、人副流感病毒3(nc—001796)、人副肠弧病毒(nc—001897)、人细小病毒4(nc—007018)、人细小病毒b19(nc—000883)、人呼吸道合胞体病毒(nc—001781)、人鼻病毒a(nc—001617)、人鼻病毒b(nc—001490)、人泡沫逆转录病毒(nc—001795)、人嗜t淋巴细胞病毒1(nc—001436)、人嗜t淋巴细胞病毒2(nc—001488)。
在某些实例中,靶标蛋白由来自致癌病毒诸如eb病毒(ebv)或人乳头瘤病毒(hpv,例如hpv16、hpv18)的核酸序列(例如,基因组靶标核酸序列)产生。在其他实例中,由核酸序列(例如,基因组靶标核酸序列)产生的靶标蛋白来自病原性病毒,诸如呼吸道合胞体病毒、肝炎病毒(例如丙型肝炎病毒)、冠状病毒(例如sars病毒)、腺病毒、多瘤病毒、巨细胞病毒(cmv)或单纯疱疹病毒(hsv)。
实施例
实施例1-[4-({[3-({2-[3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰胺基]乙基}氨甲酰基)喹喔啉-2-基]氧基}甲基)-3,5-二甲氧基苯氧基]膦酸的合成(参见方案1)。
用可被碱性磷酸酶(ap)释放的掩蔽基团修饰2-羟基喹喔啉(hq)半抗原,即包含磷酸酶底物部分的掩蔽基团。用经掩蔽的半抗原(chq)或ap分别标记二级抗物种抗体(山羊-抗-兔抗体和山羊-抗-小鼠抗体)。因此,可测试任何一对兔和小鼠一级抗体以确定它们彼此邻近。根据以下阐述的方法并且如方案1中所述合成掩蔽hq,所述方法1说明用于缀合抗体(chq-mal)的具有马来酰亚胺(mal)反应性基团的掩蔽hq的制备。
方案3:[4-({[3-({2-[3-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)丙酰胺基]乙基}氨甲酰基)喹喔啉-2-基]氧基}甲基)-3,5-二甲氧基苯氧基]膦酸的合成
化合物2.将2,6-二甲氧基-4-羟基苯甲醛5.00g,27.4mmol)和三乙胺(4.17g,5.74ml,41.2mmol)于etoac(25ml)中的溶液在冰浴中伴随搅拌冷却至0℃。然后历时5分钟逐滴添加氯代磷酸二乙酯(4.73g,27.4mmol)。使反应物温热至室温,接着在室温("rt")搅拌约6小时(检查hplc确认反应大于约90%完成)。通过添加1mhcl(100ml)淬灭反应混合物,分离并收集有机层。再添加一定量的etoac(100ml),用1mhcl(2x100ml),饱和nahco3(3x100ml)和盐水(100ml)萃取有机物。有机层以mgso4干燥,减压除去溶剂,得到化合物2,为浅棕色粘稠油状物(7.95g,91%产率)。
化合物3.将化合物2(7.95g,25.0mmol)于thf(约100ml)中的溶液在冰浴中伴随搅拌冷却至约0℃。用研钵和研杵将nabh4(1.42g,37.5mmol)粉碎成细粉,分批添加,接着在室温搅拌约4小时(检查hplc以确认反应完成)。通过添加1mhcl小心地淬灭反应混合物直至鼓泡停止。然后在减压下除去大部分thf。所得反应混合物用etoac(3x100ml)萃取。收集有机层且合并,随后用盐水(约100ml)洗涤并以mgso4干燥。然后减压除去溶剂。将所得浅棕色粘稠油状物溶于无水ch2cl2(约50ml),然后在n2气氛下伴随搅拌在冰浴中冷却至约0℃。然后历时约5分钟的时间逐滴添加socl2(4.46g,2.72ml,37.5mmol)。使反应混合物温热至室温,随后在室温再搅拌1小时(检查hplc以确认反应完成)。通过添加饱和的nahco3小心淬灭反应混合物直至鼓泡停止。所得反应混合物用ch2cl2(3x100ml)萃取。收集有机层且合并,接着用盐水(100ml)洗涤并以mgso4干燥。然后减压除去溶剂,得到化合物3,为灰白色低熔点固体(7.54g,89%产率)。
化合物5.将3-羟基-2-喹喔啉羧酸(3.00g,15.8mmol)溶于dmf(50ml),然后添加4-二甲基氨基吡啶(2.12g,17.4mmol)。在室温搅拌反应混合物直至4-二甲基氨基吡啶溶解,此时添加n,n'-二琥珀酰亚胺基碳酸酯(4.45g,17.4mmol)。将反应混合物在室温搅拌30分钟(检查hplc以确认反应完成。如果反应没有完成,则另外添加0.1当量部分的dsc直至hplc显示完全转化)。然后添加n-boc-乙二胺(3.04g,19.0mmol)和三乙胺(2.40g,3.30ml,23.7mmol)于dmf(10ml)中的溶液,并将反应在室温搅拌1小时(检查hplc反应完成)。然后将反应混合物倒入剧烈搅拌的1mhcl(250ml)的溶液中。通过真空过滤收集所得沉淀,用水洗涤几次,并在高真空下干燥,得到化合物5,为黄色固体(5.10g,97%产率)。
化合物6.将化合物5(2.50g,7.52mmol)溶于dmf(50ml),接着添加化合物3(3.82g,11.3mmol)和k2co3(5.20g,37.6mmol)。将反应容器密封并在剧烈搅拌下在油浴中加热至55℃且保持2小时(检查hplc以确认反应完成。如果反应未完成,则另外加入0.1当量部分的化合物3直至hplc显示化合物5完全消耗)。过滤反应混合物并通过添加1mhcl小心淬灭滤液直至鼓泡停止。所得反应混合物用etoac(3x100ml)萃取。收集有机层且合并,然后用盐水(100ml)洗涤并以mgso4干燥。然后减压除去溶剂,得到淡黄色粘稠油状物。通过快速色谱法(biotagesnap50;hex:ea1:0至1:4)纯化所得残余物,得到化合物6,为淡黄色固体(3.15g,66%产率)。
化合物7.将化合物6(3.15g,4.96mmol)溶于无水ch2cl2(25ml),然后历时5分钟逐滴添加三甲基溴硅烷(3.80g,3.28ml,24.8mmol)。将容器密封并将反应混合物在室温搅拌16小时(检查hplc以确认反应完成)。然后条件meoh(25ml),减压除去溶剂。将所得固体用ch2cl2(100ml)研磨并通过真空过滤收集所得固体,得到化合物7,为浅黄色固体(2.06,87%产率)。
化合物8.化合物7(2.06g,4.31mmol)混悬于dmf(10ml),接着添加三乙胺(654mg,900μl,6.46mmol),最后添加3-马来酰亚胺基丙酸nhs酯(1.15g,4.31mmol)。将反应容器密封,并将反应混合物在室温剧烈搅拌约4小时(检查hplc以确认反应完成)。然后将反应混合物用meoh(10ml)稀释并通过制备型rp-hplc(0.05%tfa/h2o:mecn99:1至5:95历时40分钟)以5份直接纯化,得到化合物8,为淡黄色固体(1.95g,72%产率)。
马来酰亚胺官能化的hq(chq-mal)通过两种方法经由二硫化物或赖氨酸基团缀合至山羊-抗-兔和山羊-抗-小鼠igg抗体。在二硫键方法中,igg通过二硫苏糖醇(dtt)还原,然后用过量的chq-mal处理。对于赖氨酸方法,在添加过量的chq-mal之前,用过量的traut试剂(2-亚氨基硫代环戊烷盐酸盐)处理igg。在两种情况下,通过尺寸排阻色谱(sec)纯化缀合物,并通过凝胶电泳和uv-vis光谱表征。
实施例2-确认掩蔽基团的阻断
为了确认实施例1的经掩蔽的半抗原-抗体缀合物的掩蔽基团阻断抗半抗原抗体与相应的天然(即未掩饰的)半抗原的结合,用单一ihc检测测试chq缀合物。图5图示说明了ihc染色方案,其中用与chq缀合的二级抗体检测单个抗原(114),即chq经掩蔽的半抗原-抗体缀合物(103a)。在引入chq经掩蔽的半抗原-抗体缀合物(103a)之后,引入ap酶(即游离未缀合的ap)(113)以暴露经掩蔽的半抗原-抗体缀合物的半抗原。所得未掩饰半抗原(103b)能够被抗半抗原抗体(115)识别。在一些实施方案中,抗半抗原抗体(115)与一种或多种酶缀合(图5说明与3种hrp酶的缀合)。
参照图6a-6c,小鼠-抗-psa在前列腺组织上与其靶标表位结合并随后通过与chq缀合的山羊-抗-小鼠(gam-chq)结合。使用与未掩蔽的hq缀合的山羊-抗-小鼠(gam-hq)产生对照载玻片(例如图6c)。系列部分暴露于两种不同的添加,即(i)具有游离(未缀合)的ap、ph调节缓冲液和ap辅因子(镁盐)的溶液;和(ii)不含ap,但是具有ph调节缓冲液和ap辅因子(镁盐)的溶液。图6a图示说明用包含ap的溶液处理的组织;而图6b图示说明未处理的组织,即不含ap的溶液。图6c图示说明具有用未掩蔽hq标记的二级抗体的对照载玻片。在有利于酶的条件下用ap处理的样品组织有机会使经掩蔽的半抗原发生暴露(图6a)。阴性样本组织(无ap)没有受控暴露发生的机会(图6b)。这些图清楚地表明用gam-chq处理但未暴露于ap的载玻片未显示阳性染色(图6b)。然而,具有gam-chq和ap两者的载玻片显示阳性染色(图6a),并且与非掩蔽对照载玻片匹配(图6c)。这测试了掩蔽基团的有效性及其对测定条件的稳定性。
实施例3-测量蛋白质邻近性
研究了许多已知的阳性和假定的阴性系统以测试所公开的缀合物能够测量蛋白质邻近性的能力。因为生物学决定这些蛋白在正常细胞中彼此紧密接触,所以选择e-钙粘蛋白和β-连环蛋白作为已知的阳性系统。选择her2/β-连环蛋白和egfr/β-连环蛋白作为处于相同细胞区室(共定位)但不预期彼此相互作用(不是近端)的蛋白质对,因此在任何邻近测定中不应产生信号。还选择抗体对,以便有一个兔一级抗体和一个小鼠一级抗体,以允许使用抗物种二级检测。
参照图1、2和12中概述的方案,在引入第一抗体(例如与半抗原缀合的抗体、经掩蔽的半抗原-抗体缀合物和暴露酶-抗体缀合物)和第二抗体(例如与酶缀合的抗-半抗原抗体),以及随后暴露经掩蔽的半抗原之后,用与辣根过氧化物酶(hrp)缀合的小鼠-抗-hq检测未掩蔽的hq。此时,dab(3,3'-二氨基联苯胺)、银或酪胺-色原可用于可视化邻近信号。还可包括hrp/酪胺-半抗原扩增步骤以提高系统的强度(灵敏度)(例如基于酪胺-hq的optiview扩增试剂盒)。
使用自动经掩蔽的半抗原邻近测定法的一般程序来测试ffpe病例:使用discoveryezprep(ventana,p/n950-100)或discoverywash(ventana,p/n950-510)的脱石蜡溶液将载玻片脱蜡。使用discoverycc1(ventana,p/n950-124)在95℃在载玻片上进行热诱导的表位恢复一段时间,该时间取决于两种一级抗体(0-92分钟)的同一性(identity)。然后将discovery抑制剂(ventana,p/n760-4840)应用于载玻片以淬灭样品中的任何内源性过氧化物酶。将兔抗靶标1抗体与小鼠抗靶标2抗体在37℃共温育16-32分钟(取决于一级抗体的同一性)。然后将30μg/ml山羊抗-小鼠碱性磷酸酶缀合物施加到载玻片上并温育12分钟。漂洗载玻片,并将20μg/ml经掩蔽的半抗原山羊抗-兔缀合物的溶液施用于载玻片16分钟。温育后,将500mmtris缓冲液ph10.0和490mmmgcl2溶液施加到载玻片上以使经掩蔽的半抗原脱掩蔽。使hq脱掩蔽后,将小鼠-抗-hqhrp(ventana,p/n760-4820)缀合物施加到载玻片上以结合未掩蔽的hq。在某些情况下,amphq酪胺扩增试剂盒(ventana,p/n760-052)用于帮助提高信号强度。使用chromomapdab试剂盒(ventana,p/n760-159)观察邻近蛋白质,接着用苏木精ii(ventana,p/n790-2208)和bluing试剂(ventana,p/n760-2037)进行复染。
图7a-7c图示说明该实验的结果,并且图示说明具有正邻近性的蛋白质的实例。图7a图示说明用于β-连环蛋白的单一ihcdab染色(例如利用包含对β-连环蛋白具有特异性的抗体、与酶缀合的抗物种抗体和dab的检测技术)。图7b图示说明β-连环蛋白和e-钙粘蛋白的经掩蔽的半抗原邻近信号(利用经暴露酶-抗体缀合物起作用的经掩蔽的半抗原-抗体缀合物)。图7c图示说明用于e-钙粘蛋白的单一ihcdab染色(例如利用包含对e-钙粘蛋白具有特异性的抗体、与酶缀合的抗物种抗体和dab的检测技术)。
图8a-8c图示说明ihcdab染色的结果,并且图示说明用本申请所述的缀合物和方法检测到的不具邻近性的共定位蛋白质的实例。图8a图示说明egfr的单一ihcdab染色;图8b图示说明不存在egfr和e-钙粘蛋白的经掩蔽的半抗原接近信号;和图8c图示说明e-钙粘蛋白的单一ihcdab染色。
另外,图9a和9b图示说明在不同组织类型上具有和不具有邻近性的共定位蛋白质的实例。在本申请中,图9a图示说明β-连环蛋白和e-钙粘蛋白的阳性经掩蔽的半抗原邻近信号,而图9b图示说明β-连环蛋白和her2缺乏经掩蔽的半抗原邻近信号。这些实例图示说明该测定适用于不同的组织类型,但产生相同类型的结果。
从上述测定中输出的信号强度可以多种方式"拨入(dialed-in)"。市场上的信号扩增的使用容易应用于本申请公开的技术,并且据信易于增强信号(参见例如第2012/0171668号美国公开和pct/ep2015/0533556中所述的扩增技术,其公开内容在此通过引用并入本申请)。
如图图10a和10b中所示,与二级抗体缀合的经掩蔽的半抗原的数目也允许调整测定的灵敏度以适合给定系统。在该实例中,图10a图示说明用山羊-抗-兔和4(4)个chq标记进行标记的样品,而图10b图示说明用山羊-抗-兔和9(9)个chq标记进行标记的样品。在本申请中,信号强度的相对增加是基于与二级抗体缀合的经掩蔽的半抗原的数目增加,其中图10b清楚显示了与图10a相比染色强度的增加。
实施例4-用不同的hrp系统进行检测
测试了提供不同可检测信号(例如颜色)的不同hrp系统。例如,图11a和11b图示说明用银(11a)和酪胺-tamra(11b)检测。两个系统均能够检测样品中的邻近蛋白质靶标。
实施例5-总蛋白和邻近蛋白信号的多重检测
图12是说明一种总蛋白(靶2,ap-yellow)和邻近蛋白信号(靶标1+靶标2,hrp-银)的多重检测的示意图。可使用任何类型的hrp检测系统来显示邻近信号,并且可使用任何ap检测系统(例如萘酚磷酸盐/坚牢红、bcip/nbt,醌甲基化物(qm)-色原)来可视化总蛋白质。
还展示了利用hrp-dab(图13a)和hrp-银及添加用于其中一个靶点的总蛋白质染色剂检测邻近蛋白质(图13b)。这些实验用扁桃体组织上的e-钙粘蛋白和β-连环蛋白进行。另外,利用e-钙粘蛋白和β--连环蛋白双染色,图14a和14b图示说明使用不同的hrp检测系统来显现邻近信号以及总蛋白。图14a图示说明用hrp-purple检测到的接近性和用ap-yellow检测到的β-连环蛋白,而图13b图示说明用hrp-银检测到的接近性和用ap-yellow检测到的β-连环蛋白。
实施例6-pd1/pd-l1
配体pd-l1与其受体pd-1的结合调节t细胞的活化或抑制。肿瘤细胞可使用这种相互作用来逃避免疫系统。pd-l1/pd-1复合物的检测可提供比单独测量任一种蛋白质更好的肿瘤内免疫检查点的阻断状态的指示。
图16图示说明在nsclc中pd-1和pd-l1的经掩蔽的半抗原邻近信号(利用经暴露酶-抗体缀合物起作用的经掩蔽的半抗原-抗体缀合物)。紫色信号代表pd-l1/pd-1复合物的检测。
经掩蔽的半抗原邻近测定法用于测试nsclc和扁桃体的ffpe案例。这些案例在discoveryultra仪器上全自动化运行。使用discoveryezprep(ventana,p/n950-100)或discoverywash(ventana,p/n950-510)的脱石蜡溶液将载玻片脱石蜡。使用discoverycc1(ventana,p/n950-124)在95℃在载玻片上进行热诱导的表位恢复64分钟。然后将discovery抑制剂(ventana,p/n760-4840)应用于载玻片以淬灭样品中的任何内源性过氧化物酶。将兔抗pd-l1(sp263)(ventana,p/n790-4905)与小鼠抗pd-1(nat105)(ventana,p/n760-4895)在37℃共温育32分钟。对于阴性对照,省略了小鼠抗pd-1。对于剩余的运行,将载玻片在37℃温育。将30μg/ml山羊-抗-小鼠碱性磷酸酶缀合物施加到载玻片上并温育12分钟。漂洗载玻片,并将20μg/ml经掩蔽的半抗原山羊-抗-兔缀合物的溶液施用于载玻片16分钟。温育后,将500mmtris缓冲液ph10.0和490mmmgcl2溶液施加到载玻片上以使经掩蔽的半抗原脱掩蔽。使hq脱掩蔽后,将小鼠-抗-hqhrp(ventana,p/n760-4820)缀合物施加到载玻片上以结合未掩蔽的hq。使用discoverypurple试剂盒(ventana,p/n760-229)使邻近蛋白质可视化。必要时使用amphq酪胺扩增试剂盒(ventana,p/n760-052)帮助提高信号强度。
图17图示说明pd-l1和pd-1的经掩蔽的半抗原邻近信号以及pd-1的总蛋白检测。用discoverypurple检测邻近蛋白质后,用discoveryyellow(ventana,p/n760-239)检测未掩蔽的酶(碱性磷酸酶)以可视化组织上的pd-1。
图18图示说明扁桃体组织中pd-l1和pd-1的经掩蔽的半抗原邻近信号的阴性对照。测定中省略了pd-1的一级抗体。没有观察到显示检测试剂对蛋白质复合物的特异性的信号。
在所有案例中,载玻片用苏木精ii(ventana,p/n790-2208)和bluing试剂(ventana,p/n760-2037)复染。
实施例7-与cd8组合的pd1/pd-l1
图19图示说明将pd-l1和pd-1的经掩蔽的半抗原邻近信号与扁桃体组织中另一种生物标志物的后续检测相结合的实例。在这种情况下,在pd-l1/pd1复合物之后检测cd8以产生可视化参与pd-l1/pd1相互作用的cd8细胞的测定。为了多路复用,如先前所述首先检测pd-1和pd-l1邻近性。将载玻片加热至90℃且保持8分钟,以协助洗脱先前结合的原色。将兔抗-cd8(sp57)(ventana,p/n790-4460)应用于载玻片并在37℃温育16分钟。使用ultramaprbap(ventana,p/n760-4314),接着使用discoveryyellow色原体检测抗-cd8。载玻片用苏木精ii(ventana,p/n790-2208)和bluing试剂(ventana,p/n760-2037)复染。
实施例8-her2/her3
经掩蔽的半抗原邻近测定法用于测试bt-474细胞系的ffpe案例。这些案例在discoveryultra仪器上全自动化运行。使用discoveryezprep(ventana,p/n950-100)或discoverywash(ventana,p/n950-510)的脱石蜡溶液将载玻片脱石蜡。使用discoverycc1(ventana,p/n950-124)在95℃在载玻片上进行热诱导的表位恢复64分钟。然后将discovery抑制剂(ventana,p/n760-4840)应用于载玻片以淬灭样品中的任何内源性过氧化物酶。将兔抗her2(4b5)(ventana,p/n790-2991)与小鼠抗her3(spm738)(spring,p/ne19260)在37℃共温育32分钟。然后将30μg/ml山羊-抗-小鼠碱性磷酸酶缀合物施加到载玻片上并温育12分钟。漂洗载玻片,并将20μg/ml经掩蔽的半抗原山羊-抗-兔缀合物溶液施用于载玻片16分钟。温育后,将500mmtris缓冲液ph10.0和490mmmgcl2溶液施加到载玻片上以使经掩蔽的半抗原脱掩蔽。使hq脱掩蔽后,将小鼠-抗hqhrp(ventana,p/n760-4820)缀合物施加到载玻片上以结合未掩蔽的hq。使用amphq酪胺扩增试剂盒(ventana,p/n760-052)帮助提高信号强度。如下使临近蛋白可视化:使用chromomapdab试剂盒(ventana,p/n760-159),接着用苏木精ii(ventana,p/n790-2208)和bluing试剂(ventana,p/n760-2037)进行复染。
图20a-20c图示说明该实验的结果,并图示说明具有正邻近性的蛋白质的实例。图20a图示说明用于her2的单一ihcdab染色(例如利用包含对her2具有特异性的抗体、与酶缀合的抗物种抗体和dab的检测技术)。图20b图示说明her2和her3的经掩蔽的半抗原接近信号(利用经暴露酶-抗体缀合物起作用的经掩蔽的半抗原-抗体缀合物)。图20c图示说明用于her3的单一ihcdab染色(例如利用包含对her3具有特异性的抗体,与酶缀合的抗物种抗体和dab的检测技术)。
根据前面的描述,除了本申请所述的那些之外,本申请的各种修改对于本领域技术人员而言将是显而易见的。这些修改也意在落入所附权利要求的范围内。例如,本申请使用的"抗体"可以是有效结合期望靶标位点的全抗体或抗体的片段。而且,适当时,本申请的"抗体"可用靶向部分(例如配体肽、小分子等)取代。例如,如果肿瘤细胞或免疫细胞具有特异性、分化性和独特的细胞表面受体,则根据本申请可使用相应的靶向部分来区别肿瘤细胞与免疫细胞。
- 还没有人留言评论。精彩留言会获得点赞!