抗α‑共核蛋白抗体诊断脑中的α‑共核蛋白的升高水平的用途的制作方法
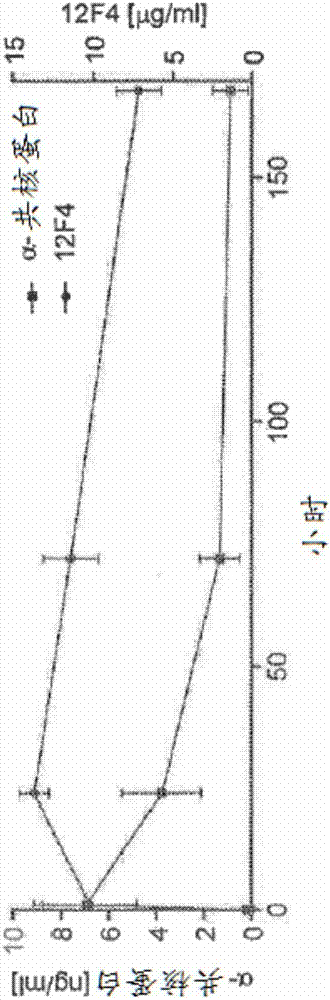
本申请是分案申请,其原申请的国际申请号为pct/us2012/062430,国际申请日为2012年10月29日,中国国家申请号为201280065165.6,进入中国国家阶段的进入日为2014年06月27日,发明名称为“抗α-共核蛋白抗体诊断脑中的α-共核蛋白的升高水平的用途”。电子递交的序列表的引用与本申请一起提交的ascii文本文件(名称:sequencelistingpct_ascii.txt;大小:5,199字节;以及创建日期:2012年10月18日)中的电子递交的序列表的内容以引用的方式整体并入本文。背景公开领域本公开涉及抗α-共核蛋白(synuclein)抗体诊断脑中的α-共核蛋白的升高水平的用途。确切来说,本公开涉及在向测试受试者施用抗α-共核蛋白抗体或其抗原结合片段之后评价血浆或脑脊髓液(csf)中的α-共核蛋白的水平的方法,所述抗α-共核蛋白抗体或其抗原结合片段可以结合具有足够活性的α-共核蛋白以改变从脑至血液或脑至csf的α-共核蛋白的净流出。公开背景哺乳动物脑通过定位于脑毛细管和软蛛网膜下的膜的血脑屏障(bbb)和定位于绒毛膜丛的血液-脑脊髓液(csf)屏障而与血液分开。α-共核蛋白在非病理条件下在脑中相对丰富。它是主要存在于胞质溶胶中的天然未折叠蛋白。它通过增加从突触前末梢释放的递质而在突触传递和突触可塑性中起重要作用。(liu等,emboj23:4506–4516(2004))。α-共核蛋白的突变与早期发作的帕金森氏病的罕见家族情况相关,并且α-共核蛋白从它的可溶形式转变成聚集的不可溶形式是神经变性病症(如帕金森氏病、路易体痴呆(dlb)以及若干其它神经变性疾患)发病的重要事件之一。(dawson等,science302:819–822(2003);bennett等,pharmacolther.105:311–331(2005);george,jm.,genomebiol.3(1):reviews3002.1–reviews3002.6(2002))。另外,已经在帕金森氏病患者的脑脊髓液(csf)和血清中发现单体α-共核蛋白和低聚体α-共核蛋白,因为很明显α-共核蛋白和甚至它的聚集的种类可以穿过血脑屏障。(el-agnaf等,fasebj.20:419–425(2006);tokuda等,biochembiophysrescommun.349:162–166(2006);lee等,jneuraltransm.113:1435–1439(2006);mollenhauer等,expneurol.213:315–325(2008);el-agnaf等,fasebj.17:1945–1947(2003);li等,expneurol204:583–588(2007)。对帕金森氏病的小鼠模型的免疫研究示出抵抗α-共核蛋白的小鼠单克隆抗体可以减少细胞内α-共核蛋白聚集体的积聚(masliah等,neuron,46:857–868(2005);masliah等,plosone,6(4):e19338(2011)支持了中和神经毒性聚集体而不会干扰单体α-共核蛋白的有益功能的抗体可以是有用的治疗剂的想法。然而,鉴于它们的非人来源,基于鼠的抗体在人中的治疗用途和诊断用途会通过人抗小鼠抗体(hama)反应受阻。因此,存在对开发一种用于评价患者脑中的α-共核蛋白的升高水平的方法的需要。简述一个实施方案涉及一种诊断测试受试者的脑中的α-共核蛋白的升高水平的方法,所述方法包括:(a)在向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段之后,在指定时间间隔下测定从测试受试者获得的血浆样品中的α-共核蛋白的水平,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液的α-共核蛋白的净流出;(b)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。还公开了一种诊断测试受试者的脑中的α-共核蛋白的升高水平的方法,所述方法包括:(a)提供抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液的α-共核蛋白的净流出;(b)指导医疗服务提供者向测试受试者外周施用抗体并且在施用之后在指定的时间间隔下从受试者获得血浆样品;(c)测定血浆样品中的α-共核蛋白的水平;(d)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。进一步公开了一种诊断测试受试者的脑中的α-共核蛋白的升高水平的方法,所述方法包括:(a)向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液的α-共核蛋白的净流出;(b)在施用之后在指定的时间间隔下从测试受试者获得血浆样品,并且递交样品用于确定α-共核蛋白的水平;(c)将血浆样品中的α-共核蛋白的水平与参比标准比较;其中血浆样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。进一步公开了如本文所描述的方法,其进一步包括将血浆样品中的α-共核蛋白的水平与在施用抗α-共核蛋白抗体或其抗原结合片段之前从测试受试者获得的血浆样品比较。在具体实施方案中,以上描述的方法中的参比标准包括在一个或多个对照受试者中的α-共核蛋白的测量的水平,其中对照受试者包括正常的健康个体和具有各种严重性的共核蛋白病的个体。进一步公开了一种追踪被治疗共核蛋白疾病的受试者的脑中的α-共核蛋白水平的方法,所述方法包括在外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆中的α-共核蛋白的水平,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液的α-共核蛋白的净流出;并且其中受试者的血浆中的α-共核蛋白水平与受试者的脑中的水平相关。在具体实施方案中,以上描述的方法进一步包括在额外的外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆中的α-共核蛋白的水平,从而绘制受试者的脑中的α-共核蛋白水平随时间变化的曲线图。一些实施方案包括如本文所描述的方法,其中方法涉及通过在施用抗α-共核蛋白抗体或其抗原结合片段之后在指定的时间间隔下测定从测试受试者获得的csf样品中的α-共核蛋白的水平来诊断测试受试者的脑中的α-共核蛋白的升高水平,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至csf的α-共核蛋白的净流出,并且其中csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。一些实施方案包括如本文所描述的方法,其进一步包括将csf样品中的α-共核蛋白的水平与在施用抗α-共核蛋白抗体或其抗原结合片段之前从测试受试者获得的csf样品比较。一些实施方案包括追踪被治疗共核蛋白疾病的受试者的脑中的α-共核蛋白水平的方法,所述方法包括在外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的csf样品中的α-共核蛋白的水平,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至csf的α-共核蛋白的净流出;并且其中受试者的csf中的α-共核蛋白水平与受试者的脑中的水平相关。一些实施方案包括如本文所描述的方法,其中抗体或其抗原结合片段特异性地与包含vh和vl的参比抗体相同的α-共核蛋白表位结合,其中vh包含seqidno:2并且vl包含seqidno:3。在一些实施方案中,抗体或其抗原结合片段竞争性地抑制包含vh和vl的参比抗体与α-共核蛋白结合,其中vh包含seqidno:2并且vl包含seqidno:3。进一步提供了如本文所描述的方法,其中抗体或其抗原结合片段包含重链可变区(vh)和轻链可变区(vl),其中vh包含seqidno:4的互补决定区-1(vhcdr1)氨基酸序列。还提供了如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vh包含seqidno:5的互补决定区-2(vhcdr2)氨基酸序列。一些实施方案包括如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vh包含seqidno:6的互补决定区-3(vhcdr3)氨基酸序列。还提供了如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vl包含seqidno:7的互补决定区-1(vlcdr1)氨基酸序列。一些实施方案包括如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vl包含seqidno:8的互补决定区-2(vlcdr2)氨基酸序列。还公开了如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vl包含seqidno:9的互补决定区-3(vlcdr3)氨基酸序列。进一步提供了如本文所描述的方法,其中抗体或其抗原结合片段包含其中抗体或其抗原结合片段包含vh和vl,其中vh包含seqidno:4、seqidno:5、seqidno:6的vhcdr1、vhcdr2和vhcdr3氨基酸序列。还公开了如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vl包含seqidno:7、seqidno:8、seqidno:9的vlcdr1、vlcdr2和vlcdr3氨基酸序列。一些实施方案包括如本文所描述的方法,其中抗体或其抗原结合片段包含vh和vl,其中vh包含seqidno:5、seqidno:6和seqidno:7的vhcdr1、vhcdr2和vhcdr3氨基酸序列,并且vl包含seqidno:7、seqidno:8和seqidno:9的vlcdr1、vlcdr2和vlcdr3氨基酸序列。一些实施方案包括如本文所描述的方法,其中抗体或其抗原结合片段包含seqidno:2的vh氨基酸序列和seqidno:3的vl氨基酸序列。还公开了如本文所描述的方法,其中抗体或其抗原结合片段是单链fv片段(scfv)、f(ab')片段、f(ab)片段或f(ab')2片段。一些实施方案包括如本文所描述的方法,其中施用是通过静脉内注射抗体。在一个实施方案中,抗体是人的。其它实施方案包括如本文所描述的方法,其中指定的时间间隔是小于一周、或小于或等于24小时、或小于或等于3小时。某些实施方案包括如本文所描述的方法,其中共核蛋白疾病选自由以下组成的组:帕金森氏病(pd)、帕金森氏病痴呆(pdd)、路易体痴呆(dlb)、阿尔茨海默氏病的路易体变体(lbvad)、多系统萎缩症(msa)、单纯性自主神经衰竭(paf)、具有1型脑铁积聚的神经变性(nbia-i)、阿尔茨海默氏病、皮克病、小儿泛发型神经轴索营养不良(哈-斯二氏疾病)、肌萎缩性侧索硬化、创伤性脑损伤以及唐氏综合症。附图简述图1(a至b):当在过表达人α-共核蛋白的转基因小鼠中12f4抗体施用时的剂量依赖型人α-共核蛋白血浆脉冲。图2:人α-共核蛋白血浆脉冲的时程和血浆12f4抗体浓度。图3(a至c):急性高剂量12f4抗体治疗过表达人α-共核蛋白的转基因小鼠减少了脑人α-共核蛋白水平。图4(a至c):人α-共核蛋白血浆水平显著地反映了12f4抗体注射后的脑α-共核蛋白水平。图5(a至c):通过elisa确定了血浆人α-共核蛋白(a)和嵌合12f4抗体水平(b)。(c)在用嵌合12f4抗体慢性治疗过表达人α-共核蛋白的转基因小鼠六个月之后,在血浆α-共核蛋白水平与脑α-共核蛋白水平之间存在显著相关性。图6:当在食蟹猴中12f4施用时,α-共核蛋白脑脊髓液(csf)脉冲和csf/血清124f比率在0.1%附近。图7:转基因α-共核蛋白小鼠中的体内微量透析示出当12f4施用时脑组织间隙流体(isf)α-共核蛋白下降。详述i.定义应该注意术语“一个(a)”或“一种(an)”实体是指一个或多个所述实体;例如“一种抗α-共核蛋白抗体”理解为代表与α-共核蛋白特异性结合的一种或多种抗体。因此,术语“一个”(或“一种”)、“一个或多个”以及“至少一个”可以在本文中互换使用。如本文所使用,术语“共核蛋白疾病(synucleinopathicdiseases)”或“共核蛋白病(synucleinopathies)”是共有主要由神经元和神经胶质的选择性易损群体中的不可溶α-共核蛋白蛋白质的聚集体组成的共同病理损伤的神经变性病症的不同组。这些病症包括帕金森氏病(pd)、帕金森氏病痴呆(pdd)、路易体痴呆(dlb)、阿尔茨海默氏病的路易体变体(lbvad)、多系统萎缩症(msa)、单纯性自主神经衰竭(paf)、具有1型脑铁积聚的神经变性(nbia-i)、阿尔茨海默氏病、皮克病、小儿泛发型神经轴索营养不良(哈-斯二氏疾病)、肌萎缩性侧索硬化、创伤性脑损伤以及唐氏综合症。临床上,取决于损伤的分布,它们的特征为运动、认知、行为以及自主功能的慢性衰退和渐进性衰退。除非另外说明,否则术语“病症”、“疾病(disease)”和“疾患(illness)”在本文中互换使用。如本文所使用,术语“结合分子”或“抗原结合分子”是指特异性结合抗原决定簇的分子这个它最广泛的意思。抗原结合分子的非限制性实例是保留抗原特异性结合的抗体及其片段以及与α-共核蛋白结合的其它非抗体分子,所述其它非抗体分子包括但不限于激素、受体、配体、主要组织相容性复合体(mhc)分子、陪伴分子如热休克蛋白(hsp)以及细胞-细胞粘合分子如钙粘蛋白、整合素、c型凝集素和免疫球蛋白(ig)超家族的成员。因此,仅为了清楚起见并且不限制本公开的范围,针对代表用于开发治疗剂和诊断剂的结合分子的抗体和抗体样分子讨论大多数以下实施方案。在另一个实施方案中,所公开的结合分子包含抗体分子的至少一个重链或轻链cdr。在另一个实施方案中,所公开的结合分子包含来自一个或多个抗体分子的至少两个cdr。在另一个实施方案中,所公开的结合分子包含来自一个或多个抗体分子的至少三个cdr。在另一个实施方案中,所公开的结合分子包含来自一个或多个抗体分子的至少四个cdr。在另一个实施方案中,所公开的结合分子包含来自一个或多个抗体分子的至少五个cdr。在另一个实施方案中,所公开的结合分子包含来自一个或多个抗体分子的至少六个cdr。本文公开了一种诊断测试受试者的脑中的α-共核蛋白的升高水平的方法,所述方法包括向受试者施用抗α-共核蛋白结合分子,例如抗体或其抗原结合片段、变体或衍生物。除非确切是指全尺寸的抗体如天然存在的抗体,否则术语“抗α-共核蛋白抗体”涵盖全尺寸的抗体以及所述抗体的抗原结合片段、变体、类似物或衍生物,例如天然存在的抗体或以类似于抗体分子的方式结合抗原的免疫球蛋白分子或工程化的抗体分子或片段。术语“抗体”和“免疫球蛋白”在本文中互换使用。抗体或免疫球蛋白至少包含重链的可变结构域,并且通常至少包含重链和轻链的可变结构域。脊椎动物系统中的基本免疫球蛋白结构是相对好理解的。参见,例如harlow等(1988)antibodies:alaboratorymanual(第2版;coldspringharborlaboratorypress)。如本文所使用,术语“免疫球蛋白”包括可以被生物化学区别的各种广泛类别的多肽。本领域技术人员将领会重链被分类为γ(gamma)、μ(mu)、α(alpha)、δ(delta)或ε(epsilon)(γ、μ、α、δ、ε),在它们之中具有一些子类别(例如,γ1至γ4)。这个链的本质是将抗体的“类别”分别确定为igg、igm、iga、igg或ige。免疫球蛋白子类别(同种型)(例如,igg1、igg2、igg3、igg4、iga1等)被很好地表征并且已知给予功能特化。鉴于本公开,熟练的技术人员易于辨别出这些类别和同种型各自的修改版本,并且因此处于本公开的范围内。所有免疫球蛋白类别清楚地处于本公开的范围内。以下讨论将总体上涉及免疫球蛋白分子的igg类别。针对igg,标准免疫球蛋白分子包含分子量大约23,000道尔顿的两个相同轻链多肽和分子量53,000至70,000的两个相同重链多肽。这四条链通常由二硫键以“y”构型连接在一起,其中轻链从“y”的开口处开始并且一直通过可变区与重链括在一起。轻链被分类为κ(kappa)或λ(lambda)(κ、λ)。可以用κ或λ轻链结合每种重链类别。通常,轻链和重链彼此共价键合,并且当通过杂交瘤、b细胞或基因工程宿主细胞来产生免疫球蛋白时,这两条重链的“尾巴”部分由共价二硫键或非共价键彼此键合。在重链中,氨基酸序列从y构型的叉端处的n-末端到每条链的底部处的c-末端。轻链和重链均分成结构和功能同源性的区。就其功能使用术语“恒定的”和“可变的”。在这点上,将领会轻链部分(vl或vk)和重链部分(vh)的可变结构域决定抗原识别和特异性。相反,轻链(cl)和重链(ch1、ch2或ch3)的恒定结构域给予重要的生物性质,如分泌、经胎盘移动、fc受体结合、补体结合以及类似性质。按照惯例,恒定区结构域的编号当它们变得离抗体的抗原结合位点或氨基末端更远时增加。n-末端部分是可变区并且在c-末端部分处是恒定区;ch3结构域和cl结构域实际上分别包含重链和轻链的羧基-末端。如上所指明,可变区允许抗体选择性识别和特异性结合抗原上的表位。那就是说,抗体的vl结构域和vh结构域或这些可变结构域内的互补决定区(cdr)的子集组合以形成限定三维抗原结合位点的可变区。这个四级抗体结构形成了存在于y的每条臂的末端处的抗原结合位点。更确切来说,通过每条vh和vl链上的三个cdr来限定抗原结合位点。在一些例子中,例如,源自骆驼科动物种类或基于骆驼科动物免疫球蛋白的工程化的某些免疫球蛋白分子(完整的免疫球蛋白分子)可以仅由重链组成,不具有轻链。参见,例如hamers-casterman等,nature363:446-448(1993)。在天然存在的抗体中,存在于每个抗原结合结构域中的六个“互补决定区”或“cdr”是短的、非邻接的氨基酸序列,当抗体在水性环境中呈现它的三维构型时,所述氨基酸序列特异性地放置以形成抗原结合结构域。抗原结合结构域中的其余氨基酸(称为“构架”区)示出较小的分子间可变性。构架区大部分采用β-片层构象,并且cdr形成连接β-片层结构并且在一些情况下形成β-片层结构的部分的环。因此,构架区起到形成支架的作用,所述支架提供用于通过链间非共价的相互作用将cdr放置在正确的方向上。通过所放置的cdr形成的抗原结合结构域限定了与免疫反应性抗原上的表位互补的表面。这个互补表面促进了抗体与它的同源表位的非共价结合。分别包含cdr和构架区的氨基酸可以被本领域普通技术人员容易地鉴定出任何给定的重链可变结构域或轻链可变结构域,因为它们已经被精确地限定(参见以下)。在其中本领域内使用和/或接受的术语存在两种或更多种定义的情况下,如本文所使用的术语的定义旨在包括所有此类意义,除非明确地相反说明。一个具体实例是使用术语“互补决定区”(“cdr”)来描述在重链多肽和轻链多肽的可变区内发现的非邻接抗原结合位点。这个具体区已经被kabat等(1983)u.s.dept.ofhealthandhumanservices,“sequencesofproteinsofimmunologicalinterest”和被chothia和lesk,j.mol.biol.196:901-917(1987)所描述,这些参考文献以引用的方式并入本文,其中定义包括当针对彼此比较时的氨基酸残基的重叠或子集。不过,应用任一定义来指抗体或其变体的cdr旨在处于如本文所定义和使用的术语的范围内。如通过每个以上引用的参考文献所定义的涵盖cdr的适当氨基酸残基作为比较被列举在以下表1中。涵盖具体cdr的准确残基编号将取决于cdr的序列和大小而改变。本领域技术人员通常可以确定什么残基包含给定抗体的可变区氨基酸序列的具体cdr。表1cdr定义1kabatchothiavhcdr131-3526-32vhcdr250-6552-58vhcdr395-10295-102vlcdr124-3426-32vlcdr250-5650-52vlcdr389-9791-961表1中的所有cdr定义的编号根据由kabat等列举的编号惯例(参见以下)。kabat等还定义了适用于任何抗体的用于可变结构域序列的编号系统。本领域普通技术人员可以明确地对任何可变结构域序列指定这种“kabat编号”系统,而不依赖于超过序列本身的任何实验数据。如本文所使用,“kabat编号”是指由kabat等(1983)u.s.dept.ofhealthandhumanservices,“sequenceofproteinsofimmunologicalinterest”所列举的编号系统。除非另外指定,否则提到在本公开的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物中编号具体氨基酸残基位置是根据kabat编号系统。本公开的抗体或其抗原结合片段、变体或衍生物包括,但不限于:多克隆的、单克隆的、多特异性的、人的、人源化的、灵长类动物源化的或嵌合的抗体、单链抗体、表位结合片段(例如fab、fab'和f(ab')2、fd、fv、单链fv(scfv)、二硫键连接的fv(sdfv)、包含vl或vh结构域的片段、由fab表达文库产生的片段以及抗独特型(抗id)抗体。scfv分子是本领域已知的并且例如被描述在美国专利号5,892,019中。本公开的免疫球蛋白或抗体分子可以具有任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2等)或免疫球蛋白分子的子类别。如本文所使用,术语“重链部分”包括衍生自免疫球蛋白重链的氨基酸序列。在某些实施方案中,包含重链部分的多肽包含以下至少一种:vh结构域、ch1结构域、铰链结构域(例如,上、中和/或下铰链区)、ch2结构域、ch3结构域或其变体或片段。例如,在本公开中使用的结合多肽可以包括:包含ch1结构域的多肽链;包含ch1结构域、至少一部分的铰链结构域以及ch2结构域的多肽链;包含ch1结构域和ch3结构域的多肽链;包含ch1结构域、至少一部分的铰链结构域以及ch3结构域的多肽链或包含ch1结构域、至少一部分的铰链结构域、ch2结构域以及ch3结构域的多肽链。在另一个实施方案中,本公开的多肽包括包含ch3结构域的多肽链。此外,在本公开中使用的结合多肽可以缺乏至少一部分的ch2结构域(例如,所有或部分的ch2结构域)。如上所列举,本领域普通技术人员将理解这些结构域(例如,重链部分)可以被修饰以使得它们的氨基酸序列与天然存在的免疫球蛋白分子不同。在某些实施方案中,本文公开了抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物,多体的一条多肽链的重链部分是与多体的第二多肽链上的那些重链部分相同的。可选地,本公开的包含重链部分的单体是不相同的。例如,每个单体可以包括形成例如双特异性抗体的不同靶结合位点。在本文所公开的方法中使用的结合分子的重链部分可以衍生自不同的免疫球蛋白分子。例如,多肽的重链部分可以包括衍生自igg1分子的ch1结构域和衍生自igg3分子的铰链区。在另一个实例中,重链部分可以包括部分衍生自igg1分子和部分衍生自igg3分子的铰链区。在另一个实例中,重链部分可以包括部分衍生自igg1分子和部分衍生自igg4分子的嵌合铰链。如本文所使用,术语“轻链部分”包括衍生自免疫球蛋白轻链(例如,κ或λ轻链)的氨基酸序列。优选地,轻链部分包括至少一个vl或cl结构域。如先前所指明,各种免疫球蛋白类别的恒定区的亚单位结构和三维构型是众所周知的。如本文所使用,术语“vh结构域”包括免疫球蛋白重链的氨基末端的可变结构域,并且术语“ch1结构域”包括免疫球蛋白重链的第一(最氨基末端)恒定区结构域。ch1结构域与vh结构域相邻并且是免疫球蛋白重链分子的铰链区的氨基末端。如本文所使用,术语“ch2结构域”包括使用常规编号方案(残基244至残基360,kabat编号系统;并且残基231至残基340,eu编号系统;参见前面引用的kabatea等)例如从抗体的约残基244延伸至残基360的重链分子的部分。ch2结构域的独特在于它不与另一个结构域紧密配对。而两条n-连接的支链碳水化合物链介于完整的天然igg分子的两个ch2结构域之间。还被充分记载的是ch3结构域从ch2结构域延伸至igg分子的c-末端并且包含大约108个残基。如本文所使用,术语“铰链区”包括使ch1结构域与ch2结构域连接的重链分子的部分。这个铰链区包含大约25个残基并且是柔性的,从而允许两个n-末端抗原结合区独立地移动。铰链区可以再分成三个相异的结构域:上、中和下铰链结构域(roux等,j.immunol.161:4083(1998))。如本文所使用,术语“二硫键”包括在两个硫原子之间形成的共价键。氨基酸半胱氨酸包含可以形成二硫键或与第二个巯基桥联的巯基。在大多数天然存在的igg分子中,ch1区和cl区由二硫键连接并且两条重链在使用kabat编号系统(位置226或229,eu编号系统)的对应于239和242的位置上由两个二硫键连接。本文所公开的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物可以它们识别或特异性结合抗原(例如,本文所公开的靶多肽(例如,α-共核蛋白))的一个或多个表位或一个或多个部分的方式描述或规定。特异性地与抗体的抗原结合结构域相互作用的靶多肽的部分是“表位”或“抗原决定簇”。靶多肽可以包含单个表位,但是通常包含至少两个表位,并且可以取决于抗原的大小、构象和类型包括任何数目的表位。此外,应该注意靶多肽上的“表位”可以是非多肽元素或可以包括非多肽元素,例如表位可以包括碳水化合物侧链。针对抗体的肽或多肽表位的最小大小认为是约四个氨基酸至五个氨基酸。肽或多肽表位优选地包含至少七个、更优选地至少九个并且最优选地在至少约15个至约30个之间的氨基酸。因为cdr可以识别在它的三级形式下的抗原肽或抗原多肽,所以包含表位的氨基酸不需要是邻接的,并且在一些情况下可以甚至不在相同的肽链上。被本公开的抗α-共核蛋白抗体识别的肽或多肽表位可以包含至少4个、至少5个、至少6个、至少7个、更优选地至少8个、至少9个、至少10个、至少15个、至少20个、至少25个、或在约15个至约30个之间的α-共核蛋白的邻接或非邻接氨基酸的序列。“特异性结合”通常意指抗体经由它的抗原结合结构域与表位结合,并且结合需要在抗原结合结构域与表位之间有一些互补。根据这个定义,当抗体经由它的抗原结合结构域比它将与随机、不相关的表位结合更容易地与所述表位结合时,所述抗体称为与表位“特异性结合”。本文使用术语“特异性”来限定相对亲和性,通过所述相对亲和性某一抗体与某一表位结合。例如,抗体“a”可以被认为具有比抗体“b”更高的针对给定表位的特异性,或抗体“a”可以称为具有比它针对相关表位“d”更高的特异性与表位“c”结合。“优选结合”意指抗体比它将与相关的、相似的、同源的或类似的表位结合更容易地与表位特异性结合。因此,与给定表位“优选结合”的抗体将更可能与所述表位结合而不是与相关表位结合,即使这样一种抗体可以与相关表位交叉反应。通过非限制性实例,如果抗体以比针对第二表位的抗体的kd小的解离常数(kd)结合所述第一表位,则抗体可以被认为优选结合第一表位。在另一个非限制性实例中,如果抗体以比针对第二表位的抗体的kd小至少一个数量级的亲和性结合第一表位,则抗体可以被认为优选结合第一抗原。在另一个非限制性实例中,如果抗体以比针对第二表位的抗体的kd小至少两个数量级的亲和性结合第一表位,则抗体可以被认为优选结合第一表位。在另一个非限制性实例中,如果抗体以比针对第二表位的抗体的k(off)小的解离速率(offrate)(k(off))结合第一表位,则抗体可以被认为优选结合第一表位。在另一个非限制性实例中,如果抗体以比针对第二表位的抗体的k(off)小至少一个数量级的亲和性结合第一表位,则抗体可以被认为优选结合第一表位。在另一个非限制性实例中,如果抗体以比针对第二表位的抗体的k(off)小至少两个数量级的亲和性结合第一表位,则抗体可以被认为优选结合第一表位。本文所公开的抗体或抗原结合片段、变体或衍生物可以据说以小于或等于5×10-2秒-1、10-2秒-1、5×10-3秒-1或10-3秒-1的解离速率(k(off))结合本文所公开的靶多肽(例如,人α-共核蛋白)或其片段或变体。更优选地,本公开的抗体可以据说以小于或等于5×10-4秒-1、10-4秒-1、5×10-5秒-1或10-5秒-1、5×10-6秒-1、10-6秒-1、5×10-7秒-1或10-7秒-1的解离速率(k(off))结合本文所公开的靶多肽(例如,人α-共核蛋白)或其片段或变体。本文所公开的抗体或抗原结合片段、变体或衍生物可以据说以大于或等于103m-1秒-1、5×103m-1秒-1、104m-1秒-1或5×104m-1秒-1的缔合速率(onrate)(k(on))结合本文所公开的靶多肽(例如,人α-共核蛋白)或其片段或变体。更优选地,本公开的抗体可以据说以大于或等于105m-1秒-1、5×105m-1秒-1、106m-1秒-1或5×106m-1秒-1或107m-1秒-1的缔合速率(k(on))结合本文所公开的靶多肽(例如,人α-共核蛋白)或其片段或变体。如果抗体与所述表位优选结合达到在某种程度上阻断参比抗体与表位结合的程度,抗体被称为竞争性地抑制参比抗体与给定表位结合。可以通过本领域已知的任何方法(例如,竞争elisa测定)来确定竞争性抑制。抗体可以据说竞争性地抑制至少90%、至少80%、至少70%、至少60%或至少50%的参比抗体与给定表位的结合。如本文所使用,术语“亲和性”是指单独表位与免疫球蛋白分子的cdr结合的强度的量度。参见,例如harlow等(1988)antibodies:alaboratorymanual(coldspringharborlaboratorypress,第2版)第27至28页。如本文所使用的术语“足够亲和性”是指抗α-共核蛋白抗体或其抗原结合片段与α-共核蛋白或其表位结合以改变从脑至血液或从脑至csf的α-共核蛋白的净流出的足够强度。如本文所使用,术语“净流出”是指从脑至血液或脑至csf的α-共核蛋白的总流量。如本文所使用,术语“亲和力(avidity)”是指一个群体的免疫球蛋白与抗原之间的复合体的总体稳定性,即,免疫球蛋白与抗原的混合物的功能组合强度。参见,例如harlow的第29至34页处。亲和力与具有特异性表位的群体中的单独免疫球蛋白分子的亲和性并且还有免疫球蛋白和抗原的化合价相关。例如,二价单克隆抗体与具有高度重复的表位结构的抗原(如聚合体)之间的相互作用将是高亲和力的一种相互作用。本文所公开的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物还可以它们的交叉反应性的方式描述或规定。如本文所使用,术语“交叉反应性”是指对一种抗原有特异性的抗体与第二抗原反应的能力;为两种不同抗原物质之间的相关性量度。因此,如果抗体与除了诱导它形成的一种表位以外的表位结合,则抗体是交叉反应的。交叉反应表位通常包含许多与诱导表位相同的互补结构特征,并且在一些情况下可以实际上比原物更好地适合。例如,某些抗体具有一定程度的交叉反应性,其中它们结合相关但不相同的表位,例如与参比表位具有至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少65%、至少60%、至少55%并且至少50%同一性(如使用本领域已知并且本文描述的方法所计算)的表位。如果抗体不能结合与参比表位具有小于95%、小于90%、小于85%、小于80%、小于75%、小于70%、小于65%、小于60%、小于55%并且小于50%同一性(如使用本领域已知并且本文描述的方法所计算)的表位,则抗体可以据说具有几乎没有的交叉反应性或不具有交叉反应性。如果抗体不能结合所述表位的任何其它类似物、直向同源物或同源物,则抗体可以被认为对某一表位有“高度特异性”。如本文所描述的抗α-共核蛋白结合分子(例如,抗体或其抗原结合片段、变体或衍生物)还可以它们对本公开的多肽(例如,人α-共核蛋白)的结合亲和性的方式描述或规定。优选的结合亲和性包括具有小于以下的解离常数或kd的那些:5×10-2m、10-2m、5×10-3m、10-3m、5×10-4m、10-4m、5×10-5m、10-5m、5×10-6m、10-6m、5×10-7m、10-7m、5×10-8m、10-8m、5×10-9m、10-9m、5×10-10m、10-10m、5×10-11m、10-11m、5×10-12m、10-12m、5×10-13m、10-13m、5×10-14m、10-14m、5×10-15m或10-15m。包括单链抗体的抗体片段可以包含单独地或与以下的全部或一部分组合的一个或多个可变区:铰链区、ch1结构域、ch2结构域和ch3结构域。还包括了也包含一个或多个可变区与铰链区、ch1结构域、ch2结构域和ch3结构域的任何组合的抗原结合片段。结合分子(例如,本文所公开的抗体或其抗原结合片段)可以来自包括鸟和哺乳动物的任何动物来源。抗体可以是人、鼠、驴、兔、山羊、豚鼠、骆驼、羊驼、马或鸡的抗体。在另一个实施方案中,可变区可以是来源于软骨鱼(condricthoid)(例如,来自鲨鱼)。如本文所使用,术语“嵌合抗体”将意指其中免疫反应性区或位点获自或衍生自第一物种并且恒定区(所述恒定区可以是完整的、部分的或根据本公开修饰的)获自第二物种的任何抗体。例如,靶结合区或位点可以来自非人来源(例如,小鼠或灵长类动物)并且恒定区可以是人的。可选地,完全人结合区可以与非人(例如,小鼠)恒定区组合。如本文所使用,术语“鼠源化的抗体”或“鼠源化的免疫球蛋白”是指包含一个或多个cdr和人构架区的抗体,所述一个或多个cdr来自本公开的人抗体,所述人构架区包含基于小鼠抗体序列的氨基酸取代和/或缺失和/或插入。提供cdr的人免疫球蛋白称为“亲本”或“受体”,并且提供构架变化的小鼠抗体称为“供体”。恒定区不需要存在,但是如果它们存在,它们通常与小鼠抗体恒定区大致上相同,即至少约85%至90%、优选地约95%或更多相同。因此,在一些实施方案中,全长鼠源化的人重链或轻链免疫球蛋白包含小鼠恒定区、人cdr和具有一定数目的“鼠源化”氨基酸取代的大致上人的构架。通常,“鼠源化的抗体”是包含鼠源化的可变轻链和/或鼠源化的可变重链的抗体。例如,鼠源化的抗体将不涵盖通常的嵌合抗体,例如因为嵌合抗体的整个可变区是非小鼠的。通过“鼠源化”的方法被“鼠源化”的修饰的抗体与提供cdr的亲本抗体相同的抗原结合,并且与亲本抗体相比时通常是在小鼠中免疫原性更少的。如本文所使用,术语“工程化的抗体”是指其中重链或轻链或这两者中的可变结构域通过来自已知特异性的抗体的一个或多个cdr的至少部分替代并且如果必要的话通过部分构架区替代和序列变化而改变的抗体。虽然cdr可以衍生自与构架区衍生自其中的抗体相同类别或甚至子类别的抗体,但是应该设想到cdr将衍生自不同类别的抗体并且优选地衍生自来自不同物种的抗体。其中来自已知特异性的非人抗体的一个或多个“供体”cdr被移植到人重链或轻链构架区中的工程化的抗体在本文中被称为”人源化的抗体”。它可以不必要用来自供体可变区的全部cdr替代所有的cdr以使一个可变结构域的抗原结合能力转移至另一个可变结构域。而它可以仅必要转移必须维持靶结合位点的活性的那些残基。如本文所使用,“人的”或“完全人的”抗体包括具有人免疫球蛋白的氨基酸序列的抗体,并且包括从人免疫球蛋白文库或从针对一种或多种人免疫球蛋白转基因的并且不会表达内源免疫球蛋白的动物中分离出的抗体,如下并且例如在kucherlapati等的美国专利号5,939,598中所描述。“人的”或“完全人的”抗体还包括至少包含重链的可变结构域、或至少包含重链和轻链的可变结构域的抗体,其中一个或多个可变结构域具有一个或多个人免疫球蛋白可变结构域的氨基酸序列。“人的”或“完全人的”抗体还包括如本文所描述的“人的”或“完全人的”抗体,所述如本文所描述的“人的”或“完全人的”抗体包含本文所描述的抗体分子(例如,vh区和/或vl区)的变体(包括衍生物)、基本上由此组成或由此组成,所述抗体或其片段与α-共核蛋白多肽或其片段或变体免疫特异性结合。可以使用本领域技术人员已知的标准技术在编码人抗α-共核蛋白抗体的核苷酸序列中引入突变,所述突变包括但不限于导致氨基酸取代的定点诱变和pcr介导的诱变。优选地,相对于参比vh区(vhcdr1、vhcdr2、vhcdr3)、vl区(vlcdr1、vlcdr2或vlcdr3),变体(包括衍生物)编码小于50个氨基酸取代、小于40个氨基酸取代、小于30个氨基酸取代、小于25个氨基酸取代、小于20个氨基酸取代、小于15个氨基酸取代、小于10个氨基酸取代、小于5个氨基酸取代、小于4个氨基酸取代、小于3个氨基酸取代或小于2个氨基酸取代。一方面,本公开的抗体是从人分离出来的人单克隆抗体。任选地,根据数据库中的相关人种系可变区序列比对和采用人抗体的构架区;参见,例如由用于蛋白质工程(cambridge,uk)的mrc中心托管的vbase(http://vbase.mrc-cpe.cam.ac.uk/)。例如,认为可能偏离真实种系序列的氨基酸可以是由于在克隆过程中并入的pcr引物序列。与人工产生的人样抗体如来自噬菌体展示抗体文库或异种小鼠的单链抗体片段(scfv)相比,本公开的人单克隆抗体的特征为:(i)使用人免疫反应而不是动物替代物的免疫反应获得,即,抗体响应于人体中的处于它的相关构象下的天然α-共核蛋白而产生;(ii)具有保护个体或至少对α-共核蛋白的存在重要的;以及(iii)因为抗体是具有人来源的,所以抵抗自体抗原的交叉反应性的危险被最小化。因此,根据本公开,使用术语“人单克隆抗体”、“人单克隆自身抗体”、“人抗体”以及类似的抗体来指代具有人来源的α-共核蛋白结合分子,即所述α-共核蛋白结合分子从人细胞如b细胞或其杂交瘤中分离出或所述α-共核蛋白结合分子的cdna直接从人细胞(例如人记忆b细胞)的mrna克隆。即使在抗体中进行了氨基酸取代例如以改进结合特征,但是人抗体仍然是“人的”。将如下和例如在kucherlapati等的美国专利号5,939,598中所描述的衍生自人免疫球蛋白文库或衍生自对一种或多种人免疫球蛋白转基因的并且不会表达内源免疫球蛋白的动物的抗体指代为人样抗体,为了使它们与本公开的真正人抗体加以区别。如本文所使用,术语“样品”是指从受试者或患者获得的任何生物材料。一方面,样品可以包括血液、脑脊髓液(“csf”)或尿液。在其它方面中,样品可以包括从血液样品中富集的全血、血浆、b细胞,以及培养细胞(例如,来自受试者的b细胞)。样品还可以包括活组织检查物或组织样品,所述活组织检查物或组织样品包括神经组织。在还其它方面中,样品可以包括全细胞和/或细胞的裂解液。可以通过本领域已知的方法来收集血液样品。一方面,可以通过在4℃下、在200μl缓冲液(20mmtris,ph7.5;0.5%nonidet;1mmedta;1mmpmsf;0.1mnacl;ix西格玛蛋白酶抑制剂以及ix西格玛磷酸酶抑制剂1和2)中涡旋振荡来重新悬浮沉淀。可以伴有间歇涡旋振荡将悬浮液保持在冰上,持续20分钟。在约4℃下、在15,000×g下旋转5分钟之后,可以将上清液的等分试样储存在约-70℃下。如本文所使用,术语“治疗(treat)”或“治疗(treatment)”是指治疗性治疗和预防性或防止性措施,其中目的是为了防止或减缓(减轻)不希望的生理学变化、感染或病症。有益的或希望的临床结果包括,但不限于:症状缓和、疾病程度减小、疾病状态稳定(即,没有恶化)、受试者中的传染物清除或减少、疾病进展延迟或减慢、疾病状态改善或减轻以及缓解(无论部分的或全体的),无论可检测的或不可检测的。“治疗”还可以意指与如果没有接受治疗的预期的存活期相比,延长存活期。有治疗需要的那些人包括已经具有感染、病状或病症的那些人以及易于具有病状或病症的那些人或其中待预防病状或病症的那些人。“测试受试者”或“个体”或“动物”或“患者”或“哺乳动物”意指任何受试者,具体是哺乳动物受试者,希望对它们进行诊断、预后或治疗。哺乳动物受试者包括人、家养动物、农场动物、以及动物园、体育竞技动物或宠物,如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛、熊等等。ii.靶多肽描述如本文所使用,术语“α-共核蛋白(α-synuclein)”、“α-共核蛋白(alpha-synuclein)”、“a-共核蛋白”以及“asyn”可互换使用以确切地指α-共核蛋白的天然单体形式。还使用术语“α-共核蛋白”来总体上鉴定α-共核蛋白的其它构象异构体,例如与多巴胺-醌(daq)结合的α-共核蛋白和α-共核蛋白的低聚体或聚集体。还使用术语“α-共核蛋白”来共同指α-共核蛋白的所有类型和形式。人α-共核蛋白的蛋白质序列是:mdvfmkglskakegvvaaaektkqgvaeaagktkegvlyvgsktkegvvhgvatvaektkeqvtnvggavvtgvtavaqktvegagsiaaatgfvkkdqlgkneegapqegiledmpvdpdneayempseegyqdyepea(seqidno):1)α-共核蛋白的氨基酸序列可以从文献和相关数据库中检索;参见,例如ueda等,pnas90:1282-11286(1993);genbankswissprot:locussyua_human,登录号p37840。最初在人脑中鉴定出α-共核蛋白作为阿尔茨海默氏病(ad)斑块的非β-淀粉样组分(nac)的前体蛋白;参见,例如ueda等,见上文。α-共核蛋白是具有140个氨基酸的蛋白质,并且作为无规卷曲以它的天然形式存在。然而,ph、分子集群、重金属含量以及多巴胺水平的变化所有均影响蛋白质构象。低聚体部分、原纤丝部分、纤丝部分和聚集体部分的构象变化被认为可调节蛋白质毒性。越来越多的证据表明:与非加合的蛋白质相比,多巴胺加合的α-共核蛋白具有更快的时间进程来形成原纤维。此外,在α-共核蛋白过表达的背景下的多巴胺是毒性的。nac(α-共核蛋白内的高度疏水结构域)是由至少28个氨基酸残基(残基60至87)和任选地35个氨基酸残基(残基61至95)组成的肽。nac展示出形成β-片层结构的趋势(iwai等,biochemistry,34:10139-10145(1995))。nac的氨基酸序列被描述在jensen等,biochem.j.310:91-94(1995);genbank登录号s56746和ueda等中,见上文。包括nac的解聚集的α-共核蛋白或其片段意指单体肽单元。解聚集的α-共核蛋白或其片段通常是可溶的,并且能够自聚集以形成可溶的低聚体。α-共核蛋白及其片段的低聚体通常是可溶的并且主要呈α-螺旋存在。单体α-共核蛋白可以通过用超声处理将冻干的肽溶解在纯净的dmso中来体外制备。离心所得到的溶液以去除任何不可溶颗粒。包括nac的聚集的α-共核蛋白或其片段意指已经缔合到不可溶β-片层组合体中的α-共核蛋白或其片段的低聚体。包括nac的聚集的α-共核蛋白或其片段还意指原纤聚合体。原纤维通常是不可溶的。一些抗体结合可溶的α-共核蛋白或其片段或聚集的α-共核蛋白或其片段。一些抗体与比单体形式或原纤形式更坚固的α-共核蛋白的低聚体结合。一些抗体结合可溶的和聚集的α-共核蛋白或其片段,以及任选地低聚体形式。iii.抗α-共核蛋白抗体本领域中已经描述了结合α-共核蛋白的抗体。参见,例如国际专利公布wo2010/069603,所述国际专利公布以引用的方式整体并入本文。本文所描述的人抗α-共核蛋白抗体与α-共核蛋白及其表位特异性结合并且与α-共核蛋白及其表位的各种构象特异性结合。例如,本文公开了特异性结合α-共核蛋白、以它的天然单体形式存在的α-共核蛋白、全长和截短的α-共核蛋白以及α-共核蛋白聚集体的抗体。例如,如本文所描述的12f4抗体与全长α-共核蛋白结合并且与在通过直接elisa所测试的包含氨基酸(aa)1至60、指向α-共核蛋白的n-末端两亲重复区内的12f4的表位的α-共核蛋白截短形式结合。(参见wo2010/069603)。如本文所使用,提到“特异性结合”、“选择性结合”或“优选结合”α-共核蛋白的抗体是指不会结合其它不相关的蛋白质的抗体。在一个实例中,本文所公开的α-共核蛋白抗体可以结合α-共核蛋白或其表位并且在其它蛋白质的约1.5倍背景以上的情况下没有示出结合。“特异性结合”或“选择性结合”α-共核蛋白构象异构体的抗体是指不会结合α-共核蛋白的所有构象(即,不会结合至少一个其它α-共核蛋白构象异构体)的抗体。例如,本文公开了可以在α-共核蛋白、人和小鼠α-共核蛋白的单体形式和聚集形式;全长α-共核蛋白和截短形式以及人α-共核蛋白与β-共核蛋白和γ-共核蛋白之中加以区别的抗体。因为本公开的人抗α-共核蛋白抗体已经从不具有帕金森综合症的体征并且展现出α-共核蛋白特异性免疫应答的老年受试者的一个库中分离,所以本文所公开的抗α-共核蛋白抗体还可以称为“人自身抗体”以便强调那些抗体确实由受试者表达并且尚未从例如人免疫球蛋白表达噬菌体文库中分离,迄今为止这代表了用于试着提供人样抗体的一种常见方法。本公开总体上涉及一种诊断测试受试者的脑中的α-共核蛋白的升高水平的方法,所述方法包括施用与α-共核蛋白或其抗原结合片段、变体或衍生物特异性结合的抗体。抗α-共核蛋白抗体可以在本文所提供的方法中使用。可以使用的抗体包括,但不限于在国际专利公布wo2010/069603中完全描述的重组人α-共核蛋白抗体ni-202.3g12、12f4或ni-202.3d8以及其抗原结合片段、变体或衍生物。在某些实施方案中,在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物具有与参比抗α-共核蛋白抗体分子(例如本文描述的那些)的氨基酸序列有至少约80%、约85%、约88%、约89%、约90%、约91%、约92%、约93%、约94%或约95%序列同一性的氨基酸序列。在另外的实施方案中,结合分子与参比抗体共有至少约96%、约97%、约98%、约99%或100%的序列同一性。在某些实施方案中,抗体或其抗原结合片段与包含免疫球蛋白重链可变区(vh)和免疫球蛋白轻链可变区(vl)的参比抗体相同的α-共核蛋白表位特异性结合,其中vh包含与seqidno:2至少80%、85%、90%、95%或100%相同的氨基酸序列并且vl包含与seqidno:3至少80%、85%、90%、95%或100%相同的氨基酸序列,如在表2中所示。进一步公开了与包含vh和vl的参比抗体相同的α-共核蛋白表位特异性结合的在本文所提供的方法中有用的抗体或其抗原结合片段、变体或衍生物,其中vh包含与seqidno:2相同或除了一个、两个、三个、四个、五个或更多个氨基酸取代之外与seqidno:2相同的氨基酸序列,并且vl包含与seqidno:3相同或除了一个、两个、三个、四个、五个或更多个氨基酸取代之外与seqidno:3相同的氨基酸序列,如在表2中所示。一些实施方案包括包含vh的在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物,其中vh的一个或多个vhcdr1、vhcdr2或vhcdr3区是与以下序列中的一种或多种的一个或多个参比重链vhcdr1、vhcdr2和/或vhcdr3氨基酸序列至少80%、85%、90%、95%或100%相同:seqidno:4、seqidno:5、seqidno:6,如在表3中所示。进一步公开了包含vh的在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物,其中vh的一个或多个vhcdr1、vhcdr2或vhcdr3区是与以下序列中的一种或多种的一个或多个参比重链vhcdr1、vhcdr2或vhcdr3氨基酸序列相同或除了四个、三个、两个或一个氨基酸取代之外相同的:seqidno:4、seqidno:5、seqidno:6,如在表3中所示。还公开了包含vl的在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物,其中vl的一个或多个vlcdr1、vlcdr2或vlcdr3区是与以下序列中的一种或多种的一个或多个参比重链vlcdr1、vlcdr2或vlcdr3氨基酸序列至少80%、85%、90%、95%或100%相同:seqidno:7、seqidno:8、seqidno:9,如在表3中所示。一些实施方案公开了包含vl的在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物,其中vl的一个或多个vlcdr1、vlcdr2或vlcdr3区是与以下序列中的一种或多种的一个或多个参比重链vlcdr1、vlcdr2或vlcdr3氨基酸序列相同或除了四个、三个、两个或一个氨基酸取代之外相同:seqidno:7、seqidno:8、seqidno:9,如在表3中所示。在其它实施方案中,在本文所提供的方法中有用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物包含与如在表2中所示的seqidno:2和seqidno:3至少80%、85%、90%、95%或100%相同的vh和vl氨基酸序列、主要由其组成或由其组成。表2:参比vh和vl氨基酸序列**vh和vlcdr1、cdr2和cdr3氨基酸序列以下划线标注表3:参比vh和vlcdr1、cdr2和cdr3氨基酸序列还包括用于在本文所描述的方法中使用的是编码如本文所描述的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物的多肽;编码此类多肽的多核苷酸;包含此类多核苷酸的载体以及包含此类载体或多核苷酸的宿主细胞,所有均用于产生在本文所描述的方法中使用的抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物。如本文所描述的抗α-共核蛋白抗体的适合的生物活性变体可以在本公开的方法中使用。此类变体将保留亲本抗α-共核蛋白抗体的希望的结合性质。用于制造抗体变体的方法通常是在本领域中可获得的。用于诱变和核苷酸序列改变的方法是本领域中众所周知的。参见,例如walker和gaastra编著(1983)techniquesinmolecularbiology(macmillanpublishingcompany,newyork);kunkel,proc.natl.acad.sci.usa82:488-492(1985);kunkel等,methodsenzymol.154:367-382(1987);sambrook等(1989)molecularcloning:alaboratorymanual(coldspringharbor,n.y.);美国专利号4,873,192;以及在其中引用的参考文献;以引用的方式并入本文。关于不影响感兴趣的多肽的生物活性的适当氨基酸取代的指导可以在dayhoff等在atlasofproteinsequenceandstructure(natl.biomed.res.found.,washington,d.c.)第345-352页(1978)中的模型中发现,以引用的方式整体并入本文。dayhoff等的模型使用了接受点突变(pam)氨基酸相似性矩阵(pam250矩阵)来确定适合的保守性氨基酸取代。保守性取代(如用具有类似性质的另一个氨基酸与一个氨基酸交换)可以是优选的。如通过dayhoff等模型的pam250矩阵所教导的保守性氨基酸取代的实例包括,但不限于以及用于测量抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物的结合特异性的方法包括,但不限于:标准竞争结合测定、用于监测通过t细胞或b细胞的免疫球蛋白分泌的测定、t细胞增殖测定、细胞凋亡测定、elisa测定以及类似的方法。参见,例如在wo93/14125;shi等,immunity13:633-642(2000);kumanogoh等,jimmunol169:1175-1181(2002);watanabe等,jimmunol167:4321-4328(2001);wang等,blood97:3498-3504(2001);以及giraudon等,jimmunol172(2):1246-1255(2004)中公开的此类测定,所有所述参考文献以引用的方式并入本文。当本文讨论包括本文所公开的恒定区、cdr、vh结构域或vl结构域的任何具体多肽是否是与另一个多肽至少约65%、约70%、约75%、约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或甚至约100%相同时,%同一性可以使用本领域中已知的方法和计算机程序/软件来测定,所述已知的方法和计算机程序/软件如但不限于bestfit程序(威斯康星序列分析包(wisconsinsequenceanalysispackage),用于unix的版本8,geneticscomputergroup,universityresearchpark,575sciencedrive,madison,wis.53711)。bestfit使用了smith和waterman(1981)adv.appl.math.2:482-489的局部同源性算法来找出两个序列之间的同源性的最佳区段。当使用bestfit或任何其它序列比对程序以确定具体序列是否是与根据本公开的参比序列例如95%相同时,必然设定了参数以使得通过参比多肽序列的全长计算同一性的百分比并且允许参比序列中的氨基酸的总数的同源性的间隔高达至5%。出于本公开的目的,可以使用smith-waterman同源性搜索算法使用仿射间隔搜索的具有间隔开放罚分(gapopenpenalty)为12,间隔延伸罚分(gapextensionpenalty)为2,blosum矩阵为62来确定序列同一性百分比。smith-waterman同源性搜索算法被教导在smith和waterman(1981)adv.appl.math.2:482-489中。变体可以例如与参比抗α-共核蛋白抗体的少至1至15个氨基酸残基,少至1至10个氨基酸残基,如6至10个,少至5个,少至4个,少至3个,少至2个,或甚至1个氨基酸残基不同。“保守性氨基酸取代”是其中氨基酸残基被具有带类似电荷的侧链的氨基酸残基替代的一种保守性氨基酸取代。具有带类似电荷的侧链的氨基酸残基的家族已经在本领域中定义。这些家族包括具有以下侧链的氨基酸:碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)以及芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。可选地,可以如通过饱和诱变沿着所有或部分的编码序列随机引入突变,并且可以筛选所产生的突变体的生物活性以鉴定保留活性(例如,结合α-共核蛋白多肽的能力)的突变体。例如,可能仅在抗体分子的构架区或仅在cdr区中引入突变。引入的突变可以是沉默或中性错义突变,即对抗体结合抗原的能力不具有作用或几乎不具有作用。这些类型的突变可以是对优化密码子使用有用的,或改进杂交瘤的抗体产生。可选地,非中性错义突变可以改变抗体结合抗原的能力。本领域技术人员将能够设计和测试带有希望的性质的突变分子,所述希望的性质如抗原结合活性不改变或结合活性改变(例如,抗原结合活性改进或抗体特异性变化)。诱变之后,通常可以表达编码的蛋白质,并且编码的蛋白质的功能活性和/或生物活性(例如,免疫特异性结合α-共核蛋白多肽的至少一个表位的能力)可以使用本文所描述的技术或通过通常本领域中已知的修饰技术来确定。iv.使用抗α-共核蛋白抗体的诊断或追踪方法本公开涉及抗α-共核蛋白结合分子(例如抗体或其抗原结合片段)用于诊断测试受试者的脑中的α-共核蛋白的升高水平(例如,用于确定受试者发展共核蛋白疾病的危险)或用于在测试受试者中监测共核蛋白疾病的进展或对共核蛋白疾病治疗的反应的用途。在某些实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)在向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段之后,在指定的时间间隔下测定从测试受试者获得的血浆或csf样品中的α-共核蛋白的水平,其中抗α-共核蛋白抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液或从脑至csf的α-共核蛋白的净流出;(b)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。在其它实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)在向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段之后,在指定的时间间隔下测定从测试受试者获得的血浆或csf样品中的α-共核蛋白的水平,其中抗α-共核蛋白抗体或其片段使血液或csf中的α-共核蛋白稳定或螯合;(b)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。在一些实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)提供抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液或从脑至csf的α-共核蛋白的净流出;(b)指导医疗服务提供者向测试受试者外周施用抗体并且在施用之后在指定的时间间隔下从受试者获得血浆样品或csf样品;(c)测定血浆样品或csf样品中的α-共核蛋白的水平;(d)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。在其它实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)提供抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段,其中抗α-共核蛋白抗体或其片段使血液或csf中的α-共核蛋白稳定或螯合;(b)指导医疗服务提供者向测试受试者外周施用抗体并且在施用之后在指定的时间间隔下从受试者获得血浆样品或csf样品;(c)测定血浆样品或csf样品中的α-共核蛋白的水平;(d)将测试受试者中的α-共核蛋白的测定的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。为了应用本公开的方法和系统,可以在施用抗α-共核蛋白抗体或其抗原结合片段之前或之后获得来自患者的样品。样品可以例如被医疗服务提供者(例如,医生)或医疗服务福利提供者(healthcarebenefitsprovider)要求、通过相同或不同的医疗服务提供者(例如,护士、医院)或临床实验室获得和/或加工,并且在加工之后,可以将结果转发给另一个医疗服务提供者、医疗服务福利提供者或患者。类似地,可以通过一个或多个医疗服务提供者、医疗服务福利提供者和/或临床实验室进行测定样品中的α-共核蛋白的水平、将测试受试者中的α-共核蛋白的测定的水平与参比标准比较、评价结果。如本文所使用,术语“医疗服务提供者”是指直接与活受试者(例如,人患者)相互作用和向其施用的个体或机构。医疗服务提供者的非限制性实例包括医生、护士、技术人员、治疗学家、药剂师、顾问、可选的医学从业者、医疗机构、医生办公室、医院、急诊室、诊所、紧急护理中心、可选的医学诊所/机构以及任何其它提供以下服务的实体:通常和/或专门的治疗、评价、维持、疗法、药物治疗和/或涉及所有或任何部分的患者的健康状态的建议,包括但不限于通常医疗、专门医疗、手术和/或任何其它类型的治疗、评价、维持、疗法、药物治疗和/或建议。如本文所使用,术语“临床实验室”是指用于检验或加工源自活受试者(例如,人类)的材料的机构。出于提供信息(例如,出于诊断、预防或治疗活受试者(例如,人类)的任何疾病或损伤或评价活受试者(例如,人类)的健康)的目的,加工的非限制性实例包括生物检验、生化检验、血清检验、化学检验、免疫血液检验、血液检验、生物物理检验、细胞检验、病理检验、遗传检验或其它检验源自人体的材料。这些检验还可以包括收集或以另外的方式获得样品、制备、确定、测量或以另外的方式描述活受试者(例如,人类)的身体中或从活受试者(例如,人类)的身体获得的样品中的各种物质的存在或不存在的程序。在某些方面中,临床实验室可以是“中央的”或“本地的”,意味着少量或单个实验室做出从所有外部来源递交的样品的所有测量。在其它方面中,可以验证多个临床实验室(又称为“卫星”或“全球”实验室)来都提供可以容易比较的标准、可靠的结果。如本文所使用,术语“医疗服务福利提供者”涵盖提供、提出、给予、全部或部分给付或以另外的方式与给予患者得到一种或多种医疗服务福利、福利计划、健康保险和/或医疗服务费用账户程序相关的个体当事人、组织或团体。在一些方面中,医疗服务提供者可以施用或指示另一个医疗服务提供者施用抗α-共核蛋白抗体或其抗原结合片段。医疗服务提供者可以实施或指示另一个医疗服务提供者或患者进行以下行为:获得样品;加工样品;递交样品;接收样品;转移样品;分析或测量样品;定量样品;提供分析/测量/定量样品之后所获得的结果;接收分析/测量/定量样品之后所获得的结果;比较/记分分析/测量/定量一个或多个样品之后所获得的结果;提供来自一个或多个样品的比较/得分;获得来自一个或多个样品的比较/得分;施用疗法或治疗剂(例如,抗α-共核蛋白抗体或其抗原结合片段);开始施用疗法;终止施用疗法;继续施用疗法;暂时中断施用疗法;增加施用的治疗剂的量;减少施用的治疗剂的量;继续施用一定量的治疗剂;增加施用治疗剂的频率;减少施用治疗剂的频率;维持治疗剂的相同给药频率;通过至少另一种疗法或治疗剂替代一种疗法或治疗剂;将一种疗法或治疗剂与至少另一种疗法或额外的治疗剂组合。在一些方面中,医疗服务福利提供者可以授权或拒绝例如收集样品;加工样品;递交样品;接收样品;转移样品;分析或测量样品;定量样品;提供分析/测量/定量样品之后所获得的结果;转移分析/测量/定量样品之后所获得的结果;比较/记分分析/测量/定量一个或多个样品之后所获得的结果;转移来自一个或多个样品的比较/得分;施用疗法或治疗剂;开始施用疗法或治疗剂;终止施用疗法或治疗剂;继续施用疗法或治疗剂;暂时中断施用疗法或治疗剂;增加施用的治疗剂的量;减少施用的治疗剂的量;继续施用一定量的治疗剂;增加施用治疗剂的频率;减少施用治疗剂的频率;维持治疗剂的相同给药频率;通过至少另一种疗法或治疗剂替代一种疗法或治疗剂;或将一种疗法或治疗剂与至少另一种疗法或额外的治疗剂组合。另外,医疗服务福利提供者可以例如授权或拒绝开处疗法,授权或拒绝覆盖疗法,授权或拒绝赔偿疗法的成本,确定或拒绝疗法的合适性等等。在一些方面中,临床实验室可以例如收集或获得样品、加工样品、递交样品、接收样品、转移样品、分析或测量样品、定量样品、提供分析/测量/定量样品之后所获得的结果、接收分析/测量/定量样品之后所获得的结果、比较/记分分析/测量/定量一个或多个样品之后所获得的结果、提供来自一个或多个样品的比较/得分、获得来自一个或多个样品的比较/得分。以上列举的行为可以通过医疗服务提供者、医疗服务福利提供者或患者自动使用计算机实施的方法(例如,经由网络服务或独立计算机系统)来进行。如本文所使用,术语“指导医疗服务提供者”包括口头指导医疗服务提供者或通过使用书面命令或这两者来指导医疗服务提供者。在一些实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液或从脑至csf的α-共核蛋白的净流出;(b)在施用之后在指定的时间间隔下从测试受试者获得血浆样品或csf样品,并且递交血浆样品或csf样品用于确定α-共核蛋白的水平;(c)将血浆样品中的α-共核蛋白的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。在其它实施方案中,如本文所描述的方法涉及使用抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)通过以下方法来诊断测试受试者的脑中的α-共核蛋白的升高水平:(a)向测试受试者外周施用抗α-共核蛋白抗体或其抗原结合片段,其中抗体或其片段使血液或csf中的α-共核蛋白稳定或螯合;(b)在施用之后在指定的时间间隔下从测试受试者获得血浆样品或csf样品,并且递交血浆样品或csf样品用于确定α-共核蛋白的水平;(c)将血浆样品中的α-共核蛋白的水平与参比标准比较;其中血浆样品或csf样品与参比标准中的α-共核蛋白的水平之间的差异或相似性与测试受试者的脑中的α-共核蛋白的水平相关。在一些实施方案中,抗α-共核蛋白抗体(包括本文所描述的其抗原结合片段、变体和衍生物)可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液或从脑至csf的α-共核蛋白的净流出并且使血液或csf中的α-共核蛋白稳定或螯合。待诊断的测试受试者可以是对疾病而言无症状的或临床前的。在具体实施方案中,测试受试者包括症状前的或具有临床前共核蛋白疾病的个体。在具体实施方案中,本文所描述的方法中的“参比标准”包括在一个或多个对照受试者中的α-共核蛋白的测量的水平,其中对照受试者包括正常的健康个体和具有各种严重性的共核蛋白病的个体。例如,对照受试者具有共核蛋白疾病,例如帕金森氏病(pd)、路易体痴呆(dlb)或阿尔茨海默氏病的路易体变体(lbvad),其中α-共核蛋白的水平与参比标准之间的相似性表明待诊断的受试者具有共核蛋白疾病。可选地或另外作为第二对照,对照受试者不具有共核蛋白疾病,其中α-共核蛋白的水平与参比标准之间的差异表明待诊断的受试者具有共核蛋白疾病。优选地,待诊断的受试者和一个或多个对照受试者是年龄匹配的。在一些实施方案中,如本文所描述的方法进一步包括将血浆样品(即,测试样品)中的α-共核蛋白的水平与在施用抗α-共核蛋白抗体(包括其抗原结合片段、变体和衍生物)之前从测试受试者获得的血浆样品(即,基线样品)比较。在其它实施方案中,如本文所描述的方法进一步包括将csf样品(即,测试样品)中的α-共核蛋白的水平与在施用抗α-共核蛋白抗体(包括其抗原结合片段、变体和衍生物)之前从测试受试者获得的csf样品(即,基线样品)比较。例如,可以对基线样品做出替代或除了与参比标准比较以外的比较。在这点上,基线样品可以用来使测试样品校准至参考标准(例如,测量值是差值或比率而不是绝对值)。通过另外的实施方案,如本文所描述的抗α-共核蛋白结合分子(具体是抗α-共核蛋白抗体)还可以在用于通过从测试的个体获得体液样品(所述体液样品可以是血液样品、淋巴样品、csf样品或任何其它体液样品)并且在能够形成抗体-抗原复合体的条件下使体液样品与如本文所描述的抗α-共核蛋白抗体接触而在个体中诊断病症的方法中使用。然后通过本领域中已知的方法确定此类复合体的水平,水平显著高于对照样品中形成的水平表明了测试的个体中的疾病。以相同的方式,还可以使用通过如本文所描述的抗α-共核蛋白抗体结合的特异性抗原。因此,本公开涉及体外免疫测定,所述体外免疫测定包含抗α-共核蛋白结合分子例如本公开的抗体或其抗原结合片段。可以通过本领域已知的任何适合的方法来评价α-共核蛋白的水平,所述方法包括例如,通过选自以下的一种或多种技术分析α-共核蛋白:蛋白质印迹、免疫沉淀、酶联免疫吸附测定(elisa)、放射免疫测定(ria)、荧光激活细胞分选(facs)、二维凝胶电泳、质谱法(ms)、基质辅助的激光脱附/离子化飞行时间-ms(maldi-tof)、表面增强的激光脱附离子化飞行时间(seldi-tof)、高效液相色谱法(hplc)、快速蛋白质液相色谱法(fplc)、串联质谱法(ms/ms)之后的多维液相色谱法(lc)以及激光密度测定法。优选地,所述α-共核蛋白的体内成像包括正电子发射断层摄影(pet)、单光子发射断层摄影(spect)、近红外(nir)光学成像或磁共振成像(mri)。如在医学领域中众所周知,用于任何一个患者的剂量取决于许多因素,包括患者的大小、体表面积、年龄、待施用的具体化合物、性别、施用时间和途径、一般健康状况以及目前正在施用的其它药物。通常,剂量可以例如在宿主体重的约0.0001mg/kg至100mg/kg,并且更通常在0.01mg/kg至5mg/kg(例如,0.02mg/kg、0.25mg/kg、0.5mg/kg、0.75mg/kg、1mg/kg、2mg/kg等等)的范围内。例如,剂量可以是1mg/kg体重或10mg/kg体重或在1mg/kg至10mg/kg的范围内。介于以上范围中间的剂量还旨在处于本公开的范围内。本文其它地方描述了术语“外周施用”。在某些实施方案中,可以使用基于抗体的阵列,所述阵列例如装载有特异性识别α-共核蛋白的本公开的抗α-共核蛋白抗体或等效的抗原结合分子。微阵列免疫测定的设计被概述在kusnezow等,mol.cellproteomics5:1681-1696(2006)中。因此,本公开还涉及装载有根据本公开鉴定的抗α-共核蛋白结合分子的微阵列。在一些实施方案中,如本文所描述的方法还涉及使用抗α-共核蛋白抗体(包括其抗原结合片段、变体和衍生物)来追踪被治疗共核蛋白疾病的受试者的脑中的α-共核蛋白水平,包括在外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆或受试者的csf中的α-共核蛋白的水平,其中抗体或其片段可以结合具有足够亲和性的α-共核蛋白以改变从脑至血液或脑至csf的α-共核蛋白的净流出;并且其中受试者的血浆或受试者的csf中的α-共核蛋白水平与受试者的脑中的水平相关。在具体实施方案中,如本文所描述的方法进一步包括在额外的外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆或受试者的csf中的α-共核蛋白的水平,从而绘制受试者的脑中的α-共核蛋白水平随时间变化的曲线图。在一些实施方案中,如本文所描述的方法还涉及使用抗α-共核蛋白抗体(包括其抗原结合片段、变体和衍生物)来追踪被治疗共核蛋白疾病的受试者的脑中的α-共核蛋白水平,包括在外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆或受试者的csf中的α-共核蛋白的水平,其中抗体或其片段使血液或csf中的α-共核蛋白稳定或螯合;并且其中受试者的血浆或受试者的csf中的α-共核蛋白水平与受试者的脑中的水平相关。在具体实施方案中,如本文所描述的方法进一步包括在额外的外周施用抗α-共核蛋白抗体或其抗原结合片段之后在指定时间下测定受试者的血浆或受试者的csf中的α-共核蛋白的水平,从而绘制受试者的脑中的α-共核蛋白水平随时间变化的曲线图。一些实施方案包括如本文所描述的方法,其中指定的时间间隔是小于12个月、小于11个月、小于10个月、小于9个月、小于8个月、小于7个月、小于6个月、小于5个月、小于4个月、小于3个月、小于2个月、小于一个月、小于一周、或小于或等于24小时、或小于或等于3小时。v.组合物和施用方法制备和向有需要的受试者施用抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物的方法是本领域技术人员众所周知的或由本领域技术人员容易确定。抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物的施用途径可以是例如口服、肠胃外、通过吸入或局部。如本文所使用的术语“外周施用”包括例如静脉内施用、动脉内施用、腹膜内施用、肌肉内施用、皮下施用、直肠施用或阴道施用。虽然所有这些施用形式清楚认为在本公开的范围内,但是用于施用的形式的实例将是用于注射的溶液,具体是用于静脉内或动脉内注射或滴注的溶液。用于注射的适合的药物组合物可以包含缓冲液(例如乙酸盐、磷酸盐或柠檬酸盐缓冲液)、表面活性剂(例如聚山梨醇酯)、任选地稳定剂(例如,人白蛋白)等等。如本文所讨论,抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物可以被配制以便有助于施用并且促进活性剂的稳定性。在某些实施方案中,根据本公开的药物组合物包含药学上可接受的、无毒性的、无菌的载体,如生理盐水、无毒性的缓冲液、防腐剂以及类似物质。出于本申请的目的,抗α-共核蛋白抗体或其抗原结合片段、变体或衍生物的药物有效量应该理解为意指足以实现与靶标有效结合并且实现例如改变从脑至血液的α-共核蛋白的净流出或改变从脑至csf的α-共核蛋白的净流出的益处的量。用于本公开中的药物组合物包含药学上可接受的载体,包括例如离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(如人血清白蛋白)、缓冲物质(如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质(如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮)、基于纤维素的物质、聚乙二醇、羟甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇以及羊毛脂。用于外周施用的制剂包括无菌水性或非水性的溶液、悬浮液以及乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油(如橄榄油)以及可注射有机酯(如油酸乙酯)。水性载体包括例如水、酒精溶液/水溶液、乳液或悬浮液,包括盐水和缓冲的介质。在本公开中,药学上可接受的载体包括,但不限于0.01m至0.1m磷酸盐缓冲液或0.8%盐水。其它常见肠胃外媒介物包括磷酸钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸化的林格氏溶液或固定油。静脉内媒介物包括流体和营养补充剂、电解质补充剂(如基于林格氏葡萄糖的那些)以及类似物质。防腐剂和其它添加剂也可以存在,例如像抗微生物剂、抗氧化剂、螯合剂和惰性气体以及类似物质。更具体来说,适合用于可注射使用的药物组合物包括无菌水溶液(其中水溶性的)或用于临时制备无菌可注射的溶液或分散液的分散剂和无菌粉末。在此类情况下,组合物必须是无菌的并且流动性应该达到存在容易注射性的程度。在制造和储存的条件下组合物应该是稳定的,并且将优选地不受微生物(如细菌和真菌)的污染作用影响而保存。载体可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇以及类似物质)以及其适合的混合物。可以例如通过使用涂层(如卵磷脂)、通过在分散液情况下保持所需要的粒径以及通过使用表面活性剂来保持适当的流动性。用于本文所公开的治疗方法的适合的制剂被描述在remington'spharmaceuticalsciences(mackpublishingco.)第16版(1980)中。可以通过各种抗菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞以及类似物质)来实现预防微生物的作用。在许多情况下,在组合物中将优选包括等渗剂,例如糖、多元醇,如甘露醇、山梨醇或氯化钠。可以通过在组合物中包括延缓吸收的试剂(例如单硬脂酸铝和明胶)而带来可注射组合物的延长吸收。在任何情况下,可以通过在适当的溶剂中并入需要的量的活性化合物(例如,单独地或与其它活性剂组合的抗α-抗体或其抗原结合片段、变体或衍生物)与本文所列举的一种成分或多种成分的组合,如果需要的话,接着通过过滤型灭菌来制备无菌可注射溶液。通常,通过将活性化合物并入到无菌媒介物中来制备分散液,所述无菌媒介物包含基本分散介质和来自以上列举的那些的需要的其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,制备的优选方法是真空干燥和冷冻干燥,这产生活性成分加上来自其先前无菌过滤的溶液的任何额外希望的成分的粉末。加工用于注射的制剂,过滤到容器(如安瓿、袋、瓶、注射器或小瓶)中,并且在根据本领域已知的方法的无菌条件下密封。此外,可以包装制剂并且以试剂盒的形式出售。制造的此类物品可以具有标签或包装说明书,这表明相关的组合物是有用于治疗遭受或易感疾病或病症的受试者。肠胃外制剂可以是快速灌注剂量、输注或具有维持剂量的装载推注剂量。可以在具体固定的或可变的时间间隔(例如,一天一次或基于“如需要时”)下施用这些组合物。如本文所公开的某些药物组合物可以可接受的剂型(包括例如,胶囊、片剂、水性混悬剂或溶液)口服施用。某些药物组合物还可以通过鼻气雾剂或吸入来施用。采用苄醇或其它适合的防腐剂、吸附促进剂以增强生物利用率、和/或其它常规稳定剂或分散剂,可以将此类组合物制备成盐水溶液。待与载体材料组合以产生单一剂型的抗α-共核蛋白抗体或其片段、变体或衍生物的量将取决于所治疗的宿主和施用的具体模式而改变。组合物可以被施用为单一剂量、多剂量或以输注的形式经过确立的时间段。还可以调整给药方案以提供最优的希望的反应(例如,治疗反应或预防反应)。***本公开的实践将采用(除非另外指出)细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组dna以及免疫学的常规技术,所述技术处于本领域的技能之内。此类技术被完全解释在参考文献中。参见,例如molecularcloningalaboratorymanual,第2版,sambrook等编著,coldspringharborlaboratorypress:(1989);molecularcloning:alaboratorymanual,sambrook等编著,coldspringsharborlaboratory,newyork(1992),dnacloning,d.n.glover编著,第i和ii卷(1985);oligonucleotidesynthesis,m.j.gait编著,(1984);mullis等美国专利号:4,683,195;nucleicacidhybridization,b.d.hames&s.j.higgins编著(1984);transcriptionandtranslation,b.d.hames&s.j.higgins编著(1984);cultureofanimalcells,r.i.freshney,alanr.liss,inc.,(1987);immobilizedcellsandenzymes,irlpress,(1986);b.perbal,apracticalguidetomolecularcloning(1984);thetreatise,methodsinenzymology,academicpress,inc.,n.y.;genetransfervectorsformammaliancells,j.h.millerandm.p.calos编著,coldspringharborlaboratory(1987);methodsinenzymology,第154和155期(wu等编著);immunochemicalmethodsincellandmolecularbiology,canerandwalker编著,academicpress,london(1987);handbookofexperimentalimmunology,第i至iv卷,d.m.weirandc.c.blackwell编著,(1986);manipulatingthemouseembryo,coldspringharborlaboratorypress,coldspringharbor,n.y.,(1986);以及在ausubel等,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,maryland(1989)中。抗体工程的一般原理列举在antibodyengineering,第2版,c.a.k.borrebaeck编著,oxforduniv.press(1995)中。蛋白质工程的一般原理列举在proteinengineering,apracticalapproach,rickwood,d.等编著,irlpressatoxforduniv.press,oxford,eng.(1995)中。抗体和抗体-半抗原结合的一般原理列举在以下:nisonoff,a.,molecularimmunology,第2版,sinauerassociates,sunderland,ma(1984);和steward,m.w.,antibodies,theirstructureandfunction,chapmanandhall,newyork,ny(1984)。另外,本领域已知并且没有确切描述的免疫学方面的标准方法通常根据如下参考文献中:currentprotocolsinimmunology,johnwiley&sons,newyork;stites等(编著),basicandclinical-immunology(第8版),appleton&lange,norwalk,ct(1994)以及mishell和shiigi(编著),selectedmethodsincellularimmunology,w.h.freemanandco.,newyork(1980)。列举免疫学的一般原理的标准参考工作包括currentprotocolsinimmunology,johnwiley&sons,newyork;klein,j.,immunology:thescienceofself-nonselfdiscrimination,johnwiley&sons,newyork(1982);kennett,r.等编著,monoclonalantibodies,hybridoma:anewdimensioninbiologicalanalyses,plenumpress,newyork(1980);campbell,a.,“monoclonalantibodytechnology”inburden,r.等编著,laboratorytechniquesinbiochemistryandmolecularbiology,第13期,elsevere,amsterdam(1984),kubyimmunnology第4版.编著richarda.goldsby,thomasj.kindtandbarbaraa.osborne,h.freemand&co.(2000);roitt,i.,brostoff,j.andmaled.,immunology第6版london:mosby(2001);abbasa.,abul,a.和lichtman,a.,cellularandmolecularimmunology第5版,elsevierhealthsciencesdivision(2005);kontermann和dubel,antibodyengineering,springerverlan(2001);sambrook和russell,molecularcloning:alaboratorymanual.coldspringharborpress(2001);lewin,genesviii,prenticehall(2003);harlow和lane,antibodies:alaboratorymanual,coldspringharborpress(1988);dieffenbach和dveksler,pcrprimercoldspringharborpress(2003)。实施例常规方法的详述(如本文采用的那些)可以在所引用的参考文献中找到。除非以下另外指出,否则已经或可以如在出版为wo2008/081008的国际申请pct/ep2008/000053和出版为wo2010/069603的国际申请pct/ep2009/009186的实施例和补充方法部分中所描述进行α-共核蛋白特异性b细胞的鉴定和展现出感兴趣的特异性以及它们的重组表达和功能特征的α-共核蛋白抗体的分子克隆,所述国际申请的公开内容以引用的方式整体并入本文。实施例1:当在过表达人α-共核蛋白的转基因小鼠中12f4施用时剂量依赖型的人α-共核蛋白血浆脉冲本实施例描述了确定注射12f4抗体后的在过表达人α-共核蛋白的转基因小鼠中的小鼠血浆中的人α-共核蛋白水平。过表达人野生型(wt)α-共核蛋白(pdgfβ-h[wt]α-共核蛋白;即,d系;masliah等,science,287(5456):1265-9(2000))的三个半月大的转基因小鼠被腹膜内注射单一剂量的0mg/kg、0.3mg/kg、1mg/kg、3mg/kg、10mg/kg或30mg/kg12f4抗体。当共转染到ig重链表达载体和κ或λig轻链表达载体的cho细胞(或人或小鼠来源的任何其它适当的受体细胞系)中时获得功能重组的单克隆抗体12f4和嵌合12f4。随后使用如在wo2008/081008中所描述的标准蛋白质a柱纯化从条件培养基纯化重组单克隆抗体。可以使用短暂地或稳定地转染细胞产生不限数量的重组人单克隆抗体。嵌合12f4抗体在调节至人可变重链和轻链的种系(gl)序列的ig可变区的n-末端上具有引物诱导的突变(参见wo2010/069603),并且表达为嵌合分子,其中调节的人可变结构域融合至小鼠igg2a恒定区。在具有自由获得食物和水的反转12h:12h光照/黑暗循环的标准居住条件下保持d系转基因α-共核蛋白小鼠。均衡治疗组的年龄和性别。注射24小时后,制备血浆样品并且通过夹心elisa(invitrogen,usa)确定人α-共核蛋白的血浆浓度。以1:4稀释血浆样品,并且在稀释缓冲液中制备具有野生型小鼠的1:4血浆标准物。控制用于12f4抗体对elisa读数的影响的结果。使用作为标准的已知浓度的重组12f4,通过人fcg捕获elisa来确定12f4抗体血浆水平。在含有来自野生型小鼠的稀释的血浆的pbs中制备标准物。当与媒介物对照比较时,在单一剂量的1mg/kg、3mg/kg、10mg/kg或30mg/kg12f4抗体之后人α-共核蛋白的血浆水平显著增加。血浆人α-共核蛋白的增加是显著地剂量依赖型(图1a至图1b)。在仅用媒介物治疗的小鼠中检测不到显著水平的人α-共核蛋白(图1b)。实施例2:α-共核蛋白血浆脉冲的时程和12f4血浆浓度本实施例描述了随时间测量的过表达人α-共核蛋白的转基因小鼠中的小鼠血浆中的人α-共核蛋白水平和12f4抗体水平的变化的时程。过表达人α-共核蛋白a53t(prp-h[a53t]α-共核蛋白](giasson等,neuron,34:521-533(2001))的八个月大转基因小鼠被腹膜内注射单一剂量的5mg/kg12f4抗体,并且注射后在时间点0小时、1小时、24小时、72小时和168小时下收集血浆样品。通过如在实施例1中所描述的elisa定量血浆人α-共核蛋白。图2示出已在1小时时间点下的血浆人α-共核蛋白峰,并且然后随时间衰退。另一方面,在24小时时间点下发现12f4抗体的最高水平,并且12f4血浆水平看起来似乎比人α-共核蛋白水平衰退更慢。实施例3:急性高剂量12f4治疗过表达人α-共核蛋白的转基因小鼠减少了与血浆人α-共核蛋白水平相关的脑人α-共核蛋白水平本实施例描述了确定在用12f4抗体注射之后的脑样品中的人α-共核蛋白水平。过表达人野生型α-共核蛋白(pdgfβ-h[wt]α-共核蛋白;d-系)的三个半月大转基因小鼠在8天内(第一次注射后72小时、144小时和192小时)被腹膜内注射四个50mg/kg剂量的12f4抗体。在最后注射之后的24小时,处死动物并且用pbs灌注。使皮层和海马均质在pbs中并且通过差速离心制备可溶(pbs-可溶)和不可溶(pbs-不可溶)脑部分。确切来说,去除脑,在-80℃下解剖并且冷冻。使用杜恩斯匀浆器(500rpm,30冲程)使冷冻的脑组织均质在10体积(v/w)的pbs中,并且超声处理1min。通过在5000g下离心5min(4℃)来去除细胞碎片。在35000rpm(ti51转子;beckman-coulter)下将上清液(sn)离心1小时(4℃)。所得到的sn命名为可溶部分。将沉淀重新悬浮在1%tritionpbs中并且超声处理(3×1min)。这个部分命名为不可溶部分。通过夹心elisa(invitrogen,usa)并且归一化至蛋白质含量来定量这两个部分中的人α-共核蛋白水平。如在图3a中所示,12f4治疗的小鼠的皮层可溶人α-共核蛋白水平显著减少34%(针对12f4190±29μg/g与针对媒介物对照288±36μg/g,n=10,p<0.05,student’s测试)。类似地,在急性12f4治疗之后观察到可溶海马人α-共核蛋白(图3b)-(针对12f4119±22μg/g与针对媒介物对照178±30μg/g,n=9-10,p=0.14,student’s测试)减少33%,并且不可溶海马人α-共核蛋白(图3c)-(针对12f423±3μg/g与针对媒介物对照31±6μg/g,n=9-10,p=0.29,student’s测试)减少26%。这些结果示出用12f4的短治疗引起过表达人α-共核蛋白的转基因小鼠中的脑α-共核蛋白病理减少。为了看出所观察的人α-共核蛋白血浆上升是否与脑α-共核蛋白病理关联,针对脑人α-共核蛋白水平绘制血浆人α-共核蛋白水平的曲线图。在急性12f4治疗之后,血浆人α-共核蛋白水平和可溶皮层人α-共核蛋白水平(图4a)与可溶海马人α-共核蛋白水平(图4b)和不可溶海马人α-共核蛋白水平(图4c)之间存在高度显著的相关性。当媒介物治疗时,观察不到血浆α-共核蛋白与脑α-共核蛋白之间的相关性。实施例4:慢性12f4治疗过表达人α-共核蛋白的转基因小鼠之后的血浆人α-共核蛋白水平与脑人α-共核蛋白水平之间的相关性本实施例描述了确定在用12f4抗体每周注射持续六个月之后的脑样品中的人α-共核蛋白水平。过表达人野生型α-共核蛋白a30p(thy1-h[a30p]-α-共核蛋白)(kahle等,amjpathol.,159(6):2215-2225(2001))的六个月大转基因小鼠每周被腹膜内注射10mg/kg嵌合12f4,持续6个月。在最后注射之后的24小时制备血浆样品和脑样品。在pbs中使皮层/海马一起均质并且通过如实施例3中所描述的差速离心制备可溶(pbs-可溶)和不可溶(pbs-不可溶)脑部分。通过如在实施例3中所描述的elisa并且归一化至蛋白质含量来定量这两个部分中的人α-共核蛋白水平。通过elisa确定血浆人α-共核蛋白水平(图5a)和嵌合12f4水平(图5b)。如在实施例1中所描述测定血浆人α-共核蛋白水平,并且使用直接α-共核蛋白elisa,使用作为标准已知浓度的重组嵌合12f4来确定嵌合12f4血浆水平。为了看出当用嵌合12f4慢性治疗时血浆α-共核蛋白和脑α-共核蛋白是否相关,针对人脑α-共核蛋白水平绘制血浆人α-共核蛋白水平的曲线图。在用嵌合12f4慢性治疗过表达人α-共核蛋白的转基因小鼠六个月之后,在血浆α-共核蛋白水平与脑α-共核蛋白水平之间存在显著相关性。(图5c)。实施例5:当在食蟹猴中12f4施用时的α-共核蛋白脑脊髓液(csf)脉冲本实施例描述了确定当12f4施用时食蟹猴的血清和脑脊髓液(csf)中的12f4水平以及csf中的内源α-共核蛋白水平。用单一剂量的10mg/kg12f4静脉内注射三只雄性幼稚食蟹猴。在12f4施用之前1至12分钟使动物禁食,并且用于给药后2小时csf样品收集。在给药后0.5小时、2小时、5小时、24小时、48小时、72小时、96小时、168小时、240小时、336小时、408小时、504小时、672小时和840小时下从股静脉/动脉收集血液样品(大约0.5ml/样品)。允许样品凝结至少30分钟,并且在每个时间间隔下完成样品收集之后在环境条件下离心。分离所得到的血清并且在-50℃至-90℃下冷冻储存直到运送在干冰上用于分析。通过夹心elisa(covance)来确定12f4血清水平。还通过elisa(covance)在给药后的各种时间点下从小脑延髓池收集的csf样品中确定12f4浓度和内源α-共核蛋白浓度。在csf样品收集之前,用肌肉内(im)注射0.1mg/kg乙酰丙嗪马来酸盐(如果必要的话用额外的维持剂量)使动物镇静。用im注射20mg/kg氯胺酮诱导麻醉。刮剃头部背面用于进入小脑延髓池,并且用无菌领域内的氯己定擦洗和氯己定溶液制备进入部位。将动物放在侧卧的位置上,并且使头向前直到下巴停靠在胸上。使用无菌技术,套在针上的导管用来进入小脑延髓池。在每天的样品收集上每日三次,大约每6至9小时对动物im施用0.01mg/kg丁丙诺啡(在csf收集之前开始)。麻醉和csf取样之后,在恢复生理病害的过程中密切监测动物,所述生理病害包括心血管/呼吸下降、体温过低以及从手术部位过量出血。在给药后的2小时、24小时、72小时、168小时、336小时、504小时和672小时下从小脑延髓池收集csf样品(大约0.2ml/样品),并且放在冰上。在-50℃至-90℃下冷冻储存样品直到运送在干冰上用于分析。如对于人igg抗体所期望,csf/血清12f4比率是大约0.1%。当12f4治疗时,csfα-共核蛋白增加约5倍。(图6)。实施例6:转基因α-共核蛋白小鼠中的体内微量透析本实施例描述了确定当在转基因α-共核蛋白a53t小鼠中12f4施用时的血浆和脑组织间隙流体(isf)中的α-共核蛋白水平。当施用12f4或媒介物对照(对照igg抗体)时,进行了转基因α-共核蛋白小鼠isf中的体内微量透析。确切来说,在异氟烷麻醉(4%至2.5%)下,在6至9个月大a53tα-共核蛋白转基因小鼠(b6;c3-tg(prp-snca*a53t)83vle/j)的纹状体中立体定向植入引导插管。刮剃头部并且用无菌解剖刀切开皮肤以暴露颅骨。在根据paxinos和franklin的寰椎的右纹状体之上进行钻孔(themousebraininstereotaxiccoordinates,第二版(2004))(坐标,ap=+0.5mm,ml=-2.2mm,dv=-2.4mm)。插入cma-12引导插管(cmamicrodialysisab,sweden)并且用不锈钢螺丝和牙粘固粉固定至颅骨。将小鼠从立体定位装置移开并且允许在单独的笼子中恢复。手术后五天,将小鼠移开至一个或多个微量透析笼子。插入cma-12定做的探针(2mm,100kda截留)并且连接至具有0.6μl/min恒定流速的cma泵。在含有bsa作为渗透剂的人工csf中进行灌注。在样品收集之前,允许探针用相同流速平衡4至20小时。通常每两小时收集基线样品,持续2小时。以单一剂量的30mg/kg腹膜内注射12f4或媒介物对照。当注射时,每小时收集样品持续大约24小时。使用冷藏的部分收集器收集所有样品并且在-80℃下储存直到通过室内紫外敏感的α-共核蛋白夹心elisa(emmanouilidou等,plosone6(7):e22225(2011))分析。也在给药前和在给药后2小时和24小时下收集血浆样品,并且然后通过人α-共核蛋白特异性的夹心elisa(invitrogen,carlsbadca)分析。在12f4施用后2至3小时,存在细胞外的isfα-共核蛋白减少大约60%。媒介物对照没有改变微量透析液中的isfα-共核蛋白水平。(图7)。实施例7:抗α-共核蛋白抗体对aav-α-共核蛋白大鼠模型中的脑脊髓液(csf)α-共核蛋白浓度的作用将在腺相关病毒(aav)-α-共核蛋白大鼠模型中评价抗α-共核蛋白抗体对csfα-共核蛋白浓度的作用。aav载体将被形成表达野生型人α-共核蛋白或与家族性帕金森氏病相关的人α-共核蛋白序列变体之一(例如,a53t或a30p)。aav-α-共核蛋白载体将被注射到成年大鼠脑的具体区域(例如,纹状体、皮层或海马)中或注射到新生大鼠的侧脑室中。一至数个月的周期将允许人α-共核蛋白的浓度在脑中增加。在此时,将通过腹膜内或静脉内施用来用抗α-共核蛋白抗体治疗大鼠,并且将在各种时间下取得csf的样品。将通过elisa在csf样品中测量α-共核蛋白的浓度。***本公开不限于所描述的具体实施方案的范围,所述具体实施方案旨在作为单一说明本公开的单独方面,并且功能上等效的任何组合物或方法处于本公开的范围内。确实,除了本文示出和描述的那些之外,根据以上描述和所附附图,本公开的各种修改将对于本领域技术人员而言变得显而易见。此类修改旨在处于所附权利要求书的范围内。在本说明书中提到的所有出版物和专利申请以引用的方式并入本文,其程度如同具体地和单独地指出每个单独的出版物或专利申请以引用的方式并入。序列表<110>生物国际神经系统科学公司a·魏霍芬t·恩格贝尔j·格林姆<120>抗α-共核蛋白抗体诊断脑中的α-共核蛋白的升高水平的用途<130>2159.356pc01<140>tobeassigned<141>herewith<150>61/554,924<151>11-02-2011<160>9<170>patentinversion3.5<210>1<211>140<212>prt<213>homosapiens<220><223>alpha-synuclein<400>1metaspvalphemetlysglyleuserlysalalysgluglyvalval151015alaalaalaglulysthrlysglnglyvalalaglualaalaglylys202530thrlysgluglyvalleutyrvalglyserlysthrlysgluglyval354045valhisglyvalalathrvalalaglulysthrlysgluglnvalthr505560asnvalglyglyalavalvalthrglyvalthralavalalaglnlys65707580thrvalgluglyalaglyserilealaalaalathrglyphevallys859095lysaspglnleuglylysasnglugluglyalaproglngluglyile100105110leugluaspmetprovalaspproaspasnglualatyrglumetpro115120125serglugluglytyrglnasptyrgluprogluala130135140<210>2<211>113<212>prt<213>artificialsequence<220><223>heavychainvariableregion(vh)<400>2gluvalglnleuvalglnserglyglyglyleuvalgluproglygly151015serleuargleusercysalavalserglypheasppheglulysala202530trpmetsertrpvalargglnalaproglyglnglyleuglntrpval354045alaargilelysserthralaaspglyglythrthrsertyralaala505560provalgluglyargpheileileserargaspaspserargasnmet65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrseralahistrpglyglnglythrleuvalthrvalser100105110ser<210>3<211>108<212>prt<213>artificialsequence<220><223>lightchainvariableregion(vl)<400>3glnservalleuthrglnproproservalservalserproglygln151015thralaargilethrcysserglyglualaleuprometglnpheala202530histrptyrglnglnargproglylysalaprovalilevalvaltyr354045lysaspsergluargproserglyvalprogluargpheserglyser505560serserglythrthralathrleuthrilethrglyvalglnalaglu65707580aspglualaasptyrtyrcysglnserproaspserthrasnthrtyr859095gluvalpheglyglyglythrlysleuthrvalleu100105<210>4<211>5<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-1(vhcdr1)<400>4lysalatrpmetser15<210>5<211>19<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-2(vhcdr2)<400>5argilelysserthralaaspglyglythrthrsertyralaalapro151015valglugly<210>6<211>2<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-3(vhcdr3)<400>6alahis1<210>7<211>11<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-1(vlcdr1)<400>7serglyglualaleuprometglnphealahis1510<210>8<211>7<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-2(vlcdr2)<400>8lysaspsergluargproser15<210>9<211>11<212>prt<213>artificialsequence<220><223>complementaritydeterminingregion-3(vlcdr3)<400>9glnserproaspserthrasnthrtyrgluval1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1