抗病原物质的浓度的测定方法与流程
本发明涉及生物
技术领域:
,尤其是涉及一种抗病原物质的浓度的测定方法。
背景技术:
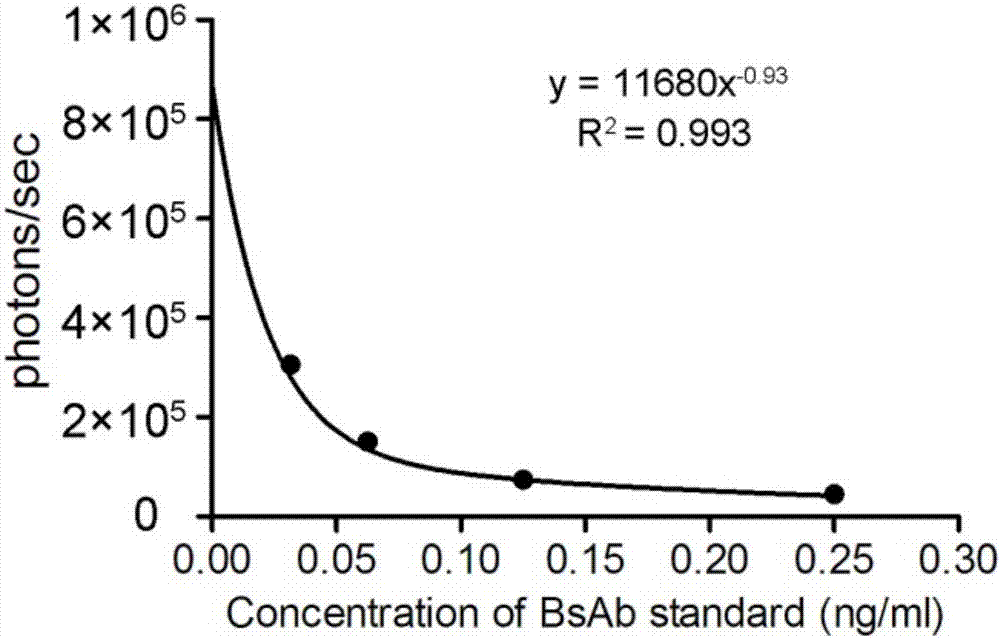
:1897年,paulehrlich首次提出靶向病原相关抗原的抗体可以用来治疗疾病。抗体药物在治疗疾病上具有广阔的应用前景,成功用于治疗肿瘤、自身免疫疾病和感染性疾病等。上世纪60年代,众多肿瘤组织/细胞特异性抗原被发现,肿瘤相关抗原成为肿瘤治疗的研究热点,也成为抗肿瘤抗体药物发开的重要靶点。抗体药物质量控制是研发和生产环节不可忽视的部分,而抗体浓度测定,是质量控制中最重要的环节之一。目前对于抗体药物而言,浓度的测定方法主要有以下几种:酶联免疫吸附法(elasa)、紫外吸收法、蛋白a亲和高效液相色谱法(proteina-hplc)等。其中,elisa指将可溶性的抗原或抗体吸附到聚苯乙烯等固相载体上,进行免疫反应的定性和定量方法。elisa方法灵敏度高,对仪器要求低,可测定的样本广泛(包括血清、分泌物、排泄物等),但是实验用时较长,操作复杂,方法误差大,线性范围窄,适合用于微量样品检测。紫外吸收法是指蛋白质分子中某些基团含有共轭双键,使蛋白质具有吸收紫外光的性质。吸收峰在280nm处,而且其吸光度和蛋白质含量成正比。紫外吸收法检测样品快速、灵敏,但需要蛋白纯度较高,检测线性范围窄,且杂蛋白和核酸的存在会干扰检测结果,对样品纯度和样品种类有要求。蛋白a亲和液相色谱法使通过蛋白a结合抗体fc段,在低ph值或者高ph值条件下洗脱,从而获得抗体浓度。蛋白a亲和液相色谱法可特异性检测抗体含量,结果准确,线性范围广,但检测用时长,对样品基质要求比较高,较适合用于抗体纯化样品和制剂样品的含量测定。因此,开发一种实验用时短、操作简单、误差小、对样品纯度和样品种类无要求的浓度检测方法,尤为重要。有鉴于此,特提出本发明。技术实现要素:本发明的目的在于提供一种抗病原物质的浓度的测定方法,以缓解现有技术中存在的抗病原物质的浓度的测定方法实验用时长、操作复杂、易受干扰误差大、对样品纯度和样品种类要求较高的技术问题。本发明提供了一种抗病原物质的浓度的测定方法,所述测定方法包括:将抗病原物质的标准品和待测样品分别与靶向病原共培养1-12小时,检测所述靶向病原的存活率,根据所述待测样品中的靶向病原存活率对应所述标准品中的靶向病原存活率,得出所述抗病原物质的待测样品的浓度。进一步地,所述抗病原物质包括抗肿瘤物质或抗微生物物质,所述靶向病原包括肿瘤或微生物。进一步地,所述抗病原物质包括抗病原抗体或抗病原小分子药物。进一步地,所述抗病原抗体为双靶向抗病原抗体。进一步地,当所述抗病原物质为抗病原抗体时,所述共培养包括将所述抗病原抗体的标准品和t细胞、抗病原物质的待测样品和t细胞分别与靶向病原共培养。进一步地,所述靶向病原与所述t细胞的数量比为1:1-1:15。进一步地,所述靶向病原带有荧光标记,通过测定所述靶向病原的荧光值检测所述靶向病原的存活率。进一步地,所述荧光标记为荧光素酶标记;优选地,所述靶向病原稳定转染荧光素酶基因。进一步地,所述抗病原物质的标准品为经过梯度稀释的标准品。进一步地,根据所述梯度稀释的标准品的浓度对应的荧光值建立标准曲线。本发明提供的抗病原物质的浓度的测定方法,将抗病原物质的标准品和待测样品分别与靶向病原共培养后,检测靶向病原的存活率,根据待测样品中的靶向病原存活率对应标准品中的靶向病原存活率,得出抗病原物质的待测样品的浓度。该方法是基于抗病原物质对靶向病原的杀伤特性,通过靶向病原的存活率推算待测样品中抗体的浓度,具有不受样品中杂蛋白和核酸的影响,误差小,而且灵敏度高,最低检测限可低至10pg/ml的优点。同时,该测定方法实验操作简单,用时短,可以在数小时内完成。并且,实验过程只需要靶向病原培养步骤,不需要购买试剂盒或者其他生化试剂,安全性高,不会给实验操作人员带来安全隐患。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明实施例1提供的梯度稀释的抗cd3/cd20样品标准品的荧光检测结果图;图2为本发明实施例1提供的梯度稀释的抗cd3/cd20样品标准品的标准曲线;图3为本发明实施例1提供的作用不同时间的待测样品的荧光检测结果图;图4为本发明实施例1提供的不同时间的小鼠血清内抗cd3/cd20抗体浓度变化曲线;图5为本发明实施例2提供的梯度稀释的抗cd3/epcam样品标准品的荧光检测结果图;图6为本发明实施例2提供的梯度稀释的抗cd3/epcam样品标准品的标准曲线;图7为本发明实施例2提供的作用不同时间的待测样品的荧光检测结果图;图8为本发明实施例2提供的不同时间的小鼠血清内抗cd3/epcam抗体浓度变化曲线;图9为本发明实施例3提供的梯度稀释的抗hu多克隆抗体标准品的标准曲线;图10为本发明实施例3提供的不同时间的抗hu多克隆抗体浓度变化曲线;图11为本发明实施例4提供的梯度稀释的人免疫球蛋白甲肝抗体标准品的标准曲线;图12为本发明实施例4提供的不同时间的人免疫球蛋白甲肝抗体浓度变化曲线;图13为本发明实施例5提供的梯度稀释的四氢异喹啉标准品的标准曲线;图14为本发明实施例5提供的不同时间的四氢异喹啉浓度变化曲线。具体实施方式下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。根据本发明的一个方面,提供了一种抗病原物质的浓度的测定方法,该方法包括:将抗病原物质的标准品和待测样品分别与靶向病原共培养1-12小时,检测靶向病原的存活率,根据待测样品中的靶向病原存活率对应标准品中的靶向病原存活率,得出抗病原物质的待测样品的浓度。本发明提供的抗病原物质的浓度的测定方法,是基于抗病原物质对靶向病原的杀伤特性,当待测样品中的靶向病原存活率与标准品中的靶向病原存活率相同时,说明待测样品的浓度与标准品的浓度相同,即通过已知的标准品的浓度对应得出待测样品的浓度。其中,靶向病原为抗病原物质能够特异性杀伤、杀灭的病原,或者为抗病原物质能够特异性抑制其生长繁殖的病原。该方法不受待测样品中其他成分的影响,检测范围广,待测样品例如可以为,但不限于抗病原物质的水溶液、盐溶液、细胞培养基、微生物培养基、体液、分泌物或排泄物。只要待测样品中不含有影响靶向病原存活率、能够特异性介导靶向病原凋亡的成分,都可以用此方法进行的抗体浓度测定。同时,该方法灵敏度高,检测限最低为10pg/ml,可根据样品浓度调节检测范围,对高浓度和低浓度样品均测定准确,误差小。并且,该测定方法实验操作简单,用时短,可以在数小时内完成。实验过程只需要病原培养步骤,不需要购买试剂盒或者其他生化试剂,安全性高,不会给实验操作人员带来安全隐患。其中,共培养的时间可根据抗病原物质的待测样品对靶向病原的杀伤强度进行调整,具有方法灵活,普适性广的优点。共培养的时间例如可以为,但不限于1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时或12小时。通过调节抗病原物质与靶向病原的共培养时间,可以调整抗病原物质对靶向病原的杀伤程度。若共培养时间少于1小时,则靶向病原没有明显损伤;若共培养时间多于12小时,则靶向病原全部死亡,不同浓度抗病原物质的作用体现不出明显差别,影响测定结果的准确性。并且,可调节的共培养时间为实验带来了灵活性。高浓度的抗病原物质可选择短时间孵育,低浓度抗原物质可选择长时间孵育。在一个优选的实施方式中,共培养的时间为2-10小时。当共培养的时间为2-10小时时,抗病原物质对靶向病原的杀伤程度适中,既对靶向病原造成明显的损伤,又不会导致大量的靶向病原的死亡,不同浓度抗病原物质对靶向病原的作用差别明显,能够保证测定结果的准确性。在一个更优选的实施方式中,共培养的时间为4小时。当共培养的时间为4小时时,抗病原物质对靶向病原的杀伤程度最适宜,既对靶向病原造成明显的损伤,又不会导致大量的靶向病原的死亡,不同浓度抗病原物质对靶向病原的作用差别明显,测定结果的准确性最优。典型的抗病原物质可以为对靶向病原具有杀伤、杀灭作用的物质,或抑制靶向病原生长繁殖的物质。在一个优选的实施方式中,抗病原物质包括抗肿瘤物质或抗微生物物质。其中,肿瘤例如可以为,但不限于淋巴瘤、卵巢癌、肝癌、肺癌、胃癌或乳腺癌;微生物例如可以为,但不限于病毒、细菌、真菌、衣原体或支原体。对应的靶向病原可以为肿瘤或微生物。其中,肿瘤例如可以为,但不限于淋巴瘤、卵巢癌、肝癌、肺癌、胃癌或乳腺癌;微生物例如可以为,但不限于病毒、细菌、真菌、衣原体或支原体。在一个优选的实施方式中,抗病原物质包括抗病原抗体或抗病原小分子药物。典型的抗病原抗体例如可以为,但不限于单克隆抗体、多克隆抗体、单靶向抗体、双靶向抗体或天然抗体。典型的抗病原小分子药物可以为化学合成的小分子药物,例如可以为,但不限于多西紫杉醇、顺铂类药物或布洛芬。在一个优选的实施方式中,抗病原抗体为双靶向抗病原抗体。其中,双靶向抗病原抗体例如可以为,但不限于抗cd3/cd20抗体或抗cd3/epcam抗体,cd3/her2抗体,cd3/cmet抗体,cd3/muci1抗体。在另一个优选的实施方式中,抗病原物质为抗病原抗体,共培养包括将抗病原抗体的标准品和t细胞、抗病原物质的待测样品和t细胞分别与靶向病原共培养。在一个更优选的实施方式中,抗病原抗体为双靶向t细胞连接抗病原抗体(bite,bispecifictcellengager)。双靶向t细胞连接抗病原抗体的一条臂与免疫效应t细胞上的表位相结合,而另一条臂连接靶向病原,以引导并激活t细胞对靶向病原的杀伤作用。典型但非限制性的测定抗病原物质的浓度的实施方式为:将靶向病原、t细胞、抗病原抗体标准品与待测样品至于37℃,5%co2中进行共培养,分组如下:分组靶向病原t细胞抗病原抗体标准品待测样品1+---2++--3+++-4++-+其中,靶向病原与t细胞的数量比为1:1-1:15,例如可以为,但不限于1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14或1:15。根据靶向病原的种类不同选择相应的靶向病原与t细胞的数量比,达到抗病原抗体对靶向病原杀伤作用明显的目的,以便于观测共培养后的靶向病原存活率,测定抗病原抗体的待测样品的浓度。在一个优选的实施方式中,靶向病原带有荧光标记,通过测定靶向病原的荧光值检测靶向病原的存活率。建立或购买稳定转染荧光标记的肿瘤细胞,通过光学成像即可了解细胞存活状态,荧光强度越强,表示细胞存活率越高,操作简单,便于观测,结果准确。优选地,荧光标记为荧光素酶(luciferase)标记。优选地,靶向病原稳定转染荧光素酶基因。在一个优选的实施方式中,抗病原物质的标准品为经过梯度稀释的标准品。梯度稀释例如可以为,但不限于10倍稀释、5倍稀释或2倍稀释。例如,测定低浓度待测样品时,可将标准品进行2倍的梯度稀释,测定高浓度待测样品时,可将标准品进行10倍的梯度稀释。根据样品浓度调节检测范围,当测定低浓度样品时,低倍数稀释,能够保证测定结果的准确性,当测定高浓度样品时,高倍数稀释,能够保证测量全面。因此,对高浓度和低浓度样品均测定准确,误差小。在一个优选的实施方式中,根据梯度稀释的标准品的浓度对应的荧光值建立标准曲线。加入荧光素底物后,将培养板置于光学成像系统置物台上,进行荧光检测。根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,荧光值为纵坐标画曲线,拟合标准曲线。根据标准曲线,用样品孔的荧光值推导待测样品的抗体浓度。如果待测样品浓度超出标准曲线检测范围,可通过调整靶向病原数量、共培养时间等重新规划标准曲线,或者可稀释或者浓缩待测样品。本发明提供的测定方法操作简单,只需要将梯度稀释的标准品和待测样品与靶向病原共培养,数小时后用成像仪测得光强度,绘制光强度与标准品浓度的标准曲线,并得到关系方程。再将测得的待测样品的光值代入关系方程,计算即可得到待测样品的浓度。为了有助于更清楚的理解本发明,下面将结合实施例和对比例对本发明的技术方案进行进一步地说明。如未明确指出,以下实施例中所使用的细胞培养基为dmem高糖培养基,购自sigma-aldrich中国;t细胞由志愿者抽血分离获得;raji细胞购自上海乐辰生物科技有限公司,skov3细胞购自中国科学院上海生命科学研究院细胞资源中心;抗cd3/cd20样品标准品购自苏州泓迅生物科技股份有限公司,抗cd3/epcam样品标准品购自苏州泓迅生物科技股份有限公司。实施例1测定nod/scid小鼠血清中抗cd3/cd20双靶向抗体浓度本实施例选用稳定转染荧光素酶的raji细胞作为待杀伤靶向病原。raji细胞是表面cd20阳性肿瘤细胞,因此,在t细胞存在的情况下,抗cd3/cd20双靶向抗体对raji细胞有杀伤作用。待测样品来自nod/scid小鼠血清,将老鼠通过眼眶取血,离心10000转,5分钟得到血清。分组如下表所示:分组raji细胞t细胞抗cd3/cd20样品标准品待测样品1+---2++--3+++-4++-+具体操作如下:步骤(a):将8×104个肿瘤细胞与3.2×105个t细胞分别或者一起铺在96孔培养板中,置于37℃,50%co2培养箱中培养4小时。步骤(b):以pbs作为对照,抗cd3/cd20标准品2倍稀释,得到一系列浓度不同的标准品,分别为0.25ng/ml、0.125ng/ml、0.0625ng/ml和0.03125ng/ml,用于得到标准曲线。取实验小鼠注射raji细胞,在注射后的1天、3天、7天、15和30天后分别取血,离心得到血清,将20ml血清加入180ml培养基中进行10倍稀释,得到待测样品稀释液。取梯度稀释的标准品加入96孔培养板中,置于37℃,50%co2培养箱中培养12小时。取与标准品体积相同的待测样品稀释液加入96孔培养板中,置于37℃,50%co2培养箱培养12小时。步骤(c):加入100×d-luciferase荧光素底物作用5min后,将96孔培养板置于ivis置物台上,进行荧光检测,得到荧光值。梯度稀释的标准品的荧光检测结果如图1所示,作用不同时间的待测样品的荧光检测结果如图3所示。步骤(d):根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,荧光值为纵坐标画曲线,拟合标准曲线。标准曲线如图2所示。步骤(e):根据步骤(d)得到的标准曲线,将测得的待测样品孔中荧光值代入,得出待测样品的抗体浓度。在本实施例中,标准曲线方程为y=11680x0.93,r2=0.993,以抗体作用时间为横坐标,测得的待测样品浓度为纵坐标绘制不同时间的小鼠血清内抗cd3/cd20抗体浓度变化曲线,结果如图4所示。实施例2测定nod/scid小鼠血清中抗cd3/epcam双靶向抗体浓度本实施例选用稳定转染荧光素酶的skov3细胞作为待杀伤靶向病原。skov3细胞是表面epcam阳性肿瘤细胞,因此,在t细胞存在的情况下,抗cd3/epcam双靶向抗体对skov3细胞有杀伤作用。待测样品来自nod/scid小鼠血清,将老鼠通过眼眶取血,10000转,5分钟离心得到血清。分组如下表所示:分组skov3细胞t细胞抗cd3/epcam样品标准品待测样品1+---2++--3+++-4++-+具体操作如下:步骤(a):将8×104个肿瘤细胞与8×105个t细胞分别或者一起铺在96孔培养板中,置于37℃,50%co2培养箱中培养12小时。步骤(b):以pbs作为对照,抗cd3/epcam标准品2倍稀释,得到一系列浓度不同的标准品,分别为100ng/ml、50ng/ml、25ng/ml、12.5ng/ml、6.25ng/ml和3.125ng/ml,用于得到标准曲线。取实验小鼠注射skov3细胞细胞,在注射后的8小时、24小时、48小时、96小时和144小时后分别眼眶取血,离心得到血清,将20ml血清加入180ml培养基中进行10倍稀释,得到待测样品稀释液。取梯度稀释的标准品加入96孔培养板中,置于37℃,50%co2培养箱中培养12小时。取与标准品体积相同的待测样品稀释液加入96孔培养板中,置于37℃,50%co2培养12小时。步骤(c):加入100×d-luciferase荧光素底物作用5min后,将96孔培养板置于ivis置物台上,进行荧光检测,得到荧光值。梯度稀释的标准品的荧光检测结果如图5所示,作用不同时间的待测样品的荧光检测结果如图7所示。步骤(d):根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,细胞活力值为纵坐标画曲线,拟合标准曲线。标准曲线如图6所示。步骤(e):根据步骤(d)得到的标准曲线,将测得的待测样品孔中细胞活力值代入,得出待测样品的抗体浓度。在本实施例中,标准曲线方程为y=56.304x-0.82,r2=0.9988,以抗体作用时间为横坐标,测得的待测样品浓度为纵坐标绘制不同时间的小鼠血清内抗cd3/epcam抗体浓度变化曲线,结果如图8所示。实施例3测定抗hu多克隆抗体的浓度本实施例选用稳定转染荧光素酶的金黄色葡萄球菌作为待杀伤靶向病原。靶向金黄色葡萄球菌dna结合蛋白hu的多克隆抗体能够抑制金黄色葡萄球菌的生物膜的形成,因此,对金黄色葡萄球菌有杀伤作用。分组如下表所示:分组金黄色葡萄球菌抗hu多克隆抗体标准品待测样品1+--3++-4+-+具体操作如下:步骤(a):取金黄色葡萄球菌单菌落接种至2mlbhi培养基中,37℃,220r/min分别培养3小时、6小时、9小时和12小时作为待测样品。步骤(b):以pbs为对照,抗hu多克隆抗体标准品5倍稀释,得到一系列浓度不同的标准品,分别为75μg/ml、15μg/ml、3μg/ml和0.6μg/ml,用于得到标准曲线。取梯度稀释的标准品加入96孔培养板中,置于37℃,培养4.5小时。取与标准品体积相同的待测样品菌液加入96孔培养板中,置于37℃,培养4.5小时。步骤(c):加入100×d-luciferase荧光素底物作用5min后,将96孔培养板置于ivis置物台上,进行荧光检测,得到荧光值。步骤(d):根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,荧光值为纵坐标画曲线,拟合标准曲线。标准曲线如图9所示。步骤(e):根据步骤(d)得到的标准曲线,将测得的待测样品孔中荧光值代入,得出待测样品的抗体浓度。在本实施例中,以抗体作用时间为横坐标,测得的待测样品浓度为纵坐标绘制不同时间的抗hu多克隆抗体浓度变化曲线,结果如图10所示。实施例4甲型肝炎病毒抗体的浓度本实施例选用稳定转染荧光素酶的甲型肝炎病毒作为待杀伤靶向病原。人免疫球蛋白甲肝抗体能够抑制甲型肝炎病毒的活性,因此,对甲型肝炎病毒有杀伤作用。分组如下表所示:分组甲型肝炎病毒人免疫球蛋白甲肝抗体标准品待测样品1+--3++-4+-+具体操作如下:步骤(a):取甲型肝炎病毒悬液接种至hepg2单层细胞中,37℃分别培养15分钟、30分钟、45分钟和1小时,作为待测样品。步骤(b):以pbs作为对照,人免疫球蛋白甲肝抗体稀释后得到一系列浓度不同的标准品,分别为10miu/ml、20miu/ml、30miu/ml、40miu/ml和50miu/ml,用于得到标准曲线。取梯度稀释的标准品加入96孔培养板中,置于37℃,培养1.5小时。取与标准品体积相同的待测样品稀释液加入96孔培养板中,置于37℃,培养1.5小时。步骤(c):加入100×d-luciferase荧光素底物作用5min后,将96孔培养板置于ivis置物台上,进行荧光检测,得到荧光值。步骤(d):根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,荧光值为纵坐标画曲线,拟合标准曲线。标准曲线如图11所示。步骤(e):根据步骤(d)得到的标准曲线,将测得的待测样品孔中荧光值代入,得出待测样品的抗体浓度。在本实施例中,以抗体作用时间为横坐标,测得的待测样品浓度为纵坐标绘制不同时间的人免疫球蛋白甲肝抗体浓度变化曲线,结果如图12所示。实施例5小分子药物四氢异喹啉的浓度本实施例选用稳定转染荧光素酶的ht-29结肠癌细胞作为待杀伤靶向病原。四氢异喹啉对ht-29具有杀伤作用。分组如下表所示:分组ht-29细胞四氢异喹啉标准品待测样品1+--3++-4+-+具体操作如下:步骤(a):将5×103个肿瘤细胞铺在96孔培养板中,置于37℃,50%co2培养箱分别培养3小时、6小时、9小时和12小时作为待测样品。步骤(b):以pbs作为对照,四氢异喹啉标准品2倍稀释,得到一系列浓度不同的标准品,分别为4mg/ml、8mg/ml、16mg/ml和32mg/ml,用于得到标准曲线。取梯度稀释的标准品加入96孔培养板中,置于37℃,50%co2培养箱中培养12小时。取与标准品体积相同的待测样品稀释液加入96孔培养板中,置于37℃,50%co2培养箱培养12小时。步骤(c):加入100×d-luciferase荧光素底物作用5min后,将96孔培养板置于ivis置物台上,进行荧光检测,得到荧光值。步骤(d):根据获得的荧光值,以梯度稀释的标准品的浓度为横坐标,荧光值为纵坐标画曲线,拟合标准曲线。标准曲线如图13所示。步骤(e):根据步骤(d)得到的标准曲线,将测得的待测样品孔中荧光值代入,得出待测样品的抗体浓度。在本实施例中,以抗体作用时间为横坐标,测得的待测样品浓度为纵坐标绘制不同时间的四氢异喹啉浓度变化曲线,结果如图14所示。综上所述,本发明提供的抗病原物质的浓度的测定方法是基于抗病原物质对靶向病原的杀伤特性,通过靶向病原的存活率推算待测样品中抗体的浓度,具有不受样品中杂蛋白和核酸的影响,误差小,而且灵敏度高,最低检测限可低至10pg/ml的优点。同时,该测定方法实验操作简单,用时短,可以在数小时内完成。并且,实验过程只需要靶向病原培养步骤,不需要购买试剂盒或者其他生化试剂,安全性高,不会给实验操作人员带来安全隐患。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1