一种药物筛选方法、试剂盒及其应用与流程
本发明属于生物医药技术领域,特别涉及一种药物筛选方法、试剂盒及其应用。
背景技术:
目前基于肿瘤细胞功能进行筛选的药物开发方式虽然应用较为广泛,但不能清楚的解释抑制肿瘤恶化的具体分子机制,因此该筛选方式获得的药物存在较大的产生临床副作用的可能性,临床使用时也需要较多精力就可能出现的副作用制定应对策略,造成药物的临床推广使用困难,因此该传统筛选方式具有较大的实用缺点。
此外,以单个基因或单个蛋白质为靶标进行靶向抗肿瘤药物筛选的方式具有普遍的应用实践,现有的大部分抗肿瘤药物如吉非替尼、拉帕替尼等均是基于该方式开发出的。然而大部分靶向单个基因或单个蛋白的抗癌药物在临床使用2~3个月后会出现患者临床耐药现象。研究发现,该耐药现象的出现主要是因为在药物作用的压力下,靶标基因或者蛋白会出现耐药突变,这些突变会导致该抗癌药物的药效降低或者消失,癌症患者因此不能继续依靠原来的靶向药物进行肿瘤治疗,造成治疗费用的浪费并延误宝贵的治疗时间。
免疫酶联吸附试验(elisa)是根据抗原-抗体结合的原理进行蛋白质定量的技术手段,目前在研究领域多用于分泌蛋白的检测,临床病理检测也常用该技术手段进行一些病理指标的判断。但传统的基于抗原-抗体结合的elisa手段应用领域比较简单,并不能大规模的直接用于蛋白质-蛋白质相互作用的检测。
现有的基于elisa进行的药物筛选技术均将目标蛋白质直接包埋于elisa酶标板上,这会造成因蛋白质活性位点埋进酶标板基质而无法使蛋白质相互作用的继续进行,因此得到假阴性的结果会大大增加。也有部分elisa筛选药物技术通过将目标蛋白质固定在elisa酶标板上,之后将活细胞放置在板上进行细胞膜蛋白质相互作用抑制剂的筛选,该筛选方式局限性较大,首先只能进行细胞膜蛋白相互作用的筛选,应用范围较窄;其次活细胞体外培养容易造成微生物污染,影响蛋白质相互作用的进行,继而影响筛选效果。
老药新用是在已经获得批准在临床使用的药物中寻找药物新的功能,以寻求其对其他病症例如癌症等的治疗。因其具有已知的副作用及相应应对方法,因此是进行抗肿瘤等药物筛选和发现的重要途径之一。高效大规模地在大量已知的药物中筛选出能够抑制肿瘤发生发展的药物是进行新的抗肿瘤药物发现的重要前提。传统的药物筛选方式效率低、耗时长、药物作用机制不明确,从而导致新药开发的进程变得缓慢。
因此,研究新的药物筛选系统对于抗癌药物(尤其是老药新用)的开发具有紧迫性和巨大的市场应用价值。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供一种药物筛选方法,所述的方法(superelisa)直接从肿瘤发生的具体分子机制角度出发,以蛋白质-蛋白质相互作用为靶点,创新地结合双夹心elisa技术进行构建。本发明基于抗原-抗体结合的传统elisa的原理基础上结合蛋白质纯化技术进行改良,通过制备带有肽段标签的蛋白质并进行纯化,直接利用标签肽段的抗体进行包埋反应,确保相互作用蛋白质活性位点的保持并高效率的进行靶向药物筛选,使其能够对蛋白质-蛋白质相互作用进行检测,成功以此作为药物筛选的基础进行蛋白质相互作用靶向药物的筛选;巧妙解决了直接将纯化后的蛋白质包埋于elisa酶标板上不能确保相互作用位点能够暴露出来,有可能会埋进酶标板基质中,导致无法检测到相互作用现象的存在,出现阴性结果的技术难题。
本发明的另一目的在于提供一种用于药物筛选的试剂盒。
本发明的又一目的在于提供所述的药物筛选方法或试剂盒的应用。
本发明的目的通过下述技术方案实现:
一种药物筛选方法,基于在病理机制中相互作用的第一蛋白质和第二蛋白质进行构建,包括如下步骤:
(1)通过本领域常规方式获得保持活性的第一蛋白质-第一蛋白标签融合蛋白与第二蛋白质-第二蛋白标签融合蛋白,所述的第一蛋白标签与第二蛋白标签不相同;
(2)以elisa常规包被方法对第一标签抗体进行包被后,洗板,然后进行封闭处理;
(3)加入第一蛋白质-第一蛋白标签融合蛋白进行孵育,洗板;
(4)加入与第二蛋白质-第二蛋白标签融合蛋白以及待筛选药物进行孵育,洗板;
(5)加入与所述的第一标签抗体的来源属性不同第二标签抗体进行孵育,洗板;
(6)加入能够结合第二标签抗体的酶标二抗进行孵育;
(7)加入显色液,充分显色后立即加入终止液终止显色;若等待过久会造成过度显色,掩盖实验组和对照组的真实差异;
(8)待显色稳定后进行双波长测定,按照od450-od630计算每个孔的吸光度值,分析待筛选药物对第一蛋白质和第二蛋白质相互作用的影响程度。
步骤(1)所述的第一蛋白质-第一蛋白标签融合蛋白、第二蛋白质-第二蛋白标签融合蛋白的纯度优选为95%以上。纯化后的蛋白质需在-80℃保存,不可反复冻融,不可长时间保存,会影响蛋白质活性。
优选的,当所述的第一蛋白质为cdk1时,所述的第二蛋白质为kctd12,可筛选得到通过破坏cdk1-kctd12两个蛋白质的相互作用而抗肿瘤的药物;当所述的第一蛋白质为c-raf1,所述的第二蛋白质为phb1,可筛选得到通过破坏c-raf1-phb1两个蛋白质的相互作用而抗肿瘤的药物。所述的肿瘤可为结肠癌。
步骤(1)中所述的第一蛋白标签和第二蛋白标签优选为his标签,gst标签或ha标签中的至少两种。
所述的第一标签抗体和第二标签抗体的来源属性不同,是由于本发明的药物筛选方法是根据对第二标签抗体的含量水平检测(通过酶标二抗检测)实现的,如果两者的来源属性相同,则无法特异性检测第二标签抗体的含量,即第一标签抗体的存在会影响对第二标签蛋白抗体含量的检测。例如,当其中一种标签抗体为鼠源时,另一种标签抗体为兔源;所述的来源可以是鼠源、兔源、羊源、人源中的至少两种。
步骤(2)中所述的第一标签抗体的浓度优选为1ng/μl。所述的第一标签抗体可用普通elisa包被液进行稀释。
所述的洗板优选用磷酸盐缓冲液进行清洗,洗板的次数优选为4~5次,每次洗板的时间优选为5分钟。
步骤(2)所述的封闭处理的具体操作为:每孔加入300μl用pbs配制的5%(w/v)牛血清白蛋白(bsa),37℃封闭2小时。
步骤(3)中所述的第一蛋白质-第一蛋白标签融合蛋白的初始浓度优选为1~4mg/ml;步骤(3)中所述的第一蛋白质-第一蛋白标签融合蛋白在每孔中的终浓度优选为5~20μg/ml。
步骤(4)中所述的第二蛋白质-第二蛋白标签融合蛋白的初始浓度优选为1~4mg/ml;步骤(4)中所述的第二蛋白质-第二蛋白标签融合蛋白在每孔中的终浓度优选为5~20μg/ml。
步骤(3)中所述的孵育优选为室温慢摇5小时进行孵育;所述的第一蛋白质-第一蛋白标签融合蛋白可先用pbs溶液进行稀释。
步骤(4)中所述的孵育优选为37℃静置孵育3~4小时;所述的第二蛋白质-第二蛋白标签融合蛋白可先用pbs溶液进行稀释。
步骤(4)中所述的待筛选药物包括一种活性成分或由至少两种活性成分组成的药物组合物;所述的药物优选为治疗癌症的药物。
步骤(5)中所述的第二标签抗体的浓度优选为0.5μg/ml;所述的孵育优选为室温孵育2小时或者4℃孵育过夜;稀释所述的第二标签抗体的溶剂优选为5%(w/v)bsa溶液。
步骤(6)中所述的酶标二抗优选为辣根过氧化酶标记的二抗;所述的酶标二抗的浓度优选为0.5μg/ml;稀释所述的酶标二抗的溶剂优选为5%(w/v)bsa溶液。
步骤(7)中所述的显色液优选为tmb;所述的显色操作优选为在37℃显色1分钟。
步骤(4)~(8)的所有操作均要求动作轻柔,不同蛋白质相互作用力度不同,过于激烈的动作会人为破坏相互作用而造成假阳性结果出现。
一种药物筛选的试剂盒,通过基于病理机制中相互作用的第一蛋白质和第二蛋白质构建双夹心elisa反应体系来实现筛选,其包括保持活性的第一蛋白质-第一蛋白标签融合蛋白与第二蛋白质-第二蛋白标签融合蛋白,来源属性不同的第一标签抗体和第二标签抗体,酶标二抗;所述的第一蛋白标签与第二蛋白标签不相同。
所述的药物筛选试剂盒还包括包被液、洗涤液、封闭液、显色液和终止液中的一种或至少两种。
所述的药物筛选方法或药物筛选的试剂盒在药物筛选中的应用。
所述的药物优选为小分子药物,所述的“小分子药物”泛指分子量为100至1800,更优120至1400的有机、无机或金属有机化合物。
肿瘤细胞通过内部蛋白质-蛋白质相互作用来传递生理功能的信号,通过多个蛋白质不断相互作用发挥癌基因的功能,最终导致如癌细胞增殖、转移等恶性现象的出现。本发明通过对传统elisa的改良,给目标蛋白质加上人工合成的肽段标签(如his、gst等),并直接将两个标签的对应抗体包埋在酶标板上,这样通过标签蛋白的抗体-抗原反应将目标蛋白质固定在酶标板上,就能确保蛋白质相互作用位点暴露在环境中并保持活性,以便相互作用的进行;操作过程更加简单,效率更高;成功实现了以蛋白质-蛋白质相互作用为靶点进行药物筛选,所筛选得到的药物可通过打断肿瘤细胞内癌基因发挥功能的信号通路以实现抗癌效果。
相对于现有技术中抗癌药物筛选的方式相比,本发明具有如下的优点及效果:
1.与基于肿瘤细胞功能筛选的方法相比,本发明操作简单、成本低廉、实验材料容易获取;筛选手段目标明确,耗时短、易操作,并能直观、清楚地了解药物作用的具体分子机制,对于由此可能产生的副作用可以提前预想并能够尽早制定应对措施,为之后药物的升级改良提供基础。
2.持续的药物作用压力是肿瘤细胞耐药的重要因素,与基于单个基因或单个蛋白质进行的药物筛选相比,本发明通过靶向蛋白质的相互作用筛选出抗肿瘤药物,并不是针对蛋白质本身,避免了对单一蛋白质形成持续的药物作用压力,大大降低了肿瘤细胞耐药性的出现。
3.本发明可以用于大规模商业化的药物筛选,每个elisa板最多可以筛选出96种小分子药物,大大缩短了药物筛选时间,提高了药物筛选效率。同时每一个elisa反应可以进行多种小分子药物联合作用效果的筛选,能够直观的提示药物联合使用的最佳比例关系,为临床用药提供可靠的参考信息。
4.本发明给目标蛋白加上标签肽段并将标签肽段抗体固定在酶标板上,利用抗原-抗体反应固定第一蛋白质。相较于现有的将目的蛋白直接固定在elisa酶标板上进行蛋白质相互作用抑制剂筛选的技术,本发明能够最大限度保持目标蛋白质相互作用位点的活性。
5.本发明利用纯化的两个蛋白质的体外反应进行抗癌药物筛选,相比于利用蛋白-细胞体外孵育进行细胞膜蛋白相互作用药物筛选的技术,本发明应用更加广泛,不受限于目标蛋白在细胞中的定位,且不易污染。
附图说明
图1是本发明的筛选方法superelisa的操作步骤流程图。
图2是实施例1基于kctd12与cdk1构建的superelisa体系示意图。
图3是实施例1中待筛选的小分子药物的吸光度值结果分析图。
图4是实施例1中1~3号药物的免疫共沉淀实验结果图。
图5是实施例1的流式细胞仪检测结果图。
图6是实施例1的克隆形成实验结果分析图。
图7是实施例2中待筛选的小分子药物的吸光度值结果分析图。
图8是是实施例2的免疫共沉淀实验结果图。
图9是实施例2的蛋白质免疫印迹实验结果图。
图10是实施例2的细胞侵袭实验结果分析图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1基于癌基因kctd12与细胞周期因子cdk1的抗肿瘤药物筛选
本实施例以癌基因kctd12与细胞周期因子cdk1的相互作用为靶点进行结肠癌抗肿瘤药物筛选为例,展示并证实本发明的技术方案的可行性以及优势。根据文献报道,癌基因kctd12通过与细胞周期因子cdk1相互作用而不断激活cdk1导致肿瘤细胞无序增殖进而导致癌症恶化(zhongy,yangj,xuww,wangy,zhengcc,lib,etal.kctd12promotestumorigenesisbyfacilitatingcdc25b/cdk1/auroraa-dependentg2/mtransition.oncogene2017;36(44):6177-6189.)。
一、融合蛋白kctd12-his,cdk1-gst的制备
(一)kctd12-his融合蛋白的表达纯化
1.构建重组表达载体pet-kctd12:根据ncbi数据库人源kctd12蛋白基因序列(ncbi登录号:nm_138444.3),利用primerpremier5.0设计并合成编码kctd12基因的引物,在两端加入双酶切位点(上游末端酶切位点为bamh1,下游末端酶切位点为ecor1,均购买自takara公司),pcr扩增出目的基因条带。
2.用1%琼脂糖凝胶电泳检测pcr产物,利用dna回收试剂盒(天根生化科技有限公司,货号:dp214)回收纯化目的片段。用内切酶进行双酶切目的基因片段及空载体pet(碧云天生物技术公司,货号d2902),分别取目的基因片段470ng和空载体200ng进行酶切,条件为37℃酶切4h;之后混合目的基因和空载体的酶切产物进行dna纯化回收(总体积50μl),取纯化回收产物35μl混合2μlt4dna连接酶(takara公司)、5μl缓冲液和8μlddh2o;取10μl连接产物转化至e.colitop10感受态细胞,经卡纳抗性平板筛选阳性重组子,对其进行菌落pcr验证及dna测序验证,经ncbiblast比对分析测序结果。质粒置于-20℃长期保存,菌株加入15%甘油保存于-80℃。
3.融合蛋白的诱导表达:将测序正确的top10-pet-kctd12接种于含有氨苄抗性(100ng/μl)的lb培养基中,37℃振荡培养过夜。次日将活化的菌种按1:100比例将菌液接入新鲜培养基扩大培养,在37℃以220rpm振荡培养至od600=0.6~0.8时,加入异丙基硫代半乳糖苷(iptg),iptg终浓度为0.5mm,同样的条件继续诱导表达4~6h后收集菌体,4700rpm于4℃离心45min,1×pbs缓冲液重悬菌体并再次离心收集菌体。将收集到的菌体于液氮和37℃反复冻融3次,然后冰浴超声30min(5s开,5s关)至菌液变澄清透亮,超声破碎物于4℃以10000rpm离心30min,弃沉淀,0.22mm孔径滤膜过滤上清,上清用于过柱纯化。取少量上清(约15μl)用12%sds-page检测融合蛋白表达状况。
4.采用qiagen公司的ni-nta亲和层析纯化柱对重组蛋白进行纯化。具体步骤为:将ni-nta树脂混匀后,取2ml上柱,室温静置30min。
(1)用10倍柱体积灭菌超纯水ddh2o清洗柱子。
(2)用10倍柱体积的平衡缓冲液平衡柱子。
(3)将收集的上清样液缓缓装入层析柱中。
(4)用10倍柱体积的平衡液冲洗树脂并收集上样流出液;
(5)分别用含有10mm咪唑,25mm咪唑,50mm咪唑,100mm咪唑和500mm咪唑的缓冲液洗脱镍柱,分别收集洗脱液。用12%sds-page对kctd12-his融合蛋白的表达量及纯度进行检测。
(6)分别用10倍柱体积的平衡缓冲液(20mm十二水合磷酸钠,500mmnaclph7.0~7.5)和10倍柱体积ddh2o清洗柱子,向柱子中加入5ml的20%乙醇,4℃保存。
5.kctd12-his融合蛋白的浓缩:利用10kd超滤管(millipore,货号:acs501012)进行融合蛋白浓缩,5000rpm离心,4℃超滤至500μl,之后使用20mmtris-hcl(含100mmnacl)冲洗浓缩液三次,并重复离心三次。获得的浓缩蛋白使用bca蛋白浓度检测试剂盒(thermofisher,货号:23227)测得浓度并放置在-80℃保存。
(二)cdk1-gst融合蛋白的表达纯化
1.构建重组表达载体pgex-4t-1-cdk1:根据ncbi数据库人源cdk1蛋白基因序列(ncbi登录号:nm_001786.4),利用primerpremier5.0设计并合成编码cdk1基因的引物,在两端加入双酶切位点(上游末端酶切位点为bamh1,下游末端酶切位点为ecor1,均购买自takara公司),pcr扩增。
2.用1%琼脂糖凝胶电泳检测pcr产物,利用dna回收试剂盒(天根生化科技有限公司,货号:dp214)回收纯化目的片段。分别取目的基因片段500ng和空载体200ng进行酶切,条件为:37℃酶切4h;之后混合目的基因和空载体的酶切产物进行dna纯化回收(总体积50μl),取纯化回收产物35μl混合2μlt4dna连接酶(takara公司)、5μl缓冲液和8μlddh2o,混合均匀于16℃连接过夜;取10μl连接产物转化至e.colibl21感受态细胞,经氨苄抗性平板筛选阳性重组子,对其进行菌落pcr验证及dna测序验证,经ncbiblast比对分析测序结果。质粒置于-20℃长期保存,菌株加入15%甘油保存于-80℃。
3.融合蛋白的诱导表达:将测序正确的bl21-pgex-4t-1-cdk1接种于含有氨苄抗性(100ng/μl)的lb培养基中,37℃振荡培养过夜。次日将活化的菌种按1:100比例将菌液接入新鲜培养基扩大培养,在37℃以220rpm振荡培养至od600=0.6~0.8时,iptg至终浓度为0.5mm,以同样的条件继续诱导表达4~6h后收集菌体,4700rpm于4℃离心45min,1×pbs缓冲液重悬菌体并再次离心收集菌体。将收集到的菌体于液氮和37℃反复冻融3次,然后冰浴超声30min(5s开,5s关)至菌液变澄清透亮,超声破碎物于4℃以10000rpm离心30min,弃沉淀,上清用于过柱纯化。取少量上清(约15μl)用12%sds-page检测融合蛋白表达状况。
4.采用ge公司的gst亲和层析纯化柱对重组蛋白进行纯化,具体步骤为:
(1)将gst亲和层析树脂混匀后,取2ml上柱,室温静置30min。
(2)用10倍柱体积灭菌超纯水ddh2o清洗柱子。
(3)用10倍柱体积的bindingbuffer(1×pbs,ph7.4)平衡柱子。
(4)将收集的上清样液缓缓装入层析柱中。
(5)用10倍柱体积的bindingbuffer洗下杂蛋白。
(6)用5倍柱体积的elutionbuffer(10mm谷胱甘肽+50mmtris-hcl)洗脱,收集流出液,即cdk1-gst融合蛋白。用12%sds-page对cdk1-gst融合蛋白的含量及纯度进行检测。
(7)用10倍柱体积的bindingbuffer和10倍柱体积ddh2o清洗柱子,向柱子中加入5ml的20%乙醇,4℃保存。
5.融合蛋白的浓缩:利用10kd超滤管(millipore,货号:acs501012)进行融合蛋白浓缩,5000rpm离心,4℃超滤至500μl,之后使用1×pbs冲洗浓缩液三次,并重复离心三次。获得的浓缩蛋白使用bca蛋白浓度检测试剂盒(thermofisher,货号:23227)测得浓度并放置在-80℃保存。
二、设置superelisa实验
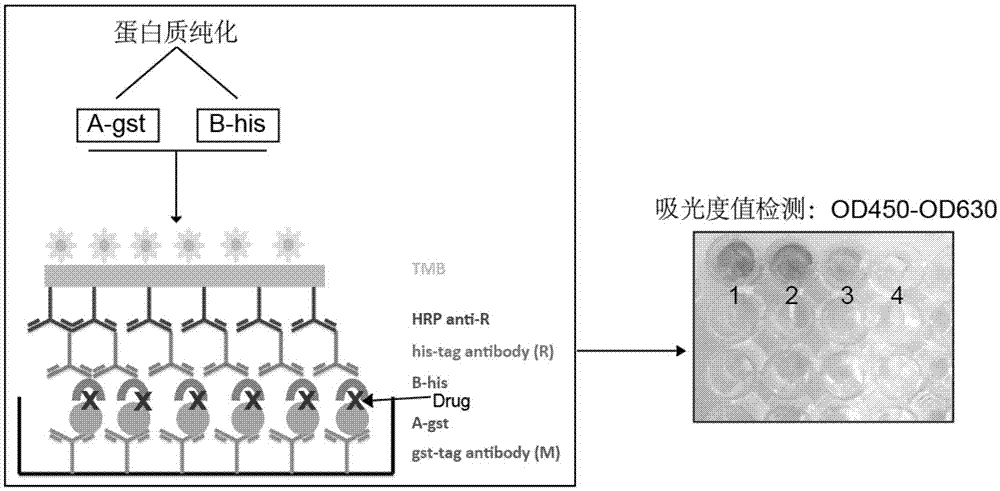
相关操作步骤流程图如图2所示。
1.包被:根据elisa的包被方法进行第一层抗体gst-tagantibody(货号:66001-2-ig,购自proteintechgroup)的包被,使用普通elisa包被液(购自neobioscience,货号:nbc01)将抗体稀释为浓度为1ng/μl的抗体稀释液,每个96孔elisa板的孔中加入100μl抗体稀释液,4℃包被过夜。
2.封闭:使用磷酸盐缓冲液(pbs)(pbs配方:4gnacl,0.1gkcl,1.815g十二水合磷酸氢二钠,0.12g磷酸氢二钾,溶解在400ml的超纯水中,定容至500ml使用)清洗elisa板1次5分钟;每孔加入300μl5%(w/v)牛血清白蛋白(bsa)(pbs配制);37℃封闭2小时。
3.加入纯化的蛋白质cdk1-gst:将1μg纯化蛋白预先混匀稀释在200μlpbs中,按照1μg/孔加入稀释后的cdk1-gst蛋白,最终每个孔中的蛋白质浓度为5μg/ml;室温慢摇5小时;之后按照上述清洗方法清洗elisa板5次,每次5分钟。
4.加入纯化的蛋白质kctd12-his:将1μg纯化蛋白预先混匀稀释在200μlpbs中,按照1μg/孔加入稀释后的kctd12-his蛋白,最终每个孔中的蛋白质浓度为5μg/ml;37℃静置孵育3~4小时;之后按照上述清洗方法清洗elisa板5次,每次5分钟。与此同时将计算好的药物按加入反应孔中,使药物终浓度为10μm。
5.加入his-tagantibody(货号:ab9108,购自abcam)抗体:按照1:2000比例,将1μg抗体在2000μl5%bsa中稀释,得到抗体稀释液,每孔加入100μl抗体稀释液,室温孵育2小时或者4℃孵育过夜。注意:anti-his抗体来源属性需与anti-gst抗体属性不同,本实施例中,gst-tagantibody是鼠抗,则his-tagantibody应为兔抗。
6.清洗掉多余抗体:清洗方法如上,清洗5次,每次5分钟。
7.孵育二抗:将够结合his-tagantibody的带有辣根过氧化酶的二抗山羊抗兔igghrp(货号:ab6721,购自abcam)按照质量体积比1:2000,也即将1μg抗体稀释到2000μl的5%bsa中,得到抗体稀释液,每孔加入100μl抗体稀释液进行孵育。
8.显色:每孔加入100μl普通elisa显色液tmb(购自neobioscience,货号:tms.12),37℃放置1分钟,立即用50μl终止液(购自neobioscience,货号:est001)终止显色。
9.读取数值:待显色稳定后使用分光光度计进行双波长测定,按照od450-od630计算得到每个孔的吸光度值,进而分析药物作用效果。
用于本实验筛选的药物来源于美国食品药品监督管理局(fda)批准的用于临床使用的小分子药物库(fda-approveddruglibrary,购自selleck,货号:l1300)。本实施例中一共对176个小分子药物进行了研究筛选,该批次小分子药物随同纯化的kctd12-his蛋白质一起加入反应体系中(即上述步骤(4))。
三、筛选结果分析
1.通过superelisa筛选,对该elisa板中各个孔的吸光度值od450-od630的值进行分析,结果如图3所示,图3中的横线指只进行蛋白质相互作用,不加药处理的阳性对照组,横线及横线以上指未出现抑制效果的药物,横线以下指出现了抑制效果的药物。分析时与同一块elisa板上的对照组作比较(吸光度值接近零的几组即为阴性对照组,横线上的一组为阳性对照组)。从图中可以看出,一共有3个孔的吸光度值显著降低(吸光度值最低的6个孔为阴性对照组),意味着这3个孔中的cdk1-kctd12相互作用被打破,因此选取这3个孔对应的小分子药物进行进一步的研究。
2.免疫共沉淀实验(co-ip)进一步验证
免疫共沉淀实验(co-ip)是检验蛋白质体内相互作用重要手段,因此本实验采取co-ip的技术手段对筛选出的药物进行进一步验证,co-ip具体操作步骤如下:
提前将4组,每组100万个结肠癌hct116(购自atcc;货号:ccl-247)或ht29细胞(购自atcc,货号:htb-38)铺在细胞培养皿中,并分别加入dmso,1号药物,2号药物,3号药物。dmso按照1μl:1000μldmem培养液比例加入,1~3号药物使用dmem培养液稀释,最终浓度均为10μm;37℃环境下培养处理细胞24小时,之后用pbs清洗细胞两次,每个培养皿加1ml0.25%胰酶消化细胞使其脱落培养皿壁;随后用每孔5ml完全培养液终止消化,300g转速常温离心3分钟,收集细胞并用5mlpbs重悬,重复离心1次。
(1)将清洗好的结肠癌细胞收集到1.5ml的ep管中。加入配置好的裂解液,此裂解液为含有1%pmsf、1%pi和磷酸酶抑制剂的western及ip裂解液(货号:p0013;购自碧云天生物技术公司),冰上裂解,每5min上下颠倒几次,轻柔的,不能涡旋,裂解30min后,13200rpm4℃离心30min。
(2)取上清至新ep管,使用bca法测蛋白浓度,随后每组取1mg蛋白质进行co-ip反应。每组加入proteina/gagarose30μl和兔igg(货号:10284-1-ap;购自proteintech)1μg,4℃旋转孵育1小时。随后4℃,2500rpm离心5min,取上清蛋白样至新ep管中。此步骤为去除样品中能与下一步中cdk1抗体孵育时非特异性结合的蛋白质。
(3)dmso处理的对照组蛋白样中加入2μg兔igg抗体,其他三组药物处理蛋白样中分别加入2μgcdk1抗体(货号:28439s;购自cellsignalingtechnology)作为实验组,4℃旋转孵育16~18h。
(4)每组样品中加入30μlproteina/gagarosebeads,4℃旋转孵育4h。
(5)2500rpm离心5分钟,去除上清;用western及ip裂解液洗轻柔润洗beads,之后2500rpm离心5分钟,重复三次。去除上清液,每组加入30μlsds裂解液(货号:p0013g;购自碧云天生物技术公司)。涡旋震荡一分钟,开水煮10min。离心,将上清进行sds-page电泳分离及westernblot分析co-ip效果。
westernblot步骤参考文献:细胞周期中蛋白质更新的定量蛋白质组学研究.何桂卫.硕士毕业论文。
结果如图4所示,co-ip证明3号药物破坏cdk1-kctd12的作用最强。
superelisa和co-ip实验均证明3号药物能够显著破坏kctd12和cdk1的相互作用,3号药物是阿德福韦酯(adefovirdipivoxil),该药物是治疗肝炎的临床用药,迄今为止并没有用于癌症治疗的报道,因此本实验证明该药物可能是一个潜在的靶向kctd12-cdk1相互作用的抗癌药物。
四、3号药物的进一步研究
(一)细胞周期研究
通过细胞分裂效果检测方法对3号药物展开进一步研究。
1.将结肠癌细胞hct116铺到6孔板中,每孔50万个细胞。实验组加2μl10mm的阿德福韦酯到2ml的完全培养液中,使其终浓度为10μm;对照组加2μldmso到2ml的完全培养液中。37℃培养48小时。
2.消化细胞并计数,实验组和对照组各取50万细胞。使用pbs清洗细胞,洗掉附着的培养液,300g离心5分钟。
3.预先配置600μlpbs和fbs的混合物,配置方法为540μlpbs+60μlfbs,混匀后冰上预冷。分别取pbs和fbs混合物300μl重悬细胞,随后每组各加入700μl预冷的100%乙醇,4℃旋转过夜(16~18小时)固定。
4.4℃,1400g离心7分钟。1mlpbs重悬细胞,重复离心7分钟。
5.每组细胞样品中加入1.4ml0.25%triton100重悬细胞,0.25%triton100使用pbs稀释纯的triton100进行配制。冰上孵育15分钟。之后1400g离心去除上清液。
6.取h3p-fitc抗体(货号:3465s;购自cellsignalingtechnology)按照1:1600稀释到1%bsa中(1μg抗体+1600μl1%bsa)。每组使用800μl抗体稀释液重悬细胞,室温避光旋转孵育3小时。
7.1400g离心7分钟,去除上清液。使用800μl1%(w/v)bsa清洗细胞一次,重复离心7分钟。此步骤需要避光操作。
8.进行pi染色,具体操作参考:细胞周期中蛋白质更新的定量蛋白质组学研究.何桂卫.硕士毕业论文
9.样品进行流式细胞仪检测。
蛋白质kctd12-cdk1的相互作用是促进细胞从g2期过渡到m期的重要步骤,若两者的相互作用被破坏,则癌细胞不能继续分裂而积累在g2期。因此通过检测阿德福韦酯处理后结肠癌细胞是否发生g2期积累可验证该药物是否是通过破坏kctd12-cdk1的相互作用而影响癌细胞分裂。
流式细胞仪检测阿德福韦酯处理结肠癌细胞后,结果如图5所示,发生g2期积累的细胞明显增多。黑色方框内为g2期细胞,灰色方框内是m期细胞(用来确定黑色方框的位置,两者的上下位置,宽度应保持一致);dmso为对照组。
(二)克隆形成实验证明阿德福韦酯能显著抑制结肠癌细胞增殖
1.10μm阿德福韦酯浓度处理结肠癌细胞
将结肠癌细胞hct116(货号:ccl-247,购自美国模式培养物集存库atcc)铺到六孔板中,每孔50万个细胞。用dmso配制原始浓度为10mm的阿德福韦酯溶液,加药时按照2μl药物+2000μl细胞培养液的比例,使细胞接触到的药物最终浓度为10μm,10μm阿德福韦酯浓度处理结肠癌细胞处理48小时后,收集细胞并计数。
2.将步骤1得到的细胞,按每个孔500个细胞的密度接种到六孔板中;
3.每孔加入2ml的培养基,所述的培养基为dmem培养液+终浓度为10%的fbs(dmem培养液货号:11965092;fbs货号:10082147,均购自thermofisherscientific);
4.培养10天后,用pbs清洗细胞两遍;
5.无水甲醇固定10min;
6.pbs清洗2两遍;
7.0.5%的结晶紫染色10min;
8.用pbs清洗两遍,洗去非特异的染色以及背景;
9.晾干,用扫描仪扫描结果。
以药物等体积的dmso进行处理作为参照。
研究表明kctd12-cdk1的相互作用是促进肿瘤细胞分裂进程的重要原因,因此本实验利用superelisa筛选到的阿德福韦酯处理结肠癌细胞,克隆形成实验发现肿瘤细胞的恶性增殖能够被阿德福韦酯显著抑制(细胞克隆数量的多少和大小是癌细胞恶性增殖的指标之一),结果如图6所示。
本实施例证明了通过本发明的superelisa筛选得到的药物,具有明确的作用方式,即阿德福韦酯通过显著破坏cdk1-kctd12两个蛋白质的相互作用实现对肿瘤细胞恶性增殖的抑制,抑制作用较强。
实施例2基于phb和c-raf1的抗肿瘤药物筛选
phb1-c-raf1相互作用被认为与结肠癌转移相关(chiucf,homy,pengjm,hungsw,leewh,liangcm,etal.rafactivationbyrasandpromotionofcellularmetastasisrequirephosphorylationofprohibitinintheraftdomainoftheplasmamembrane.oncogene2013;32(6):777-87.),本实施例以phb1-c-raf1相互作用为靶点进行结肠癌抗肿瘤药物筛选为例,进一步展示并证实本发明的技术方案通用性、可行性以及优势。
一、融合蛋白phb1-his,c-raf1-gst的制备
(一)phb1-his融合蛋白的表达纯化
1.构建重组表达载体pet-his:根据ncbi数据库人源phb1蛋白基因序列(ncbi登录号:nm_001281496.1),利用primerpremier5.0设计并合成编码phb1基因的引物,在两端加入双酶切位点(上游末端酶切位点为bamh1,下游末端酶切位点为ecor1,均购买自takara公司),pcr扩增出目的基因条带。
2.用1%琼脂糖凝胶电泳检测pcr产物,利用dna回收试剂盒(天根生化科技有限公司,货号:dp214)回收纯化目的片段。用内切酶进行双酶切目的基因片段及空载体pet(碧云天生物技术公司,货号d2902),分别取目的基因片段470ng和空载体200ng进行酶切,条件为37℃酶切4h;之后混合目的基因和空载体的酶切产物进行dna纯化回收(总体积50μl),取纯化回收产物35μl混合2μlt4dna连接酶(takara公司)+5μl缓冲液+8μlddh2o;取10μl连接产物转化至e.colitop10感受态细胞,经卡纳抗性平板筛选阳性重组子,对其进行菌落pcr验证及dna测序验证,经ncbiblast比对分析测序结果。质粒置于-20℃长期保存,菌株加入15%甘油保存于-80℃。
3.融合蛋白的诱导表达:将测序正确的top10-pet-phb1接种于含有氨苄抗性(100ng/μl)的lb培养基中,37℃振荡培养过夜。次日将活化的菌种按1:100比例将菌液接入新鲜培养基扩大培养,在37℃以220rpm振荡培养至od600=0.6~0.8时,加入异丙基硫代半乳糖苷(iptg),iptg终浓度为0.5mm,同样的条件继续诱导表达4~6h后收集菌体,4700rpm于4℃离心45min,1×pbs缓冲液重悬菌体并再次离心收集菌体。将收集到的菌体于液氮和37℃反复冻融3次,然后冰浴超声30min(5s开,5s关)至菌液变澄清透亮,超声破碎物于4℃以10000rpm离心30min,弃沉淀,0.22mm孔径滤膜过滤上清,上清用于过柱纯化。取少量上清(约15μl)用12%sds-page检测融合蛋白表达状况。
4.采用qiagen公司的ni-nta亲和层析纯化柱对重组蛋白进行纯化。具体步骤为:
(1)将ni-nta树脂混匀后,取2ml上柱,室温静置30min。
(2)用10倍柱体积灭菌超纯水ddh2o清洗柱子。
(3)用10倍柱体积的平衡缓冲液平衡柱子。
(4)将收集的上清样液缓缓装入层析柱中。
(5)用10倍柱体积的平衡液冲洗树脂并收集上样流出液;
(6)分别用含有10mm咪唑,25mm咪唑,50mm咪唑,100mm咪唑和500mm咪唑的缓冲液洗脱镍柱,分别收集洗脱液。用12%sds-page对phb1-his融合蛋白的表达量及纯度进行检测。
(7)分别用10倍柱体积的平衡缓冲液(20mm十二水合磷酸钠,500mmnacl,ph7.0~7.5)和10倍柱体积ddh2o清洗柱子,向柱子中加入5ml的20%乙醇,4℃保存。
5.kctd12-his融合蛋白的浓缩:利用10kd超滤管(millipore,货号:acs501012)进行融合蛋白浓缩,5000rpm离心,4℃超滤至500μl,之后使用20mmtris-hcl(含100mmnacl)冲洗浓缩液三次,并重复离心三次。获得的浓缩蛋白使用bca蛋白浓度检测试剂盒(thermofisher,货号:23227)测得浓度并放置在-80℃保存。
(二)c-raf1-gst融合蛋白的表达纯化
1.构建重组表达载体pgex-4t-1-c-raf1-gst:根据ncbi数据库人源c-raf1蛋白基因序列(ncbi登录号:nm_001354689.1),利用primerpremier5.0设计并合成编码c-raf1基因的引物,在两端加入双酶切位点(上游末端酶切位点为bamh1,下游末端酶切位点为ecor1,均购买自takara公司),pcr扩增。
2.用1%琼脂糖凝胶电泳检测pcr产物,利用dna回收试剂盒(天根生化科技有限公司,货号:dp214)回收纯化目的片段。分别取目的基因片段680ng和空载体200ng进行酶切,条件为:37℃酶切4h;之后混合目的基因和空载体的酶切产物进行dna纯化回收(总体积50μl),取纯化回收产物35μl混合2μlt4dna连接酶(takara公司)+5μl缓冲液+8μlddh2o,混合均匀于16℃连接过夜;取10μl连接产物转化至e.colibl21感受态细胞,经氨苄抗性平板筛选阳性重组子,对其进行菌落pcr验证及dna测序验证,经ncbiblast比对分析测序结果。质粒置于-20℃长期保存,菌株加入15%甘油保存于-80℃。
3.融合蛋白的诱导表达:将测序正确的bl21-pgex-4t-1-c-raf1接种于含有氨苄抗性(100ng/μl)的lb培养基中,37℃振荡培养过夜。次日将活化的菌种按1:100比例将菌液接入新鲜培养基扩大培养,在37℃以220rpm振荡培养至od600=0.6~0.8时,加入iptg至终浓度为0.5mm,同样的条件继续诱导表达4~6h后收集菌体,4700rpm于4℃离心45min,1×pbs缓冲液重悬菌体并再次离心收集菌体。将收集到的菌体于液氮和37℃反复冻融3次,然后冰浴超声30min(5s开,5s关)至菌液变澄清透亮,超声破碎物于4℃以10000rpm离心30min,弃沉淀,上清用于过柱纯化。取少量上清(约15μl)用12%sds-page检测融合蛋白表达状况。
4.采用ge公司的gst亲和层析纯化柱对重组蛋白进行纯化,具体步骤为:
(1)将gst亲和层析树脂混匀后,取2ml上柱,室温静置30min。
(2)用10倍柱体积灭菌超纯水ddh2o清洗柱子。
(3)用10倍柱体积的bindingbuffer(1×pbs,ph7.4)平衡柱子。
(4)将收集的上清样液缓缓装入层析柱中。
(5)用10倍柱体积的bindingbuffer洗下杂蛋白。
(6)用5倍柱体积的elutionbuffer(10mm谷胱甘肽+50mmtris-hcl)洗脱,收集流出液,即c-raf1-gst融合蛋白。用12%sds-page对c-raf1-gst融合蛋白的含量及纯度进行检测。
(7)用10倍柱体积的bindingbuffer和10倍柱体积ddh2o清洗柱子,向柱子中加入5ml的20%乙醇,4℃保存。
5.融合蛋白的浓缩:利用10kd超滤管(millipore,货号:acs501012)进行融合蛋白浓缩,5000rpm离心,4℃超滤至500μl,之后使用1×pbs冲洗浓缩液三次,并重复离心三次。获得的浓缩蛋白使用bca蛋白浓度检测试剂盒(thermofisher,货号:23227)测得浓度并放置在-80℃保存。
二、设置superelisa实验
相关操作步骤流程图如图1所示。
1.包被:根据elisa的包被方法进行第一层抗体gst-tagantibody(货号:66001-2-ig,购自proteintechgroup)的包被,使用普通elisa包被液(购自neobioscience,货号:nbc01)将抗体配制为浓度为1ng/μl的抗体稀释液,每个96孔elisa板的孔中加入100μl抗体稀释液,4℃包被过夜。
2.封闭:使用磷酸盐缓冲液(pbs)(pbs:4gnacl,0.1gkcl,1.815g十二水合磷酸氢二钠,0.12g磷酸氢二钾,溶解在400ml的超纯水中,定容至500ml使用)清洗elisa板1次5分钟;每孔加入300μl5%(w/v)牛血清白蛋白(bsa)(pbs配制);37℃封闭2小时。
3.加入纯化的蛋白质c-raf1-gst:将1μg纯化蛋白预先混匀稀释在200μlpbs中,按照1μg/孔加入稀释后的c-raf1-gst蛋白,最终每个孔中的蛋白质浓度为5μg/ml,室温慢摇5小时;之后按照上述清洗方法清洗elisa板5次,每次5分钟。
4.加入纯化的蛋白质phb1-his:将1μg纯化蛋白预先混匀稀释在200μlpbs中,按照1μg/孔加入稀释后的phb1-his蛋白,最终每个孔中的蛋白质浓度为5μg/ml;37℃静置孵育3~4小时;之后按照上述清洗方法清洗elisa板5次,每次5分钟。与此同时将计算好的药物加入反应孔中,使药物终浓度为10μm。
5.加入his-tagantibody(货号:ab9108,购自abcam)抗体:按照1:2000比例,将1μg抗体在2000μl5%bsa中稀释,得到抗体稀释液,每孔加入100μl抗体稀释液,室温孵育2小时或者4℃孵育过夜。注意:gst-tagantibody抗体来源属性需与his-tagantibody抗体属性不同,在本实施例中,gst-tagantibody是鼠抗,his-tagantibody是兔抗。
6.清洗掉多余抗体:清洗方法如上,清洗5次,每次5分钟。
7.孵育二抗:将能够结合his-tagantibody一抗的带有辣根过氧化酶的二抗山羊抗兔igghrp(货号:ab6721;购自abcam)按照质量体积比1:2000,将抗体1μg稀释到2000μl的5%(w/v)bsa中,得到抗体稀释液,每孔加入100μl抗体稀释液进行孵育。
8.显色:每孔加入100μl普通elisa显色液tmb(货号:tms.12,购自neobioscience),37℃放置1分钟,立即用50μl终止液(货号:est001,购自neobioscience)终止显色。
9.读取数值:待显色稳定后使用分光光度计进行双波长测定,按照od450-od630计算得到每个孔的吸光度值,进而分析药物作用效果。
用于本实验筛选的药物来源于美国食品药品监督管理局(fda)批准的用于临床使用的小分子药物库(fda-approveddruglibrary,购自selleck,货号:l1300)。本实施例中一共对88个小分子药物进行了研究筛选,该批次小分子药物随同纯化的phb1-his蛋白质一起加入反应体系中(即上述步骤(4))。
三、筛选结果分析
1.利用superelisa技术从fda小分子药物库中筛选能够特异性抑制phb和c-raf1相互作用的小分子药物。共有88个小分子药物参与筛选,其中阿伏苯宗对phb-c-raf1相互作用的抑制最为明显(箭头指向处),结果如图7所示,横线指只进行蛋白质相互作用,不加药处理的阳性对照组,横线及横线以上指未出现抑制效果的药物,横线以下指出现了抑制效果的药物。分析时与同一块elisa板上的对照组作比较(吸光度值接近零的几组即为阴性对照组,横线上的一组为阳性对照组)。
2.免疫共沉淀进一步验证
免疫共沉淀实验(co-ip)是检验蛋白质体内相互作用重要手段,为了进一步研究验证阿伏苯宗的抗癌机制和效果,本实施例进行免疫共沉淀实验(co-ip)对阿伏苯宗的作用进行进一步研究。co-ip具体操作步骤如下:
(1)提前将2组,每组100万个结肠癌hct116细胞铺在细胞培养皿中,并分别加入dmso和阿伏苯宗。dmso按照1μl:1000μldmem培养液比例加入,阿伏苯宗使用dmem培养液稀释,最终浓度均为10μm;
(2)37℃环境下培养处理细胞24小时,之后用pbs清洗细胞两次,每个培养皿加1ml0.25%胰酶消化细胞使其脱落培养皿壁;随后用每孔5ml完全培养液终止消化,300g转速常温离心3分钟,收集细胞并用5mlpbs重悬,重复离心1次。
(3)将清洗好的结肠癌细胞收集到1.5ml的ep管中。加入配置好的裂解液,此裂解液为含有1%pmsf、1%pi和磷酸酶抑制剂的western及ip裂解液(货号:p0013,购自碧云天生物技术公司),冰上裂解,每5min上下颠倒几次,轻柔的,不能涡旋,裂解30min后,13200rpm4℃离心30min。
(4)取上清至新ep管,使用bca法测蛋白浓度,随后每组取1mg蛋白质进行co-ip反应。每组加入proteina/gagarose30μl和兔igg(货号:10284-1-ap;购自proteintech)1μg,4℃旋转孵育1小时。随后4℃,2500rpm离心5min,取上清蛋白样至新ep管中。此步骤为去除样品中能与下一步中phb1抗体孵育时非特异性结合的蛋白质。
(5)dmso处理的对照组蛋白样中加入2μg兔igg抗体,阿伏苯宗处理的蛋白样中加入2μgphb1抗体(货号:2426s;购自cellsignalingtechnology)作为实验组,4℃旋转孵育16~18h。
(6)每组样品中加入30μlproteina/gagarosebeads,4℃旋转孵育4h。
(7)2500rpm离心5分钟,去除上清;用western及ip裂解液洗轻柔润洗beads,之后2500rpm离心5分钟,重复三次。去除上清液,每组加入30μlsds裂解液(货号:p0013g;购自碧云天生物技术公司)。涡旋震荡一分钟,开水煮10min。离心,将上清进行sds-page电泳分离及westernblot分析co-ip效果。
westernblot步骤参考文献:细胞周期中蛋白质更新的定量蛋白质组学研究.何桂卫.硕士毕业论文)。
结果如图8所示,co-ip证明阿伏苯宗能够显著破坏phb1-c-raf1的作用。
本实施例通过分子生物学手段证明阿伏苯宗能够显著抑制phb1和c-raf1的相互作用,能够破坏结肠癌细胞中与癌细胞转移相关的信号通路,证明了阿伏苯宗对结肠癌细胞信号通路的影响。
四、对筛选所得药物的进一步研究
(一)mek激活水平的检测
蛋白质mek是phb-c-raf1信号通路的下游分子,通过检测mek的激活水平即磷酸化状态(pmek)可以证实phb和c-raf1之间的相互作用是否被破坏。pmek水平的降低也意味着结肠癌细胞的转移能力下降。
通过蛋白质免疫印迹(westernblot)的方法检测mek的激活水平,具体步骤如下:
1.将结肠癌细胞hct116或结肠癌细胞rko(购自atcc,货号crl-2577)铺在六孔板中,每孔50万细胞。分别往培养孔中加dmso(对照组)和阿伏苯宗(实验组)各2μl,每个孔加入dmem完全培养液2000μl,其中阿伏苯宗的终浓度为10μm。混匀培养液,37℃培养处理细胞48小时。
2.pbs清洗细胞两次,每个孔加0.5ml0.25%胰酶消化细胞使其脱落培养皿壁;随后用每孔1ml完全培养液终止消化,细胞悬液收集到1.5mlep管中,300g转速常温离心3分钟,收集细胞并用1mlpbs重悬,重复离心1次。
3.去除上清,每组加入配置好的裂解液50μl,此裂解液为含有1%pmsf、1%pi和磷酸酶抑制剂的sds细胞裂解液(货号:p0013g;购自碧云天生物技术公司)。冰上裂解,每5min涡旋震荡一次,裂解30min后,13200rpm4℃离心30min。
4.使用bca法测蛋白浓度,并各取每组30μg蛋白进行westernblot实验,具体步骤参考:细胞周期中蛋白质更新的定量蛋白质组学研究.何桂卫.硕士毕业论文。本实验分别用到的抗体为mek,pmek,actin对应的一抗,均购自cellsignalingtechnology公司,货号分别为4694s,9154s,3700s。所有一抗浓度均为1:2000(1μg蛋白质稀释在2000μl5%bsa中)。
5.wb实验得到阿伏苯宗处理后(实验组)结肠癌细胞中mek激活水平的变化,该变化通过pmek水平的高低来体现。
结果如图9所示,蛋白质免疫印迹实验证明阿伏苯宗(avo)处理的结肠癌细胞中的mek磷酸化(pmek)水平降低,意味着阿伏苯宗抑制了phb和c-raf1之间的相互作用。
(二)细胞侵袭试验研究
1.将hct116结肠癌细胞系(货号:ccl-247,购自美国模式培养物集存库atcc)铺到六孔板中,每孔50万个细胞。配制原始浓度为10mm阿伏苯宗,加药时按照2μl药物+2000μl细胞培养液的比例,使细胞接触到的药物最终浓度为10μm,10μm浓度的阿伏苯宗处理结肠癌细胞48小时,之后用胰酶消化细胞,用无血清培养液重悬细胞并计数准备细胞侵袭实验。以dmso处理的细胞实验组作为阴性对照组(nc)。
2.小室准备:先把干净无菌的小室放置在transwell专用的24孔板的孔里,确保放平;之后将5μl基质胶与95μl预冷无血清培养液混合均匀小心铺到小室上室中,室温静置30分钟后吸掉溶液,此时基质胶会在小室上室形成胶质薄层,用以模拟人体内血管壁等基质类结构。
3.在24孔板上靠孔壁轻轻加入600μl完全培养基,保证小室底膜和培养基充分接触,没有气泡阻隔,然后把细胞悬液充分混匀,在每个小室里轻轻均匀滴加等体积等数量的200μl细胞悬液,确保细胞铺的均匀。
4.将种好的细胞培养板固定好,放置在37℃,5%co2培养箱中培养48小时。
5.细胞固定:取出小室,轻轻地在pbs中润洗两遍,加甲醇固定底膜细胞30min。
6.结晶紫染色:用pbs洗两次,除去甲醇,用0.1%结晶紫染色20min。
7.洗净观察:用pbs或纯水洗去小室上的结晶紫,并湿润的棉签轻轻擦掉小室上层未穿膜的细胞,并洗干净。
8.拍照:把清洗干净的小室晾干,置于干净的24孔板,在倒置荧光显微镜下观察,并且在每一个小室选取相同位置的5个视野(上、下、左、右、中)拍照;
9.统计分析:利用软件imagej计算照片上的细胞或者计算其覆盖面积,进行统计分析。
结果如图10所示,处理的细胞(实验组)与dmso处理的对照组之间的细胞相比,侵袭能力下降了4倍,表明阿伏苯宗能够显著抑制结肠癌细胞的转移。
本实施例证明了通过本发明的筛选得到的小分子药物阿伏苯宗能够显著破坏蛋白质phb和c-raf1之间的相互作用,并因此能够强效的抑制结肠癌细胞的转移,具有重要的临床价值和商业价值。
以上是实施例展示了本发明所提供的小分子抗癌药物筛选方法能够基于蛋白质-蛋白质的相互作用,高效地筛选出具有抗肿瘤活性的小分子靶向药物,适用性良好,可为以后针对蛋白质相互作用的靶向药物的开发提供重要的技术前提,具有重要的应用价值。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!