一种1-(4-氯苯基)-5-苯基-1H-三唑与血清作用的差异蛋白检测方法与流程
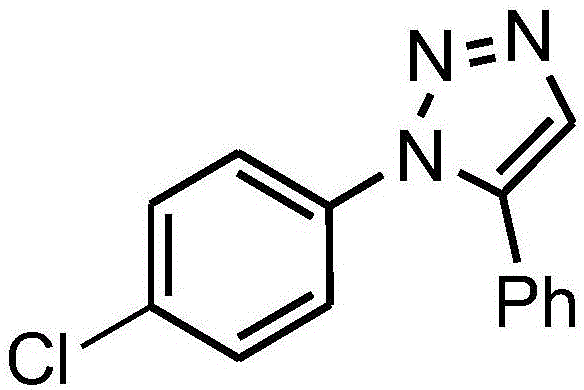
本发明属于有机合成及生物化学领域,具体涉及一种1-(4-氯苯基)-5-苯基-1h-三唑与血清作用的差异蛋白检测方法。
背景技术:
:1,2,3-三氮唑化合物以其独特的五元芳香含氮杂环结构,可与其他取代基相缀合或并合形成多种类型具有药物活性的衍生物,又表现出低毒性及良好的生物活性,已在材料化学、药物化学、有机化学和有机金属化学等许多领域有广泛的应用,并愈来愈受到研究者的青睐。而蛋白质组学是一门在蛋白质水平上认识生命机理的学科,其学术理念和相关技术方法已被广泛应用于生命科学的各个领域,涉及多种重要的生物学现象,并已成为人类重大疾病诊断、治疗和寻找药物靶点的有效方法之一。小分子药物的作用靶点通常是蛋白质,而蛋白质组学是一种应用化学小分子来检测整个目标蛋白质组的手段,从整体水平上,观察蛋白质组的变化,发现差异表达蛋白并研究它的的生物功能以及与小分子的作用机理,从而找到新的药物靶点或者发现具有药用价值的小分子。人体血液中的蛋白质几乎与机体中所有的细胞、组织、器官有关,血液蛋白的动态变化可以直接反应机体的健康情况,是研究各类疾病相关标志物最有价值的标本。本发明化合物1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑通过在模拟人生理温度条件下,进行血清与化合物相互结合的体外培养,并采用蛋白质组学研究方法结合maldi-tof-ms技术开展在化合物存在时的血清蛋白质组学研究,分析差异表达蛋白,寻找特定疾病的特异血清蛋白标志物或者发现新的疾病相关蛋白质,为疾病的诊断或治疗提供新的依据,为1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑可能作为新药物的开发提供更加直观的理论基础。技术实现要素:本发明提供一种1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑与血清作用检测差异蛋白的方法,其特征在于包括如下步骤:(1)将血清蛋白与1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物溶液混合均匀得样品a,恒温培养得样品b;(2)去除样品b中的高丰度蛋白得样品c(3)用bradford法对样品c的蛋白浓度进行定量。(4)进行双向电泳实验:①按每胶条蛋白质上样量1.3mg,上样总体积为455ul的标准水化上样,进行第一向等电聚焦;②第一向等电聚焦完毕后,将胶条平衡后转到聚丙烯酰胺凝胶进行第二垂直电泳实验;③电泳结束后进行考马斯亮蓝染色,脱色,保存,扫描分析;(5)胶片图像处理及质谱鉴定①凝胶图像分析,筛选出表达异常的蛋白点并做上标记;②差异蛋白点的酶解及质谱鉴定;(6)结果利用imagemaster5.0凝胶图像分析软件获得27个差异表达蛋白质点,再通过ncbinr的blast的检索,确定了1-27号差异表达蛋白的信息(见下表)。所述步骤(1)中1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物溶液为1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物的甲醇溶液,样品a中1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物的浓度为2.0×10-3mol/l;恒温培养:温度为37℃,转速为r=280rpm,时间为1h;所述血清蛋白优选人血清蛋白;所述步骤(2)中去除高丰度蛋白的方法优选按照andybio试剂盒要求去除高丰度蛋白;所述步骤(4)中胶条规格为24cm非线性ipg胶条ipgph=3~10nl。本发明的另一实施方案提供1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑在与血清蛋白作用确定差异蛋白中的应用。本发明的另一实施方案提供一种制备1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑的方法,其特征在于包括如下步骤:室温下,将1-叠氮基-4-氯代苯与苯乙烯溶于有机溶剂中,加入smi2,搅拌反应2.5小时后得到1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑;所述有机溶剂为thf与hmpa体积比为1:1的混合溶液;1-叠氮基-4-氯代苯、苯乙烯、smi2的摩尔比为1:1.0-1.2:2.0。与现有技术相比,本发明的优点在于:(1)本发明建立了1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物与人血清作用的差异蛋白检测的双向电泳研究方法,优点是样品处理时间短,操作简单,获得的图谱清晰,重复性好;共鉴定了27个差异蛋白,对进一步了解1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑作为活性化合物小分子参与转运和代谢过程中相关的血液蛋白信息及相关的代谢网络,及更为深入研究开发及利用1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑奠定科学合理的理论基础;(2)本发明提供了一种以smi2催化1-叠氮基-4-氯代苯与苯乙烯制备1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑的全新方法,该方法操作简便,收率高。附图说明图1为1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑的结构图;图2为人血清样品双向电泳图谱;图3为人血清样品与1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物相互作用的双向电泳图谱;图4为1号蛋白一级质谱图;图5为1号蛋白肽段分子量为1994.1335(+1)的二级图谱;图6为2号蛋白一级质谱图;图7为2号蛋白肽段分子量为1623.8837(+1)的二级图谱;图8为3号蛋白一级质谱图;图9为3号蛋白肽段分子量为2496.4016(+1)的二级图谱;图10为4号蛋白一级质谱图;图11为4号蛋白肽段分子量为1478.7638(+1)的二级图谱;图12为5号蛋白一级质谱图;图13为5号蛋白肽段分子量为1148.6721(+1)的二级图谱;图14为7号蛋白一级质谱图;图15为7号蛋白肽段分子量为1641.8093(+1)的二级图谱;图16为8号蛋白一级质谱图;图17为8号蛋白肽段分子量为2296.2661(+1)的二级图谱;图18为9号蛋白一级质谱图;图19为9号蛋白肽段分子量为3587.8601(+1)的二级图谱;图20为10号蛋白一级质谱图;图21为10号蛋白肽段分子量为1646.9363(+1)的二级图谱;图22为11号蛋白一级质谱图;图23为11号蛋白肽段分子量为1874.9916(+1)的二级图谱;图24为13号蛋白一级质谱图;图25为13号蛋白肽段分子量为2296.2661(+1)的二级图谱;图26为14号蛋白一级质谱图;图27为14号蛋白肽段分子量为1874.0706(+1)的二级图谱;图28为15号蛋白一级质谱图;图29为15号蛋白肽段分子量为1479.8237(+1)的二级图谱;图30为16号蛋白一级质谱图;图31为16号蛋白肽段分子量为2037.2269(+1)的二级图谱;图32为17号蛋白一级质谱图;图33为17号蛋白肽段分子量为2296.2036(+1)的二级图谱;图34为18号蛋白一级质谱图;图35为18号蛋白肽段分子量为1406.7456的二级图谱;图36为20号蛋白一级质谱图;图37为20号蛋白蛋白肽段分子量为1286.7281(+1)的二级图谱;图38为21号蛋白一级质谱图;图39为21号蛋白蛋白肽段分子量为1311.8309的二级图谱;图40为22号蛋白一级质谱图;图41为22号蛋白蛋白肽段分子量为2451.4080(+1)的二级图谱;图42为24号蛋白一级质谱图;图43为24号蛋白蛋白肽段分子量为1863.9534(+1)的二级图谱;图44为25号蛋白一级质谱图;图45为25号蛋白肽段分子量为1716.9952的二级图谱;图46为26号蛋白一级质谱图;图47为26号蛋白肽段分子量为1179.6797(+1)的二级图谱;图48为27号蛋白一级质谱图;图49为27号蛋白肽段分子量为1884.0687(+1)的二级图谱;图50为19号蛋白一级质谱图;图51为19号蛋白肽段分子量为2680.5447(+1)的二级图谱。具体实施方式为了便于对本发明的进一步理解,下面提供的实施例对其做了更详细的说明。但是这些实施例仅供更好的理解发明而并非用来限定本发明的范围或实施原则,本发明的实施方式不限于以下内容。实施例一、血液样品材料选用健康人血液标本男女各100例,平均年龄17±1岁。所有血样标本均在清晨空腹状态下采集,抽取体检者静脉血置于干净无菌的试管中,静置2小时后快速离心分层,保存于-80℃超低温冰箱。实施例二、血清样品与1,2,3-三氮唑化合物混合培养随机抽取12例血液样本(男女各6例)溶解收集上层血清蛋白,加入1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物储备液(储备液为1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑的甲醇溶液),使其在血清样品中的浓度为2.0×10-3mol/l,h混合均匀。取2ml混合血清样品和2ml对照血清样品放置37℃恒温箱,在转速280rpm条件下,孵育1小时。实施例三、去除血清中高丰度蛋白孵育后的血清样本均按andybio试剂盒要求进行操作。具体如下:1)取100ul冰浴的试剂a加入到20ul血清样本中混合均匀。2)放入-20℃冰箱冷藏90min。3)取出样品并在转速为15000g,4℃的条件下离心20min。4)小心去除上清液。5)取1ml冰浴的试剂b到沉淀中,混合均匀。6)混合液置于冰水中15min。7)然后在转速15000g,4℃的条件下离心混合液20min。8)小心去除上清液。9)沉淀样品自然风干。10)按10mg/ml的比例加入蛋白裂解液使风干样品完全溶解,所得白色溶液即为去除高丰度蛋白样品。实施例四、bradford法测样品溶液中的蛋白浓度1)配制bradford溶液。2)配制标准蛋白溶液,精确称量牛血清蛋白样品用超纯水配制成1mg/ml溶液。3)用bradford溶液将标准蛋白储备液稀释成0、2、4、6、8、10μg/ml的系列浓度。4)利用紫外分光光度法测定系列标准蛋白溶液在595nm处的吸光度值,并根据标准蛋白浓度和相应的吸光度值做成标准曲线方程。5)测定目标蛋白样品溶液在595nm条件下的吸光度值,制作标准曲线,计算出样品中蛋白浓度。实施例五、双向电泳实验步骤1)水化上样在室温20℃下,按每胶条蛋白质上样量1.3mg,上样总体积为455ul的标准在一次性水化盘内采用胶内水化上样,时间为18h,胶条规格为24cm非线性ipg胶条ipgph=3~10nl。2)第一向等电聚焦在20℃条件下,将水化结束后的胶条迅速转移至ettanipgphor3聚焦仪上。按表1中的参数运行:表1等电聚焦参数步骤项目电压(v)时间(h)1除盐25042除盐50023除盐100014升压1000-800035正式聚焦800011万vlu6保护1000任意3)制胶配制12.5%的垂直板聚丙稀酰胺凝胶,将胶母液注入到干净无水的玻璃夹层中,上部留1cm左右的空间,用饱和的正丁醇封面。4)胶条平衡等电聚焦结束后,将ipg胶条先后在平衡液ⅰ(每10ml平衡缓冲液现加入0.125g二巯基苏糖醇)和平衡液ⅱ(每10ml平衡缓冲液现加入0.125g碘乙酰胺)中震荡15min。所述平衡液i和ii的基本配方均为:ph=8.8,1.5mtris-hcl,尿素6m,甘油30%,sds2%,溴酚蓝0.002%。5)第二向-十二烷基硫酸钠聚丙稀酰胺凝胶电泳(sds-page)平衡后的胶条转至聚丙稀酰胺凝胶上方,排除胶条下所残留的气泡,用琼脂糖封胶液将胶条稳住。待琼脂糖凝固后,将凝胶玻璃板固定于垂直电泳模具上,插入电泳槽。循环水浴设置为16℃,按电功率5w运行1h,电功率7w运行至溴酚蓝指示剂到达凝胶底端约5mm处。6)染色及脱色将凝胶片切角作标记,再放入考马斯亮兰染色液中,水平震荡10h左右。染色后的凝胶片放入脱色液中,水平震荡20min,重复两次。再用超纯水洗脱至凝胶片背景色消失。实施例六、图像处理及质谱鉴定1)凝胶图像分析采用imagescanneriii扫描仪扫描凝胶图谱,扫描后的图像用imagemaster5.0分析软件进行分析,对比筛选出表达异常的蛋白点并做上标记。2)制作干胶粒挖出与标记蛋白相匹配的蛋白点,放入合适的ep管中并做好标记。依次加入超纯水、脱色液和乙腈进行洗涤脱色,得到的胶粒置于超净台小风吹干。3)蛋白样品酶解根据干胶粒体积,加入5-6ul的胰蛋白酶溶液(20ng/ul)至完全覆盖住胶粒,置于4℃冰箱1h,使胶粒充分吸收酶液。去除多余的酶液,再根据胶粒大小补加5-7ul的胰蛋白酶buffer,于37℃酶解13h左右。酶解后的蛋白样品在10000g,常温下离心5min,收集酶解液用于质谱鉴定。4)目标蛋白的质谱鉴定及数据库检索采用基质辅助激光解析飞行时间质谱进行差异蛋白的鉴定,测试前需以基质峰、酶自切峰进行校正。仪器参数设置:nd:yag激光器,335nm,200hz激光激发。将原始质谱数据输入matrixscience网站(http://www.matrixscience.com)进行搜索,可得到理论上与酶解肽段相匹配的蛋白。主要搜索参数:数据库(database):ncbiprot;酶(enzyme):胰蛋白酶(trypsin);种类(taxonomy):人(homosapiens);固定修饰(fixedmodification):脲甲基半胱氨酸carbamidomethyl(c);可变修饰(variablemodification):氧化(oxidation)。图2是对照组人血清样品的双向电泳图谱,图谱经imagemaster2-dplatinum5.0分析后检测到每张胶平均有356±9个蛋白点,图3是人血清样品与1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑化合物相互作用的双向电泳图谱,每张胶平均有359±7个蛋白点,将对照图谱与样品图谱进行匹配,以p≤0.05作为标准,经imagemaster2-dplatinum5.0分析后共确认差异蛋白27个,如3所示,差异点的编号已在图中显示。实施例七结果利用imagemaster5.0凝胶图像分析软件获得27个差异表达蛋白质点,再通过ncbinr的blast的检索,确定了这些蛋白名称(见表2),分别为:角蛋白1,血清白蛋白前原蛋白,纤溶酶原同种型1前体,血清转铁蛋白异构体1前体,α-2-巨球蛋白同种型的前体,补体c3前蛋白,白蛋白样,部分,免疫球蛋白α-2重链,部分,玻连蛋白前体,激肽原-1异构体2前体,a1bg蛋白,簇蛋白前原蛋白,皮质类固醇结合球蛋白前体,富含亮氨酸的α-2-糖蛋白1,α-1-抗胰凝乳蛋白酶前体,血清淀粉样蛋白p组分前体,recname:full=免疫球蛋白γ-1重链;altname:full=免疫球蛋白γ-1重链nie,载脂蛋白a-i亚型1前原蛋白,链a,影响淀粉样途径的转甲状腺素蛋白的共价二聚体,补充c1q亚组分亚基b前体,载脂蛋白c-iii前体,角蛋白,ii型细胞骨架6b,血清对氧磷酶/芳基酯酶1前体等。表21-(4-氯苯基)-5-苯基-1h-1,2,3-三唑与人血清样品作用后的差异蛋白信息实施例八1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑的制备室温下,取1-叠氮基-4-氯代苯(1.0mmol)与苯乙烯(1.0mmol)溶于thf与hmpa的混合溶剂中(10ml,体积比1:1)中,加入smi2(2.0mmol),搅拌反应2.5小时后(tlc检测原料消失),反应液浓缩后,用乙酸乙酯稀释、依次用水、饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩后,经硅胶柱层析得到1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑(淡黄色固体,232mg,收率90.7%,mp87-89℃,1hnmr(cdcl3,400mhz):δ=7.86(s,1h),7.45-7.37(m,3h),7.31(d,j=8hz,2h),7.23(d,j=7.8hz,2h);13cnmr(cdcl3,100mhz):δ=137.7,135.1,135.0,133.5,129.5,129.4,129.0,128.6,126.4,126.2)。实施例九室温下,取1-叠氮基-4-氯代苯(1.0mmol)与苯乙烯(1.2mmol)溶于thf与hmpa的混合溶剂中(10ml,体积比1:1)中,加入smi2(2.0mmol),搅拌反应2.5小时后(tlc检测原料消失),反应液浓缩后,用乙酸乙酯稀释、依次用水、饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩后,经硅胶柱层析得到1-(4-氯苯基)-5-苯基-1h-1,2,3-三唑(淡黄色固体,238mg,结构确证数据与报道一致)。室温下,取1-叠氮基-4-氯代苯(1.0mmol)与苯乙烯(1.2mmol)溶于thf与hmpa的混合溶剂中(10ml,体积比1:1)中,加入smi2(0.2mmol),搅拌反应2.5小时后,tlc检测显示反应液中反应物仍是主点,隐约可见目标产物点。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种咪康唑药物中间体α‑(2,4‑二氯苯基)‑β‑(1‑咪唑基)乙醇的合成方法与制造工艺
- 一种烯丙尼定药物中间体2‑(N‑烯丙基‑N‑2,6‑二氯苯基)氨基咪唑啉的合成方法与制造工艺
- 一种啶酰菌胺中间体2‑(4‑氯苯基) 硝基苯的制备方法与制造工艺
- 一种咪康唑药物中间体2,4,‑二氯苯基氯甲基甲酮的合成方法与制造工艺
- 一种阿立哌唑口服用液体干混悬剂及其制备方法与制造工艺
- 一种铑‑双磷配体四氟化硼盐及制备方法与制造工艺
- 用于制备AZD5363的方法和在其中使用的新颖中间体与制造工艺
- 用于治疗ADHD的达斯曲林(DASOTRALINE)剂量和方法与制造工艺
- 用于治疗ADHD的方法和达斯曲林(DASOTRALINE)组合物与制造工艺
- 药物活性物质的固体形式的制造方法与工艺