测量分子间和/或分子内相互作用的方法与流程
本发明涉及改进的测量粒子的分子间和/或分子内相互作用和/或粒子的修饰的方法。
发明背景
溶剂敏感的荧光染料,即部花青染料已被报道适合通过共价连接到蛋白质上而用于体内成像。这些染料可用于研究蛋白质的构象变化(hahn等人在j.am.chem.soc.2003,125,4132–4145中)。
聚甲炔染料已被报道可用作用于研究这些染料与生物大分子如核酸和蛋白质的非共价相互作用的光谱荧光探针(tatikolov,journalofphotochemistryandphotobiologyc:photochemistryreviews2012,13,55–90)。
还已报道,花青染料的光物理性质受生物分子内的分子环境影响,因此使这些染料适合作为生物物理研究中的荧光探针(levitus等人,quaterlyreviewsofbiophysics2010,1–29)。
蛋白质诱发的荧光增强是已报道的一种效应以描述在蛋白质结合至荧光探针附近的核酸时发生的荧光强度提高。特别地,共价连接到dna上的花青染料在蛋白质结合至dna时发生荧光强度提高(myong等人,pnas2011,108,7414–7418中;levitus等人,j.phys.chem.lett.2015,6,1819–1823中)。
部花青染料已被报道可用作检测和量化蛋白质活性如构象变化和配体结合的染料。此外,在wo2005/088308a2中公开了可结合至所选靶的生物传感器分子和检测靶生物分子和蛋白质活性的方法。
在wo2008/061706a1中公开了通过热光学表征测量粒子的相互作用,尤其是生物分子与配体之间的相互作用的方法。这种热光学表征基于由强温度梯度的建立产生的热泳。
发明概述
本发明涉及改进的测量粒子的分子间和/或分子内相互作用和/或粒子的修饰的方法。特别地,本发明的方法提供改进的灵敏度。此外,本发明的方法使用能够检测通过先前已知的方法不能以足够的灵敏度测量的相互作用的染料。此外,该方法不依赖于加热方法/来源,也不依赖于反应容器的几何构造(即该实验可在孔板中进行而不仅仅在毛细管中进行)。
在本发明的方法中,使用被一种或多种温敏染料标记的标记粒子。
在第一个方面中,本发明涉及一种测量标记粒子与配体之间的相互作用的方法。第一个方面的方法包括下列步骤:
a)提供包含在溶液中的标记粒子和配体的样品,其中所述标记粒子溶解或分散在溶液中或固定在固体载体上;
b)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
c)以溶液中的不同配体浓度重复步骤(a)和(b)多次;和
d)基于标记粒子的荧光的配体浓度依赖性变化测定标记粒子与配体之间的相互作用。
在第二个方面中,本发明涉及一种测量分子间和/或分子内相互作用的方法。第二个方面的方法包括下列步骤:
a)提供包含标记粒子的样品;
b)在第一温度下荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)将所述样品加热或冷却到第二温度;
d)在第二温度下荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征分子间和/或分子内相互作用和/或粒子的修饰/变化。
在第三个方面中,本发明涉及一种测量时间依赖性变化的方法。第三个方面的方法包括下列步骤:
a)提供包含标记粒子的样品;
b)荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)等待预定时间;
d)荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的时间依赖性变化。
在第四个方面中,本发明涉及一种测量环境依赖性变化的方法。第四个方面的方法包括下列步骤:
a)提供包含标记粒子的第一样品;
b)荧光激发所述标记粒子和检测第一样品中的受激粒子的第一荧光;
c)提供包含基本相同浓度的标记粒子的第二样品,其中第二样品不同于第一样品;
d)荧光激发所述标记粒子和检测第二样品中的受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的环境依赖性变化。
在第五个方面中,本发明涉及一种蛋白质标记试剂盒,其包含两种反应性染料,其中所述染料具有间隔基团,所述间隔基团具有能使染料与蛋白质共轭的反应性基团。
附图简述
图1显示使用peltier装置或红外激光器作为加热源的所选聚甲炔和呫吨染料的温度诱发荧光强度变化。
图2显示使用peltier装置作为加热源的各种染料的温度诱发荧光强度变化。
图3显示通过环境(例如ph)调制的染料monosulfocy5和dy647p1的温度诱发荧光强度变化。
图4显示使用peltier装置或红外激光器作为加热源的标记粒子的配体诱发荧光强度变化以测定配体ecossb对cy5-ssdna的结合亲和力。
图5显示在单个升高温度下的标记粒子的配体诱发荧光强度变化以测定配体blip对monosulfocy5-tem1的结合亲和力。
图6显示标记粒子的温度诱发荧光强度变化和在35℃下的配体诱发荧光强度变化以测定配体呋塞米(furosemide)对用monosulfocy5(a)或d647p1(b)标记的碳酸酐酶(caii)的结合亲和力。
图7显示在6℃和23℃下的标记粒子的配体诱发荧光强度变化以测定配体曲妥珠单抗(trastuzumab)对monosulfocy5-蛋白质a的结合亲和力。
图8显示在37℃下的标记粒子的配体诱发荧光强度变化以测定配体阿那白滞素(anakinra)对用dylight655b1至b4标记的il-r1蛋白质的结合亲和力。
图9显示在35℃至23℃之间冷却后的标记粒子的配体诱发荧光强度变化以测定配体pd169316对用cy5标记的p38α蛋白质的结合亲和力。
图10显示在加热后的标记粒子的配体诱发荧光强度变化以测定配体pd169316和birb对用cy5、z-cy5、oregongreen488、oregongreen488-trisnta、tamra或tamrax标记的p38α蛋白质的结合亲和力。
图11显示在37℃至45℃之间加热后的标记粒子的配体诱发荧光强度变化以测定配体blip对tem1和配体birb对p38α蛋白质的结合亲和力,用monosulfocy5或dy647p1标记。
图12显示在37℃至45℃之间加热后的标记粒子的配体诱发荧光强度变化以测定配体blip对tem1和配体pd169316对p38α蛋白质的结合亲和力,用monosulfocy5、dy630或dy631标记。
图13显示在单一给定温度下的标记粒子的配体诱发荧光强度变化,以得出独特的热光学曲线(thermo-opticalprofile)。
图14示意性显示在染料与粒子之间的间隔基长度对标记粒子的配体诱发荧光强度变化的影响。
图15显示使用peltier装置的单独的和与p38α蛋白质和tem1共轭的染料monosulfocy5和setau的温度诱发荧光强度变化。
图16显示与mbk和tem1共轭的monosulfocy5的温度诱发荧光强度变化以测定热去折叠。
图17和18显示在结合和未结合状态下荧光随温度的变化的示例性示意图。
图19a至19e显示特定染料的结构。
发明详述
本发明提供测量粒子的分子间和/或分子内相互作用和/或粒子的修饰的方法。本发明的方法提供改进的灵敏度。此外,本发明的方法使用这样的染料,其能实现检测出通过先前已知的方法不能以足够的灵敏度检测出的相互作用。
根据本发明,粒子的修饰包括例如粒子的糖基化、磷酸化、脂化、羰基化、氧化等。
术语相互作用包含生物分子(例如蛋白质、dna、rna、透明质酸等)之间以及(修饰的)(纳米)粒子/(微)珠和生物分子之间的相互作用。
特别地,本发明的方法能够测量分子如生物分子的稳定性,或分子(特别是生物分子)与例如如下物质的相互作用:另外的(生物)分子,特别是修饰的生物分子,粒子,例如纳米粒子或微粒,珠粒,例如微珠。也可用本发明的手段和方法测定这些特征的组合。但是要指出,本发明不限于生物分子的测量/表征。因此,也可通过本文中公开的手段和方法测量和测定其它化合物/粒子的特征,例如可以测定和/或测量动力学事件和分子相互作用。因此,也可通过本发明的方法测量化学反应(如无机或有机反应)。还想到测定复合物形成和/或它们的解离。
这种表征尤其包括测定生物物理学特征,如熔点或熔解曲线、复合物形成、蛋白质-蛋白质相互作用、蛋白质或肽折叠/去折叠、分子内相互作用、分子间相互作用、测定粒子或分子间的相互作用等。
相应地,借助本文中提供的方法,尤其可以测量、检测和/或验证生物、化学或生物物理学过程和/或调查、研究和/或验证样品如生物或制药样品。诊断试验也可行并且是本发明的实施方案。尤其设想了并且可行的是测量蛋白质或核酸分子如双链dna或双链rna(dsdna/dsrna)或杂交核酸分子如dna/rna杂交体的熔解特征,测量和或分析核酸序列,如检测和/或测量单核苷酸多态性(snps)或对应于和作为它们的相对长度函数测量核酸分子的稳定性;测量和/或验证pcr最终产物,例如在普通医疗诊断中,以及在极体诊断、植入前诊断、法医分析中。相应地,对技术人员明了的是,本发明中提供的手段和方法特别地并且非限制性地可用于其中涉及给定粒子/分子与其它分子/粒子的亲和力的测量和/或验证。例如,本文中提供的方法以及装置可用于检测和测量核酸分子和蛋白质的温度稳定性以及熔点。因此,在本发明范围内的是,例如,在合成后或合成过程中测量和验证(dna-)引物和(dna-或rna-)探针。也设想了在模板如dna芯片上的核酸分子的测量。术语熔解在本发明中是指生物分子如核酸(例如rnas、dnas)或蛋白质的热变性。
在本发明中也设想了核酸分子中的突变和遗传变异的测量、检测和/或验证,例如以单链构象多态性(sscps)的形式或以限制性片段长度多态性(rflps)等形式。本发明还提供了分析异源双链的可能性。异源双链由例如野生型和突变dna分子的混合物的热变性和再退火生成。特别也可测量蛋白质结合到dna分子上对dna分子的稳定性的影响。还可测量蛋白质的热稳定性和分子(例如小分子、药物、药物候选物)对热变性的影响。
例如,蛋白质-蛋白质相互作用,如蛋白质结构的或蛋白质的或其片段的复合物形成的测量也在本发明的范围内。这样的测量包括但不限于抗体-抗原结合反应(也为单链抗体、抗体片段、chromobodies等形式)的测量。本发明的实施方案还涉及解离事件(例如蛋白质复合物的解离)的检测和或测量。因此,本发明也可用于解离事件的测量、测定和/或验证,如蛋白质复合物例如抗体-抗原复合物等的解离的测量。
本发明不限于短dna的检测或双链或单链核酸分子的测定。也可测量粒子/分子之间的相互作用,如下物质的构象、水力半径、结合动力学和稳定性:粒子/分子,例如蛋白质、核酸(例如dna、rna、pna、lna)、纳米粒子、珠粒,特别是微珠、脂质、脂质体、囊泡、细胞、生物聚合物(透明质酸、藻酸盐等)、二维脂质片、无机物质(例如碳纳米管、巴基球等)、聚乙二醇(peg)。
在第一个方面中,本发明涉及一种测量标记粒子与配体之间的相互作用的方法。在这种方法中,可依赖于配体的浓度测量标记粒子与配体的相互作用。
本发明的第一个方面的方法包括下列步骤:
a)提供包含在溶液中的标记粒子和配体的样品,其中所述标记粒子溶解或分散在溶液中或固定在固体载体上;
b)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
c)以溶液中的不同配体浓度重复步骤(a)和(b)多次;和
d)基于标记粒子的荧光的配体浓度依赖性变化测定标记粒子与配体之间的相互作用。
优选地,在步骤a)中将标记粒子和配体以预定浓度在溶液中提供,或在标记粒子固定在固体载体上的情况下,将标记粒子以预定量提供且配体以预定浓度提供。这意味着预先确定各荧光测量中的标记粒子和配体的量并在步骤a)和b)之间不改变,例如由于洗涤步骤的改变。此外,在步骤a)中提供的溶液在步骤b)中用于在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
使用本发明的第一个方面的方法,可以获得显示标记粒子的荧光的配体浓度依赖性变化的结合曲线。由该结合曲线(也称为“热光学曲线”)可以测定粒子和配体的解离常数。因此,在本发明的一个特别优选的实施方案中,测量标记粒子与配体之间的相互作用的方法是测量粒子和配体的解离常数,如粒子-配体键的解离常数的方法。
优选地,可通过本发明的第一个方面的方法测定生物分子/配体、蛋白质/配体、蛋白质/蛋白质或受体/配体之间的相互作用。
在本发明的第一个方面的一个优选实施方案中,步骤(b)包括下列步骤:
ba)将所述溶液加热或冷却到预定温度;
bb)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
该附加加热或冷却步骤有利于预定温度的特定调节。为了测量1/1000的荧光相对差异,优选使用加热或冷却元件,如peltier元件或红外激光器控制预定温度。有利的是控制预定温度以避免随时间经过的温度漂移且使温度变化小于+/-1k,优选小于+/-0.5k。
因此,在一个优选实施方案中,本发明的第一个方面的方法包括下列步骤:
a)提供包含在溶液中的标记粒子和配体的样品,其中所述标记粒子溶解或分散在溶液中或固定在固体载体上;
ba)将所述溶液加热或冷却到预定温度;
bb)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
c)以溶液中的不同配体浓度重复步骤(a)和(b)多次;和
d)基于标记粒子的荧光的配体浓度依赖性变化测定标记粒子与配体之间的相互作用。
不希望受制于理论,但认为,当配体结合至标记粒子时,标记粒子(即共轭到粒子上的染料)的荧光变化基于下列理论原理:
热光学测量的最重要参数之一是如下定义的结合振幅δf归一:
这里,f是在温度t下的测量荧光值。比较在起始温度t始下和在不同的最终温度t终下的荧光值。两个荧光值的比率给出归一化荧光f归一。δf归一的值,即在结合和未结合状态的f归一值之间的差值应该尽可能大以实现具有最佳信噪比的最佳测量结果。图17显示在结合和未结合状态下随温度的荧光变化的示例性示意图。相应地指示所用荧光值。曲线的实际过程可大范围地变化。此外,完全可以想到以冷却溶液的方式进行测量,即t始和t终由此互换。
随着t始和t终之间的温度差提高,δf归一通常更高。但是,δf归一始终也依赖于所用荧光团以及标记的分子和滴定的配体。
|t终-t始|=δt
δf归一~δt
在许多相互作用中
|f结合(t始)-f未结合(t始)|=δf始已显示对滴定配体的浓度的依赖性。换言之,在没有温度变化的t始(即预定温度)的情况下已看出绝对荧光值的配体依赖性。但是,在结合和未结合状态之间的荧光相对变化
在大多数情况下极小(在几百分比的范围内)。在样品生产过程中,手动和自动化液体操作过程都生成数个百分比的靶浓度(和因此绝对荧光值)的随机偏差,由此掩盖了在t始下的绝对荧光的配体依赖性(即不利的信噪比)。因此优选在两种不同温度下测量荧光并计算(在不同温度下测得的)两个值的商,由此可以校正液体操作误差。
但是,取决于配体的随温度变化的荧光相对变化,即相对结合振幅ar也通常小,仍在几百分比的范围内并依赖于δt。
吸移误差不起任何作用,因为考虑的是相对值,但ar在小于未知温度tx的所有温度下为大约1(图18)。
仅在高于tx的温度下,ar开始偏离1,并且只有在这种情况下才能以高精度测量结合。ar越大或越小,即ar越偏离1,测量结果越好。
概括而言,这意味着应该在多于一种温度下测量荧光以消除吸移误差。另一方面,在测量开始时ar偏离1时的温度tx取决于所用荧光团、标记的靶分子和滴定的配体。这意味着应该扫描宽的温度范围以确定tx。温度t终理想地高于tx。根据ar与1相差多少,在一些情况下也优选较大的δt以实现足够的信噪比。但是,小的δt值是优选的,因为在大的δt值下,结合的热力学平衡可极大不同于在t始下的热力学平衡。
图18显示在结合和未结合状态下荧光随温度变化的示例性示意图。标记出上文提到的进一步的术语和值。由该图也明显的是,t始越大,δf始变得越大,但仅在t始>tx时。显示的荧光变化不必是线性的,指数衰减也有可能。为简单起见,图18显示线性函数。
要指出,本发明的方法不依赖于基于由强空间温度梯度的建立产生的热泳的热光学表征。
因此,在本发明的第一个方面的一个更优选的实施方案中,步骤(b)包括下列步骤:
b1)在第一预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
b2)将所述溶液加热或冷却到第二预定温度;
b3)在第二预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
在该优选实施方案中,在两种不同温度下在变化的配体浓度存在下测定标记粒子的荧光。如上文解释,该程序能够消除吸移误差。
在该优选实施方案中,可基于在第二预定温度下的荧光f2除以在第一预定温度下的荧光f1的比率(即f2/f1)的配体浓度依赖性变化来测定标记粒子和配体之间的相互作用。
在本发明的第一个方面中,预定温度是配体结合至标记粒子时的温度。换言之,预定温度是这样的温度:在该温度,在荧光激发中发生构象变化的染料的分数由于配体结合至标记粒子而变化。此外,预定温度是染料的光异构化率或内部转化率由于配体结合至标记粒子而变化时的温度。
在本发明中,术语配体“结合”至标记粒子是指共价结合或通过分子间力如离子键、氢键和范德华力结合。
当在下文中提到“预定温度”时,同样适用于在本发明的第一个方面的更优选实施方案中的第一预定温度和第二预定温度。
有利的是根据相应粒子的性质选择预定温度。在这方面,预定温度应该优选低于粒子溶解、去折叠和/或改变的温度。以粒子为蛋白质的情况为例,可优选将预定温度调节到低于蛋白质的热变性起始温度。可通过尤其如wo2017/055583a1中所述进行热稳定性测量来测定起始温度。
本发明的第一个方面中的预定温度优选在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。优选生成稳定的预定温度,即将预定温度控制在窄范围内,优选在+/-1k内,更优选在+/-0.5k内。
通常,室温波动大于+/-1k,即使通过例如空调主动控制。因此,如果预定温度是室温,必须进一步控制预定温度以实现稳定的预定温度。更优选地,预定温度不同于室温。室温是指20℃至25℃,优选25℃的温度。
同样地,在本发明的第一个方面的更优选实施方案中,在加热或冷却步骤中的第一和第二预定温度优选在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。第一预定温度优选在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。第二预定温度优选在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。要理解的是,在加热的情况下,选择足够低的第一预定温度以使第二预定温度不超过其上述上限。同样地,在冷却的情况下,选择足够高的第一预定温度以使第二预定温度不超过其上述下限。如上所述,在此也有利的是,将第一和第二预定温度稳定地控制至低温度波动,优选小于+/-1k。
第一预定温度和第二预定温度之差通常在+/–0.1k至+/–90k的范围内。这是指温度差的绝对值|t第二–t第一|在0.1k至90k之间,即温度差可为正的(加热)或负的(冷却)。优选地,温度差在+/-1k和+/-40k的范围内,更优选在+/–1k至+/-20k的范围内。低温度差是有利的,因为系统尽可能少地被温度变化干扰。本领域技术人员会认识到,通过冷却整个样品,有可能实现较高升温幅度(即通过激光加热)而不对温敏材料造成损坏。
在本发明的第一个方面的优选实施方案的方法中,可以使用选自加热或冷却流体或气体、加热元件(例如加热电阻器,或其它基于焦耳加热的元件,如金属加热元件、陶瓷加热元件、聚合物ptc加热元件、复合加热元件、半导体加热元件)或热电元件,例如peltier元件,或电磁辐射(如led,例如ir-led,或激光器,例如红外激光器,或微波)的加热或冷却源进行加热或冷却。
优选使用peltier元件,因为其可用于加热样品和/或冷却样品(例如将样品冷却到环境温度以下)。特别地,通过peltier元件可通过调转电流方向而从加热切换到冷却。peltier元件是可加热以及主动冷却到室温以下的几种元件之一。
优选使用激光器,优选其电磁辐射直接被样品吸收的激光器,因为可在样品中快速和直接地改变温度而不机械接触样品。
激光辐射直接被样品吸收并转化成热,例如波长为980nm+/–30nm、1480nm+/–30nm、1550nm+/–30nm、1940nm+/–30nm的红外激光极好地被水吸收并极快加热。这种加热方法是无接触的,即快速并且没有污染风险。样品室仅必须对该激光透明但不需要良好的热导率,这不同于借助加热元件接触加热。
温度诱发荧光强度变化仅依赖于染料的物理化学性质(图1)。由于温度诱发荧光强度变化的程度仅依赖于染料的物理化学性质,其与所用的加热源无关。因此,基于染料在指定红外激光器开通时间(ir-laseron-time)下的荧光强度,可以评估探针的温度。
借助激光,仅加热纳升体积范围,通过荧光光学器件测量其荧光(检测体积通常仅为100μmx100μmx100μm=1nl体积)。不必加热更大体积,荧光光学器件通常无法检测更大体积的荧光。
在本发明的第一个方面的优选实施方案中,步骤(b2)和(b3)可以相继或同时进行。
根据本发明的第一个方面,粒子包括生物分子、纳米粒子、微粒和囊泡。粒子还包括生物细胞(例如细菌或真核细胞)或亚细胞片段、病毒粒子或病毒和细胞器等。纳米粒子还包括nanodiscs。nanodisc是由磷脂的脂双层构成的合成模型膜系统,具有由两个亲水蛋白质屏蔽(screened)的疏水边缘。
生物分子优选选自氨基酸、蛋白质、肽、单糖和二糖、多糖、脂质、糖脂、脂肪酸、甾醇、维生素、神经递质、酶、核苷酸、代谢物、核酸及其组合。更优选地,生物分子选自蛋白质、肽、酶、核酸及其组合。
优选地,(标记粒子中的)粒子是生物分子,最优选蛋白质或核酸。
蛋白质选自酶(例如碳酸酐酶、β内酰胺酶tem1、或激酶如mek1和p38)、转运蛋白(例如mbp)、抑制蛋白(例如β内酰胺酶抑制蛋白blip、阿那白滞素)、结构蛋白、信号蛋白、配体结合蛋白、陪伴分子(例如热休克蛋白hsp90)、抗体(例如曲妥珠单抗)和受体(例如白介素1受体)。
核酸包括dna、rna、lna和pna。锁核酸(lna),通常被称为不可达rna(inaccessiblerna),是一种经过修饰的rna核苷酸。lna核苷酸的核糖部分被连接2′氧和4′碳的额外桥修饰。肽核酸(pna)是类似于dna或rna的人工合成聚合物。dna和rna分别具有脱氧核糖和核糖骨架,而pna的骨架由肽构成,如通过肽键连接的重复n-(2-氨基乙基)-甘氨酸单元。各种嘌呤和嘧啶碱基通过亚甲桥(-ch2-)和羰基(-(c=o)-)连接到骨架。
在本发明中,纳米粒子是具有小于100nm的平均粒度的粒子。术语“平均粒度”描述了如通过使用例如brookhaveninstruments’90plus或malvernzetasizerz90粒度分析仪的动态光散射测得的平均有效直径。优选地,粒度为1nm至100nm,优选1至70nm。纳米粒子可以是有机或无机粒子。纳米粒子也可作为复合粒子存在,如具有附着于其表面的有机分子的无机核。
微粒是最长维度小于1mm但通常大于100nm的微观粒子。可使用透射电子显微术(tem)、扫描电子显微术(sem)和准弹性光散射(qels)的粒度分析法来表征微粒。微粒也可以微珠形式存在。
微粒可以是例如涂布或未涂布的二氧化硅-/玻璃-/可生物降解粒子、聚苯乙烯-/涂布-/流式细胞术(flowcytometry)-/pmma-/三聚氰胺-/nist粒子、琼脂糖粒子、磁性粒子、涂布或未涂布的金粒子或银粒子或其它金属粒子、过渡金属粒子、生物材料、半导体、有机和无机粒子、荧光聚苯乙烯微球、非荧光聚苯乙烯微球、复合材料、脂质体、细胞等。
市售微粒可以多种多样的材料获得,包括陶瓷、玻璃、聚合物和金属。日常生活中遇到的微粒包括花粉、砂、粉尘、面粉和糖粉。在生物系统中,微粒是衍生自与血流接触的细胞如血小板和内皮细胞的在血液中循环的小的膜结合囊泡。
微珠优选是最大维度小于5毫米的制造的固体塑料粒子。微珠也可以是均匀聚合物粒子,直径通常为0.5至500微米。
术语“修饰粒子”或“修饰珠粒”特别涉及包含或连接至分子(优选生物分子)的珠粒或粒子。这也包含用这些(生物)分子涂布这样的珠粒或粒子。
可以修饰根据本发明的粒子或珠粒以使例如生物分子如dna、rna或蛋白质能够结合(在一些实施方案中特异性和/或共价结合)到粒子或珠粒上。因此,珠粒和/或粒子,特别是附着于或连接至这样的珠粒或粒子的分子的特征分析在本发明的范围内。特别地,这样的分子是生物分子。相应地,术语“修饰(微)珠粒/(纳米-或微)粒子”特别涉及包含要分析或表征的附加分子的珠粒或粒子。修饰或未修饰的微粒/(纳米-或微)粒子能与溶液中的其它粒子/分子如生物分子(例如dna、rna或蛋白质)相互作用。
在本发明的方法中,使用被一种或多种温敏染料标记的标记粒子。在本发明中,“标记粒子”是指可通过荧光手段检测的荧光标记分子/粒子或其它分子/粒子,例如包含固有荧光团的分子/粒子,或附有荧光团的粒子/分子。特别地,标记粒子优选是附着至,例如共价结合至染料,或经高亲和力蛋白标签,如多组氨酸标签、flag标签或类似物可逆结合至染料的粒子。
蛋白标签是基因移植到重组蛋白上的肽序列。这些包括poly(his)标签、聚阴离子氨基酸,如flag标签,表位标签(epitopetags)如v5-tag、myc-tag、ha-tag和ne-tag,可允许特异性酶法修饰(如通过生物素连接酶生物素化)或化学修饰(如与flash-edt2反应以供荧光成像)的标签。
可用于本发明的染料是表现出温度依赖性荧光强度的染料,即当通过冷却或加热改变温度时染料的荧光强度提高或降低。这种现象被称为温度相关荧光强度变化。在本发明中,表现出这一行为的染料被称为“温敏染料”。优选地,用于本发明的染料在结合到粒子(即标记粒子)上时不仅表现出荧光强度中的温度诱发变化,还表现出其荧光强度的温度依赖性中的配体结合诱发变化。
本发明人已经发现,结合到粒子如生物分子上的染料的温度依赖性可用于测定配体与生物分子之间的相互作用参数。
不希望受制于理论,但相信这一发现基于下列理论原理:
花青染料的反式形式如cy5是荧光的,而顺式形式是非荧光的。花青染料的反式形式由于如下所示由离域电子造成的共振或稳变异构现象而是荧光的:
聚甲炔染料的荧光量子产率极大依赖于探针所处的分子环境,其决定顺-反光异构化的效率。荧光寿命极大依赖于温度和溶剂粘度,因为异构化是涉及大的分子运动的活化过程。如在染料结合至粒子如生物分子时所观察到的,当键旋转在空间上受阻时,荧光效率显著提高。结合到蛋白质上或内的染料分子的受激态c=c旋转在空间上受阻,并且较不可能转化成顺式异构体。在较高温度下,结合至蛋白质的染料的提高的振动自由度能允许更高的至“暗”顺式状态的转化率,这导致测得的荧光降低。如实施例中所示的实验证实,配体诱发的生物分子构象变化调制染料的荧光强度(这是结合至蛋白质的染料的振动自由度变化的后果)。由于该原因,有可能在单一温度下测量结合亲和力。此前尚未报道仅使用染料的温度依赖性测定配体与生物分子之间的相互作用参数的方法。
一旦形成,光异构体发生热反向异构化反应以产生热力学稳定的全反式异构体。光异构相对于其它两种过程的相对效率取决于温度、溶剂粘度和可能造成位阻的取代基的存在。重要地,较低温度造成较低异构化率和较高荧光产额。
染料的温度依赖性,即染料通过荧光强度变化对温度变化作出反应的固有性质,仅依赖于染料的化学结构。荧光分子的温度依赖性受其取代基的旋转自由度影响。具有强刚性(stronglyrigidized)结构的染料,例如但不限于atto647n、atto655和cf640r以可忽略不计的荧光强度变化对温度提高作出响应(图2)。因此,这些染料不适用于本发明。具有刚性较低的结构的染料(例如但不限于荧光素、oregongreen488、dy495、罗丹明、tamra、ir640)在温度提高时表现出荧光强度的明显降低。最敏感的染料属于聚甲炔染料类(例如但不限于cy3、monosulfocy3、dy567、cy5、monosulfocy5、dy630、dy647p1、dy650、alexa647和dylight655b1-b4)。这些染料的荧光是强温度依赖性的(图2)。
通过共轭至粒子(生物分子)调制染料的温度依赖性,以得出独特的热光学曲线(图15)。如对作为聚甲炔染料的代表的monosulfocy5所示,温度诱发的荧光强度变化在生物分子存在下极大降低,并且其显著依赖于共轭至染料的生物分子的性质(图15a)。方酸菁轮烷(squaraine)如setau的荧光强度对温度变化的敏感度小得多。在setau共轭至生物分子时,对温度的敏感性没有显著改变(图15b)。
具有中等至强温度依赖性的染料(例如但不限于呫吨染料(例如荧光素、罗丹明、tamra和dy495)和聚甲炔染料(例如cy3、monosulfocy3、dy547、cy5、monosulfocy5、dy630、dy631和dy647p1))非常适用于热光学研究。它们的温度依赖性显著地受与生物分子的共轭影响。
具有显著(significant)温度依赖性的染料(例如但不限于dylight655b3、ir650)可能不适用于热光学研究,因为它们的温度敏感性不受与生物分子的共轭的影响。
导致温度诱发荧光强度变化的染料的温度依赖性因此是最佳的用于热光学研究的染料所必需的但不是充分的。染料与生物分子之间的相互影响独特地决定染料的热光学曲线的效率和敏感性(图5和13)。此前尚未报道仅使用染料的温度依赖性测定配体与生物分子之间的相互作用参数的本方法。
可用于本发明的染料应该表现出优选>0.3%/k,更优选>0.5%,最优选>1%/k的在游离形式下的温度依赖性。
染料的温度依赖性必须通过共轭至标记粒子来调制。染料应该表现出优选>0.3%/k,更优选>0.5%/k,最优选>1%/k的在共轭形式下的温度依赖性。
染料应该优选具有低的在标记后造成标记粒子聚集的趋势。
尽管磺酸根或类似基团并入染料导致标记的生物分子的聚集降低,但染料在与生物分子共轭后的低净电荷(优选≥-2)对染料的最佳热光学曲线而言是优选的。
用于配体
用于配体
热光学读取的灵敏度可以通过改变在染料与生物分子之间的间隔基的长度和化学性质调制(图10和14)。具有独特化学性质(如z-cy5中的两性离子特性)的较长连接基与具有经典的己酰基间隔基的cy5相比有助于广泛感测配体诱发的构象变化(图10a)。太短间隔基,如在oregongreen488或tamra中的那些,可能阻碍高效感测微环境中的变化,这是由于生物分子中的配体诱发的构象变化(图10b-c)。染料与生物分子之间的间隔基的长度和化学性质因此决定了热光学剖析的灵敏度。决定了共轭后的染料与生物分子之间的距离的间隔基长度应该最优选比两个ch2基团长。
生物分子对染料的温度依赖性的调制取决于染料在共轭至生物分子后表现出的净电荷。如实验证实,磺酸根基团的数量提高与热光学读取的质量负相关(图8),其中用含有苯并吡喃嗡核和各种数量的磺酸根基团的聚甲炔染料标记il-r1。测定配体阿那白滞素对标记的il-r1的亲和力。较大(>2)数量的磺酸根基团降低该染料对热光学剖析(profiling)的适用性。分别带有1个和2个磺酸根基团的羰花青染料monosulfocy5和dy647p1的比较表现出类似效应,这表明磺酸根基团数关键性地决定了该染料对热光学研究的适用性(图11)。
特定染料可用于特定用途以实现最佳信噪比。噪音被定义为不是由配体结合造成的热光学信号的变化。如图12中所示,不对称聚甲炔染料dy630和dy631在检测蛋白质-蛋白质相互作用的测定中优异(图12a),但在检测小分子与蛋白质的结合的测定中表现出不良的热光学曲线(图12b)。另一方面,对称羰花青染料monosulfocy5在检测小分子与蛋白质的结合的测定中表现出优异的曲线(profile)。
可用于本发明的温敏染料优选选自聚甲炔染料和呫吨染料。聚甲炔染料优选包括对称和不对称花青染料或具有苯并吡喃嗡核的聚甲炔染料。呫吨染料包括罗丹明染料和荧光素染料。
优选的具有苯并吡喃嗡核的聚甲炔染料包括但不限于chromeop543、dy630、dy631、dy650、dylight655b2、dylight655b3。优选的花青染料包括但不限于cyanine2、cy3、monosulfocy3、cy5、monosulfocy5(形式1)、monosulfocy5(形式2)、disulfocy5、z-cy2、z-cy5、monosulfoz-cy5、alexa647、dy547p1和dy647p1。优选的呫吨染料包括但不限于tamra、tamrax、dy495和oregongreen。更优选的呫吨染料包括但不限于tamrax和dy495。
尤其优选的染料是dy630、dy631、dylight655b2、dylight655b3、cyanine2、z-cy2、z-cy5、monosulfocy5(形式1)、monosulfocy5(形式2)和tamrax。图19a至19e显示上述染料的结构式。在图19a至19e中,染料有时显示为无间隔基团的纯染料,有时显示为包括间隔基团和反应性基团的反应性染料。
根据本发明的第一个方面,标记粒子优选用一种或多种染料标记,所述染料选自通式(i)、(iia)、(iib)或(iii)所示的染料:
其中
x1是o、s或cr5r6;
x2是o、s或cr7r8;
r1和r2各自独立地选自氢和可被取代的烷基;
r3、r4、r5、r6、r7和r8各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r1、r2、r3、r4、r5、r6、r7和r8的至少一个是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
a是0至4的整数;
b是0至4的整数;且
n是1至3,优选1或2的整数;
其中
x3和x4之一是nr9且x3和x4的另一个是o、s或cr13r14;
r9选自氢和可被取代的烷基;
r10、r11、r12、r13和r14各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r9、r10、r11、r12、r13和r14的至少一个是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
c是0至4的整数;
d是0至2的整数;
e是0至4的整数;且
m是1至3,优选1或2的整数;和
其中
y是or18或nr19r20;
z是o或+nr21r22;
r15、r16和r17各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是至少一个r17是间隔基团,染料通过该间隔基团共轭到粒子上;
r18是h或碱金属离子,
r19、r20、r21和r22各自独立地选自氢和可被取代的烷基,优选地,r19、r20、r21和r22各自相同;
f是0至3的整数;
g是0至3的整数;且
h是1至5的整数。
r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r19、r20、r21和r22的烷基优选是可被取代的c1–4烷基,例如但不限于甲基、乙基、丙基、正丁基、叔丁基、甲氧基乙基。
基团r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r19、r20、r21和r22优选不含引入可能在配体结合至标记粒子后干扰荧光强度变化的大位阻的大基团,如芳基。
r3、r4、r5、r6、r7、r8、r10、r11、r12、r13、r14、r15、r16和r17的烯基优选是可被取代的c1–4烯基。r3、r4、r5、r6、r7、r8、r10、r11、r12、r13、r14、r15、r16和r17的烷氧基优选是可被取代的c1–4烷氧基。
r1和r2的烷基可被选自烷氧基和磺酸根,优选甲氧基和磺酸根的一个或多个取代基取代。
r3、r4、r5、r6、r7和r8的羧酸酯基团、烷基、烯基或烷氧基可被选自氧基和磺酸根的一个或多个取代基取代,优选无取代基。
r9的烷基可被与r1和r2的烷基相同的取代基取代,并可优选被一个或多个磺酸根基团取代。
r10、r11、r12、r13和r14的羧酸酯基团、烷基、烯基或烷氧基可被与r3、r4、r5、r6、r7和r8的烷基、烯基或烷氧基相同的取代基取代,并可优选被一个或多个烷基,优选甲基取代。
r15、r16和r17的羧酸酯基团、烷基、烯基或烷氧基可被与r3、r4、r5、r6、r7和r8的烷基、烯基或烷氧基相同的取代基取代,并可优选不含取代基。
r19、r20、r21和r22的烷基可被与r1和r2的烷基相同的取代基取代,并可优选不含取代基。
间隔基团是这样的基团:染料通过其共轭到粒子上。最优选,间隔基团比两个ch2基团长,如己酰基间隔基团。
在本发明中,术语“磺酸”和“磺酸根基团”可互换使用并且是指基团“-so3-”。如本领域技术人员理解,该基团带负电荷。这种负电荷要求标记粒子内的相应正电荷(内盐)或在溶液中存在相应的正离子。正离子可以是可溶于包含标记粒子的溶液的任何离子并可优选选自铵离子、碱金属离子和碱土金属离子,最优选钠或钾离子。同样地,具有整体正电荷的标记粒子要求在溶液中的相应负离子。负离子可以是可溶于包含标记粒子的溶液的任何离子并可优选选自卤素离子、硫酸根离子、六氟磷酸根和四氟硼酸根离子。
式(i)的染料优选是通式(i’)所示的染料:
其中
x1是o或cr5r6;
x2是o或cr7r8;
r1、r2、r5、r6、r7和r8各自独立地为可被取代的c1–20烷基;
r3和r4各自独立地选自氢和磺酸或其盐;
条件是r1、r2、r5、r6、r7和r8之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;且
n是等于1或2的整数。
式(iia)或(iib)的染料优选是通式(iia’)或(iib’)所示的染料:
其中
x3和x4之一是nr9且x3和x4的另一个是cr13r14;
磺酸根基团在相对于nr9的4-位;
r9是可被取代的c1–c20烷基;
r11、r12、r13和r14各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r9、r13和r14之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
d是0至2的整数;
e是0至3的整数;且
m是等于1或2的整数。
再更优选地,式(iia’)或(iib’)的染料是通式(iia”)或(iib”)所示的染料:
其中
x3和x4之一是nr9且x3和x4的另一个是cr13r14;
磺酸根基团在相对于nr9的4-位;
r9是可被取代的c3–6烷基;
r13和r14各自独立地为可被取代的c1–4烷基;
条件是r9、r13和r14之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;且
m是等于1或2的整数。
式(iii)的染料优选是通式(iii’)所示的染料:
其中
y是oh或n(ch3)2;
z是o或+n(ch3)2;
r15和r16各自独立地为氢或卤素;
r17是间隔基团,染料通过该间隔基团共轭到粒子上;且
r17a是羧基或其盐。
优选地,所述通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的染料中的间隔基团是可被取代的c4至c20亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被脂环族基团、芳基、杂环基团、杂芳基或选自o、n和s的杂原子替代。更优选地,通式(i’)、(iia’)、(iib’)、(iia”)或(iib”)的染料包含该优选间隔基团。再更优选地,通式(i’)、(iia’)、(iib’)、(iia”)或(iib”)的染料包含共轭到生物分子上,优选共轭到蛋白质上的该优选间隔基团。
再更优选地,通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的间隔基团是可被取代的c4至c6亚烷基链,其中一个碳原子可被一个芳基替代。再更优选地,通式(i’)、(iia’)、(iib’)、(iia”)或(iib”)的染料包含这种再更优选的间隔基团。最优选地,通式(i’)、(iia’)、(iib’)、(iia”)或(iib”)的染料包含共轭到生物分子上,优选共轭到蛋白质上的这种再更优选的间隔基团。
优选地,所述通式(iii)或(iii’)的染料中的间隔基团是可被取代的c2至c10亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被脂环族基团、芳基、杂芳基、杂环基团或选自o、n和s的杂原子替代。更优选地,通式(iii’)的染料包含该优选间隔基团。再更优选地,通式(iii’)的染料包含共轭到生物分子上,优选共轭到蛋白质上的该优选间隔基团。
再更优选地,所述通式(iii)或(iii’)的染料中的间隔基团是可被取代的c3至c7亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被选自o、n和s的杂原子替代。再更优选地,通式(iii’)的染料包含这种再更优选的间隔基团。最优选地,通式(iii’)的染料包含共轭到生物分子上,优选共轭到蛋白质上的这种再更优选的间隔基团。
通式(iii)或(iii’)的染料也可包含如对于通式(i’)、(iia’)、(iib’)、(iia”)或(iib”)的染料的间隔基团定义的间隔基团。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)、(iib”)、(iii)或(iii’)的间隔基团通常不含两个连续杂原子。r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r17任一种的间隔基团通常是经亚甲基结合至染料结构的基团,即间隔基团r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14和r17在邻近染料结构的那端以亚甲基开始。间隔基团的远端,即间隔基团的连向粒子的那端,通常是羰基。此外,通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)、(iib”)、(iii)或(iii’)的间隔基团优选是可被取代的c4至c20亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被选自o、n和s的杂原子替代,其中该间隔基团的远端是包含三个ni(ii)离子的trisnta-ni络合物。换言之,间隔基团如图19e中示例性地对trisnta647和trisntaoregongreen488所示连向染料。trisnta经ni离子共轭到粒子上。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)、(iib”)、(iii)或(iii’)的间隔基团的取代基可选自氧基、c1-4亚烷基磺酸根和c1-4烷基。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的间隔基团的c4至c20亚烷基链可被选自氧基、c1-4亚烷基磺酸根和c1-4烷基,优选氧基、亚甲基磺酸根和c1-4烷基的一个或多个取代基取代。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的间隔基团的c4至c6亚烷基链可被与相应的c4至c20亚烷基链相同的取代基取代,并可优选被选自氧基的一个或多个取代基取代。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的上述c4至c20亚烷基链中的任选n-杂原子可被选自氢和c1-4烷基的取代基取代。
通式(iii)或(iii’)的间隔基团的c2至c10亚烷基链可被选自氧基和c1-4烷基,优选氧基的一个或多个取代基取代。
通式(iii)或(iii’)的上述c2至c10亚烷基链中的任选n-杂原子可被选自氢和c1-4烷基,优选氢的一个或多个取代基取代。
通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)、(iib”)、(iii)或(iii’)的间隔基团的亚烷基链中的任选脂环族基团、芳基、杂芳基、杂环基团可被选自氧基和c1-4烷基,优选氧基的一个或多个取代基取代。
该染料可获自dyomics、thermofischerscientific、lumiprobe、cyandye或kerafast。或者,用于本发明的染料可通过已知方法制备。制备苯并吡喃嗡染料如dy631的具体方法描述在us6,924,372b2中;dy647p1和monosulfody647p1的制备描述在us2013/0251637a9中;染料如z-cy5的合成描述在us8,197,758b2中;且制备monosulfocy5的方法提供在us5,268,486中。这些文献全文经此引用并入本文。
可通过使粒子(如生物分子)与具有能将染料共轭到粒子上的反应性基团的反应性染料反应形成标记粒子。特别优选的反应性基团是实施例中所用的n-羟基琥珀酰亚胺活化酯(nhs)基团。但是,反应性基团不限于nhs,而是可以使用能将染料共轭到粒子上的其它基团,如马来酰亚胺、酰胺、磺酰胺、脲和硫脲形成与n-羟基琥珀酰亚胺活化酯、磺酰氯、异氰酸酯、异硫氰酸酯、叠氮、炔、酰肼、羧酸和胺基团。原则上可以使用能将染料共轭到生物分子上的任何染料修饰。e.m.sletten和c.r.bertozzi在angew.chem.int.ed.engl.2009;48(38):6974–6998中已经研究了修饰生物分子的方法,其全文经此引用并入本文。
示例性的通用蛋白质标记程序包括下列步骤:
1.在相应的标记缓冲液中制备粒子;
2.加入染料并将其与粒子混合;
3.在暗处在给定温度下培养给定时间(大多数时间在冰上、rt或37℃);和
4.通过纯化方法,例如但不限于凝胶色谱法、排阻色谱法除去未结合的染料;作为洗脱缓冲液,可以使用测定缓冲液。
对于蛋白标签的标记,通常不需要除去游离染料,这是由于化学计量标记比(其中所有染料结合到标签上)。
由于染料应该经间隔基团连接到粒子上,上文提到的反应性基团通常连接到反应性染料中的间隔基团的另一端,即间隔基团在一端连向染料并在另一端连向反应性基团。在具有反应性基团的反应性染料与粒子反应后,染料经间隔基团连接到粒子上。
反应性染料可以蛋白质标记试剂盒提供。各试剂盒可含有足够用于多个蛋白质标记反应,如2至8,优选3至5个蛋白质标记反应的材料。根据所用蛋白质的量,可提供足够用于大约1000个微型实验的材料。
标记试剂盒包括反应性染料作为主要组分。优选地,试剂盒可如本发明的第五个方面分开包括多于一种染料,如两种或三种不同染料,更优选两种不同染料。蛋白质标记试剂盒优选进一步包含解释试剂盒在至少一种本发明的方法中的应用的指导手册。
另外,该试剂盒通常进一步包括选自缓冲液交换柱、纯化柱、标记缓冲液、适配器及其组合的至少一种。
配体结合至靶生物分子如蛋白质可导致宽范围的构象变化,如氨基酸侧链、环(loop)或域移动。本发明的第一个方面中可用的配体可以(但不限于)选自离子、金属、化合物、药物片段(小化学片段,其只能弱结合到生物靶)、碳水化合物、小分子如atp(具有低分子量(<900道尔顿)的有机化合物;小分子可有助于调节生物过程并通常具有大约1nm的尺寸)、药物、前药、脂质、生物分子、蛋白质如趋化因子和细胞因子、肽、类肽、酶、抗原、辅因子、核酸、适体、抑制剂、fc受体、ssdna、纳米粒子、脂质体、单层囊泡(包括小单层囊泡(suv)和巨单层囊泡(guv))、聚合物、有机分子、无机分子、金属络合物、激素、香料、加臭剂、粒子和(微)珠。优选地,配体选自离子、金属、化合物、药物片段、碳水化合物、小分子、药物、前药、脂质、蛋白质、肽、类肽、酶、核酸、适体、激素、香料和加臭剂。
在下文中,使用标记法“粒子→配体”显示粒子-配体组合,即粒子显示在箭头的左侧,相应配体显示在箭头的右侧。
优选的粒子→配体组合选自酶→脂质、受体→激素、受体→趋化因子、酶→抑制剂、受体→神经递质、受体→细胞因子、酶→离子、受体→离子、受体→氨基酸、酶→辅因子、受体→脂质、受体→甾醇、酶→片段、受体→肽、受体→片段、酶→代谢物、受体→受体、受体→糖脂、酶→dna、受体→加臭剂、受体→前药、酶→rna、受体→药物、酶→单糖→/二糖或多糖、酶→脂肪酸、酶→维生素、酶→前药、酶→药物、脂质体→蛋白质、转运蛋白→底物、抗体→抗原、病毒粒子→受体、病毒→结构蛋白、抗体→fc受体、陪伴分子→atp、ssdna→ssdna、适体→配体、陪伴分子→离子、rna→小分子、多糖→小分子、陪伴分子→蛋白质、dna→小分子、结构蛋白→结构蛋白、信号蛋白→信号蛋白、信号蛋白→小分子、信号蛋白→前药、信号蛋白→药物、信号蛋白→脂质、结构蛋白→离子、纳米粒子→蛋白质、细胞器→蛋白质、纳米粒子→dna、细胞器→脂质、纳米粒子→rna。最优选的粒子→配体组合选自酶→脂质、受体→激素、受体→趋化因子、酶→抑制剂、受体→神经递质、受体→细胞因子、酶→离子、受体→离子、受体→氨基酸、酶→辅因子、受体→脂质、受体→甾醇、酶→片段、受体→肽、受体→片段、酶→代谢物、受体→受体、受体→糖脂、酶→dna、受体→加臭剂、受体→前药、酶→rna、受体→药物、酶→单糖/二糖或多糖、酶→脂肪酸、酶→维生素、酶→前药、酶→药物、脂质体→蛋白质、转运蛋白→底物、抗体→抗原、病毒粒子→受体、病毒→结构蛋白、抗体→fc受体、陪伴分子→atp、ssdna→ssdna、适体→配体、陪伴分子→离子、rna→小分子、陪伴分子→蛋白质、dna→小分子、结构蛋白→结构蛋白、信号蛋白→信号蛋白、信号蛋白→小分子、信号蛋白→前药、信号蛋白→药物、信号蛋白→脂质、结构蛋白→离子。
最优选的粒子→配体组合选自酶→脂质、受体→激素、受体→趋化因子、酶→抑制剂、受体→神经递质、受体→细胞因子、酶→离子、受体→离子、受体→氨基酸、酶→辅因子、受体→脂质、受体→甾醇、酶→片段、受体→肽、受体→片段、酶→代谢物、受体→受体、受体→糖脂、酶→dna、受体→加臭剂、受体→前药、酶→rna、受体→药物、酶→单糖/二糖或多糖、酶→脂肪酸、酶→维生素、酶→前药、酶→药物、脂质体→蛋白质、转运蛋白→底物、抗体→抗原、抗体→fc受体、陪伴分子→atp、ssdna→ssdna、适体→配体、陪伴分子→离子、rna→小分子、陪伴分子→蛋白质、dna→小分子、结构蛋白→结构蛋白、信号蛋白→信号蛋白、信号蛋白→小分子、信号蛋白→前药、信号蛋白→药物、信号蛋白→脂质、结构蛋白→离子。在上述最优选的粒子→配体组合中,粒子和配体优选源自真核细胞,更优选源自人、小鼠、大鼠或灵长类动物细胞;或病原体,如疟原虫属、锥虫属、弧菌属、沙门氏菌属、结核分枝杆菌和病毒如寨卡病毒、埃博拉病毒、马尔堡病毒、尼帕病毒、严重急性呼吸综合征(sars)、中东呼吸综合征冠状病毒(mers-cov)、克里米亚-刚果出血热(cchf)、裂谷热(rvf)、hiv。
由于染料的温度依赖性受染料所处的局部环境影响,预期配体诱发的构象变化会转化成依赖于该系统中存在的配体浓度的独特热光学曲线(图13)。如对cy5-ssdna结合至蛋白质ecossb(即大肠杆菌单链dna-结合蛋白,图4)所示,通过染料所处的局部环境调制染料的温度依赖性可用于使用热光学手段和peltier装置或红外激光器作为加热源测定结合亲和力(图4)。也可在将探针冷却时施加热光学手段。如图9中所示,用红外激光器预热探针并在冷却时监测温度诱发荧光变化。作为冷却peltier装置的附加来源,可以使用冷却流体或气体(包括空气)。
生物分子如蛋白质的热去折叠以大的构象变化为特征。由于染料的温度依赖性受局部微环境影响并且这种环境在去折叠后改变,如对mbp和tem1所示,可以使用热光学手段测定生物分子的熔解温度(图16)。
本发明的第一个方面的方法中所用的样品是包含标记粒子和配体的溶液。在此,可将标记粒子溶解或分散在该溶液中。或者,可将标记粒子固定在固体载体上,使该固体载体与包含配体的溶液接触。优选,将标记粒子溶解或分散在溶液中。优选,使用缓冲剂将水溶液的ph值调节到2至10,更优选4至10,再更优选5至9,最优选6至8.5。
在本发明的第一个方面中,标记粒子在溶液中的优选浓度为10皮摩尔至1微摩尔,更优选100皮摩尔至100纳摩尔。配体浓度优选为0.01皮摩尔至1摩尔,更优选1皮摩尔至100毫摩尔,再更优选10皮摩尔至10毫摩尔。
在优选选自多孔板、微流体芯片、毛细管、比色皿、反应管、吸管端、微流路(microfluidics)、小滴(droplets)和半透明容器的样品室中提供样品。半透明容器可以是玻璃容器或塑料容器。
有利的是在具有在荧光激发光束方向上的1μm至500μm,特别是1μm至250μm,特别是1μm至100μm,特别是3μm至50μm,特别是5μm至30μm的厚度的室内提供样品探针。本领域技术人员会理解,术语室也是指例如毛细管、微流体芯片或多孔板。
本领域技术人员会理解,本文所用的术语“荧光”不限于“荧光本身”,本文中公开的手段、方法和装置也可利用其它手段,特别是冷光(luminescence),如磷光使用和利用。相应地,术语“荧光激发所述标记粒子和首先检测和/或测量所述受激粒子的荧光”涉及在上文指定的方法中的“激发步骤”并可包含冷光的相应激发,即用比后续发射的检测短的波长进行激发。因此,术语“再次(secondly)检测和/或测量粒子的荧光”在本文中是指检测激发后的所述发射的步骤。本领域技术人员机会认识到,在本发明中,“激发”波长和“发射”波长必须分开。
荧光激发所述标记粒子和检测受激粒子的荧光的手段不受限制并可使用技术人员已知的任何合适的手段。
根据本发明,用于激发,优选荧光激发标记粒子/分子的优选手段可以是选自激光器、纤维激光器、二极管激光器、led、卤素、led阵列、hbo(hbo灯是例如短弧灯,其中放电电弧在高压下在汞蒸气气氛中点火)、hxp(hxp灯是例如短弧灯,其中放电电弧在极高压下在汞蒸气气氛中燃烧。例如,与hbo灯相比,它们在明显更高压力下运行并且它们使用卤素循环。hxp灯生成紫外线和可见光,包括显著部分的红光)的任何合适的装置。
根据本发明,在溶液中用于检测受激粒子,特别用于检测荧光的优选手段可以是选自ccd摄影机(2d或线扫描ccd)、line-camera、光电倍增管(pmt)、雪崩光电二极管(apd)、cmos-摄影机的任何合适的装置。
本发明的方法可在任何合适的装置中进行。优选地,该方法可使用下列装置之一进行:monolithnt.115g/rmo-g009、monolithnt.115r/bmo-g008、monolithnt.115b/gmo-007或monolithnt.115picomo-006,但不限于此。
在第二个方面中,本发明涉及一种测量分子间和/或分子内相互作用的方法。第二个方面的方法包括下列步骤:
a)提供包含标记粒子的样品;
b)在第一温度下荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)将所述样品加热或冷却到第二温度;
d)在第二温度下荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征分子间和/或分子内相互作用和/或粒子的修饰/变化。
本发明的第二个方面的方法包括但不限于如本发明的第一个方面中的配体-标记粒子结合相互作用。此外,本发明的第二个方面的方法包括测量化学反应(如粒子的无机或有机反应,包括糖基化、磷酸化、脂化、羰基化、氧化)以及复合物形成和/或它们的解离的方法。
在第三个方面中,本发明涉及一种测量时间依赖性变化的方法。第三个方面的方法包括下列步骤:
a)提供包含标记粒子的样品;
b)荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)等待预定时间;
d)荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的时间依赖性变化。
本发明的第三个方面的方法可用于测量标记粒子的时间依赖性变化,例如用于构象变化、结合动力学的动力学测量或稳定性测量或用于质量控制测量。
在第四个方面中,本发明涉及一种测量环境依赖性变化的方法。第四个方面的方法包括下列步骤:
a)提供包含标记粒子的第一样品;
b)荧光激发所述标记粒子和检测第一样品中的受激粒子的第一荧光;
c)提供包含基本相同浓度的标记粒子的第二样品,其中第二样品不同于第一样品;
d)荧光激发所述标记粒子和检测第二样品中的受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的环境依赖性变化。
本发明的第四个方面的方法可用于测定环境变化对标记粒子的影响。这样的环境变化包括但不限于ph变化、温度变化、压力变化、溶剂变化、其它溶质如盐的浓度变化等。
在本发明的第二、第三和第四个方面的方法中,使用与本发明的第一个方面中所述的相同染料标记的相同标记粒子。术语相互作用以与本发明的第一个方面中相同的方式使用。进行本发明的第二、第三和第四个方面的方法的温度优选对应于本发明的第一个方面的预定温度。本发明的第二个方面中的温度差优选与本发明的第一个方面中相同。这同样适用于加热和冷却方法。本发明的第二、第三和第四个方面中的样品溶液中的标记粒子浓度优选与本发明的第一个方面中相同。本发明的第二、第三和第四个方面中的优选粒子-配体组合优选与本发明的第一个方面中相同。也可使用相同的样品室。本发明的第二、第三和第四个方面中的用于荧光激发标记粒子和用于检测受激粒子的手段优选也与本发明的第一个方面中相同。
美国专利us9,676,787b2公开了某些苯并吡喃嗡化合物和它们在生物分子标记中的用途。在该文献中,仅检测配体。仅制备了稀释系列以展示与先前存在的染料相比,所公开的苯并吡喃嗡染料的改进的检测范围。原则上单一配体浓度足以证实该效应。因此,仅证实所涉染料适用于标准用途,如免疫印迹。在此,荧光强度依赖于留在测量样品中的荧光团的数量。详细地,该文献描述了下列程序:
(a)抗原(配体)在具有指定浓度的溶液中结合到表面。
(b)除去抗原溶液并洗涤表面。
(c)随后,将荧光染料标记的抗体添加到表面并培养。
(d)除去含有标记抗体的溶液并洗涤表面。
(e)检测经抗原结合到表面的抗体的荧光。
(f)没有描述进行实验的温度。但是,不需要小心控制温度,因为荧光变化很大。
阅读us9,676,787b2的技术人员会假设荧光强度变化源自这样的事实:由于表面上会结合或多或少的抗原,因此在荧光检测时会有或多或少少的抗体结合到表面。这暗示了各抗体表现出相同荧光强度,无论是否有配体结合到其上。另外,对于抗原的检测,单一抗原浓度是足够的。
这根本不同于本发明。
在本发明的方法中,可以检测配体与粒子之间的结合常数而非简单地检测配体的存在。因此,在检测开始时已预先确定配体和粒子的浓度。主要区别在于,测得的荧光强度变化不是源自荧光标记粒子量的变化而是源自感测环境的荧光染料的亮度变化,因此亮度随粒子的结合状态而变。详细地,本发明与上述文献的区别如下:
(a)各荧光测量中的粒子和配体的量预先确定并且不改变,例如由于洗涤步骤的改变。
(b)各标签(荧光团)亮度取决于标记粒子是否结合到配体上。
(c)小心控制温度,因为预期的荧光变化可能极小并且会被小的温度依赖性荧光变化掩盖。
在本发明中,荧光变化不是源自荧光粒子的不同量,而是源自基于是否结合了配体的各个粒子的荧光强度变化。特别地,当配体结合到标记的(荧光)粒子时,荧光可提高或降低。测定结合常数(被称为kd或ka)需要稀释系列。此外,配体和粒子在荧光测量过程中以预先确定的相同浓度存在。没有洗涤步骤。
本发明概括在下列项目中:
1.一种测量标记粒子与配体之间的相互作用的方法,其包括步骤:
a)提供包含在溶液中的标记粒子和配体的样品,其中所述标记粒子溶解或分散在溶液中或固定在固体载体上;
b)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
c)以溶液中的不同配体浓度重复步骤(a)和(b)多次;和
d)基于标记粒子的荧光的配体浓度依赖性变化测定标记粒子与配体之间的相互作用,
其中所述标记粒子用一种或多种染料标记,所述染料选自通式(i)、(iia)、(iib)或(iii)所示的染料:
其中
x1是o、s或cr5r6;
x2是o、s或cr7r8;
r1和r2各自独立地选自氢和可被取代的烷基;
r3、r4、r5、r6、r7和r8各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r1、r2、r3、r4、r5、r6、r7和r8的至少一个是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
a是0至4的整数;
b是0至4的整数;且
n是1至3,优选1或2的整数;
其中
x3和x4之一是nr9且x3和x4的另一个是o、s或cr13r14;
r9选自氢和可被取代的烷基;
r10、r11、r12、r13和r14各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r9、r10、r11、r12、r13和r14的至少一个是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
c是0至4的整数;
d是0至2的整数;
e是0至4的整数;且
m是1至3,优选1或2的整数;和
其中
y是or18或nr19r20;
z是o或+nr21r22;
r15、r16和r17各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是至少一个r17是间隔基团,染料通过该间隔基团共轭到粒子上;
r18是h或碱金属离子,
r19、r20、r21和r22各自独立地选自氢和可被取代的烷基,优选地,r19、r20、r21和r22各自相同;
f是0至3的整数;
g是0至3的整数;且
h是1至5的整数。
2.项目1的方法,其中标记粒子和配体在步骤a)中以预定浓度在溶液中提供或标记粒子以预定量固定在固体载体上提供且配体以预定浓度提供;并且在步骤a)中提供的溶液在步骤b)中用于在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
3.根据项目1或2的方法,其中步骤(b)包括下列步骤:
ba)将所述溶液加热或冷却到预定温度;
bb)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
4.根据项目1或2的方法,其包括下列步骤:
a)提供包含在溶液中的标记粒子和配体的样品,其中所述标记粒子溶解或分散在溶液中或固定在固体载体上;
ba)将所述溶液加热或冷却到预定温度;
bb)在预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
c)以溶液中的不同配体浓度重复步骤(a)和(b)多次;和
d)基于标记粒子的荧光的配体浓度依赖性变化测定标记粒子与配体之间的相互作用。
5.根据项目1或2的方法,其中步骤(b)包括下列步骤:
b1)在第一预定温度下荧光激发所述标记粒子和检测受激粒子的荧光;
b2)将所述溶液加热或冷却到第二预定温度;
b3)在第二预定温度下荧光激发所述标记粒子和检测受激粒子的荧光。
6.根据项目1至5任一项的方法,其中所述式(i)的染料是通式(i’)所示的染料:
其中
x1是o或cr5r6;
x2是o或cr7r8;
r1、r2、r5、r6、r7和r8各自独立地为可被取代的c1–20烷基;
r3和r4各自独立地选自氢和磺酸或其盐;
条件是r1、r2、r5、r6、r7和r8之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;且
n是等于1或2的整数。
7.根据项目1至5任一项的方法,其中所述式(iia)或(iib)的染料是通式(iia’)或(iib’)所示的染料:
其中
x3和x4之一是nr9且x3和x4的另一个是cr13r14;
磺酸根基团在相对于nr9的4-位;
r9是可被取代的c1–c20烷基;
r11、r12、r13和r14各自独立地选自羟基、羧基、磺酸、硫羟或其盐、氢、卤素、可被取代的羧酸酯基团、硝基、胺、酰胺、可被取代的烷基(优选c1–4烷基)、可被取代的烷氧基和可被取代的烯基;
条件是r9、r13和r14之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;
d是0至2的整数;
e是0至3的整数;且
m是等于1或2的整数。
8.根据项目7的方法,其中所述式(iia’)或(iib’)的染料是通式(iia”)或(iib”)所示的染料:
其中
x3和x4之一是nr9且x3和x4的另一个是cr13r14;
磺酸根基团在相对于nr9的4-位;
r9是可被取代的c3–6烷基;
r13和r14各自独立地为可被取代的c1–4烷基;
条件是r9、r13和r14之一是间隔基团,染料通过该间隔基团共轭到粒子上,其中所述间隔基团比两个ch2基团长;且
m是等于1或2的整数。
9.根据项目1至8任一项的方法,其中所述通式(i)、(i’)、(iia)、(iib)、(iia’)、(iib’)、(iia”)或(iib”)的染料中的间隔基团是可被取代的c4至c20亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被脂环族基团、芳基、杂环基团、杂芳基或选自o、n和s的杂原子替代。
10.根据项目9的方法,其中所述间隔基团是可被取代的c4至c6亚烷基链,其中一个碳原子可被一个芳基替代。
11.根据项目1至5任一项的方法,其中所述式(iii)的染料是通式(iii’)所示的染料:
其中
y是oh或n(ch3)2;
z是o或+n(ch3)2;
r15和r16各自独立地为氢或卤素;
r17是间隔基团,染料通过该间隔基团共轭到粒子上;且
r17a是羧基或其盐。
12.根据项目1至5或11任一项的方法,其中所述通式(iii)或(iii’)的染料中的间隔基团是可被取代的c2至c10亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被脂环族基团、芳基、杂芳基、杂环基团或选自o、n和s的杂原子替代。
13.根据项目12的方法,其中所述间隔基团是可被取代的c3至c7亚烷基链,其中所述亚烷基链的一个或多个碳原子可独立地被选自o、n和s的杂原子替代。
14.根据项目1至13任一项的方法,其中预定温度在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。
15.根据项目14的方法,其中预定温度不同于室温。
16.根据项目14或15的方法,其中预定温度是配体结合至标记粒子时的温度。
17.根据项目14或15的方法,其中预定温度是这样的温度:在该温度,在荧光激发中发生构象变化的染料分数由于配体结合至标记粒子而变化。
18.根据项目14或15的方法,其中预定温度染料的光异构化率或内部转化率由于配体结合至标记粒子而变化时的温度。
19.根据项目1至18任一项的方法,其中将预定温度控制在+/-1k内,优选在+/-0.5k内。
20.根据项目3至19任一项的方法,其中使用选自加热或冷却流体、加热或冷却气体、加热元件、peltier元件、电磁辐射及其组合的加热或冷却源进行加热或冷却。
21.根据项目5至20任一项的方法,其中第一预定温度在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。
22.根据项目5至21任一项的方法,其中第二预定温度在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。
23.根据项目5至20任一项的方法,其中第一和第二预定温度在-20℃至115℃的范围内,优选0.1℃至100℃,更优选在5℃至60℃的范围内,再更优选在10℃至60℃的范围内,最优选在10℃至40℃的范围内。
24.根据项目5至23任一项的方法,其中将第一和第二预定温度控制在+/-1k内,优选在+/-0.5k内。
25.根据项目5至24任一项的方法,其中第二温度和第一温度之差在+/–0.1k至+/-90k的范围内,优选在+/–1k和+/-40k的范围内,更优选在+/-1k至+/-20k的范围内。
26.根据项目1至25任一项的方法,其中在选自多孔板、毛细管、比色皿、反应管、吸管端、微流体芯片、小滴和半透明容器的室中提供样品。
27.根据项目1至26任一项的方法,其中所述粒子选自有机分子、生物分子、纳米粒子、微粒、囊泡、生物细胞或亚细胞片段、生物组织、病毒粒子、病毒和细胞器。
28.根据项目27的方法,其中所述生物分子选自氨基酸、蛋白质、肽、单糖和二糖、多糖、脂质、糖脂、脂肪酸、甾醇、维生素、神经递质、酶、核苷酸、代谢物、核酸及其组合。
29.根据项目28的方法,其中所述生物分子选自蛋白质、肽、酶、核酸及其组合。
30.根据项目29的方法,其中所述蛋白质选自酶、转运蛋白、抑制蛋白、结构蛋白、信号蛋白、配体结合蛋白、陪伴分子、抗体和受体。
31.根据项目30的方法,其中所述蛋白质选自酶、转运蛋白、抑制蛋白、陪伴分子、抗体和受体。
32.根据项目29的方法,其中所述核酸选自dna、rna、lna和pna。
33.根据项目1至32任一项的方法,其中溶液中的标记粒子浓度为10皮摩尔至1微摩尔,优选100皮摩尔至100纳摩尔。
34.根据项目1至34任一项的方法,其中配体浓度为0.01皮摩尔至1摩尔,优选1皮摩尔至100毫摩尔,更优选10皮摩尔至10毫摩尔。
35.根据项目1至34任一项的方法,其中所述配体选自离子、金属、化合物、药物片段、碳水化合物、小分子、药物、前药、脂质、蛋白质、肽、类肽、酶、核酸、纳米粒子、脂质体、suvs、guvs、聚合物、有机分子、无机分子、金属络合物、激素、香料、加臭剂、粒子和(微)珠。
36.项目1至35任一项的方法,其中粒子和配体选自被标为粒子→配体的下列组合:酶→脂质、受体→激素、受体→趋化因子、酶→抑制剂、受体→神经递质、受体→细胞因子、酶→离子、受体→离子、受体→氨基酸、酶→辅因子、受体→脂质、受体→甾醇、酶→片段、受体→肽、受体→片段、酶→代谢物、受体→受体、受体→糖脂、酶→dna、受体→加臭剂、受体→前药、酶→rna、受体→药物、酶→单糖→二糖或多糖、酶→脂肪酸、酶→维生素、酶→前药、酶→药物、脂质体→蛋白质、转运蛋白→底物、抗体→抗原、病毒粒子→受体、病毒→结构蛋白、抗体→fc受体、陪伴分子→atp、ssdna→ssdna、适体→配体、陪伴分子→离子、rna→小分子、多糖→小分子、陪伴分子→蛋白质、dna→小分子、结构蛋白→结构蛋白、信号蛋白→信号蛋白、信号蛋白→小分子、信号蛋白→前药、信号蛋白→药物、信号蛋白→脂质、结构蛋白→离子、纳米粒子→蛋白质、细胞器→蛋白质、纳米粒子→dna、细胞器→脂质、纳米粒子→rna。
37.项目1至36任一项的方法,其中测量标记粒子与配体之间的相互作用的方法是测量粒子和配体的解离常数的方法。
38.一种测量分子间和/或分子内相互作用的方法,其包括步骤:
a)提供包含标记粒子的样品;
b)在第一温度下荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)将所述样品加热或冷却到第二温度;
d)在第二温度下荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征分子间和/或分子内相互作用和/或粒子的修饰/变化,
其中所述标记粒子用一种或多种染料标记,所述染料选自如项目1或6至13任一项中定义的通式(i)、(iia)、(iib)或(iii)所示的染料。
39.一种测量时间依赖性变化的方法,其包括步骤:
a)提供包含标记粒子的样品;
b)荧光激发所述标记粒子和检测受激粒子的第一荧光;
c)等待预定时间;
d)荧光激发所述标记粒子和检测受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的时间依赖性变化,
其中所述标记粒子用一种或多种染料标记,所述染料选自如项目1或6至13任一项中定义的通式(i)、(iia)、(iib)或(iii)所示的染料。
40.一种测量环境依赖性变化的方法,其包括步骤:
a)提供包含标记粒子的第一样品;
b)荧光激发所述标记粒子和检测第一样品中的受激粒子的第一荧光;
c)提供包含基本相同浓度的标记粒子的第二样品,其中第二样品不同于第一样品;
d)荧光激发所述标记粒子和检测第二样品中的受激粒子的第二荧光;
e)基于第一和第二荧光表征粒子的环境依赖性变化,
其中所述标记粒子用一种或多种染料标记,所述染料选自如项目1或6至13任一项中定义的通式(i)、(iia)、(iib)或(iii)所示的染料。
41.一种蛋白质标记试剂盒,其包含两种或更多种反应性染料,其中各染料独立地包含如项目1或6至13任一项中定义的通式(i)、(iia)、(iib)或(iii)所示的结构单元,所述染料具有间隔基团,所述间隔基团具有能将染料结合到蛋白质的反应性基团。
42.项目41的蛋白质标记试剂盒,其进一步包含解释所述试剂盒在至少一种项目1至31任一项的方法中的应用的指导手册。
43.项目41或42的蛋白质标记试剂盒,其进一步包含选自缓冲液交换柱、纯化柱、标记缓冲液、适配器及其组合的至少一种。
实施例
试剂:
n-羟基琥珀酰亚胺(nhs)衍生染料获自thermofischerscientific(荧光素、oregongreen488、tamra)、lumiprobe(cy3、cy5、disulfocy5、cy5.5)、dyomics(dy495、dy567p1、dy630、dy631、dy647p1、dy650)、setabiochemicals(setau-647)、cyandye(monosulfocy3、monosulfocy5)和attotech(atto488、atto647n、atto655)。使用的所有染料的结构显示在图19a至19e中。蛋白质获自crelux(hsp90、p38α(p38alpha)、tem1、blip、麦芽糖结合蛋白(mbp)),碳酸酐酶ii(caii)购自sigma-aldrich。nhs标记缓冲液和染料分离柱获自nanotempertechnologiesgmbh。作为测定缓冲液使用补充了0.05%tween20的tris-mgcl2缓冲液[50mmtris-hcl、150mmnacl、10mmmgcl2]。
蛋白质标记:
靶蛋白(p38α、碳酸酐酶、tem1、hsp90)在碳酸盐缓冲液中在ph8.2下标记。染料-蛋白质比在3:1至5:1之间变化。标记反应在室温下进行30分钟。使用nanotempertechnologies提供的染料分离柱将游离染料与标记的蛋白质分离。
所用装置:
a)ir.red、ir.green或ir.blue:包含红色、绿色或蓝色荧光检测通道和红外激光器(波长1480nm)的nanotempertechnologiesprototypes用作加热源。所用滤光片是(激发/发射(nm)):ir.red500-580/655-720nm、ir.green515-555/618-652nm和ir.blue450-490/600-650nm。所用led是:ir.red20ma、2.1v、630nm;ir.green20ma、3.4v、540nm;和ir.blue20ma、3.4v、480nm。这些装置用于热光学表征不同荧光团和它们对报道结合事件的灵敏度。
b)prometheusnt.48:来自nanotempertechnologies的标准nt.48装置,其具有uv范围激发和检测光学元件。用peltier装置实现样品加热。主要用途是蛋白质的熔解曲线的检测。
c)pr.red:nanotempertechnologiesprototype,其使用与红色荧光检测通道(500-580/655-720nm)结合的基于peltier装置的样品加热。该装置用于热光学表征不同荧光团和它们对结合事件的灵敏度以及用于蛋白质的热去折叠。
荧光测量:
使用ir.red、ir.green或ir.blue(使用红外激光器加热探针)或pr.red(使用peltier装置加热探针)测量在加热后的荧光强度变化。对于这些实验,将探针加载到384孔板或定制玻璃容器中。探针含有游离染料、给定浓度的仅荧光标记靶或与给定浓度的荧光标记靶混合的特定配体的稀释系列。
数据采集和分析:
在数据采集过程中,来自模拟数字转换器的原始数据显示为荧光强度(任意单位)。然后将各个迹线归一化为在1开始。为了描绘结合曲线,设定加热之前和之后的区间并且平均该区间内的数据并计算f归一。结合曲线中的各数据点代表在特定配体浓度下的平均f归一。
用moaffinity分析软件(nanotempertechnologiesgmbh)或origin(originlab)测定解离常数(kd)。温度诱发的荧光强度变化归一化:初始荧光(fi)强度被定义为1且数据归一化为ft/fi,其中ft是在给定的提高的温度下的荧光强度。所得f归一对给定配体的递增浓度作图。根据这样的拟合测定解离常数(kd),所述拟合依照质量作用定律描述了的1:1化学计量比的分子相互作用。通过拟合下列方程估算kd:
其中f(c)是在给定配体浓度c下结合的分数,“未结合”是靶的f归一信号,“结合”是复合物的f归一信号,kd是解离常数或结合亲和力,且c靶是该测定中的靶的最终浓度。
参比例1
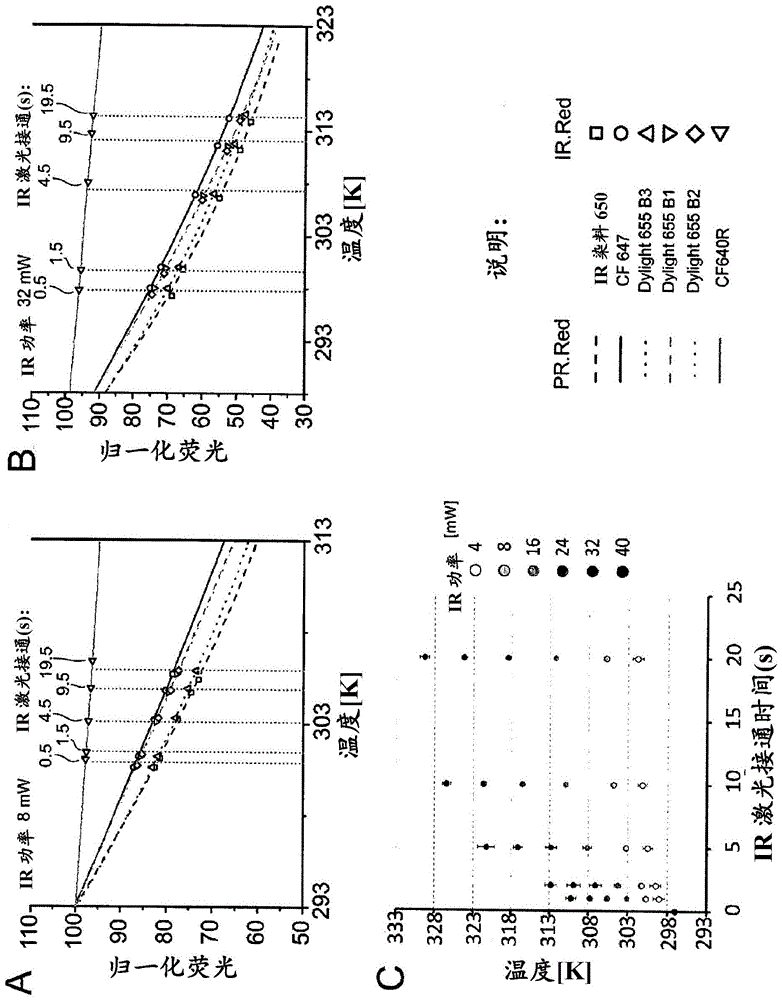
将在测定缓冲液中的100nmnhs-酯荧光团(ir染料650(li-corbiotechnology)、cf647(biotium)、dylight655b1、b2和b3(thermoscientific)和cf640r(biotium))一式两份加载到prometheusnt.48标准处理毛细管(nanotempertechnologies)中并在具有monolithnt.115blue/redoptic的ir装置中使用4、8、16、24、32和40mw红外激光功率进行热光学实验。监测红外激光诱发的荧光变化20秒。同样的样品也通过借助peltier元件以1k/min加热而施以线性升温。使用monolithnt.115blue/redoptic(nanotempertechnologies)收集样品荧光。关于分析,用来自使用在peltier装置中的线性加热的实验的温度和相对荧光损失来校正热光学实验中的相对荧光损失。结果提供在图1中。
在相同温度下,用pr.red观察到的温度诱发荧光强度变化严格地与用ir.red观察到的温度诱发荧光强度变化相关(图1a和1b)。
参比例2
染料在dmso中预稀释并在测定缓冲液中进一步稀释到100nm的最终浓度。然后将染料填充到高灵敏度prometheus玻璃毛细管中并一式三份加载到pr.red.中。将加热斜率设定为1k/min并从293–368k记录数据。结果提供在图2中。
参比例3
染料在dmso中预稀释并在给定缓冲液中进一步稀释到100nm的最终浓度。然后将染料填充到高灵敏度prometheus玻璃毛细管中并一式三份加载到pr.red.中。将加热斜率设定为1k/min并从293–368k记录数据。
已经发现,如图3中所示,温度诱发荧光强度变化另外也受到染料所处的环境调制。这种敏感性的程度取决于染料的结构。dy647p1和monosulfocy5是磺酸根基团数不同的聚甲炔染料。dy647p1具有两个磺酸根基团,monosulfocy5只有一个磺酸根基团。
实施例1
重组ecossb蛋白质如curthu.等人在biochemistry,1993,32(10),第2585–2591页中所述纯化,其全文经此引用并入本文。该蛋白质在50mmhepesph7.4、150mmnacl和2mmedta中以稀释系列从1μm稀释到0.4nm,每个浓度的最终体积为10μl。随后,将10μl含有在相同缓冲液中的20nmcy5-oligodt35(metabion)的溶液添加到各ecossb浓度中。将10ml各溶液填充到monolithnt.labelfreepremiumcoatedcapillaries(对于使用pr.redpeltier装置的实验)和monolithnt.115premiumcoatedcapillaries(对于在激光装置ir.red中的实验)中。在pr.red上在以7k/min从293k至368k的线性梯度中,和在ir.red上用16mw的激光功率,进行加热。将在302k的温度下的归一化荧光变化对ecossb浓度作图。结果提供在图4中。
实施例2
蛋白质标记:使用nhs标记缓冲液和1:3蛋白质/染料标记比用monosulfo-cy5标记蛋白质tem1。因此,将100μl的24μm染料溶液与100μl的8μm蛋白质溶液混合并在暗处在室温下反应30分钟。使用排阻色谱法除去游离染料。为此,在标记反应被加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。将blip在测定缓冲液中稀释到1μm。用该溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的132nm标记tem1添加到稀释系列中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管(premiumcoatedglasscapillaries)之前,样品在4℃和15,000g下离心10分钟。
用pr.red测量和数据分析:使用pr.red进行实验。使用20%led测量tem1对blip的亲和力。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图5中。
实施例3
蛋白质标记:使用nhs标记缓冲液和1:3蛋白质/染料标记比用monosulfocy5或dy647p1标记蛋白质caii。因此,100μl的24μm染料溶液与100μl的8μm蛋白质溶液混合并在暗处在室温下进行反应30分钟。如实施例2中所述使用排阻色谱法除去游离染料。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。呋塞米在测定缓冲液中稀释到50μm。用该溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的100nm标记caii添加到稀释系列中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用pr.red的测量和数据分析:使用pr.red进行实验。使用20%led测量caii对呋塞米的亲和力。使用origin软件(originlabcorporation)分析数据。结果提供在图6中。
实施例4
蛋白质标记:使用nhs标记缓冲液和1:3蛋白质/染料标记比用monosulfocy5标记蛋白质a。因此,100μl的24μm染料溶液与100μl的8μm蛋白质溶液混合并在暗处在室温下进行反应30分钟。如实施例2中所述使用排阻色谱法除去游离染料。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。曲妥珠单抗在pbs-0.05%tween20缓冲液中稀释到2.5μm。用该溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的10nm标记蛋白质a添加到稀释系列中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用ir.red的测量和数据分析:使用ir.red进行实验。使用20%led和切断ir激光测量蛋白质a对曲妥珠单抗的亲和力。使用mo亲和力分析软件(nanotempertechnologies)和graphpadprism7.0(graphpadsoftwareinc.)分析数据。结果提供在图7中。
实施例5
蛋白质标记:根据标准nhs标记程序用dylight655衍生物标记il-r1蛋白质。为此,染料在dmso中预稀释并在nhs标记缓冲液中进一步稀释到6μm的最终浓度。在相同的标记反应优化缓冲液中将蛋白质稀释到2μm的最终浓度。对于标记反应,将100μl染料溶液与100μl蛋白质溶液混合并在暗处在室温下进行反应30分钟。此后使用排阻色谱法除去游离染料。为此,在标记反应加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。
稀释系列的制备:在蛋白质标记后,制备配体阿那白滞素的连续稀释,样品体积为10μl。在制备系列稀释后,将10μl的1nm标记蛋白质添加到所有配体稀释液中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心1分钟。
用ir.red的测量和数据分析:使用ir.red在12mw的红外激光功率下进行实验以在60%的led功率下将探针加热到310k。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图8中。
实施例6
蛋白质标记:使用nhs标记化学用cy5标记p38alpha蛋白质。为此,染料在dmso中预稀释并在nhs标记缓冲液中进一步稀释到24μm的最终浓度。使用相同的标记反应优化缓冲液将蛋白质稀释到8μm的最终浓度。对于标记反应,将100μl染料溶液与100μl蛋白质溶液混合并在暗处在室温下进行反应30分钟。此后使用排阻色谱法除去游离染料。为此,在标记反应加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。含4%dmso的测定缓冲液充当测定缓冲液。pd169316在测定缓冲液中稀释到10μm和4%dmso。用该溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的100nm标记蛋白质添加到所有配体稀释液中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用ir.red的测量和数据分析:使用ir.red在24mw的红外激光功率和20%的led功率下进行实验。用红外激光器将探针预热到308k的温度。在探针冷却到296k后,监测荧光变化。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图9中。
实施例7
蛋白质标记:用oregongreen488tris-nta衍生物标记histaggedp38α。为此,染料在pbst中稀释到100nm的最终浓度,同时使用pbst缓冲液将蛋白质浓度调节到200nm。这两种样品1:1混合,最终体积为200μl并在暗处在室温下进行标记反应30分钟。此后将反应混合物在4℃和15,000g下离心10分钟。
使用nhs标记化学用oregongreen488、cy5、zcy5、tamra和tamrax标记histaggedp38alpha。为此,染料在dmso中预稀释并在nhs标记缓冲液中进一步稀释到6μm(对于z-cy5)和24μm(对于其它染料)的最终浓度。使用相同的标记反应优化缓冲液将蛋白质稀释到2μm(对于z-cy5)和8μm(对于其它染料)的最终浓度。对于标记反应,将100μl染料溶液与100μl蛋白质溶液混合并在暗处在室温下进行反应30分钟。此后使用排阻色谱法除去游离染料。为此,在标记反应加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。含4%dmso的测定缓冲液充当测定缓冲液。将用于z-cy5标记p38的pd169316和用于其它标记产物的birb在测定缓冲液中稀释到10μm和4%dmso。用该溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的100nm标记蛋白质添加到所有配体稀释液中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用ir.red的测量和数据分析:使用ir.red在24mw的红外激光功率下进行实验。对于染料cy5、z-cy5、oregongreen488和oregongreen488-trisnta,将探针从296k加热到310k,对于tamra和tamrax,加热到318k。由于染料荧光强度的固有差异,必须为各染料优化led功率。对于p38α-cy5,使用20%led功率测量,而p38alphaz-cy5使用60%led功率分析。tamra和tamrax标记的p38alpha使用100%和40%led功率测试。oregongreen488和oregongreen488-tris-nta标记的p38alpha分别使用100%和40%led功率检测。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图10中。
实施例8
蛋白质标记:蛋白质tem1和p38alpha都使用nhs标记缓冲液和1:3蛋白质/染料标记比用dy647p1和monosulfo-cy5标记。因此,将100μl的24μm染料溶液与100μl8μm蛋白质溶液混合并在暗处在室温下进行反应30分钟。如实施例2中所述使用排阻色谱法除去游离染料。
稀释系列的制备:在蛋白质标记后,制备配体的稀释系列。含4%dmso的测定缓冲液充当用于p38alpha对birb的测定缓冲液,同时测定缓冲液用于tem1对blip。birb和blip都在测定缓冲液中分别稀释到10μm和4%dmso和1μm。用这些溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的100nm标记p38alpha或132nm标记tem1添加到稀释系列中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用ir.red的测量和数据分析:使用ir.red在24mw的红外激光功率下在310k至318k之间的温度下进行实验。由于染料荧光强度的固有差异,必须为各染料优化led功率。对于dy647p1标记的tem1使用30%led功率和对于monosulfo-cy5标记的tem1使用80%led功率,测量tem1对blip的亲和力。使用30%led功率测量p38alpha-dy647p1对birb的亲和力,同时使用80%led功率分析p38monosulfo-cy5。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图11。
实施例9
蛋白质标记:使用nhs标记化学和分别1:3、1:3和1:5染料/蛋白质标记比用monosulfo-cy5、dy630和dy631标记蛋白质tem1和p38alpha。因此,将100μl的24μm染料溶液与100μl8μm蛋白质溶液混合并在暗处在室温下进行反应30分钟。如实施例2中所述使用排阻色谱法除去游离染料。
稀释系列的制备:在蛋白质标记后,制备配体blip和pd169316的稀释系列。含4%dmso的测定缓冲液充当用于p38alpha对pd169316的测定缓冲液,同时测定缓冲液用于tem1对blip。pd169316和blip都在测定缓冲液中分别稀释到10μm和4%dmso和1μm。用这些溶液开始,使用10μl的样品体积制备16步系列稀释。在制备系列稀释后,将10μl的100nm标记p38alpha或132nm标记tem1添加到稀释系列中。通过上下吸移混合样品。在加载高级涂覆玻璃毛细管之前,样品在4℃和15,000g下离心10分钟。
用ir.red的测量和数据分析:使用ir.red在24mw的红外激光功率下进行实验以将探针加热到310k至318k的温度。由于染料荧光强度的固有差异,必须为各染料优化led功率:对于dy630标记的tem1使用100%led功率、对于dy631标记的tem1使用80%led功率和对于monosulfo-cy5标记的tem1使用60%led功率。使用mo亲和力分析软件(nanotempertechnologies)分析数据。结果提供在图12中。
实施例10
蛋白质p38α和tem1都用monosulfo-cy5标记。另一p38alpha用setau647标记。为此,将染料溶解在dmso中并使用nhs标记缓冲液进一步稀释到24μm的最终浓度。对于1:3的蛋白质/染料比,使用nhs标记缓冲液将蛋白质稀释到8μm的最终浓度。对于标记反应,将100μl染料溶液与100μl蛋白质溶液混合并在暗处在室温下进行反应30分钟。此后使用排阻色谱法除去游离染料。为此,在标记反应加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。在b柱纯化后,将蛋白质直接加载到高灵敏度prometheus玻璃毛细管(1.6μm)中并使用pr.red以用下列装置设置以一式两份测量:1k/min;从293–368k。
游离染料在dmso中预稀释并在测定缓冲液中进一步稀释到100nm的最终浓度。然后将染料填充到高灵敏度prometheus毛细管中并一式三份加载到pr.red装置中。将加热斜率设定为1k/min并从293–368k记录数据。使用microsoftexcel分析数据。结果提供在图15中。
实施例11
蛋白质tem1和mbp都使用nhs标记缓冲液和1:3蛋白质/染料标记比用monosulfo-cy5标记。为此,将染料溶解在dmso中并在nhs标记缓冲液中进一步稀释到24μm的最终浓度。使用相同的标记反应优化缓冲液将蛋白质稀释到8μm的最终浓度。对于标记反应,将100μl染料溶液与100μl蛋白质溶液混合并在暗处在室温下进行反应30分钟。此后使用排阻色谱法除去游离染料。为此,在标记反应加载进入树脂之前,使用9ml测定缓冲液来平衡b柱。在加入300μl测定缓冲液后,使用600μl测定缓冲液洗脱标记的蛋白质。这里,前100μl不含任何蛋白质并弃置。在b柱纯化后,将蛋白质直接加载到高灵敏度prometheus玻璃毛细管(1.6μm)中并一式两份使用两种装置测量:pr.red使用1k/min从293–368k,prometheusnt.48使用5k/min从293–368k。由装置软件直接输出数据。结果提供在图16中。
- 还没有人留言评论。精彩留言会获得点赞!