一种控制氧化铁纳米粒子在动物脑内分布及其荧光检测方法与流程
本发明涉及纳米材料在动物体内分布的控制及检测表征,特别是控制氧化铁纳米粒子在动物脑内分布及其荧光检测方法,属于生物纳米材料及应用领域。
背景技术:
注入动物脑内的磁性氧化铁纳米粒子能否大部分地分布于细胞膜附近,对于在外磁场中触发神经元细胞膜通道具有关键的影响。多巴胺能神经元上的辣椒素受体trpv1非选择性阳离子通道的触发,可以诱导钙离子内流,达到促进多巴胺分泌的目的,可用于治疗多巴胺缺乏引起的退行性神经疾病。利用链霉亲和素(sa)与生物素(biotin)之间的特异性结合,事先在动物脑内特定部位注射微量的biotin,biotin是生物膜合成所需的成分,因而容易吸附于细胞膜上,再将sa修饰的氧化铁纳米粒子注入到动物脑内同一区域,利用sa与biotin之间的强结合作用,可以控制氧化铁纳米粒子大部分分布于动物脑内神经元细胞膜上。
在动物脑内微量注射的磁性氧化铁纳米粒子由于在组织内分布广且粒径小,使tem观察组织内纳米粒子在亚细胞结构的分布时变得困难,可以用荧光标记技术观察纳米粒子在黑质内的分布情况。
异硫氰酸荧光素(fitc)作为一种显绿色的荧光探针,可以与蛋白质中的氨基(-nh2)以及硫醇(-sh)基团共价结合。fitc最大吸收峰约480nm,最大荧光发射峰为520nm,这种荧光团的吸收及发射波长即使fitc与蛋白质结合后也没有明显的变化。因此将fitc-sa以化学交联的方式偶联在聚乙烯亚胺(pei)修饰的超顺磁性氧化铁纳米粒子(pei-spions)表面,用来标记纳米粒子使其呈绿色荧光。
腺相关病毒(aav)属于无包膜的单链dna病毒,只有在与腺病毒或疱疹病毒等辅助性病毒的共同参与下,宿主才能产生有致病性的aav。因aav不参与任何疾病的发生,转染力很强,表达周期长以及具有组织特异性等特点而被广泛应用。以脑立体定位注射的方式在dat-cre转基因动物黑质内注射腺相关病毒avv-dio-chr2-mcherry,这种腺相关病毒顺向转染神经元,可特异性转染多巴胺能神经元,而对其他细胞比如胶质细胞等不具备转染性,并表达光激活蛋白chr2,使细胞在特定频段的激光激发下产生动作电位。由于chr2-mcherry融合蛋白的读码框是反向的,其两侧各有一对反向的lox位点(loxp和1ox2272)。通过带有基因cre的腺相关病毒去转染细胞,使细胞的基因片段上带有cre酶系,细胞能够表达cre蛋白,然后cre会通过识别基因chr2-mcherry两对反向lox位点中的任意一对并使这对lox位点之间的序列倒置,最终细胞内表达chr2-mcherry蛋白,使多巴胺能神经元显红色荧光。
使用dapi(4’,6-二脒基-2-苯基吲哚二盐酸盐)溶液对细胞核进行染色。由于dapi可以透过完整的细胞膜,与细胞核内的dna结合后显示蓝色荧光,因此可以用于活细胞和固定细胞的染色,以便结合chr2-mcherry蛋白标记的多巴胺能神经元(显红色荧光)来判断氧化铁纳米粒子(氧化铁纳米粒子表面修饰层含fitc,显绿色荧光)是处于胞内还是胞外。
本发明提供一种控制氧化铁纳米粒子在动物脑内分布及其荧光检测方法。
技术实现要素:
本发明的目的是提供一种将链霉亲和素修饰的氧化铁纳米粒子分布于事先注入生物素的动物脑组织中的细胞膜表面的方法,及用荧光标记检测氧化铁纳米粒子分布于细胞膜上的方法。以下实施例用小鼠作为模拟实验。
具体步骤为:
(1)将15g聚乙二醇(peg)和0.3gpei加入50ml三口烧瓶中,以乙酰丙酮铁(fe(acac)3)为铁源,将回流时间和温度分别设置为1h和200-320℃,反应结束后使用甲苯、丙酮清洗,清洗完毕后分散在去离子水中,并使用ls磁珠分选柱滤去残留的聚合物以及甲苯、丙酮。得到聚乙烯亚胺修饰的氧化铁纳米粒子(pei-spions)。
(2)将13.2mg1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和10.0mgn-羟基琥珀酰亚胺磺酸钠盐溶于2ml0.01m的pbs缓冲液(ph=7.4)中,然后加入40-120μlfitc-sa(1mg/ml)。避光环境下活化10min,随后加入2-3μlβ-巯基乙醇以避免蛋白质交联。然后将2mlpei-spions(2mg/ml)加入混合液中,在摇床内(100r/min,25℃)反应3h。使用ls磁珠分选柱除去游离的fitc-sa,用0.01mpbs缓冲液彻底洗涤,重复三次,可得到fitc-sa/pei-spions,将其置于4℃冷藏柜中保存。
(3)荧光转染多巴胺能神经元:取8周龄以上的dat-cre转基因小鼠,通过腹腔注射适量的戊巴比妥钠溶液(80mg/kg)将其麻醉,使用剪刀将小鼠头部的毛发剪去,将头皮充分暴露出来,然后将小鼠头部固定在立体定位仪上。使用手术剪沿着矢状缝剪开头皮,分离上皮组织,并使用缝合线拉住上皮保持切口张开,露出颅骨,使用含75%酒精的棉球轻轻擦拭颅骨表面,进行消毒。p-97电极内灌满矿物油,彻底排出电极内气泡,使用nanoliter2000系统作为压力注射设备将p-97电极置于电极夹持器上,排出一定量的矿物油,然后吸取适量的avv-dio-chr2-mcherry,同时固定在脑立体定位注射仪上。avv-dio-chr2-mcherry为能够特异性感染并使多巴胺能神经元呈红色荧光的腺相关病毒。调整脑立体定位注射仪高度和水平位置,保证前囱(bregma)和后囱(lambda)两点位于同一水平面上。以bregma点作为零点,调节位置坐标至:ap:2.9mm,ml:±1.3mm,缓慢下降电极到达颅骨表面,并对电极下方的颅骨位置进行标记。然后上抬电极,在标记的位置处进行钻孔,露出硬脑膜,用注射器针尖挑破硬脑膜,暴露出脑结构,切勿触伤脑组织。将p-97电极调节至脑组织上方,根据深度坐标d-v:4.5mm缓缓下降电极,以每次50nl的量向黑质部位注射腺相关病毒,每点注射总量为150-300nl。病毒注射完成后,停留5~10min后再将电极缓慢抬出,防止压力过大使病毒溢出,以保证病毒能够更好的扩散。腺相关病毒注射完成后,使用手术缝合线将小鼠头部皮肤缝好,缝合处涂抹四环素软膏防止伤口感染。单笼单只并供水供食饲养2周以上。
(4)生物素定位注射:确定小鼠前/后囱的位置,调整前/后囱的高度,使其务必始终处在同一条水平线上。参照小鼠立体定位图谱,确定小鼠左侧黑质坐标,即前囟(p后):-2.9mm,旁开(r右):1.3mm,深度(h):-4.5mm。在前囱后2.9mm以及矢状缝右侧1.3mm处的位置钻孔,孔径约2mm。通过p-97电极吸取200-400nl浓度为1mg/ml溶解在人工脑脊液(acsf)中的生物素,将电极缓缓插入黑质坐标位置,以每次注入50nl的生物素溶液于黑质内,注射后留针10min。慢慢退针,并用手术缝合线将伤口缝合,并使用四环素软膏涂抹伤口以防止伤口感染,将小鼠挪至37℃左右的环境下,使其尽快回复正常;
(4)纳米粒子定位注射:注射生物素24h之后,参照步骤(2)立体定位方法,使用p-97电极抽取500nl浓度为1mg/ml的fitc-sa/pei-spions分散液(分散液为ph=7.2、浓度0.01m的pbs,并提前用0.22μl无菌滤膜过滤),将电极缓缓插入大鼠左侧黑质部位,随后以每次注入50nl的量将总量500nl纳米粒子分散液注入黑质内。注射完毕后停留10min,缓缓退针。随后使用手术线缝合切口皮肤,缝合完毕后用四环素软膏涂抹切口,防止伤口处感染。将实验后的大鼠挪到37℃左右的环境下,使其尽快恢复正常并供水供食,将其置于动物房中饲养。
(5)心脏灌注及取脑:4h后,参照先前麻醉步骤,将小鼠彻底麻醉后,使其平躺在手术板上,准备解剖。首先将小鼠胸骨毛皮处剪开,将毛皮与组织分离,竖直下刀剪开胸腔,将腹部剪开,看见肝脏。将胸骨与肋软骨掀开,使心脏露出,分辨出左心室和右心室(右心室为静脉血,色深;左心室为动脉血,色鲜),在心尖偏右处(左心室)插入针头,开始注射nacl注射液(温度最好比常温低10℃,效果较好),并用止血钳紧紧夹住针头的插口处,防止针头脱落,用剪刀在右心室剪开一个小孔使血液流出,通过体循环,将血液排出有利于解剖。此灌注过程中,先迅速再缓慢,尽可能的把毛细血管内的血液冲洗掉。内脏颜色变浅后,取下nacl注射液,迅速灌注4%pfa(多聚甲醛)溶液(含0.5%的戊二醛溶液以增加固定效果),使小鼠肌肉迅速硬化,抬起小鼠尾部、头部,若肌肉已基本硬化,则取下针管,此过程最多不要超过4min,因为缺氧4min后可导致组织消融。将大鼠头部取下,剪掉皮毛并刮去肌肉,沿鼻骨切断,颅骨沿中间划开,沿着冠状缝剥开,小心翼翼地取出大脑,切勿破坏脑结构,放入10ml离心管中,加入4%pfa溶液(含0.5%戊二醛)进行固定并4℃保存,标记。
(6)共聚焦显微镜观察的样品进行冰冻切片:小鼠取脑后,将大脑放置在含有4%pfa溶液(含0.5%戊二醛)的离心管中进行固定24h;弃去离心管中的pfa溶液,加入30%蔗糖溶液进行脱水处理,每24h更换一下溶液,待鼠脑沉入离心管底部,脱水完成;取出鼠脑,并用滤纸将表面的液体吸干,修块,并用o.c.t包埋剂将鼠脑固定在组织托上,置入冰冻切片机中冷却(-20℃),制成10μm的薄片;将盖玻片使用pbs缓冲液清洗过夜,保证玻片上的气泡完全排出,使用0.4μg/ml的dapi溶液对细胞核进行染色。由于dapi可以透过完整的细胞膜,与细胞核内的dna结合后显示蓝色荧光,因此可以用于活细胞和固定细胞的染色,以便结合chr2-mcherry蛋白标记的多巴胺能神经元(显红色荧光)来判断纳米粒子(表面涂层含fitc,显绿色荧光)是处于胞内还是胞外。
采用激光共聚焦显微镜分别对两组小鼠黑质部位的脑切片进行观察。
采用本发明技术方案具有如下有益效果:
本发明将生物素注入小鼠黑质部位,吸附于神经元的细胞膜上,形成结合位点,再将链霉亲和素修饰的氧化铁纳米粒子注入相同的黑质部位后,利用生物素和链霉亲和素之间的强特异性作用,使得氧化铁纳米粒子分布于神经元细胞膜表面。将荧光素fitc结合的sa修饰在pei-spions表面,来标记氧化铁纳米粒子使其在相应激发光下呈绿色荧光,用avv-dio-chr2-mcherry特异性转染多巴胺能神经元使其在相应激发光下呈红色荧光。利用激光共聚焦显微镜结合细胞的明场像及荧光成像就可以观察到氧化铁纳米粒子在细胞膜上的分布。
本发明中使用的纳米粒子毒性较低、生物相容性好,并且通过简单地向黑质提供微量生物素的方法,使sa修饰的纳米粒子附着在细胞膜上的量明显增加,并用荧光成像方法验证了这种使纳米粒子在体内附着于细胞膜的方案是可行的。这为利用磁性纳米粒子在外磁场中的磁热或扰动效应打开神经元膜通道提供了实施的基础。
附图说明
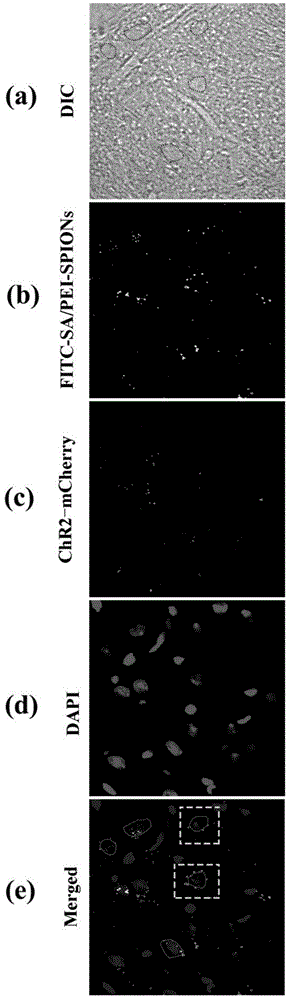
图1为本发明实施例1中氧化铁纳米粒子在小鼠脑组织上分布的激光共聚焦显微镜照片。图1(a):黑质切片(~10μm)在激光共聚焦扫描显微镜明场下的图片;图1(b):fitc标记的sa/pei-spions,图中白点皆为标记的纳米粒子;图1(c):chr2-mcherry标记多巴胺能神经元,图中的白点标记出呈点状的chr2-mcherry;图1(d):dapi标记包括神经元在内的所有细胞的细胞核,图中的灰色片状物质为细胞核;图1(e):图①-④的叠加图,方形虚线框中纳米粒子沿着细胞轮廓分布。
图2为本发明实施例2(对比实施例)中氧化铁纳米粒子在小鼠脑组织上分布的激光共聚焦显微镜照片。图2(a):黑质切片(~10μm)在激光共聚焦扫描显微镜明场下的图片;图2(b):fitc标记的sa/pei-spions,图中白点皆为标记的纳米粒子;图2(c):chr2-mcherry标记多巴胺能神经元,图中的白点标记出呈点状的chr2-mcherry;图2(d):dapi标记包括神经元在内的所有细胞的细胞核,图中的灰色片状物质为细胞核;图2(e):图①-④的叠加图,圆形虚线框中纳米粒子主要分布在细胞内
具体实施方式
为了使本发明更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1:
(1)将15gpeg和0.3gpei加入50ml三口烧瓶中,以fe(acac)3为铁源,将回流时间和温度分别设置为1h和260℃,反应结束后使用甲苯、丙酮清洗,清洗完毕后分散在去离子水中,并使用ls磁珠分选柱滤去残留的聚合物以及甲苯、丙酮。得到聚乙烯亚胺修饰的氧化铁纳米粒子(pei-spions)。
(2)将13.2mg1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐和10.0mgn-羟基琥珀酰亚胺磺酸钠盐溶于2ml0.01m的pbs缓冲液(ph=7.4)中,然后加入50μlfitc-sa(1mg/ml)。避光环境下活化10min,随后加入2μlβ-巯基乙醇以避免蛋白质交联。然后将混合液加入2mlpei-spions(2mg/ml)中,在摇床内(100r/min,25℃)反应3h。使用ls磁珠分选柱除去游离的fitc-sa,用0.01mpbs缓冲液彻底洗涤,重复三次,可得到fitc-sa/pei-spions,将其置于4℃冷藏柜中保存待使用。
(3)荧光转染多巴胺能神经元:取8周龄以上的dat-cre转基因小鼠,通过腹腔注射适量的戊巴比妥钠溶液(80mg/kg)将其麻醉,使用剪刀将小鼠头部的毛发剪去,将头皮充分暴露出来,然后将小鼠头部固定在立体定位仪上。使用手术剪沿着矢状缝剪开头皮,分离上皮组织,并使用缝合线拉住上皮保持切口张开,露出颅骨,使用含75%酒精的棉球轻轻擦拭颅骨表面,进行消毒。p-97电极内灌满矿物油,彻底排出电极内气泡,使用nanoliter2000系统作为压力注射设备将p-97电极置于电极夹持器上,排出一定量的矿物油,然后吸取适量的avv-dio-chr2-mcherry,同时固定在脑立体定位注射仪上。avv-dio-chr2-mcherry为能够特异性感染并使多巴胺能神经元呈红色荧光的腺相关病毒。调整脑立体定位注射仪高度和水平位置,保证前囱(bregma)和后囱(lambda)两点位于同一水平面上。以bregma点作为零点,调节位置坐标至:ap:2.9mm,ml:±1.3mm,缓慢下降电极到达颅骨表面,并对电极下方的颅骨位置进行标记。然后上抬电极,在标记的位置处进行钻孔,露出硬脑膜,用注射器针尖挑破硬脑膜,暴露出脑结构,切勿触伤脑组织。将p-97电极调节至脑组织上方,根据深度坐标d-v:4.5mm缓缓下降电极,以每次50nl的量向黑质部位注射腺相关病毒,每点注射总量为200nl。病毒注射完成后,停留5~10min后再将电极缓慢抬出,防止压力过大使病毒溢出,以保证病毒能够更好的扩散。腺相关病毒注射完成后,使用手术缝合线将小鼠头部皮肤缝好,缝合处涂抹四环素软膏防止伤口感染。单笼单只并供水供食饲养2周以上。
(4)生物素定位注射:确定小鼠前/后囱的位置,调整前/后囱的高度,使其务必始终处在同一条水平线上。参照小鼠立体定位图谱,确定小鼠左侧黑质坐标,即前囟(p后):-2.9mm,旁开(r右):1.3mm,深度(h):-4.5mm。在前囱后2.9mm以及矢状缝右侧1.3mm处的位置钻孔,孔径约2mm。通过p-97电极吸取300nl浓度为1mg/ml溶解在人工脑脊液(acsf)中的生物素,将电极缓缓插入黑质坐标位置,以每次注入50nl的生物素溶液于黑质内,注射后留针10min。慢慢退针,并用手术缝合线将伤口缝合,并使用四环素软膏涂抹伤口以防止伤口感染,将小鼠挪至37℃左右的环境下,使其尽快回复正常;
(5)纳米粒子定位注射:注射生物素24h之后,参照步骤(2)立体定位方法,使用p-97电极抽取500nl浓度为1mg/ml的fitc-sa/pei-spions分散液(分散液为ph=7.2、浓度0.01m的pbs,并提前用0.22μl无菌滤膜过滤),将电极缓缓插入大鼠左侧黑质部位,随后以每次注入50nl的量将总量500nl纳米粒子分散液注入黑质内。注射完毕后停留10min,缓缓退针。随后使用手术线缝合切口皮肤,缝合完毕后用四环素软膏涂抹切口,防止伤口处感染。将实验后的大鼠挪到37℃左右的环境下,使其尽快恢复正常并供水供食,将其置于动物房中饲养。
(6)心脏灌注及取脑:4h后,参照先前麻醉步骤,将小鼠彻底麻醉后,使其平躺在手术板上,准备解剖。首先将小鼠胸骨毛皮处剪开,将毛皮与组织分离,竖直下刀剪开胸腔,将腹部剪开,看见肝脏。将胸骨与肋软骨掀开,使心脏露出,分辨出左心室和右心室(右心室为静脉血,色深;左心室为动脉血,色鲜),在心尖偏右处(左心室)插入针头,开始注射nacl注射液(温度最好比常温低10℃,效果较好),并用止血钳紧紧夹住针头的插口处,防止针头脱落,用剪刀在右心室剪开一个小孔使血液流出,通过体循环,将血液排出有利于解剖。此灌注过程中,先迅速再缓慢,尽可能的把毛细血管内的血液冲洗掉。内脏颜色变浅后,取下nacl注射液,迅速灌注4%pfa溶液(含0.5%的戊二醛溶液以增加固定效果),使小鼠肌肉迅速硬化,抬起小鼠尾部、头部,若肌肉已基本硬化,则取下针管,此过程最多不要超过4min,因为缺氧4min后可导致组织消融。将大鼠头部取下,剪掉皮毛并刮去肌肉,沿鼻骨切断,颅骨沿中间划开,沿着冠状缝剥开,小心翼翼地取出大脑,切勿破坏脑结构,放入10ml离心管中,加入4%pfa溶液(含0.5%戊二醛)进行固定并4℃保存,标记。
(7)冰冻切片制备共聚焦显微镜观察的样品:小鼠取脑后,将大脑放置在含有4%pfa溶液(含0.5%戊二醛)的离心管中进行固定24h;弃去离心管中的pfa溶液,加入30%蔗糖溶液进行脱水处理,每24h更换一下溶液,待鼠脑沉入离心管底部,脱水完成;取出鼠脑,并用滤纸将表面的液体吸干,修块,并用o.c.t包埋剂将鼠脑固定在组织托上,置入冰冻切片机中冷却(-20℃),制成10μm的薄片;将盖玻片使用pbs缓冲液清洗过夜,保证玻片上的气泡完全排出,使用0.4μg/ml的dapi溶液对细胞核进行染色。由于dapi可以透过完整的细胞膜,与细胞核内的dna结合后显示蓝色荧光,因此可以用于活细胞和固定细胞的染色,以便结合chr2-mcherry蛋白标记的多巴胺能神经元(显红色荧光)来判断纳米粒子(表面涂层含fitc,显绿色荧光)是处于胞内还是胞外。
采用激光共聚焦显微镜分别对小鼠黑质部位的脑切片进行观察,脑切片在两种通道(488nm激发红、绿色荧光,405nm激发蓝色荧光)的激发波长激发下,显示出腺相关病毒avv-dio-chr2-mcherry转染的多巴胺能神经元的细胞膜上呈红色荧光,fitc-sa/pei-spions显示出绿色荧光以及dapi标记的细胞核显蓝色荧光。在60×物镜下,通过显微镜在明场下观察的神经元形态以及参照荧光对比度可以基本确定细胞大概的轮廓,并在图中使用黑色虚线标出细胞位置(图1)。可以发现在有生物素参与的情况下,纳米粒子大部分都能沿着神经元细胞膜的方向分布或者游离在细胞之间。值得注意的是:腺相关病毒avv-dio-chr2-mcherry转染的多巴胺能神经元的细胞膜上呈红色荧光与细胞膜上的fitc-sa/pei-spions显示出绿色荧光叠加后显现出黄色荧光。
实施例2(对比实施例):
实验操作步骤1-3,5-7与实施例1基本相同,但是,没有给小鼠黑质相应部位注射生物素(即取消步骤4)。用共聚焦荧光显微镜观察小鼠闹切片,发现只注射了fitc-sa/pei-spions的脑片荧光分布图显示纳米粒子分布没有规律(图2),有少量的纳米粒子附着在膜上,大部分纳米粒子进入细胞内。
- 还没有人留言评论。精彩留言会获得点赞!