一种脂肪细胞的染色方法及其应用与流程
本发明属于生物技术领域,涉及一种脂肪细胞的染色方法及其应用,特别涉及一种能够同时表征脂肪细胞中的脂滴和细胞骨架的方法及其应用。
背景技术:
油红o脂肪染色法是指在日常病理诊断和科研工作中为了显示组织内的脂肪常采用油红o进行染色的方法,油红o为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织内甘油三酯等中性脂肪着色。
该方法用于脂肪细胞的染色,可使脂肪细胞中的脂滴着色,但是用途过于狭窄,可探究范围也有限,比如,不能够用于染色细胞骨架。
显示细胞骨架的常用方法有考马斯亮蓝染色法,具有简单易行的特点,但不能区分骨架蛋白的组成,仅能用于骨架形态及完整性研究。
用去垢剂tritonx-100处理细胞,可以溶解膜脂,并与大部分非骨架蛋白疏水区结合而将其溶解掉,剩下细胞骨架系统的蛋白不被溶解掉,然后用蛋白染料考马斯亮蓝染色即可显示骨架结构。
该方法不适合于脂肪细胞骨架的染色,因为脂肪细胞富含油脂不易着色。
由于鲜有技术不能良好地同时对脂肪细胞脂滴与细胞骨架进行染色,对于脂肪细胞脂滴与细胞骨架关系的研究,鲜有相关报道。
技术实现要素:
为了解决现有技术的不足,本发明利用脂肪细胞脂滴与细胞骨架的特性设计了一种混合染色的方法。该方法可用于探究脂滴与细胞骨架的关系,且染色步骤简单,便于操作,染色效果好,完全可用于有关于脂肪细胞的科学研究。
本发明利用两种染色方法的结合与创新,可以清楚显示脂肪细胞脂滴与骨架的形态分布,可用于有关脂肪细胞的研究。
较为具体地,本发明第一方面提供了一种脂肪组织染色方法,所
述染色方法包括如下步骤:
a.用tritonx-100处理脂肪组织冷冻切片;
b.除去所述tritonx-100;
c.用戊二醛固定所述脂肪组织冷冻切片;
d.用油红o染色所述脂肪组织冷冻切片;
e.对所述脂肪组织冷冻切片脱色;
f.用dmso处理所述脂肪组织冷冻切片;
g.除去dmso;
h.用考马斯亮蓝r250染色所述脂肪组织冷冻切片;
i.脱色。
在一些实施方式中,在步骤a之前,用磷酸缓冲液漂洗所述脂肪组织冷冻切片;
在一些实施方式中,所述脂肪组织冷冻切片厚度30-40μm;
在一些实施方式中,在步骤a中,用0.8-1.2%tritonx-100处理脂肪组织冷冻切片15-25min;
在一些实施方式中,在步骤b中,用m缓冲液除去所述tritonx-100;
在一些实施方式中,在步骤b中,用m缓冲液洗1-3次,每次3-6min;
在一些实施方式中,在步骤c中,用2.5-3.5%戊二醛固定所述脂肪组织冷冻切片20-40min;
在一些实施方式中,在步骤d中,用油红o染色所述脂肪组织冷冻切片8-12min;
在一些实施方式中,在步骤e中,用异丙醇对所述脂肪组织冷冻切片脱色;
在一些实施方式中,所述异丙醇的浓度为55-65%,处理时间为冲洗至洗去浮色;
在一些实施方式中,在步骤f中,用45-55%%dmso处理所述脂肪组织冷冻切片5-10分钟;
在一些实施方式中,在步骤g中,用磷酸缓冲液漂洗除去dmso;
在一些实施方式中,在步骤h中,用0.15-0.25%考马斯亮蓝r250染色所述脂肪组织冷冻切片25-35min;
在一些实施方式中,在步骤i中,蒸馏水洗脱色。
在一些实施方式中,在步骤a之前,用磷酸缓冲液漂洗所述脂肪组织冷冻切片三次,每次一分钟;
在一些实施方式中,所述脂肪组织冷冻切片厚度35μm;
在一些实施方式中,在步骤a中,用1%tritonx-100处理脂肪组织冷冻切片20min;
在一些实施方式中,在步骤b中,用m缓冲液除去所述tritonx-100三次,每次5min;
在一些实施方式中,在步骤b中,用m缓冲液洗三次,每次5min;
在一些实施方式中,在步骤c中,用3%戊二醛固定所述脂肪组织冷冻切片30min;
在一些实施方式中,在步骤d中,用油红o染色所述脂肪组织冷冻切片10min;
在一些实施方式中,在步骤f中,用50%的dmso处理所述脂肪组织冷冻切片8分钟;
在一些实施方式中,在步骤g中,用磷酸缓冲液漂洗一次除去dmso;
在一些实施方式中,在步骤h中,用0.2%考马斯亮蓝r250染色所述脂肪组织冷冻切片30min;
在一些实施方式中,在步骤i中,蒸馏水洗两次脱色;
优选,在步骤i后,将样品置于载玻片上加盖玻片。
本发明第二方面提供了一种用于脂肪组织染色的试剂盒,所述试剂盒包括:
用于盛装或盛装有磷酸缓冲液的试剂瓶;
用于盛装或盛装有tritonx-100的试剂瓶;
用于盛装或盛装有m缓冲液洗的试剂瓶;
用于盛装或盛装有戊二醛的试剂瓶;
用于盛装或盛装有油红o的试剂瓶;
用于盛装或盛装有异丙醇的试剂瓶;
用于盛装或盛装有dmso的试剂瓶;
用于盛装或盛装有考马斯亮蓝r250的试剂瓶;
在一些实施方式中,所述试剂盒用于本发明第一方面所述的脂肪组织染色方法;
在一些实施方式中,所述试剂盒还包括:
用于盛装或盛装有蒸馏水的试剂瓶;
在一些实施方式中,所述试剂盒还包括:
载玻片;
在一些实施方式中,所述试剂盒还包括:
盖玻片。
本发明第三方面提供了一种脂肪组织染色方法,所述染色方法包括如下步骤:
a.用dmso处理脂肪组织冷冻切片;
b.除去dmso;
c.用tritonx-100处理脂肪组织冷冻切片;
d.除去所述tritonx-100;
e.用戊二醛固定所述脂肪组织冷冻切片;
f.除去戊二醛;
g.用考马斯亮蓝r250染色所述脂肪组织冷冻切片;
h.脱色。
在一些实施方式中,在步骤a之前,用磷酸缓冲液漂洗所述脂肪组织冷冻切片;
在一些实施方式中,所述脂肪组织冷冻切片厚度30-40μm;
在一些实施方式中,在步骤a中,用45-55%的dmso处理所述脂肪组织冷冻切片5-10分钟;
在一些实施方式中,在步骤c中,用0.8-1.2%tritonx-100处理脂肪组织冷冻切片15-25min;
在一些实施方式中,在步骤d中,用m缓冲液除去所述tritonx-100;
在一些实施方式中,在步骤d中,用m缓冲液洗1-3次,每次3-6min;
在一些实施方式中,在步骤e中,用2.5-3.5%戊二醛固定所述脂肪组织冷冻切片20-40min;
在一些实施方式中,在步骤f中,用磷酸缓冲液漂洗除去戊二醛;
在一些实施方式中,在步骤g中,用0.15-0.25%考马斯亮蓝r250染色所述脂肪组织冷冻切片25-35min;
在一些实施方式中,在步骤h中,蒸馏水洗脱色。
在一些实施方式中,在步骤a之前,用磷酸缓冲液漂洗所述脂肪组织冷冻切片三次,每次一分钟;
在一些实施方式中,所述脂肪组织冷冻切片厚度35μm;
在一些实施方式中,在步骤a中,用50%的dmso处理所述脂肪组织冷冻切片8分钟;
在一些实施方式中,在步骤c中,用1%tritonx-100处理脂肪组织冷冻切片20min;
在一些实施方式中,在步骤d中,用m缓冲液除去所述tritonx-100三次,每次5min;
在一些实施方式中,在步骤e中,用3%戊二醛固定所述脂肪组织冷冻切片30min;
在一些实施方式中,在步骤f中,用磷酸缓冲液漂洗三次除去戊二醛;
在一些实施方式中,在步骤g中,用0.2%考马斯亮蓝r250染色所述脂肪组织冷冻切片30min;
在一些实施方式中,在步骤h中,蒸馏水洗两次脱色;
在一些实施方式中,在步骤h后,将样品置于载玻片上加盖玻片。
本发明第四方面提供饿了一种用于脂肪组织染色的试剂盒,所述试剂盒包括:
用于盛装或盛装有磷酸缓冲液的试剂瓶;
用于盛装或盛装有dmso的试剂瓶;
用于盛装或盛装有tritonx-100的试剂瓶;
用于盛装或盛装有m缓冲液洗的试剂瓶;
用于盛装或盛装有戊二醛的试剂瓶;
用于盛装或盛装有考马斯亮蓝r250的试剂瓶;
在一些实施方式中,所述试剂盒用于本发明第三方面所述的脂肪组织染色方法;
在一些实施方式中,所述试剂盒还包括:
用于盛装或盛装有蒸馏水的试剂瓶;
在一些实施方式中,所述试剂盒还包括:
载玻片;
在一些实施方式中,所述试剂盒还包括:
盖玻片。
本发明第五方面如本发明第一方面所述的方法,或者本发明第二方面所述的试剂盒在同时表征脂肪细胞脂滴与细胞骨架或所述脂肪细胞脂滴与所述细胞骨架关系中的应用或用途。
本发明第六方面提供了如本发明第三方面所述的方法,或者本发明第四方面所述的试剂盒在表征脂肪细胞的细胞骨架中的应用或用途。
附图说明
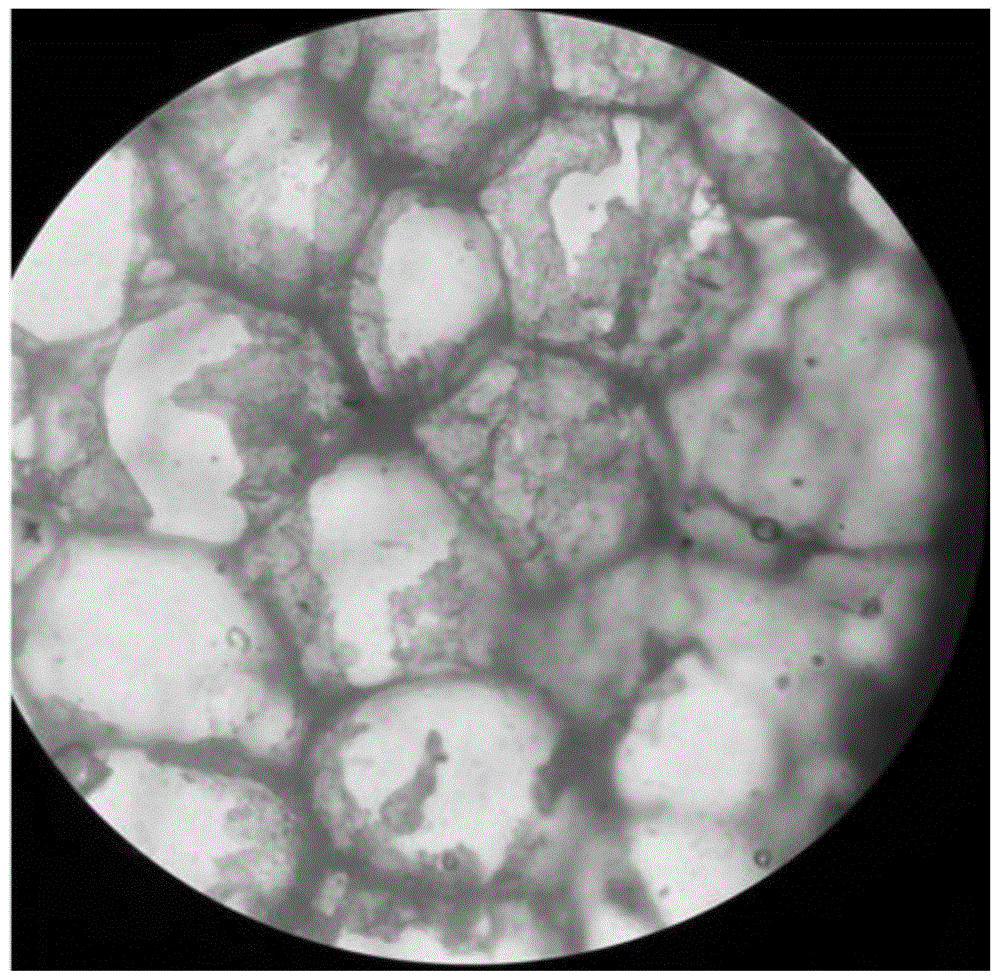
图1为本发明实施例1的×100下染色显微照片。
图2为本发明实施例2的×20下染色显微照片。
图3为本发明实施例3的×20下染色显微照片。
图4为本发明实施例4的×20下染色显微照片。
图5为本发明实施例5的×20下染色显微照片。
图6为本发明实施例6的×40下染色显微照片。
图7为本发明实施例7的×20下染色显微照片。
图8为本发明实施例7的×100下染色显微照片。
图9为本发明实施例8的×100下染色显微照片。
图10为本发明实施例9的×40下染色显微照片。
具体实施方式
为了更好的解释本发明的技术方案,下面结合附图详细介绍本发明的实施例。以下实施例用于进一步说明本发明,但不应理解为对本发明的固定或限制。若未特别指明,实施例中所用的技术特征可以替换为具有在不背离发明构思前提下等同或相似功能或效果的其他本领域已知的技术特征。
材料与方法
1实验材料
仪器:冷冻切片机(cm1900);
动物材料:本实验用昆明小鼠由抗衰老中草药安徽省工程技术研究中心提供(安徽阜阳);滤纸;载玻片;o.c.t。
试剂:0.2%考马斯亮蓝r250染液(0.2%(w/v)考马斯亮蓝r-250,25%(v/v)异丙醇,10%(v/v)冰醋酸);0.5%油红o染液(油红o粉0.5g,加异丙醇100ml,60摄氏度水浴至完全溶解,制成储存液,用时取6ml原液加4ml蒸馏水过滤后使用);磷酸缓冲液(pbs,ph7.5);50%二甲亚砜(dmso)水溶液;1%tritonx-100;m缓冲液(咪唑50mmol/l3.40g,kcl50mmol/l3.73g,mgcl2·6h2o0.5mmol/l0.1g,egta1.0mmol/l0.38g,edta·2h2o0.1mmol/l0.04g,b-巯基乙醇1.0mmol/l70ul,甘油4.0mmol/l294.8ul,加水定容至1l,ph调至7.2);3%戊二醛水溶液;60%异丙醇。
2实验材料的获取
解剖体形正常的昆明小鼠,取其腹股沟部脂肪组织。
3制片
使用冷冻切片机(leicacm1900)按照常规方式制作小鼠脂肪组织冷冻切片。
由于脂肪组织冷冻切片不易操作细胞形态易受温度影响,且染色过程中易出现脱片现象,本发明采用事先将使用的载玻片置于冷冻切片机内降温减少温度对脂肪组织切片的影响,切片使用较厚的冷冻脂肪组织切片(切片厚度35μm)能获得细胞形态良好的切片,由于脂肪细胞富含油脂所以不能烤片,采用室温放置1~2min使组织切片贴片。
下面各个实施例中使用了前述材料和方法,凡是未指出的地方均使用了相同的方法步骤和参数。实施例以及前述材料和方法未提及指出为本领域常规技术手段,属于公知常识。
实施例1:改良脂肪细胞切片考马斯亮蓝r250染色法
1.冷冻脂肪组织切片(切片厚度35μm),置于磷酸缓冲液中漂洗三次,每次1min,50%dmso处理8分钟。
2.除去dmso,加入2ml1%tritonx-100处理20min。
3.除去tritonx-100,用m缓冲液洗三次,每次5min。
4.用3%戊二醛固定30min。
5.除去固定剂,用磷酸盐缓冲液轻轻清洗三次,每次3min。
6.用0.2%考马斯亮蓝r250染色30min。
7.用蒸馏水洗两次,将样品置于载玻片上加盖玻片,镜检。
×100下染色显微照片参见图1。从图1中可以看出实施例1的方法能够良好地显色脂肪细胞中的细胞骨架。
从图1中可见,实施例1改良的考马斯亮蓝r250染色法解决了传统染色法不能使脂肪细胞骨架着色的问题,可呈现清晰的脂肪细胞骨架。
实施例2:考马斯亮蓝染色法
使用冷冻切片机(leicacm1900)制作小鼠脂肪组织冷冻切片,直接将切片置于未经降温处理的载玻片上,室温放置1~2min使组织切片贴片。
染色步骤:
1.冷冻脂肪组织切片(切片厚度35μm)置于磷酸缓冲液中漂洗三次,每次一分钟,50%dmso处理8分钟;
2.除去dmso,加入2ml1%tritonx-100处理20min;
3.除去tritonx-100,用m缓冲液洗三次,每次5min;
4.用3%戊二醛固定30min;
5.除去固定剂,用磷酸盐缓冲液轻轻清洗三次,每次3min;
6.用0.2%考马斯亮蓝r250染色30min;
7.用蒸馏水洗两次,将样品置于载玻片上加盖玻片,镜检。
×20镜检结果参见图2。
从图2中可见,使用未经降温处理的载玻片导致细胞形态损坏,由此可知,使用经降温处理的载玻片效果更好,更易保存完整的细胞形态。
实施例1与实施例2的差别在于,实施例2使用未经降温处理的载玻片,而实施例1与其他实施例一样,使用了经过降温处理的载玻片。由此可知,使用了经过降温处理的载玻片能够是显色照片更完整,效果更清晰。
实施例3:考马斯亮蓝染色
实验步骤:
1.冷冻脂肪组织切片(切片厚度35μm)置于磷酸缓冲液中漂洗三次,每次1min;
2.除去磷酸缓冲液,加入2ml1%tritonx-100处理20min;
3.除去tritonx-100,用m缓冲液洗三次,每次5min;
4.用3%戊二醛固定30min;
5.除去固定剂,用磷酸盐缓冲液轻轻清洗三次,每次3min;
6.用0.2%考马斯亮蓝r250染色30min;
7.用蒸馏水洗两次,将样品置于载玻片上加盖玻片,镜检。
×20镜检结果参见图3。
对照图1和图3可知,未经dmso处理导致细胞内骨架无法着色,这说明dmso处理能够促进考马斯亮蓝r250染色。
实施例4:考马斯亮蓝染色
1.冷冻脂肪组织切片(切片厚度35μm)置于磷酸缓冲液中漂洗三次,每次1min,50%dmso处理15分钟;
2.除去磷酸缓冲液,加入2ml1%tritonx-100处理20min;
3.除去tritonx-100,用m缓冲液洗三次,每次5min;
4.用3%戊二醛固定30min;
5.除去固定剂,用磷酸盐缓冲液轻轻清洗三次,每次3min;
6.用0.2%考马斯亮蓝r250染色30min;
7.用蒸馏水洗两次,将样品置于载玻片上加盖玻片,镜检。
×20镜检结果参见图4。
从图4中可以看出,此图为考马斯亮蓝染色中dmso处理时间过长,导致细胞形态被破坏。dmso处理时间不能过长。
实施例5:油红o染色
1.脂肪组织冷冻切片(切片厚度35μm),磷酸缓冲液漂洗三次,每次1min。
2.3%戊二醛固定30min。
3.油红o染色10min。
4.60%异丙醇脱色,镜检。
×20下染色显微照片参见图5。从图5中可以看出实施例5的方法能够良好地显色脂肪细胞中的脂肪滴。
实施例6:油红o染色
实验流程:
1.脂肪组织冷冻切片(切片厚度35μm),磷酸缓冲液漂洗三次,每次1min;
2.3%戊二醛固定30min;
3.化学纯dmso处理8min;
4.油红o染色10min;
5.60%异丙醇脱色,镜检。
×40下染色显微照片参见图6。从图6中可以看出实施例6的方法中,油红o染色中用化学纯dmso处理效果,细胞形态被破坏。
实施例7:油红o、考马斯亮蓝r250混合染色法
1.脂肪组织冷冻切片(切片厚度35μm),磷酸缓冲液漂洗三次,每次1min;
2.加入2ml1%tritonx-100处理20min。
3.除去tritonx-100,用m缓冲液洗三次,每次5min。
4.用3%戊二醛固定30min。
5.油红o染色10min。
6.60%异丙醇脱色。
7.50%dmso处理8min。
8.除去dmso,用磷酸缓冲液漂洗一次。
9.用0.2%考马斯亮蓝r250染色30min。
10.用蒸馏水洗两次脱色,将样品置于载玻片上加盖玻片,镜检。
×20与×100下染色显微照片参见图7和图8。从图7和图8中可以看出实施例7的油红o、考马斯亮蓝r250混合染色法可以清晰的展现脂肪细胞中的脂滴分布与细胞骨架的分布与形态,可用于科学研究,且方法步骤简单有效且带有创新性、实用性。
实施例8:油红o、考马斯亮蓝r250混合染色法
实验流程:
1.脂肪组织冷冻切片(切片厚度35μm),磷酸缓冲液漂洗三次,每次1min;
2.3%戊二醛固定30min;
3.油红o染色10min;
4.60%异丙醇脱色;
4.磷酸缓冲液漂洗一次,每次1min;
5.除去磷酸缓冲液,加入2ml1%tritonx-100处理20min;
6.除去tritonx-100,用m缓冲液洗三次,每次5min;
7.用3%戊二醛固定30min;
8.除去固定剂,用磷酸盐缓冲液轻轻清洗三次,每次3min;
9.用0.2%考马斯亮蓝r250染色10min;
10.用蒸馏水洗两次,将样品置于载玻片上加盖玻片,镜检。
×100下染色显微照片参见图9。
通过图9可以看出,该实施例大部分细胞只留存一个空壳。
实施例9:
1.脂肪组织冷冻切片(切片厚度35μm),磷酸缓冲液漂洗三次,每次1min;
2.加入2ml1%tritonx-100处理20min;
3.除去tritonx-100,用m缓冲液洗三次,每次5min;
4.用3%戊二醛固定30min;
5.50%dmso处理8分钟;
6.除去dmso,用磷酸缓冲液漂洗一次,用0.2%考马斯亮蓝r250染色30min,蒸馏水脱色;
7.油红o染色10min;
8.60%异丙醇脱色,将样品置于载玻片上加盖玻片,镜检。
×40镜检结果参见图10。
图7-8中先考油红o染色而后马斯亮蓝染色比图10中先考马斯亮蓝染色而后油红o染色的效果更好。
以上各个实施例只是用于进一步说明本发明,并不是用来限制本发明的保护范围,凡是基于本发明的构思所作出的等同变换及对本发明的各个技术方案显而易见的改进,均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!