TAS1R3蛋白作为标志物用于表达该蛋白的肿瘤的治疗、诊断和/或预后目的的用途的制作方法
本发明提供了tas1r3蛋白在上皮肿瘤和其他人类病理学中作为新的标志物和分子靶标的用途。特别地,本发明中的一部分为tas1r3蛋白及其表达产物作为用于治疗、诊断或预后目的的标志物的检测用于正常表达该蛋白的肿瘤中的用途。
背景技术:
在过去的30年中,瘤形成疾病的化疗方面取得了重大进展。这包括在开发新的化疗剂方面的一些进展,尤其是在开发同时药物给药的方案方面。对细胞和组织水平上的肿瘤形成过程以及基本抗瘤药剂作用机理的深入了解,也促使了多种瘤形成疾病的化疗取得进展,包括包括绒毛膜癌、肾母细胞瘤、急性白血病、横纹肌肉瘤、视网膜母细胞瘤、霍奇金氏病和伯基特淋巴瘤。然而,尽管在肿瘤学领域,尤其是化疗领域到目前取得了进展,许多最普遍形式的人类癌症仍然对当前的化疗具有抗性。
从这个意义上说,在任何肿瘤治疗方案中,为了使其有效,“总细胞消灭(totalcellannihilation)”的概念至关重要。这个概念认为,为了制定外科手术或化疗或这两者的有效治疗方案,必须对所有所谓的“克隆源性(clonogenic)”恶性细胞(即,具有以不受控制的方式生长和替代任何可以被清除的肿瘤块的能力的细胞)进行总细胞消灭。由于开发实现总细胞消灭的治疗剂和治疗方案的终极需求,某些类型的肿瘤比其他类型的肿瘤对疗法更敏感。例如,软组织肿瘤(例如淋巴瘤)以及血液和血液形成器官的肿瘤(例如白血病)通常比实体瘤(例如癌症)对化疗疗法产生更令人满意的响应。软肿瘤对化疗更敏感的一个原因是化疗干预中淋巴瘤和白血病细胞的物理可及性更高。简而言之,对于大多数化疗剂来说,到达实体瘤块的所有细胞比到达软肿瘤要困难得多,因此,在实体瘤的情况下,要实现总细胞破坏要困难得多。在这方面,为了治疗这样的肿瘤,即实体瘤,化疗剂的剂量显著增加,从而导致副作用,这通常限制了疗法的总体有效性。
因此,开发能够治疗实体瘤的令人满意的抗肿瘤剂的策略,涉及设计选择性杀死肿瘤细胞,同时对正常组织产生相对少(如果存在)的不良作用的药剂。由于瘤形成组织和正常组织之间几乎没有定性差异,因此这一目标很难实现。因此,近年来,已经进行了许多努力来尝试鉴定可以作为用于化疗和用于诊断的免疫学靶标的肿瘤特异性“标志物抗原”。从这个意义上讲,本发明通过提供一种新的生物标志物来解决这一方面,该生物标志物在原发性肿瘤和弥散性细胞中均在肿瘤细胞的细胞膜中差异表达。另外,该生物标志物的表达与肿瘤细胞的较大的侵袭能力和致瘤能力有关,尤其在缺乏营养的条件下增加其表达,因此能够将该生物标志物用于癌症的诊断/预后。最后,由于该生物标志物是一种膜受体,因此可以设计靶向疗法,例如可以阻止细胞增殖以及细胞迁移、侵袭和扩散的能力的配体(诸如小分子、肽或拮抗剂)。因此,在过去,免疫毒素已用于选择性地靶向实体瘤的癌细胞。免疫毒素是特异性的靶药剂(通常是针对肿瘤的抗体或其片段)与细胞毒性剂(例如毒素部分)的缀合物。靶药剂被设计为将毒素导向携带靶抗原的细胞,并杀死该细胞。另一方面,已经开发了“第二代”免疫毒素,例如开发了使用去糖基化蓖麻毒素a链的免疫毒素,以防止免疫毒素的肝截留并降低肝毒性(blakeyetal.,1987a;b),以及开发了具有新交联键的免疫毒素以提供更高的免疫毒素体内稳定性(thorpeetal.,1988)。免疫毒素已显示有效治疗小鼠(thorpeetal.,1988,ghetieetal.,1991,griffinetal.,1988a;b)以及人(vitettaetal.,1991)的淋巴瘤和白血病。因此,本发明提供了可用于合成免疫毒素的针对本发明生物标志物的特异性靶药剂。
另外,新的生物标志物(例如本发明中详述的生物标志物)的鉴定,对于用于诊断和预后目的的个性化药物的开发,以及对于靶向疗法的选择和治疗的监测是极其有用的。个性化医学的前提基础在于,每个肿瘤都是唯一的,并且会随时间动态变化,因此拥有允许始终确定最佳治疗方法的工具非常重要。在个性化医学领域,液体活检以其决定性的作用脱颖而出。今天,我们知道肿瘤的起源是由于遗传改变的出现,所述的遗传改变影响细胞的增殖和存活机制并且在其分子组成上复杂且异质。另一方面,一旦诊断出癌症,就必须通过分析dna、rna和蛋白质谱来表征原发性肿瘤或其转移。在同一肿瘤内共存着不同的肿瘤克隆,标志着肿瘤的演变以及对各种疗法的抗性,因此,创造了术语“动态肿瘤”。这些易于随时间变化,因此,确定各个时间点的优势克隆是选择最有效治疗策略的关键。非小细胞肺癌(nsclc)的诊断通常是通过ct扫描(一种敏感但非特异性的技术)进行的,这需要通过侵入性程序(活检)进行额外的随访,这就是为什么临床实践需要提供与诊断成像相关的信息的新的生物标志物,以及能够提供信息而无需采用入侵性程序(诸如活检)的生物标志物的原因。
技术实现要素:
在本发明中,首次描述了tas1r3受体作为生物标志物在癌症诊断、监测和治疗中的用途。从这个意义上说,本发明的作者证明了tas1r3是肿瘤学中感兴趣的生物标志物,可用于疾病的诊断,并且能够提供相关信息,以便监测演变、选择治疗并选择性地指导治疗分子。已经确定,可以确定针对该受体的疗法,并且还可以指导缀合物和受控药物释放系统(例如纳米颗粒),从而非常有效地观察缀合物和受控药物释放系统在原发性、弥散性和转移性肿瘤细胞中的胞内积累。另一方面,还证明了tas1r3存在于循环肿瘤细胞(ctc)中。这些是由原发性肿瘤释放到血流中的肿瘤细胞,被认为是转移发生的关键因素,因此,它们的早期检测将作为转移的早期检测指标,也可用于监测该疾病和评估其对药物的反应。
总的来说,这一发现为用化合物功能化任何类型的分子以用作针对肿瘤细胞,特别是针对ctc(循环肿瘤细胞)和原发性、弥散性或转移性肿瘤细胞的药理和/或诊断载体打开了大门,所述化合物充当针对tas1r3受体的配体,优选是选自抗体、抗体片段、适体、肽或低分子疏水或亲水分子(例如降甜剂(lactisole))的配体,以及能够与tas1r3受体结合的配体-药物或配体-放射性同位素缀合物,或用反应性基团功能化的配体。
附图说明
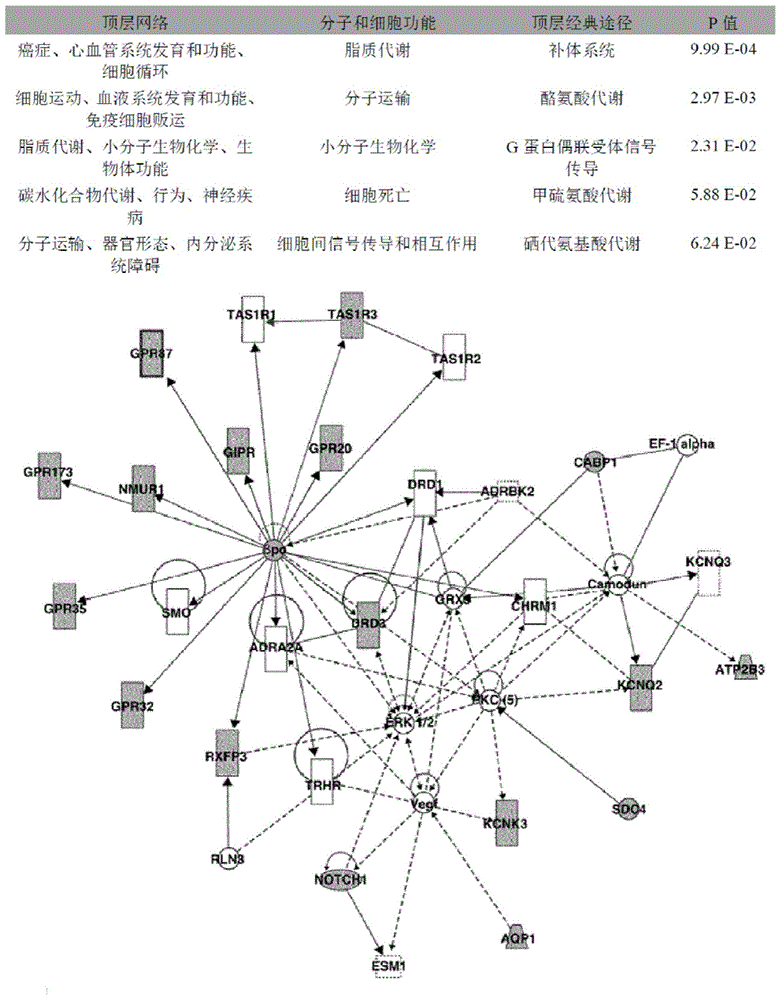
图1.使用ingenuitypathwayanalysis(ipa)软件针对差异表达进行生物信息学分析以解释ctc的生物学特性。上图:主要网络、分子和细胞功能以及主要的经典途径和相应的p值。下图:根据ctc的表达谱得到的针对细胞运动途径、脂质代谢和碳水化合物的相互作用网络。
图2.与健康捐献者的对照组(n=16)相比,对从转移性非小细胞肺癌(nsclc)患者(n=42)分离的循环肿瘤细胞中的tas1r3表达进行验证。
图3.转移性肺癌(nsclc)患者的肿瘤组织相比于非肿瘤对照组织(n=6)中tas1r3的表达。
图4.以u87细胞系的值为参照,tas1r3受体(mrna)在不同肿瘤类型的不同细胞系:结肠癌(sw620和sw480)、肺癌(a549和h1755)、胶质母细胞瘤(u87和u118)和胰腺癌(miapaca2)中的相对表达(p值=0.0001)。
图5.在一组不同来源的肿瘤细胞中通过免疫荧光法研究tas1r3的表达(细胞核周围的较亮点状信号)(a)。免疫荧光揭示,相比于从原发性肿瘤中分离的结肠细胞(sw480),转移性来源的结肠细胞(sw620)中目的蛋白tas1r3(光信号)的表达更高(b)。细胞核用dapi染色。
图6.在高和低葡萄糖浓度的培养基中培养的sw620细胞中的tas1r3表达。rt-pcr(a)。通过蛋白质印迹进行蛋白质表达的光密度分析(b)。
图7.在高和低葡萄糖浓度的培养基中培养的sw620细胞系的细胞增殖(a)和集落形成(b)测定(数据对应于在培养物中保持15天的数量为400个的接种细胞)。
图8.当细胞与降甜剂保持接触9天时对受体进行rt-pcr,并与对照(在低葡萄糖浓度的培养基中培养的sw620)进行比较(a)。在低葡萄糖浓度和降甜剂浓度增加(从0.44mg/ml到7mg/ml)的培养基中培养sw620细胞72小时(b)。培养15天后,对照sw620细胞或与浓度为3.5mg/ml的降甜剂配体接触后的集落形成(c)。在用降甜剂处理的sw620细胞(3.5mg/ml处理72小时,箭头显示可以看到染色的细胞)中进行表示细胞衰老的β-半乳糖苷酶染色(d)。蛋白质印迹显示当sw620细胞暴露于不同的葡萄糖浓度(高和低)和降甜剂(3.5mg/ml)9天时,参与肿瘤进展的不同蛋白质的表达(e)。在补加有不同受体配体(葡萄糖、甜蜜素、甜味蛋白(brazzein)和降甜剂)的dmem培养基中培养的sw620细胞的细胞增殖(p值<0.0001)(f)。
图9.在较高表达tas1r3(在低葡萄糖浓度下培养)或较低表达tas1r3(在高葡萄糖浓度下培养)的sw620细胞中培养4小时后,标记有dir的用降甜剂(o:sm:lact为1:0.1:0.1)功能化的鞘磷脂纳米乳剂的内化。在功能化的纳米乳剂与受体表达更高的细胞培养的情况下,荧光强度更大。细胞核用dapi染色,最亮的信号归因于包裹在纳米乳剂中的did。
图10.结肠肿瘤细胞(sw620)在用油酸和鞘磷脂的白色纳米乳剂(ne)和降甜剂功能化的油酸和鞘磷脂的纳米乳剂(f-ne)处理后,或包封抗肿瘤药物依托泊苷后,培养48小时之后的细胞活力(mtt测定)(p值,****=0.0001,***=0.001)。
图11.人抗tas1r3多克隆抗体(refsc50353,scbt)功能化的荧光量子点(红色)的内化。量子点在37℃下培养1小时。对tas1r3受体(绿色)进行标记,以确定该tas1r3受体与量子点的共定位。细胞核用dapi染色。
图12.tas1r3受体及其配体的图示。
图13.ctc和基因表达谱的检测。通过免疫技术从晚期非小细胞肺癌患者中分离的ctc的基因表达谱的工作流程图。患者(n=10)和对照(n=4)之间差异表达的基因(ctc特定基因)的层次聚类。微阵列显著性分析(significanceanalysisformicroarrays(sam))结果的图表,显示了患者组和对照组之间基因表达的差异。突出显示的点对应于与对照组相比在患者组中表达水平增加且统计学上显著的基因,这被认为表征了转移性肺癌ctc群体。
图14.卡普兰-迈耶曲线(kaplan-meiercurves)。指以42例非小细胞肺癌患者ctc样品中存在tas1r3高或低/中水平为依据的总生存期。患者的总生存(os)时间是从化疗线开始到患者死亡之间的时间。tas1r3受体表达值较低的患者中观察到较高的生存率(值≥-7.5,截止点设定为tas1r3表达值的平均值)。使用统计分析软件包spss进行数据分析。
具体实施方式
定义
在本发明中,“tas1r3受体”理解为味觉g蛋白偶联跨膜受体,该受体不但在味蕾中表达,而且在其他组织(例如肝和胰腺)中以及肿瘤细胞中表达。该受体有多种参考序列,例如;hgnc:15661(ncbivega:otthumg00000003071);entrezgene:83756;ensembl:ensg00000169962;omim:605865;ouniprotkb:q7rtx0。该受体可被发现与tas1r1受体或tas1r2形成异二聚体,并且由于被不同的氨基酸、葡萄糖等激活,可以充当甜味或鲜味的检测剂。有关tas1r3受体及其配体的示意图,参见图12。
在本发明中,tas1r3受体的配体应理解为能够与tas1r3受体相互作用的分子,例如单糖和二糖、人工甜味剂(例如三氯蔗糖、甜蜜素、新橙皮苷(neoesperidine)、二氢查耳酮及其衍生物)、甜味抑制剂(例如降甜剂及衍生物)、蛋白质(例如甜味蛋白或其片段)以及通过选择系统特别设计的其他物质(例如抗体、抗体片段、肽、适体、小分子、蛋白质等)。
在本发明中,“与配体的缀合物”是合并了配体和具有治疗活性(药物、放射性药物等)或用于诊断目的(放射性同位素、螯合剂、钆、荧光团等)的分子的化学缀合物。
在本发明中,“用反应性基团功能化的配体”是指已被化学修饰而提供反应性基团的配体,该反应性基团随后可用于化学或生化反应中或用于与其它分子随后的结合或选择性相互作用。
如本文所用,术语“从患者中分离的生物样品”是指通过常规临床方案中用于诊断用途的常规外科手术程序取下的生物肿瘤样品或包含肿瘤组织的生物样品。另外,该术语应理解为涵盖从血液、血清或血浆中分离的任何组织或生物样品,所述血液、血清或血浆包含肿瘤组织或循环肿瘤细胞或由肿瘤释放的物质。
如本文所用,术语“组织累及”是指组织中存在肿瘤细胞。
如本文所用,术语“tas1r3表达的确定”是指可以评估所述蛋白质或其任何表达产物(例如rna)的表达的引物、抗体或任何其他系统。
如本文所用,术语“患者”优选指人。但是,其可以指哺乳动物,包括非灵长类哺乳动物(例如马、狗、猫、大鼠、小鼠、牛或猪)和灵长类哺乳动物(例如猴子)。
如本文所用,术语“分子标志物/肿瘤生物标志物”是指癌症的生物标志物,即,由肿瘤或基质细胞产生,与它们的存在密切相关,并且提供了受肿瘤细胞影响的组织累及状态的临床关注信息的物质。“分子标志物/肿瘤生物标志物”还指癌症的生物标志物,即,由肿瘤或由与它们的存在密切相关的基质细胞产生,并且提供了通过使用受体配体(优选以缀合物形式的配体)针对所述细胞指导治疗的可能性的物质。
tas1r3表达水平的确定可以通过免疫学技术进行,例如elisa、elona、免疫印迹、免疫荧光或免疫组织化学、流式细胞术和适体组织化学。免疫印迹基于检测先前在变性条件下通过凝胶电泳分离,并通过与特异性抗体和显影系统(例如化学发光)培养而固定在膜(通常是硝化纤维素膜)上的蛋白质。免疫荧光分析需要使用对靶蛋白具有特异性的抗体进行表达分析。elisa和elona基于使用抗原、酶标记的抗体或适体,使得靶抗原和标记抗体形成的缀合物得以形成酶活性复合物。由于其组成部分(抗原或标记的抗体或适体)之一被固定在支持物上,因此抗原-抗体/适体复合物被固定在支持物上,并且因此可以通过添加底物而被检测到,所述底物被酶转化为可通过例如分光光度法或荧光法检测的产物。
当使用免疫学方法时,可以使用已知以高亲和力结合至靶蛋白以检测靶蛋白的量的任何试剂,例如抗体或适体。然而,优选使用抗体,例如多克隆血清、杂交瘤上清液或单克隆抗体、抗体片段、fv、fab、fab'和f(ab')2、scfv、双抗体、三抗体、四抗体和人源化抗体。另一方面,蛋白质表达水平的确定可以通过现有技术中熟知的免疫组织化学技术来进行。要通过免疫组织化学和/或合适的组织化学进行测定,样品可以是新鲜的、冷冻的或石蜡包埋的样品,并使用福尔马林类保护剂固定。为了进行免疫组织化学测定,用对tas1r3特异的抗体或适体对样品进行染色,并确定已染色细胞的频率和染色强度。通常,基于染色细胞的频率而计算出的表示表达和总体的值(在0至4之间的值)分配给样品,以及还分配表示每种染色细胞中的强度的值(在0至4之间的值)。将表达值分配给样品的典型标准已被详细描述,例如,在handbookofimmunohistochemistryandinsituhybridizationinhumancarcinomas,m.hayated.,2004,academicpress中。另外,免疫组织化学允许鉴定癌组织中存在的哪种类型的细胞是使标志物表达水平改变的细胞。优选地,免疫组织化学检测与用作阳性标记和阴性标记的细胞样品平行进行,并且可以使用与被分析肿瘤来源相同的健康组织作为参考。使用背景对照也是常见的。
在要分析大量样品的情况下(例如,当要分析来自同一患者的多个样品或来自不同患者的样品时),可以使用矩阵格式和/或自动化程序。在一种实施方式中,可以使用组织微阵列(组织微阵列或称tma),该组织微阵列可以使用不同的技术获得。作为微阵列的一部分的样品可以以不同方式分析,包括免疫组织化学、原位杂交、原位pcr、rna或dna分析、形态学检查以及以上任意的组合。处理组织微阵列的方法已被描述,例如,在konenen,j.etal.,(nat.med.1987,4:844-7)中。组织微阵列由直径为0.6至2mm的圆柱状核心制备而成,这些圆柱状核心来自包埋在石蜡中并再包埋在单个受体块中的组织样品。这样,可以将来自多个样品的组织插入到单个石蜡块中。tas1r3表达水平的确定需要与参考值相关,该参考值对应于来自癌症患者的活检样品中的肿瘤组织集合中测得的tas1r3表达水平的中值。所述参考样品通常通过合并来自对象群体的等量样品而获得。一般而言,典型的参考样品获取自经临床充分证明且其疾病通过常规方法(直肠指检、粪便隐血试验、乙状结肠镜检查、结肠镜检查、活检、肿瘤标志物(例如癌胚抗原)测定、超声、ct、核磁共振、正电子发射断层扫描)之一明确表征的对象。在这样的样品中,可以确定生物标志物的正常(参考)浓度,例如通过提供参考群体的平均浓度来确定。在确定标志物的参考浓度时,应考虑几个因素。需考虑的因素包括所涉及样品的类型(例如组织或csf)、患者的年龄、体重、性别、总体身体状况等。例如,将相等数量的具有至少2个、至少10个、至少100个,至优选为多于1000个对象的组作为参考组,优选根据上述考虑因素(例如不同的年龄类别)将所述的组分类。获取参考水平的样品的集合,优选为由患有与所研究的患者相同类型的癌症的对象组成。
一旦建立了该中值或阈值,就可以将在患者的肿瘤组织中表达的该标志物的水平与该中值进行比较,并以此方式将该水平归属于“增加的”或“减少的”表达水平。由于对象之间的变化性(例如,与年龄、种族等有关的方面),很难(即使实际上并非完全不可能)建立tas1r3表达的绝对参考值。因此,在特别的实施方式中,通过用常规方法计算百分位数来确定tas1r3表达的“增加的”或“减少的”表达的参考值,所述常规方法涉及测试对象的一个或多个分离样品中tas1r3的表达水平,所述对象已通过上述方法之一对疾病进行了充分证明。“减少的”aptx的水平可以优选地归属于tas1r3表达水平等于或小于正常群体中的第50百分位的样品,包括例如,表达水平等于或低于正常群体中的第60百分位,等于或小于正常群体中的第70百分位,等于或小于正常群体中的第80百分位,等于或低于正常群体中的第90百分位,以及等于或低于正常群体中的第95百分位。然后,“增加的”tas1r3的水平可以优选地归属于tas1r3表达水平等于或超过正常群体中的第50百分位的样品,包括例如,表达水平等于或超过正常群体中的第60百分位,等于或超过正常群体中的第70百分位,等于或超过正常群体中的第80百分位,等于或超过正常群体中的第90百分位,以及等于或超过正常群体中的第95百分位。如本文所用,术语“增加的tas1r3的表达水平”是指高于参考样品中出现的水平的tas1r3水平。特别地,对于从患者中分离的样品来说,当表达水平相对于参考样品为至少1.1倍、1.5倍、5倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或甚至更高时,可以认为样品具有增加的tas1r3表达水平。
描述
本发明的作者已经在ctc(循环肿瘤细胞)(参见实施例1)和肿瘤中鉴定了新受体tas1r3(味觉受体),并确定所述受体的表达根据葡萄糖的存在而变化,并且与原发性、弥散性或转移性肿瘤细胞的存在有关。
从这个意义上讲,如图2至5可见,与健康供体的对照组(n=16)相比,在从转移性肺癌(nsclc)患者(n=42)中分离的循环肿瘤细胞中证实了更高的tas1r3表达(图2),转移性肺癌(nsclc)患者的肿瘤组织相比于非肿瘤对照组织具有更高的tas1r3表达(图3),且在不同肿瘤类型的不同细胞系:结肠癌(sw620和sw480)、肺癌(a549和h1755)、胶质母细胞瘤(u87和u118)和胰腺癌(miapaca2)中,具有更高的tas1r3表达(图4)。类似地,通过免疫荧光,以原发性肿瘤分离的结肠细胞(sw480)为对比,研究了一组不同来源的肿瘤细胞特别是转移性来源的结肠细胞(sw620)中tas1r3的表达。
鉴于图2和图3证明了该生物标志物在肿瘤细胞相比于非肿瘤对照组织中的表达水平的明显差异,这些数据证明了该生物标志物的诊断潜力,而基于图14的结果,显示了tas1r3受体表达水平较低的患者的总生存期更高,这证明了该生物标志物的预后潜力。
因此,本发明涉及一种新的预后/诊断肿瘤生物标志物,该生物标志物能够检测生物样品例如组织或血液、血清或血浆样品中原发性、弥散性或转移性肿瘤细胞的存在。而且,本发明涉及检测生物样品例如组织或血液、血清或血浆样品中tas1r3表达水平,以诊断肿瘤细胞在所述组织或生物样品中的累及或存在,无论是原发性、弥散性或转移性的。所述信息也将具有预后价值,这是因为鉴定转移性肿瘤细胞,或将生物样品例如组织或血液血清或血浆样品中的tas1r3受体的水平和/或浓度与来自健康个体的、或来自健康器官或组织的一部分或没有肿瘤累及的生物样品中的tas1r3受体的水平和/或浓度进行比较,或与参考值进行比较,会为个体的预后提供有用的信息,例如有关癌症患者的总生存期(os)的信息。从这个意义上说,测定tas1r3的表达和鉴定表达tas1r3的细胞类型将允许预测受肿瘤细胞影响的组织累及。另外,tas1r3受体的表达水平将允许预测转移性肿瘤细胞暗示的可能累及,从而提供明确的预后价值。
因此,本发明的第一方面涉及一种用于预测或体外诊断患者中肿瘤累及或存在(瘤形成或转移性累及或存在)的方法,其特征在于包括以下步骤:
a)首先从患者分离至少一种生物样品,所述生物样品优选血液、血清或血浆样品或组织样品,优选是固定的,更优选是固定并包埋在石蜡中的样品;和
b)通过细胞类型鉴定技术确定tas1r3在生物样品例如组织或血液血清或血浆样品的细胞中的表达水平;和
c)将所述表达水平与健康个体的生物样品、健康器官或组织的一部分的生物样品或没有肿瘤累及的生物样品中的tas1r3受体的表达水平进行比较,或与参考值进行比较,
其中,与健康个体的生物样品、健康器官或组织的一部分的生物样品或没有肿瘤累及的生物样品中的tas1r3受体的表达水平相比,或与参考值相比,所述表达水平增加表示患者中的肿瘤累及或存在(瘤形成或转移性累及或存在)。
另外,在第二方面,本发明涉及一种用于体外预后患有肿瘤累及或存在(瘤形成或转移性累及或存在)的患者的临床病程的方法,其特征在于包括以下步骤:
a)首先从患者分离至少一种生物样品,所述生物样品优选血液、血清或血浆样品或肿瘤组织样品,优选是固定的,更优选是固定并包埋在石蜡中的样品;和
b)通过细胞类型鉴定技术确定tas1r3在生物样品例如组织或血清或血浆血液样品的细胞中的表达,和
c)将所述表达水平与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平进行比较,或与参考值进行比较,
其中,与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平相比,或与参考值相比,所述表达水平增加则表示患者的临床演变消极。
患者的临床演变消极应优选地理解为,估计总生存期小于5年,优选小于3年。
另外,本发明的第三方面涉及一种用于体外监测患有肿瘤累及或存在(瘤形成或转移性累及或存在)的患者的临床演变的方法,其特征在于包括以下步骤:
a)首先从患者分离至少一种生物样品,所述生物样品优选血液、血清或血浆样品或肿瘤组织样品,优选是固定的,更优选是固定并包埋在石蜡中的样品;和
b)通过细胞类型鉴定技术确定tas1r3在生物样品例如组织或血液、血清或血浆样品的细胞中的表达,和
c)将所述表达水平与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平进行比较,或与参考值进行比较,
其中,与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平相比,或与参考值相比,表达水平增加则表示患者的临床演变消极。
另外,本发明的第四方面涉及一种监测患有肿瘤累及或存在(瘤形成或转移性累及或存在)的患者对体外治疗的响应的方法,其特征在于包括以下步骤:
a)首先从患者分离至少一种生物样品,所述生物样品优选血液、血清或血浆样品或肿瘤组织样品,优选是固定的,更优选是固定并包埋在石蜡中的样品;和
b)通过细胞类型鉴定技术确定tas1r3在生物样品例如组织或血液、血清或血浆样品的细胞中的表达,以及
c)将所述表达水平与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平进行比较,或与参考值进行比较,
其中,与在获得步骤a)的生物样品的时间之前获得的同一患者生物样品中的tas1r3受体的表达水平相比,或与参考值相比,表达水平增加则表示患者对治疗缺乏响应。
如在本文的“定义”部分中所述,术语“测定tas1r3的表达”是指抗体或可以评估所述蛋白质表达的任何其他系统,例如适体。为了获得可用于测定tas1r3表达水平的抗体或适体,对人tas1r3蛋白进行了序列分析。根据这些数据,可以预测从免疫学角度(存在于n末端胞外区)最合适的序列如下:
乙酰基-lsqqlrmkgdyvlggc-酰胺基(seqidno1)
乙酰基-erlkirwhtsdnqkpvsrc-酰胺基(seqidno2)
基于这些数据,使用异源表达系统大肠杆菌(escherichiacoli)合成了肽(乙酰基-lsqqlrmkgdyvlggc-酰胺基)。将所得蛋白质纯化至均质,最终纯度为90至95%,取2mg缀合至klh,3mg缀合至bsa。基因组构建体的设计基于文献(maitrepierreetal.,2012)进行。类似地,对储存缓冲液配方进行了研究以保持蛋白质的完整性(限制最终配方中去污剂和多糖的使用)。将获得的批次等分在标记的无菌小瓶中,并保存在-80℃下直至使用。用4加2个剂量的50μg肽对小鼠进行几次免疫后,对血液进行滴定以评估对肽的反应的增加。结果表明,小鼠产生了针对该肽的一些响应,尽管是阻碍生产实现的非常低的值。
因此,在本发明的第一至第四方面的优选实施方式中,用能够结合至seqidno1或seqidno2的抗体或其片段或适体来确定tas1r3在生物样品例如组织或血液血清或血浆样品的细胞中的表达。
在本发明的第一至第四方面的优选实施方式中,本发明的特征在于,所述方法的阴性预测值大于80%,更优选地大于90%、95%、96%、97%、98%或99%。也就是说,当在患者的生物样品中的细胞中未检测到tas1r3的表达时,意味着该样品不会受到肿瘤的影响。
如本文所用,术语“阴性预测值”是指测试为阴性因此未患疾病(受肿瘤细胞影响的组织累及)的病例的百分比。
在另一种优选的实施方式中,本发明的特征在于所述患者患有实体瘤,优选患有选自以下的疾病:乳腺癌、黑素瘤、葡萄膜黑素瘤、胰腺癌、肺癌、前列腺癌、胃癌、头颈癌、肉瘤、胶质母细胞瘤、神经母细胞瘤、结肠直肠癌、头与颈癌、肾和膀胱癌以及肝癌。
在另一个优选的实施方式中,本发明的特征在于,步骤b)中定义的细胞类型鉴定技术选自以下:免疫组织化学、免疫荧光、适体组织化学和流式细胞术。优选地,步骤b)中定义的细胞类型鉴定技术是免疫组织化学,更优选地,免疫组织化学包括以下步骤:
i)样品的预处理,
ii)免疫染色;
iii)复染色;和
iv)免疫染色分析。
在另一种优选的实施方式中,本发明的特征在于已经从步骤a)中定义的组织中获得的样品选自以下:固定组织样品、新鲜组织样品和冷冻组织或血液样品、血清或血浆。优选地,它是固定组织样品或血液、血清或血浆样品。
在另一种优选的实施方式中,本发明的特征在于患者是哺乳动物。优选地,哺乳动物选自以下:人、灵长类和非灵长类。更优选地,患者是人。
在本发明的第五方面,本发明还涉及tas1r3,其用作肿瘤生物标志物,优选用于上述方法。
本发明还涉及用于上述方法的试剂盒。
本发明的实施方式可以通过流式细胞术、免疫组织化学、免疫荧光或任何其他能够鉴定本领域技术人员已知的细胞类型的技术在新鲜、固定或冷冻的组织中进行。
另一方面,由于该受体用于对分子(例如纳米粒子、药物或放射性同位素)的选择性定向的巨大潜力,并且考虑到我们了解存在与该受体相互作用且非内源性的分子,因此不会发生竞争现象;我们选择了该受体的几种配体,特别是几种甜味剂,以验证可以针对该受体设计疗法的假设。我们还使用所述配体对纳米结构进行了功能化,以使该纳米结构针对表达tas1r3的肿瘤,例如原发性肿瘤或弥散性肿瘤细胞,例如ctc(循环肿瘤细胞)和转移性细胞。我们还观察到一些配体(例如降甜剂或用降甜剂功能化的纳米结构)可以在肿瘤毒性和增殖方面引起治疗作用。
为了进行所述功能化,获取表2中描述的配体,并将其通过共价结合至疏水部分(例如lact-c16),或通过在预先形成的纳米乳剂(例如bra)上培养,而进行连接。所使用的肽的序列和所得纳米乳剂的理化性质如下所述(表2)。
表1.用几种感兴趣的配体功能化的纳米乳剂的组成和理化性质
lact:降甜剂;bra:甜味蛋白肽;
pdi:多分散性指数
ζ:zeta电位
*纳米颗粒
一旦进行了前述的功能化,我们在表达受体的细胞(肿瘤细胞)中观察到了用针对tas1r3的配体功能化的纳米乳剂的高内化能力。例如,在用降甜剂功能化的纳米乳剂的情况下,纳米乳剂中包封的did信号相对大于其他未功能化的纳米乳剂。此外,我们观察到,当肿瘤细胞以较低强度表达靶受体时(在此为在葡萄糖含量较高的培养基中培养的sw620细胞中的tas1r3(低表达,实施例2)),信号强度降低(实施例4)。
因此,本发明证明了用针对在肿瘤细胞的细胞膜中,特别是在弥散性和转移性肿瘤细胞膜中表达的tas1r3的配体对纳米系统的功能化,使该纳米系统成为具有强大的治疗潜力的单位。特别地,所述纳米系统可以用作用于开发联合疗法的载体。另外,在本发明的实施例5中描述了对除纳米乳剂以外的结构(例如量子点)的所述功能化潜力。该发现可以外推到任何类型的纳米系统,例如纳米颗粒、胶束或脂质体,即,针对该受体的配体可以用作选择性载体,该选择性载体用于使任何类型的纳米系统功能化。此外,该发现可以外推至任何类型的系统,例如包含针对该受体的配体的任何配体-药物缀合物和/或配体-放射性同位素,并且可以用作使所述药物或放射性同位素功能化的选择性胞内载体。
表2.功能化纳米结构的组成和理化性质
sm:鞘磷脂;o:油酸;pc:磷脂酰胆碱;lact:降甜剂-c16/-c18;bra:甜味蛋白肽
pdi:多分散性指数
ζ:zeta电位
因此,本发明证明,一旦携有配体的任何类型的纳米结构、脂质体、药物或放射性同位素针对本发明的受体进行了功能化,则观察到所述结构向表达受体的细胞运动,特别是向原发性、弥散性或转移性肿瘤细胞运动。
因此,本发明的第六方面涉及通过使用受体配体,优选使用以缀合物或免疫毒素为形式的配体,将tas1r3受体作为分子标志物/肿瘤生物标志物来指导针对肿瘤细胞的疗法的用途。免疫毒素是特异性靶药剂(通常是针对肿瘤的抗体或其片段)与细胞毒素药剂(例如毒素部分)的缀合物。靶药剂被设计为将毒素导向携带靶标抗原的细胞,并杀死该细胞。
因此,在本发明的第七方面,本发明提供了含如下各项的缀合物:
-特异性靶药剂,其通常是能够与tas1r3受体相互作用的分子,例如单糖和二糖、人工甜味剂(例如三氯蔗糖、甜蜜素、新橙皮苷、二氢查耳酮及其衍生物)、甜味抑制剂(例如降甜剂)及衍生物、蛋白质(例如甜味蛋白)以及通过选择系统特别设计的其他物质(例如抗体、抗体片段、肽、适体、小分子、蛋白质等);和
-细胞毒性剂(例如细胞毒性剂或抗肿瘤药物)、放射性同位素、纳米结构或纳米乳剂。
在本发明的第七方面的优选实施方式中,所述靶药剂是能够结合seqidno1或seqidno2的抗体或其片段、肽或适体。
本发明的第八方面涉及本发明的第七方面的缀合物,其用于疗法或体内诊断。优选地,用于体内治疗或诊断癌症,更优选地,用于治疗或体内诊断实体瘤,优选为选自以下组中的肿瘤:乳腺癌、黑素瘤、葡萄膜黑素瘤、胰腺癌、肺癌、前列腺癌、胃癌、头颈癌、肉瘤、胶质母细胞瘤、神经母细胞瘤、结肠直肠癌、头与颈癌、肾和膀胱癌以及肝癌或弥散性或转移性细胞。
在说明书和权利要求书全文中,单词“包括”及其变体并不意图排除其他技术特征、添加剂、组分或步骤。对于本领域技术人员而言,本发明的其他目的、优点和特征可部分从说明书描述中得到,部分从本发明的实际实施方式中得到。下列附图和实施例是作为举例说明而提供,并不意图限制本发明。
实施例
实施例1.tas1r3受体在肿瘤细胞中的表达
从外周血样品(患者=10,对照n=4)中,使用用于其分离的磁性颗粒(基于epcam的cellectiontmepithelialenrich
还进行了差异表达的基因组分析。如图1所示,首先使用ingenuitypathway(ipa)软件分析基因集,以生成基因网络并提供表征转移性肺癌患者的ctc的信号传导途径的概览。在529种显著基因中,有349种是注释基因,因此被ipa鉴定出来。作为一种活跃弥散性肿瘤细胞亚群,ctc的特定基因集所代表的主要分子和细胞功能与细胞运动、细胞死亡、信号传导和细胞间相互作用、分子转运和脂质代谢相关,主要由与g蛋白偶联的受体和补体系统途径的信号传导调节。根据1)与粘附、细胞移动和迁移有关的功能,然后是2)在细胞表面上的位置,进一步过滤了基因列表。所得分子为nocth1和tas1r3。
接下来,我们着手验证候选基因在患者和对照的独立队列中的表达。使用定量pcr,证实了该受体的表达水平在患者中显著更高(图2)。用cd45(造血细胞标志物)作为非特异性分离标志物将表达值标准化。此外,在石蜡处理的健康组织和肿瘤组织样品中对该受体的表达进行了补充验证(图3)。为此,我们使用用于石蜡处理样品的特定提取试剂盒(rneasyffpe试剂盒,qiagen)从5个14微米的石蜡切片中各自提取rna。为了知道其浓度,使用了nanodrop设备(nanodrop2000c,thermoscientific)。使用这些数据,进行每个样品中rna浓度的标准化,将总共2μg加入无核酸酶水,终体积为10μl。接下来,使用高容量cdna反转录试剂盒(appliedbiosystems),热循环仪(peqstar96hpl,
为了获得关于标志物预后价值的信息,使用spss统计软件包进行了卡普兰-迈耶(kaplan-meier)生存分析(图14)。为了应用该方法,将观察到的所有生存时间从最低到最高进行排序,并对其分别注释产生的死亡和删失的数量。对于每个时间段,计算生存概率,而卡普兰-迈耶函数为“随时间变化累积的个体生存概率”。与tasr13表达值较高的ctc患者(深色线)相比,tas1r3表达值低于截止值-7.5的ctc患者(浅色线)的总生存期(以月计)更好,p值为0.09。
关于细胞培养物中表达的评估,使用了几种类型的细胞系,所述细胞系来自atcc(americantypeculturecollection,美国模式培养物集存库)(图4)。使用了来自淋巴结的转移性结肠细胞(sw620,ccl-227)、结直肠腺癌上皮细胞(sw480,ccl-228)、肺癌上皮细胞(a549,ccl-185)和来自肝脏的转移性肺细胞(h1755,crl-5892)、胰腺癌细胞(miapaca-2,crl-1420)和胶质母细胞瘤细胞(u118,htb-15和u87mg,htb-14)。将sw620、sw480、a549、u118和u87mg细胞系在dmemhg培养基(杜氏改良伊戈尔培养基-高葡萄糖,sigma-aldrich)中维持,将h1755细胞系在rpmi1640培养基(
关于图5所示的免疫荧光研究,在试验进行前一天将所研究的细胞接种到8孔微室(plc30108,spllifesciences)。24小时后,抽吸除去培养基,并用pbs1x洗涤,然后在室温下用4%多聚甲醛固定细胞15分钟。将细胞用pbs1x洗涤两次,然后在室温下用0.2%triton100x透化10分钟。洗去triton后,将抗人(兔)一抗(mbiosource)以1:1000的稀释度在溶解有0.2%bsa的1xpbs中培养,将板在室温下培养1小时。然后洗涤一抗,施加含稀释度为1:500的抗兔二抗(ab150077或111-585-144jacksonimmunoresearch)的bsa0.2%pbs1x,所述抗兔二抗用荧光团(根据抗体采用alexafluor488或594)标记。同时,添加hoechst33342
为了对蛋白质进行定性研究,对从sw620细胞株中分离出的蛋白质进行蛋白质印迹分析,结果如图6(b)所示。将细胞在高葡萄糖浓度(杜氏改良伊戈尔培养基-高葡萄糖,sigma-aldrich)和低葡萄糖浓度(杜氏改良伊戈尔培养基-低葡萄糖,sigma-aldrich)的培养基中培养,并以正常频率将细胞传代。用胰蛋白酶消化细胞,并使用牛鲍氏计数板进行计数,以使所有细胞系具有相似数量的细胞(500万个)。然后将其以150×g在室温下离心5分钟(centrifugesl16r,转子tx-400,
实施例2.tas1r3在具有不同葡萄糖浓度水平的培养基中的表达。
tas1r3在结肠细胞系sw620中的表达取决于培养基中的葡萄糖含量(如图6a中观察到,相对于处于低葡萄糖含量的细胞,高水平的葡萄糖导致较低的表达)。此外,我们通过蛋白质印迹证实了该结果(图6b)。而且,如图6所见,当sw620结肠细胞在缺少葡萄糖的情况下生长时,受体表达增加,这将该受体的表达与细胞代谢相关联。
在sw620细胞中进行细胞增殖研究(图7a),该sw620细胞在高葡萄糖浓度和低葡萄糖浓度的培养基中培养。将细胞用胰蛋白酶消化并铺板相同数目的细胞,以便在0、24、72、96和168小时的时间点,对细胞胰蛋白酶消化后使用牛鲍氏计数板对细胞计数。以类似的方式,在存在游离配体的培养基中进行细胞增殖研究(图8),所述游离配体以不同浓度添加到培养基中。用显微镜(leica
实施例3.tas1r3作为开发新的抗肿瘤疗法的靶标
培养基中降甜剂(lactisole,tas1r3受体的一种配体)的存在导致所研究的受体表达增加(图8a)。尽管在较高浓度下,配体的存在干扰细胞增殖(图8b),我们已将这一事实与诱导细胞衰老相关联(图8d)。此外,我们还已通过蛋白质印迹法看到,sw620培养基中tas1r3的配体(例如降甜剂或葡萄糖(hg))的存在会激活与肿瘤进展相关的途径,例如p-erk、p-akt或igf-ir(图8e)。还确定了tas1r3的其他配体(衍生自甜味蛋白和甜蜜素的肽)也如何根据浓度或每种分子或多或少地干扰增殖(图8f)。
为了确定在细胞与配体培养之后是否诱导了细胞衰老,将sw620细胞系的500,000个细胞和低葡萄糖浓度的培养基在6孔板中培养。在几个孔中,添加配体(3.5mg/ml)。72小时后,将孔洗涤并在室温下固定(2%甲醛,0.2%戊二醛的pbs溶液)15分钟。用1xpbs洗涤3次除去溶液,然后施加染色溶液,并且染色溶液按照1毫升含如下成分而计算:200μl柠檬酸/磷酸盐缓冲液(ph6.0)(磷酸氢二钠(na2hpo4)0.2m+0.1m柠檬酸)、30μl5mnacl、50μl铁氰化钾(k3[fe(cn)6])(100mm)、50μl亚铁氰化钾(k4[fe(cn)6])(100mm)、2μl氯化镁(mgcl2)(1m)、50μlx-gal溶液(20mg/ml5-溴-4-氯-3-吲哚基β-d-吡喃半乳糖苷的二甲基甲醛溶液)和618μl蒸馏水。将其在37℃的烘箱中培养过夜,用流动蒸馏水洗涤孔两次,然后加pbs1x,并在vert显微镜(a1,
为了测试在具有游离配体的培养基中的集落形成,进行了相同的过程,但是在该情况下,将细胞接种在1000ml/l的葡萄糖(低葡萄糖浓度)中,并将3.5mg/ml配体添加到24孔的每个孔中。结果示于图8c中。对于经处理的细胞,在板上未观察到代表性集落的形成,这与在低葡萄糖浓度(lg)的培养基中生长的对照sw620细胞相反。因此,可以说配体影响肿瘤的增殖并因此影响其形成集落的能力。
这一发现非常有趣,因为它可以为该配体提供针对纳米颗粒的活性定向和以及作为药物的双重功能。
实施例4.针对tas1r3的靶向疗法
如下所述将纳米乳剂用针对tas1r3的不同配体进行功能化。在轻柔磁力搅拌下,将含油酸和鞘磷脂(分别5mg和500μg)的100μl乙醇与500μg共价连接至c16-c18链的降甜剂一起添加在1mlmilli-q水(milliporemilli-q
为了研究功能化对纳米乳剂与表达感兴趣受体的细胞相互作用的能力的影响,使用了流式细胞术和共聚焦显微镜技术。具体而言,使用sw620细胞,并使用共聚焦显微镜。对于这些实验,在8孔微室(plc30108,spllifesciences)中每孔接种80,000个细胞。24小时后,将细胞与包封有dir的由油酸和标记有硝基苯并噁二唑(nbd)的鞘磷脂衍生物制备的纳米乳剂(olm;o:sm为1:0.1)以及用降甜剂功能化的相同的纳米乳剂(olm-l;o:sm:lact为1:0.1:0.1)在纳米乳剂孔中进行培养,终浓度为0.12mg/ml。在37℃下培养4小时后,将细胞用1xpbs洗涤两次,然后用4%多聚甲醛固定15分钟,然后用1xpbs洗涤孔两次,然后用hoechst33342(thermo
o:sm:lact为1:0.1:0.1(ne-f)载有相对于其他成分1%重量的依托泊苷。在96孔板中每孔接种10,000个细胞。培养24小时后,将20μl的测试制剂按浓度递增顺序加至110μl培养基,且作为对照,添加溶解有米系统的溶媒(在最大部分情况下为水)以建立阳性对照,其中添加6%的triton100x稀释液以建立阴性对照(或全部死亡)。48小时后,吸出板中的培养基,用1xpbs洗涤,然后以1:10在未补加并用0.22μm过滤器过滤的dmem中稀释后,加入含浓度为5mg/ml的mtt试剂的1xpbs。每孔施加110μl。在培养箱中放置4个小时后,从板中去除培养基,然后添加110μl体积的1xdmso(二甲基亚砜,99.7%,acrosorganics)溶解线粒体酶产生的甲臜晶体。保护光板在37℃下培养15分钟,然后在分光光度计(multiskanex,
实施例5.量子点实验
用针对人蛋白质tas1r3的抗体功能化的量子点。按照供应商的说明,使用siteclicktm
我们进行了功能化量子点与悬浮和贴附的肺癌细胞a549的相互作用测试。在4℃和37℃下培养4小时。培养时间后,除去培养基并用1xpbs洗涤。根据经验接种悬浮培养的细胞,以使细胞贴附并进行tas1r3受体的免疫荧光研究。24小时后,通过抽吸除去培养基,并用pbs1x洗涤,在室温下用4%多聚甲醛固定细胞15分钟。然后,将抗人tas1r3一抗(兔)(refsc50353,scbt)以1:1000的稀释度在溶解有0.2%bsa的1xpbs中培养,将板在室温下培养1小时。然后洗涤一抗,加入用含0.2%bsa的pbs1x以1:500稀释的抗兔二抗(111-585-144jacksonimmunoresearch),所述抗兔二抗用荧光团(alexafluor488)标记。同时,添加hoechst33342
序列表
<110>圣地亚哥-德-孔波斯特拉健康研究所基金会(fidis)
加利戈健康服务
<120>tas1r3蛋白作为标志物用于表达该蛋白的肿瘤的治疗、诊断和/或预后目的的用途
<130>903853
<140>ep18382013.3
<141>2018-01-15
<160>3
<170>bissap1.3.6
<210>1
<211>16
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>1
<223>乙酰赖氨酸
乙酰化
<220>
<223>合成肽
<220>
<221>mod_res
<222>16
<223>半胱氨酰胺
<400>1
leuserglnglnleuargmetlysglyasptyrvalleuglyglycys
151015
<210>2
<211>19
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>1
<223>乙酰谷氨酸
乙酰化
<220>
<223>合成肽
<220>
<221>mod_res
<222>19
<223>半胱氨酰胺
酰胺化
<400>2
gluargleulysileargtrphisthrseraspasnglnlysproval
151015
serargcys
<210>3
<211>7
<212>prt
<213>人工序列
<220>
<223>bra
<400>3
cysphetyraspglulysarg
15
- 还没有人留言评论。精彩留言会获得点赞!