一种废旧镍钴锰酸锂三元正极材料再生的方法与流程
本发明涉及一种废弃锂离子电池镍钴锰酸锂三元正极材料的回收方法,特别涉及一种废旧锂离子电池镍钴锰酸锂三元正极废料通过混酸浸出、共结晶沉淀及高温固相反应实现再生的方法,属于二次资源回收利用和循环经济技术领域。
背景技术
随着便携式电子设备和电动汽车的发展和普及,锂离子电池的使用急剧增加,同时产生了大量的锂离子电池固体废物。研究表明,到2020年中国废弃的锂离子电池将达到250亿只,其质量将达到50万吨。由于锂离子电池中重金属和有毒电解质含量高,对废锂离子电池的不当处理将带来严重的环境污染,并威胁人类健康。同时,废锂离子电池含有大量的有价金属,包括li、ni、co、al和cu。因此,从废旧锂离子电池中回收有价金属,特别是来源有限的有价金属,从经济和环境保护的角度来看是一个非常值得关注的问题。
目前,锂离子电池的回收方法主要包括了火法冶金方法、湿法冶金方法和生物冶金的方法。湿法冶金工艺,由于其金属回收率高,纯度高,能耗低等优点被广泛使用。一般来说,回收过程主要包括预处理,正极活性物质的浸出和浸出液中金属的提取。因此,如何高效环保地回收金属成为回收的关键。对于金属浸出过程,单酸浸出系统应用比较广泛,混酸浸出系统缺乏系统上、理论上的研究。传统单酸浸出以无机酸或有机酸为浸出剂,这种工艺存在酸耗大,浸出时间长的缺点。并且由于镍钴锰酸锂三元正极材料中镍、钴、锰处于高价态,在酸溶液中不容易浸出,此浸出工艺还需要添加相应的还原剂将高价态的金属还原成低价态,促进镍钴锰的浸出,常用的还原剂为h2o2。对于金属分离回收过程,正极废料浸出后通常采用沉淀法、溶剂萃取法、结晶法分离回收浸出液中的金属,没有实现正极废料中金属组分的闭环循环,并且存在二次污染严重、产品不纯、回收工艺复杂、回收成本高等缺点。
技术实现要素:
现有技术在回收锂离子电池正极材料过程中采用传统浸出结合传统金属分离回收工艺,传统浸出工艺采用单一酸浸出,采用单一无机酸浸出时,其二次污染严重,采用单一有机酸酸浸出时,价格昂贵,且两种浸出方式都存在酸耗大,浸出时间长,还需要额外加入还原剂等缺点;传统金属分离工艺,存在回收过程复杂、效率低、产品不纯,且伴随二次污染,难以将有价金属综合回收。本发明的目的是在于提供了一种混酸浸出废旧镍钴锰酸锂三元正极材料并且直接利用浸出液合成镍钴锰酸锂三元正极材料的方法,该方法采用的磷酸-柠檬酸混酸体系具有协同浸出效应,浸出效果明显优于单一酸的作用结果,能够明显降低酸耗,大大缩短浸出时间,节约成本,整个体系对环境的影响较小。由于混酸浸出剂中的柠檬酸本身具有还原性,能将镍钴锰酸锂中高价态的镍,钴,锰还原成低价态,促进各种金属在酸性溶液中的浸出效率,故整个浸出过程无需额外加入还原剂;同时,混酸浸出液无需金属分离,直接用于三元正极材料合成,实现三元正极材料中镍、钴、锰等闭路循环,操作简单,处理成本低,有利于工业化生产。
本发明提供了一种废旧镍钴锰酸锂三元正极材料再生的方法,其包括以下步骤:
1)将废旧镍钴锰酸锂三元正极材料采用磷酸-柠檬酸混酸溶液浸出,得到浸出液;
2)所述浸出液通过镍盐、钴盐和锰盐调节其镍离子、钴离子和锰离子的摩尔比例满足镍钴锰酸锂三元正极材料中镍、钴和锰的元素摩尔比例要求后,添加至草酸溶液中进行共沉淀反应,得到镍钴锰草酸盐;
3)将镍钴锰草酸盐预煅烧,得到镍钴锰氧化物;所述镍钴锰氧化物与锂源通过研磨混合后,煅烧,即得再生镍钴锰酸锂三元正极材料。
本发明采用磷酸-柠檬酸混酸溶液可以将废旧镍钴锰酸锂中的li+、ni2+、co2+、mn2+等金属高效浸出,磷酸和柠檬酸之间具有明显的协同浸出效应,浸出效果明显优于单一酸的作用结果,能够明显降低酸耗,大大缩短浸出时间,节约成本,整个体系对环境的影响较小。另外,由于混酸浸出剂中的柠檬酸本身具有还原性,能将镍钴锰酸锂中高价态的镍,钴,锰还原成低价态,促进其在酸性溶液中的浸出效率,故整个浸出过程无需额外加入还原剂。在此基础上采用草酸作为金属离子沉淀剂,在适当的条件下,可以将ni2+、co2+、mn2+选择性沉淀,生成高纯度的锰钴镍的草酸共晶体,共晶体直接通过高温固相反应制备镍钴锰酸锂三元正极材料。该方法无需对浸出液进行金属分离,直接用于三元正极材料合成,实现三元正极材料中镍、钴、锰等金属闭路循环,浸出废液可以用于回收锂,且操作简单,处理成本低,有利于工业化生产。
优选的方案,所述浸出的条件为:磷酸-柠檬酸混酸溶液中酸总浓度为0.3~0.7m,磷酸浓度≤0.6m,浸出固液比为15~40g/l,浸出温度为50~95℃,浸出时间为5~60min。磷酸-柠檬酸混酸溶液中酸总浓度优选为0.6~0.7m。磷酸浓度优选为0.2~0.3m。浸出固液比优选为15~20g/l。浸出温度优选为85~90℃。浸出时间优选为30~60min。最优选的浸出的条件为:磷酸-柠檬酸混酸溶液中酸总浓度为0.6m,磷酸浓度为0.2m,浸出固液比为20g/l,浸出温度为90℃,浸出时间为30min。在最优选的浸出条件下,li+、ni2+、co2+、mn2+等金属的浸出率均达到90%以上。
本发明的磷酸-柠檬酸混酸溶液中磷酸和柠檬酸之间起到明显的协同作用:一方面,柠檬酸作为还原剂可以将部分以高价态存在的金属还原成低价态,而低价态的金属有利于磷酸浸出;另一方面,柠檬酸能螯合浸出的金属离子,进一步促进浸出反应的进行;第三方面,柠檬酸作为有机弱酸,其可以通过电离作用较慢释放氢离子,起到缓冲作用,弥补无机磷酸分解反应消耗的氢离子,使浸出过程磷酸保持较高的浸出能力,因此,磷酸-柠檬酸协同作用明显,相对单一无机酸或有机酸可以提高金属的浸出效率。
优选的方案,浸出液通过镍盐、钴盐和锰盐调节其镍离子、钴离子和锰离子的摩尔比例满足5:2:3,且浸出液中镍离子、钴离子和锰离子的总浓度在0.3~0.7m范围内。所述镍盐为水溶性镍盐,优选为醋酸盐。所述钴盐为水溶性钴盐,优选为醋酸钴。所述锰盐为水溶性锰盐,优选为醋酸锰。
优选的方案,所述共沉淀反应的条件为:在500~850rpm搅拌速度下,将浸出液滴加至浓度为0.3~0.7m的草酸溶液中,同时调节体系ph=1~4,在温度为25~60℃条件下反应4~6h;草酸溶液中草酸的摩尔量与浸出液中镍离子、钴离子和锰离子总摩尔量之比为1.0~1.5:1。优选的草酸溶液浓度为0.3~0.5m。优选体系ph为1.5~2.5。优选的反应温度为50~60℃。优选的反应时间为4~6h。草酸溶液中草酸的摩尔量与浸出液中镍离子、钴离子和锰离子总摩尔量之比优选为1.2~1.5:1。最优选的方案,所述共沉淀反应的条件为:在600rpm搅拌速度下,将浸出液滴加至浓度为0.4m的草酸溶液中,同时调节体系ph=2,在温度为50℃条件下反应5h;草酸溶液中草酸的摩尔量与浸出液中镍离子、钴离子和锰离子总摩尔量之比为1.2:1。在最优选的条件下,可以实现镍离子、钴离子和锰离子高效选择性沉淀。
优选的方案,所述预煅烧的条件为:在450~550℃温度下,预煅烧4~6h。预煅烧过程主要是分解草酸盐预聚体,以获得高纯度的锰、钴、镍氧化物共晶。最优选的预煅烧条件:预煅烧温度500℃,预煅烧时间5h。
优选的方案,镍钴锰氧化物与锂源按摩尔比li/m=1~1.1的混合,其中,m=ni+co+mn。最优选的摩尔比为li/m=1.05。
优选的方案,所述煅烧的条件为:在750~950℃温度下,煅烧6~18h。最优选的煅烧条件:煅烧温度800℃,预煅烧时间12h。
本发明提供的废旧镍钴锰酸锂三元正极材料再生的方法包括以下具体步骤:
1)将废弃的锂离子电池三元正极材料lini0.5co0.2mn0.3o2与磷酸-柠檬酸混酸溶液混合反应,得到含有li+、ni2+、co2+、mn2+的浸出溶液;所述混酸总浓度为0.3~0.7m,混酸中磷酸的浓度为≤0.6m,浸出固液比为15~40g/l,浸出温度为50~95℃,浸出时间为5~60min;
2)加入镍醋酸盐、钴醋酸盐、锰醋酸盐调节浸出液中镍离子、钴离子、锰离子的物质的量之比为5:2:3,总金属离子浓度为0.4m,以草酸为沉淀剂,氨水为ph调节剂,适宜温度下反应5h,并陈化一夜,然后过滤沉淀物,洗涤,干燥,得到镍钴锰草酸盐前驱体;所用沉淀剂草酸的浓度为0.4m,在600rpm的搅拌速度下,采用正向加料的方式,将镍钴锰混合溶液逐滴滴入草酸溶液,加料速度为9ml/min;反应过程中,通过添加浓氨水,调节体系ph=1~4,反应温度为25~60℃;草酸与浸出液总金属离子物质的量之比r=1.0~1.5:1。
3)将前驱体于500℃下预煅烧5h,研磨成粉末,粉末再与碳酸锂粉末按照li/m=1~1.1(m=ni+co+mn)摩尔比配料,在乙醇介质中手动研磨1h,干燥后在6mpa压力下压成圆片,750~950℃下煅烧6~18h,研磨,得到锂离子电池三元正极材料。
与现有技术相比,本发明技术方案带来的有益效果为:
1)本发明的废旧镍钴锰酸锂三元正极材料合成过程中,采用磷酸和柠檬酸作为镍钴锰酸锂三元正极材料中金属的协同浸出剂,相较于传统单酸浸出能够明显降低酸耗,大大缩短浸出时间,节约成本,并且整个过程无需额外加入还原剂;且磷酸和柠檬酸来源范围广,价格便宜,对环境影响小。
2)本发明的废旧镍钴锰酸锂三元正极材料合成过程中浸出液无需分离,直接用于合成三元正极材料,避免了现有技术中对浸出液中各种金属进行分离提纯的复杂流程,实现了金属的闭环循环利用。
附图说明
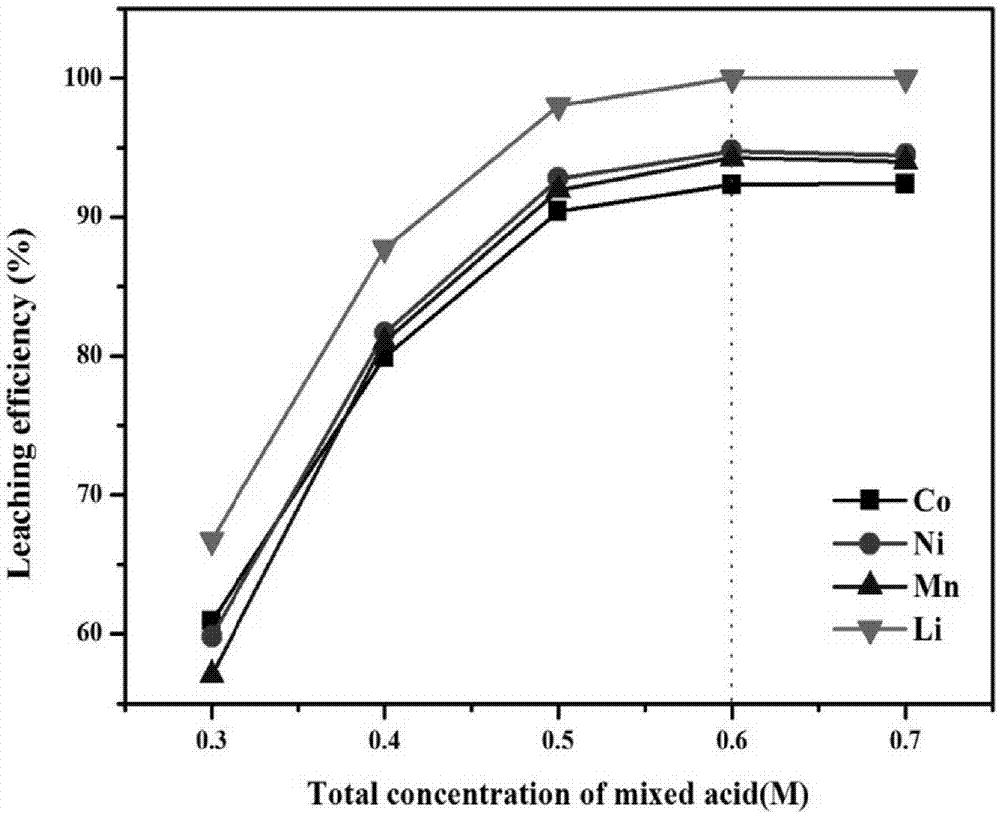
【图1】为对比实施例1中不同混酸总浓度得到的浸出液中锂、镍、钴、锰离子的浸出率。
【图2】为对比实施例2中混酸中不同磷酸浓度得到的浸出液中锂、镍、钴、锰离子的浸出率。
【图3】为对比实施例3中不同反应温度得到的浸出液中锂、镍、钴、锰离子的浸出率。
【图4】为对比实施例4中不同固液比得到的浸出液中锂、镍、钴、锰离子的浸出率。
【图5】为对比实施例5中不同反应时间得到的浸出液中锂、镍、钴、锰离子的浸出率。
【图6】为实施例1中最佳煅烧条件800℃,12h,锂金属比为1.05下制备的所得产品lini0.5co0.2mn0.3o2的xrd图。
【图7】为实施例1中最佳煅烧条件800℃,12h,锂金属比为1.05下制备的所得产品lini0.5co0.2mn0.3o2的sem图。
具体实施方式
以下实施例旨在进一步说明本发明内容而不是限制本发明权利要求的保护范围。
表征和分析手段:
采用电感耦合等离子体发射光谱仪(icp-oes)对滤液中的金属离子含量进行检测和分析。
xrd射线粉末衍射仪和扫描电子显微镜(sem)对沉淀产品进行表征和分析。
对比实施例1
配置混酸总浓度分别为0.3、0.4、0.5、0.6和0.7m,其中磷酸和柠檬酸等浓度混合的混酸溶液,均按照以下操作分别进行混酸浸出反应。取100ml混酸溶液加入250ml烧瓶中,调至转速500r/min。待溶液加热至90℃时,再加入2glini0.5co0.2mn0.3o2三元正极废料,搅拌反应40min后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液。
本对比例条件下不同混酸总浓度得到的浸出液中锂、镍、钴、锰离子的浸出率见表1和图1。
表1不同混酸总浓度得到的浸出液中锂、镍、钴、锰离子的浸出率
由表1和图1可知,在本对比例条件下,当混酸总浓度从0.3m增大到0.6m时,li、co、ni和mn的浸出效率分别从66.73%增大到100%、60.91%增大到92.32%、59.82%增大到94.77%、57.03%增大到94.26%。进一步增大混酸总酸浓度到0.7mol/l,各元素浸出效率基本上不再变化,所以选取0.6m作为最佳反应酸浓度。
对比实施例2
配置混酸总浓度为0.6m,混酸中磷酸浓度分别为0、0.1、0.2、0.3、0.4、0.5和0.6m的混酸溶液,均按照以下操作分别进行混酸浸出反应。取100ml混酸溶液加入250ml烧瓶中,调至转速500r/min。待溶液加热至90℃时,再加入2glini0.5co0.2mn0.3o2三元正极废料,搅拌反应40min后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液。
本对比例条件下混酸中不同磷酸浓度得到的浸出液中锂、镍、钴、锰离子的浸出率见表2和图2。
表2混酸中不同磷酸浓度得到的浸出液中锂、镍、钴、锰离子的浸出率
由表2和图2可知,在本对比例条件下,当磷酸浓度为0m,柠檬酸为0.6m时,co、ni、mn和li的浸出效率分别为50.71%、49.64%、45.56%、54.87%。当磷酸浓度为0.6m,柠檬酸浓度为0m时,co、ni、mn和li的浸出效率分别为38.66%、40.09%、1.36%、73.91%。可见在单一酸体系下,浸出效率比较低。当磷酸浓度为0.2m以及0.3m时,浸出效率最高,co、ni、mn和li的浸出效率分别为91.42%和92.32%、94.03%和94.77%、92.28%和94.26%、100%和100%。考虑到磷酸浓度太高,容易造成磷酸盐污染。故选磷酸浓度为0.2m,柠檬酸浓度为0.4m作为最佳反应条件。
对比实施例3
配置混酸总浓度为0.6m,其中磷酸浓度为0.2m,柠檬酸浓度为0.4m的混酸溶液。控制反应温度为50、60、70、80、90和95℃,分别进行以下浸出反应。取100ml混酸溶液加入250ml烧瓶中,调至转速500r/min。待溶液加热至设定温度后,再加入2glini0.5co0.2mn0.3o2三元正极废料,搅拌反应40min后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液。
本对比例条件不同反应温度得到的浸出液中锂、镍、钴、锰离子的浸出率见表3和图3。
表3不同反应温度得到的浸出液中锂、镍、钴、锰离子的浸出率
由表3和图3可知,在本对比例条件下,在反应温度达到90℃之前,活性物质的浸出效率随反应温度的增加而增大。进一步提高反应温度,浸出效率略有减低。分析原因可能是因为高温下酸发生了部分分解。因此,还原浸出的反应温度控制在90℃比较合适。
对比实施例4
配置混酸总浓度为0.6m,其中磷酸浓度为0.2m,柠檬酸浓度为0.4m的混酸溶液。控制反应固液比为15、20、25、30和40g/l,分别进行以下浸出反应。取100ml混酸溶液加入250ml烧瓶中,调至转速500r/min。待溶液加热至90℃后,再加入相应量lini0.5co0.2mn0.3o2三元正极废料,搅拌反应40min后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液,
本对比例条件不同固液比得到的浸出液中锂、镍、钴、锰离子的浸出率见表4和图4。
表4不同固液比得到的浸出液中锂、镍、钴、锰离子的浸出率
由表4和图4可知,在本对比例条件下,当固液比较小时,锂、钴、镍和锰能达到非常高的还原浸出效率。固液比超过20g/l时,浸出率随着固液比的增加急剧下降。考虑到保证浸出效率的前提下,降低化学药品的消耗量,选取固液比为20g/l作为最佳反应条件。
对比实施例5
配置混酸总浓度为0.6m,其中磷酸浓度为0.2m,柠檬酸浓度为0.4m的混酸溶液。控制反应时间为5、10、20、30、40和60min,分别进行以下浸出反应。取100ml混酸溶液加入250ml烧瓶中,调至转速500r/min。待溶液加热至90℃后,再加入2glini0.5co0.2mn0.3o2三元正极废料,搅拌至反应时间后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液。
本对比例条件不同反应时间得到的浸出液中锂、镍、钴、锰离子的浸出率见表5和图5。
表5不同反应时间得到的浸出液中锂、镍、钴、锰离子的浸出率
由表5和图5可知,在本对比例条件下,反应时间对钴、镍、锰和锂的浸出率的影响非常显著,当浸出时间为5min时,钴、镍、锰和锂的浸出率分别为45.70%、45.63%、42.72%和57.79%。随着反应时间的增加浸出率也逐渐增大,当反应时间为30min时,超过91.63%的co、93.38%的ni、92.00%的mn和100%的li被浸出。然而,再增加时间,锂、钴、镍、锰的浸出率基本不再变化。所以,选定30min为最优还原浸出时间。
通过对比例1~5的实验结果可知,最佳的浸出工艺条件为混酸总浓度0.6m、混酸中磷酸浓度0.2m、浸出温度90℃、反应时间30min和固液比20g/l。通过icp-oes检测,得到最佳浸出条件下li+、ni2+、co2+、mn2+的浸出率分别为100%、93.38%、91.63%和92.00%。保存滤液用于后续三元正极材料的再生。
实施例1
(1)配置混酸总浓度为0.6m,其中磷酸浓度为0.2m,柠檬酸浓度为0.4m的混酸溶液。取100ml加入250ml烧瓶中,调至转速500r/min。待溶液加热至90℃时,再加入2glini0.5co0.2mn0.3o2三元正极废料,搅拌反应30min后,抽滤,得到含有li+、ni2+、co2+、mn2+的溶液。
(2)取50ml(1)步骤所得溶液,加入(ch3coo)2ni·4h2o,(ch3coo)2co·4h2o和(ch3coo)2mn·4h2o,调节ni2+,co2+和mn2+离子的摩尔比为5:2:3,且溶液的总金属离子浓度为0.4m。在600rpm的搅拌速度下,采用正向加料的方式,将所述镍钴锰混合溶液逐滴滴入适量h2c2o4溶液中,其滴加速度9ml/min。反应过程中,通过添加nh3·h2o,调节体系ph,于适宜温度下反应5h,并陈化一夜,然后过滤沉淀物,洗涤,干燥,得到ni0.5co0.2mn0.3c2o4·2h2o。设计相应的单因素实验探究最优沉淀条件,控制ph(1、2、3、4)、反应温度(25、40、50、60℃)以及草酸与浸出液总金属离子物质的量之比r(1.0、1.2、1.5)。ph过高或过低,均不能完全沉淀金属离子。ph过高,所加氨水过量,部分金属离子优先和氨水形成配合物,难以被草酸沉淀下来,尤其是ni2+。温度低于50℃时,不能完全沉淀金属离子,所得沉淀结晶性能较差,颗粒不均匀。r=1.0时,所加草酸的量不足以完全沉淀金属离子。r=1.2或1.5时,即草酸过量时,能完全沉淀金属离子。通过icp-oes检测,得到最佳沉淀条件ph=2、反应温度为50℃、草酸与浸出液总金属离子物质的量之比r=1.2(即60ml0.4mh2c2o4溶液)。在最佳沉淀条件下,得到3.61gni0.5co0.2mn0.3c2o4·2h2o。
(3)将(2)所得ni0.5co0.2mn0.3c2o4·2h2o于500℃下预煅烧5h,得到1.50g(ni0.5co0.2mn0.3)3o4。再与一定量li2co3粉末混合,加入乙醇介质于玛瑙研钵中手动研磨1h,干燥后使用相应模具和压片机在6mpa压力下压成圆片,在适宜温度下于管式炉中煅烧一段时间,然后研磨,得到再生的lini0.5co0.2mn0.3o2。设计相应的单因素实验探究最佳煅烧条件,煅烧温度(750、800、850、900和950℃)、煅烧时间(6h,12h和18h)、锂金属比(1.00,1.05和1.10)。煅烧温度过低或煅烧时间过短,颗粒没有完全发育长大,形状不规整,结晶度低,阳离子混排严重。煅烧温度过高或煅烧时间过长,颗粒异常变大,导致锂离子在充放电过程中迁移路径变长,在晶体中扩散速度变慢。并且锂挥发严重,阳离子混排加剧,材料电化学性能下降。锂金属比过低,由于锂高温下挥发,煅烧后所得材料中锂含量偏低,造成阳离子混排严重。锂金属比过高,则太多锂进入材料结构,造成材料偏离层状结构。
将上述条件下所得再生lini0.5co0.2mn0.3o2,采用xrd对其化合物的成分进行鉴别和对比分析,由得到的xrd图可知,所述电极材料归属于r-3m型空间群的α-nafeo2型层状结构,根据(006)/(102)和(108)/(110)这两对衍射峰分裂表明该材料具有良好有序的层状结构。i003/i104(r)衍射峰强度比可以用来表征阳离子混合度。一般来说,当r>1.2时,阳离子混合程度较低。对于六方单元,晶格参数a和c的比值可以表征六方结构的完整性。一般来说,当c/a>4.899时,六方结构被认为是非常规则的。由此判定依据,初步判定800℃,12h,锂金属比为1.05为最佳煅烧条件,其(006)/(102)和(108)/(110)这两对衍射峰有明显分裂,r1=1.23,c/a=4.9460。
本实施例再生三元正极材料的合成过程中,在最优操作条件下生成草酸盐预聚体ni0.5co0.2mn0.3c2o4·2h2o,氧化物中间体(ni0.5co0.2mn0.3)3o4以及产品lini0.5co0.2mn0.3o2金属组成的理论值和实际值(icp-oes检测所得)见表6。
表6草酸盐预聚体,氧化物中间体以及产品金属组成的理论值和实际值
以上所述仅为本发明的较佳实施例,凡依本发明权利要求范围所做的均等变化与修饰,皆应属本发明权利要求的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!