抗菌剂固定化方法及抗病毒剂固定化方法与流程
相关分案申请
本申请案是发明名称为“抗菌剂及抗病毒剂组成物的制造方法及固定化方法,抗菌化方法,清洗、漱口方法”,申请号为200980157494.1的发明专利国际申请案的分案申请,原申请案的申请日是2009年11月05日。
本发明涉及一种含有含硅化合物的抗菌剂组成物及抗病毒剂组成物,以及使用该抗菌剂组成物的抗菌化方法及清洗、漱口方法,进而涉及一种使用该抗菌剂组成物或者该病毒剂组成物的抗菌剂固定化方法及抗病毒剂固定化方法。
背景技术:
近年来,对生活环境的卫生意向提高,因此对餐具、眼镜、水池、厨房周边、便器、卫生间周边、浴池、浴室周边、洗脸盆、盥洗室周边、纤维制品或者衣服的卫生意向、抗菌意向提高。另外,除了高龄化社会的到来,新型流感的世界性蔓延也成为较大要因,所以也强烈期望通过不仅简便地使细菌或霉菌等真菌类失活,而且简便地使流感病毒(influenzavirus)、诺如病毒(norovirus)等病原体病毒失活,使毛巾或口罩等围绕生活环境的物品等抗菌化、抗病毒化,来显着减少被感染或二次感染的风险。
这样一来,卫生意向、抗菌意向、抗病毒意向进一步提高,因此要求可发挥出比以前的抗菌剂或抗病毒剂更高的杀菌性能或病原性病毒的失活能力的抗菌剂组成物或抗病毒剂组成物,例如专利文献1~专利文献3中公开了可带来抗菌性的含硅化合物,且公开了采用所述化合物的各种态样的组成物。
另一方面,若尝试使所述组成物专业化为牙科材料,则特别处于义齿使用者增加,义齿清洗剂的使用量也增大的状况下,并且也使用各种组成的义齿清洗剂等,因此也要求兼具可用于短时间的清洗且抗菌性长期持续的清洗性能的抗菌剂组成物。
例如,若将可发挥上述清洗性能的以前的抗菌剂组成物以成分类来分类,则可分类为将过氧化物、次氯酸、酵素、酸、生药、银类无机抗菌剂或者消毒药中的任一种作为主要成分,或者将两种以上组合而成的成分类。而且,属于同一成分类的抗菌剂组成物中,其具体组成也是各种各样。其原因在于,于作为抗菌剂组成物而要求清洗性能及杀菌性能这两种功能的情况,将发挥各自作用的成分组合来构成的情况较多。
为了也应对上述要求,例如专利文献4中公开了:兼具抗菌性能及清洗性能的清洗剂组成物,其清洗性能及杀菌性能更高,另外以改善经清洗的被清洗物品的抗菌性能、清洗性能及其持续性为目的,于植牙、牙冠、牙桥、矫正用托架、牙科用线等牙科材料,特别是义齿中,在安装于口腔内时可阻止义齿表面再形成义齿菌斑;或义齿清洗剂组成物,其特别是可不对义齿使用者造成特别的负担或不快感,而容易对义齿赋予抗菌性能。
现有技术文献
专利文献
专利文献1:日本专利特表2007-502328号公报
专利文献2:日本专利特表平6-505036号公报
专利文献3:日本专利特开2006-213709号公报
专利文献4:日本专利特开2007-146134号公报
技术实现要素:
发明所要解决的课题
然而,若使所述专利文献1~专利文献3中所示的例如十八烷基二甲基(3-三甲氧基硅烷基丙基)氯化铵之类的所谓甲氧基体的含硅化合物包含于组成物中,则在制造步骤中或输送中、或者使用中无法避免毒性高的甲醇的参与,因此不仅在组成物自身的安全性方面残留很多问题,并且也依然不明了是否可对病原体病毒,特别是流感等病毒充分发挥失活的作用。
另一方面,所述专利文献4中记载的清洗剂组成物中所含的抗菌成分的含硅化合物是由使其溶解的溶剂、所混合的表面活性剂的种类来决定其于溶液中的稳定性,根据情况会产生白浊凝胶化,由此存在清洗剂组成物的抗菌性赋予性能下降的情况。进而,为了应对近年来的卫生意向及抗菌意向的进一步提高的要求,而谋求抗菌性及抗菌持续性进一步提高的抗菌剂组成物。
另外,若在利用所述抗菌剂组成物来清洗及赋予抗菌性的同时也可以消毒、除菌,则对于卫生环境的进一步提高及病原菌感染预防而言有效,但所述专利文献4中,虽然关于清洗剂组成物的物品清洗及抗菌性赋予有所记载,但并未对该清洗剂组成物是否可以在清洗及抗菌性赋予的同时也可以消毒、除菌进行研究。
进而,若抗菌性清洗剂不仅可进行义齿的清洗及抗菌化,并且作为牙的主成分的羟磷石灰(hydroxyapatite)也可以抗菌化,则通过将所述抗菌性清洗剂作为洁牙剂、漱口剂来使用,对于龋齿、牙周病以外的齿性感染症或吸入性肺炎的治疗、预防非常有效,但并未对所述专利文献4中记载的清洗剂组成物实际上是否可使牙或作为其主成分的羟磷石灰抗菌化进行研究。
此外,若可将如上所述的高性能的抗菌剂组成物或抗病毒剂组成物牢固地固定在物品的表面,则预计利用价值会进一步提高。
因此,本发明的目的在于解决所述问题,提供一种通过采用利用特定的制法来获得的含硅化合物,而不仅兼具高安全性及优异的抗菌性,抗菌成分更稳定,可对牙赋予抗菌性,并且也可以进行物品清洗及漱口的抗菌剂组成物,以及兼具高安全性及优异的病毒失活能力的抗病毒剂组成物;并且提供一种使用这些组成物的抗菌方法,清洗、漱口方法,以及抗菌剂及抗病毒剂的固定化方法。
解决课题采用的手段
本发明人等人为了解决所述问题而进行潜心研究,结果发现一种含有利用特定的制法来获得的含硅化合物作为抗菌成分的抗菌剂组成物、及含有特定的含硅化合物的抗病毒剂组成物,从而完成本发明。
即,本发明的抗菌剂组成物含有含硅化合物,该含硅化合物是通过使下述通式(a)所表示的三乙氧基硅烷基化合物在乙醇溶剂中反应而获得:
[化1]
x-(ch2)3-si-(och2ch3)3(a)
(式中,x表示卤素离子或者有机羰氧基离子(有机羧酸离子)),并且所述含硅化合物是由下述通式(1)所表示:
[化2]
(式中,r1表示碳原子数12~24的烷基,r2及r3表示可相同或不同的碳原子数1~6的低级烷基,x表示卤素离子或者有机羰氧基离子(有机羧酸离子))。
所述通式(1)所表示的含硅化合物优选为十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵(octadecyldimethyl(3-triethoxysilylpropyl)ammoniumchloride)。
所述抗菌剂组成物可还包含乙醇,也可以还包含水,也可以还包含两性离子表面活性剂和/或阳离子表面活性剂。
本发明的抗菌化方法在于利用所述抗菌剂组成物使物品的表面抗菌化。
本发明的清洗、漱口方法在于使用所述抗菌剂组成物来清洗、漱口。
本发明的抗病毒剂组成物在于含有下述通式(1)所表示的含硅化合物:
[化3]
(式中,r1表示碳原子数12~24的烷基,r2及r3表示可相同或不同的碳原子数1~6的低级烷基,x表示卤素离子或者有机羰氧基离子(有机羧酸离子))。
所述通式(1)所表示的含硅化合物优选为十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵。
所述抗病毒剂组成物可还包含乙醇,也可以还包含水,也可以还包含两性离子表面活性剂和/或阳离子表面活性剂。
所述抗病毒剂组成物优选为具有使选自由a型流感病毒(人、禽、猪(新型))、b型流感病毒、副流感病毒(parainfluenzavirus)及诺如病毒所组成组群中的至少一种病毒失活的能力。
本发明的抗菌剂固定化方法在于:使用表面具有含氧官能基的物品,对该物品的表面涂布或者喷雾所述抗菌剂组成物,或者将该物品浸渍于所述抗菌剂组成物中。
本发明的抗病毒剂固定化方法在于:使用表面具有含氧官能基的物品,对该物品的表面涂布或者喷雾所述抗病毒剂组成物,或者将该物品浸渍于所述抗病毒剂组成物中。
发明的效果
利用本发明的抗菌剂组成物及抗病毒剂组成物,由于含有利用特定的制法来获得的具有乙氧基的所谓乙氧基体的含硅化合物,因此在制造步骤中或输送中、或者使用中毒性高的甲醇完全不参与,与以前的含有甲氧基体的含硅化合物的药剂相比可保持极高的安全性,也可以发挥优异的抗菌性或抗病毒性。
通常,菌或病毒仅经过1小时~2小时,其数量就增殖为大致2倍,因此若假设可将这些菌或病毒的数量抑制为千分之一,则达到所述相同数量的增殖数为止产生数十小时的宽限期,因此确认到相当的抗菌性或抗病毒性。在此,本发明的抗菌剂组成物及抗病毒剂组成物所发挥的抗菌性或抗病毒性与应用以前的含有甲氧基体的含硅化合物的药剂的情况相比,可将残存菌数或者残存病毒量减少数位数以上而使其实质上为0,表现出极其划时代的效果,利用价值非常高。所述抗病毒性尤其对a型流感病毒(人、禽、猪(新型))、b型流感病毒、副流感病毒或者诺如病毒而言非常有效。
另外,通过在所述抗菌剂组成物及抗病毒剂组成物中组合特定的表面活性剂、及特定的溶剂,可使抗菌成分长期稳定化,与以前相比可提高抗菌性能及持续性,进而也可以进行物品的消毒、除菌,且在漱口的同时有效地使牙抗菌化,可简便且有效地使牙或羟磷石灰抗菌化。
进而,利用本发明的抗菌剂固定化方法及抗病毒剂固定化方法,可在物品的表面有效地固定抗菌剂及抗病毒剂,基于高安全性,可使这些药剂所具有的抗菌性或抗病毒性充分发挥。
附图说明
图1是表示实例3中的etac与si-qac的抗菌性比较试验的结果的图表,纵轴为吸亮度。
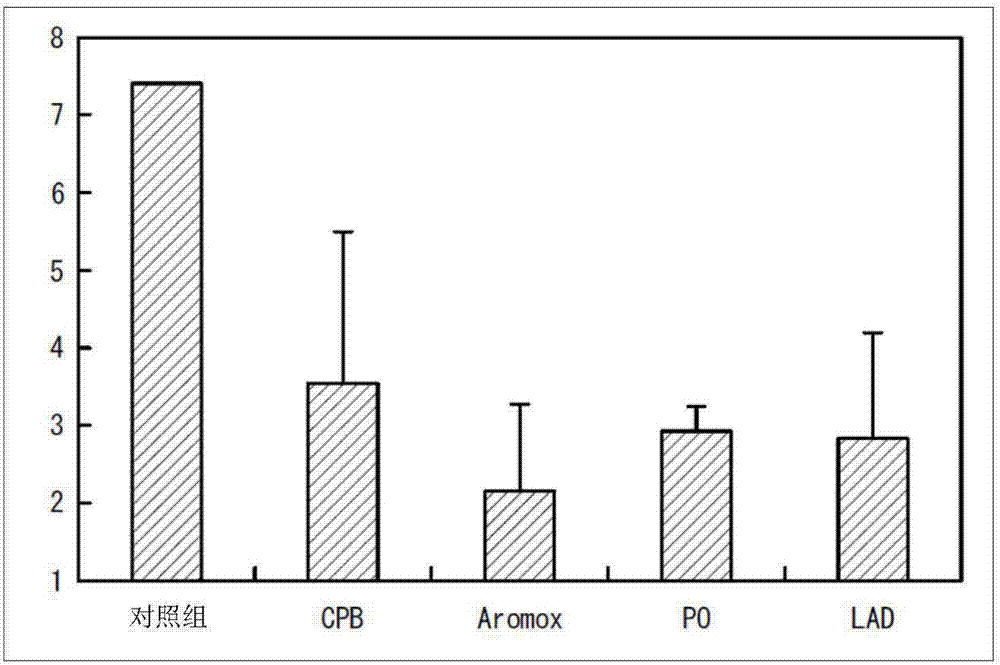
图2是表示实例6中的etac水溶液中的抗菌性试验的结果的图表,纵轴为检测出的菌数(对数值)。
图3是表示实例9中的对于流感病毒的病毒感染性失活能力试验的结果的图表,纵轴为etac浓度(%),横轴为残存流感病毒量(%)。
图4是表示实例9中的对于新型(猪)流感病毒(h1n1型)的病毒感染性失活能力试验的结果的图表,纵轴为残存流感病毒量(病毒残存率:%)。
图5是表示实例10中的etac处理毛巾及etac处理玻璃小瓶的抗流感病毒作用试验的结果的图表,纵轴为50%组织培养感染量(50%tissuecultureinfectiousdose[tcid50])。
具体实施方式
以下,对本发明进行更详细的说明。
此外,本说明书中,所谓“抗菌”,是指细菌及真菌类的杀菌或者损伤、或者这些细菌及真菌类的增殖防止,所谓“抗病毒”,是指病原体病毒的失活。
本发明的抗菌剂组成物含有含硅化合物,该含硅化合物是通过使下述通式(a)所表示的三乙氧基硅烷基化合物在乙醇溶剂中反应而获得:
[化4]
x-(ch2)3-si-(och2ch3)3(a)
(式中,x表示卤素离子或者有机羰氧基离子(有机羧酸离子)),并且所述含硅化合物是由下述通式(1)所表示:
[化5]
(式中,r1表示碳原子数12~24的烷基,r2及r3表示可相同或不同的碳原子数1~6的低级烷基,x表示卤素离子或者有机羰氧基离子(有机羧酸离子))。
式(a)及式(1)中的x可例示:氯离子、溴离子等卤素离子;甲基羰氧基离子(乙酸盐离子)、乙基羰氧基离子(丙酸盐离子)、苯基羰氧基离子(苯甲酸盐离子)等有机羰氧基离子(有机羧酸离子)。
式(1)中的r1的碳原子数12~24的烷基可例示:十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、二十一烷基、二十二烷基、二十三烷基、二十四烷基等。
式(1)中的r2及r3的可相同或不同的碳原子数1~6的低级烷基例如可例示:甲基、乙基、丙基、异丙基、丁基、戊基、己基、环己基等。
即,本发明的抗菌剂组成物中所含的所述通式(1)所表示的含硅化合物是通过使所述通式(a)所表示的特定的三乙氧基硅烷基化合物在乙醇溶剂中反应而获得的特定含硅化合物,所述含硅化合物是在硅原子上键合有3个乙氧基的所谓乙氧基体的含硅化合物。
若是如以前的含硅化合物那样,在硅原子上键合有甲氧基的所谓甲氧基体的含硅化合物,则制造时需要甲醇,而且在制造后也有由于水解等副反应而生成甲醇的顾虑。然而已指出,甲醇是不仅经口时有害的顾虑高,而且有强烈的眼刺激或对生殖能力或者胎儿的不良影响的顾虑,除此以外,也有中枢神经系统、视觉器官、全身毒性的障碍或者对呼吸器官的刺激的顾虑或引发困倦或者头晕的顾虑,而且会导致由长期或反复暴晒所引起的中枢神经系统、视觉器官的障碍。因此,与以前相比,由于如上所述的甲醇的存在,不仅所得的含硅化合物自身的安全性受到威胁,而且含有该含硅化合物的抗菌剂组成物的安全性也受到威胁。
对此,本发明中,在制造所述含硅化合物时使用乙醇溶剂,另一方面,完全不使用如甲醇这种毒性高的溶剂,并且从作为乙氧基体的所述含硅化合物而言,完全不存在由于水解等副反应而生成甲醇的情况,因此所得的抗菌剂组成物的安全性极高。进而,当所述通式(a)所表示的特定的三乙氧基硅烷基化合物在乙醇溶剂中反应时,也不存在获得作为副产物的如甲氧基体这种含硅化合物的顾虑。
所述通式(1)所表示的含硅化合物的具体例可列举:十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十二烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十二烷基二异丙基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十八烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十八烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵等,这些化合物中,更优选为生物体毒性或使用时的环境负荷、废液的环境负荷最少的十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵。
制造所述含硅化合物时,是使所述通式(a)所表示的特定的三乙氧基硅烷基化合物在乙醇溶剂中反应。通过使这些化合物在乙醇溶剂中反应,可有效抑制甲氧基体等副产物的产生,并且可显着提高所得含硅化合物的安全性。具体而言,是使所述通式(a)所表示的特定的三乙氧基硅烷基化合物与下述通式(b)所表示的胺在乙醇溶剂中反应:
[化6]
(式中,r1表示碳原子数12~24的烷基,r2及r3表示可相同或不同的碳原子数1~6的低级烷基)。
更具体而言,例如于制造十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵的情况,是向反应器中投入作为所述通式(a)所表示的三乙氧基硅烷基化合物的三乙氧基硅烷基丙基氯化物、作为所述通式(b)所表示的胺的n,n-二甲基十八烷基胺、及乙醇,通常加热至100℃~180℃,优选为120℃至150℃,通常使其反应10小时~60小时,优选为20小时~40小时。所反应的三乙氧基硅烷基化合物与胺的摩尔比通常优选为1.5∶0.8~1∶1。此外,乙醇中的这些三乙氧基硅烷基化合物及胺的浓度并无特别限定,可视需要来适当变更。
本发明的抗菌剂组成物中的所述含硅化合物的含量只要是可发挥抗菌作用及其持续性的量,则并无特别限定,通常为0.6ppm以上,优选为20ppm以上,更优选为0.006重量百分比(wt%)~24wt%,最优选为0.06wt%~6wt%,为了充分发挥抗菌化作用及其持续性,优选为在该范围内。
本发明的抗菌剂组成物中可还包含乙醇。所述乙醇浓度并无特别限定,从以抗菌化作用为主要目标的观点而言,优选为50体积百分比(vol%)~85vol%。另外,从将所述抗菌剂组成物固定在物品上的观点而言,乙醇浓度优选为35vol%~85vol%。所述抗菌剂组成物中可还包含水。即,所述抗菌剂组成物中可含有水、乙醇、或者乙醇水溶液(以下,也将所述溶剂称为“水和/或乙醇”)中的任一种作为溶剂。于将这些中的任一种用作溶剂的情况,均为只要所述含硅化合物的含量在所述范围内,则与甲醇相比毒性极低,可大幅度提高所得抗菌剂组成物的安全性,因此可获得兼具高度的安全性及优异的抗菌化作用的药剂。
进而,所述抗菌剂组成物中可根据用途而含有至少一种两性离子表面活性剂,或者可含有至少一种阳离子表面活性剂,也可以含有这些两性离子表面活性剂及阳离子表面活性剂这两者。其中,优选为含有所述两性离子表面活性剂。通过含有这些表面活性剂,则变得更容易使所述含硅化合物在药剂中稳定化来防止溶液的白浊、凝胶化。
所述两性离子表面活性剂优选为选自由甜菜碱(betaine)类及氧化胺(amineoxide)类所组成组群中的至少一种。其中,从抗菌成分的进一步稳定化的观点而言,优选为氧化胺类的两性离子表面活性剂。
甜菜碱类的两性离子表面活性剂例如可列举:椰子脂肪酸酰胺丙基羧基甜菜碱(coconutfattyacidamidepropylcarboxybetaine)、月桂基二甲基氨基乙酸甜菜碱(lauryldimethylaminoaceticacidbetaine)、咪唑鎓甜菜碱(imidazoliumbetaine)等。这些表面活性剂中,从作为水和/或乙醇中的抗菌成分的所述含硅化合物的稳定性的观点而言,优选为椰子脂肪酸酰胺丙基羧基甜菜碱、月桂基二甲基氨基乙酸甜菜碱。
氧化胺类两性离子表面活性剂例如可列举:月桂基二甲基氧化胺(lauryldimethylamineoxide)、月桂酰胺丙基二甲基氧化胺(lauroylamidepropyldimethylamineoxide)等。这些表面活性剂中,从作为水和/或乙醇中的抗菌成分的所述含硅化合物的长期稳定性的观点而言,优选为月桂基二甲基氧化胺。
所述阳离子表面活性剂例如可列举:下述通式(2)
[化7]
(式中,r11表示碳原子数6以上的烃基,r12、r13及r14表示可相同也可以不同的低级烃基,y表示卤素离子或者有机羰氧基离子)所表示的阳离子表面活性剂(其中,所述含硅化合物除外)、氯化鲸蜡基吡啶鎓(cetylpyridiniumchloride)、n-椰油酰基-精氨酸乙酯吡啶酮羧酸盐(n-cocoyl-arginineethylesterpyridonecarboxylate)等。
所述通式(2)所表示的阳离子表面活性剂中优选为,r11表示碳原子数10至25的烷基,r12、r13及r14表示可相同或不同的碳原子数1至6的低级烷基,y为卤素离子或者有机羰氧基离子(有机羧酸离子)。
所述通式(2)所表示的阳离子表面活性剂的碳原子数6以上的烃基r11可例示:己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基、二十一烷基、二十二烷基、二十三烷基、二十四烷基、二十五烷基等。
所述通式(2)所表示的阳离子表面活性剂的r12、r13及r14例如可例示:甲基、乙基、丙基、异丙基、丁基、戊基、己基、环己基、苯基、甲苯基等。
所述通式(2)所表示的阳离子表面活性剂具体而言可例示以下化合物。即,可列举:癸基三甲基氯化铵、癸基三乙基乙酸铵、十二烷基三甲基乙酸铵、十二烷基三异丙基溴化铵、十三烷基三乙基溴化铵、十四烷基三甲基氯化铵、十四烷基三乙基氯化铵、十四烷基三正丙基氯化铵、十五烷基三甲基氯化铵、十五烷基三乙基氯化铵、十五烷基三正丙基氯化铵、十六烷基三甲基氯化铵、十六烷基三乙基氯化铵、十六烷基三正丙基氯化铵、十八烷基三甲基氯化铵、十八烷基三乙基氯化铵、十八烷基三正丙基氯化铵等,尤其最优选为十六烷基三甲基铵。
所述阳离子表面活性剂中,从可进一步提高抗菌性及稳定性的方面而言,特别优选为十六烷基三甲基铵、氯化鲸蜡基吡啶鎓。
另外,特别是从即便是在短时间的处理条件下使用低含量的所述含硅化合物的情况也可以发挥优异抗菌性的观点而言,所述两性离子表面活性剂及阳离子表面活性剂中,特别优选为作为两性离子表面活性剂的月桂基二甲基氧化胺。即便在严酷的条件下也表现出显着的抗菌性,推测是由于,通过月桂基二甲基氧化胺与含硅化合物的反应而生成中间体,所述中间体有助于提高作为抗菌成分的反应性。
所述两性离子表面活性剂的含量通常为0.007(重量/体积百分比)wt/vol%~20wt/vol%,优选为0.05wt/vol%~10wt/vol%,为了充分发挥抗菌作用及其持续性,优选为在该范围内。特别是在牙科材料或毛巾等纤维制品及衣服等各物品上固定所述抗菌剂组成物中的含硅化合物的情况,所述抗菌剂组成物中的含硅化合物的含量通常只要为0.03wt%以上,优选为0.06wt%以上,则可充分发挥其效果。对于上限值并无特别限制,从成本方面而言,优选为0.6wt%以下。此外,于包含阳离子表面活性剂的情况,从所述含硅化合物的稳定性及抗菌性提高的观点而言,其含量优选为0.01wt/vol%~5wt/vol%,更优选为0.05wt/vol%~1wt/vol%。
所述抗菌剂组成物特别是在包含两性离子表面活性剂的情况,也可以作为发挥清洗作用的清洗剂组成物来使用。所述清洗剂组成物可在作为其抗菌成分的所述含硅化合物并不白浊凝胶化的情况下长期稳定,并且赋予比以前的清洗剂组成物更高的抗菌性能,进而,从可进行牙的抗菌化的方面而言,作为以龋齿、牙周病以外的齿性感染症或吸入性肺炎的治疗、预防为目的的洁牙剂、漱口剂而有用。另外,所述清洗剂组成物可还包含至少一种阳离子表面活性剂。通过添加阳离子表面活性剂,可进一步提高本发明的清洗剂组成物的抗菌性及抗菌持续性、以及稳定性。
另外,所述抗菌剂组成物特别是在包含阳离子表面活性剂的情况,作为用以在将物品进行消毒、清洗、除菌的同时进行抗菌化的消毒、清洗、漱口、除菌及抗菌化用组成物也有用。所述消毒、清洗、漱口、除菌及抗菌化用组成物与所述本发明的抗菌剂组成物同样,可进行牙的抗菌化,因此可作为以龋齿、牙周病以外的齿性感染症或吸入性肺炎的治疗、预防为目的的洁牙剂、漱口剂来使用。
这些清洗剂组成物及消毒、清洗、漱口、除菌及抗菌化用组成物中的所述含硅化合物的含量是与所述本发明的抗菌剂组成物同样,通常为0.6ppm以上,优选为20ppm以上,更优选为0.006wt%~24wt%,最优选为0.06wt%~6wt%,为了充分发挥抗菌作用及其持续性,优选为在该范围内。特别是于在牙科材料或毛巾等纤维制品及衣服等各物品上固定所述消毒、清洗、漱口、除菌及抗菌化用组成物中的含硅化合物的情况,该组成物中的含硅化合物的含量只要与所述本发明的抗菌剂组成物同样地,通常为0.03wt%以上,优选为0.06wt%以上,则可充分发挥其效果。对于上限值并无特别限制,从成本方面而言,优选为0.6wt%以下。
从水和/或乙醇中的所述含硅化合物的稳定性及抗菌性提高的观点而言,所述消毒、清洗、除菌及抗菌化用组成物中的阳离子表面活性剂的含量优选为0.01wt/vol%~5wt/vol%,更优选为0.5wt/vol%~3wt/vol%。
本发明的抗菌化方法在于:发挥消毒、清洗、除菌及抗菌化作用,利用所述本发明的抗菌剂组成物(清洗剂组成物)对物品的表面进行消毒、清洗、除菌及抗菌化。具体而言,物品的利用所述抗菌剂组成物的消毒、清洗、除菌及抗菌化可通过以下操作来进行:将物品浸渍于所述抗菌剂组成物中,或将所述抗菌剂组成物涂布或者喷雾于物品的表面上,或利用所述抗菌剂组成物将物品的表面冲洗数次,或者利用渗入了所述抗菌剂组成物的布等来擦净物品的表面;只要是物品与所述抗菌剂组成物可接触规定时间的方法,则并无特别限制。另外,进行这些处理的时间也只要是所述抗菌剂组成物中所含的抗菌成分可与物品的表面充分反应的时间即可,可适当选择。此外,也可以在利用所述抗菌剂组成物进行消毒、清洗、除菌及抗菌化之后,根据需要进行水洗等,从物品的表面去除抗菌剂组成物。
利用本发明的抗菌化方法来消毒、清洗、除菌及抗菌化的物品可列举:植牙、牙冠、牙桥、矫正用托架、牙科用线等牙科材料;餐具、眼镜、水池、厨房周边、便器、卫生间周边、浴池、浴室周边、洗脸盆、盥洗室周边、毛巾等纤维制品或者衣服等范围广泛的物品。
另外,本发明的清洗、漱口方法是在将物品消毒的同时进行抗菌化的方法,利用所述本发明的抗菌剂组成物(消毒、清洗、漱口、除菌及抗菌化用组成物),将物品进行消毒、清洗、漱口、除菌及抗菌化。具体而言,可通过以下操作来进行:将物品浸渍于所述抗菌剂组成物中,或利用渗入了所述抗菌剂组成物的布等来擦净物品的表面,或者对所述物品涂布或者喷雾所述抗菌剂组成物;只要是物品与所述抗菌剂组成物可接触规定时间的方法,则并无特别限制。另外,进行这些处理的时间也只要是所述抗菌剂组成物中所含的抗菌成分可与物品的表面充分反应的时间即可,可适当选择。或者也可以使用所述本发明的抗菌剂组成物(消毒、清洗、漱口、除菌及抗菌化用组成物)来漱口。具体而言,利用所述抗菌剂组成物的漱口例如可通过使用所述抗菌剂组成物进行含漱来冲洗口腔内,进行漱口。
若利用如上所述的清洗、漱口方法,则通过使用抗菌赋予性及抗菌持续性优异的所述抗菌剂组成物,可有效地进行口内的清洗、消毒、除菌,同时可对牙赋予优异的抗菌性及抗菌持续性。
另外,使所述含硅化合物在水和/或乙醇中稳定化的方法中,也可以采用通过使用氧化胺类两性离子表面活性剂的至少一种来使本发明的所述通式(1)所表示的含硅化合物在水和/或乙醇中稳定化的方法。通过使所述通式(1)所表示的含硅化合物在氧化胺类的两性离子表面活性剂与水和/或乙醇中共存,可使所述含硅化合物在水和/或乙醇中长期稳定化,可制造可防止溶液的白浊、凝胶化而赋予优异的抗菌性及抗菌持续性的抗菌剂组成物。
使本发明的所述通式(1)所表示的含硅化合物在水和/或乙醇中稳定化的方法中,除了氧化胺类两性离子表面活性剂的至少一种以外,也可以进一步使用至少一种阳离子表面活性剂,可获得同样的效果。
使本发明的所述通式(1)所表示的含硅化合物在水和/或乙醇中稳定化的方法中,所述通式(1)所表示的含硅化合物、氧化胺类两性离子表面活性剂、阳离子表面活性剂是与本发明的抗菌剂组成物中所含的化合物相同。另外,所述含硅化合物及氧化胺类两性离子表面活性剂的含量的范围也与本发明的抗菌剂组成物中所含的表面活性剂为相同的范围,对于使所述含硅化合物在水和/或乙醇中稳定化而进一步获得的溶液充分发挥抗菌作用及其持续性而言优选。此外,于使用阳离子表面活性剂的情况,从所述含硅化合物的稳定性及抗菌性提高的观点而言,其含量的范围也优选为与所述抗菌剂组成物中所含的表面活性剂为相同的范围。
另外,使本发明的所述通式(1)所表示的含硅化合物在水和/或乙醇中稳定化的方法,是在使所述含硅化合物在水和/或乙醇中稳定化的方法中,使用阳离子表面活性剂的至少一种。通过使所述通式(1)所表示的含硅化合物在阳离子表面活性剂与水和/或乙醇中共存,可使所述含硅化合物在水和/或乙醇中长期稳定化,可制造除了可防止溶液的白浊、凝胶化而赋予优异的抗菌性及抗菌持续性以外,也可以进行消毒、除菌的抗菌剂组成物。
使本发明的所述通式(1)所表示的含硅化合物在水和/或乙醇中稳定化的方法中,所述通式(1)所表示的含硅化合物、阳离子表面活性剂是与本发明的抗菌剂组成物中所含的化合物相同。另外,所述含硅化合物及阳离子表面活性剂的含量的范围也与本发明的抗菌剂组成物中所含的化合物为相同的范围,这对于使所述含硅化合物在水和/或乙醇中稳定化而进一步获得的溶液充分发挥抗菌作用及其持续性而言优选。
另外,利用所述本发明的抗菌剂组成物,也可以使牙或者羟磷石灰抗菌化。通过使用本发明的抗菌剂组成物,可对牙或作为其主成分的羟磷石灰简便地赋予优异的抗菌性,可使其抗菌性长期持续。此外,从可使优异的抗菌性更长期地持续的方面而言,优选为利用本发明的抗菌剂组成物来抗菌化。
利用所述本发明的抗菌剂组成物的牙或者羟磷石灰的抗菌化,具体而言可通过以下操作来进行:将牙或者羟磷石灰浸渍于本发明的抗菌剂组成物中,或于牙或者羟磷石灰的表面涂布或者喷雾本发明的抗菌剂组成物,或者利用渗入了本发明的抗菌剂组成物的布等来擦净牙或者羟磷石灰的表面;只要是牙或者羟磷石灰与本发明的抗菌剂组成物可接触规定时间的方法,则并无特别限制。另外,进行这些处理的时间也只要是本发明的抗菌剂组成物中所含的抗菌成分可与牙或者羟磷石灰的表面充分反应的时间即可,可适当选择。
本发明的抗病毒剂组成物在于含有下述通式(1)所表示的含硅化合物:
[化8]
(式中,r1表示碳原子数12~24的烷基,r2及r3表示可相同或不同的碳原子数1~6的低级烷基,x表示卤素离子或者有机羰氧基离子(有机羧酸离子))。所述通式(1)中的r1~r3及x与所述的本发明的抗菌剂组成物中的含硅化合物含义相同。从所述作为乙氧基体的含硅化合物而言,不会由于水解等副反应而生成毒性高的甲醇,因此安全性非常高,通过含有所述化合物,可获得兼具高度的安全性及优异的抗病毒性的抗病毒剂组成物。
所述通式(1)所表示的含硅化合物的具体例可列举:十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十二烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十二烷基二异丙基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十四烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十五烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十六烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵、十八烷基二乙基(3-三乙氧基硅烷基丙基)氯化铵、十八烷基二正丙基(3-三乙氧基硅烷基丙基)氯化铵等,这些含硅化合物中,更优选为生物体毒性或使用时的环境负荷、废液的环境负荷的最少的十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵。
所述通式(1)所表示的含硅化合物优选为使下述通式(a)所表示的三乙氧基硅烷基化合物在乙醇溶剂中反应而获得:
[化9]
x-(ch2)3-si-(och2ch3)3(a)
(式中,x表示卤素离子或者有机羰氧基离子(有机羧酸离子))。所述三乙氧基硅烷基化合物与所述本发明的抗菌剂组成物中的三乙氧基硅烷基化合物相同,关于制造方法也与所述本发明的抗菌剂组成物中的含硅化合物相同。即,若利用如上所述的反应,则在制造所述含硅化合物时,也完全不使用如甲醇这种毒性高的溶剂,因此可获得安全性更高的抗病毒剂组成物。
另外,本发明的抗病毒剂组成物中的所述含硅化合物的含量只要是可发挥抗病毒作用及其持续性的量,则并无特别限定,通常为0.6ppm以上,优选为20ppm以上,更优选为0.006wt%~24wt%,最优选为0.06wt%~6wt%,为了充分发挥抗病毒作用及其持续性,优选为在该范围内。
本发明的抗病毒剂组成物中可还包含乙醇。所述乙醇浓度并无特别限定,从以抗病毒作用为主要目标的观点而言,优选为50vol%~85vol%。另外,从将所述抗病毒剂组成物固定在物品上的观点而言,乙醇浓度优选为35vol%~85vol%。所述抗病毒剂组成物中可还包含水。即,所述抗病毒剂组成物中可含有水、乙醇、或者乙醇水溶液(水和/或乙醇)中的任一种作为溶剂。这些溶剂均与甲醇相比,毒性极低,可大幅度提高所得抗病毒剂组成物的安全性,因此可获得兼具高度的安全性及优异的抗病毒作用的药剂。如此一来,仅通过含有所述含硅化合物、及视需要的水和/或乙醇,就可以简便且有效地使病原体病毒失活,可防止病原体病毒的感染扩大,提升卫生环境。
可由所述抗病毒剂组成物而失活的病毒可列举:a型流感病毒(人、禽、猪(新型))、b型流感病毒、副流感病毒、(a~e型)肝炎病毒、麻疹病毒(measlesvirus)、疱疹病毒(herpesvirus)、腮腺炎病毒(mumpsvirus)、狂犬病病毒、流感病毒等具有包膜(envelope)的病毒、诺如病毒、人类免疫缺陷病毒(humanimmunodeficiencyvirus,hiv)等。这些病毒中,优选为流感病毒、诺如病毒,尤其从对于a型流感病毒(猪(新型))(新型(猪)流感病毒(h1n1型))也发挥优异的失活能力的方面而言,表现出高利用价值。
进而,所述抗病毒剂组成物中,根据用途可还包含至少一种两性离子表面活性剂,或者可包含至少一种阳离子表面活性剂,也可以包含这些两性离子表面活性剂及阳离子表面活性剂两者。其中,优选为包含所述两性离子表面活性剂。通过含有这些表面活性剂,变得更容易使所述含硅化合物在药剂中稳定化,防止溶液的白浊、凝胶化。此外,可使用的所述两性离子表面活性剂及阳离子表面活性剂的种类、以及其含量与所述本发明的抗菌剂组成物相同。
利用本发明的抗病毒剂组成物的病毒失活,具体而言可通过以下操作来进行:将存在附着病毒的顾虑的物品浸渍于所述抗病毒剂组成物中,或对该物品涂布或者喷雾所述抗病毒剂组成物,或者利用渗入了所述抗病毒剂组成物的布等来擦净该物品的表面;只要是该物品与所述抗病毒剂组成物可接触规定时间的方法,则并无特别限制。另外,进行这些处理的时间也只要是利用所述抗病毒剂组成物来使附着于物品上的病毒充分失活的时间即可,可适当选择。
本发明的抗菌剂固定化方法在于:使用表面具有含氧官能基的物品,对该物品的表面涂布或者喷雾所述抗菌剂组成物,或者将该物品浸渍于所述抗病毒剂组成物中;同样地,本发明的抗病毒剂固定化方法在于:使用表面具有含氧官能基的物品,对该物品的表面涂布或者喷雾所述抗病毒剂组成物,或者将该物品浸渍于所述抗菌剂组成物中。即,这些抗菌剂固定化方法及抗病毒剂固定化方法均为使用表面具有-oh基或-o-基等含氧官能基的物品,对其表面涂布或者喷雾所述抗菌剂组成物或者抗病毒剂组成物的方法,或者将该物品浸渍于所述抗菌剂组成物或者抗病毒剂组成物中的方法。如上所述,所述抗菌剂组成物或者抗病毒剂组成物由于含有通式(1)所表示的具有乙氧基的含硅化合物,因此所述乙氧基不仅与被处理物品表面的含氧官能基反应而释放出乙醇,并且经由氧而共价键合。由此,在被处理物品表面牢固地固定含硅化合物中的抗菌或者抗病毒活性部位,对被处理物品表面赋予较强的抗菌性能或者抗病毒性能及优异的持续性。
所述被处理物品只要是表面具有-oh基或-o-基等含氧官能基的物品即可,并无特别限定,可从如牙科材料这样的微细物品包含至毛巾等纤维制品及衣服等物品等,甚至大型物品。另外,由于将所述含氧官能基赋予给物品表面,因此可在涂布所述抗菌剂组成物或者抗病毒剂组成物之前,预先对被处理物品的表面实施赋予含氧官能基的表面处理。所述表面处理优选为例如臭氧水处理,更具体而言可列举:浸渍于臭氧水中的处理、喷雾臭氧水的处理、或者涂布臭氧水的处理。所述臭氧水处理具体而言是使用臭氧水的浸渍、喷雾、涂布之类的简易处理,因此对于从例如微细物品至大型物品为止所有的物品而言,也可以灵活对应而容易作为处理对象,并且也容易组入至生产线中,可在物品的表面更牢固地固定抗菌剂组成物或者抗病毒剂组成物。
所述利用臭氧水的处理并无特别限制,例如可使用适当调整浓度的臭氧水,根据所述臭氧水的浓度来适当变更处理时间而进行处理。具体而言,例如于臭氧的浓度为0.4ppm~0.6ppm的情况,只要进行约5分钟左右的浸渍处理即可,于通常的数ppm浓度的臭氧水的情况,只要仅仅喷雾而进行自然干燥处理,就可以对物品赋予更充分的抗菌性能或者抗病毒性能及其持续性。
实例
以下,具体地列出本发明的实例,但本发明并不限定于实例的内容。此外,实例中的简称如下所述。
etac:十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵
si-qac:十八烷基二甲基(3-三甲氧基硅烷基丙基)氯化铵
cpb:溴化鲸蜡基吡啶鎓
aromox(注册商标):月桂基二甲基氧化胺(狮王(lion)公司制造)
lad:月桂酰胺丙基二甲基氧化胺(川研精化(kawakenfinechemicals)公司制造)
hd:十六烷基三甲基氯化铵
cpc:氯化鲸蜡基吡啶鎓
po:聚氧乙烯山梨糖醇酐单月桂酸酯
cde:椰子脂肪酸二乙醇酰胺
消毒用乙醇(日本药典70%消毒用醇)
[合成例1(二甲基十八烷基[3-(三乙氧基硅烷基)丙基]氯化铵乙醇溶液的合成)]
向经氮气冲洗的加压反应器中,加入三乙氧基硅烷基丙基氯化物(东京化成工业股份有限公司)41.5g(0.17mol)、n,n-二甲基十八烷基胺(东京化成工业股份有限公司)44.6g(0.150mol)、乙醇40.5g,加热至135℃。反应20小时而获得二甲基十八烷基[3-(三乙氧基硅烷基)丙基]氯化铵(etac)乙醇溶液121.4g。
含量为63.8%,纯度为77.5g,产率为95.9%。
此外,二甲基十八烷基[3-(三乙氧基硅烷基)丙基]氯化铵的鉴定是利用质谱法(massspectrometry,ms)来进行。以下列出测定条件及波谱数据。
1)测定条件:
质量范围:22.0458~711.451m/z
离子化法:快速原子轰击(fastatombombardment,fab)
模式:正
2)波谱数据:m/z=530
[安全性试验例1~安全性试验例3]
为了确认包含本发明的十八烷基二甲基(3-三乙氧基硅烷基丙基)氯化铵的组成物的安全性,而进行致突变性试验、使用雌鼠的急性经口毒性试验、及使用兔子的皮肤一次刺激性试验。
《试验例1:致突变性试验》
使用合成例1中所得的60wt%etac乙醇溶液(淡黄色透明液体)作为样品,为了调查所述样品的致突变性,依据劳动省告示第77号(1988年9月1日),使用大肠杆菌(escherichiacoli)wp2uvra及鼠伤寒沙门氏菌(salmonellatyphimurium)ta系4菌株(ta100、ta1535、ta98及ta1537),来进行回复突变试验。试验时,在分注有15ml营养肉汤培养基[oxoid,nutrientbrothno.2]的附隔板的三角烧瓶中,接种所解冻的菌分注冷冻保存液,在37℃下旋转培养10小时,将所得的溶液作为检定菌液。称取样品,添加注射用水,来制备试验原液,使用注射用水将试验原液加以适当稀释来制备试验液。阳性对照物质是使用2-(2-呋喃基)-3-(5-硝基-2-呋喃基)丙烯酰胺、叠氮化钠、9-氨基吖啶-盐酸盐、2-氨基蒽。将注射用水作为阴性对照,以0.610μg/板~1250μg/板的用量来进行试验。
其结果为,无菌试验中,未确认到试验原液及s9mix均成为阴性对照值的2倍以上的回复突变菌落数增加,未观察到菌的发育。另一方面,作为阳性对照来使用的2-(2-呋喃基)-3-(5-硝基-2-呋喃基)丙烯酰胺、叠氮化钠及9-氨基吖啶-盐酸盐中,与阴性对照相比较确认到显着的回复突变菌落数增加。另外,2-氨基蒽是于s9mix存在下引发显着的回复突变。根据以上情况,判断试验例1条件下的样品的致突变性为阴性。
《试验例2:使用雌鼠的急性经口毒性试验》
将合成例1中所得的60wt%etac乙醇溶液以注射溶液加以稀释,来调制400mg/ml、300mg/ml、200mg/ml及100mg/ml的试验液。将该溶液以8000mg/kg、6000mg/kg、4000mg/kg及2000mg/kg的体积对鼠单次经口投予,关于对照群,是将注射溶液水对雌鼠单次经口投予,观察14天。
其结果为,8000mg/kg、6000mg/kg、4000mg/kg投予群所有例以及2000mg/kg的2例中从投予后5分钟起看到主动运动的降低,但至投予后4小时为止恢复原样,然后未确认到异常(在所有条件下,死亡例均为0)。以上情况表明,样品鼠的通过单次经口投予的半数致死量(ld50)值为8000mg/kg以上。
《试验例3:使用兔子的皮肤一次刺激性试验》
将合成例1中所得的etac乙醇溶液以消毒用乙醇(80%乙醇)加以稀释,调制3wt%etac的80%乙醇溶液,将其对100%棉的毛巾喷雾后,于室温下放置3分钟,在流水下水洗、干燥而制作etac处理毛巾。将所述处理毛巾作为样品,依据经济合作与发展组织(organizationforeconomiccooperationanddevelopment,oecd)化学品测试导则(guidelinesforthetestingofchemicals)404(2002),使用兔子进行皮肤一次刺激性试验。将裁剪为约2cm×3cm的样品以约0.5ml的注射用水来润湿,对3只兔子的无伤及有伤皮肤各1处分别应用24小时。
其结果为,于去除后1小时在1例的有伤皮肤上看到非常轻度的红斑(点数1),但24小时后消失,然后未看到刺激反应。于其余的应用部位,通过观察期间而未看到刺激反应。依据联邦公报(federalregister)(1972)而求出的一次刺激性指数(p.i.i.)成为0.1,使用兔子的皮肤一次刺激性试验中,样品被评价为纳入“无刺激性”的范畴。
[实例1(3wt%etac水溶液中的稳定性试验)]
将所述合成例1中所得的60wt%etac乙醇溶液、水及各种表面活性剂加以混合,来比较稳定性。所使用的表面活性剂是使用cpb、aromox及lad作为两性离子表面活性剂,hd及cpc作为阳离子表面活性剂,po及cde作为非离子表面活性剂。etac的最终浓度是调整为3wt%。各表面活性剂的最终浓度是调整为:非离子表面活性剂与两性离子表面活性剂为1wt%,阳离子表面活性剂为0.1wt%。对所得的溶液确认5天~2周后有无沉淀。将结果示于表1~表2。
[表1]
[表2]
使用两性离子表面活性剂或者两性离子表面活性剂+阳离子表面活性剂的溶液即便经过2周以上也未产生沉淀,较为稳定(表1,项1~项4)。
另外,为了进行比较,对无表面活性剂、非离子表面活性剂、阳离子表面活性剂也进行同样的试验,但分别在经过5天~2周时产生沉淀(表1,项5~项7)。
[实例2(3wt%etac消毒用乙醇溶液中的稳定性试验)]
将所述合成例1中所得的60wt%etac乙醇溶液与阳离子表面活性剂混合,以消毒用乙醇稀释20倍,将etac的最终浓度调整为3wt%,且将表面活性剂的最终浓度调整为1wt%。使用hd及cpc作为阳离子表面活性剂。对所得的溶液确认沉淀的有无。将结果示于表3。
[表3]
关于添加了hd及cpc的溶液,未产生沉淀,较为稳定(表3,项2及项3)。
另外,为了进行比较,对于无表面活性剂的情况也进行同样的试验,但在混合后数小时内产生沉淀(表3,项1)。
[实例3(etac与si-qac的抗菌性比较试验1)]
将60wt%si-qac甲醇溶液或者所述合成例1中所得的60wt%etac乙醇溶液与表面活性剂加以混合,以水或者消毒用乙醇稀释20倍,将etac或者si-qac及表面活性剂的最终浓度分别调整为下述浓度。
3%siqac+1%po、3%etac+1%lad、3%etac+1%lad+0.1%cpc的水溶液3样品。
3%etac+0.1%hd、3%etac+0.1%cpc的消毒用乙醇溶液2样品。
将血球计数器用盖玻片在mq水(对照组)与所得的溶液5样品中浸渍30分钟后,取出并放置1小时后进行水洗,去除剩余的溶液。接着,接种50μl的106cfu/ml的白色念珠菌(candidaalbicans)gdh18的菌悬浮液,于室温下放置2小时后,添加沙氏培养基(sabouraud′smedium)3ml,于37℃下培养22小时。
推算菌数时是使用吸亮度(波长:600nm,测定机器:生物亮度计(biophotometer))。吸亮度0.3相当于107cfu/ml。
将结果示于图1。如图1所示,在利用3%etac+1%lad(ladetac)、3%etac+1%lad+0.1%cpc(lad+cpcetac)、3%etac+0.1%hd的消毒用乙醇溶液(hdetac乙醇)、3%etac+0.1%cpc的消毒用乙醇溶液(cpcetac乙醇)进行处理的玻璃表面,完全未确认到发育,与此相对,si-qac(posi-qac)看到约2.6×107cfu/ml的增殖菌,暗示出,即便与以前的作为甲氧基体的含硅化合物相比,也获得非常高的抗菌性。
[实例4(etac与si-qac的抗菌性比较试验2)]
将60wt%si-qac甲醇溶液或者所述合成例1中所得的60wt%etac乙醇溶液、表面活性剂及水加以混合,将etac或者si-qac及表面活性剂的最终浓度分别调整为下述浓度。
3%siqac+1%po、3%siqac+1%po+hd、3%siqac+1%lad、3%etac+1%lad、3%etac+1%lad+0.1%cpc的各水溶液。
将血球计数器用盖玻片在所得溶液中浸渍45分钟后,取出并进行水洗,去除剩余的溶液,在放置1小时后、干燥后用于实验。接着,接种50μl的106cfu/ml的白念珠菌gdh18的菌悬浮液,于室温下放置2小时后,添加沙氏培养基3ml,于37℃下培养24小时、48小时、90小时。
为了简易地推算菌数,使用念珠菌黄色培养基。于在培养基中未发育的情况为红色的状态,颜色未变化(记作○),增殖菌为5×106cfu/ml时变化为橙色(记作δ),在1×108cfu/ml下变化为黄色(记作×)。
将结果示于表4。在以各条件处理的所有玻璃中,24小时内培养基呈现红色(记作○),认为通过任一溶液中的抗菌处理,均可在接种后24小时抑制发育。48小时后,仅是使用etac的3%etac+1%lad、3%etac+1%lad+0.1%cpc的各溶液看到抑制(记作○)。进而,在90小时后,仅在以3%etac+1%lad+0.1%cpc进行处理的玻璃上看到抑制(记作○)。
[表4]
[实例5(3wt%etac水溶液中的抗菌性试验1)]
将所述合成例1中所得的60wt%etac乙醇溶液、两性离子表面活性剂及水加以混合,将etac及表面活性剂的最终浓度调整为:etac为3%,两性离子表面活性剂为1%。
两性离子表面活性剂是使用cpb及aromox、lad。
向玻璃瓶中加入所得的水溶液,浸渍20分钟后,取出并进行水洗,去除剩余的溶液,在放置3小时后、干燥后用于实验。接着,接种50μl的106cfu/ml的白念珠菌gdh18的菌悬浮液,于室温下放置12小时后,添加沙氏培养基3ml,于37℃下培养24小时、100小时。
为了简易地推算菌数,使用念珠菌黄色培养基。于在培养基中未发育的情况为红色的状态,颜色未变化(记作○),增殖菌为5×106cfu/ml时变化为橙色(记作δ),在1×108cfu/ml下变化为黄色(记作×)。
将结果示于表5。在以各条件处理的所有玻璃中,24小时内培养基呈现出红色(记作○),认为即便通过任一溶液的抗菌处理,均可在接种后24小时抑制发育。
100小时后,如表5所示,使用etac且添加了aromox或lad的情况均看到抑制(记作○)。
[表5]
[实例6(3wt%etac水溶液中的抗菌性试验2)]
将所述合成例1中所得的60wt%etac乙醇溶液、水及各种表面活性剂加以混合,来比较稳定性。所使用的表面活性剂是使用cpb、aromox及lad作为两性离子表面活性剂,po作为非离子表面活性剂。etac的最终浓度是调整为3wt%,各表面活性剂的最终浓度是调整为1wt%。
向玻璃瓶中加入所得的水溶液,浸渍20分钟后,取出并进行水洗,去除剩余的溶液,在放置3小时后、干燥后用于实验。接着,接种50μl(菌数:约1万个)的106cfu/ml的白念珠菌gdh18的菌悬浮液,于37℃下培养18小时。
为了简易地推算菌数,使用念珠菌黄色培养基。将结果示于图2。图2的纵轴是表示在培养18小时后检测出的菌数(对数值)。即,于纵轴的值为8的情况,显示菌数为1亿个,于纵轴的值为6的情况,显示菌数为100万个。于使用任一种表面活性剂的情况,均显示接种菌数低于4(1万个)的值,特别是在使用aromox的情况,可发挥出对数值为2、即100个左右非常高的抗菌性。其特别暗示出etac与aromox生成中间体,由此反应性提高的可能性,因此利用傅立叶变换红外光谱法(fouriertransforminfraredspectroscopy,ft-ir)来分析所述溶液中的产物,结果确认到中间体的生成。
[实例7(羟磷石灰的抗菌化试验)]
将所述合成例1中所得的60wt%etac乙醇溶液、aromox及水加以混合,将最终浓度调整为3%etac、1%aromox。
将1英寸见方(厚度2mm)的烧结羟磷石灰(pentaxapp-100)在所得的水溶液中浸渍5分钟、10分钟、20分钟、30分钟后,取出并进行水洗,去除剩余的溶液,在放置1小时后、干燥后用于实验。
接着,接种20μl的106cfu/ml的白念珠菌gdh18的菌悬浮液,于室温下放置4小时后,添加沙氏培养基2ml,于37℃下培养24小时、32小时、44小时。
为了简易地推算菌数,使用念珠菌黄色培养基。于在培养基中未发育的情况为红色的状态,颜色未变化(记作○),增殖菌为5×106cfu/ml时变化为橙色(记作δ),在1×108cfu/ml下变化为黄色(记作×)。
将结果示于表6。在以各条件处理的所有羟磷石灰中,24小时内培养基呈现出红色(记作○),认为即便通过任一溶液的抗菌处理,均可在接种后24小时抑制发育。未处理的羟磷石灰(对照组)中,增殖至约5×106cfu/ml(记作δ)。
在以各条件处理的所有羟磷石灰中,32小时后培养基呈现出红色(记作○),认为即便通过任一溶液的抗菌处理,均可在接种后32小时抑制发育。未处理的羟磷石灰(对照组)中,呈现出黄色(记作×),增殖至约1×108cfu/ml左右。
44小时后,经5分钟浸渍处理的羟磷石灰确认到菌的增殖(记作δ),经10分钟、20分钟、30分钟浸渍处理的羟磷石灰未确认到发育(记作○)。
[表6]
[实例8(病毒失活试验)]
关于本发明的清洗剂组成物及消毒、清洗、漱口、除菌及抗菌化用组成物是否具有使病毒失活的能力来进行试验。病毒是使用流感病毒、猫嵌杯样病毒(felinecalicivirus)(已知与人的诺如病毒为同属,在作为猫肾细胞的crfk细胞中增殖,可作为人的诺如病毒的代替实验系来使用)。病毒力价的测定是使用50%组织培养感染剂量(50%tissuecultureinfectiousdose,tcid50)法来进行。
准备3wt%etac的80%乙醇溶液作为试验溶液。使用10cm2细胞培养用培养皿,于流感病毒的情况,将犬肾细胞培养至70%~100%融合,于猫嵌杯样病毒的情况,将crfk细胞培养至70%~100%融合。接着,将100tcid50的流感病毒或者猫嵌杯样病毒的溶液100μl及试验溶液100μl,添加于0.8ml的5%胎牛血清-达尔伯克氏改良伊格尔培养基(fetalcalfserum-dulbecco′smodifiedeagle′smedium,fcs-dmem)中,使其接触1小时(病毒经稀释10倍,成为10tcid50)。然后,将100μl含病毒的5%fcs-dmem接种于细胞培养液(5%fcs-dmem)0.9ml中,进行培养(病毒经进一步稀释10倍,成为1tcid50)。在4~5天后与7~8天后向各孔中分别平稳地添加50μl添加有10%fcs的dmem。在11~13天后利用显微镜来判定细胞变性的终点。对于各试验溶液以及使用蒸馏水来代替试验溶液的未处理对照组,利用里-明二氏(reed-muench)法来算出50%组织感染率(tcid50)。其结果为,于对照组(未处理)的情况为0.8~1.2tcid50,确认到对所使用的培养细胞的病毒感染,于利用含有etac的溶液来处理的情况,未确认到由任一种病毒引起的感染,认为接种时病毒失活。
[实例9(对于流感病毒的病毒感染性失活能力试验)]
使用禽类无症状(弱毒株)的正粘病毒(orthomyxovirus)科流感病毒a属a/swan/shimane/499/83(h5n3)及新型(猪)流感病毒(h1n1型)作为流感病毒,以蔗糖密度梯度离心来纯化,制成对pbs进行透析的病毒液来使用。进而,使用犬肾细胞的细胞系即mdck(+)细胞。
将所述病毒液与合成例1中所得的etac乙醇溶液以1∶9的比(10μl+90μl)加以混合,于室温下反应3分钟。由处理后的病毒液,以dmem来制备10倍阶段稀释列(包含0.6%etac、0.2%etac、0.06%etac、0.02%etac、0.006%etac、0.002%etac、0.0006%etac、0.0002%etac、6×10-5%etac、0%etac),接种于96孔板的单层培养细胞中(50μl/well),进行1小时病毒吸附。然后,将病毒接种液抽吸去除,添加dmem、20μg/ml胰蛋白酶(100μl/well)。5天后,在cpe扩散处固定、染色,使用behrens-kaerber法来算出50%感染量(单位:50%tissuecultureinfectiousdose[tcid50]),测定病毒感染价。
将结果示于图3~图4。如图3所示,可知于将etac乙醇溶剂的溶液以dmem加以稀释的情况,即便稀释至残存感染价0.002%(20ppm)也有效。此外,所述病毒为禽类流感弱毒株,所述病毒液是以蔗糖密度梯度离心来纯化,是对pbs进行透析而成的,认为杂质的混入少。另外,与禽类流感病毒中所得的结果同样地,对新型流感病毒(h1n1型)也确认到非常高的效果(参照图4)。这些结果被设想与具有相同物理性状的a型流感病毒即人型(h1n1、h3n2)也共通。
[实例10(etac处理毛巾及etac处理玻璃小瓶的抗流感病毒作用试验)]
病毒(病毒液)及细胞是使用与实例9相同的病毒(病毒液)及细胞。
将合成例1中所得的etac乙醇溶液以消毒用乙醇(80%乙醇)加以稀释,调制3wt%etac、0.3wt%etac、0.06wt%etac的80%乙醇溶液,将其喷雾至100%棉的毛巾上后,于室温下放置3分钟,于流水下进行水洗、干燥来制作etac处理毛巾。
接着,称取所得的毛巾17mg左右,加入至24孔板的孔中,滴加病毒液50μl,使其渗入。于室温下培养30分钟后,添加300μl的dmem(dulbecco′smodifiedeagle′smem),一边移液一边回收病毒。
接着,将所述80wt%etac/乙醇溶液调整为0.3%、0.15%、0.1%、0.75%、0.06%、0.03%、0.01%的浓度,将小瓶内面在室温下处理10分钟,以乙醇清洗4次后,加以干燥来制作etac处理玻璃小瓶。
接着,向所得的小瓶中加入病毒液(50μl或者病毒液50μl+dmem250μl),一边以振荡器来振荡,一边培养30分钟。
由处理后的病毒液,与实例9同样地以dmem来制备10倍阶段稀释列,接种于96孔板的单层培养细胞中(50μl/well),进行1小时病毒吸附。
然后,将病毒接种液抽吸去除,添加dmem、20μg/ml胰蛋白酶(100μl/well)。5天后,在cpe扩散处固定、染色,使用behrens-kaerber法来算出50%感染量(单位:50%tissuecultureinfectiousdose[tcid50]),测定病毒感染价。
将结果示于图5。如图5所示,etac处理毛巾及etac处理玻璃小瓶均于以0.06%etac(80%乙醇溶剂)以上的浓度进行处理的情况,确认到具有非常高的失活能力。
- 还没有人留言评论。精彩留言会获得点赞!