一种利用茉莉酸甲酯进行杂交鹅掌楸体胚发生的方法与流程
本发明属于组培苗
技术领域:
,具体涉及一种利用茉莉酸甲酯(meja)进行杂交鹅掌楸体胚发生的方法。
背景技术:
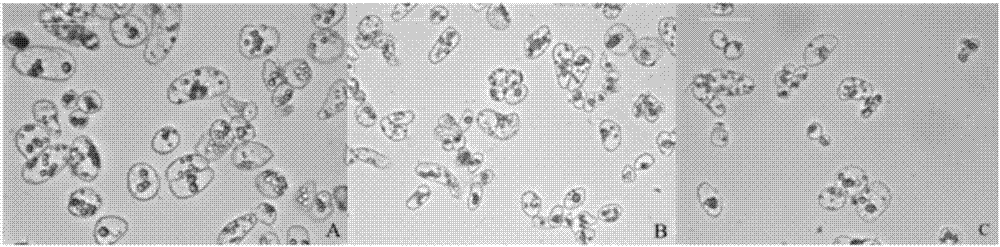
:近年来,人们不断地加大对植物体细胞胚胎发生的研究,使其在几十年内得到了快速的发展,并取得很大的成果。由于体细胞诱导产生的体胚具备发生数量多、生长速度快、结构完整、繁殖效率高等特点,使体胚发生技术成为植物快速繁殖的有效手段,有利于保存优良的林木品种、缩短优良品种培育时间、加快产业化的发展等,在林业的发展中具有重要意义。植物体细胞胚胎发生是细胞工程中植株再生的有效途径,它可以在一些植物尤其是木本植物生长繁殖周期较长,或者有的植物种子难以萌发中发挥巨大作用。体胚发生主要分为诱导胚性愈伤组织的形成和体胚的形态建成。第一阶段选择外植体,选取未成熟胚、根、茎、叶、花器官等组织诱导形成胚性愈伤组织;第二阶段诱导胚性愈伤组织分化形成体细胞胚。胚性细胞经过一系列的发育形成球形胚,最终形成子叶胚,子叶胚再经进一步培养形成完整的植株。植物直接的体细胞胚胎发生是在外植体包括器官、组织、细胞等直接发育分化成体细胞胚。而间接体胚发生是外植体形成愈伤愈伤组织后进一步发育成体细胞胚,或者形成胚性愈伤组织后经过悬浮培养后形成体细胞胚。林木体细胞胚胎研究起源于20世纪70年代rao等对檀香的体细胞胚胎发生的研究。尽管大部分木本植物的体胚发生存在一定难度,但几十年的努力,木本植物通过体胚发生形成再生植株已经达到二百种以上,还有一些用材树种的体胚发生的研究也取得新进展。马尾松、火炬松等部分裸子植物的体细胞胚胎发生体系已经较成熟,能够组织培养技术实现植株再生。陈金慧等首次成功建立杂交鹅掌楸体细胞胚胎发生体系,并进一步诱导出体胚苗,加快杂交鹅掌楸的产业化发展。体胚发生时,外界因素诱导内部发生变化或内部自身因素使调控基因表达,从而完成植物体胚的发生。其主要的影响因素有:外植体选择、基因型、培养基的选择、环境条件、生长调节物质等。其中植物激素在体胚发生中起到不可替代的作用。1)基因型与外植体的选择只要是活的植物组织或器官都可作为组织培养的材料。体胚发生会因外植体的状态、类型、基因型等因素的不同而存在很大差异。在进行组织培养过程中,选择的外植体器官分化程度低并且生理状态较好,可以大大提升体胚发生诱导率。因此在进行组织诱导时,通常选择生理状态好、品质优良的材料,可以加大植物体胚诱导的成功率。由于植物基因型的不同,使得体细胞胚诱导时在激素的使用、培养条件等方面都存在差异。不同基因型的体细胞胚诱导效率存在较大差异,有可能是因为不同基因型的最佳培养条件不同。黄璐等诱导胚性愈伤组织和体胚发生时,发现不同基因型的体胚诱导率存在差异。2)培养基的选择通常培养基主要由碳水化合物、氮源、无机盐、维生素等成分组成,每个组成部分都起到重要作用。其中氮源对体细胞胚胎发生有较大的影响。崔凯荣等在培养基中加不同比例的硝态氮及氨态氮诱导枸杞体胚发生时,发现当培养基中只加氨态氮不加硝态氮时,枸杞体细胞胚胎发生诱导率最高。3)环境条件通常暗培养环境下有利于木本植物胚性愈伤组织的诱导,待体胚进行成熟培养时则需要光照,光照也有利于降低畸形率。虽然黑暗与光照条件下都可以诱导胚性愈伤组织,但在光照条件下诱导产生的胚性愈伤组织可能会褐化或者体胚再生频率不高。陈金慧等在研究杂交鹅掌楸体细胞胚胎发生时,发现暗环境有利于胚性愈伤组织生长和体胚发生,体胚发生后及时移至光照条件下培养,有利于体胚发育和植株再生。温度也是影响体胚发生的重要因素。高温或低温都有可能影响胚性愈伤组织的体胚发生能力。陈小鹏在黄瓜的体胚发生研究中发现高温会导致体胚数量减少,降低体胚诱导率。张宇等在研究水曲柳的体胚发生中,发现低温处理后能够促进体胚同步化。4)外源激素在体胚发生中的作用植物激素在一定浓度下能够调控植物生理反应,在生长发育、成熟衰老等方面发挥最重要作用。在植物体胚发生过程中植物激素的选择是至关重要的。植物体胚发生所需要的植物激素及含量是不同的,即使同种植物在诱导体胚发生中的不同阶段所需植物激素也是不同的。从大多数的报道看,生长素是体细胞胚分裂所必需的,可促使内源生长素的增加,进而促进细胞分裂和内源激素平衡,最终促使细胞进入胚胎状态。对大多数植物来说,除了生长素,体胚发生还需要细胞分裂素。6-ba(细胞分裂素)有利于愈伤组织的形成。kt则有助于改善愈伤组织的质量。近年有研究发现tdz活性更高,已经诱导出体胚,如花生的体胚诱导。许多研究都证实aba在许多植物体胚的不同阶段都一定的促进作用。对一些植物的aba突变体进行研究,发现在植物体胚成熟阶段aba发挥重要功能,有利于体细胞胚胎后期的发育。许多植物的体胚诱导过程中aba都能够刺激体细胞胚成熟,能够有效提高体胚发生率。由于树种特性的不同,一些植物在体细胞胚胎发生中添加外源aba不利于体胚发生或者抑制体胚发生,如火炬松、白云松等。近年来茉莉酸类(ja)被越来越多的研究者关注,作为一种新型的生长调节剂,除了起到防御作用外,还能调控植物的生长发育。当ja浓度高时,对植物生长具有较强的抑制作用,包括叶片、下胚轴、根部的生长,还有抑制叶绿素的合成、卷须的形成等。但ja类物质浓度较低时,能够促进下胚轴及根部的生长。除此之外,ja还能加快果实的成熟、调节气孔的运动、使呼吸作用增强、还能促进马铃薯块茎形成等形态建成。在植物受到胁迫时,包括外界刺激(高温、低温、干旱等)以及生物胁迫(病虫害),此时ja响应机制开始发挥防御功能。当外施一定浓度的ja同样能够启动ja的防御机制。当植物受到病虫害等胁迫反应时,体内ja含量有所增加,它能在植物体内运输,又具有很强的挥发性,传递信号给未受伤部位,从而启动防御系统。技术实现要素:发明目的:针对现有技术中存在的不足,本发明的目的是提供一种利用茉莉酸甲酯进行杂交鹅掌楸体胚发生的方法,提高体胚诱导率、降低畸形率。技术方案:为了实现上述发明目的,本发明采用的技术方案为:一种利用茉莉酸甲酯进行杂交鹅掌楸体胚发生的方法,包括种子灭菌、胚性愈伤组织的诱导、胚性悬浮细胞系的建立、液体单细胞的获得及过渡、诱导杂交鹅掌楸体胚的发生步骤,其中,在诱导杂交鹅掌楸体胚的发生时,在培养基中添加茉莉酸甲酯和aba,或单独添加茉莉酸甲酯。所述的茉莉酸甲酯的用量为0.5×10-6~100×10-6mol/l,aba的用量为2mg/l。所述的培养基位液体培养基或固体培养基。所述的杂交鹅掌楸的基因型为c138、233012、253010。所述的杂交鹅掌楸的基因型为c138,在培养基中添加2mg/laba和1×10-6mol/lmeja。所述的杂交鹅掌楸的基因型为233012,在培养基中添加2mg/laba和1×10-6mol/lmeja。所述的杂交鹅掌楸的基因型为253010,在培养基中添加2mg/laba和1×10-6mol/l或5×10-6mol/lmeja。所述的茉莉酸甲酯的用量为12.5×10-6mol/lmeja。有益效果:与现有技术相比,本发明的利用茉莉酸甲酯进行杂交鹅掌楸体快繁的方法,在杂交鹅掌楸体细胞胚胎发生过程中,加入植物生长调节剂meja有助于提高培养细胞内源aba水平,有效提高体胚诱导率、降低畸形率、提高体胚成熟率,进一步的提高杂交鹅掌楸体胚发生效率,具有很好的实用性,利于杂交鹅掌楸快繁体系的建立。附图说明图1是未成熟胚诱导的愈伤组织图;图中,a为白色组织为非胚性愈伤组织,b、c为胚性愈伤愈伤组织;图2是不同基因型杂交鹅掌楸过筛后的单细胞状态图;图中,a、b、c分别为基因型c138、233012、253010;图3是不同meja浓度下c138培养30d的体胚发生统计结果图;图4是不同meja浓度下c138的植株再生情况图;图中,a、b、c、d、e、f为1、2、4、10、7、12号培养基;图5是不同meja浓度下233012培养30天的体胚发生统计结果图;图6是不同meja浓度下233012的植株再生情况图;图中,a为1号培养基、b为2号培养基、c为4号培养基、d为9号培养基;图7是不同meja浓度下253010培养30天的体胚发生统计结果图;图8是不同基因型的杂交鹅掌楸体胚诱导情况结果图;图9是不同meja浓度对杂交鹅掌楸体胚苗根长的影响结果图;图10是不同浓度meja下c138体胚的发生图;图中,1-12为1-12号培养基;图11是不同浓度meja下233012体胚的发生图;图中1-12为1-12号培养基;图12是不同meja浓度处理下253010的体胚发生图;图中,1-12为1-12号培养基;图13是不同meja浓度下253010的体胚发生结果图;图中,a、c、e、g为光照前体胚状态,b、d、f、h为光照后体胚状态;a、b为1号培养基,c、d为2号培养基,e、f为6号培养基,g、h为11号培养基。具体实施方式下面结合具体实施例,对本发明做进一步的说明。以下实施例中使用的供试材料选用本申请人的课题组于2012年及2013年的杂交鹅掌楸优良性状组合的未成熟胚及未成熟胚诱导成的愈伤组织材料。选用杂交鹅掌楸的基因型为c138、233012、253010。本申请人选用中国马褂木和北美鹅掌楸于花期(四五月份)进行的人工杂交控制授粉,获得杂交幼胚。在南京地区授粉后约8周,进行采样。将采集的聚合翅果进行低温(4℃)冷藏。茉莉酸甲酯母液的配置:茉莉酸甲酯(sigma公司,液体状,纯度>95%)。用无水乙醇助溶,加水定容(使助剂溶液浓度为20%)配制成10μmol/ml的母液。采用水系、孔径0.22μm的滤膜灭菌(若只用无水乙醇作溶剂,需要采用有机系滤膜除菌)。体胚发生率(%)=体胚发生总数/观察细胞数(团)×100%;体胚成熟率(%)=成熟胚总数/观察细胞数(团)×100%;畸形胚发生率(%)=畸形胚总数/观察细胞数(团)×100%;再生植株率(%)=再生植株总数/体胚发生总数×100%。实施例1未成熟胚的胚性愈伤组织的诱导1、种子灭菌灭菌前应先剖开聚合翅果将种翅去除,先将种子用水冲洗30min。然后在超净工作台中进行灭菌处理,将种子置于无菌三角瓶中加入75%乙醇,灭菌30s,倒出75%乙醇并加入0.1%的氯化汞,灭菌8~10min,倒去氯化汞溶液,在用无菌水洗涤3~4次,处理结束封口放入4℃条件下保存,进行下一步处理。2、胚性愈伤组织的诱导在无菌环境下将种皮去除,将未成熟胚及胚乳放置添加有2,4-d、ba等激素的3/4ms培养基中进行愈伤诱导培养,培养条件为23℃,暗培养,继代周期为25~30d。起初种子长出白色透明非胚性愈伤组织。继代时将白色透明非胚性愈伤组织去除,剩余部分继续培养。经过一段时间继代培养,开始长出黄色细颗粒状、质地结实的组织。继续培养,直至达到稳定状态。待其长出胚性愈伤组织并状态良好时,将培养基中2,4-d的浓度应由原来的2.0mg/l降为1.0mg/l,将琼脂粉改为水晶洋菜(2.3g/l)。如图1所示,在培养初期,愈伤组织大多偏白,含水量多,这部分为非胚性愈伤组织。继代时将其去除,之后长出的组织状态呈黄色细颗粒状、水分含量较少,组织较致密。3、胚性悬浮细胞系的建立液体培养基与胚性愈伤组织培养基一致,不加水晶洋菜。选取状态较好的胚性愈伤组织,按照1:9的比例进行悬浮培养,即胚性愈伤组织5g,液体培养基45ml,在摇床中进行悬浮培养。悬浮培养条件为23℃、转速95r/min下进行暗培养。继代周期为7d。通常情况下继代2~3次为宜。4、液体单细胞的获得及过渡液体继代2~3次后,获得稳定性及均匀性较好的液体悬浮系。之后采取的是物理筛选的方法,利用特定目数的细胞筛获得单细胞,根据此次杂交鹅掌楸愈伤组织的特性,选用400目(孔径38μl)和150目(孔径100μl)的筛子配合使用。用400目的筛子过滤掉细胞团,用150目的筛子将较小的细胞、破碎的细胞筛除,将收集到大小在38~100μl之间的单细胞,在加入aba(2mg/l)外源激素液体培养基中过渡培养两天。悬浮培养条件为23℃、转速95r/min下进行暗培养。选择状态较好的胚性愈伤组织,颜色为黄色且呈小颗粒状,质地较为紧实。建立液体悬浮系,此过程设定转速为95r/min,即能将细胞摇散,又不会因转速太快使细胞破碎。继代周期为7d,连续继代2~3次,保证能够获得足够的单细胞。然后选择150目和400目的筛子进行物理筛选,从而获得大小较为一致的单细胞,从图2可以看到杂交鹅掌楸单细胞的状态,细胞呈圆球形,内含物较多,分裂速度较快,符合杂交鹅掌楸胚性细胞的特点。在获得单细胞进行过渡培养的阶段,需要用显微镜对单细胞进行观察,以确定其浓度。5、不同浓度meja诱导杂交鹅掌楸体胚的发生过渡培养2天后,用显微镜观察细胞状态及密度,并进行下一步体胚诱导。杂交鹅掌楸体胚诱导培养基:3/4ms+vc5mg/l+ch0.2g/l+活性炭2g/l+蔗糖40g/l+8g/l琼脂粉,在培养基中加入不同浓度meja和aba2.0mg/l(如表1所示),以不加meja和aba及只添加2.0mg/laba的培养基为对照。用移液枪吸取液体细胞,均匀的铺在体胚诱导固体培养基上,每皿2ml,在23℃暗培养。定期用体式显微镜等观察不同胚期状态,观察体胚及再生植株的生长状态。选择三个基因型c138、253010、233012,每个浓度处理5皿。表1添加meja的体胚诱导培养基在体胚发育及萌发过程中,以正常的子叶胚为统计标准,观察记录各个meja不同浓度处理下体胚的生长发育状况及体胚发生时间,分别统计成熟胚总数及在萌发过程中再生植株数量。用显微镜观察杂交鹅掌楸体胚发生初期体细胞生长状态,及长出体胚后观察体胚的发育情况。观察并拍照记录体胚增殖分化速度、体胚出现时间及生长状态,统计子叶胚的数量、畸形胚数量及幼苗数量。待其长出真叶后移入幼苗成熟培养基中。与对照相比在不同浓度meje的体胚诱导培养基上培养10d时,就能够观察到有体胚的产生,体胚主要为呈球形胚、心形胚。30d时已经发育为成熟的子叶胚。1)基因型c138的体胚发生情况如图3所示,在添加aba和meja的体胚诱导培养基中,体胚诱导率随着meja的浓度上升而上升,在meja浓度为1×10-6mol/l(4号培养基)时,达到最大值,而且其畸形发生率最低。从图4可以看出,此时大部分体细胞胚形态正常。当meja浓度达到1×10-4mol/l时,体胚诱导率大幅下降,并产生较多的畸形胚,说明高浓度的meja不利于杂交鹅掌楸体胚的发生。添加aba和meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为2.42e-08<0.05,差异性显著。表明aba和meja配合使用对基因型c138的体胚诱导有较大影响。如图3所示,在只添加meja的处理中,体胚诱导率均高于对照组(不添加激素),8、9、10号培养基均高于添加2.0mg/laba的对照组。10号培养基(1×10-6mol/lmeja)处理下体胚诱导率及体胚成熟率达到最高值。只添加meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为2.63e-06<0.05,差异性显著。单一添加meja对基因型c138体胚诱导有影响较大。相比较于两组对照,4号和10号培养基的体胚发生率和体胚成熟率明显高于两组对照,10号培养基(meja5×10-6mol/l)的体胚诱导率和体胚成熟发生率为最高,但体胚发生畸形率比4号培养基高1.29%。而4号培养基(aba2mg/l和meja1×10-6mol/l)体胚发生率和体胚成熟发生率仅次于10号培养基,而且体胚畸形率最低。综合考虑,2.0mg/laba和1×10-6mol/lmeja配合使用时,体胚诱导效果达到最佳水平。通过观察c138再生植株的情况,从图4可以看出,除了正常子叶苗之外,还有一些单子叶苗,后期将其转入不添加任何激素的3/4ms培养基中进行培养,发现单子叶再生苗大部分能够生长发育成正常植株。在进行体胚苗的统计时,观察到只添加meja时,尤其meja(5×10-7mol/l)处于低浓度时,体胚苗根部明显比对照长。由图5可知,1×10-4mol/l的meja在体胚发生中对杂交鹅掌楸体胚苗根的生长起到明显抑制作用。可见,c138进行体胚诱导时,meja能够起到促进作用并能在一定程度对畸形胚起到抑制作用。2)基因型233012的体胚发生情况由图5可知,在添加aba和meja的体胚诱导培养基中,基因型233012在4号培养基(aba2mg/l和meja1×10-6mol/l)上体胚发生率和体胚成熟率最高,而且体胚畸形发生率最低,体胚诱导效果达到最佳水平。添加aba和meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为5.06e-08<0.05,差异性显著。表明aba和meja配合使用对基因型233012的体胚诱导有较大影响。在单独添加meja的体胚诱导培养基中,体胚诱导率随着meja浓度的上升而升高,在9号培养基(meja1×10-6mol/l)时体胚诱导效果最佳,其体胚发生率为58.06%,体胚成熟率为36.67%,畸形胚发生率为5.27%。在高浓度meja(1×10-4mol/l)时诱导率大幅度下降,只有25.34%,而且会诱导出部分畸形胚,并伴随有褐化现象。单独添加meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为0.0001<0.05,差异性显著。表明单一添加meja对基因型233012的体胚诱导影响较大。4号和9号培养基的体胚发生率及成熟均高于对照,4号的体胚畸形率低于两组对照。4号培养基的体胚发生率和成熟率均为最高,体胚畸形率最低。4号和9号中meja的浓度均为1×10-6mol/l,说明233012中meja的浓度为1×10-6mol/l时诱导效果最好。综合考虑,2.0mg/laba和1×10-6mol/lmeja配合使用时,体胚诱导效果达到最佳水平。如图6所示,经过液体悬浮培养体系诱导形成体胚,由暗环境转入光环境培养,诱导出体胚苗,及时将其转入不添加任何激素的3/4ms培养基中进行培养,经培养,发现233012的再生植株能够正常生长。3)基因型253010的体胚发生情况从图7中可以看出,添加aba和meja的体胚诱导培养基中,基因型253010的体胚发生率最高为4号培养基(aba2mg/l和meja1×10-6mol/l),其次是5号(aba2mg/l和meja5×10-6mol/l),但是4号的体胚成熟率比5号低1.96%。在添加aba和meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为1e-06<0.05,差异性显著。表明aba和meja配合使用对基因型253010的体胚诱导有较大影响。在只添加meja的体胚诱导培养基中,10号培养基(meja5×10-6mol/l)的体胚诱导率最高体胚发生率为37.52%,体胚成熟率为25.30%,畸形胚发生率为7.81%。体胚诱导率随着meja浓度的上升而升高,浓度在5×10-6mol/l时达到最高,之后诱导率后开始下降。253010体胚发生时畸形率差别不大。高浓度meja(1×10-4mol/l)处理下诱导率有所下降,体胚畸形率升高。添加meja的培养基诱导体胚发生时,将每种处理的体胚诱导率进行差异性显著分析,计算可知,p值为5.32e-05<0.05,差异性显著。单一添加meja时对基因型253010体胚诱导有影响较大。对所有处理进行比较,发现10号的体胚发生率和成熟率略高于4号,但是10号的体胚畸形率高于4号。此次,4号和10号的体胚发生率和成熟率差异不大。综合考虑,2.0mg/laba和1×10-6mol/lmeja配合使用时,体胚诱导效果达到最佳水平。4)不同基因型对体胚发生率的影响同一植物的不同基因型在诱导体胚发生时,结果可能存在较大差异。本发明通过建立悬浮培养体系,杂交鹅掌楸基因型c138、233012、253010在添加不同浓度meja的体胚诱导培养基中诱导体胚发生,诱导效果不太一致,但都在外施2mg/laba和1×10-6mol/lmeja的情况下,三者的诱导效果相对最佳,将这三个基因型在2mg/laba和1×10-6mol/lmeja处理下的体胚发生率进行方差分析,如表2,p值为0.0012<0.05,说明差异显著。表明基因型是杂交鹅掌楸体胚发生的重要因素,如图8所示。表2不同基因型的杂交鹅掌楸体胚发生的方差分析差异源ssdfmsfp-valuefcrit组间3463.9621731.9825.260.00125.1434组内411.43668.57总计3875.3985)杂交鹅掌楸体胚苗根长的测量如图9所示,基因型c138在进行体胚苗发生,杂交鹅掌楸体胚诱导培养基中加入不同浓度的meja会体胚苗的根长产生影响。从图9可知,在aba和meja共同诱导杂交鹅掌楸体胚发生时,促进根生长的效果不明显。同样meja浓度达到62.5×10-6mol/l时,不利于根的伸长生长。在只加meja共同诱导杂交鹅掌楸体胚发生时,8号培养基中体胚苗根最长,说明根长与meja浓度成负相关,当浓度达到62.5×10-6mol/l时,其根明显短于其他浓度处理的体胚苗,说明高浓度meja对体胚苗的根的生长有抑制作用。可见,在植物组织培养过程中,植物激素对体胚发生起到至关重要的作用。c138、233012、253010三个基因型在不同浓度meja的杂交鹅掌楸体胚诱导培养基中诱导体胚过程,发现添加aba和meja或者单独添加meja时,都能提高体胚诱导率以及植株再生率。但是,这三种基因型的体胚诱导率存在差异,其体胚诱导率从高到低依次为233012、c138、253010。6、再生植株的培养杂交鹅掌楸单细胞经过球形胚、心形胚、鱼雷胚、子叶胚等阶段的发育,60d后发育成体胚再生植株,比较再生植株生长状况,并从每种体胚诱导培养基中随机取50株再生植株,取出测量其根长,进行统计分析。随后将再生植株接入不添加任何激素及附加物的3/4ms培养基。待再生苗高度达到4、5cm后,可进行炼苗及移栽到基质中继续培养。实施例2在经过一定次数的继代培养后,愈伤组织状态呈现黄色细颗粒状、质地结实、生长速度较为缓慢,此时杂交鹅掌楸的胚性愈伤组织状态较好。待其长出胚性愈伤组织并状态良好时,进行体胚诱导。直接利用固体培养基进行体细胞胚诱导,将状态较好的愈伤组织直接铺在体胚诱导培养基中进行培养,杂交鹅掌楸体胚诱导培养基:3/4ms+vc5mg/l+ch0.2g/l+活性炭2g/l+蔗糖40g/l+琼脂粉8g/l,在培养基中加入不同浓度的meja和aba(如表3所示),以不加meja和aba及只添加2.0mg/laba的培养基为对照,观察固体培养基中不同浓度茉莉酸甲酯对杂交鹅掌楸体胚发生的影响。选基因型为c138、233012、253010且状态较好的愈伤组织,直接铺在添加不同浓度meja的体胚诱导培养基中,进行体胚诱导培养,每种处理铺4皿,每皿放置7块愈伤组织。培养条件为23℃,暗培养,30d继代一次。60d后统计c138、233012、253010体胚发生数及体胚苗数量,统计单位为个数/皿。继代一次至二次后,待其长出成熟体胚及体胚苗时,将诱导体胚发生的愈伤组织分为两部分,一部分入原来的培养基,一皿放7块,23℃,暗培养;另一部分转入不加任何激素的3/4ms基本培养基,并放入光照培养室中培养。用显微镜观察杂交鹅掌楸体胚发生初期体细胞生长状态,及长出体胚后观察体胚的发育情况。观察并拍照记录体胚增殖分化速度、体胚出现时间及生长状态,体胚以正常形态的子叶胚为统计标准。表3添加meja的体胚诱导培养基培养基型号aba(mg/l)meja(μmol/l)100220320.1420.5522.56212.57262.5800.1900.51002.511012.512062.5直接将基因型c138、233012、253010的胚性愈伤组织放在添加不同浓度meja的杂交鹅掌楸体胚诱导培养基中,进行体胚诱导培养。三个基因型c138、233012、253010都能成功诱导出体胚,但是其体胚诱导结果存在差异。在不同浓度meja的体胚诱导培养基中,基因型253010在20d时开始有胚状体的产生;基因型233012在30d开始有胚状体的产生;而基因型c138,在继代培养一次后,50d左右开始产生胚状体。如表4、图10所示,基因型c138在不同浓度meja的体胚诱导培养基中体胚发生数目不多,最多只有41个/皿,再生植株率有31.71%。表4不同浓度meja下基因型c138的体胚发生情况如表5所示,基因型233012在添加aba和meja的体胚诱导培养基中,随着meja浓度的上升,体胚数目持续增多。当meja达到12.5×10-6mol/l时,诱导效果达到最佳水平,此时体胚发生数为97个/皿,再生植株率达到49.48%。单独添加meja时,诱导效果不如aba和meja配合使用。从图11可知,愈伤组织变成团状并在团状组织上产生体胚。当meja浓度达到62.5×10-6mol/l时,组织变为较硬的团状,很少能发育为成熟的子叶胚。因此,高浓度meja诱导体胚发生时,会抑制体胚的诱导及生长。表5不同meja浓度下基因型233012的体胚发生情况将基因型253010的胚性愈伤组织转入添加不同meja浓度的体胚诱导培养基中,20d左右时253010开始出现胚状体,在2mg/laba和12.5×10-6mol/lmeja的处理中最早发现体胚,随后其他处理也开始长出体胚。图12和表6可知,30d时基因型253010在不同浓度meja诱导下体胚的状态,能明显看到6号培养基中的体胚已经产生子叶胚且数目较多。体胚数量可达231个/皿,再生植株有136株/皿,再生植株率为58.87%,相比其它培养基最大值。在诱导体胚发生过程中随着时间的增长,组织开始变硬,可能是由于含水量降低的缘故。当meja浓度达到62.5×10-6mol/l时,会抑制体胚的生长及发育,经过一定时间的生长后,组织状态开始变褐。表6不同meja浓度下基因型253010的体胚发生情况基因型253010的体胚发育成熟后,将其转入光照培养室中培养(23℃,16h光培养8h暗培养)。由图13可知,4号培养基中再生植株数量最多,且明显多于两组对照组。基因型是体胚发生的一个重要影响因子。本实施例表明,不同基因型诱导体胚发生效果存在差异。基因型253010的体胚诱导能力最佳,其次是233012,最后是c138。直接使用固体体胚诱导培养过程中,无论是否添加2mg/laba,体胚诱导数量都是随着meja浓度的升高而增加,当meja浓度达到12.5×10-6mol/l时,诱导出体胚数目最多。而aba和meja配合使用能够诱导更多体胚发生。在诱导基因型c138、233012、253010的体胚发生途径中,aba(2mg/l)和meja(12.5×10-6mol/l)配合使用,能够提高体胚的发生效率及促进体细胞胚成熟,并且能够提高其植株再生率。高浓度的meja(62.5×10-6mol/l)对体胚诱导和体胚生长有明显抑制作用。黑暗中组织分化速度较快,虽然有体胚苗的产生,但存在一定的畸形苗。因此,当体胚成熟并长出部分再生植株后,应将其转入光照下培养,体胚苗经过光合作用变绿。另外,由于外施激素的刺激,使体胚的下胚轴粗大,影响根系生长状态。所以,在长出子叶胚后,应及时将其转入不加任何激素的3/4ms基本培养基培养。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1