一种光药结合法诱导龟足稚体人工育苗方法与流程
本发明涉及水产养殖的技术领域,具体涉及一种光药结合法诱导龟足稚体人工育苗方法。
背景技术:
龟足(capitulummitellalinnaeus)是一种具有较高经济价值和发展前景的海水养殖品种,隶属于节肢动物门、甲壳亚门、蔓足下纲、围胸总目、有柄目、铠茗荷亚目、指茗荷科(pollicipidae)龟足属(capitulum)。龟足俗称笔架、佛手、狗爪螺等,一般栖居在海浪剧烈冲击水流通畅的中、高潮区的岩石缝隙中,常见于群生簇状分布或与鳞笠藤壶、刺巨藤壶等伴生粘附于岩石或其它物体表面。由于受到栖息环境的制约,龟足种群规模较小且大小个体混杂,幼体常附着在成体柄部;采捕时均将成簇个体挖出,大量未达到食用规格的幼体也被带走,使种群资源受到极大破坏;撬砸等采挖行为也容易破坏岩礁生境,同时岩礁上的作业对采捕者而言也极具危险性。为了合理开发和保护龟足资源,有必要对龟足进行人工育苗和增养殖研究,这样,可大大减少对野生资源的采捕,控制对环境的过度开发,从而有效保护福建特色的海产品资源和海岸生态环境。
指茗荷科的另一属指茗荷属(pollicipe)具有很大的经济价值。在西班牙、葡萄牙p.polymerus和p.pollicipes更是被视为美味佳肴,作为一种巨大经济价值的渔业资源被高度开发利用,有着广阔的商业需求和很高的市场价格,目前每公斤的价格可高达200欧元。由于过度的开发利用,出于保护的需要,西班牙等国均限制其采捕量。
蔓足类的生活史通常要经过营浮游生活的6期无节幼体、不摄食的腺介幼虫、固着的稚体和成体几个发育阶段。腺介幼虫是蔓足类发育过程中的一个重要阶段,唯一的作用是选择适宜附着的基质并完成变态。在腺介幼虫附着变态过程中,腺介幼虫的游泳足快速划动,以规律性的“步伐”在基质表面行走,通过第一触角探测附着基质,分泌临时胶体形成足迹;如果基质条件适宜,腺介幼虫则分泌永久胶体附着,进而变态为稚体,个体进入固着生活阶段。蔓足类浮游的腺介幼虫在附着变态过程中,其形态结构及生活习性发生了剧烈变化。如果腺介幼虫不能完成附着变态,随着营养物质的耗尽,最终走向死亡。无柄蔓足类藤壶是最主要的海洋污损生物,国外以纹藤壶(amphibalanusamphitrite)为模型生物对藤壶的附着变态机制进行了多年研究,希望能开发出干扰其附着变态的高效、绿色的防污剂。经济有柄蔓足类(指茗荷属和龟足属)与无柄蔓足类藤壶分属于不同的目,它们的形态和生活方式存在很大的差异。有柄类龟足分泌的粘胶剂借助于柄的基部固着在基质上,无柄类藤壶分泌的粘胶剂则通过整个底盘固着在基质上。无柄类藤壶在人工条件下腺介幼虫易于附着变态,而有柄类(龟足属和指茗荷属)对生态的要求特殊,在人工条件下腺介幼虫难以完成附着变态。对经济有柄蔓足类而言,腺介幼虫在室内完成附着变态是人工育苗的关键;对污损无柄蔓足类来说,干扰其附着变态是防除的关键。
虽然目前实验室实现从龟足卵的人工孵化、无节幼虫的培养、最后能够大规模培养出腺介幼虫,但要实现龟足的人工育苗,必须突破在人工条件下诱导龟足腺介幼虫发育成稚体的难题。龟足腺介幼虫人工条件下的变态发育成稚体是实现龟足人工育苗的核心问题,因此需要研发出能够有效促进龟足腺介幼虫变态发育的方法。
保幼激素及类似物是最重要的一类昆虫激素,具有调控昆虫生长、发育、变态和生殖等的生理功能,也能调控虾蟹等十足目甲壳动物的生长发育。虽然近年对保幼激素的作用分子机制进行了大量研究,但远未彻底揭示保幼激素的作用机理。由于保幼激素及类似物种类多,且一种药物往往具有多种生理调节功能;昆虫和甲壳动物的种类繁多,昆虫保幼激素及类似物对甲壳动物的效应,在不同物种甚至同一物种不同的发育阶段都可出现不同的效应;药物的浓度、作用的时间等都会导致显著差异。因此,某一药物针对不同物种的作用往往是不同的。中国专利(专利号201510183853.8)已公开了《一种利用保幼激素-ⅲ诱导龟足金星幼虫附着变态的方法》。在此工作的基础上,再次研发出以保幼激素类似物s-烯虫乙酯为主要成份的专用诱导剂结合龟足腺介幼虫驱光性特点,建立一种光药结合法诱导龟足稚体人工育苗的方法。
技术实现要素:
为了实现上述目标,本发明采取的技术方案为:
1、附着变态的诱变剂的配制:
按照s-烯虫乙酯:二甲基亚砜为1:40~50(w/v)的重量体积比例混合溶匀,加乙醇配制成含有s-烯虫乙酯1mg/ml的专用诱变剂,4℃条件下保存;
2、在诱变培育池(另案同日申请)中的a级池、b级池、c级池中分别放入腺介幼虫附着器,注满清洁的新鲜海水后,关闭诱变培育池中的各级池相通的上溢水管和下排水管,将收集培养的腺介幼虫移入诱变培育池中的a级池海水中,并开启a级池输气管进行持续微充气,使腺介幼虫自由分散。
3、微充气30分钟后,开启诱变培育池a级池中的诱变剂滴加管,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每分钟5-8滴诱变剂,持续滴加60-90分钟。持续保持微充气。
4、诱变剂滴加完毕后6h,盖上盖子,开启b级池的led灯持续2小时后关灯,开启诱变培育b池级池中的诱变剂滴加管,对b级池连续滴加诱变剂,诱变剂滴加的速度以每升b级池海水每分钟3-5滴,滴加90-120分钟。持续保持微充气。
5、b级池诱变剂滴加完毕后4h,盖上盖子,开启c级池的led灯持续2小时后关灯,开启诱变培育池c级池诱变剂滴加管,对c池连续滴加诱变剂,诱变剂滴加的速度以每升c池海水每分钟2-7滴,滴加150分钟。保持微充气。
6、48h后,关闭各池间的上溢水管,打开a级池与b级池、b级池与和c级池间的下排水管及c级池尾水管,开启注水管对a级池进行不间断注水,24小时注水量为a级池水体总体积的1/3。注水的同时开启诱变剂滴加管,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每十分钟1-5滴,连续的注水时间为4-6天。注入的清洁海水,混合后经由a级池下排水管流入b级池再流入c级池,最后由c级池尾水管排出培育尾水。b、c级池的设置,可将a级池未附着的腺介幼虫进一步诱导附着,有效防止腺介幼虫的流失,延长了诱导海水的停留时间,提高变态附着率。
7、4-6天后,停止注水和滴加,分别取出腺介幼虫附着基,即可转入稚体养殖阶段。
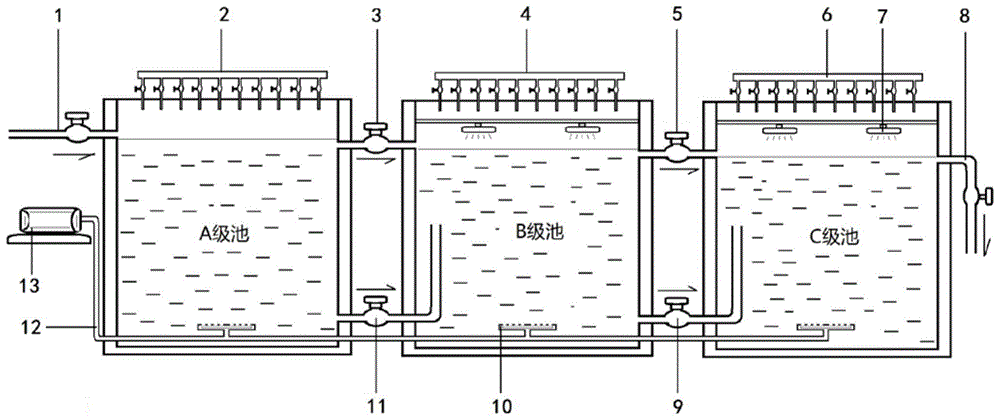
本发明所述的诱变培育池,由三级水池、鼓气系统、海水注入管、灯光系统和诱变剂滴加系统构成,其中三级水池,由a级池、带有顶盖的b级池、带有顶盖的c级池依次排列而成,a级池、b级池之间,b级池、c级池之间,分别通过上溢水管、下排水管相连接;c池的海水充满后,尾水由尾水管排出;鼓气系统设置于水池的底部,海水注入管设置在a级池的上部,诱变剂滴加系统分别设置在a级池、b级池、c级池的水面上方;灯光系统设置在b级池、c级池的水面与顶盖之间。c级池的海水充满后,尾水由尾水管排出。
所述的上溢水管,设置有阀门,按其位置分为ab池上溢水管、bc池上溢水管,分别设置在b级池、c级池池水水面等高位的侧壁上,
所述的下排水管,设置有阀门,按其位置分为ab池下排水管、bc池下排水管,分别设置在a级池、b级池、c级池侧壁的下半部,起到相邻两个池子联通作用。
所述的鼓气系统,鼓气系统由空压机,输气管和爆气盘构成,输气管和爆气盘相连后设置于a级池、b级池、c级池的底部,输气管连接的爆气盘,位于a级池、b级池、c级池的中心处,输气管通入空气后从爆气盘释放进入海水水体中,起到对海水水体搅拌作用。
所述的诱变剂滴加管,在总的输入管出口端并排设置5-10路带有阀门的滴加控制头,可根据a级池、b级池、c级池的水量决定打开几路滴加控制头。
所述的烯虫炔酯,购置于试剂公司。
所述的诱变培育池的b级池、c级池设置的顶盖,各装有红光led灯盘,灯盘离水面20cm。
所述的清洁海水:水温为23-28℃,盐度为25-35,ph7.9-8.1。
所述的s-烯虫乙酯,购置于试剂公司。
采用本发明方法进行了8批次的试验,并在同等试验条件下设立了两个对照组,记录龟足腺介幼虫变态发育成稚体出苗率数据如下:
从上表可以看出,本发明实验组8批次培育稚体的出苗率平均数可达到59.13%,最高为76%,获得的稚体能够正常生长发育成为成体,而实验组出苗率分别为0.68%和1.06%,其平均数仅为0.86%,远远低于实验组的59.13%。
本发明设计了专用培育池,采用光药结合法,操作简单,作用稳定,育苗效果及其显著,出苗率可达59.13%以上。本发明给出了稚体苗种的培育方法,诱变剂应用的特定诱变培育池、诱变方法、合适浓度、处理时间,是一种龟足稚体苗种培育的有效方法。
附图说明
图1是本发明所述的一种光药结合法诱导龟足稚体人工育苗方法中采用的诱变培育池结构剖面示意图。
具体实施方式
本发明已连续在多批次的龟足稚体苗种培育中应用,均达到良好的效果。以下结合附图以实施例方式对本发明做进一步的说明。
图1中,1是诱变培育池注水管;2是a级池诱变剂滴加管,在总的输入管出口端并排设置5-10路带有阀门的滴加控制头,可根据a级池、b级池、c级池的水量决定打开几路滴加控制头;3是a级池、b级池之间相连相同的上溢水管,水管中设置有阀门;4是b级池诱变剂滴加管,其构造与级池诱变剂滴加管(2)相同;5是b级池、c级池之间相连相同的上溢水管,水管中设置有阀门;6是c级池诱变剂滴加管,与a级池诱变剂滴加管(2)的构造相同;7是设置中b级池和c级池水面之上的led灯,led灯的数量可根据水体体积和水面的面积设定个数;8是设置在c级池侧壁上的排水管,水管中设置有阀门;9是设置在b级池、c级池侧壁的下半部的bc池下排水管,水管中设置有阀门;10是鼓气系统中的爆气盘,爆气盘与输气管相连后设置于a级池、b级池、c级池部的中心处,输气管空气通过爆气盘释放进入海水水体中,起到对海水水体搅拌作用;11是设置在a级池、b级池侧壁的下半部的ab池下排水管,水管中设置有阀门;12是鼓气系统中的输气管,输气管连接外设的空压机和爆气盘(10)。
实施例1
1、龟足腺介幼虫附着变态的诱变剂的配制:
按照s-烯虫乙酯:二甲基亚砜为1:40~50(w/v)的重量体积比例混合溶匀,加乙醇配制成含有s-烯虫乙酯1mg/ml的诱变剂,4℃条件下保存;
2.诱变培育池:
本实施例所述的诱变培育池结构如技术方案所示。诱变培育池由a级池、b级池、c级池3个同体积的池子相连而成,b级池、c级池为加盖的全避光完全黑暗的暗池。其中:a级池、b级池、c级池的尺寸为:1.5米(长)×1.5米(宽)×2.0米(高),注水高度1.5米。
3、在诱变培育池中的a级池、b级池、c级池中分别放入腺介幼虫附着器,注满清洁的海水后,关闭诱变培育池中的各级池相通的上溢水管和下排水管,将收集培养的200000只腺介幼虫移入诱变培育池中的a级池海水中,并开启外设的空压机通过输气管(12)对a级池进行持续微充气,使腺介幼虫自由分散。
4、微充气30分钟后,开启诱变培育池a级池诱变剂滴加管(2)中10路带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每分钟6滴诱变剂,持续滴加60分钟。持续保持微充气。
5、诱变剂滴加完毕后经过6h,启动b级池的水面之上的四盏各6w的led灯,持续2小时后关灯,开启诱变培育池b级池诱变剂滴加管(4)中10路带有阀门的滴加控制头,对b级池连续滴加诱变剂,诱变剂滴加的速度以每升b级池海水每分钟4滴,滴加90分钟。持续保持微充气。
6、b级池诱变剂滴加完毕后经过4h,启动c级池的水面之上的四盏各6w的led灯持续2小时光照后关灯,开启c级池诱变剂滴加管(6)中10路带有阀门的滴加控制头,对c级池连续滴加诱变剂,诱变剂滴加的速度以每升c级池海水每分钟2滴,滴加150分钟。保持微充气。
7、c级池诱变剂滴加完毕后经过48h,关闭各池间的上溢水管,打开各池间的下排水管及c级池尾水管(8),开启注水管(1)对a级池进行不间断注水,24小时注水量为a级池水体总体积的1/3。注水的同时开启a级池诱变剂滴加管(2)总的1路带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每十分钟5滴,连续的注水时间为4天。注入的清洁海水,混合后经由a级池下排水管流入b级池再流入c级池,最后由c级池尾水管排出培育尾水。b、c级池的设置,可将a级池未附着的腺介幼虫进一步诱导附着,有效防止腺介幼虫的流失,延长了诱导海水的停留时间,提高变态附着率。
8、停止注水和滴加后,分别取出腺介幼虫附着基,即可转入稚体养殖阶段。
本实施例所述的洁净海水,水温为27-28℃,海水盐度为35,海水ph8.0。
经计数测算本次实验收获稚体苗种127150只,出苗率达到63.3%。
实施例2
1、龟足腺介幼虫附着变态的诱变剂的配制:
按照s-烯虫乙酯:二甲基亚砜为1:40~50(w/v)的重量体积比例混合溶匀,加乙醇配制成含有s-烯虫乙酯1mg/ml的诱变剂,4℃条件下保存;
2、诱变培育池:
本实施例所述的诱变培育池结构如技术方案所示。诱变培育池由a级池、b级池、c级池3个同体积的池子相连而成,b级池、c级池为加盖的全避光完全黑暗的暗池,。其中:a级池、b级池、c级池的尺寸为:1.0米(长)×1.0米(宽)×1.6米(高),注水高度1.3米。
3、龟足亲体经培育后产卵、孵化,收集孵出的无节幼虫于500l黑色玻璃钢养殖桶中培育11天,待大部分无节幼虫发育至腺介幼虫时取样计数,有腺介幼虫约140000只。在诱变培育池中的a级池、b级池、c级池中分别放入腺介幼虫附着器,注满清洁的海水后,关闭诱变培育池中的各级池相通的上溢水管和下排水管,将收集培养的140000只腺介幼虫移入诱变培育池中的a级池海水中,并开启a级池空气管进行持续微充气,使腺介幼虫自由分散。
4、微充气30分钟后,开启诱变培育池中3路带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每分钟5滴诱变剂,持续滴加90分钟。持续保持微充气。
5、诱变剂滴加完毕后经过6h,启动b级池的顶盖中的四盏各6w的led灯,持续2小时后关灯,开启诱变培育池中3路带有阀门的滴加控制头,对b级池连续滴加诱变剂,诱变剂滴加的速度以每升b级池海水每分钟5滴,滴加90分钟。持续保持微充气。
6、b级池诱变剂滴加完毕后经过4h,启动c级池的顶盖中的四盏各6w的led灯持续2小时光照后关灯,开启c级池中3路带有阀门的滴加控制头,对c级池连续滴加诱变剂,诱变剂滴加的速度以每升c级池海水每分钟3滴,滴加150分钟。保持微充气。
7、c级池诱变剂滴加完毕后经过48h,关闭各池间的上溢水管,打开各池间的下排水管及c级池尾水管,开启注水管对a级池进行不间断注水,24小时注水量为a级池水体总体积的1/3。注水的同时开启1路的带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每十分钟5滴,连续的注水时间为6天。注入的清洁海水,混合后经由a级池下排水管流入b级池再流入c级池,最后由c级池尾水管排出培育尾水。b、c级池的设置,可将a级池未附着的腺介幼虫进一步诱导附着,有效防止腺介幼虫的流失,延长了诱导海水的停留时间,提高变态附着率。
8、停止注水和滴加后,分别取出腺介幼虫附着基,即可转入稚体养殖阶段。
本实施例所述的洁净海水,水温为27-28℃,海水盐度为32,海水ph8.0。
经计数测算本次育苗收获稚体苗种103600只,出苗率达到74%。
实施例3
1、龟足腺介幼虫附着变态的诱变剂的配制:
按照s-烯虫乙酯:二甲基亚砜为1:40~50(w/v)的重量体积比例混合溶匀,加乙醇配制成含有s-烯虫乙酯1mg/ml的诱变剂,4℃条件下保存;
2、诱变培育池:
本实施例所述的诱变培育池结构如技术方案所示。诱变培育池由a级池、b级池、c级池3个同体积的池子相连而成,b级池、c级池为加盖的全避光完全黑暗的暗池。其中:a级池、b级池、c级池的尺寸为:1.0米(长)×1.0米(宽)×1.3米(高),注水高度1.0米。
3、龟足亲体经培育后产卵、孵化,收集孵出的无节幼虫于500l黑色玻璃钢养殖桶中培育10天,待大部分无节幼虫发育至腺介幼虫时取样计数,有腺介幼虫约285000只。在诱变培育池中的a级池、b级池、c级池中分别放入腺介幼虫附着器,注满清洁的海水后,关闭诱变培育池中的各级池相通的上溢水管和下排水管,将收集培养的285000只腺介幼虫移入诱变培育池中的a级池海水中,并开启a级池空气管进行持续微充气,使腺介幼虫自由分散。
4、微充气30分钟后,开启诱变培育池中3路带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每分钟6滴诱变剂,持续滴加60分钟。持续保持微充气。
5、诱变剂滴加完毕后经过6h,启动b级池的顶盖中的四盏各6w的led灯,持续2小时后关灯,开启诱变培育池中2路带有阀门的滴加控制头,对b级池连续滴加诱变剂,诱变剂滴加的速度以每升b级池海水每分钟5滴,滴加90分钟。持续保持微充气。
6、b级池诱变剂滴加完毕后经过4h,启动c级池的顶盖中的四盏各6w的led灯持续2小时光照后关灯,开启c级池中1路带有阀门的滴加控制头,对c级池连续滴加诱变剂,诱变剂滴加的速度以每升c级池海水每分钟7滴,滴加150分钟。保持微充气。
7、c级池诱变剂滴加完毕后经过48h,关闭各池间的上溢水管,打开各池间的下排水管及c级池尾水管,开启注水管对a级池进行不间断注水,24小时注水量为a级池水体总体积的1/3。注水的同时开启1路的带有阀门的滴加控制头,对a级池连续滴加诱变剂,诱变剂滴加的速度以每升a级池海水每十分钟5滴,连续的注水时间为6天。注入的清洁海水,混合后经由a级池下排水管流入b级池再流入c级池,最后由c级池尾水管排出培育尾水。b、c级池的设置,可将a级池未附着的腺介幼虫进一步诱导附着,有效防止腺介幼虫的流失,延长了诱导海水的停留时间,提高变态附着率。
8、停止注水和滴加后,分别取出腺介幼虫附着基,即可转入稚体养殖阶段。
经计数测算本次育苗收获稚体苗种215000只,出苗率达到76%。
本实施例所述的海水水体,水温为27-28℃,海水盐度为32,海水ph8.0。
发明给出的制剂配方和稚体苗种生产方法对龟足人工育苗效果良好。
- 还没有人留言评论。精彩留言会获得点赞!