白花前胡不定芽的繁殖方法
1.本发明涉及一种白花前胡不定芽的繁殖方法。
背景技术:
2.白花前胡(peucedanum praeruptorum dunn)具有抗心肌缺血、保护心肌、改善心脏功能、降血压、抗氧化、祛痰、抗菌、抗肿瘤等药理作用。其主产于浙江、四川等地,但由于连年采挖,野生资源逐渐枯竭,目前人工栽培的白花前胡,存在制种不纯、品质不稳定的问题。而种子繁殖萌发率较低,出苗不整齐,生长周期长,存在变异可能,影响药效,限制了白花前胡的可持续发展。
3.因此,提高白花前胡的繁殖效率是保护白花前胡资源、解决市场供需需要的关键技术。吴沿胜等研究确定了白花前胡根、茎、叶愈伤组织诱导的条件,但基于愈伤组织建立的再生体系容易发生变异,导致药效成分不稳定,因此本发明提出基于不定芽诱导的白花前胡再生体系,可以有效规模化提供遗传背景一致的优质白花前胡种苗,保障了白花前胡药效成分稳定,为白花前胡药材的科学应用提供了技术支撑。
4.目前尚未有伞形科植物利用诱导不定芽繁殖的。
技术实现要素:
5.本发明要解决的技术问题是提供一种白花前胡不定芽的繁殖方法。
6.为解决上述技术问题,本发明提供一种白花前胡不定芽的繁殖方法,包括以下步骤:
7.1)、外植体灭菌:
8.选择长势良好(叶色深绿、植株健壮、无病虫害)的白花前胡植株,首先流水清洗植株,然后切取植株茎尖(约0.5~1cm3的方块)作为外植体材料;
9.将外植体材料消毒后,用无菌滤纸吸干外植体材料表面水分,用无菌手术刀修整,从而将茎尖外层变色的组织切除(升汞消毒后会导致外层组织变褐色,不切去会影响内层活细胞吸收营养);得茎尖外植体;
10.2)、无菌苗培养:
11.将步骤1)得到的茎尖外植体接种到扩繁培养基中,在植物组织培养室内于24
±
1℃培养,直至在外植体上诱导出长度≥0.5cm且个数≥5个的不定芽才结束培养,此步骤2)结束后所得物命名为白花前胡无菌苗;
12.此步骤2)的培养时间约为4~6周;
13.3)、生根培养:
14.将步骤2)所得的白花前胡无菌苗上的每个长度≥0.5cm的不定芽分别进行切割,得单芽;
15.将单芽转接到生根培养基中,在植物组织培养室内培养,培养温度24
±
1℃,直至获得根数≥5根且株高≥3.0cm的生根后白花前胡无菌组培苗;
16.此步骤3)的总培养时间约为30天左右;在生根培养基中培养15d后就出现生根现象;
17.4)、组培苗驯化移栽:
18.将步骤3)所得的生根后白花前胡无菌组培苗放入水培瓶内进行水培养,培养温度为24
±
1℃,水培瓶做遮光处理(避免绿藻生长);直至当培养至株高≥15cm且根长≥10cm的根至少有5根时,结束此步骤。
19.说明:结束此步骤后,可进行后续的常规基质栽培。
20.作为本发明的白花前胡不定芽的繁殖方法的改进,扩繁培养基为:ms+2.4~2.6mg 6-ba、20~30g白砂糖、4~9g琼脂,ph 5.8
±
0.2。
21.所述扩繁培养基的制备方法为:以ms基本培养基为基础,加入6-苄氨基腺嘌呤(6-ba)、白砂糖、琼脂,均匀混合,利用1mol/l的koh或1mol/l的hcl调节ph为5.8
±
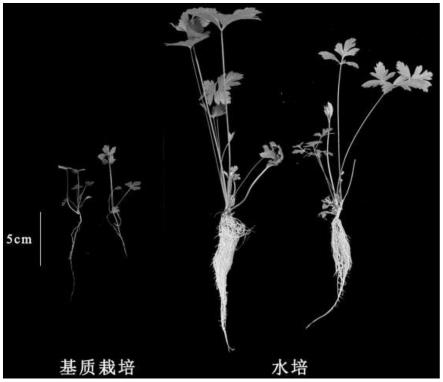
0.2;每1l的ms基本培养基加入2.4~2.6mg 6-ba、20~30g白砂糖、4~9g琼脂。
22.作为本发明的白花前胡不定芽的繁殖方法的进一步改进,生根培养基为:1/2ms+0.2mg naa+20~30g白砂糖+4~9g琼脂,ph 5.8
±
0.2。
23.所述生根培养基的制备方法为:以1/2ms基本培养基(即溶液中所有物质的含量为ms基本培养基的一半)为基础,加入萘乙酸(naa)、白砂糖、琼脂,均匀混合,利用1mol/l的koh或1mol/l的hcl调节ph为5.8
±
0.2;每1l的1/2ms基本培养基加入0.2mg naa、20~30g白砂糖、4~9g琼脂。
24.作为本发明的白花前胡不定芽的繁殖方法的进一步改进,步骤4)中,利用霍格兰营养液(hoagland nutrient solution,phygene)进行水培养。
25.作为本发明的白花前胡不定芽的繁殖方法的进一步改进,步骤1)中的消毒为:
26.将外植体材料用70%~75%(体积%)的乙醇消毒后,用无菌水冲洗;然后用0.1%(质量%)的hgcl2消毒10~15min,无菌水冲洗至少3次。
27.作为本发明的白花前胡不定芽的繁殖方法的进一步改进,步骤1)中:70%~75%乙醇消毒时间为30
±
5s;0.1%hgcl2消毒茎尖的时间在12~15min(期间不时摇晃)。
28.本发明具有以下技术优势:
29.1)白花前胡茎尖诱导产生的不定芽多,培养4~6周,一般为5~20个不定芽;生长状态好;利用植物组织培养技术对白花前胡进行再生体系构建,不受外界环境条件的影响;该方法不定芽诱导率高、重复性好、生产周期短,成本低。
30.2)区别于诱导愈伤组织实现白花前胡再生的方法,利用植物组织培养技术诱导白花前胡不定芽,保留白花前胡优良性状并世代传递,避免制种不纯和遗传变异。
31.综上,本发明的方法外植体灭菌效果好、成活率高,不定芽诱导率高、生长状态好,组培苗生根率高,移栽成活率高。
附图说明
32.下面结合附图对本发明的具体实施方式作进一步详细说明。
33.图1为组培苗驯化移栽时直接基质栽培和水培的对比图;
34.图2为不同生根培养基下培养30天的对比图。
具体实施方式
35.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
36.实施例1、一种白花前胡不定芽的繁殖方法,依次进行以下步骤:
37.1)、外植体灭菌:
38.选择长势良好(叶色深绿、植株健壮、无病虫害)的白花前胡植株,首先流水清洗植株,然后切取植株茎尖(约0.5~1cm3方块)作为外植体材料;
39.将外植体材料用70%~75%(体积%)的乙醇消毒30s后,用无菌水冲洗3~5次;然后用0.1%(质量%)的hgcl2消毒12min(期间不时摇晃),无菌水冲洗5~6次后;用无菌滤纸吸干外植体材料表面水分,用无菌手术刀修整,从而将茎尖外层变色的组织切除(升汞消毒后会导致外层组织变褐色,不切去会影响内层活细胞吸收营养);获得茎尖外植体;
40.2)、无菌苗培养:
41.将步骤1)得到的茎尖外植体接种到扩繁培养基(ba2.5)中,在植物组织培养室内(24℃)培养,直至在外植体上诱导出长度≥0.5cm且个数≥5个的不定芽才结束培养,此步骤结束后所得物命名为白花前胡无菌苗;
42.扩繁培养基ba2.5为:ms+2.5mg 6-ba、25g白砂糖、5g琼脂,ph 5.8。
43.扩繁培养基ba2.5的制备方法为:以ms基本培养基为基础,加入6-苄氨基腺嘌呤(6-ba)、白砂糖、琼脂,均匀混合,利用1mol/l的koh或1mol/l的hcl调节ph为5.8左右;每1l的ms基本培养基加入2.5mg 6-ba、25g白砂糖、5g琼脂。
44.培养时间约为5周左右;所得不定芽强壮。
45.3)、生根培养:
46.将步骤2)所得的白花前胡无菌苗上的每个长度≥0.50cm的不定芽分别进行切割,得单芽;
47.将单芽转接到生根培养基naa 0.2中,在植物组织培养室内培养,温度为24
±
1℃,直至获得根数≥5根且株高≥3.0cm的生根后白花前胡无菌组培苗;
48.此步骤3)的总培养时间约为30天;在生根培养基中培养15d后出现生根现象。
49.生根培养基naa 0.2为:1/2ms+0.2mg naa+20g白砂糖+4g琼脂,ph 5.8。
50.生根培养基naa 0.2的制备方法为:以1/2ms基本培养基(即溶液中所有物质的含量为ms基本培养基的一半)为基础,加入萘乙酸(naa)、白砂糖、琼脂,均匀混合,利用1mol/l的koh或1mol/l的hcl调节ph为5.8左右;每1l的1/2ms基本培养基加入0.2mg naa、20g白砂糖、4g琼脂。
51.4)、组培苗驯化移栽:
52.将步骤3)所得的生根后白花前胡无菌组培苗放入水培瓶内利用霍格兰营养液(hoagland nutrient solution)进行常规的水培养,水培瓶做遮光处理(避免绿藻生长),培养条件为温度24
±
1℃,当培养至株高≥15cm且根长≥10cm的根至少有5根时,结束此步骤。
53.当培养30天时,就能满足上述条件,所得如图1的右图所示,植株高度超过15cm、根系发达,因此可以结束此步骤,进行后续的常规基质栽培。
54.如果将步骤3)所得的生根后白花前胡无菌组培苗直接进行常规基质栽培,30天
时,所得结果如图1的左图所示。其生长效果明显不如本发明。
55.生长基质为按照体积比2:1:1比例混匀的泥炭、蛭石、珍珠岩。
56.对比例1-1、
57.将实施例1的步骤2)中的“扩繁培养基ba2.5”改成“扩繁培养基ba0.5”,即,6-ba的用量由2.5mg/l改为0.5mg/l。其余等同于实施例1的步骤1)~步骤2)。
58.培养6周后,扩繁培养基诱导得到不定芽2~3个,叶色浅绿,茎紫红,不定芽数量少,无玻璃化现象。
59.对比例1-2、
60.将实施例1的步骤2)中的“扩繁培养基ba2.5”改成“扩繁培养基ba 1.0”,即,6-ba的用量由2.5mg/l改为1.0mg/l。其余等同于实施例1的步骤1)~步骤2)。
61.培养6周后,扩繁培养基诱导得到不定芽4个,叶色翠绿,茎偏白。
62.对比例1-3、
63.将实施例1的步骤2)中的“扩繁培养基ba2.5”改成“扩繁培养基ba 1.5”,即,6-ba的用量由2.5mg/l改为1.5mg/l。其余等同于实施例1的步骤1)~步骤2)。
64.培养6周后,扩繁培养基诱导平均得到不定芽7个,全株翠绿,不定芽紧密矮小,不适合后续的生根培养。
65.对比例1-4、
66.将实施例1的步骤2)中的“扩繁培养基ba2.5”改成“扩繁培养基ba 2.0”,即,6-ba的用量由2.5mg/l改为2mg/l。其余等同于实施例1的步骤1)~2)。
67.培养6周后,扩繁培养基诱导平均得到不定芽5个,植株较纤弱,不适合后续的生根培养。
68.对比例1-5、
69.将实施例1的步骤2)中的“扩繁培养基ba2.5”改成“扩繁培养基ba 3.0”,即,6-ba的用量由2.5mg/l改为3mg/l。其余等同于实施例1的步骤1)~3)。
70.培养6周后,因为激素浓度过高,团聚的多数不定芽没有分化(肉眼无法分辨出茎、叶),且有严重的玻璃化现象,质地脆(操作时极易损伤)。
71.对比例2-1、
72.将实施例1的步骤3)中的“生根培养基(naa0.2)”改成“1/2ms”,其余等同于实施例1的步骤1)~3)。
73.所得结果为:在生根培养基中培养17d后才出现生根,根纤弱、数量少;培养30天后如图2的左图所示。
74.对比例2-2、
75.将实施例2的步骤3)中的“生根培养基(naa0.2)”改成“生根培养基(iba0.2)”,即,将“naa 0.2mg/l”改成“iba 0.2mg/l”,其余等同于实施例1的步骤1)~3)。
76.所得结果为:在生根培养基中培养17d后出现生根,根纤弱细长,植株总体较矮;培养30天后如图2的中图所示。
77.最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1