呈容易混合形式的具有改善的亲脂性溶解度和生物利用度的营养产品的制作方法
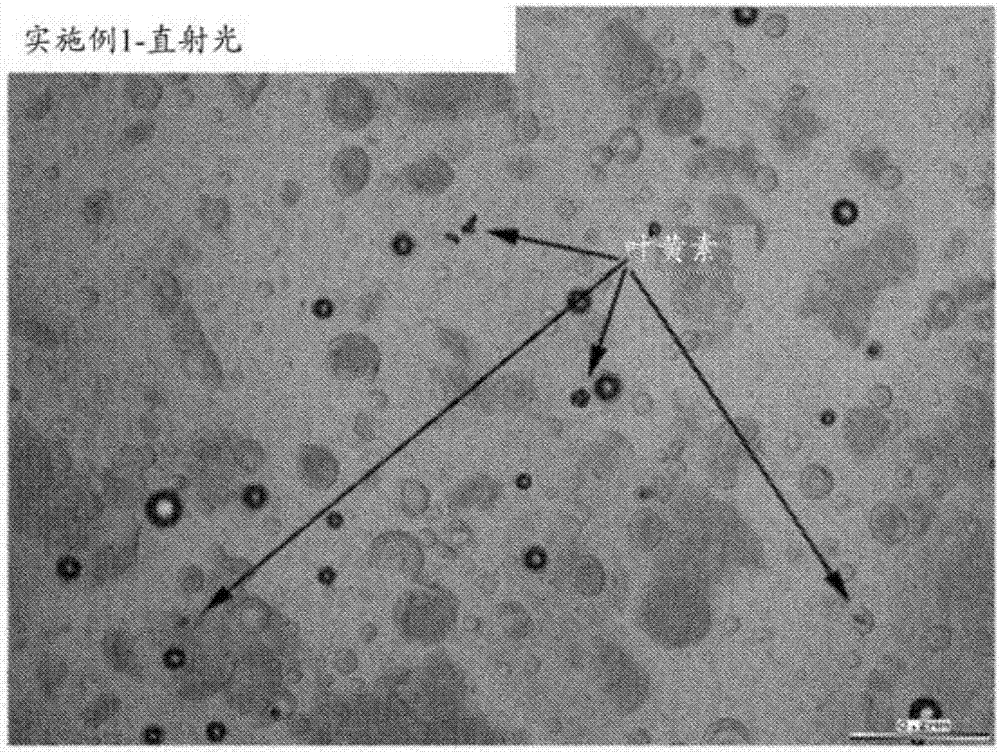
相关申请的交叉引用本申请要求2015年7月29日提交的美国临时专利申请号62/198,512的优先权和权益,所述申请的全部内容以引用的方式并入本文。领域本公开涉及用于制备包含含有亲脂性营养素的强化粉末的营养产品的方法。本公开还涉及含有亲脂性营养素的强化粉末和制备此类强化粉末的方法。这些强化粉末和含有它们的营养产品改善了强化粉末中含有的亲脂性营养素的生物利用度。背景成人、小儿和婴儿制造的营养产品可包含多种亲脂性营养素,诸如类胡萝卜素、脂溶性维生素、亲脂性抗氧化剂或其组合。包含亲脂性营养素的当前营养产品通常在食用后提供这些营养素的有限生物利用度,因为亲脂性营养素在水性混合物中不可溶或不稳定。因此,常常用亲脂性营养素过度强化营养产品,以确保可从化合物获得期望的营养益处。在一些情况下,过度强化可能是实现期望益处所需的亲脂性营养素量的约2倍至约10倍。这些高强化率可能导致生产成本的增加以及配制营养产品时的潜在复杂性,而不提供另外的消费者益处。此外,过度强化的营养产品可能以不溶的亲脂性营养素占满使用者的消化道,从而导致消化不良。发明概述在一些实施方案中,本公开涉及用于制备含有亲脂性营养素的营养产品的方法。所述方法包括将亲脂性营养素、甘油单酯和甘油二酯(mdg)油以及磷脂混合以形成第一混合物。将第一混合物与包含载体的水性液体混合,并且将所得的水性混合物干燥以形成强化粉末。这种强化粉末包含浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。将强化粉末与基础营养组合物混合以形成营养产品。在一些实施方案中,基础营养组合物或所得的营养产品可呈粉末、溶液、乳液、混悬液或凝胶的形式。在一些实施方案中,本公开涉及用于制备含有亲脂性营养素的强化粉末的方法。所述方法包括将亲脂性营养素、mdg油和磷脂混合以形成第一混合物。将第一混合物与包含载体的水性液体混合,并且将所得的水性混合物干燥以形成强化粉末。这种强化粉末包含浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。在一些实施方案中,将强化粉末与基础营养组合物进一步混合以形成营养产品。在一些实施方案中,本公开涉及一种强化粉末。所述强化粉末包含亲脂性营养素、mdg油、磷脂和载体。所述强化粉末含有浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。在一些实施方案中,将所述强化粉末与基础营养组合物混合以形成营养产品。附图简述图1是生育酚家族的化学结构。图2是如在直射光下所看到的来自实施例1的重构粉末的显微照片。图3是如在偏振光下所看到的来自实施例1的重构粉末的显微照片。图4是如在直射光下所看到的来自实施例2的重构粉末的显微照片。图5是如在偏振光下所看到的来自实施例2的重构粉末的显微照片。图6是如在直射光下所看到的来自实施例3的重构粉末的显微照片。图7是如在偏振光下所看到的来自实施例3的重构粉末的显微照片。详细描述虽然涵盖总体发明构思的实施方案可采取多种形式,但本文将描述各种实施方案,其中应理解本公开仅被认为是示例性的,并且总体发明构思不意图限于所公开的实施方案。本发明涉及用于以生物利用度更高的形式递送营养素(包括亲脂性营养素)的营养产品。制备包含亲脂性营养素、包含甘油单酯和甘油二酯的油(下文称为“mdg油”)、磷脂和载体的强化粉末并干燥。这种强化粉末用于强化营养产品,诸如在强化粉末中提供改善的亲脂性营养素生物利用度的营养产品。强化粉末使得营养组合物在不过度强化的情况下能够递送亲脂性营养素,这降低了生产成本,限制了组合物的复杂性,并且产生更合乎需要的产品。营养组合物可由婴儿、幼儿、儿童或成人摄取,从而提供正常发育、生长或营养需求所需的营养素。在一些实施方案中,本公开涉及用于制备含有亲脂性营养素的营养产品的方法。所述方法包括将亲脂性营养素、甘油单酯和甘油二酯(mdg)油以及磷脂混合以形成第一混合物。将第一混合物与包含载体的水性液体混合,并且将所得的水性混合物干燥以形成强化粉末。这种强化粉末包含浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。将强化粉末与基础营养组合物混合以形成营养产品。在一些实施方案中,基础营养组合物或所得的营养产品可呈粉末、溶液、乳液、混悬液或凝胶的形式。在一些实施方案中,本公开涉及用于制备含有亲脂性营养素的强化粉末的方法。所述方法包括将亲脂性营养素、mdg油和磷脂混合以形成第一混合物。将第一混合物与包含载体的水性液体混合,并且将所得的水性混合物干燥以形成强化粉末。这种强化粉末包含浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。在一些实施方案中,将强化粉末与基础营养组合物进一步混合以形成营养产品。在一些实施方案中,本公开涉及一种强化粉末。所述强化粉末包含亲脂性营养素、mdg油、磷脂和载体。所述强化粉末含有浓度为约6重量%至约50重量%的mdg油和浓度为约1重量%至约12重量%的磷脂。在一些实施方案中,将所述强化粉末与基础营养组合物混合以形成营养产品。出于本公开的目的,定义以下术语:除非另外说明,否则如本文所用的术语“基础营养组合物”是指添加强化粉末之前的营养组合物。基础营养组合物包含蛋白质、碳水化合物和脂肪中的至少一种,并且适于肠内施用给受试者。基础营养组合物还可包含维生素、矿物质和其他成分,并且代表唯一的、主要的或补充的营养来源。除非另外说明,否则如本文所用的术语“生物可利用的”或“生物利用度”是指通过受试者体内的体循环而可用于受试者的靶组织的营养素的量。在此上下文中,术语“生物可利用的”或“生物利用度”可具体地是指亲脂性营养素(诸如叶黄素或维生素d)被从胃肠道吸收到淋巴中,然后进入个体的血流中,使得所述物质可被吸收到体内的器官和组织中的能力。随着营养素的生物利用度的程度增加,营养素变得更可能进入并保留在血流中,在血流中所述营养素被身体吸收和使用。随着营养素的生物利用度的程度降低,营养素变得不太可能从胃肠道吸收到淋巴中,而是在进入血流之前从身体排出。除非另外说明,否则如本文所用的术语“干混”是指将干燥或半干燥的组分或成分混合以形成基础粉末,或者将干燥的粉状或粒状组分或成分添加到现有粉末以形成粉末状组合物。如本文所用的术语“肠内施用”或“经肠内施用”是指提供由受试者通过胃肠道(例如,口服或通过饲管进入胃中)摄取的组合物。这与胃肠外施用形成对比,所述胃肠外施用通过除胃肠道之外的方式(例如,静脉内)发生。除非另外说明,否则如本文所用的术语“脂肪”、“脂质”和“油”可互换地用于指源自或加工自植物或动物的脂质材料。这些术语还包括合成的脂质材料,只要此类合成材料适于施用给如本文所限定的受试者。如本文所用的术语“脂肪酸”通常是指具有包含碳原子和氢原子的长亲脂性链的羧酸。具体的脂肪酸可通过以下方式鉴定:对碳原子数目进行计数并且确定其他化学特性,诸如碳原子之间双键的存在情况和位置、从主亲脂性链出来的任何碳原子支化情况和链中其他原子种类的存在情况。脂肪酸可描述为“饱和的”(碳链中的碳原子之间不存在双键)、“单不饱和的”(碳链中的碳原子之间存在一个双键)或“多不饱和的”(碳链中的碳原子之间存在多于一个双键)。出于本公开的目的,“游离脂肪酸”是指未键合的脂肪酸分子,而“脂肪酸基团”是指键合到其他分子的脂肪酸部分。出于本公开的目的,脂肪酸基团优选地键合到甘油分子以形成甘油酯。出于本公开的目的,除非另外说明,否则“脂肪酸”是指组合物中的游离脂肪酸和脂肪酸基团两者。除非另外说明,否则如本文所用的术语“强化粉末”是指呈粉末形式的含有一种或多种亲脂性营养素的添加剂。将强化粉末与组合物混合以用亲脂性营养素强化组合物。添加强化粉末的组合物可以是营养组合物,或者可以是由受试者经肠内食用的另一种产品(例如,咖啡、茶、思慕雪或食品)。具体地,出于本公开的目的,强化粉末包含一种或多种亲脂性营养素、mdg油、磷脂和载体。如本文所用的术语“甘油酯”通常是指包含键合到脂肪酸基团的甘油分子的亲脂性营养素。甘油单酯是键合到单个脂肪酸基团的甘油分子;甘油二酯是键合到两个脂肪酸基团的甘油分子;并且甘油三酯是键合到三个脂肪酸基团的甘油分子。脂肪和油包含甘油酯,并且来自动物、鱼类、藻类、植物或种子来源的典型脂肪和油主要由甘油三酯组成。除非另外说明,否则如本文所用的术语“婴儿”是指约36月龄或更小的人。除非另外说明,否则如本文所用的术语“幼儿”是指约12月龄至约3岁的人。除非另外说明,否则如本文所用的术语“儿童”是指约3岁至约18岁的人。除非另外说明,否则如本文所用的术语“青少年”是指约10岁至约18岁的人。除非另外说明,否则如本文所用的术语“成人”是指约18岁或更大的人。除非另外说明,否则如本文所用的术语“老年人”是指约50岁或更大的人。如本文所用的术语“亲脂性营养素”是指在有机溶剂(诸如乙醇、甲醇、乙醚、丙酮、氯仿、苯或脂质)中具有的溶解度比在水中具有的溶解度更大的组分。维生素a、维生素e、维生素d、叶黄素、玉米黄质和番茄红素是亲脂性营养素的实例。出于本公开的目的,术语“亲脂性营养素”可适用于其他亲脂性营养素,包括但不限于药物化合物。如本文所用的术语“甘油单酯和甘油二酯油”或“mdg油”是指包含甘油单酯和甘油二酯并且基于mdg油的重量含有0重量%至约20重量%甘油三酯的油。mdg油包含可以是饱和或不饱和的脂肪酸。基于总脂肪酸的百分比,mdg油中约60%至约98%的脂肪酸是不饱和的,并且mdg油中小于约10%的脂肪酸是多不饱和的。mdg油中至少约70%的脂肪酸含有14至24个碳原子。除非另外说明,否则如本文所用的术语“营养组合物”是指包含蛋白质、碳水化合物和脂肪中的至少一种并且适于肠内施用给受试者的营养粉末、固体、半固体、液体和半液体。营养组合物还可包含维生素、矿物质和其他成分,并且代表唯一的、主要的或补充的营养来源。如本文所用的术语“营养产品”是指呈粉末形式的营养组合物。营养产品包含蛋白质、碳水化合物和脂肪中的至少一种,并且适于肠内施用给受试者。营养产品还可包含维生素、矿物质和其他成分,并且代表唯一的、主要的或补充的营养来源。营养产品还可包含强化粉末。如本文所用的术语“重构(reconstitute)”或“重构(reconstitution)”是指与水或另一种水性液体混合以形成液体组合物或液体营养组合物的粉末。如本文所用的术语“粉末”描述组合物或其部分的物理形式,其为可流动或可勺取的细分微粒固体。如本文所用的术语“受试者”是指摄取组合物的哺乳动物,包括但不限于人类、驯养家畜(例如,牛、马或猪)或宠物(例如,狗或猫)。除非另外定义,否则本文所用的所有技术和科学术语均具有与本领域普通技术人员通常理解的相同的含义。如有冲突,将以本文件(包括定义)为准。下文描述了优选的方法和材料,尽管在营养组合物的实践或测试中可使用与本文所述的方法和材料相似或等效的方法和材料。本文所提及的所有公布、专利申请、专利以及其他参考文献均以引用的方式整体并入。本文所公开的材料、方法和实施例仅是例示性的,并且不意图为限制性的。如本文所用,术语“包含(comprise)”、“包括(include)”、“具有(having)”、“具有(has)”、“可以(can)”、“含有(contain)”及其变化形式意图是不排除另外行为或结构的可能性的开放式连接词、术语或词语。除非上下文另外清楚地说明,否则单数形式“一个/种(a)”、“一个/种(an)”和“所述(the)”包括复数引用。本公开还涵盖“包括本文所呈现的实施方案或要素”、“由本文所呈现的实施方案或要素组成”以及“基本由本文所呈现的实施方案或要素组成”的其他实施方案,无论是否明确地提出。此外,对于所采用的术语“或(or)”(例如,a或b)来说,其旨在表示“a或b或两者”。当申请人意图指示“仅a或b而不是两者”时,则将采用术语“仅a或b而不是两者”。因此,在本文中术语“或”的使用是包括性的,而不是排他性的使用。除非另外说明,否则如本文所用的所有百分比、份数和比率均按总产品的重量计。所有此类重量在其涉及所列举的成分时均基于活性成分,并且因此,除非另外说明,否则不包括可包括在可商购获得的材料中的溶剂或副产物。除非另外说明或由作出参考组合的上下文清楚地进行相反的暗示,否则如本文所用的方法或工艺步骤的所有组合可以任何顺序进行。本文所公开的所有范围和参数(包括但不限于百分比、份数和比率)均应理解为涵盖其中假定和包括的任何和所有子范围以及端点之间的每个数字。例如,所陈述的“1至10”的范围应被认为是包括以最小值1或更大开始并以最大值10或更小结束的任何和所有子范围(例如,1至6.1或2.3至9.4)以及所述范围内包含的每个整数(1、2、3、4、5、6、7、8、9和10)。本公开的组合物的各种实施方案可包含痕量的本文所述的任何任选或所选的必需成分或特征,前提条件是剩余制剂仍含有如本文所述的所有所需的成分或特征。在此上下文中并且除非另外说明,否则术语“痕量”意指所选制剂含有按组合物的重量计不超过2重量%的任选成分,通常小于1重量%,并且还包含百分之零的此类任选或所选的必需成分。本公开的组合物的各种实施方案还可基本上不含本文所述的任何任选的成分或特征,前提条件是剩余组合物仍含有本文所述的所有所需的成分或特征。在此上下文中并且除非另外说明,否则术语“基本上不含”意指所选组合物含有小于功能量的任选成分,按组合物的重量计通常小于约1重量%,包括小于约0.5重量%,包括小于约0.1重量%,并且还包括百分之零的这种任选成分。组合物可包含以下项、由或基本上由以下项组成:本文所述产品的必需元素,以及本文所述的或以其他方式用于产品应用中的任何另外的或任选的元素。强化粉末如上所讨论,本公开涉及包含强化粉末的营养产品。在某些实施方案中,给出了制备包含强化粉末的营养产品的方法。在某些实施方案中,给出了制备强化粉末的方法。在某些实施方案中,给出了适用于营养组合物的强化粉末。本公开的强化粉末包含至少一种亲脂性营养素、mdg油、磷脂和载体。将强化粉末干燥以形成干燥粉末成分,其可立即添加到营养组合物。可替代地,可将强化粉末包装并储存用于将来使用。本公开的强化粉末从制造和配制两个角度均是有利的。所述强化粉末可批量生产并储存用于以后使用,这改善了制造效率。强化粉末可在制造工艺其中可添加干燥成分的任何适宜阶段与营养组合物混合,从而简化营养组合物的制造过程。通常,在制造营养组合物期间,在添加到营养组合物之前将亲脂性营养素溶解或悬浮在液化的递送油中。常常必须加热递送油以使油液化、降低油的粘度或增强亲脂性营养素的溶解度或分散性。就在添加到营养组合物之前,还必须将液化的递送油和亲脂性营养素充分混合,以确保亲脂性营养素均匀地溶解或分散在递送油中。亲脂性营养素均匀分散在递送油中对于帮助亲脂性营养素均匀分散在营养组合物中是重要的。然而,就在将亲脂性营养素和递送油添加到营养组合物之前,加热或液化递送油、添加亲脂性营养素以及充分混合递送油和亲脂性营养素的这些步骤增加了营养组合物的制造过程的设备和工艺复杂性。相比之下,本公开的强化粉末可单独地制造,任选地储存,并且在向营养组合物添加其他固体或粉状成分的任何合适的点添加到营养组合物。强化粉末可具有延长的保质期。这种延长的保质期意味着强化粉末可批量制备,然后储存用于将来使用。如先前所讨论,储存的强化粉末可在制造工艺的任何合适的阶段容易地添加到营养组合物。批量制备强化粉末改善了制造效率并降低了强化粉末和含有强化粉末的营养组合物的成本。强化粉末可在23℃下稳定至少约1天至至少约48个月。强化粉末可在23℃下稳定至少约1天至至少约36个月。强化粉末可在23℃下稳定至少约10天至至少约36个月。强化粉末可在23℃下稳定至少约6个月至至少约12个月。强化粉末可在23℃下稳定至少约1天至至少约24个月。强化粉末可在23℃下稳定至少约1天、2天、3天、4天、5天、6天、7天、10天、14天、21天、28天、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、15个月、18个月、21个月、24个月、27个月、30个月、33个月、36个月、39个月、42个月、48个月或大于48个月。在一些实施方案中,在将mdg油和亲脂性营养素与强化粉末的其他成分共混之前,可能期望将亲脂性营养素与mdg油混合。可在加热存在下或在环境温度下并且在一些实施方案中在搅拌下,将亲脂性营养素与mdg油混合以使亲脂性营养素溶解、分散或悬浮在mdg油中。在一些实施方案中,可能期望将mdg油、亲脂性营养素和磷脂混合以形成第一混合物,之后将这种第一混合物与强化粉末的其他成分混合。为了制备第一混合物,可在加热存在下或在环境温度下并且在一些实施方案中在搅拌下,将亲脂性营养素和磷脂与mdg油混合以使亲脂性营养素和磷脂溶解、分散或悬浮在mdg油中。在一些实施方案中,可能期望将mdg油和磷脂共混,之后将亲脂性营养素与含有磷脂的mdg油共混。在这些实施方案中,可在加热存在下或在环境温度下并且在一些实施方案中在搅拌下,将磷脂与mdg油混合以使磷脂溶解、分散或悬浮在mdg油中。然后可在加热存在下或在环境温度下并且在一些实施方案中在搅拌下,将亲脂性营养素与含有磷脂的mdg油混合以使亲脂性营养素溶解、分散或悬浮在含有磷脂的mdg油中。亲脂性营养素强化粉末包含至少一种亲脂性营养素。已知当将亲脂性营养素掺入到营养组合物中时,所述亲脂性营养素在受试者食用营养组合物时可能是生物利用度差的。然而,通过将亲脂性营养素与mdg油、磷脂和载体一起掺入强化粉末中,亲脂性营养素可在强化粉末或营养组合物中更稳定,并且在被受试者食用时生物利用度更高。示例性亲脂性营养素包括叶黄素、玉米黄质、虾青素、α-或β-隐黄质、β-胡萝卜素、其他类胡萝卜素、辅酶q10、油溶性维生素(例如,合成或天然形式的维生素a、e、d或k)、番茄红素或其组合。亲脂性营养素可以是长链多不饱和脂肪酸(lcpufa)的来源。lcpufa的一些实例包括但不限于亚油酸(18:2n-6)、α-亚麻酸(18:3n-3)、γ-亚麻酸(18:3n-6)、十八碳四烯酸(18:4n-3)、二高-γ-亚麻酸(20:3n-6)、二十碳四烯酸(20:4n-3)、花生四烯酸(“ara”,20:4n-6)、二十碳五烯酸(“epa”,20:5n-3)和二十二碳六烯酸(“dha”,22:6n-3)。据设想,本公开的亲脂性营养素还可以是亲脂性药剂。可包括在本发明组合物中的亲脂性药剂的合适的非限制性实例可选自:油溶性药物(例如,诸如环孢素的免疫抑制剂、诸如ritonavirtm的蛋白酶抑制剂、大环内酯类抗生素和诸如propofoltm的油溶性麻醉剂);合成和天然形式的甾体激素,诸如雌激素、雌二醇、黄体酮、睾酮、可的松、植物雌激素、脱氢表雄酮(dhea)和生长激素;油溶性酸和醇(例如,酒石酸、乳酸、丁基化羟基苯甲醚、丁基化羟基甲苯、木质素、植物甾醇、诸如槲皮素和白藜芦醇的类黄酮以及二烯丙基二硫化物);及其组合。另外的亲脂性药剂可在美国专利申请号13/452,033中发现,所述申请于2012年4月20日提交并且据此以引用的方式以与本公开一致的程度并入。亲脂性营养素是婴儿、幼儿、儿童和成人的宝贵营养来源。亲脂性营养素的实例及其特性如下。叶黄素本公开的强化粉末可包含叶黄素,其生物利用度根据本公开进行改善。叶黄素属于称为类胡萝卜素的抗氧化剂类。除非另外说明,否则如本文所用的术语“叶黄素”是指游离叶黄素、叶黄素酯、叶黄素盐或如本文所述的其他叶黄素衍生物或相关结构中的一种或多种。适用于本发明的强化粉末的叶黄素或叶黄素来源包括游离叶黄素以及酯、盐或具有以下化学式的其他衍生物或相关结构:以上化学式包括叶黄素的一般结构和相关的衍生物或结构。例如,游离叶黄素对应于其中r1和r2两者均是氢的式,并且包括其顺式和反式异构体及其盐,例如钠或钾盐。适用于本公开的强化粉末的叶黄素酯包括上式的任何叶黄素酯(其中r1和r2是相同的或不同的),并且是营养上可接受的单价盐、氢或羧酸基团,前提条件是r1和r2中的至少一个是羧酸基团。合适的叶黄素酯包括顺式异构体和反式异构体。r1和r2部分可以是饱和或不饱和的c1至c22脂肪酸基团,其非限制性实例包括甲酸、乙酸、丙酸、丁酸、戊酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸和油酸。叶黄素存在于眼睛中,特别是在视网膜中,它在那里保护视网膜免受氧化损伤。叶黄素对婴儿的视力发育以及儿童和成人的视网膜健康是重要的。叶黄素与年龄相关性白内障和黄斑变性的风险降低相关联。叶黄素的任何天然或合成来源均适用于本文所公开的强化粉末,前提条件是此类来源适用于可摄取组合物并且与组合物中的其他成分相容。叶黄素可作为单独的成分提供,或以与其他材料或来源(包括诸如混合的类胡萝卜素预混物的来源)的任何组合提供。例如,叶黄素可以与其他类胡萝卜素(诸如玉米黄质、虾青素或β-胡萝卜素)的混合物提供。用于本文的合适的叶黄素来源的非限制性实例包括购自keminindustries,inc.,desmoines,iowa,usa的结晶叶黄素和购自basf,ludwigshafen,germany的叶黄素5%dc。为了在本公开的强化粉末中提供有效量的叶黄素和mdg油,叶黄素以相对于mdg油量的量存在于给定强化粉末中。强化粉末中的叶黄素量与mdg油量的比率应为约0.0003:1至约0.04:1(叶黄素重量:mdg油重量)。例如,叶黄素可以每1gmdg油约0.3mg、约0.5mg、约0.8mg、约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg或约40mg叶黄素的量存在于强化粉末中。叶黄素与mdg油的其他比率在本公开的范围内。基于本文的公开,本领域技术人员可计算出将允许有效量的叶黄素和mdg油掺入到强化粉末中的合适的比率。在含有叶黄素的强化粉末中,叶黄素以将在强化粉末中或可替代地在待用强化粉末强化的营养组合物中提供有效量的叶黄素的量存在于强化粉末中。例如,基于强化粉末的总重量,叶黄素可以约0.01重量%、约0.025重量%、约0.05重量%、约0.1重量%、约0.2重量%、约0.25重量%、约0.5重量%、约0.75重量%、约1重量%、约1.25重量%、约1.5重量%、约1.75重量%或约2重量%的叶黄素的量存在。基于本文的公开,本领域技术人员可计算出将允许有效量的叶黄素掺入到强化粉末中的合适的量。维生素d本公开的强化粉末可包含维生素d,其生物利用度根据本公开进行改善。“维生素d”是指与类固醇相关的一组亲脂性营养素或“类维生素”。术语“维生素d”涵盖若干种类维生素,但其中最重要的是麦角钙化醇,也称为维生素d2:和胆钙化醇,也称为维生素d3:出于本公开的目的,除非另外说明,否则如本文所用的术语“维生素d”涵盖所有形式的维生素d,无论是作为单独的类维生素(诸如维生素d2或维生素d3),还是作为两种或更多种类维生素的组合。维生素d可从饮食中摄取,并且维生素d3还通过胆固醇与来自阳光的uv辐射反应而在哺乳动物皮肤中合成。一旦进入体内,维生素d类维生素被代谢成调节血流中钙和磷酸盐浓度并且促进骨骼健康生长和维持的其他化学形式。维生素d的任何天然或合成来源均适用于本文所公开的强化粉末,前提条件是这种来源适用于可摄取组合物并且与组合物中的其他成分相容。维生素d可作为单独的成分提供,或以与其他材料或来源(包括诸如多种维生素预混物的来源)的任何组合提供。例如,维生素d可与其他油溶性维生素(诸如维生素a、维生素e或维生素k)混合。用于本文的合适的维生素d来源的非限制性实例包括由basf公司(florhampark,newjersey,usa)提供的维生素d3、由fermentabiotech公司(kullu,himachalpradesh,india)提供的维生素d3或由dsmnutritionalproductsag(kaiseraugst,switzerland)提供的为了在本公开的强化粉末中提供有效量的维生素d和mdg油,维生素d以相对于mdg油量的量存在于给定组合物中。组合物中的维生素d量与mdg油量的比率应为每100克mdg油约20μg维生素d至每100克mdg油约50mg维生素d。例如,维生素d可以每100gmdg油约20μg、约50μg、约100μg、约250μg、约500μg、约1mg、约5mg、约10mg、约15mg、约20mg、约25mg或约50mg维生素d的量存在于组合物中。维生素d与mdg油的其他比率在本公开的范围内。基于本文的公开,本领域技术人员可计算出将允许有效量的维生素d和mdg油掺入到组合物中的合适的比率。在含有维生素d的强化粉末中,维生素d以将在强化粉末中或可替代地在待用强化粉末强化的营养组合物中提供有效量的维生素d的量存在于强化粉末中。例如,维生素d可以每1kg强化粉末约50μg、约100μg、约500μg、约1mg、约5mg、约10mg、约25mg、约50mg、约75mg、约100mg或约125mg维生素d的量存在。基于本文的公开,本领域技术人员可计算出将允许有效量的维生素d掺入到强化粉末中的合适的量。维生素e和生育酚本公开的强化粉末可包含维生素e。术语“维生素e”涵盖称为生育酚的相关化学物质家族。生育酚包括色满环和植基尾,符合图1所示的化学结构。生育酚包括rrr-α-生育酚(有时也称为“天然维生素e”)和全-外消旋-α-生育酚(有时称为“合成维生素e”)。生育酚可用的有四种形式:α、β、γ和δ,它们的不同之处在于色满环上的甲基(“me”)的数目和位置(参见下表1)。α-生育酚是最常称为“维生素e”的生育酚,并且是生育酚家族中最熟知和研究最多的。然而,生育酚的β、γ和δ形式也可能在体内具有维生素e型特性,并且美国饮食实际上含有比α-生育酚更多的γ-生育酚。表1化合物r1r2r3α-生育酚mememeβ-生育酚mehmeγ-生育酚hmemeδ-生育酚hhme由于分子结构中的三个手性碳(在图1中由星号(“*”)标出),生育酚可以多种立体异构体形式存在。每个手性碳具有两种可能的构型,r或s,所以三个手性碳的存在意味着生育酚分子有八种不同的立体异构体(rrr、sss、rsr、srs等)。天然维生素e是单一立体异构体rrr-α-生育酚。rrr-α-生育酚具有立体异构体的最大生物活性,并且据报道是大脑中α-生育酚的主导形式。然而,当合成生产α-生育酚时,制造方法并不优先形成任何特定的立体异构体。相反,合成的α-生育酚含有基本上相等量的所有八种立体异构体,其中仅一种是rrr-α-生育酚。在100g合成的α-生育酚中,每种立体异构体占总量的约12.5g。因为合成的α-生育酚由所有八种立体异构体组成,所以它也称为“外消旋-”或全-外消旋-α-生育酚。生育酚是强大的抗氧化剂,其将活性氧物质和自由基在这些氧化剂可对活细胞造成损伤之前清除。生育酚特别有用,因为它们是亲脂性的,并且因此可保护细胞的脂肪结构(诸如细胞壁)免受氧化损伤。认为α-生育酚可预防或减轻与氧化应激相关联的许多医学和生物学问题。除了其抗氧化特性之外,认为α-生育酚可减少炎症。生育酚易于随时间反应和降解,特别是在纯化和长期储存时。生育酚酯对于长期储存更稳定,并且因此用于营养补充剂和用于强化加工食品的生育酚常常呈生育酚乙酸酯或生育酚琥珀酸酯的形式。然而,一旦摄取,生育酚酯在消化道中迅速转化回游离生育酚。早已知道α-生育酚的立体异构体的生物活性不同,其中rrr-α-生育酚是最具生物活性的形式。公认的营养指南认为,rrr-α-生育酚比全-外消旋-α-生育酚的生物活性高1.36倍。最近的研究已表明,rrr-α-生育酚的生物活性实际上可能甚至更高,也许是全-外消旋-α-生育酚活性的约2倍。这种生物活性的差异并不是因为rrr-α-生育酚本质上是比其他立体异构体更好的抗氧化剂。体外研究已显示,α-生育酚的所有立体异构体均同等地与氧化性化学物质(诸如过氧化物)反应。相反,rrr-α-生育酚似乎比其他立体异构体的生物利用度更高。与sxx-α-生育酚立体异构体相比,四种rxx-α-生育酚立体异构体优先地从肝转移到极低密度脂蛋白(vldl)中,然后转移到血浆和红细胞中。一旦进入血流,其他器官(诸如大脑)优先地吸收rrr-α-生育酚立体异构体。因此,与存在于全-外消旋-α-生育酚中的其他立体异构体相比,人体的某些代谢系统主动且优先地吸收rrr-α-生育酚。α-生育酚存在于许多植物油(诸如向日葵油、红花油和橄榄油)中。α-生育酚还可存在于种子、坚果和一些蔬菜(诸如菠菜)中。存在于食物中的α-生育酚的形式是单一立体异构体rrr-α-生育酚。维生素e的任何天然或合成来源(以生育酚的单一立体异构体的任何组合或立体异构体的混合物)均适用于本文所公开的强化粉末,前提条件是这种来源适用于可摄取组合物并且与组合物中的其他成分相容。维生素e可作为单独的成分提供,或以与其他材料或来源(包括诸如多种维生素预混物的来源)的任何组合提供。例如,维生素e可与其他油溶性维生素(诸如维生素a、维生素d或维生素k)混合。用于本文的合适的维生素e来源的非限制性实例包括由zmc-usa(thewoodlands,texas,usa)提供的维生素e、由parchemfinechemicals(newrochelle,newyork,usa)提供的维生素e或由dsmnutritionalproductsag(kaiseraugst,switzerland)提供的为了在本公开的强化粉末中提供有效量的维生素e和mdg油,维生素e以相对于mdg油量的量存在于给定组合物中。组合物中的维生素e量与mdg油量的比率应为约0.0006:1至约0.25:1(维生素e重量:mdg油重量)。例如,维生素e可以每100gmdg油约60mg、约100mg、约150mg、约200mg、约250mg、约500mg、约1g、约5g、约10g、约15g、约20g或约25g维生素e的量存在于组合物中。维生素e与mdg油的其他比率在本公开的范围内。基于本文的公开,本领域技术人员可计算出将允许有效量的维生素e和mdg油掺入到组合物中的合适的比率。在含有维生素e的强化粉末中,维生素e以将在强化粉末中或可替代地在待用强化粉末强化的营养组合物中提供有效量的维生素e的量存在于强化粉末中。例如,维生素e可以每1g强化粉末约0.15mg、约0.25mg、约0.5mg、约0.75mg、约1mg、约5mg、约10mg、约25mg、约50mg、约75mg、约100mg、约125mg或约250mg维生素e的量存在。基于本文的公开,本领域技术人员可计算出将允许有效量的维生素e掺入到强化粉末中的合适的量。dha本公开的强化粉末可包含dha,其生物利用度根据本公开进行改善。dha是lcpufa,一种在亲脂性链中具有22个碳原子的ω-3脂肪酸,通常存在于例如冷水鱼和藻类中:dha是人脑、大脑皮层和视网膜的主要结构组分,并且是婴儿和婴孩的眼睛、大脑和神经系统正常发育的必需脂肪酸。母乳含有dha,并且许多婴儿配方富含dha,因为它在婴儿的这些系统的生长和发育中起着至关重要的作用。对为孕妇提供补充dha的兴趣日益增长。据信,dha降低了发展泪腺性角膜结膜炎、青光眼和黄斑变性的风险。dha也是成人的健康大脑功能所需的。dha缺乏可能导致健康老年人的精神功能下降,并且初步研究表明,早期用dha补充剂干预可改善50岁以上成人的记忆力和学习能力。dha的任何天然或合成来源均适用于本文所公开的强化粉末,前提条件是这种来源适用于可摄取组合物并且与组合物中的其他成分相容。dha可作为单独的成分提供,或以与其他材料或来源(包括诸如含有其他lcpufa的油的来源)的任何组合提供。例如,dha可与含有其他lcpufa的其他油(诸如鱼油)混合或混合在多种维生素混合物中。用于本文的合适的dha来源的非限制性实例包括购自dsmnutritionalproducts,kaiseraugst,switzerland的life’s和购自basfpharma公司,callanish,scotland的maxomegatmdha。为了在本公开的强化粉末中提供有效量的dha和mdg油,dha以相对于mdg油量的量存在于给定组合物中。组合物中的dha量与mdg油量的比率应为约0.06:1至约9.5:1(dha重量:mdg油重量)。例如,dha可以每100gmdg油约6g、约10g、约20g、约30g、约50g、约100g、约200g、约300g、约400g、约500g、约600g、约700g、约800g、约800g或约950gdha的量存在于组合物中。dha与mdg油的其他比率在本公开的范围内。基于本文的公开,本领域技术人员可计算出将允许有效量的dha和mdg油掺入到组合物中的合适的比率。在含有dha的强化粉末中,dha以将在强化粉末中或可替代地在待用强化粉末强化的营养组合物中提供有效量的dha的量存在于强化粉末中。例如,dha可以每1g强化粉末约10mg、约15mg、约20mg、约25mg、约50mg、约75mg、约100mg、约125mg或约250mgdha的量存在。基于本文的公开,本领域技术人员可计算出将允许有效量的dha掺入到强化粉末中的合适的量。甘油单酯和甘油二酯油如先前所讨论,本公开的强化粉末包含mdg油,其包含甘油单酯和甘油二酯的共混物(“mdg油”)。甘油单酯是由通过酯键键合到甘油分子的一个脂肪酸基团组成的甘油酯。甘油单酯是在甘油三酯和甘油二酯分解期间形成的身体中的正常代谢物。甘油二酯是由通过酯键键合到甘油分子的两个脂肪酸基团组成的甘油酯。甘油单酯和甘油二酯的商业来源的非限制性实例包括天然来源或合成来源。天然来源包括动物脂肪,诸如源自动物(例如,源自牛或猪)的甘油酯;或植物油,诸如源自玉米油、大豆油、向日葵油、红花油或椰子油的甘油酯。在一些实施方案中,mdg油中甘油单酯和甘油二酯的混合物可源自红花油、玉米油或向日葵油中甘油三酯的水解。按强化粉末的重量百分比,根据本公开的强化粉末可以约6重量%至约50重量%,包括约6.5重量%至约50重量%、包括约7重量%至约45重量%、包括约7.5重量%至约42重量%、包括约8重量%至约40重量%、包括约8.5重量%至约37重量%、包括约9重量%至约35重量%、包括约9.5重量%至约30重量%、包括约10重量%至约25重量%以及还包括约15重量%至约20重量%mdg油的量包含mdg油。在一些实施方案中,按强化粉末的重量百分比,组合物可包含约12.5重量%至约22重量%的mdg油。按mdg油的重量计,根据本公开的mdg油以至少5重量%,包括约5重量%至约95重量%、包括约20重量%至约80重量%、包括约25重量%至约60重量%、包括约30重量%至约55重量%、包括约32重量%至约52重量%以及包括约36重量%至约47重量%的量包含甘油单酯。按mdg油的重量计,mdg油中的甘油二酯占至少约5重量%,包括约5重量%至约95重量%、包括约10重量%至约80重量%、包括约20重量%至约70重量%、包括约22重量%至约64重量%、包括约40重量%至约60重量%以及包括约45重量%至约55重量%。在一些实施方案中,mdg油可包含甘油三酯。在优选的实施方案中,按mdg油的重量计,甘油三酯占不超过约20重量%、不超过约15重量%、不超过约10重量%、不超过约5重量%、不超过约2重量%或不超过约1重量%。mdg油还可包含游离脂肪酸和游离甘油。按mdg油的重量计,游离脂肪酸和游离甘油通常占小于约10重量%、优选地小于5重量%、更优选地小于2重量%。按mdg油的重量计,mdg油的示例性实施方案可由或基本上由甘油单酯、甘油二酯和不超过约20重量%的甘油三酯组成。mdg油的其他示例性实施方案可由或基本上由甘油单酯和甘油二酯组成。对于根据本公开的mdg油,甘油单酯、甘油二酯和甘油三酯中的脂肪酸基团可以是相同的或不同的。类似地,mdg油中的任何游离脂肪酸可与甘油单酯、甘油二酯或甘油三酯中的脂肪酸基团相同或不同。根据本公开的mdg油可包含在其亲脂性链中含有至少14个碳原子的脂肪酸。优选地,这些脂肪酸含有14至24个碳原子。更优选地,这些脂肪酸含有14至20个碳原子。这些脂肪酸可选自由以下项组成的组:肉豆蔻酸、棕榈酸、硬脂酸、花生酸、二十二烷酸、棕榈油酸、油酸、亚油酸、α-亚麻酸、γ-亚麻酸、十八碳四烯酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸及其组合。含有14至24个碳原子链长的脂肪酸可占mdg油中脂肪酸的至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。优选地,mdg油主要包含在亲脂性链中具有18个碳原子的脂肪酸。具有18个碳原子的脂肪酸可选自由以下项组成的组:硬脂酸、油酸、亚油酸、α-亚麻酸、γ-亚麻酸、十八碳四烯酸及其组合。按脂肪酸的百分比计,mdg油可包含约50%至约95%、优选地约60%至约95%的在亲脂链中具有18个碳的脂肪酸,然而,前提条件是任何链长的多不饱和脂肪酸在mdg油中提供小于约10%的脂肪酸。根据本公开的mdg油可包含单不饱和脂肪酸。单不饱和脂肪酸可选自由以下项组成的组:棕榈油酸、油酸及其组合。单不饱和脂肪酸可占mdg油中脂肪酸基团的至少约50%、至少约55%、至少约60%、至少约64%、至少约68%、至少约70%、至少约75%、至少约80%或至少约85%。根据本公开的mdg油还可包含多不饱和脂肪酸。多不饱和脂肪酸占mdg油中脂肪酸的小于约10%,优选地小于mdg油中脂肪酸的约8%、更优选地小于mdg油中脂肪酸的约5%。mdg油还可包含痕量的其他添加剂,诸如抗氧化剂、表面活性剂、乳化剂、风味剂、着色剂和稳定剂。此类添加剂的使用是本领域熟知的。磷脂如先前所讨论,本公开的强化粉末包含至少一种磷脂。磷脂是与甘油三酯相关的,因为它们具有甘油骨架,其中两个脂肪酸基团和一个磷酸基团连接到甘油。极性分子也连接到磷酸基团。极性分子和磷酸基团在磷脂分子的一端形成亲水性区域,而两个脂肪酸在磷脂分子的另一端形成亲脂性(即,疏水性)区域。因此,磷脂可具有乳化特性和表面活性剂特性。磷脂构成生物细胞膜的重要组分。示例性磷脂包括但不限于卵磷脂、胆碱、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酸、磷脂酰丝氨酸、溶血磷脂及其组合。胆碱强化粉末中的磷脂可包括胆碱。胆碱可充当强化粉末中的营养素以及增强亲脂性营养素的生物利用度的试剂。胆碱充当用于生物合成其他甲基化产物的甲基的来源。它是神经递质乙酰胆碱的前体。已证明,施用胆碱对患有与有缺陷的胆碱能神经传递相关的任何病症的患者是有益的。胆碱与卵磷脂也是磷脂和鞘磷脂的主要组分。由于其在膜结构中的基本功能,胆碱缺陷引起临床上表现为脂肪肝、肾损伤(出血性肾坏死)和脂蛋白代谢受损的整个范围的磷脂异常。在饮食胆碱缺乏的情况下,胆固醇酯和脂肪在肝中积累。在美国联邦法规中提到氯化胆碱和胆碱酒石酸氢盐作为营养/膳食补充剂已被授予gras状态(一般认为是安全的)。胆碱可在制备强化粉末期间的不同阶段添加到强化粉末。例如,在一个实施方案中,可将mdg油与亲脂性营养素混合,并且然后将胆碱添加到mdg油混合物。在另一个实施方案中,可将mdg油、亲脂性营养素和胆碱混合以形成混合物。在另一个实施方案中,可将mdg油与胆碱混合,并且然后将亲脂性营养素添加到mdg油混合物。按强化粉末的重量百分比,胆碱可为强化粉末的约1重量%至约12重量%。按强化粉末的重量百分比,胆碱可为强化粉末的约1.1重量%至约11重量%,包括约1.2重量%至约10重量%、约1.4重量%至约9重量%、约1.5重量%至约8重量%、约1.7重量%至约7重量%、约1.8重量%至约6重量%、约1.9重量%至约5重量%、约2重量%至约4.5重量%、约2.2重量%至约4.3重量%、约2.4重量%至约4.1重量%、约2.6重量%至约4重量%、约2.8重量%至约3.8重量%以及约3.0重量%至约3.5重量%。按强化粉末的重量百分比,胆碱可为强化粉末的约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%、约1.5重量%、约1.6重量%、约1.7重量%、约1.8重量%、约1.9重量%、约2.0重量%、约2.3重量%、约2.5重量%、约2.7重量%、约2.9重量%、约3重量%、约3.1重量%、约3.3重量%、约3.5重量%、约3.7重量%、约3.9重量%、约4重量%、约4.1重量%、约4.3重量%、约4.5重量%、约4.7重量%、约4.9重量%、约5重量%、约5.5重量%、约6重量%、约6.5重量%、约7重量%、约7.5重量%、约8重量%、约8.5重量%、约9重量%、约9.5重量%、约10重量%、约11重量%以及约12重量%。卵磷脂强化粉末中的磷脂可包括卵磷脂。卵磷脂可充当强化粉末中的营养素来源以及增强亲脂性营养素的生物利用度的试剂。卵磷脂主要是甘油磷脂(例如,磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇)的混合物。磷脂酰胆碱通常为主要的甘油磷脂组分。卵磷脂还可含有其他化合物诸如游离脂肪酸、甘油单酯、甘油二酯、甘油三酯、糖酯和其他含有脂质/脂肪酸的化合物。卵磷脂有时分类为甘油磷脂(glycerolphospholipid)或甘油磷脂(glycerolphosphatide)。这类化合物具有两亲特性并且因此具有乳化功能性。卵磷脂由美国食品和药品管理局批准用于人类食用,状态为“generallyrecognizedassafe”。适用于本文的卵磷脂的非限制性实例包括蛋卵磷脂、小麦卵磷脂、玉米卵磷脂、大豆卵磷脂、改性卵磷脂及其组合。卵磷脂可以脱油形式或液体形式提供,或者以富含磷脂酰胆碱的形式提供。另外,卵磷脂可源自包括但不限于以下项的来源:有机大豆、菜籽油、脱脂乳或乳清蛋白。在一个实施方案中,强化粉末可包含脱油卵磷脂,其中脱油卵磷脂包含:约1%水;约3%甘油三酯;约24%磷脂酰胆碱;约20%磷脂酰乙醇胺;约14%磷脂酰肌醇;约7%磷脂酸;约8%次要磷脂;约8%复合糖;以及约15%糖酯。在另一个实施方案中,强化粉末可包含液体卵磷脂,其中液体卵磷脂包含:约1%水;约37%甘油三酯;约16%磷脂酰胆碱;约13%磷脂酰乙醇胺;约10%磷脂酰肌醇;约5%磷脂酸;约2%次要磷脂;约5%复合糖;以及约11%糖酯。适用于本文的卵磷脂可由任何已知或其他合适的营养来源获得。非限制性实例包括:来自admspecialtyfoodingredients,decatur,ill.,usa的大豆卵磷脂;来自solae,llc,st.louis,mo.,usa的大豆卵磷脂;以及来自americanlecithincompany,oxford,conn.,usa的大豆卵磷脂。卵磷脂可在制备强化粉末期间的不同阶段添加到强化粉末。例如,在一个实施方案中,可将mdg油与亲脂性营养素混合,然后将卵磷脂添加到mdg油混合物。在另一个实施方案中,可将mdg油、亲脂性营养素和卵磷脂混合以形成混合物。在另一个实施方案中,可将mdg油与卵磷脂混合,并且然后将亲脂性营养素与mdg油混合物混合。按强化粉末的重量百分比,卵磷脂可为强化粉末的约1重量%至约12重量%。按强化粉末的重量百分比,卵磷脂可为强化粉末的约1.1重量%至约11重量%,包括约1.2重量%至约10重量%、约1.4重量%至约9重量%、约1.5重量%至约8重量%、约1.7重量%至约7重量%、约1.8重量%至约6重量%、约1.9重量%至约5重量%、约2重量%至约4.5重量%、约2.2重量%至约4.3重量%、约2.4重量%至约4.1重量%、约2.6重量%至约4重量%、约2.8重量%至约3.8重量%以及约3.0重量%至约3.5重量%。按强化粉末的重量百分比,卵磷脂可为强化粉末的约1重量%、约1.1重量%、约1.2重量%、约1.3重量%、约1.4重量%、约1.5重量%、约1.6重量%、约1.7重量%、约1.8重量%、约1.9重量%、约2.0重量%、约2.3重量%、约2.5重量%、约2.7重量%、约2.9重量%、约3重量%、约3.1重量%、约3.3重量%、约3.5重量%、约3.7重量%、约3.9重量%、约4重量%、约4.1重量%、约4.3重量%、约4.5重量%、约4.7重量%、约4.9重量%、约5重量%、约5.5重量%、约6重量%、约6.5重量%、约7重量%、约7.5重量%、约8重量%、约8.5重量%、约9重量%、约9.5重量%、约10重量%、约11重量%以及约12重量%。载体如先前所讨论,本公开的强化粉末包含载体。载体可以是适用于可摄取组合物的任何固体或半固体化合物,并且与组合物中的其他成分相容。优选的固体或半固体载体包含水溶性或水悬浮性常量营养素。合适的载体包括但不限于碳水化合物和蛋白质。示例性碳水化合物载体包括:简单糖(例如,葡萄糖、果糖或蔗糖);复合糖(例如,麦芽糖糊精、低聚果糖或菊粉);淀粉(例如,玉米淀粉、改性玉米淀粉、马铃薯淀粉或大米淀粉);纤维素(例如,粉状纤维素、微晶纤维素或半纤维素);糖醇(例如,木糖醇、甘露糖醇、山梨糖醇或麦芽糖醇);及其组合。示例性蛋白质载体包括:乳蛋白(例如,酪蛋白、酪蛋白酸盐或乳清);动物蛋白(例如,牛肉、家禽肉或鱼肉);植物蛋白(例如,菜豆、豌豆或马铃薯);谷物蛋白(例如,大米或小麦);及其组合。合适载体的优选实例是脱脂乳粉,其包含简单糖(例如,乳糖)和蛋白质(例如,酪蛋白和乳清)的组合。载体还可呈包含适用于可摄取组合物并且与组合物中的其他成分相容的化合物的水性溶液、乳液或混悬液的形式。优选的液体载体包含水和水溶性或水悬浮性常量营养素。合适的液体载体包括但不限于包含碳水化合物或蛋白质的液体。示例性液体载体包括流体全脂乳、流体脱脂乳、流体炼乳、流体淡炼乳、水性淀粉浆液、液体糖溶液、玉米糖浆、稀释玉米糖浆、蜂蜜、稀释蜂蜜及其组合。合适的液体载体的优选实例是流体脱脂乳,其包含简单糖(例如,乳糖)和蛋白质(例如,酪蛋白和乳清)的组合。按强化粉末的重量百分比,载体可为强化粉末的约40重量%至约88重量%。按强化粉末的重量百分比,载体可为强化粉末的约42重量%至约85重量%,包括约45重量%至约82重量%、约48重量%至约80重量%、约50重量%至约78重量%、约52重量%至约75重量%、约55重量%至约72重量%、约58重量%至约70重量%、约60重量%至约68重量%、约62重量%至约66重量%以及约63重量%至约65重量%。按强化粉末的重量百分比,载体可为强化粉末的约40重量%、约43重量%、约46重量%、约49重量%、约50重量%、约53重量%、约56重量%、约59重量%、约60重量%、约64重量%、约67重量%、约70重量%、约73重量%、约75重量%、约77重量%、约80重量%、约84重量%、约86重量%以及约88重量%。载体可在制备强化粉末期间的不同阶段添加到强化粉末。在优选的实施方案中,将载体溶解或悬浮在水性溶液或混悬液中。将包含载体的水性液体与mdg油、亲脂性营养素和磷脂的混合物混合。基础营养组合物如上所讨论,可将强化粉末与基础营养组合物共混,以形成营养产品。基础营养组合物是与强化粉末混合之前的营养组合物。基础营养组合物包含蛋白质、碳水化合物和脂肪中的至少一种,并且适于肠内施用给受试者。基础营养组合物还可包含维生素、矿物质和其他成分,并且代表唯一的、主要的或补充的营养来源。常量营养素根据本公开的基础营养组合物可包含选自脂肪、蛋白质、碳水化合物及其混合物的组的一种或多种常量营养素。一般来说,适用于营养产品的脂肪、碳水化合物或蛋白质的任何来源也适用于本文,前提条件是此类常量营养素也与如本文所定义的强化粉末和营养组合物的必需元素相容。虽然脂肪、蛋白质和碳水化合物的总浓度或量可根据受试者的营养需求而变化,但此类浓度或量最通常落在以下实施范围之一内,包括本文所述的任何其他必需脂肪、蛋白质和/或碳水化合物成分。按基础营养组合物的重量计,碳水化合物浓度通常可在约5重量%至约70重量%,包括约7重量%至约60重量%、包括约10重量%至约55重量%的范围内。按基础营养组合物的重量计,脂肪浓度最通常在约0.5重量%至约50重量%,包括约0.75重量%至约40重量%、包括约1重量%至约35重量%、包括约1.25重量%至约30重量%、包括约1.5重量%至约28重量%、包括约1.75重量%至约25重量%、包括约2重量%至约20重量%、包括约2.25重量%至约15重量%、包括约2.5重量%至约10重量%以及还包括约2.5重量%至约5重量%的范围内。按基础营养组合物的重量计,蛋白质浓度可在约1重量%至约85重量%、约5重量%至约50重量%、约7重量%至约32重量%或约8重量%至约30重量%的范围内。基于基础营养组合物的卡路里百分比,碳水化合物、脂肪和蛋白质的另外范围在表2中列出。表2注意:表中的每个数值前面均有术语“约”。本文所述基础营养组合物中的合适的脂肪的非限制性实例可选自以下项的组:椰子油、分馏椰子油、大豆油、玉米油、橄榄油、红花油、高油酸红花油、中链甘油三酯油、向日葵油、高油酸向日癸油、棕榈油和棕榈仁油、棕榈油精、菜籽油、海洋油、棉籽油、琉璃苣油、海藻油、真菌油及其组合。基础营养组合物中合适的碳水化合物或其来源的非限制性实例可选自以下项的组:麦芽糖糊精、水解或改性的淀粉或玉米淀粉、葡萄糖聚合物、玉米糖浆、玉米糖浆固体、源自大米的碳水化合物、蔗糖、葡萄糖、果糖、乳糖、高果糖玉米糖浆、蜂蜜、糖醇(例如,麦芽糖醇、赤藓糖醇或山梨糖醇)及其组合。基础营养组合物中合适的蛋白质或其来源的非限制性实例可选自源自任何合适来源的部分水解或非水解蛋白质的组,所述合适来源诸如乳(例如,酪蛋白、酪蛋白酸盐或乳清)、动物(例如,牛肉、家禽肉或鱼肉)、谷物(例如,大米或小麦)、植物(例如,豌豆、马铃薯或菜豆)或其组合。此类蛋白质的非限制性实例包括全脂牛乳、部分或完全脱脂乳、乳蛋白分离物、乳蛋白浓缩物、酪蛋白酸盐、酪蛋白分离物、乳清蛋白、乳清蛋白浓缩物、大豆蛋白分离物、大豆蛋白浓缩物、豌豆蛋白分离物、豌豆蛋白浓缩物、水解酵母、马铃薯、大米、小麦、油菜、动物胶原、明胶、牛初乳、人初乳、糖巨肽、菌蛋白、氨基酸及其组合。在一些实施方案中,基础营养组合物包含仅由完整的或部分水解的蛋白质组成的蛋白质组分;即,蛋白质组分基本上不含具有25%或更高水解度的任何蛋白质。在此上下文中,术语“部分水解的蛋白质”是指具有小于25%的水解度的蛋白质,包括小于20%、包括小于15%、包括小于10%以及包括具有小于5%的水解度的蛋白质。水解度是肽键通过水解化学反应断裂的程度。为了定量这些实施方案的部分水解的蛋白质组分,通过定量所选组合物的蛋白质组分的氨基氮与总氮比(an/tn)来确定蛋白质水解的程度。通过usp滴定法定量氨基氮组分以用于确定氨基氮含量,而总氮组分通过kjeldahl法来测定。这些分析方法是熟知的。任选成分本文所述的基础营养组合物还可包含其他任选成分,其可改变基础营养组合物的物理、化学、快感或加工特性,或在用于目标群体时充当另外的营养组分。许多此类任选成分是已知的或以其他方式适用于其他营养产品,并且还可用于本文所述的基础营养组合物,前提条件是此类任选成分对于口服施用是安全且有效的,并且与所选产品形式中的必需成分和其他成分相容。此类任选成分的非限制性实例包括防腐剂、抗氧化剂、乳化剂、缓冲剂、如本文所述的另外的营养素、着色剂、风味剂、增稠剂、稳定剂等。基础营养组合物还可包含矿物质,其非限制性实例包括钙、磷、镁、铁、锌、锰、铜、钠、钾、钼、铬、硒、氯化物及其组合。基础营养组合物还可包含维生素或相关营养素,其非限制性实例包括维生素a、维生素d、维生素e、维生素k、硫胺素、核黄素、吡哆醇、维生素b12、其他类胡萝卜素、烟酸、叶酸、泛酸、生物素、维生素c、胆碱、肌醇、其盐和衍生物及其组合。在一些实施方案中,基础营养组合物可包含选自以下项的组的化合物:羟基丁酸甲酯、亮氨酸、β-丙氨酸、表没食子儿茶素没食子酸酯、人乳寡糖、益生元、益生菌及其组合。基础营养组合物还可包含一种或多种掩蔽剂以减少或以其他方式掩盖苦味和余味。合适的掩蔽剂包括天然甜味剂和人造甜味剂、钠来源(诸如氯化钠)和水状胶体(诸如瓜尔胶、黄原胶、角叉菜胶、结冷胶)及其组合。基础营养组合物中掩蔽剂的量可根据所选的特定掩蔽剂、组合物中的其他成分以及其他组合物或产品目标变量而变化。然而,按基础营养组合物的重量计,此类量最通常在至少0.1重量%,包括约0.15重量%至约3.0重量%以及还包括约0.18重量%至约2.5重量%的范围内。制造方法强化粉末、基础营养组合物和营养产品的各种实施方案可通过用于制备所选产品形式(诸如液体、半液体或粉末组合物)的任何工艺或合适的方法来制备。强化粉末为了制备具有改善的一种或多种亲脂性营养素的生物利用度的强化粉末,可使用根据本公开的方法。所述方法可包括以下步骤:形成包含mdg油、亲脂性营养素和磷脂的第一混合物;将包含载体的水性液体与第一混合物混合以形成第二混合物;以及干燥第二混合物以形成强化粉末。在用于制备强化粉末的一种合适的制造工艺中,包含mdg油、一种或多种亲脂性营养素和磷脂的混合物形成第一混合物。添加第一混合物的组分的顺序并不关键,但通常优选mdg油是添加到第一混合物的第一或第二组分。在某些实施方案中,将mdg油与一种或多种亲脂性营养素混合,并且之后添加磷脂。在某些实施方案中,将mdg油与一种或多种亲脂性营养素混合,并且之后添加磷脂和一种或多种另外的亲脂性营养素。在某些实施方案中,将mdg油与磷脂混合,并且之后添加一种或多种亲脂性营养素。在某些实施方案中,将mdg油与一种或多种亲脂性营养素和磷脂同时混合,并且之后添加一种或多种另外的亲脂性营养素。第一混合物可通过以下方式来形成:在添加其他成分之前加热mdg油,或者可在混合(任选地在搅拌下)的同时加热第一混合物,以增强第一混合物的成分溶解或分散成均匀的混合物。在一些实施方案中,将第一混合物加热至约85℉(约29℃)30分钟。在一些实施方案中,将第一混合物加热至约120℉(约49℃)约10分钟。本领域技术人员将理解,第一混合物的组成将影响用于加热和充分混合第一混合物所需的温度和时间。将第一混合物与载体混合。在一些实施方案中,将包含载体的水性液体与第一混合物混合以形成第二混合物。在一些实施方案中,可在与第一混合物混合之前将载体溶解或悬浮在水性液体中。在一些实施方案中,载体可以是与第一混合物混合以形成第二混合物的水性液体载体。在一些实施方案中,将载体和第一混合物同时混合在水性液体中。在已将第二混合物的成分混合之后,通过适于制备和配制粉末的任何已知技术来干燥第二混合物以形成强化粉末。在一些实施方案中,可通过喷雾干燥步骤或冷冻干燥步骤干燥第二混合物。喷雾干燥步骤可包括适用于粉末生产的任何喷雾干燥技术。不同的喷雾干燥方法和技术已知用于营养领域,所有这些方法和技术均适用于制造本文所述的强化粉末。在一些实施方案中,可通过挤出工艺挤出和干燥第二混合物。不同的挤出工艺已知用于营养领域,所有这些工艺均适用于制造本文所述的强化粉末。在一些实施方案中,将第二混合物干燥以形成游离颗粒强化粉末。在干燥后,可将强化粉末立即共混到基础营养组合物中,以形成营养产品。在一些实施方案中,可将强化粉末添加到完成的基础营养乳液以形成营养产品乳液。在一些实施方案中,可在制造基础营养乳液期间的合适阶段将强化粉末添加到基础营养乳液,以形成营养产品乳液。在一些实施方案中,可在制造基础营养乳液期间将强化粉末与下述浆液(例如,cho-min、pif或piw浆液)中的一种同时添加到基础营养乳液,以形成营养产品乳液。在一些实施方案中,然后可使用本领域已知的任何方法将营养产品乳液干燥以形成营养产品粉末。在一些实施方案中,可将强化粉末与基础营养粉末干混,以形成营养产品粉末。在一些实施方案中,可将游离颗粒强化粉末与基础营养粉末干混以形成营养产品粉末。可替代地,可将强化粉末储存用于以后加工、包装到合适的容器或其他包装中等。基础营养组合物在用于制备基础营养组合物的一种合适的制造工艺中,制备至少三种单独的浆液,包括脂肪包蛋白质(protein-in-fat)(pif)浆液、碳水化合物-矿物质(cho-min)浆液和水包蛋白质(protein-in-water)(piw)浆液。pif浆液通过以下方式来形成:加热并混合油(例如,大豆油、菜籽油或玉米油),并且然后在持续加热和搅拌下添加乳化剂(例如,卵磷脂)、脂溶性维生素和总蛋白(例如,乳蛋白浓缩物)的至少一部分。通过在加热和搅拌下向水中添加矿物质(例如,柠檬酸钾、磷酸氢二钾或柠檬酸钠)(包括痕量和超痕量矿物质(tm/utm预混物))和增稠剂或粘度剂(例如,纤维素凝胶、结冷胶或角叉菜胶)来形成cho-min浆液。在添加另外的矿物质(例如,氯化钾、碳酸镁或碘化钾)和碳水化合物(例如,蔗糖或玉米糖浆)之前,可将所得的浆液在持续加热和搅拌下保持10分钟以完成cho-min浆液。通过在加热和搅拌下将水和剩余蛋白质混合来形成piw浆液。根据这种工艺,将三种浆液在加热和搅拌下混合在一起。将ph调节至期望范围,例如6.6至7,之后使组合物经受高温短时(“htst”)加工。组合物在htst工艺期间进行热处理、乳化、匀化和冷却。添加水溶性维生素和抗坏血酸(如果适用),再次调节ph(如果必要),添加风味剂,并且添加任何另外的水以将固体含量调节至期望范围。在一些实施方案中,在如先前所讨论已将所有浆液和基础营养乳液的其他成分混合并且加工之后,可如上所述将本公开的强化粉末添加到基础营养乳液。在一些实施方案中,可在制造基础营养乳液期间的合适阶段将强化粉末添加到基础营养乳液,以形成营养产品乳液。在一些实施方案中,可在制造基础营养乳液期间将强化粉末与浆液(例如,cho-min、pif或piw浆液)中的一种同时添加到基础营养乳液,以形成营养产品乳液。所得的营养产品乳液任选地可根据任何合适的灭菌技术(例如,无菌、干馏、热填充、化学、辐射或过滤灭菌技术)进行包装和灭菌。可替代地,如先前所述,在已将所有浆液和基础营养组合物的其他成分进行混合和加工之后,可使用适于制备和配制粉末的任何已知技术将基础营养组合物干燥以形成基础营养粉末。例如,基础营养粉末可通过喷雾干燥步骤或冷冻干燥步骤进行干燥。喷雾干燥步骤可包括适用于粉末生产的任何喷雾干燥技术。许多不同的喷雾干燥方法和技术已知用于营养领域,所有这些方法和技术均适用于制造本文所述的喷雾干燥的基础营养粉末。在干燥之后,可立即将成品基础营养粉末与强化粉末干混,或者可将基础营养粉末储存用于将来加工、包装到合适的容器中等。营养产品如先前所讨论,通过将强化粉末与基础营养组合物混合来制造本公开的营养产品。在用于制备营养产品的合适制造工艺的一些实施方案中,可将强化粉末添加到完成的基础营养乳液以形成营养产品乳液。在一些实施方案中,可在制造基础营养乳液期间的合适阶段将强化粉末添加到基础营养乳液,以形成营养产品乳液。在一些实施方案中,可在制造基础营养乳液期间将强化粉末与上述浆液(例如,cho-min、pif或piw浆液)中的一种同时添加到基础营养乳液,以形成营养产品乳液。在一些实施方案中,然后可使用本领域已知的任何方法将来自任何这些实施方案的营养产品乳液干燥以形成营养产品粉末。在一些实施方案中,可将强化粉末与基础营养粉末干混,以形成营养产品粉末。在一些实施方案中,可将游离颗粒强化粉末与基础营养粉末干混以形成营养产品粉末。按所得营养产品的重量百分比,添加到基础营养组合物的强化粉末为约0.1重量%至约16重量%,包括约0.2重量%至约15重量%、约0.3重量%至约14重量%、约0.5重量%至约12.5重量%、约0.75重量%至约10重量%、约1重量%至约8重量%、约1.25重量%至约7.5重量%、约1.5重量%至约6重量%、约2重量%至约5重量%、约2.25重量%至约4重量%以及约2.5重量%至约3重量%。使用方法本文所述的营养产品和强化粉末改善了存在于营养产品和强化粉末中的亲脂性营养素的生物利用度。不希望受理论束缚,据信,在食用后,强化粉末中的mdg油、磷脂和载体改善了强化粉末中以及最终营养产品中亲脂性营养素的溶解或分散。亲脂性营养素的改善的溶解或分散使亲脂性营养素更容易地结合到形成于肠中的胶束中。强化粉末中组分的组合和相互作用还可帮助亲脂性营养素更容易地结合到形成于肠中的胶束中。强化粉末中的甘油单酯和甘油二酯还可增强乳糜微粒的形成。因此,将亲脂性营养素更有效地递送至肠道的刷状缘并且吸收到体内。在亲脂性营养素是叶黄素的实施方案中,可将包含叶黄素的营养产品施用给受试者,以促进眼睛和视网膜健康发育,维持整体眼睛健康,并且预防或减少年龄相关性黄斑变性和其他视网膜疾病和病症。接受具有叶黄素的营养产品的受试者可包括但不限于孕妇和产后妇女、婴儿、儿童以及成人。在一些实施方案中,本公开的方法可针对孕妇或产后妇女,以促进发育中的胎儿或婴儿的眼睛和视网膜发育以及健康的视力。在一些实施方案中,本公开的方法可针对婴儿和儿童,以促进成长中的儿童的眼睛和视网膜发育以及健康的视力。在一些实施方案中,本公开的方法可针对患有年龄相关性黄斑变性或其他视网膜疾病和病症的成人。在一些实施方案中,出于预防、最小化或延缓随时间发展此类疾病和病状的目的,本公开的方法还针对“有风险”的个体,包括未受年龄相关性黄斑变性或其他视网膜疾病或病症影响或未患有所述疾病或病症的个体。出于此类发育、维持和预防目的,本公开的方法优选地包括连续每日施用如本文所述的营养产品。此类发育、维持和预防方法可针对诸如以下的受试者:孕妇和产后妇女、婴儿、儿童和成人,特别是老年人,其由于遗传因素、环境因素等而易于发展年龄相关性黄斑变性或其他视网膜疾病和病症。在亲脂性营养素是维生素d的实施方案中,可将包含维生素d的营养产品施用给受试者,以促进骨骼健康发育、减少维生素d缺乏、增加骨强度、保持或增加骨矿化并且保持或增加骨矿物质密度。包含维生素d的营养产品还可施用给患有或有风险患有与骨矿化不足相关联的疾病和病状(诸如佝偻病、骨软化症、骨质疏松症、骨质减少症和骨折)的受试者。接受具有维生素d的营养产品的受试者可包括但不限于孕妇和产后妇女、婴儿、儿童、青少年、成人、绝经后妇女和老年人。在一些实施方案中,本公开的方法针对孕妇或产后妇女,以促进发育中的胎儿或婴儿的骨骼健康发育。在一些实施方案中,本公开的方法针对婴儿和儿童,以促进成长中的儿童的骨骼健康发育并且预防佝偻病或骨折。在一些实施方案中,本公开的方法针对青少年和成人,以促进骨矿化和骨矿物质密度增加。在一些实施方案中,本公开的方法针对绝经后妇女,以预防或减缓骨质疏松症的发作。在一些实施方案中,本公开的方法针对患有骨软化症、骨质疏松症、骨质减少症或其他骨疾病和病症的成人。在一些实施方案中,出于预防、最小化或延缓随时间发展此类疾病和病状的目的,本公开的方法针对“有风险”的个体,包括未受骨软化症、骨质疏松症、骨质减少症、失去平衡和跌倒、骨折或其他骨疾病或病症影响或未患有所述疾病或病症的个体。出于此类发育、维持和预防目的,本公开的方法优选地包括连续每日施用如本文所述的营养产品。此类发育、维持和预防方法针对诸如以下的受试者:孕妇和产后妇女、婴儿、儿童、青少年、成人、绝经后妇女和老年人。预防方法特别针对易于发展年龄相关性骨质疏松症、骨质减少症、失去平衡或跌倒、骨折或与维生素d食用不足或与骨矿化不足相关联的其他疾病和病症的老年人。在亲脂性营养素是维生素e的实施方案中,可将包含维生素e的营养产品施用给受试者以提供抗氧化剂、促进心血管健康并且预防或降低某些类型癌症的风险。接受具有维生素e的营养产品的受试者可包括但不限于孕妇和产后妇女、婴儿、儿童以及成人。在一些实施方案中,本公开的方法可针对孕妇或产后妇女,以促进发育中的胎儿或婴儿的健康发育。在一些实施方案中,本公开的方法可针对婴儿和儿童,以促进成长中的儿童的健康发育。在一些实施方案中,本公开的方法可针对患有心血管疾病的成人。在一些实施方案中,出于预防、最小化或延缓随时间发展此类疾病和病状的目的,本公开的方法还针对“有风险”的个体,包括未受癌症、心血管疾病或其他疾病或病症影响或未患有所述疾病或病症的个体。出于此类发育、维持和预防目的,本公开的方法优选地包括连续每日施用如本文所述的营养产品。此类发育、维持和预防方法可针对诸如以下的受试者:孕妇和产后妇女、婴儿、儿童和成人,特别是老年人,其由于遗传因素、环境因素等而易于发展癌症、心血管疾病或其他疾病和病症。在亲脂性营养素是dha的实施方案中,可将包含dha的营养产品施用给受试者,以促进眼睛、大脑和中枢神经系统健康发育,维持整体大脑健康,预防或减少年龄相关性精神功能下降,并且减少心血管和其他疾病和病症。接受具有dha的营养产品的受试者可包括但不限于孕妇和产后妇女、婴儿、儿童以及成人。在一些实施方案中,本公开的方法可针对孕妇或产后妇女,以促进发育中的胎儿或婴儿的眼睛、大脑和中枢神经系统发育。在一些实施方案中,本公开的方法可针对婴儿和儿童,以促进成长中的儿童的眼睛、大脑和中枢神经系统发育。在一些实施方案中,本公开的方法可针对成人,以维持整体大脑健康,预防或减少年龄相关性精神功能下降,并且减少心血管和其他疾病和病症。在一些实施方案中,出于预防、最小化或延缓随时间发展此类疾病和病状的目的,本公开的方法还针对“有风险”的个体,包括未受年龄相关性精神功能下降或心血管疾病影响或未患有所述疾病的个体。出于此类发育、维持和预防目的,本公开的方法优选地包括连续每日施用如本文所述的营养产品。此类发育、维持和预防方法可针对诸如以下的受试者:孕妇和产后妇女、婴儿、儿童和成人,特别是老年人,其由于遗传因素、环境因素等而易受年龄相关性精神功能下降、心血管疾病或其他疾病和病症影响。在这些实施方案中,个体期望地每日食用至少一份营养产品,并且在一些实施方案中,可每日食用两份、三份或甚至更多份。每一份均期望作为单一未分开的剂量施用,但所述份也可分成两个或更多个部分或分开的份,以在一天中服用两次或更多次。本公开的方法包括连续日复一日施用以及周期性或限制性施用,但通常期望连续日复一日施用。所述营养产品可由婴儿、儿童和成人使用。实施例以下实施例举例说明包含亲脂性营养素的营养产品和强化粉末的具体实施方案和具体特征。实施例仅是出于说明的目的而给出的,并且不应解释为对本公开的限制,因为在不脱离本公开的精神和范围的情况下,所述实施例的许多变型是可能的。除非另外说明,否则所有示例性量均是基于组合物总重量的重量百分比。实施例1-3在实施例1-3中,制备三种含有叶黄素的干燥可混合粉末。实施例1和2是根据现有技术制备的比较实施例,并且实施例3是根据本公开制备的强化粉末。分析所得粉末的叶黄素的分散性、流动性和重构特性。在实施例中比较两种不同的油:高油酸红花油(hosafo,实施例1)和mdg油(mdg,实施例2-3)。将三种油样品加热至125℉(52℃),并且向每一种添加20%在红花油中的叶黄素混悬液。将卵磷脂(一种磷脂)添加到实施例3的mdg油和叶黄素混合物。接下来,将脱脂乳粉溶液在140℉(60℃)的温度下溶解在水中。将每种油样品添加到乳溶液的单独部分。实施例混合物的最终组成显示在表3中。表3比较实施例1比较实施例2实例3组分重量%重量%重量%水74.98174.98174.981脱脂乳粉18.74618.74618.746hosafo6.24900mdg油06.2495.207卵磷脂001.042叶黄素(20%,在红花油中)0.0240.0240.024然后将每种示例性混合物加热至160℉-185℉(71℃-85℃)之间的温度。用两阶段均化器,使用2,400-2,700psi(16.5-18.6mpa)之间的第一阶段压力和300-500psi(2.1-3.5mpa)之间的第二阶段压力将示例性混合物均化。将示例性混合物在165℉-185℉(74℃-85℃)之间的温度下进一步巴氏灭菌,然后冷却至低于45℉(7℃)的温度。如下将示例性混合物喷雾干燥。将示例性混合物加热至150℉-165℉(66℃-74℃)之间,然后将蒸汽注入混合物中以将温度升高至240℉-260℉(116℃-127℃)之间。然后将示例性混合物通过5秒保持管,并且闪蒸冷却至170℉-190℉(77℃-88℃)之间。然后将混合物进料到蒸发器中,其中每种混合物的总固体含量增加至大约48%至50%。将每种混合物在150℉-190℉(66℃-88℃)之间的温度和1,700psi与2,400psi(11.7mpa与16.5mpa)之间的压力下喷雾干燥。收集所得的粉末并且密封在容器中以等待进一步测试。分析从实施例1-3收集的粉末的粉末流动性、松散堆积密度和重构特性。还通过光学显微镜目视评估粉末的叶黄素分散性。用brookfield粉末流动测试仪测试粉末流动性。将粉末样品放置于样品槽中,并且然后粉末流动测试仪进行流动函数(粘着强度)测试,所述粉末流动测试仪使粉末样品经受剪切测试以估计粉末流动。粉末流动性以10分的“流动系数”标度评估,其中1-2代表“非常粘着”(即,流动性差),2-4代表“粘着”(即,流动性中等),并且4-10代表“易流动”(即,流动性好)。粉末流动性测试的结果显示在表4中。表4样品流动系数流动特性实施例13.13初始粘着;在约2.0kpa或更小时变得非常粘着实施例22.44初始粘着;在约1.5kpa或更小时变得非常粘着实施例35.26初始易流动;在约2.5kpa或更小时变得粘着通过本公开的工艺制备的实施例3产生具有良好流动性特性的粉末。比较实施例1-2具有较差的流动特性。通过以下来分析粉末的松散堆积密度:用粉末填充已知体积和重量的量筒,然后测量填充的量筒的所得重量以计算松散堆积密度。如下进行粉末重构泡沫测试。称量适合添加到180ml水的一定量的粉末。用180ml水填充8盎司的瓶,将预先称量的粉末添加到瓶,并且将盖放置到瓶上。将瓶放置在循环速度为每秒4个循环的机械摇动器中,并且将瓶摇动20个循环以重构粉末。将来自瓶的重构液体沿着250-ml刻度量筒的一侧倾倒。当刻度量筒静置时,以预定时间间隔从刻度量筒测量由重构液体生成的泡沫的体积(ml)。如下进行粉末重构相分离测试。如上所述,将一定量的粉末在180ml水中进行重构用于粉末重构泡沫测试。将重构液体倒入250ml刻度量筒中并使其静置30分钟。然后观察重构液体的分离迹象。从刻度量筒测量顶相体积(ml)。如下进行粉末重构玻片颗粒测试。如上所述,将一定量的粉末在180ml水中进行重构用于粉末重构泡沫测试。使重构液体静置5分钟,并且用勺子小心地去除任何表面泡沫。轻轻搅拌重构的液体。一旦液体静止,将3”×1”×1mm的载玻片垂直浸入容器中心,深度达最小4cm,持续5秒钟。将玻片从液体中取出,并且在用毛巾或布擦拭干净玻片背面的液体时使其在水平位置保持竖直。通过将玻片边缘放置到纸巾上来排干玻片下边缘上的多余液体。然后在上方有白色荧光的情况下在黑色背景下通过1.5倍放大透镜目视检查玻片。通过将玻片上的液体与照相标准进行并排目视比较来给出1至6的评级值。测试来自实施例1-3的粉末的松散堆积密度和粉末重构。这些测试的结果显示在表5中。对于每个实施例,使用每1l水258g粉末进行粉末重构测试。表5含有mdg油的粉末(实施例2-3)具有与这些粉末将与其干混的基础营养粉末的堆积密度(即,约0.35g/cc至约0.61g/cc)相当的堆积密度。将具有相似堆积密度的粉末干混通常改善共混物的均匀性。此外,重构特性显示,与含有hosafo的粉末(实施例1)所观察到的相比,含有mdg油的粉末(实施例2-3)重构期间生成的泡沫分散得更快。含有mdg油的重构粉末未显示油相分离,并且玻片颗粒值减小。使用直射光和偏振光两者通过光学显微镜目视评估叶黄素在每种粉末样品中的分散性。用水将每种粉末样品重构在20重量%的乳液中。在光学显微镜下以100倍放大率检查重构粉末的样品。粉末的显微照片显示在图2至7中。图2和3分别显示实施例1的重构粉末在直射光和偏振光下的显微照片。在两张显微照片中均可看到存在许多游离、未分散的叶黄素的晶体。这在偏振光下特别明显。图4和5分别显示实施例2的重构粉末也在直射光和偏振光下的显微照片。在这些显微照片中,游离叶黄素的晶体较少,并且这些晶体似乎比实施例1中的晶体更小。因此,似乎实施例2的粉末中的叶黄素比实施例1的粉末中的叶黄素分得更细,并且可能更分散。最后,图6-7分别显示实施例3的重构粉末也在直射光和偏振光下的显微照片。在这些显微照片中,叶黄素的晶体非常小,以至于在直射光下基本上不可见,并且仅可用偏振光观察和鉴定。因此,似乎实施例3的粉末中的叶黄素与实施例1或2中的相比分得最细,并且因此叶黄素可在实施例3的粉末中更分散。实施例4和5在实施例4和5中,根据本公开通过将强化粉末以两种浓度干混到基础营养粉中来制备营养粉末。使用实施例3作为强化粉末。如先前所讨论,用下表6中所示的成分清单制备用于幼儿或儿童营养制剂的基础营养粉末。所有成分量以每1,000kg批量的营养粉末列出。表6通过将2克强化粉末与430克基础营养粉末混合来制备实施例4。通过将34.88克强化粉末与397.12克基础营养粉末混合来制备实施例5。通过在容器中翻转粉末将粉末混合2分钟。通过上述测试方法测试实施例4和5的营养粉末的松散堆积密度、粉末流动性和重构特性。对于每个实施例,使用每1l水216g粉末进行粉末重构测试。还如下分析实施例4和5的营养粉末的振实堆积密度。通过用粉末填充已知体积和重量的量筒并且将量筒夹持到振动装置上来分析粉末的振实堆积密度。使样品振动,并且然后取出。取出多余的粉末以使样品与已知体积的量筒的顶部齐平。将所得的量筒中粉末的净重用于计算振实堆积密度。表7将强化粉末添加到基础营养粉末改善了流动性并且增加了堆积密度,从而允许较小的包装尺寸。此外,实施例5与基础营养粉末相比泡沫显著减少。虽然本申请通过描述其实施方案进行阐明,并且虽然已相当详细地描述了实施方案,但申请人不意图将附加权利要求书的范围限定或以任何方式限制于这类细节。本领域的技术人员将很容易想到另外的优势和修改。因此,本申请在其较广泛的方面不限于特定细节、代表性组合物、制剂和方法以及所示和所述的说明性实施例。因此,在不脱离本文中申请人的一般公开的精神或范围的情况下,可对此类细节作出变更。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1