减少农场动物抗生素施用的方法和组合物与流程
本申请根据35u.s.c.§119(e)要求2016年3月22日提交的美国临时申请序列号62/311,706的权益,其全部内容通过引用并入本文。
背景技术:
在农场动物(比如肉牛、猪和家禽)的生产中,用抗生素对动物群体进行大规模治疗以防止疾病暴发是常见的。但是人们越来越希望减少这些抗生素的施用,特别是当这些动物是饲养作为人类食用的食物时。
遗憾的是,畜牧生产者几乎没有方法来确定哪些动物需要治疗;难以将受益于抗生素治疗的受感染动物与未受感染的动物区分开来。由于动物是混在一起饲养的,它们更容易被感染,但根据温度或抗体反应很难将感染的动物与未感染的动物区分开来,特别是如果感染是近期发生的。与人类不同,动物不能对他们是否生病的问题提供言语回应。最后,农场动物通常以牧群或畜群集中饲养,对个体动物进行诊断的时间通常非常有限。因此,为了保持动物健康并确保需要治疗的动物得到治疗,通常给所有牲畜或家禽施用抗生素,无论这些牲畜群或家禽群的所有成员是否需要。或者,有些围栏或群体没有施用到抗生素,即使该群体中有个体可能被感染。
因此,需要新的技术来快速诊断那些当前可能被感染的动物,使得它们可以与未出现感染特征的动物得到不同的管理。
本发明通过提供用于减少农场动物抗生素施用的方法和组合物克服了本领域的上述缺点。
技术实现要素:
在一个方面,本发明提供了鉴定动物适于进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上开始抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在进一步的方面,本发明提供了确定动物需要进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法以及确定动物进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的时间的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上确定所述动物需要进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法以及确定所述动物进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的时间的方法。
在其他方面,本发明提供了减少或停止正在接受抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的动物的抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上鉴定所述动物适于减少或停止抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在另一方面,本发明提供了跟踪一组动物的疾病情况和/或治疗(例如抗生素治疗)的方法,包括:(a)选择动物组中的个体动物;(b)采集来自(a)的所述动物的样品;(c)对所述样样品执行白细胞差异计数;(d)将(c)的所述白细胞差异计数与感染指数进行比较;(e)在所述比较步骤的基础上将所述个体动物分配到正常亚组或异常亚组;(f)生成所述动物的电子记录,包括所述动物的身份、所述动物的白细胞差异计数历史、所述动物的病史和所述动物的治疗和/或管理方案历史;以及(g)重复步骤(a)到(f),直到所述动物组中的所有动物被分配到所述正常亚组或所述异常亚组,并将所述电子记录存储在数据库中。
在又一方面,本发明提供了装置,包括:(a)具有至少第一内腔的壳体;(b)在所述第一内腔中的自动显微镜;(c)在所述第一内腔中的至少一个第一盒分配器;(d)在所述壳体中并与所述第一盒分配器可操作地连接的至少一个第一盒分配器通道门;(e)在所述壳体中并与所述第一盒分配器可操作地连接的至少一个第一新盒通道口;(f)在所述壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(g)与所述壳体可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器。
本发明还提供了组合装置,包括:(a)具有至少第一内腔的第一壳体;(b)在所述第一内腔中的自动显微镜;(c)具有至少第二内腔的第二壳体;(d)在所述第二内腔中的至少一个第一盒分配器;(e)在所述第二壳体中并与所述第一盒分配器可操作地连接的至少一个第一盒分配器通道门;(f)在所述第二壳体中并与所述第一盒分配器可操作地连接的至少一个第一新盒通道口;(g)在所述第一壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(h)与所述第一和第二壳体中的每个可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器。
附图说明
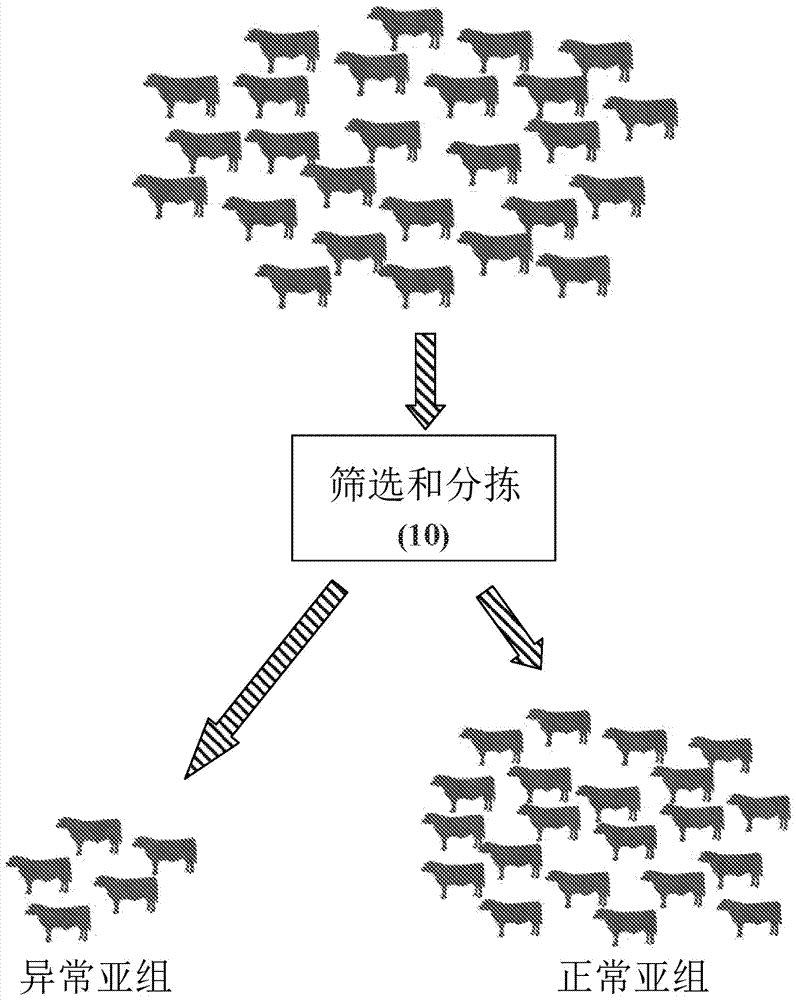
图1是本发明方法的示意图。
图2是本发明方法的一个实施例的筛选和分拣步骤的流程图。
图3a是用于实施本发明方法的装置的一个实施例的内部示意图。
图3b是图3a的装置的外部示意图。
图4a是用于实施本发明方法的装置的第二实施例的内部示意图。
图4b是图4a的装置的外部示意图。
图5是可用于图3a、3b、4a和4b的装置中的盒分配器的透视图。
图6是用于对样品成像的成像读取器的示意图。
具体实施方式
下文将参考附图对本发明进行更为详细的描述,附图中示出了本发明的实施例。但是,本发明可以以许多不同的形式来实施,并且不应被解释为用于限制本文阐述的实施例;相反,提供这些实施例,从而使得本公开更为全面和完整,并将本发明的保护范围完整地传达给本领域技术人员。
相同的数字始终指代相同的元件。在附图中,为了清楚起见,可能放大了某些线、层、部件、元件或特征的厚度。使用时,除非另有说明,虚线表示可选特征或操作。
如本文所用的“有需要”的受试者是指能得益于本发明的治疗和/或手段的治疗效果和/或预防效果的受试者。这样的受试者可以是被诊断患有本发明疾病或病症的受试者,疑似患有或发生本发明病症或疾病的受试者,和/或被确定具有增加的患有或发生本发明疾病或病症的风险的受试者。
术语“治疗(treat)”、“治疗(treating)”或“的治疗(treatmentof)”(及其语法变体)是指受试者病情的严重程度降低、至少部分得到改善或减轻,和/或是指部分缓解、减轻或者减少至少一种临床症状和/或延缓疾病或病症的发展。
术语“预防(prevent)”、“预防(preventing)”和“的预防(preventionof)”(及其语法变体)是指减轻和/或延缓受试者疾病、病症和/或临床症状的发作和/或发展,和/或降低相对于没有采用本发明方法的情况下发生的疾病、病症和/或临床症状的发作和/或发展的严重程度。预防可以是完全的,例如完全没有出现疾病、病症和/或临床症状。预防也可以是部分的,使得受试者的疾病、病症和/或临床症状的发生率和/或发作和/或发展的严重程度低于未采用本发明的组合物的情况。
如本文所用的,术语“治疗有效量”或“有效量”是指本发明的组合物或制剂或治疗剂的量在受试者身上得到治疗上有用的反应。本领域技术人员将理解,治疗效果不需要是彻底的或治愈的,只要对受试者有一些益处即可。
如在本发明的说明书和所附权利要求中所使用的,单数形式的“一”、“一个”和“所述”也包括复数形式,除非上下文另外明确指出。例如,“细胞”可以指单个细胞或多个细胞。
同样如本文所使用的,“和/或”是指并且包括一个或多个相关所列项目的任何和所有可能的组合,以及当在替代方式(“或”)中解释时缺少的组合。
如本文所使用的,过渡性短语“基本上由......组成”(和语法变体)应被解释为涵盖所列举的材料或步骤以及不会实质上影响本发明的基本和新颖性特征的那些材料或步骤。参见inreherz,537f.2d549,551-52,190u.s.p.q.461,463(ccpa1976)(原文加粗);另见mpep§2111.03。因此,本文使用的术语“基本上由...组成”不应被解释为等同于“包含”。
应进一步理解,当在本说明书中使用时,术语“包括”和/或“包含”指存在所述特征、整数、步骤、操作、元件和/或部件,但不排除存在或者添加一个或多个其他特征、整数、步骤、操作、元件、部件和/或它们的群组。如本文所使用的,术语“和/或”包括一个或多个相关所列项目的任何和所有组合。
当提及诸如量或浓度(例如,药物组合物中的苯并二氮杂的量)等可测量值时,本文所用的术语“约”意指包括指定值的20%、10%、5%、1%、0.5%、0.4%、0.3%、0.2%或0.1%的变化。
除非上下文另有说明,其具体意图是指本文所述的本发明的各种特征可以以任何组合使用。例如,关于一个实施例描述的特征也可以适用于本发明的其他实施例和方面,并且可以与本发明的其他实施例和方面组合。
此外,本发明还设想了在本发明的一些实施例中,可排除或省略本文所述的任何特征或特征组合。
为了说明目的,若说明书指出复合体包含组分a、b和c,则其具体意图是指a、b或c中的任一个或其组合可以被省略和放弃。
除非另外定义,否则本文使用的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。可以进一步理解的是,诸如在常用词典中定义的那些术语应当被解释为与其在本申请和相关领域的上下文中具有的含义一致,并且不应该被理解为理想形式或过度形式,除非在本文中明确地如此定义。这里在本发明的描述中使用的术语仅用于描述特定实施例的目的,而不旨在限制本发明。
本文提及的所有出版物、专利申请、专利和其他非专利参考文献的全部内容通过引用并入本文。
可以理解的是,当一个元件被称为是“在另一个元件上”,“附接”、“连接”、“耦合”、“接触”另一个元件等时,其可以直接在其他元件上,直接“附接”、直接“连接”、直接“耦合”和/或直接接触其他元件,或者也可以存在居间元件。相反,当一个元件被称为例如“直接在另一个元件上”,“直接附接”、“直接连接”、“直接耦合”或“直接接触”另一个元件时,不存在居间元件。本领域技术人员还应理解,提到的与另一特征“相邻”布置的结构或特征可具有与相邻特征重叠或位于其下方的部分。
为了便于描述附图中所示的一个元件或特征与其他元件或特征的关系,本文可以使用空间相关术语,例如“下方”、“下面”,“下部”、“上方”、“上部”等应当理解,除了附图中所示的取向之外,空间相关术语旨在包括使用或操作中的装置的不同取向。例如,如果翻转图中的装置,则被描述为在其他元件或特征“下方”或“下面”的元件的取向为在其他元件或特征“上方”。因此,示例性术语“下方”可以包括上方和下方两个方向。或者,该装置可以是定向的(旋转90度或在其他方向),并且本文使用的空间相关描述应相应地进行解释。类似地,除非另有明确说明,否则本文使用术语“向上”、“向下”、“垂直”、“水平”等仅用于解释的目的。
应当理解,尽管本文可以使用术语第一、第二等来描述各种元件、部件、区域、层和/或部分,但是这些元件、部件、区域、层和/或部分不应该是受这些术语的限制。相反,这些术语仅用于将一个元件、部件、区域、层和/或部分与另一个元件、部件、区域、层和/或部分区分开。因此,本文讨论的第一元件、部件、区域、层或部分可以被称为第二元件、部件、区域、层或部分,而不脱离本发明的教导。除非另有明确说明,否则操作(或步骤)顺序不限于权利要求或附图中所示的顺序。
可以实施本发明实施例的动物包括但不限于肉牛、奶牛、绵羊、猪、山羊、兔和家禽(例如鸡、火鸡、鸭、鹅、鹌鹑、野鸡、鹧鸪(比如石鸡(chukarpartridge)等)。
可根据本发明向动物施用的抗生素或免疫刺激剂包括但不限于以下抗生素种类:氨基香豆素、氨基糖苷类、酰胺醇类、头孢菌素类、二氨基嘧啶类、氟喹诺酮类、糖脂类、离子载体、林可酰胺类、大环内酯类、青霉素类、截短侧耳素类、多肽类、喹喔啉类、链阳性菌素类、磺胺类、四环素类及它们的组合。
可以通过任何合适的技术施用抗生素,包括口服给药(例如,通过将抗生素化合物作为饲料添加剂加入动物饲料中)、肠胃外注射(例如,静脉内注射、皮下注射、动脉内注射、肌内注射等)等。
本发明的样品可包括血液、乳汁、初乳、尿液、鼻腔粘液、阴道分泌物、粘液分泌物、关节液、脑脊液、抽吸液、引流液、灌洗液或洗出液、来自动物的可能包含白细胞的组织或任何其他生物样品。
在一个实施例中,本发明提供了鉴定动物适于进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上开始抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在上述方法中,比较步骤可包括下述方面、基本上由或由下述方面组成:将白细胞差异细胞计数中的嗜中性粒细胞值与(a)的嗜中性粒细胞值进行比较,将白细胞差异细胞计数中的淋巴细胞值与(b)的淋巴细胞值进行比较,和/或将白细胞差异细胞计数中的嗜酸性粒细胞值与(c)的嗜酸性粒细胞值进行比较,可以任意组合,其中中性粒细胞值、淋巴细胞值和/或嗜酸性粒细胞值超过相应的(a)的中性粒细胞值、(b)的淋巴细胞值和/或(c)的嗜酸性粒细胞值的范围证明抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案适合于所述动物。
在进一步的实施例中,本发明提供了确定动物(例如有下述需要的动物)需要进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法以及确定动物(例如有下述需要的动物)进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的时间的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上确定所述动物需要进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法以及确定所述动物进行抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的时间的方法。
在上述方法中,比较步骤可包括下述方面、基本上由或由下述方面组成:将白细胞差异细胞计数中的嗜中性粒细胞值与(a)的嗜中性粒细胞值进行比较,将白细胞差异细胞计数中的淋巴细胞值与(b)的淋巴细胞值进行比较,和/或将白细胞差异细胞计数中的嗜酸性粒细胞值与(c)的嗜酸性粒细胞值进行比较,可以任意组合,其中嗜中性粒细胞值、淋巴细胞值和/或嗜酸性粒细胞值在相应的(a)的嗜中性粒细胞值、(b)的淋巴细胞值和/或(c)的嗜酸性粒细胞值的范围外证明抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案适合于所述动物。
本发明另外提供了减少或停止正在接受抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的动物的抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案的方法,包括:a)采集来自所述动物的样品;b)对所述样品执行白细胞差异细胞计数;c)将(b)的所述白细胞差异细胞计数与感染指数进行比较;以及d)在所述比较步骤的基础上鉴定或确定所述动物适于减少或停止抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在上述方法中,比较步骤包括将白细胞差异细胞计数中的嗜中性粒细胞值与(a)的嗜中性粒细胞值进行比较,将白细胞差异细胞计数中的淋巴细胞值与(b)的淋巴细胞值进行比较,和/或将白细胞差异细胞计数中的嗜酸性粒细胞值与(c)的嗜酸性粒细胞值进行比较,可以任意组合,其中嗜中性粒细胞值、淋巴细胞值和/或嗜酸性粒细胞值在相应的(a)的嗜中性粒细胞值、(b)的淋巴细胞值和/或(c)的嗜酸性粒细胞值的范围内证明减少或停止抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案适合于所述动物。
在本发明的方法中,感染指数可以是,但不限于,a)嗜中性粒细胞值,其范围为约xnx103个细胞/微升至约ynx103个细胞/微升,其中xn为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6或1.7x103个嗜中性粒细胞/微升,yn为4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9或12.0x103个嗜中性粒细胞/微升;b)淋巴细胞值,其范围为约xl×103个细胞/微升至约yl×103个细胞/微升,其中xl为3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9或7.0x103个淋巴细胞/微升,yl为10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2或12.3x103个淋巴细胞/微升;c)嗜酸性粒细胞值,其范围为约xe×103个细胞/微升至约ye×103个细胞/微升,其中xe为0.0×103个嗜酸性粒细胞/微升,ye为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0x103个嗜酸性粒细胞/微升;以及d)(a)、(b)和(c)的任意组合。应理解,本文列举的值包括所述值的十分之一、百分之一或千分之一等的任意分数。例如,0.0至0.1的范围包括0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.080.09;1.0至1.1的范围包括1.01、1.02、1.03、1.04、1.05、1.06、0.07、1.08、1.09;1.1至1.2的范围包括1.11、1.12、1.13、1.14、1.15、1.16、1.17、1.18、1.19等,与在本文中明确阐述的每个单独的值类似。
在一些实施例中,(a)、(b)和(c)可以计算为总细胞数(例如,总白细胞数)的百分比。
在一些实施例中,可以使用不同的指数使不同的端点最优化。在有些情况下,对于动物管理方案来说,最有利的是使院内疾病率(hospitalpull)(发病率)降至最低。或者,使体重增长最大化可能是优选的动物管理方案。例如,为了使动物的体重增长最大化,可以使用嗜中性粒细胞在1.3至5.8×103个细胞/微升之间和淋巴细胞在0至11.3×103个细胞/微升之间的阈值。另一个例子是降低发病率的逻辑指数,例如:在一组中的一个动物或多个动物的样品测量中,如果嗜酸性粒细胞通常等于零个,嗜中性粒细胞范围为0.8至4.0×103个细胞/微升,淋巴细胞范围为7.0至10.8×103个细胞/微升,或者如果嗜酸性粒细胞大于零个细胞/微升,并且嗜中性粒细胞范围为1.66至5.4×103个细胞/微升,淋巴细胞范围为4.1至10.2×103个细胞/微升,那么可以将发病率(例如,生病动物的数量)可以降至最低。
在本发明的一些实施例中,感染指数可以是单核细胞值,其范围为约xm×103个细胞/微升至约ym×103个细胞/微升,其中xm是0.0×103个单核细胞/微升,ym是0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0x103个单核细胞/微升。
在本发明的一些实施例中,感染指数可以是嗜碱性粒细胞值,其范围为约xm×103个细胞/微升至约ym×103个细胞/微升,其中xm是0.0×103个嗜碱性粒细胞/微升,ym是0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0x103个嗜碱性粒细胞/微升。
在一些实施例中,用于本文所述的嗜中性粒细胞、淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞和任何其他白细胞类型的指数可以计算为总细胞数(例如,总白细胞数)的百分比。
在本发明的方法中,用于本文所述的嗜中性粒细胞、淋巴细胞、嗜酸性粒细胞、单核细胞和嗜碱性粒细胞的指数可以单独使用或任意组合使用。
在本发明的方法中,一只动物可以存在于一组动物中(例如,在牧群中或畜群中或一个种群等等中)。每只动物可以单独存在,或与动物群中的其他动物一起存在,可以在本领域所知的围场、围栏、畜栏、鸡笼、饲养区、畜棚、田间、牧场、饲养箱、饲养槽等等中。
在一些实施例中,本发明方法的一个或多个(包括所有)步骤可以在现场进行,例如在动物或动物群可能存在的位置,包括例如饲养槽边或围栏边。在一些实施例中,本发明的方法可以在不超过约10、9、8、7、6、5、4、3、2或1分钟的平均时间内进行。在特定的实施例中,所述步骤在饲养槽边和/或围栏边进行,平均时间不超过约5分钟、2分钟或1分钟。
在一些实施例中,可以对从一组动物中的每只动物采集的样品执行白细胞差异细胞计数,并与感染指数进行比较,然后根据所述比较步骤可以将每只动物分配到正常亚组或异常亚组。
在一些实施例中,所述正常亚组的动物和所述异常亚组的动物可以一起喂养数周和/或数月,而仅对所述异常亚组的动物施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在一些实施例中,所述正常亚组的动物和所述异常亚组的动物一起喂养数周和/或数月,同时对所述正常亚组的动物和所述异常亚组的动物施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在一些实施例中,将所述异常亚组的动物与所述正常亚组的动物隔离开。
在附加实施例中,本发明提供了跟踪一组动物的疾病情况和/或治疗(例如抗生素治疗)的方法,包括:(a)选择动物组中的个体动物;(b)采集来自(a)的所述动物的样品;(c)对所述样品执行白细胞差异计数;(d)将(c)的所述白细胞差异计数与感染指数进行比较;(e)在所述比较步骤的基础上将所述个体动物分配到正常亚组或异常亚组;(f)生成所述动物的电子记录,包括所述动物的特征、所述动物的白细胞差异计数历史、所述动物的病史和所述动物的治疗和/或管理历史;以及(g)重复步骤(a)到(f),直到所述动物组中的所有动物被分配到所述正常亚组或所述异常亚组,并将所述电子记录存储在数据库中。
在一些实施例中,本文所述方法的采集步骤包括将所述样品分配到盒子中,并且所述执行或生成步骤可以使用所述盒子中的所述样品进行。
在一些实施例中,可以将所述盒子预热到预定温度,并且可以使用预热到基本相同的预定温度的盒读取器(cartridgereader)来进行所述执行步骤或生成步骤。
在一些实施例中,其中所述采集步骤包括将所述样品转移到自动显微镜盒中。
在一些实施例中,本发明的方法可包括步骤:对所述异常亚组的动物施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案,但不对所述正常亚组的动物施用;(ii)将所述异常亚组的动物送入医院治疗,但不将所述正常亚组的动物送入医院治疗;和/或(iii)将所述异常亚组的动物与所述正常亚组的动物进行隔离。
在一些实施例中,本发明的方法可以进一步包括步骤:喂养所述正常亚组的动物和/或所述异常亚组的动物;和/或(ii)定期记录所述正常亚组的动物的重量和/或所述异常亚组的动物的重量。
在一些实施例中,所述正常亚组的动物和所述异常亚组的动物一起喂养数周和/或数月,而仅对所述异常亚组的动物施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代或不同的管理方案。
本发明的管理方案的非限制性实例包括淘汰、抗生素治疗、免疫刺激治疗、个体化治疗、群组治疗和/或隔离。在一些实施例中,采用替代或不同的管理方案,表示管理方案可以与先前的管理方案不同。
在一些实施例中,所述正常亚组的动物和所述异常亚组的动物一起喂养数周和/或数月,同时对所述正常亚组的动物和所述异常亚组的动物施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
在一些实施例中,将所述异常亚组的动物与所述正常亚组的动物隔离开。
在一些实施例中,所述异常亚组的动物不施用抗生素治疗、抗感染治疗、益生菌治疗、免疫刺激治疗、附加监控和/或单独或替代管理方案。
本发明还提供了用于将健康信息传递给一方或多方的方法,其中按本文所述方法采集健康数据,将其上传到记录动物健康状态、治疗状态和/或亚组的网络数据库,并使所述一方或多方能够访问数据库。
在本发明的附加实施例中,提供了一种装置,包括:(a)具有至少第一内腔的壳体;(b)在所述第一内腔中的自动显微镜;(c)在所述第一内腔中的至少一个第一盒分配器;(d)在所述壳体中并与所述第一盒分配器可操作地连接的至少一个第一盒分配器通道门;(e)在所述壳体中并与所述第一盒分配器可操作地连接的至少一个第一新盒通道口;(f)在所述壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(g)与所述壳体可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器。
在一些实施例中,本发明的装置还能包括(h)在所述第一内腔中的第二盒分配器;(i)在所述壳体中并与所述第二盒分配器可操作地连接的第二盒分配器通道门;以及(j)在所述壳体中并与所述第二盒分配器可操作地连接的第二单独盒通道口。
在一些实施例中,本发明的装置还可包括与所述至少一个加热器可操作地连接的加热器控制器;以及在所述壳体中并与所述加热器控制器可操作地连接的至少一个温度传感器。
在另一实施例中,本发明提供了组合装置,包括:(a)具有至少第一内腔的第一壳体;(b)在所述第一内腔中的自动显微镜;(c)具有至少第二内腔的第二壳体;(d)在所述第二内腔中的至少一个第一盒分配器;(e)在所述第二壳体中并与所述第一盒分配器可操作地连接的至少一个第一盒分配器通道门;(f)在所述第二壳体中并与所述第一盒分配器可操作地连接的至少一个第一新盒通道口;(g)在所述第一壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(h)与所述第一和第二壳体中的每个可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器。
在一些实施例中,本发明的装置还能包括(i)在所述第二内腔中的第二盒分配器;(j)在所述第二壳体中并与所述第二盒分配器可操作地连接的第二盒分配器通道门;以及(k)在所述第二壳体中并与所述第二盒分配器可操作地连接的第二单独盒通道口。
在附加实施例中,本发明的组合装置还能包括与所述至少一个加热器中的每个可操作地连接的加热器控制器;以及在每个所述壳体中并与所述加热器控制器可操作地连接的至少一个温度传感器。
应当理解,本发明的方法可以用本发明的装置和/或本发明的组合装置实施。
另外,本发明提供了一种快速测试,其能方便地在动物移动关键时间进行或重复进行,以确定当前感染的可能风险(特别是被送往医院的几率)和对动物表现(体重增加)的影响,这样生产者可以做出管理决策(特别是与入栏和治疗有关的),以最大限度地提高个体动物的健康和经济效益。该预测工具将帮助生产者(例如,牛饲养者)在关于将动物送到饲养场和/或医院的动物管理上做出更明智的决策,从而实现准确的抗生素使用、降低的成本、改善的动物福利和更好的畜群管理实践。
尽管本发明的各方面主要针对肉牛进行描述,但本发明也可用于管理其他农场动物工业,例如猪和家禽。例如,猪移动到仔猪舍、后备猪培育舍、种猪群或肥育猪舍代表了猪的动物移动关键时间,与牛被送到饲养场相似。当动物被重新分组并在同一设施内移动时,或者在任何时候具有较高的暴露于感染的风险的情况下,本发明也是有用的。只要动物暴露于新的同圈动物或新环境中,就会增加可能导致感染的新病原体的传播风险。由于混合饲养使得动物暴露于新的潜在感染的动物移动关键时间的另一个例子是将牛从育犊母牛生产场(cow-calfoperation)转移到架子牛-育前牛生产场(stocker-backgrounderoperation)。
因此,本发明的一个方面是减少或靶向一组农场动物的抗生素治疗方法,或鉴定将受益于抗生素治疗、早期淘汰/收获、附加测试或单独管理方案的个体动物的方法,包括以下步骤:(a)选择该组的个体动物(例如,当通过单转移槽按顺序转移动物时);(b)从个体动物身上采集样本(例如,当动物在单转移槽中时);(c)生成来自血液样品(例如,当动物在单转移槽中时)的白细胞计数和/或差异细胞计数(例如,淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、嗜中性粒细胞或带状核嗜中性粒细胞计数,比如利用包括样品中每个相关细胞类型的数目和/或百分比的白细胞差异,单独使用或与血细胞类型的比例、组合细胞类型和组合细胞类型的比例、白细胞总数、体温和/或红细胞数组合使用,任选地与动物性别、品种、体重、年龄或体温组合使用);(d)将细胞计数与感染指数进行比较(例如,当动物在单转移槽中时);(e)根据感染指数将个体动物转移(例如,从单转移槽经单个门或至少一对门中的一个转移)到正常亚组或异常亚组(例如,通过:(i)将动物转移通过一个门或至少一对门,以分开围栏;和/或(ii)给被分配到异常亚组的动物施用抗生素,比如通过肠胃外注射,同时动物仍然单转移槽中,等等;通常,其中正常亚组和异常亚组都包含在相同或单独的集中动物饲养场(cafo)中,例如饲养圈));(f)重复步骤(a)至(e),直至该组所有动物都被分配到正常亚组或异常亚组。这些组可以或可以不进行物理隔离。
本发明的另一方面是确定一组农场动物或被集中并转移到围栏中的其他动物(例如,生猪(swine)或家猪(pig))需要抗生素治疗、附加测试、淘汰或替代管理的方法,或者确定一组农场动物或被集中并转移到围栏中的其他动物(例如,生猪(swine)或家猪(pig))进行抗生素治疗、附加测试、淘汰或替代管理的时间的方法,包括以下步骤:(a)从围栏或所述组中个体动物的一部分(例如,两个、三个、四个或五个或更多但不少于全部)中采集样品(例如,随机);(b)生成样品的白细胞差异计数;(c)将白细胞差异计数与感染指数进行比较;然后(d)根据上述结果,如果足够多的动物被感染,则采取措施(比如变化饲料配给量或使用抗生素等)来保护该组动物的健康。
本发明的又一方面是跟踪农场动物的疾病情况和/或抗生素治疗的方法,特别是在动物移动或混合时,包括步骤:(a)识别个体动物(例如,通过电子方式阅读动物身上或与动物连接的标签(例如,有源或无源rfid或条形码动物识别标签),或通过手动记录动物身上或与动物连接的字母数字指示器(例如,录入生成差异计数和/或白细胞计数的同一自动显微镜/读取器中));(b)从动物身上采集样品(例如,包括将样品转移到自动显微镜/读取器盒中);(c)将样品绑扎在动物身上(例如,通过电子方式读取所述盒上或与所述盒连接的标签(例如,有源或无源rfid或条形码盒识别标签),或通过手动记录所述盒上或与所述盒连接的字母数字指示器(例如,录入生成差异计数和/或白细胞计数的同一自动显微镜/读取器中));(d)生成样品的(例如,所有白细胞类型的)白细胞差异计数和/或白细胞计数;(e)将差异计数和/或白细胞计数与感染指数进行比较,以将个体动物分配到正常亚组或异常亚组(例如,适合采用抗生素治疗、免疫刺激剂治疗、益生菌、饲料添加剂、抗感染、住院、淘汰和/或隔离的组);(f)生成动物的电子记录(例如,存储在自动显微镜上和/或上传到万维网上的数据库),其包含动物的身份特征、白细胞差异计数和/或白细胞计数,任选但优选地,随后可对该记录进行审核,以确定只对异常亚组中的动物而不是正常亚组中的动物进行治疗;(g)重复步骤(a)至(f),直到所有来自该组的动物都进行了测试并被分配到正常亚组或异常亚组,并将电子记录存储在共同数据库中。在一些实施例中,该方法还包括输入与数据库中每只动物对应的电子记录中的每只动物的抗生素治疗数据;以及(h)任选地,但在一些实施例中是优选地,喂养两个亚组的动物至少1、2、3或4周,长达6周或更长时间(例如,对于家禽),或至少1、2、3或4个月,长达10个月或更长时间(例如,对于牛),但是仅给异常亚组的动物施用抗生素。
在前述的一些实施例中,该方法进一步包括喂养(两个亚组的)动物至少1、2、3或4周,长达6周或更长时间(例如,对于家禽或猪),或至少1、2、3或4个月,长达10个月或更长时间(例如,对于牛或猪),但是仅给异常亚组的动物施用抗生素。如果接受测试后(即,如在医院测试中),也可以对正常亚组进行治疗。
在前述的一些实施例中,所述生成步骤利用自动显微镜进行。
在前述的一些实施例中,所述采集步骤通过静脉穿刺(例如,从颈静脉或尾静脉)或毛细血管床切割(例如,在动物的耳朵或鼻子中)进行。
在前述的一些实施例中,所述采集步骤(b)、生成步骤(c)和比较步骤(d)一起在饲养槽边或围栏边进行,平均时间不超过5、4、3、2或1分钟。
在前述的一些实施例中,将异常亚组的动物与正常亚组的动物隔离,以将疾病传播降至最低程度,任选地对异常亚组的动物施用或不施用抗生素或免疫刺激剂(即,被隔离或仅住院)。
在前述的一些实施例中,正常亚组的动物采用天然或有机饲养方案或养护方案(例如,经认证的有机或无抗生素方案)。
在前述的一些实施例中,所述采集步骤包括将样品分配到盒(例如自动显微镜读取器盒)中,并且利用盒中的样品进行所述生成步骤(例如,将所述盒插入自动显微镜中)。
在前述的一些实施例中,将所述盒预热至预定温度(例如,约60、65、70、75、80、85、90、95、100、105、110华氏度等),利用预先加热到基本相同的预定温度(例如,在其五度或十度内)的盒读取器进行所述生成步骤。
在本发明的方法中,感染指数可以是,但不限于,a)嗜中性粒细胞值,其范围为约xnx103个细胞/微升至约ynx103个细胞/微升,其中xn为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6或1.7x103个嗜中性粒细胞/微升,yn为4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9或12.0x103个嗜中性粒细胞/微升;b)淋巴细胞值,其范围为约xl×103个细胞/微升至约yl×103个细胞/微升,其中xl为3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9或7.0x103个淋巴细胞/微升,yl为10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2或12.3x103个淋巴细胞/微升;c)嗜酸性粒细胞值,其范围为约xe×103个细胞/微升至约ye×103个细胞/微升,其中xe为0.0×103个嗜酸性粒细胞/微升,ye为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0x103个嗜酸性粒细胞/微升;以及d)(a)、(b)和(c)的任意组合。
前述的一些实施例还包括步骤:(i)对异常亚组的动物而不对正常亚组的动物施用抗生素或免疫刺激剂;(ii)将所述异常亚组的动物送入医院治疗,但不将所述正常亚组的动物送入医院治疗;和/或(iii)将异常亚组的动物与正常亚组的动物隔离;(iv)淘汰异常亚组的动物,其中选择任何上述管理决定可利用白细胞图谱进行辅助。
前述的一些实施例还包括步骤:(i)喂养正常亚组和/或异常亚组的动物;和/或(ii)周期性地记录正常亚组和/或异常亚组的动物重量(例如,并将该重量输入对应的每只动物的电子记录中)。
本发明还提供了用于将健康信息传递给不同动物所有者的方法,其中按本文所述方法采集健康数据,将其上传到记录动物健康状态或亚组的网络数据库,监护链上的下一个实体可访问数据以做出治疗、分组或管理决策。
本发明进一步提供了一种如本文所述的基于动物移动/混合时的饲养槽边/围栏边白细胞差异来预测动物表现(尤其是平均日增重和/或住院率)的方法。
在一些实施例中,所述采集步骤(b)、绑扎步骤(c)、生成步骤(d)和比较步骤(e)一起在饲养槽边或围栏边进行,平均时间不超过5、2或1分钟。
本文还描述了在减少一组农场动物的抗生素施用的系统中使用的装置,包括:(a)具有至少第一内腔的壳体;(b)在所述第一内腔中的自动显微镜;(c)在所述第一内腔中的至少第一盒分配器;(d)在所述壳体中并与所述第一盒分配器可操作地连接的至少第一盒分配器通道门(例如,用于向盒分配器中重新装填多个新盒,然后将其加热);(e)在所述壳体中(任选地在通道门中)并与所述第一盒分配器可操作地连接的至少第一新盒通道口;(f)在所述壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(g)与所述壳体可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器(例如,至基本相同的温度)。所述装置还包括:(h)在所述第一内腔中的第二盒分配器;(i)在所述壳体中并与所述第二盒分配器可操作地连接的第二盒分配器通道门;以及(j)在所述壳体中并与所述第二盒分配器可操作地连接的第二单独盒通道口;(k)与所述壳体具有基本相同的温度或者其他合适的操作温度的单独分开的加热腔。所述装置还包括:与所述至少一个加热器可操作地连接的加热器控制器;以及在所述壳体中并与所述加热器控制器可操作地连接的至少一个温度传感器。
本文还描述了在减少一组农场动物的抗生素施用的系统中使用的组合装置,包括:(a)具有至少第一内腔的第一壳体;(b)在所述第一内腔中的自动显微镜;(c)具有至少第二内腔的第二壳体;(d)在所述第二内腔中的至少第一盒分配器;(e)在所述第二壳体中并与所述第一盒分配器可操作地连接的至少第一盒分配器通道门(例如,用于向盒分配器中重新装填多个新盒,然后将其加热);(f)在所述第二壳体中(任选地在通道门中)并与所述第一盒分配器可操作地连接的至少第一新盒通道口;(g)在所述第一壳体中并与所述自动显微镜可操作地连接的填充盒插入口;以及(h)与所述第一壳体和第二壳体中的每个可操作地连接的至少一个加热器,其配置用于加热所述自动显微镜和所述至少第一盒分配器(例如,至基本相同的温度)。所述装置还包括:(i)在所述第二内腔中的第二盒分配器;(j)在所述第二壳体中并与所述第二盒分配器可操作地连接的第二盒分配器通道门;以及(k)在所述第二壳体中并与所述第二盒分配器可操作地连接的第二单独盒通道口。所述装置还包括:与所述至少一个加热器中的每个可操作地连接的加热器控制器;以及在每个所述壳体中并与所述加热器控制器可操作地连接的至少一个温度传感器。
由于公众健康对抗生素耐药性细菌的关注持续上升,这种细菌能直接和间接培育人的抗生素耐药性,因此动物农业面临着越来越大的压力,要求最大限度地减少抗生素的使用。2013年,美国疾病控制和预防中心(cdc)估计,由于抗生素耐药性,美国每年有超过200万人生病以及23,000人死亡。在美国,由于抗生素耐药性造成的经济损失估计每年有所不同,但是直接医疗保健成本可能高达200亿美元,每年损失可能高达350亿美元,包括生产力损失(以2008年美元计算)。2013年cdc出版物呼吁“改变使用抗生素的方式”,因为这“大大减缓抗生素耐药性感染的发展和传播可能是最重要的一项行动”。本发明旨在创造这种变化,通过为牲畜生产者提供快速、准确的筛选工具来将健康动物与将受益于抗生素干预的动物分开。
图1示意性地示出了本发明的一个实施例,其中即将进入的肉牛经分拣被分到具有感染的异常免疫特征的组(该组因此将进行抗生素治疗、附加测试或隔离、标记或单独管理,这些措施单独使用或与任何前述措施组合使用),以及具有正常、健康血液特征的组,该组不进行抗生素治疗、隔离或附加测试。无论何时提到治疗,它都可以与隔离、附加测试或单独管理互换使用。图2中更全面地示出了筛选和分拣。在非限制性示例实施例中,从所述组中选择动物,分配自动显微镜读取器盒并且在低温下时应当首先预热(其细节将在下面进一步讨论),将从动物采集的样品(在分配所述盒之前或之后)放入所述盒中,将所述盒插入自动显微镜读取器中,该读取器进行白细胞差异细胞计数并基于先前确定的感染指数生成该动物是否应当进行抗生素治疗的指示。然后将动物分配到适当的(正常/异常)组中,从读取器中取出所述盒,并对下一只动物重复该过程直至筛选完所有动物。
可以通过任何合适的技术采用任何合适的装置采集样品,比如喷枪、空心针、注射器、毛细管作用腔或其组合。目前用于从牛或奶牛采集血液或其他样品的优选装置是pct公开号wo2017/019743中描述的装置,其公开内容通过引用整体并入本文。从这类初始采集装置中,将未凝固的血液(有或没有抗凝血剂)转移到自动显微镜盒中。
可以进行白细胞差异细胞计数并且可以适用于实施本发明的自动显微镜盒和自动显微镜读取器的实例包括wardlaw、levine和rodriguez的美国专利号6,350,613和bresolin、calderwood等人的美国专利申请公开号us2014/0009596中描述的那些,其公开内容通过引用整体并入本文。通常,显微镜盒包括底部、光学透明顶部(“盖玻片”或“窗口”)、两者之间的平坦或楔形腔室以及与该腔室流体连通用于将样品填充至所述腔室中的端口。当插入自动显微镜时,可以通过“窗口”或“盖玻片”进行样品中细胞成像,并且可以从这些图像中自动生成白细胞计数和/或差异计数。
在动物离开已经完成了筛选程序的饲养槽或位置之前,或通过任何其他合适的技术,可以任选地借助于自动门和滑槽系统将动物朝特定亚组分配,比如pratt的美国专利号5,673,647和hulls的美国专利号8,418,660中描述的(其可以与确定“正常”或“异常”状态的装置相连或连接)。
图3-5示意性地示出了本发明的自动显微镜装置的非限制性实例。该装置大体上包括(如本领域中已知的)壳体和盒读取器(例如,用于接收所述盒、自动显微镜的xyz台)以及(任选地但在一些实施例中优选地)用于xyz台和自动显微镜的控制器,以及用于进行白细胞差异计数并生成异常指示的计算机和相关软件,所述异常指示可以指示感染或压力,或正常的话,指示无感染(这也可以位于单独的本地设备中,或远程地或“在云上”)。另外,该装置包括至少一个位于壳体内的新盒分配器(优选地,如图所示,至少两个,以及可选地三个或更多个),至少一个加热器,优选地加热器控制器,以及优选地至少一个温度传感器。加热器和温度传感器定位成使壳体的内容物(特别是盒分配器中的新盒)以及盒读取器保持在基本相同的温度下,以使如下文所述的在低温下读取盒的过程中使热冲击降至最小。所述壳体可设置有通道门(例如,顶部铰接、侧面铰接等),用于移除空的盒分配器并用填充有新盒的新盒分配器替换它。或者,所述盒分配器可以永久地或半永久地固定在壳体中,并且所述通道门构造成简单地允许用新盒重新装填空的分配器。可以提供用于移除单个新盒的另外的或单独的通道门(狭槽或开口),可选地采用机械或电动机械顶出机构。存在两个盒式分配器可以使得能对一个分配器中的新进装填的新盒进行升温,同时用另一个分配器分配先前加热好的盒子。
虽然在图3a-3b的实施例中,所述盒分配器和盒读取器放置在共同的壳体中,但在图4a-4b的替代实施例中,所述盒分配器和盒读取器包含在单独的壳体中,各部件分开放置在两个不同的壳体中,但是以协同方式调节温度使两者温度基本相同(例如,使用共同的控制器,或者使用以协同方式控制两个单元的两个单独的控制器)。
图6示出了根据一些实施例的示例性成像读取器10。成像读取器10包括相机12、样品14、控制器16和显示器18。如图所示,相机12配置用于对样品14进行成像,样品14可以例如使用样品盒插入成像读取器10中。相机12可包括用于对样品进行成像的任何光学部件,包括光源、透镜等。相机12可以是任何合适的成像设备,例如ccd设备,并且可以检测并生成各种信号的数字图像和/或强度值。所述成像读取器可以是自动显微镜装置。
本文所述的成像读取器10的各个部件可以是本领域已知的,或者是基于本公开和现有的自动显微镜装置对于本领域技术人员来说是其显而易见的变型,比如在bacus的美国专利号4,998,284;price的5,790,710;ramm的6,381,058;wardlaw的6,929,953;stuckey的6,927,903;perz的8,000,511;wardlaw的8,045,165;levine的8,081,303;sammak的美国专利申请号2001/0041347;或rodriguez的2009/0233329中描述的。成像读取器10可以是可从advancedanimaldiagnostics(researchtrianglepark(三角研究园),美国北卡罗莱纳州)购得的qscouttm读取器。
控制器16可以包括计算机处理器并且可以配置用于接收来自相机12的强度值和/或图像,分析强度值和/或图像并在显示器18上显示结果。
控制器16还可以配置用于实施本文描述方法的各种自动化步骤。
本发明的装置的非限制性实例是
在以下非限制性实施例中更详细地解释本发明。
实施例
作为一个示例,血液是使用任何合适的血液采集装置和转移装置从来自饲养槽边的肉牛的颈静脉、耳静脉、尾静脉等采集的。从采集装置和转移装置,血液被转移到自动显微镜盒中。在优选实施例中,所述盒具有一个微流体室,深15微米,具有9mm×18mm光学透明盖玻片,以能在冬季肉牛转移期间通常遇到的低温下实现快速装填。还有其他几何形状可以实现这一目的,比如(i)盖玻片,其一边为6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2、12.3、12.4、12.5、12.6、12.7、12.8、12.9、13.0、13.1、13.2、13,3、13.4、13.5、13.6、13.7、13.8、13.9、14.0、14.1、14.2、14.3、14.4、14.5、14.6、14.7、14.8、14.9、15.0、15.1、15.2、15.3、15.4、15.5、15.6、15.7、15.8、15.9、16.0、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、17.0、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8、17.9、18、18.1m,并且在同一平面内任意组合,从而使另一边可为6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0、11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2、12.3、12.4、12.5、12.6、12.7、12.8、12.9、13.0、13.1、13.2、13,3、13.4、13.5、13.6、13.7、13.8、13.9、14.0、14.1、14.2、14.3、14.4、14.5、14.6、14.7、14.8、14.9、15.0、15.1、15.2、15.3、15.4、15.5、15.6、15.7、15.8、15.9、16.0、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、17.0、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8、17.9、18、18.1mm;(ii)深度为5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.1、10.2、10.3、10.4、10.5、10.6、10.7、10.8、10.9、11.0,11.1、11.2、11.3、11.4、11.5、11.6、11.7、11.8、11.9、12.0、12.1、12.2、12.3、12.4、12.5、12.6、12.7、12.8、12.9、13.0、13.1、13.2、13,3、13.4、13.5、13.6、13.7、13.8、13.9、14.0、14.1、14.2、14.3、14.4、14.5、14.6、14.7、14.8、14.9、15.0、15.1、15.2、15.3、15.4、15.5、15.6、15.7、15.8、15.9、16.0、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、17.0、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8、17.9、18.0、18.1、18.2、18.3、18.4、18.5、18.6、18.7、18.8、18.9、19.0、19.1、19.2、19.3、19.4、19.5、19.6、19.7、19.8、19.9或20.0微米深;(iii)可能没有直线边和正交边(例如模制的波形边);(iv)可能不是平行的,因此可能具有0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0度的角(v)将具有预定的已知体积范围的样品面积(即,其观察面积乘以其深度)或将具有在每单位体积计算的细胞中使用的测量的已知体积,其可以为(a)手动输入到仪器中的或(b)由仪器通过编码技术(例如条形码或rfid)读取的。
合适的自动显微镜是aadqscout自动显微镜/白细胞读取器(可从advancedanimaldiagnostics公司(633davisdrive,suite460,morrisville(莫里斯维尔),nc27560usa)购得),其进行如上所述的改进以包含用于新盒的热保护存储区,并将自动显微镜本身保持在与那些新盒基本相同的温度下。通常,在化学和生物应用中重要的是将装置和盒保持在最低70华氏度,优选地接近90华氏度。由于该装置通常在室外操作并且在饲养场上暴露于非常低的温度,这种热保护是很重要的,防止在较冷的环境温度下可能发生的对白细胞的热“冲击”以及在将样品添加到新载玻片上时阻碍成功的染色渗透。
此外,将新盒和仪器保持在基本相同的温度下降低了热膨胀系数失配(cte不匹配)的影响。所述盒通常由多种材料制成,并且包含新鲜样品可以填充的空间或空隙。任何cte不匹配都可能导致轻微翘曲,导致细胞漂移出自动显微镜的焦平面。保持均匀的温度可以减少这种影响,从而减少焦点并减少得到结果的总体时间。否则,当玻片膨胀和收缩时,操作员将不得不不断地重新对焦以保持焦平面。
aadqscout读取器可以从样品(例如血液样品)生成以下结果:(1)每毫升中白细胞总数;(2)每毫升中淋巴细胞总数;(3)每毫升中嗜中性粒细胞总数;(4)每毫升中嗜酸性粒细胞总数;(5)每毫升中单核细胞总数;(6)每毫升中嗜碱性粒细胞总数;(7)嗜中性粒细胞百分比、嗜酸性粒细胞百分比、淋巴细胞百分比、单核细胞百分比和嗜碱性粒细胞百分比;以及(6)检测未成熟、未分段的嗜中性粒细胞,包括带状核嗜中性粒细胞。在非限制性实例中,如图6所示,生成基于每毫升总嗜中性粒细胞数和每毫升总淋巴细胞数的“感染指数”。另外,可任选地包括其他变量,比如上述血细胞类型的比例、细胞类型的组合和细胞类型组合的比例、白细胞总数、体温和/或红细胞数,任选地与动物的性别、体重、年龄和体温组合使用。
在图6中被鉴定为“异常”的动物可以具有多种病原体并且可以处于疾病周期的不同点。自动化差异使得能够检测“可疑病毒或可疑细菌”,从而使生产者能对动物进行隔离以改善畜群管理。动物可以被分为更有可能对治疗产生体重增加反应的组vs更有可能没有体重增加反应但已通过将动物送入医院围栏证明的更不可能出现基于治疗的临床疾病的组。
饲料场的常见做法是进行群体预防,对整组即将进入的牛群进行药物治疗。中度风险牛的初步研究表明,大约85%的牛是“正常的”,并且在抵达时不需要使用抗生素治疗。有10000头牛时,这相当于节约了100,000美元-200,000美元的抗生素,并减少了不必要的抗生素使用。此外,在我们的初步研究中,喂养抗生素的“正常”动物群和未喂养抗生素的“正常”动物群之间的平均日增重(adg)没有实质性差异。但是,喂养抗生素的“异常”动物与未喂养抗生素的“异常动物”之间的adg存在差异:在我们的初步研究中,经过40天的喂食后,经治疗的“异常”动物每天超过未经治疗的“异常”动物约0.35磅。
工作流程.对牛进行采样和测试的点到点过程可以由条形码读取器、rfid读取器和/或简单的数字键盘操纵。将动物的耳标或其他识别标签扫描到qscout读取器(或用键盘输入的id)中,抽取血样并将血液放入自动显微镜盒中。所述盒在底部标签上有自己的条形码,当所述盒缩回读取器时,该条形码由机载扫描器扫描。qscout读取器自动将该盒样品和测试结果与之前扫描的动物id相关联。测试结果存储于在qscout中用于机上报告的数据库中,并且还被推送到网站数据库,在该数据库中,生产者可以访问已测试的所有他的动物并且可以查看来自一个单元、多个单元、多个地点等的测试结果。
前述内容是对本发明的说明,但不应解释为是对其进行限制。本发明由以下权利要求以及其中包含的权利要求的等同体限定。
- 还没有人留言评论。精彩留言会获得点赞!