苦参药渣多糖合生元及其制备方法与应用与流程
本发明涉及苦参药渣多糖合生元及其制备方法,属于中药渣资源化技术和微生态制剂领域。
背景技术:
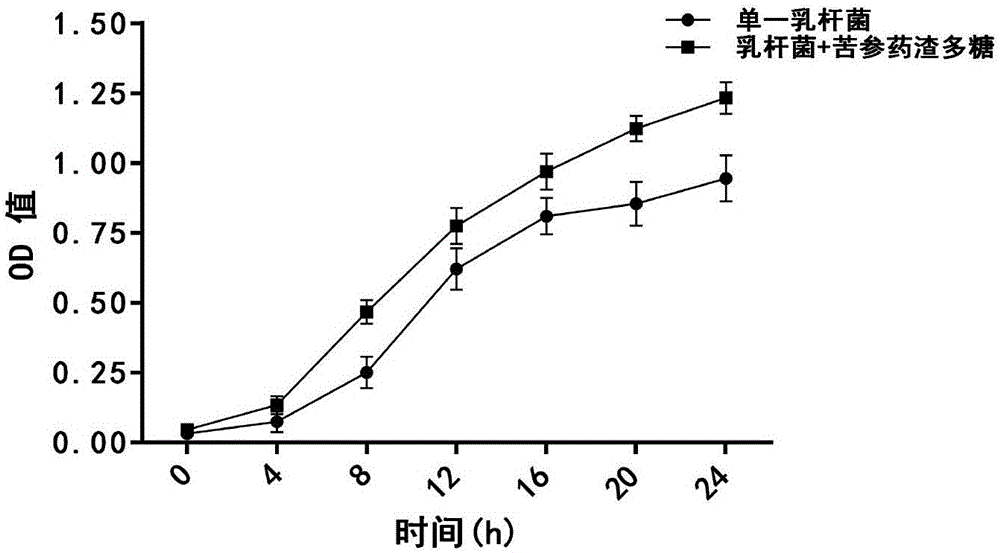
:中药资源性产品是国家的中药战略物资,是保障国民健康、发展民族医药产业的物质基础,中医药事业的健康发展有赖于中药资源的高效利用和可持续发展。随着我国大中药产业的快速发展和健康服务业的不断推进,以及国际市场对于自然资源性产品的青睐,促使中药及天然药用生物资源原料的生产规模不断扩大。与此同时,在中药资源产业化过程中也产生了巨量的中药废弃物,其主要来源于药材生产过程中的废弃组织器官、下脚料、中药提取物及资源性产品制造过程中产生的废渣、废水、废气等。目前对中药药渣的处理方法主要有:①作为废弃物集中堆放或掩埋,这样不仅占用大量土地,产生大量有害发酵气体,而且易污染地下水;②将中药药渣干燥后焚烧,但焚烧后产生大量烟尘、二氧化碳等排放物,造成环境污染和资源的极大浪费。如何有效利用中药渣是实现中药可持续化和现代化的一个亟待解决的问题。目前对于中药药渣的转化利用技术较多,如资源性化学成分的再提取、微生物发酵、酶解、制备活性炭、作为有机肥、饲料添加剂和真菌培养基质等。其中利用中药药渣中活性组分与益生菌联合应用(合生元)的研究较为突出。合生元是一种由益生菌(如乳酸菌、芽孢杆菌、光合细菌等)和益生元(如低聚糖、皂苷类、蒽醌类等)按照一定工艺配制而成的微生态活性物质。其主要的功效是调节肠道菌群结构,促进有益微生物在肠道内的定殖,减少病原微生物的数量,提高机体免疫力,改善肠黏膜屏障功能,提高肠道消化能力,促进营养物质的吸收。目前合生元的制备方法主要有两种:配伍型合生元和发酵型合生元。配伍型合生元是把有益菌与中药直接配合使用。其优点在于保证有益菌与中药各自性能的稳定性,但该方法没有充分发挥两者之间的互相促进作用,特别是益生菌对益生元促进代谢的作用的利用十分有限。发酵型合生元则在这方面优势明显,在益生菌在发酵的同时,自身生长代谢往往也得以促进。因此最后的发酵产物既含有较高的有益菌浓度,又含有优良的益生元成分,可作为标准而理想的合生元。目前合生元的生产多采用常规的配伍型,发酵型合生元的理论研究较为成熟,但其应用开发较少。苦参,为豆科植物苦参sophoraflavescensait.的干燥根,其味苦,性寒,具有清热燥湿,杀虫利尿等功效。苦参作为常用大宗中药材品种,市场需求量逐年增大,与此同时其制剂过程产生的固体废弃物及副产物数量巨大,且无有效利用途径而废弃,造成资源浪费,长此以往不利于苦参资源产业的绿色、可持续发展。有研究报道,苦参根中含有丰富的多糖类成分,其多糖主要由半乳糖、甘露糖组成,具有良好的抗氧化活性。研究表明苦参药渣中含有约10%左右的多糖类成分,目前鲜见对苦参药渣中多糖类成分的资源化利用报道,利用中药渣中多糖类成分制备合生元的研究也较少,也未见相关产品。因此,将苦参药渣多糖与植物乳杆菌共同发酵生产制备合生元,不仅可有效地利用苦参药渣资源,还可得到优良的合生元制剂,该发明对中药废弃物资源的综合高效利用具有积极的推动作用。技术实现要素:发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种苦参药渣多糖合生元及其制备方法。本发明另一个目的是提供苦参药渣多糖合生元在制备肠道微生态调节、改善肠道屏障及消化能力和增强免疫力的保健品或动物饲料添加剂中的应用。技术方案;为了实现以上目的,本发明采取的技术方案为:一种苦参药渣多糖合生元,它是由植物乳杆菌发酵苦参药渣多糖制备得到。作为优选方案,以上所述的一种苦参药渣多糖合生元,苦参药渣多糖由摩尔比为0.20:0.44:2.14:1.03:1.00:0.31的半乳糖、甘露糖、葡萄糖、木糖、鼠李糖及阿拉伯糖组成。一种苦参药渣多糖合生元的制备方法,包括以下步骤:(1)将mrs培养基(乳酸细菌培养基)初始ph值控制在6.4~6.6之间,并经高压灭菌、冷却、静置;(2)将苦参药渣多糖以1~5g/l的浓度加入到步骤(1)的mrs培养基中;然后经微孔滤膜过滤,分离,收集滤液;(3)在无菌操作台下,将活化后的植物乳杆菌按体积比1%~5%的接种量接种在上述步骤(2)含有苦参药渣多糖的mrs培养基的滤液中,分装,封口;(4)将上述滤液以静置状态放置在37℃的厌氧培养箱中培养,培养时间为12~30h;培养后的菌液经冷冻干燥后,既得苦参药渣多糖合生元冻干粉。作为优选方案,以上所述的苦参药渣多糖合生元的制备方法,乳酸细菌培养基(mrs培养基)的初始ph值为6.5。作为优选方案,以上所述的苦参药渣多糖合生元的制备方法,微孔滤膜孔径为0.22μm。作为优选方案,以上所述的苦参药渣多糖合生元的制备方法,苦参药渣多糖是按以下方法制备得到的:称取苦参药渣干燥样品,加入石油醚脱脂,脱脂后样品烘干,加入乙醇,回流提取,趁热滤过,滤渣用热的乙醇,洗涤,滤渣干燥后,加入水,加热回流提取,得提取液,减压浓缩水提液至适当体积,缓慢加入无水乙醇,使含醇量达到80~85%,静置过夜,离心,得上清滤液和沉淀,沉淀即为苦参药渣粗多糖;称取苦参药渣粗多糖,溶解于纯水中,得多糖水溶液,称取三氯乙酸,溶解于纯水中,制成三氯乙酸溶液;将粗多糖和三氯乙酸溶液混匀,静置过夜,离心取上清,再加入和上清液同体积的三氯乙酸溶液,进行二次除蛋白;将除完蛋白后的多糖溶液减压浓缩至一定体积,缓慢加入无水乙醇,使其含醇量达80~85%,静置过夜后,用布氏漏斗抽滤,得到的沉淀即为除去蛋白后的苦参多糖;将苦参多糖沉淀溶于去离子超纯水中,经ab-8型大孔吸附树脂吸附,进行脱色、除杂处理,冷冻干燥后即得苦参药渣多糖。作为更加优选方案,以上所述的苦参药渣多糖合生元的制备方法,苦参药渣多糖是按以下方法制备得到的:称取苦参药渣干燥样品1.0kg,按1:10(m/v)比例加入石油醚脱脂两次,脱脂后样品烘干,加入10倍量的80%乙醇,80℃水浴回流提取2h,趁热滤过,滤渣用热的80%乙醇,洗涤2~3次,滤渣干燥后,加入10倍量的纯水于150℃加热回流,提取两次,每次2h,合并提取液。减压浓缩水提液至适当体积,缓慢加入无水乙醇,使含醇量达到80%,4℃静置过夜,离心,得上清滤液和沉淀,沉淀即为苦参药渣粗多糖。称取苦参药渣粗多糖100g,溶解于1.0l纯水中,得多糖水溶液。称取三氯乙酸100g,溶解于纯水中,制成5%三氯乙酸溶液。将粗多糖和三氯乙酸溶液按体积比1:1混匀,4℃静置过夜,离心取上清,再加入和上清液同体积的三氯乙酸溶液,进行二次除蛋白。将除完蛋白后的多糖溶液减压浓缩至一定体积,缓慢加入无水乙醇,使其含醇量达80%,于4℃静置过夜后,用布氏漏斗抽滤,得到的沉淀即为除去蛋白后的多糖。将该沉淀溶于去离子超纯水中,经ab-8型大孔吸附树脂吸附,进行脱色、除杂处理,冷冻干燥后即得苦参药渣多糖。作为优选方案,以上所述的苦参药渣多糖合生元的制备方法,步骤(2)苦参药渣多糖的发酵终浓度为2.0g/l。本发明提供的苦参药渣多糖合生元可通过改善小鼠肠道菌群多样性及菌群组成结构,促进有益菌的生长,降低有害菌的数量,可提高肠道消化酶活力,保持肠道黏膜的完整性和通透性,维护肠道屏障功能,降低机体内毒素、二胺氧化酶、d-乳酸和炎症因子的水平。有益效果:1、本发明首先创造性的提取得到苦参药渣多糖,并添加入优选的植物乳杆菌,苦参药渣多糖与植物乳杆菌共同发酵生产制备合生元,不仅可有效地利用苦参药渣资源,还可得到优良的合生元制剂,该发明对中药废弃物资源的综合高效利用具有积极的推动作用。2、实验结果表明,且本发明提供的苦参药渣多糖作为发酵来源,如图1所示,能很好的促进植物乳杆菌的生长。表明本发明提供的苦参药渣多糖是植物乳杆菌繁殖的优良营养源。3、本发明制备得到的苦参药渣多糖合生元可提高肠道消化酶活力,保持肠道黏膜的完整性和通透性,维护肠道屏障功能,降低机体内毒素、二胺氧化酶、d-乳酸和炎症因子的水平,能有效调节机体肠道保持健康的状态,促进机体对营养物质的吸收,可提高机体的免疫力,具有重要的应用价值。附图说明图1为单一植物乳杆菌及苦参药渣多糖-植物乳杆菌共培养的生长曲线。具体实施方式以下结合实施例和试验数据对本发明发的技术特征和优点作详细的说明。实施例1植物乳杆菌的驯化将植物乳杆菌接种于含5g/l的苦参药渣多糖的mrs培养基中,30℃培养24h,连续传5代,然后接种到含2g/l苦参药渣多糖的mrs培养液中培养24h,连续传3代,获得适应苦参药渣多糖的植物乳杆菌,放在2~8℃冰箱中,保存备用。实施例2苦参药渣多糖合生元的制备(1)用1mol/l的naoh调节mrs培养基ph值,使其ph值为6.5,然后高温高压灭菌20分钟。将100mlmrs液体培养基装入250ml锥形瓶中,加入0.2g苦参药渣多糖(苦参药渣多糖的制备方法为:称取苦参药渣干燥样品1.0kg,按1:10(m/v)比例加入石油醚脱脂两次,脱脂后样品烘干,加入10倍量的80%乙醇,80℃水浴回流提取2h,趁热滤过,滤渣用热的80%乙醇,洗涤2~3次,滤渣干燥后,加入10倍量的纯水于150℃加热回流,提取两次,每次2h,合并提取液。减压浓缩水提液至适当体积,缓慢加入无水乙醇,使含醇量达到80%,4℃静置过夜,离心,得上清滤液和沉淀,沉淀即为苦参药渣粗多糖。称取苦参药渣粗多糖100g,溶解于1.0l纯水中,得多糖水溶液。称取三氯乙酸100g,溶解于纯水中,制成5%三氯乙酸溶液。将粗多糖和三氯乙酸溶液按体积比1:1混匀,4℃静置过夜,离心取上清,再加入和上清液同体积的三氯乙酸溶液,进行二次除蛋白。将除完蛋白后的多糖溶液减压浓缩至一定体积,缓慢加入无水乙醇,使其含醇量达80%,于4℃静置过夜后,用布氏漏斗抽滤,得到的沉淀即为除去蛋白后的多糖。将该沉淀溶于去离子超纯水中,经ab-8型大孔吸附树脂吸附,进行脱色、除杂处理,冷冻干燥后即得苦参药渣多糖),然后用孔径为0.22μm微孔滤膜过滤,分离滤液。(2)在无菌操作台下,将实施例1活化后的植物乳杆菌按体积比2%的接种量接种在上述步骤(1)含有苦参药渣多糖的mrs培养基的滤液中,分装后封口。(3)将上述含有植物乳杆菌的滤液静置放置于37℃厌氧培养箱中培养24h。培养后的菌液经冷冻干燥后既得苦参药渣多糖合生元冻干粉,放在2~8℃冰箱中,保存备用。对照实施例(1)用1mol/l的naoh调节mrs培养基ph值,使其ph值为6.5,然后高温高压灭菌20分钟。将100mlmrs液体培养基装入250ml锥形瓶中。(2)在无菌操作台下,将实施例1活化后的植物乳杆菌按体积比2%的接种量接种在上述步骤(1)mrs培养基的滤液中,分装后封口。(3)将上述含有植物乳杆菌的滤液静置放置于37℃厌氧培养箱中培养24h。培养后的菌液经冷冻干燥后,既得植物乳杆菌发酵对照物,放在2~8℃冰箱中,保存备用。实施例3下面结合饲养试验、生化检测试验和微生物学检验,对本发明作进一步的描述:一、动物饲养实验(一)试验动物的选择、分组与实验设计icr小鼠(4周龄,雄性,18-22g);购自南京青龙山动物养殖场,所有动物饲养条件均为spf级,22℃,昼夜循环12h条件下饲养,适应喂养1周以后。随机分组,每组8只,每天灌胃一次,续灌胃28d。受试药物:植物乳杆菌、苦参药渣多糖(按实施例1方法制备得到)、苦参药渣多糖合生元(实施例2制备得到,以下简称合生元)。对照实施例。具体的实验动物分组及给药剂量见表1。表1实验动物分组和给药剂量组别剂量灌胃量/ml空白组生理盐水0.3低剂量植物乳杆菌100mg/kg0.3高剂量植物乳杆菌200mg/kg0.3低剂量苦参药渣多糖108cfu/kg0.3高剂量苦参药渣多糖109cfu/kg0.3实施例2低剂量合生元100mg/kg0.3实施例2高剂量合生元200mg/kg0.3对照实施例发酵物低浓度100mg/kg0.3对照实施例发酵物高浓度200mg/kg0.3(二)试验指标测定小鼠灌胃结束后24h进行解剖,解剖前禁食禁水,称重后,摘眼球取血,断颈处死。血液于4℃静置1h后离心(3,000rpm,10min,4℃),取上层血清。血清二胺氧化酶(dao)、d-乳酸(d-la)、内毒素(et)、抗肿瘤坏死因子(tnf-α)按照对应elisa试剂盒说明书的操作步骤测定。解剖时取出完整的心脏、肝脏、脾脏、胸腺、肺和肾脏组织,生理盐水中清洗后,用滤纸吸干,精确称量其质量。用剪刀分别剪取十二指肠、回肠部位肠段约2cm,用生理盐水冲洗后,回肠肠段放置于中性福尔马林溶液中固定,经石蜡包埋,切片,脱腊后用苏木精-伊红(haematoxylineosin,h&e)染色,在显微镜下观察肠黏膜结构。十二指肠肠段立即放入液氮中保存。测定时取出肠段,用冰生理盐水10倍稀释、匀浆,收集匀浆液,离心(6,000rpm,10min,4℃),吸取上清液,按照淀粉酶(amylase)活性测定试剂盒、胰蛋白酶(trypsin)活性测定试剂盒、脂肪酶(lipase)活性测定试剂盒、碱性磷酸酶(alp)活性测定试剂盒的说明书中的操作步骤测定各消化酶的活性。于灌胃第28d收集每组小鼠新鲜粪便约0.2g。用2ml去离子水溶解,涡旋混匀。离心(6,000rpm,10min)后吸取上清液用ph计测定其ph值。取新鲜粪便约0.1g,用自动水分测定仪测定粪便中的含水量。(三)试验结果由表2中数据可以看出,植物乳杆菌组、苦参药渣多糖组以及苦参药渣多糖合生元组均能显著提高小鼠的肺指数。高剂量合生元组能显著提高小鼠的心脏指数、胸腺指数,其它给药组对小鼠的脏器指数均无显著的影响。此结果提示苦参药渣多糖合生元能够改善小鼠体质,增强脏器分化和免疫力,使其脏器指数升高。表2小鼠脏器指数的结果注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。由表3中数据可以看出,苦参药渣多糖合生元组的小鼠粪便含水量较低,结合实验中的观察,空白组粪便略稀,不易成形,而合生元组的粪便质地较硬,易于成形,有利于排便。肠道内环境的ph值对于维持肠道健康非常重要,肠道各种消化酶和有益菌的生长需要稳定合适的ph值,肠道ph值过高会导致一些腐生菌在肠道内大量繁殖,代谢产生一些致癌物质。单一乳杆菌、苦参药渣多糖以及苦参药渣多糖合生元均能不同程度的下调小鼠肠道ph值,其中苦参药渣多糖合生元组效果最优。说明苦参药渣多糖合生元能降低小鼠肠道中的游离氨类物质,下调肠道ph值,改善肠道微环境。表3小鼠粪便含水量、ph值及氨含量结果注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。小鼠血清指标如表4所示。从表4中可以看出,合生元可以显著降低小鼠血清中tnf-α、dao及d-lac的含量。说明合生元能够阻止dao和d-lac进入血液,改善小鼠的肠道黏膜屏障功能,维持肠黏膜的完整性。血清中tnf-α和内毒素水平的下降说明合生元能够降低体内炎症反应的发生,增强小鼠的免疫能力。表4小鼠血清中et、tnf-α、dao及d-lac的含量结果注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。小鼠回肠组织病理切片结果表示,回肠组织的绒毛高度、隐窝深度、黏膜厚度及绒毛高度/隐窝深度(v/c)见表5。从表中结果可以看出,合生元可以显著提升小鼠回肠的绒毛高度、黏膜厚度及v/c值。说明合生元可以提升小鼠回肠组织表面积,加快细胞生长,对营养物质的消化和吸收功能增强。表5小鼠回肠绒毛高度、隐窝深度、黏膜厚度及绒毛高度/隐窝深度(v/c)注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。小鼠肠道内消化酶活性如表6所示。实验结果表明,本发明制备得到的合生元能显著提升小鼠肠道内各种消化酶的活性,有利于降解食物中的淀粉、蛋白质和脂质,提高小肠的消化能力,增强小肠对营养物质的吸收。表6小鼠肠道内消化酶活性注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。各组小鼠肠道内容物中优势菌群依次为厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、变形菌门(proteobacteria)、放线菌门(actinobacteria)以及其他一些菌群如软壁菌门(tenericutes)、脱铁杆菌门(deferribacteres)等。各组菌群结构类似,但组成比例有所不同。不同组别之间的厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)及变形菌门(proteobacteria)组成比例及f/b/p值见表7,相比于空白组,合生元组的f/b/p值有明显的上升,说明合生元能改变小鼠肠道的菌群组成结构。表7不同给药剂量下各组之间的厚壁菌门(f)、拟杆菌门(b)及变形菌门(p)组成比例及f/b/p值注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。小鼠肠道内特征性差异菌属结果如表8所示,合生元组可以显著提高小鼠肠道内一些菌的数量。例如,lactobacillus(乳杆菌属)在合生元组中的丰度显著高于空白组、单一植物乳杆菌、单一苦参多糖组和对照例培养物。肠道内的lactobacillus能促进消化酶的分泌,其产生的代谢产物能抑制肠道内产胺的有害菌群的生长,维护肠黏膜屏障的完整性,通过激活肠道自身免疫系统功能来提高机体的免疫力。另一方面,合生元可以降低肠道内一些有害菌的数量,抑制其生长。例如desulfovibrio(脱硫弧菌)在合生元组中显著低于正常组。desulfovibrio被认为与肠息肉和溃疡性结肠炎的发生密切相关,降低desulfovibrio在肠道内的数量对维持肠道健康有重要的意义。对比结果表明,单纯给予小鼠外源性植物乳杆菌、苦参药渣多糖或对照例培养物并不能改变增加肠道内乳杆菌的数量,而合生元却能显著地提升小鼠肠道内lactobacillus的数量。表8小鼠肠道内特征性差异菌属注:与空白组相比,*表示p<0.05表示显著性差异,**表示p<0.01表示极显著差异。在本发明筛选表明中,苦参药渣多糖能促进乳杆菌的生长,而将苦参药渣多糖与植物乳杆菌发酵制备合生元,乳杆菌能利用和分解苦参药渣多糖并定殖与肠道内,同时苦参药渣多糖能诱导和刺激肠道内一些有益肠道菌的生长,抑制有害菌的繁殖。乳杆菌和苦参药渣多糖两者互相协同,共同改善小鼠肠道的微生态环境。从上述实施例可知,本发明苦参药渣多糖合生元可以调节动物肠道微生态,改善动物肠道屏障及消化能力,增强动物的免疫力。应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1