一种具有提高性功能功效的牡蛎肽及其制备方法与流程
本发明涉及一种具有提高性功能功效的牡蛎肽及其制备方法,属于生物技术领域。
背景技术:
牡蛎,又名生蚝,生长在温、热带海洋中,属于牡蛎科的双壳类软体动物。其肉质细嫩、鲜味突出、口感独特,已逐渐成为人们颇为喜爱的餐桌美食。
研究表明,牡蛎除了口感较佳外,还具有蛋白含量高脂肪含量低的特点,并且含有人体所需的8种氨基酸,还有糖元、牛磺酸、胱氨酸、维生素a、维生素b1、维生素b2、维生素d、维生素e、岩藻糖及铜、锌、锰、钡、磷、钙、镁、铝和有机质等,因此,近年来以牡蛎为原材料进行药物或保健品研究的报道也层出不穷。
现阶段,为了能够进一步提高人体对牡蛎中营养成分的吸收,多以牡蛎为原料进行酶解,从而分离出具有对生物机体的生命活动有益或具有生理作用的不同小肽。这些小肽具有一定的人体代谢和生理调节功能,可以在肠道内直接被吸收,吸收速度较直接食用牡蛎更为迅速,所以对牡蛎进行酶解生成牡蛎肽是牡蛎深加工的新方向。
目前在牡蛎肽的生产过程中,多以为人体提供更多的营养以抗疲劳、提高免疫力为方向对牡蛎进行酶解,因此在酶解过程中会不可避免损失掉一些具有其他功能性的肽段,窄化了牡蛎的应用范围,影响了牡蛎深加工的进一步发展。
技术实现要素:
本发明提供一种牡蛎肽,该牡蛎肽通过其中包含一定质量含量的特定功能肽段,异亮氨酰精氨酸(ile-arg,ir)、精氨酰异亮氨酸(arg-ile,ri)以及缬氨酰精氨酸(val-arg,vr),因而在促进睾酮、二氢睾酮分泌等方面能表现出良好功效。
本发明还提供一种上述牡蛎肽的制备方法,通过对牡蛎肉原料酶解以及分离纯化工序的控制,使产物明确含有一定质量含量的异亮氨酰精氨酸(ile-arg,ir)、精氨酰异亮氨酸(arg-ile,ri)以及缬氨酰精氨酸(val-arg,vr)等功能性肽段。
本发明还提供一种上述牡蛎肽在提高性功能产品中的应用。
本发明提供一种牡蛎肽,所述牡蛎肽组成中至少包括肽段异亮氨酰精氨酸(ile-arg,ir)、精氨酰异亮氨酸(arg-ile,ri)以及缬氨酰精氨酸(val-arg,vr);
具体地,基于牡蛎肽的总质量(干基),ri的质量含量≥3.60mg/100g、ir的质量含量≥7.60mg/100g、vr的质量含量≥6.50mg/100g。
除此之外,上述牡蛎肽还具备平均分子量小易吸收的特点,具体地,牡蛎肽中分子量小于1000u的肽的质量含量≥90%。
本发明的牡蛎肽是以剥壳后的牡蛎肉为原料,依次进行蛋白富集处理(酸处理去除脂肪和多糖)、蛋白变性处理(碱处理)、酶解处理(中性蛋白酶和木瓜蛋白酶)以及分离纯化处理得到;其中,酶解处理中控制酶解时间为3-6h,酶解温度以中性蛋白酶和木瓜蛋白酶的最佳活性温度确定,具体可以为45-55℃。
在具体制备时,首先对牡蛎肉进行酸处理,即对牡蛎肉中的脂肪、多糖等成分进行分离,从而提高酶解底物的蛋白含量,实现蛋白富集,提升酶解效率;然后对蛋白富集后的产物进行蛋白变性处理,一定温度下通过碱的作用使牡蛎蛋白发生变性,微观上表现应该是牡蛎蛋白的空间结构被破坏,更多牡蛎蛋白的酶解点位得以暴露,进一步有利于酶解效率的提升;蛋白变性处理结束后,以蛋白变性产物作为酶解底物,利用中性蛋白酶和木瓜蛋白酶进行酶解,酶解产物经灭酶(例如升温至115-125℃并保温15s),得到酶解液。
酶解处理中,需要对酶的用量进行控制以尽可能保证产物中的肽段ri、ir以及vr具有较高质量含量。以牡蛎肉原料的质量为基准,每1000g牡蛎肉原料可以利用0.8-1.6au中性蛋白酶,100000-300000u木瓜蛋白酶。
酶解液进行分离纯化处理,得到本发明的牡蛎肽。
酶解液的分离纯化处理主要包括离心、过滤以及柱层析处理。
具体地,先对酶解液进行离心,收集离心上清液;然后对离心上清液进行过滤以分离其中的大分子物质,例如可以采用孔径为50-200nm陶瓷膜;最后,依次利用阳离子交换层析柱和疏水层析柱对过滤后的滤液进行柱层析处理,从而使酶解液中的肽段ri、ir以及vr得以保留。在具体实施方式中,阳离子交换层析柱的填料可采用732型阳离子交换树脂,且粒径在0.315-1.25mm之间;疏水层析柱的填料采用octylsepharose4ff型疏水介质,且粒径在45-165μm之间。
随后,对柱层析处理收集的液体产物进行浓缩干燥,得到所需要的牡蛎肽,其中至少含有了肽段ri、ir以及vr。
研究表明:上述含有特定质量含量ri、ir以及vr肽段的牡蛎肽能够显著促进睾酮、二氢睾酮的生成,有助于性功能的改善;此外,牡蛎肽中分子量小于1000u的成分所占比例高于90%,从而被人体肠道完整吸收,更易在人体内发挥作用。
本发明还提供上述牡蛎肽的制备方法,包括以下步骤:
1)将牡蛎肉原料加水成混合料液,向所述混合料液中加入浓盐酸并搅拌,离心,收集沉淀;
2)向所述沉淀加水制成浆液后,加入碱后在85-90℃处理使蛋白变性,得到变性牡蛎蛋白溶液;
3)向所述变性牡蛎蛋白溶液中加入中性蛋白酶和木瓜蛋白酶进行3-6h酶解处理,灭酶后,制得酶解液;
4)将所述酶解液离心后,对离心上清液依次进行过滤、柱层析处理,得到所述牡蛎肽。
本发明对所采用的牡蛎品种以及产地不做限制,并且牡蛎肉原料可以是剥壳后的新鲜牡蛎肉,也可以是解冻后的牡蛎肉。将牡蛎肉原料洗净后,为了使后续蛋白富集处理以及蛋白变性处理效果更好,可以将洗净后的牡蛎肉利用绞肉机进行绞碎处理。
进一步地,步骤1)中牡蛎肉原料与水的质量体积比为1:(5-8)即:1kg的牡蛎肉原料与5-8l的水进行混合制备混合料液。随后,控制温度为20-30℃,向混合液中加入浓盐酸且搅拌60-120min,离心(3000-4000rpm,10min)收集沉淀。上述操作的目的是使牡蛎肉中的脂肪和多糖分子等成分与蛋白分离而留在离心上清液中,使牡蛎肉中的蛋白被富集于沉淀中,从而有利于提高后续酶解处理的效率。一般用浓酸处理,从操作和产物的安全性及便利性考虑,可以使用浓盐酸,浓盐酸的用量以牡蛎肉原料计,具体地,每千克牡蛎肉原料中加入浓盐酸3-5ml。
收集步骤1)中的沉淀后,向其中加入水搅拌制成浆液。其中,水的用量以牡蛎肉原料计,每1kg的牡蛎肉原料向沉淀中加入0.5-1l的水进行搅拌制备浆液。该处理能够将蛋白被富集的沉淀物加入适量水制成具有一定流动性的浆液,利于后续的变性处理和酶解。加水过少时浆液流动性差,不利于酶制剂的作用,易导致酶解效率降低;而加水过多时反应体积过大,后续处理(例如浓缩等)的负荷增加,也可能导致产物组成和结构的改变,此外处理成本也会相应增加。其中,水可以采用纯水、蒸馏水、去离子水等。本发明在制备混合液和浆液时可以采用蒸馏水。
进一步地,步骤2)中的蛋白变性处理是在碱性的高温环境下进行,可以向制成的浆液中加入碱性物,一般用强碱,常用的是氢氧化钠或氢氧化钾,可以向浆液中直接加入固体碱。具体地,向浆液加入氢氧化钠固体,85-90℃下保温并持续搅拌60-120min,其中,每公斤所述牡蛎肉原料中加入氢氧化钠固体0.8-1.0g。该条件能够将牡蛎原料中天然存在的蛋白酶灭活,避免其对中性蛋白酶和木瓜蛋白酶的酶解效果造成影响,同时还能破坏牡蛎蛋白的空间结构,暴露出更多的酶切位点,易于被蛋白酶酶解。此外,所述浆液中蛋白质含量较高,在碱性环境中适度水解还有助于解决浆液流动性差、溶液粘稠的问题,有利于后续酶解的进行。
本发明人对于如何使牡蛎肉的酶解产物中能含有预期质量含量的ri、ir以及vr肽段进行了大量研究摸索,证明酶制剂的选择及相应的分离工艺对结果具有关键影响。发明人在研究过程中意外地发现,只有同时采用中性蛋白酶以及木瓜蛋白酶进行酶解,既有助于同时得到ri、ir以及vr肽段,还有利于后续对ri、ir以及vr肽段的分离纯化,从而进一步保证使ri的质量含量≥3.60mg/100g、ir的质量含量≥7.60mg/100g、vr的质量含量≥6.50mg/100g。
特别是,在本发明的酶解中,基于牡蛎肉原料的质量,中性蛋白酶的用量为0.8-1.6au/1000g,木瓜蛋白酶的用量为100000-300000u/1000g,即,每千克牡蛎肉原料需要用0.8-1.6au的中性蛋白酶以及100000-300000u的木瓜蛋白酶。本发明的酶解在中性蛋白酶和木瓜蛋白酶的最佳活性温度下进行,例如45-55℃,并且控制酶解时间为3-6h,酶解时间过短(<1h)不利于蛋白的降解,而时间过长(例如超过7h)可能导致目标肽段的进一步降解。上述酶解还可有利于形成分子量较小的成分(例如分子量小于1000u的肽),从而有利于人体吸收。
酶解完成后,可以采用本领域常规灭酶手段进行灭酶,例如升温至115-125℃并维持15s左右。
进一步地,可控制步骤4)中离心的转速为3000-4000rpm且时间为10min左右,离心可以采用本领域常用设备进行,例如管式离心机等。离心结束后,收集离心上清液并采用孔径为50-200nm的陶瓷膜对离心上清液进行过滤。该过滤可以进一步筛出酶解液中的大分子蛋白,保留其中的ri、ir以及vr肽段并提高ri、ir以及vr肽段的质量含量。
在本发明中,对过滤后的滤液可以进行柱层析处理。柱层析处理包括对滤液依次利用阳离子交换层析柱和疏水层析柱进行处理。具体地,利用阳离子交换层析柱进行处理包括:将滤液以1-5cm/min的线速度通过阳离子交换层析柱,再用蒸馏水清洗阳离子层析柱1-3cv,再用200mmol/l氯化钠溶液流洗1-3cv,最后用700mmol/l氯化钠溶液洗脱并收集阳离子洗脱液2-4cv;随后,将上述阳离子洗脱液以1-5cm/min的线速度通过疏水层析柱,再用700mmol/l氯化钠溶液清洗疏水层析柱1-3cv以去除未被吸附的杂蛋白,最后用蒸馏水洗脱疏水层析柱1-3cv并收集。
阳离子交换层析柱进行再生后可以用蒸馏水平衡,且阳离子交换层析柱的填料可采用732型阳离子交换树脂,填料粒径在0.315-1.25mm之间;疏水层析柱采用700mmol/l氯化钠溶液平衡,且疏水层析柱的填料采用octylsepharose4ff型疏水介质,且粒径在45-165μm之间。
进一步地,可对从疏水层析柱收集的洗脱液进行浓缩,例如可采用旋转蒸发仪进行蒸发浓缩,并且可控制蒸发时的蒸汽压为0.02-0.04mpa,蒸发温度为60-80℃,当浓缩液中的固含量为10-20%时停止浓缩,该固含量便于后续干燥处理的进行,具体地,当固含量过高时,体系粘度增大,则不利于干燥;当固含量过低时,会增加干燥能耗,延长干燥时间。进一步地,在浓缩后可进行干燥,从而制得牡蛎肽,干燥例如可以为冷冻干燥,冷冻干燥的工艺可以为:在-50℃预冻4-6小时,然后抽真空,真空度低于20后升温至20-30℃,维持15-30小时。
通过上述酶解工艺与分离纯化工艺,不仅能够得到ri、ir以及vr肽段,更通过适宜的工艺参数能够使肽段ri的质量含量≥3.60mg/100g、ir的质量含量≥7.60mg/100g、vr的质量含量≥6.50mg/100g。
本发明还提供上述牡蛎肽在提高性功能产品中的应用,产品包括但不限于食品、保健品以及药品。
通过大量研究数据证明,本发明的含有特定质量含量的ri、ir以及vr功能肽段的牡蛎肽在促进睾酮、二氢睾酮生成方面具有显著的能力,可以认为,本发明提供的牡蛎肽具有显著的提高性功能的能力,除常规意义上的保健应用外,更可用于提高性功能产品等,从而拓宽了牡蛎的应用范围,为牡蛎的深加工提供了新的方向。
本发明的实施,至少具有以下优势:
1、本发明提供的牡蛎肽,明确含有ri、ir以及vr功能肽段,且ri的质量含量≥3.60mg/100g、ir的质量含量≥7.60mg/100g、vr的质量含量≥6.50mg/100g,具有显著的提高性功能的功效,用于相关功能产品的原料,为牡蛎肽产品提供了更为广泛的应用前景。
2、本发明提供的牡蛎肽的制备方法,通过采用特殊的预处理、酶解以及分离纯化工艺,得到具有特定质量含量肽段ri、ir以及vr的牡蛎深加工产物。
附图说明
图1为本发明实施例1中牡蛎肽的分子量分布凝胶色谱图;
图2为本发明实施例及对比例中鉴定ri、ir以及vr所用的1μg/ml标样质谱图;
图3为本发明3mg/ml实施例1中牡蛎肽中ri、ir以及vr的质谱图;
图4为本发明实施例2中牡蛎肽的分子量分布凝胶色谱图;
图5为本发明3mg/ml实施例2中牡蛎肽中ri、ir以及vr的质谱图;
图6为本发明实施例3中牡蛎肽的分子量分布凝胶色谱图;
图7为本发明3mg/ml实施例3中牡蛎肽中ri、ir以及vr的质谱图;
图8为本发明3mg/ml对比例1中牡蛎肽中ri、ir以及vr的质谱图;
图9为本发明3mg/ml对比例2中牡蛎肽中ri、ir以及vr的质谱图;
图10为本发明3mg/ml对比例3中牡蛎肽中ri、ir以及vr的质谱图;
图11为本发明3mg/ml对比例4中牡蛎肽中ri、ir以及vr的质谱图;
图12为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞存活率的关系图;
图13为各试验组与tm3细胞存活率的关系图;
图14为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中睾酮含量的关系图;
图15为各试验组与tm3细胞分泌的睾酮含量的关系图;
图16为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中二氢睾酮含量的关系图;
图17为各试验组与tm3细胞分泌的二氢睾酮含量的关系图;
图18为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中no含量的关系图;
图19为各试验组与tm3细胞内no含量的关系图;
图20为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中sod活力的关系图;
图21为各试验组与tm3细胞内sod活力的关系图;
图22为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中cgmp含量的关系图;
图23为各试验组与tm3细胞内cgmp含量的关系图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例和对比例中,中性蛋白酶购自诺维信,0.8au/g;木瓜蛋白酶购自南宁庞博,100万u/g;碱性蛋白酶购自诺维信,2.4au/g;酸性蛋白酶购自丹尼斯克,2000sapu/g。
实施例1
本实施例的牡蛎肽按照以下方法制备得到:
1、取一公斤去壳牡蛎肉,解冻后用绞肉机搅碎,加入5l蒸馏水制成混合液;将混合液放入20℃水浴中搅拌,再加入浓盐酸5ml持续搅拌60min,用台式离心机以3500rpm的转速离心10min,收集沉淀;
2、向沉淀中加入1l蒸馏水调浆搅拌成浆液,再向浆液中加入氢氧化钠固体0.8g,边搅拌边升温至90℃,维持60min,得到变性牡蛎蛋白溶液;
3、通过换热器将变性牡蛎蛋白溶液降温至50℃,加入中性蛋白酶1.0g,木瓜蛋白酶0.2g,酶解4h后利用uht灭酶,得酶解液;
4、酶解液用台式离心机以3500rpm的转速离心10min,收集离心上清液,再用200nm的陶瓷膜对离心上清液过滤,收集滤液;将滤过液以1cm/min的线性流速通过阳离子交换层析柱(柱型号为:xk16-50,直径16mm,高度400mm;填料为732型阳离子交换树脂,填料粒径在0.315-1.25mm之间),上完样后,以相同的流速用蒸馏水清洗阳离子交换层析柱60min,用200mmol/l氯化钠溶液流洗60min,用700mmol/l氯化钠溶液进行洗脱,收集洗脱液400ml;将阳离子层析洗脱液以1cm/min的线性流速通过疏水层析柱(柱型号为:xk16-50,直径16mm,高度400mm;填料为octylsepharose4ff型疏水介质,且粒径在45-165μm之间),再用700mmol/l氯化钠溶液进行流洗30min,用蒸馏水洗脱疏水层析柱300ml并收集;将疏水层析洗脱液用旋转蒸发仪浓缩至100ml(波美值:17%),冻干(-50℃预冻6小时,然后抽真空,真空度低于20后升温至20℃,维持20小时),得到牡蛎肽粉15g。
产物测定
1、牡蛎肽的分子量分布检测
采用gb/t22492-2008大豆肽粉中附录规定的实验方法进行分子量检测。
图1为本发明实施例1中牡蛎肽的分子量分布凝胶色谱图。
表1为实施例1中牡蛎肽的分子量分布数据。
表1
2、牡蛎肽中功能肽段ri、ir以及vr的含量检测:
利用超高效液相色谱仪nexerax2与三重四极杆质谱仪联用系统(岛津,日本)对本实施例中的牡蛎肽中的肽组分进行鉴定。
液相色谱条件:色谱柱:inertsilods-3(5μm,2.1*250mm);流动相:a为0.1%甲酸水溶液,b为0.1%甲酸乙腈溶液;梯度洗脱程序:0-15min,b0-50%;15-20min,b50-100%;20-25min,b100%;25.1-35min,b0%;流速:0.2ml/min;进样体积:1μl;柱温:40℃。
质谱条件:离子化模式:esi,正离子模式;离子喷雾电压:+4.5kv;雾化气流速:氮气3.0l/min;加热气流速:氮气10l/min;干燥气流速:氮气10l/min;dl温度:250℃;加热模块温度:400℃;离子源温度:300℃;扫描模式:多反应监测(mrm);驻留时间:100ms;延迟时间:3ms;mrm参数:见表2。
表2
*表示定量离子
肽段标准品配制:分别准确称取ri、ir以及vr标准品粉末20.0mg,加水溶解,涡旋混匀,定容至100ml,即为200μg/ml的标准储备液。分别取500μl上述标准储备液,定容至10ml,即得混合标准母液10μg/ml。将上述混合标准母液用纯水逐级稀释至0.0625、0.125、0.25、0.5、1、2.5、5和10μg/ml的系列标准工作溶液。
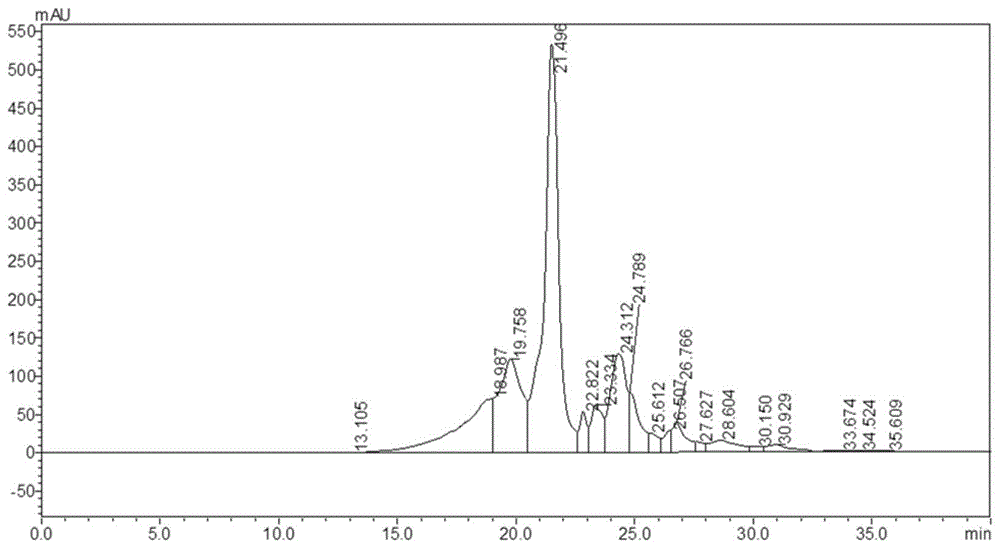
图2为本发明实施例及对比例中鉴定ri、ir以及vr所用的1μg/ml标样质谱图,图3为本发明3mg/ml实施例1中牡蛎肽中ri、ir以及vr的质谱图。
通过图3和图2的比对可知,本实施例1中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本实施例1制备的牡蛎肽中ri含量为3.68mg/100g,ir含量为7.84mg/100g,vr含量为6.77mg/100g。
实施例2
本实施例的牡蛎肽按照以下方法制备得到:
1、取五公斤去壳牡蛎肉,解冻后用绞肉机搅碎,加入25l蒸馏水制成混合液;将混合液放入20℃水浴中搅拌,再加入浓盐酸25ml持续搅拌60min,用台式离心机以3500rpm的转速离心10min,收集沉淀;
2、向沉淀中加入5l蒸馏水调浆搅拌成浆液,再向浆液中加入氢氧化钠固体5g,边搅拌边升温至90℃,维持60min,得到变性牡蛎蛋白溶液;
3、通过换热器将变性牡蛎蛋白溶液降温至50℃,加入中性蛋白酶5g,木瓜蛋白酶1g,酶解5h后利用uht灭酶,得酶解液;
4、酶解液用台式离心机以3500rpm的转速离心10min,收集离心上清液,再用200nm的陶瓷膜对离心上清液过滤,收集滤液;将滤过液以5cm/min的线性流速通过阳离子交换层析柱(柱型号为:xk26-100,直径26mm,高度60mm;填料为732型阳离子交换树脂,填料粒径在0.315-1.25mm之间),上完样后,以相同的流速用蒸馏水清洗阳离子交换层析柱30min,用200mmol/l氯化钠溶液流洗30min,用700mmol/l氯化钠溶液进行洗脱,收集洗脱液1500ml;将阳离子层析洗脱液以5cm/min的线性流速通过疏水层析柱(柱型号为:xk26-100,直径26mm,高度60mm;填料为octylsepharose4ff型疏水介质,且粒径在45-165μm之间),再用700mmol/l氯化钠溶液进行流洗30min,用蒸馏水洗脱疏水层析柱1600ml并收集;将疏水层析洗脱液用旋转蒸发仪浓缩至400ml(波美值:18%),冻干(-50℃预冻6小时,然后抽真空,真空度低于20后升温至20℃,维持20小时),得到牡蛎肽粉70g。
产物测定
1、采用与实施例1相同的方法对本实施例牡蛎肽的分子量分布进行检测
图4为本发明实施例2中牡蛎肽的分子量分布凝胶色谱图。
表3为实施例2中牡蛎肽的分子量分布数据。
表3
2、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图5为本发明3mg/ml实施例2中牡蛎肽中ri、ir以及vr的质谱图。
通过图5和图2的比对可知,本实施例2中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本实施例2制备的牡蛎肽中ri含量为3.75mg/100g,ir含量为7.69mg/100g,vr含量为6.87mg/100g。
实施例3
1、取10kg去壳牡蛎肉,解冻后用绞肉机搅碎,加入50l蒸馏水制成混合液;将混合液放入25℃水浴中搅拌,再加入浓盐酸50ml持续搅拌60min,用台式离心机以3500rpm的转速离心10min,收集沉淀;
2、向沉淀中加入10l蒸馏水调浆搅拌成浆液,再向浆液中加入氢氧化钠固体10g,边搅拌边升温至90℃,维持90min,得到变性牡蛎蛋白溶液;
3、通过换热器将变性牡蛎蛋白溶液降温至50℃,加入中性蛋白酶12g,木瓜蛋白酶2g,酶解5h后利用uht灭酶,得酶解液;
4、酶解液用台式离心机以3500rpm的转速离心10min,收集离心上清液,再用200nm的陶瓷膜对离心上清液过滤,收集滤液;将滤过液以1cm/min的线性流速通过阳离子交换层析柱,上完样后,以相同的流速用蒸馏水清洗阳离子交换层析柱60min,用200mmol/l氯化钠溶液流洗60min,用700mmol/l氯化钠溶液进行洗脱,收集洗脱液3000ml;将阳离子层析洗脱液以1cm/min的线性流速通过疏水层析柱,再用700mmol/l氯化钠溶液进行流洗30min,用蒸馏水洗脱疏水层析柱300ml并收集;将疏水层析洗脱液用旋转蒸发仪浓缩至800ml(波美值:19%),冻干(-50℃预冻6小时,然后抽真空,真空度低于20后升温至20℃,维持20小时),得到牡蛎肽粉150g。其中,层析柱型号为xk50/400。
产物测定
1、采用与实施例1相同的方法对本实施例牡蛎肽的分子量分布进行检测图6为本发明实施例3中牡蛎肽的分子量分布凝胶色谱图。
表4为实施例3中牡蛎肽的分子量分布数据。
表4
2、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图7为本发明3mg/ml实施例3中牡蛎肽中ri、ir以及vr的质谱图。
通过图7和图2的比对可知,本实施例3中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本实施例3制备的牡蛎肽中ri含量为3.78mg/100g,ir含量为7.86mg/100g,vr含量为6.63mg/100g。
对比例1
本对比例的制备方法与实施例2中的制备基本相同,唯一不同处在于:本对比例利用200nm的陶瓷膜对离心上清液过滤后,将滤液直接用旋转蒸发仪浓缩至800ml(不经过阳离子交换层析柱和疏水层析柱的处理),冻干,得到牡蛎肽粉160g。
产物测定
1、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图8为本发明3mg/ml对比例1中牡蛎肽中ri、ir以及vr的质谱图。
通过图8和图2的比对可知,本对比例1中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本对比例1制备的牡蛎肽中ri含量为1.13mg/100g,ir含量为2.14mg/100g,vr含量为1.95mg/100g。
对比例2
本对比例的制备方法与实施例2中的制备基本相同,唯一不同处在于:本对比例在收集阳离子交换层析柱流出的洗脱液1500ml后,未经过疏水层析柱的处理,直接将1500ml的洗脱液旋转蒸发仪浓缩至700ml,冻干,得到牡蛎肽粉140g。
产物测定
1、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图9为本发明3mg/ml对比例2中牡蛎肽中ri、ir以及vr的质谱图。
通过图9和图2的比对可知,本对比例2中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本对比例2制备的牡蛎肽中ri含量为1.85mg/100g,ir含量为3.79mg/100g,vr含量为3.25mg/100g。
对比例3
本对比例的制备方法与实施例2中的制备基本相同,唯一不同处在于:在酶解时加入5g碱性蛋白酶(诺维信,alcalase2.4l)和5g中性蛋白酶(诺维信,neutrase0.8l),酶解时间4h,其余后处理与实施例2相同。
产物测定
1、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图10为本发明3mg/ml对比例3中牡蛎肽中ri、ir以及vr的质谱图。
通过图10和图2的比对可知,本对比例3中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本对比例3制备的牡蛎肽中ri含量为0.87mg/100g,ir含量为2.08mg/100g,vr含量为1.62mg/100g。
对比例4
本对比例的制备方法与实施例2中的制备基本相同,唯一不同处在于:水洗后调浆,不加naoh,用5g酸性蛋白酶(丹尼斯克,foodpropal)和1g木瓜蛋白酶,酶解4h,其余后处理与实施例2相同。
产物测定
1、采用与实施例1相同的方法对牡蛎肽中功能肽段ri、ir以及vr的含量进行检测。
图11为本发明3mg/ml对比例4中牡蛎肽中ri、ir以及vr的质谱图。
通过图11和图2的比对可知,本对比例4中的牡蛎肽中同时存在肽段ri、ir以及vr。经检测,本对比例4制备的牡蛎肽中ri含量为0.75mg/100g,ir含量为1.63mg/100g,vr含量为1.30mg/100g。
利用下述方法对样品的提高性功能进行评价。
1、mtt法检测牡蛎肽对睾丸间质细胞tm3增殖的影响
mtt操作流程:将细胞密度稀释为1×105个/ml,将细胞加入96孔板中,100μl/孔。24小时观察到细胞均匀贴壁后,弃掉上清液,加入pbs缓冲液冲洗细胞2-3次,用含有牡蛎肽的细胞培养液处理细胞,不加样品的孔设为正常对照组,同一块96孔板,每个浓度梯度设置4复孔,24h后弃细胞上清液,再用pbs缓冲液冲洗细胞2-3次,然后每孔加入100μlmtt溶液(0.5mg/ml),37℃继续孵育4h,小心去除培养液及mtt,每孔加入100μldmso溶液,震荡10min使结晶物溶解。用酶标仪在490nm下测定吸光值,细胞存活率=实验组od/对照od×100%。
2、睾酮的检测
用牡蛎肽培养液培养tm3细胞,24h后将培养液离心,取上清液,混匀,按elisa试剂盒说明,检测睾酮的含量。
睾酮检测操作流程:①从已平衡至室温密封的铝箔袋种取出试验所需板条,未用的板条和干燥剂请收回铝箔袋内扣紧自封条,密封口袋,放入2-8℃。②酶标板上所有孔按50μl/孔加入标准品和待测样品,并设定4个blank孔。③每孔加入酶标抗原工作液50μl后(blank孔除外),再次按照同样的加样顺序加入兔抗睾酮抗体工作液50μl,待混匀后,用封板膜封住反应孔,37℃孵育1h。④提前20min打开酶标仪电源,预热仪器,设置好检测程序。⑤小心揭掉封板膜,用洗板机洗涤3遍,最后一次尽量扣干。⑥根据试验实际用量将显色底物a和显色底物b等体积混合,按100μl/孔加入所用孔内并用封板膜封住反应孔,37℃避光温育15min。⑦加入终止液50μl/孔,混匀后即可测量od450值(10min内)。
3、二氢睾酮(dht)含量
用牡蛎肽培养液作用于tm3细胞,24h后将培养液离心,取上清液,混匀,按elisa试剂盒说明,检测二氢睾酮的含量。
二氢睾酮检测操作流程:①标准孔按照50μl/孔加入。②样品孔先加入40μl样品稀释液再加入10μl待测样品,空白孔不添加任何东西。③用封板膜封住反应孔,置于37℃孵育45min。④小心揭掉封板膜,用洗板机洗涤3遍,最后一次尽量扣干。⑤除空白孔外每孔加入抗体50μl。⑥用封板膜封住反应孔,置于37℃孵育30min。⑦用封板膜封住反应孔,置于37℃孵育30min。⑧洗涤步骤同⑤。⑨每孔加入显色液a50μl,显色液b50μl,轻轻混匀,置于37℃避光孵育15min。⑩加入终止液50μl/孔,混匀后即可测量od450值。
4、no含量的测定
用牡蛎肽培养液作用于tm3细胞,24h后将培养液离心,取上清液,混匀,按no测定试剂盒说明,检测no的含量。
no检测操作流程:①试剂准备:将所有试剂取出,平衡至室温使用。②100μm标准工作液:在495μl反应缓冲液中加入5μl浓缩标准品,充分混匀即可。③总一氧化氮检测工作液的配制:根据样品数量,按40体积griessreagenti中加1体积no3-还原剂和40体积griessreagentii配制适量反应工作液,充分混匀,需在1小时内使用。④在96孔板内对板孔进行编号及加样:封上盖板膜将微孔板放置60℃孵育10min,到时间后取出微孔板放入37℃温箱孵育60min,然后取出放入酶标仪内540nm处进行读值。⑤样品中总一氧化氮的定量计算:样本总一氧化氮含量(μm)=(样品孔od值-空白孔od值)/(标准品孔od值-空白孔od值)×标准品浓度(100μm)×n(稀释因子)。
5、小鼠睾丸间质细胞tm3中sod(超氧化物歧化酶)含量的测定
用牡蛎肽培养液作用于tm3细胞,24h后将细胞裂解获得裂解液,按sod测定试剂盒说明,检测sod的含量。
sod检测操作流程:①收集大约2×106个细胞,800g4℃离心2min后弃去上清,冷pbs冲洗细胞,离心后弃上清;加入500μl预冷的裂解液(50mmpotassiumphosphate,0.1mmedta,0.5%tritonx-100)重悬细胞,冰上静置10min,12000g4℃离心5min,吸取上清用于检测。②在96孔板内对板孔进行编号及加样,加完后,将微孔板置室温孵育10min,到时间后取出微孔板放入酶标仪内550nm处进行读值。③样品中超氧化物歧化酶(sod)的定量计算:抑制率(%)=(对照孔od值-样品孔od值)/对照孔od值。将抑制率50%反应时的酶活力定义为1u,细胞裂解液上清超氧化物歧化酶(sod)含量(u/mg)=抑制率/50%/待测样品蛋白浓度(mg/ml)×100×n(稀释因子)
6、cgmp(环磷酸鸟苷)测定
用牡蛎肽培养液作用于tm3细胞,24h后细胞裂解获得裂解液,按cgmp测定试剂盒说明,检测cgmp的含量。
cgmp检测操作流程:①从已平衡至室温密封的铝箔袋种取出试验所需板条,未用的板条和干燥剂请收回铝箔袋内扣紧自封条,密封口袋,放入2-8℃。②酶标板上所有孔按50μl/孔加入中和试剂。②然后选择适当的孔按100μl/孔加入标准品和待测样品。③每孔加入50μlcgmp结合物后,再加入50μlcgmpelisa抗体。④混匀后,用封板膜封住反应孔,置于平板振荡器上500prm温育2h。⑤小心揭掉封板膜,用洗板机洗涤3遍,最后一次尽量扣干。⑥然后向每孔种加入200μl的pnpp底物溶液,在室温下继续孵育1h。⑦最后向每孔中加入50μl终止液,混匀后即可测量od450值(10min内)。
以实施例1-3中的牡蛎肽以及对比例1-4中的牡蛎肽为样品进行以下试验。
试验例1
a.为检测不同浓度的牡蛎肽培养液对tm3细胞活性的影响,设置系列浓度100μg/ml、200μg/ml、400μg/ml、800μg/ml、1mg/ml、2mg/ml、4mg/ml、8mg/ml、10mg/ml的实施例1的牡蛎肽培养液作用于tm3细胞,并通过mtt法确定牡蛎肽的最适作用浓度。
图12为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞存活率的关系图。如图12所示,与未加入牡蛎肽的对照组相比,牡蛎肽浓度为100μg/ml-1mg/ml时对tm3细胞的存活率无显著影响(p>0.05),当牡蛎肽浓度为2mg/ml-10mg/ml范围内时对细胞的活性具有抑制作用,且具有浓度依赖性,显示牡蛎肽浓度较高时对细胞具有毒性作用。
为了保证后续实验细胞的正常生长,样品的加样浓度应在无毒性浓度以下。因此,本发明将实施例1的牡蛎肽的加样浓度设为100μg/ml、400μg/ml、1mg/ml。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通过mtt法检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞存活率的影响。
图13为各试验组与tm3细胞存活率的关系图。如图13所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够使tm3细胞具有较高的存活率。
试验例2
本试验例用不同浓度的实施例1的牡蛎肽培养液和相同浓度的实施例1-3以及对比例1-4的牡蛎肽培养液分别处理tm3细胞24h后,收集细胞的上清培养基,用elisa法测细胞分泌的睾酮含量。
a.分别将实施例1的牡蛎肽配制成不同浓度的培养液,并通过elisa法检测不同浓度的实施例1的牡蛎肽对tm3细胞分泌的睾酮含量的影响。
图14为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中睾酮含量的关系图。如图14所示,与不加任何牡蛎肽的对照组相比,不同浓度的牡蛎肽对tm3细胞睾酮分泌量明显增加(p<0.05),且具有浓度依赖性。当牡蛎肽浓度为1mg/ml时对tm3细胞分泌睾酮的促进作用要高于阳性对照西地那非(200μg/ml),表明牡蛎肽确实具有促进tm3细胞分泌睾酮的作用。
在保证样品总量一定的情况下,为考察不同加样时间对细胞的影响,又将100μg/ml、400μg/ml浓度分为两次加样(24h两次,每12h一次),即将100μg/ml分为两次,每次50μg/ml;将400μg/ml分为两次,每次200μg/ml。从图14可以看出,等量牡蛎肽加样两次更能促进tm3细胞的睾酮分泌。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通过elisa法检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞分泌的睾酮含量的影响。
图15为各试验组与tm3细胞分泌的睾酮含量的关系图。如图15所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够显著促进tm3细胞分泌睾酮,且实施例1对tm3细胞睾酮生成的促进作用最强。
试验例3
二氢睾酮是由睾丸分泌的一种类固醇激素,是人体内主要的雄性激素,与男性第二性征的发育有关,对维持正常的性欲有着重要的作用。本试验例用不同浓度的实施例1的牡蛎肽培养液和相同浓度的实施例1-3以及对比例1-4的牡蛎肽培养液分别处理tm3细胞24h后,收集细胞的上清培养基,用elisa法测细胞分泌的二氢睾酮含量。
a.分别将实施例1的牡蛎肽配制成不同浓度的培养液,并通过elisa法检测不同浓度的实施例1的牡蛎肽对tm3细胞分泌的二氢睾酮含量的影响。图16为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中二氢睾酮含量的关系图。如图16所示,与不加任何培养液的对照组相比,对照组tm3细胞的二氢睾酮含量明显低于牡蛎肽处理的tm3细胞的二氢睾酮含量,说明牡蛎肽具有促进和改善睾丸间质细胞分泌二氢睾酮的作用,且具有浓度依赖性。阳性对照西地那非(200μg/ml)也具有显著促进tm3细胞生成睾酮的作用,当牡蛎肽浓度为1mg/ml时对细胞的促进作用与阳性对照西地那非的促进作用相近。
在保证样品总量一定的情况下,为考察不同加样时间对细胞的影响,又将100μg/ml、400μg/ml浓度分为两次加样(24h两次,每12h一次),即将100μg/ml分为两次,每次50μg/ml;将400μg/ml分为两次,每次200μg/ml。从图16中可以看出,等量牡蛎肽加样两次更能促进tm3细胞的二氢睾酮分泌。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通过elisa法检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞分泌的二氢睾酮含量的影响。
图17为各试验组与tm3细胞分泌的二氢睾酮含量的关系图。如图17所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够显著促进tm3细胞分泌二氢睾酮,且实施例1对tm3细胞二氢睾酮生成的促进作用最强。
试验例4
no是一种脂溶性小分子,其化学性质不稳定,体内在一氧化氮合酶的催化反应下产生,在体内可以引起血管的扩张,所以是阴茎海绵体舒张的重要信使,对阴茎勃起的诱导和维持的过程具有决定性的作用。本试验例用不同浓度的实施例1的牡蛎肽培养液和相同浓度的实施例1-3以及对比例1-4的牡蛎肽培养液分别作用于tm3细胞,24h后将培养液离心,取上清液,混匀,按no测定试剂盒说明,检测牡蛎肽对tm3细胞中no含量的作用。
a.分别将实施例1的牡蛎肽配制成不同浓度的培养液,并通过no测定试剂盒检测不同浓度的实施例1的牡蛎肽对tm3细胞内no含量的影响。图18为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中no含量的关系图。如图18所示,与不加任何培养液的对照组中的tm3细胞比较,阳性对照西地那非(200μg/ml)及牡蛎肽实验组中tm3细胞no含量均显著地增加(p<0.05)。
在保证样品总量一定的情况下,为考察不同加样时间对细胞的影响,又将100μg/ml、400μg/ml浓度分为两次加样(24h两次,每12h一次),即将100μg/ml分为两次,每次50μg/ml;将400μg/ml分为两次,每次200μg/ml。从图18中可以看出,当牡蛎肽分为两次加样处理tm3细胞后,其细胞no含量增加更加明显。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通通过no测定试剂盒检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞内no含量的影响。
图19为各试验组与tm3细胞内no含量的关系图。如图19所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够显著促进tm3细胞内no含量,且实施例1对tm3细胞内no含量的促进作用最强。
试验例5
超氧化物歧化酶(sod)是一种生物体内的活性物质,能消除生物体在新陈代谢过程中产生的有害物质。sod可以催化超氧自由基转化为过氧化氢和分子氧,在抵御氧自由基导致的细胞损伤中起到关键的作用。为评价tm3细胞氧化环境,本试验例用不同浓度的实施例1的牡蛎肽培养液和相同浓度的实施例1-3以及对比例1-4的牡蛎肽培养液分别作用于tm3细胞,24h后将培养液离心,取上清液,混匀,按sod测定试剂盒说明,测定细胞中sod的活力。
a.分别将实施例1的牡蛎肽配制成不同浓度的培养液,并通过sod酶测定试剂盒检测不同浓度的实施例1的牡蛎肽对tm3细胞内sod酶活力的影响。图20为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中sod活力的关系图。如图20所示,牡蛎肽组细胞内sod酶活力与不加任何培养液的对照组相比显著提高(p<0.05),且高剂量组(1mg/ml)效果要明显优于低剂量组(100μg/ml),呈现一定的剂量依赖性。牡蛎肽处理tm3细胞后,可以显著增强sod的酶活力,使细胞内的氧化环境有助于睾酮等雄性激素的生成。
在保证样品总量一定的情况下,为考察不同加样时间对细胞的影响,又将100μg/ml、400μg/ml浓度分为两次加样(24h两次,每12h一次),即将100μg/ml分为两次,每次50μg/ml;将400μg/ml分为两次,每次200μg/ml。从图20中可以看出,当牡蛎肽分为两次加样处理tm3细胞后,其细胞sod活力增加更加明显。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通通过sod测定试剂盒检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞内sod活力的影响。
图21为各试验组与tm3细胞内sod活力的关系图。如图21所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够显著促进tm3细胞内sod活力,且实施例1对tm3细胞内sod活力的促进作用最强。
试验例6
本试验例用不同浓度的实施例1的牡蛎肽培养液和相同浓度的实施例1-3以及对比例1-4的牡蛎肽培养液分别作用于tm3细胞,24h后将培养液离心,取上清液,混匀,按cgmp测定试剂盒说明,对tm3细胞中cgmp含量进行了检测。
a.分别将实施例1的牡蛎肽配制成不同浓度的培养液,并通过cgmp测定试剂盒检测不同浓度的实施例1的牡蛎肽对tm3细胞内cgmp含量的影响。图22为本发明实施例1中牡蛎肽在不同质量浓度下与tm3细胞中cgmp含量的关系图。如图22所示,与不加任何培养液的对照相比,牡蛎肽能显著提高tm3细胞cgmp的含量,并且随牡蛎肽浓度的增加其作用效果越强。
在保证样品总量一定的情况下,为考察不同加样时间对细胞的影响,又将100μg/ml、400μg/ml浓度分为两次加样(24h两次,每12h一次),即将100μg/ml分为两次,每次50μg/ml;将400μg/ml分为两次,每次200μg/ml。从图22中可以看出,同样地我们发现等量牡蛎肽加样两次更能促进tm3细胞分泌cgmp。
b.分别将实施例1-3以及对比例1-4的牡蛎肽配制成浓度为400μg/ml的培养液,并通通过cgmp测定试剂盒检测实施例1、2、3和对比例1、2、3、4的牡蛎肽对tm3细胞内cgmp含量的影响。
图23为各试验组与tm3细胞内cgmp含量的关系图。如图23所示,相较于对比例1-4的牡蛎肽,实施例1-3的牡蛎肽能够显著促进tm3细胞内cgmp含量的提高,且实施例1对tm3细胞分泌cgmp的促进作用最强。
图12-图23中,*”代表与空白组比较,p<0.05。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!