一种马铃薯源蛋白酶抑制剂混合物及提取方法、应用与流程
本发明涉及天然产物提取及应用技术领域,特别提供了一种马铃薯源蛋白酶抑制剂混合物及提取方法、应用。
背景技术:
马铃薯淀粉生产过程中会产生大量有机废液,其中主要含有蛋白及其他组分,如糖类、微细纤维及少量淀粉等。这些有机化合物虽然本身无毒,但高浓度的蛋白废液排放到环境中一则是资源的极大浪费,二则会造成水资源生态环境的失衡,影响鱼类、其它水生动植物的生活。对人类的生产、生活造成不良影响。因此,马铃薯蛋白如何高效地提取、分离、纯化,如何得到有益的应用是解决淀粉企业有机废液处理,资源循环利用,经济效益提高的重要途径之一。然而,目前相关的研究报道稀缺,制约了马铃薯产业的可持续发展。
研究表明,马铃薯蛋白主要由三部分组成,其中蛋白酶抑制剂(分子量范围在5-25kda的一组蛋白质的混合物)为主要成分,约占蛋白总量的50%,patatin占40%,大分子量蛋白占10%。实现各组分蛋白的提取分离是研究其功能及应用的前提。盐析和等电点分离是植物蛋白质大量提取的常用方法。盐析可以使蛋白质在加入高浓度中性盐后从溶液中沉淀析出,且具有可逆性,能够保持蛋白质的生物活性,操作简单方便、成本低,适用于蛋白粗提,但所得蛋白纯度不高。调节溶液ph值至酸性也可以使蛋白质在其等电点发生沉淀后再复溶,使蛋白与其他可溶性成分分离,等电点分离法产品成本低、纯度较高,但提取率不高。其他方法如色谱柱分离,虽然产品纯度高、分离效果好,但生产工程复杂、成本高,不适合大规模分离提取。
技术实现要素:
为了解决上述技术问题,本发明提供了一种马铃薯源蛋白酶抑制剂混合物及提取方法、应用,以低成本且高效率的方法制备马铃薯源蛋白酶抑制剂混合物,同时发现了马铃薯源蛋白酶抑制剂混合物的体外抗氧化能力及其加工稳定性,并发现了马铃薯源蛋白酶抑制剂混合物可以有效保护huvec细胞免受h2o2诱导的氧化应激损伤和抑制gist882肿瘤细胞的生长。
本发明是这样实现的,提供一种马铃薯源蛋白酶抑制剂混合物的提取方法,包括如下步骤:
1)室温条件下向马铃薯淀粉工业废液中加入硫酸铵,使其饱和度达到30%~80%,将所得体系在4~6℃条件下,80~150rpm震荡辅助提取90~120min,8000~10000r/min固液分离20~30min,得到沉淀为马铃薯粗蛋白提取物;
2)将上述步骤1)制备的马铃薯粗蛋白提取物复溶于蒸馏水,料液比为1:5~1:10(g/ml),得到马铃薯粗蛋白提取液;
3)调节上述步骤2)制备的马铃薯粗蛋白提取液ph为2.5~5.0,静置,8000~10000r/min固液分离20~30min,上清液透析36~48h后进行冷冻干燥处理,得到马铃薯源蛋白酶抑制剂混合物。
本发明还提供了利用上述的马铃薯源蛋白酶抑制剂混合物的提取方法提取的马铃薯源蛋白酶抑制剂混合物。
本发明还提供了上述的马铃薯源蛋白酶抑制剂混合物在抗氧化保护方向的用途。
进一步地,上述的马铃薯源蛋白酶抑制剂混合物在抗氧化保护方向的应用包括在体外抗氧化能力及加工稳定性、细胞内外抗氧化性、保护细胞免受h2o2诱导的氧化应激损伤方向的应用。
本发明还提供了上述的马铃薯源蛋白酶抑制剂混合物在抗肿瘤方向中的应用。
进一步地,上述的马铃薯源蛋白酶抑制剂混合物在抗肿瘤方向的应用,包括在抑制gist882肿瘤细胞的生长方向的应用。
与现有技术相比,本发明的优点在于:
通过盐析与等电点协同作用提取马铃薯源蛋白酶抑制剂混合物,提高了蛋白酶抑制剂的提取率,最高可达80.18%,具有操作简单、成本低适于规模化生产的优势;
在该蛋白酶抑制剂混合物制备过程中同时公开了该蛋白酶抑制剂混合物对abts自由基具有良好的清除作用,并在油脂体系具有突出的抗氧化能力,其抗氧化能力表现出极好的耐高压稳定性,在冷杀菌体系中具有良好的工业化前景。同时还具备消除自由基、保护细胞氧化损伤和抑制肿瘤细胞生长等功能活性。在功能食品、医药品及化妆品领域具有良好的应用潜能,赋有重要的经济价值和市场价值。
附图说明
下面结合附图及实施方式对本发明作进一步详细的说明:
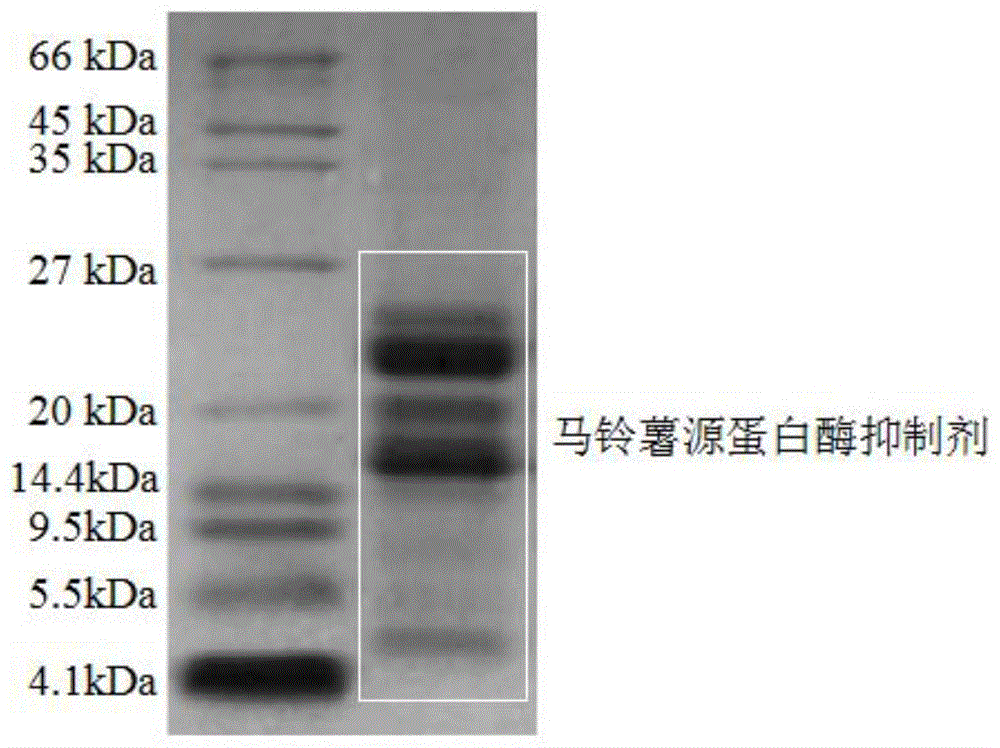
图1为马铃薯源蛋白酶抑制剂凝胶电泳结果图;
图2-a为马铃薯源蛋白酶抑制剂体外抗氧化性-总还原力检测结果图;
图2-b为马铃薯源蛋白酶抑制剂体外抗氧化性-羟自由基清除能力检测结果图;
图2-c为马铃薯源蛋白酶抑制剂体外抗氧化性-dpph自由基清除能力检测结果图;
图2-d为马铃薯源蛋白酶抑制剂体外抗氧化性-abts自由基清除能力检测结果图;
图2-e为马铃薯源蛋白酶抑制剂体外抗氧化性-油脂过氧化抑制能力检测结果图;
图3-a为加工条件(温度)对马铃薯源蛋白酶抑制剂抗氧化能力影响的结果图;
图3-b为加工条件(ph)对马铃薯源蛋白酶抑制剂抗氧化能力影响的结果图;
图3-c为加工条件(高压)对马铃薯源蛋白酶抑制剂抗氧化能力影响的结果图;
图4为马铃薯源蛋白酶抑制剂对h2o2诱导huvec细胞内ros的影响结果图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
下面将结合具体实施方式进一步说明本发明,但本发明要求保护的范围并不局限于下列实施方式。
前期的研究发现,马铃薯蛋白酶抑制剂在全ph范围具有良好的溶解性,而patatin和大分子量蛋白则在等电点沉淀,本发明利用这一特点开发了一种盐析和等电点分离协同作用提取、纯化马铃薯蛋白酶抑制剂的新方法,大幅提高了其提取率,具有成本低、操作简便等优势,更适合于实现工业化生产。同时,提供了除抑制蛋白酶活性以外马铃薯蛋白酶剂具有抗氧化、抑制肿瘤细胞等新的用途。
实施例1、马铃薯源蛋白酶抑制剂混合物的制备
室温下取硫酸铵加入马铃薯淀粉工业废液中,使硫酸铵达到40%饱和度,将所得体系在4℃、100rpm震荡辅助90min进行提取,于4℃、8000rpm固液分离20min,得到马铃薯粗蛋白提取物。将其按照1:10复溶于蒸馏水,得到马铃薯蛋白提取液。调节马铃薯粗蛋白溶液ph至3.4,4℃静置3min,4℃、8000rpm固液分离20min,上清液透析后进行冷冻干燥处理,从而获得马铃薯源蛋白酶抑制剂混合物。电泳结果如图1所示。
实施例2、体外抗氧化活性
(1)总还原力
不同浓度的样品溶液(0.1,0.5,1,2,3,4,5mg/ml)、pbs(0.2m,ph6.6)和的铁氰化钾溶液(1%)各1ml混匀,50℃反应20min后加入1ml三氯乙酸(10%),于4000r/min离心20min后取1ml上清液与蒸馏水和三氯化铁(0.1%)各1ml混匀,室温反应10min。同时以1mlpbs代替样品,制备空白对照。每个样品设3个复孔,重复检测至少3次。取平均值,根据以下公式计总还原力大小。
总还原力=(ax-a0)/a0×100%
ax表示样品组的吸光度,a0表示使用pbs代替样品作为空白对照组的吸光度。ic50用于测量总还原力水平。
如图2-a所示,马铃薯源蛋白酶抑制剂的总还原力明显高于卵清蛋白,但远低于维生素c。马铃薯源蛋白酶抑制剂的ic50值为20.018±0.212mg/ml,比卵清蛋白(180.039±0.68mg/ml)高约9倍。抗氧化能力大小依次为:维生素c>马铃薯源蛋白酶抑制剂>卵清蛋白(图2-a)。
(2)羟自由基清除能力
不同浓度的样品溶液(0.1,0.5,1,2,3,4,5mg/ml)、水杨酸(9mm)、硫酸亚铁溶液(9mm)和h2o2(8.8mm)各1ml混匀,37℃反应30min。同时以2ml蒸馏水代替样品和h2o2溶液,制备空白对照。。重复3次,取平均值,根据以下公式计算清除率。
清除率(%)=[a0-(ax-ax0)]/a0×100%
ax表示样品组的吸光度,ax0表示样品空白对照组的吸光度,a0表示空白对照组的吸光度。ic50用于测量羟自由基清除活性水平。
如图2-b所示,在羟自由基分析中,马铃薯源蛋白酶抑制剂的清除自由基能力与卵清蛋白相似,ic50分别为2.395±0.822g/ml,23.203±0.181mg/ml远低于维生素c(0.137±0.238mg/ml)。羟自由基清除能力大小依次为:维生素c>卵清蛋白>马铃薯源蛋白酶抑制剂(图2b)。
(3)dpph自由基清除能力
不同浓度的样品溶液(0.1,0.5,1,2,3,4,5mg/ml)和0.04g/ldpph乙醇溶液各2ml加入试管中并快速混合,室温避光反应20min,同时以2ml乙醇代替样品和dpph溶液,制备空白对照。重复3次,取平均值,根据以下公式计算清除率。
清除率(%)=[a0-(ax-ax0)]/a0×100%
ax表示样品组的吸光度,ax0表示样品空白对照组的吸光度,a0表示空白对照组的吸光度。ic50用于测量dpph清除活性水平。
如图2-c所示,在dpph分析中,马铃薯源蛋白酶抑制剂的清除自由基能力高于卵清蛋白,但低于维生素c。dpph自由基清除能力大小依次为:维生素c>马铃薯源蛋白酶抑制剂>卵清蛋白。
(4)abts自由基清除能力
0.2ml不同浓度的样品溶液(0.1,0.5,1,2,3,4,5mg/ml)和0.8mlabts工作液加入试管中并快速混合,室温避光反应6min,同时以0.2ml乙醇代替样品,制备空白对照。重复3次,取平均值,根据以下公式计算清除率。
清除率(%)=(a0-a)/a0×100%
a表示样品组的吸光度,a0表示空白对照组的吸光度。ic50用于测量abts清除活性水平。
如图2-d所示,在abts分析中,马铃薯源蛋白酶抑制剂的清除自由基能力与卵清蛋白相似,低于维生素c。马铃薯源蛋白酶抑制剂的ic50值为0.018±0.118mg/ml,是卵清蛋白(0.445±0.332mg/ml)的24.7倍。abts自由基清除能力大小依次为:维生素c>马铃薯源蛋白酶抑制剂>卵清蛋白。
(5)油脂过氧化抑制能力
不同浓度的样品溶液(0.1,0.5,1,2,3,4,5mg/ml)、脂质分散体系和硫酸亚铁(0.4mm)各1ml加入试管中并快速混合,37℃避光反应60min,加入2mltca-tba-hcl混合液,90~100℃水浴15min,迅速冷却,3000r/min离心10min。取上清液于525nm测吸光度。同时以蒸馏水代替样品,制备空白对照。重复3次,取平均值,根据以下公式计算抑制率。
抑制率(%)=(a0-a)/a0×100%
a表示样品组的吸光度,a0表示空白对照组的吸光度。ic50用于测量油脂过氧化抑制水平。
如附图2-e所示,马铃薯源蛋白酶抑制剂的油脂过氧化抑制能力高于维生素c和卵清蛋白。马铃薯源蛋白酶抑制剂的ic50值为0.296±0.522mg/ml,比维生素c(0.54±0.71mg/ml)的效力高约1.8倍,比卵清蛋白(0.822±0.83mg/ml)效力高约2.8倍。油脂过氧化抑制能力大小依次为:马铃薯源蛋白酶抑制剂>维生素c>卵清蛋白(图2-e)。
实施例3、不同加工因素对抗氧化性的影响
(1)温度稳定性
马铃薯源蛋白酶抑制剂配成溶液(1mg/ml),在4-100℃下加热1h,迅速冷却。测定其体外抗氧化能力随温度的变化曲线。
如图3-a所示,马铃薯源蛋白酶抑制剂的体外抗氧化能力与温度呈负相关。其总还原力、dpph清除能力、羟自由基清除能力和脂质过氧化抑制率随温度的升高而缓慢下降。abts自由基的清除能力存在有两个梯度下降阶段,在50℃前仍具有较高的抗氧化能力。结果表明,马铃薯源蛋白酶抑制剂在一定的温度范围内能够保持稳定的抗氧化活性。
(2)ph稳定性
马铃薯源蛋白酶抑制剂溶于不同ph溶液中,配置成浓度为1mg/ml的蛋白液,在4℃静置1h后测定其体外抗氧化能力随ph的变化曲线。
如图3-b所示,ph对马铃薯源蛋白酶抑制剂的体外抗氧化能力存在不同的影响。在羟基自由基体系,马铃薯源蛋白酶抑制剂在酸性或碱性条件下具有较好的清除活性。dpph自由基的清除能力与ph呈负相关,在酸性条件下活性较好。abts则与dpph趋势相反。在油脂体系中,酸性弱碱性条件下马铃薯源蛋白酶抑制剂对脂质过氧化抑制率较好。结果显示,马铃薯源蛋白酶抑制剂在比较广泛的ph范围内具有良好的抗氧化性,具有广阔的应用前景。
(3)耐高压稳定性
马铃薯源蛋白酶抑制剂配成溶液(1mg/ml),在25℃,100-600mpa下处理10min。测定其体外抗氧化能力随压力的变化曲线。
如图3-c所示,马铃薯源蛋白酶抑制剂经过高压处理后,其抗氧化性无显著性变化。结果表明,马铃薯源蛋白酶抑制剂在短时间内高压处理能保持较好的结构和抗氧化活性。因此,马铃薯源蛋白酶抑制剂可以作为一个能够耐受超高压杀菌的潜在功能因子应用于食品、药品及化妆品中。
实施例4、细胞内外抗氧化
将处于对数生长期的人肝癌hepg2细胞按照6×105个/ml接种于黑色透明平底的96孔板中,过夜培养。吸去细胞培养液,用pbs缓冲液清洗。将样品与用细胞培养液配置的dcfh-da以1:1的比例加入,在细胞培养箱中孵育1h。吸去dcfh-da,每个样品的前3个孔用pbs清洗,后3个孔不用pbs清洗。用排枪快速加入溶于hbss中的abap,并迅速放入多功能荧光酶标仪中进行测定,在激发波长:485nm,发射波长:538nm的条件下每5min读数一次,测定其60min内荧光强度的变化。计算曲线下面积,并带入标曲,求得样品的槲皮素当量。结果如表1所示,马铃薯源蛋白酶抑制剂细胞内外抗氧化能力存在浓度依存性,为其今后在人体内抗氧化活性的进一步应用提供了科学的基础数据和可能性。
表1马铃薯蛋白酶抑制剂在细胞内外的抗氧化作用
实施例5、氧化损伤保护作用
取对数生长期、生长状态良好的huvec细胞,以2×105个/孔接种,过夜培养后,弃去培养液,添加马铃薯源蛋白酶抑制剂与细胞预孵育1h后,再加入h2o2共同孵育1h。根据试剂盒检测ros、ldh、sod、no和mda损伤前后变化,每组设置6个平行。结果如表2和图4显示,马铃薯源蛋白酶抑制剂可以有效地保护huvec细胞免受h2o2氧化应激损伤。
对照例1:正常生长细胞
对照例2:h2o2模型组:
表2马铃薯蛋白酶抑制剂对h2o2诱导的huvec细胞内ldh、sod、mda、no的影响
注:表中小写字母表示p<0.05时的统计学显著性差异。
实施例6、抗肿瘤作用
对数生长期的gist882按照1×105个/ml接种于96孔板中,置于培养箱中过夜培养。弃去上清液,加入样品,37℃、5%co2的培养箱中培养48h。加入mtt溶液,避光操作,37℃孵育4h,弃掉上清液,加入dmso,测定490nm处的吸光值,计算存活率。每组样品设置6个平行。制备的马铃薯源蛋白酶抑制剂对gist882肿瘤细胞具有一定的抑制作用,ic50为10.532±0.87mg/ml,因此本产品可用于抑制肿瘤生长的保健食品中。
以上实施例显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,而不是以任何方式限制本发明的范围,在不脱离本发明范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!