一种乳酸菌提取物、其制备方法及应用
1.本发明涉及一种乳酸菌提取物、其制备方法及应用。
背景技术:
2.随着科技的发展、核技术的广泛应用,电离辐射已经渗入到生活中的各个领域。x射线、核废料都是常见的人为辐射源;不带电荷的中子、带电荷的α粒子,属于自然辐射。电离辐射在给人们带来便利的同时,也对健康造成了一定的影响。电离辐射能够通过组织与细胞等产生活性氧(ros)自由基,干扰dna、蛋白质等大分子,诱导细胞损伤和细胞功能的异常,导致人与动物的机体损伤,如造血系统、免疫系统与消化系统等,最终导致机体多种器官发生功能性紊乱、发生病变甚至引起机体死亡。
3.随着人们对辐射损伤和防护的深入了解,许多辐射防护剂已经被发现。辐射防护剂分为两类:一类是以人工合成的药物为主,主要是色氨类化合物、含硫化合物等,但存在副作用大、作用时效短、价格昂贵等缺点;另一类是天然辐射防护剂,如多糖、多酚类物质,其优点是作用时效长、成本低且无明显毒副作用。天然辐射防护剂主要分为植物多酚类、植物多糖类、生物碱类、皂苷类、花青素类、维生素类等,其中植物多酚和植物多糖居多,并且各种不同来源的植物多糖已被广泛研究,微生物来源的辐射防护剂研究相对较少。寻找高效、无毒副作用、可长期服用的新型天然辐射防护剂已成为目前的研究重点。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的首要发明目的在于提供一种乳酸菌提取物。
6.本发明的第二发明目的在于提供该乳酸菌提取物的制备方法。
7.本发明的第三发明目的在于提供该乳酸菌提取物的应用。
8.为了完成本发明的发明目的,采用的技术方案为:
9.本发明提出一种乳酸菌提取物,所述乳酸菌提取物中含有经
60
co-γ射线辐照后的乳酸菌的胞内物。
10.可选的,所述乳酸菌提取物为所述胞内物的冻干粉。
11.本发明还提出该乳酸菌提取物的制备方法,其特征在于,至少包括以下步骤:
12.s1、将乳酸菌进行两次活化,第二代培养至对数期,采用
60
co-γ辐照处理;
13.s2、收集菌体,破碎,离心收集上清液;
14.s3、冷冻干燥。
15.可选的,所述培养的温度为30~37℃,优选35℃。
16.可选的,所述
60
co-γ辐照处理为采用50~750gy的总剂量处理菌体,优选采用250~500gy的总剂量处理菌体;辐照的时间为60~180min,优选120min。
17.可选的,在s2中,将辐照处理后的发酵液离心收集菌体,进行破碎;
18.所述破碎的条件为:在200~500w条件下超声破碎细胞,工作2~4s,间歇4~6s,破
碎处理的时间为10~20min;
19.优选为,在300w条件下超声破碎细胞,工作3s,间歇5s,破碎处理的时间为15min:
20.更优选的,所述离心条件为0~6℃条件下,8000~10000rpm,离心时间为8~12min。
21.可选的,在s2中,所述破碎前还包括洗涤的步骤;
22.所述洗涤为采用浓度为75mm的磷酸盐缓冲液pbs洗涤菌体2~4次。
23.可选的,在s3中,将上清液过滤除菌后进行冷冻干燥,所述冷冻干燥的条件为:
24.放在一80~一70℃条件下预冷过夜,在真空冷冻干燥机中进行冻干,冷阱温度为-60~-55℃,真空度为3~5pa,冷冻时间为36~48h。
25.本发明至少具有以下有益的效果:
26.本发明的乳酸菌提取物原料易得,制备工艺简单,具有较高的抗氧化损伤和抗辐射损伤的作用,具有很强的应用价值。
附图说明
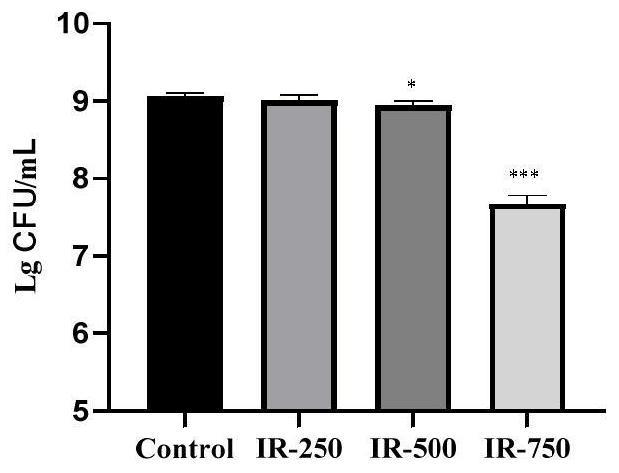
27.图1为不同辐射剂量对乳酸菌存活数的影响;
28.图2为辐射诱导后的乳酸菌胞内物对h
202
损伤乳酸菌的保护作用;
29.图3为正常的乳酸菌胞内物(cfe)对aml一12细胞的辐射防护作用;
30.图4为实施例1的乳酸菌胞内物(ir-cfe)对aml一12细胞的辐射防护作用;
31.图5为正常的乳酸菌胞内物辐射组(cfe+ir)与实施例1的乳酸菌胞内物辐射组(ir-cfe+ir)对aml-12细胞的辐射防护作用对比结果;
32.图6为乳酸菌胞内物对辐射后小鼠外周血白细胞的影响;
33.图7为乳酸菌胞内物对辐射后小鼠外周血红细胞的影响;
34.图8为乳酸菌胞内物对辐射后小鼠血清中sod的影响;
35.图9为乳酸菌胞内物对辐射后小鼠血清中mda的影响;
36.图10为乳酸菌胞内物对辐射后小鼠血清中gsh-px的影响;
37.图11为乳酸菌胞内物对辐射后小鼠血清中gsh的影响。
具体实施方式
38.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
39.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
40.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.乳酸菌是一类能够利用可发酵碳水化合物产生大量乳酸的细菌的通称。乳酸菌是益生菌的主要菌群,是人体肠道菌群中的重要组成部分,能够维持人类身体健康、提高生活质量,被公认为是食品安全级微生物。乳酸菌的抗氧化能力已经被很多研究证实,包括还原力、脂质过氧化物抑制力、金属螯合能力以及各种自由基的清除能力。由于乳酸菌具有较高的抗氧化能力,因此其在增强宿主免疫系统、预防衰老、降低胆固醇、调节肠道微生物、保护肝脏等方面发挥着重大作用;对于一些疾病包括癌症、克罗恩氏病也具有一定的疗效。本发明经研究发现,
60
co-γ诱导的乳酸菌中的某些成分具有抗氧化损伤的效果,从而完成本发明。虽然辐射刺激对乳酸菌造成了一定的伤害,但是却可以诱导乳酸菌产生一系列的应答反应,能够使自身恢复到正常的生理状态。在此过程中产生的一些物质,能够降低辐射对机体的伤害。这类辐射防护剂直接来源于辐射诱导后的乳酸菌菌体,经过超声破碎可直接获得,原料易得,制备方法简单,成本低,可用于工业化实施。
42.本发明实施例提出一种乳酸菌提取物,含有经
60
co-γ射线辐照后的乳酸菌的胞内物,该提取物可作为辐射防护剂和抗氧化剂。
43.优选的,乳酸菌提取物为胞内物的冻干粉。
44.本发明还涉及该乳酸菌提取物的制备方法,至少包括以下步骤:
45.s1、将乳酸菌进行两次活化,第二代培养至对数期,采用
60
co-γ辐照处理;
46.s2、收集菌体,破碎,离心收集上清液;
47.s3、冷冻干燥。
48.可选的,培养的温度为30~37℃恒温培养,优选35℃。
49.可选的,
60
co-γ处理为采用50~750cy的总剂量处理菌体,优选采用250~500gy的总剂量处理菌体;辐射时间为120min。本发明实施例经研究发现乳酸菌在给予低剂量、缓慢辐照的过程中,会启动多种应激机制来抵御不良环境,从而获得的胞内物中的活性成分的含量更好,抗氧化、抗辐射的性能更佳。
50.可选的,在s2中,将辐照处理后的发酵液离心收集菌体,进行破碎。
51.本发明实施例的破碎条件为:在200~500w条件下超声破碎细胞,工作2~4s,间歇4~6s,破碎处理的时间为10~20min。
52.本发明实施例的破碎条件优选为,在300w条件下超声破碎细胞,工作3s,间歇5s,破碎处理的时间为15min。在此条件下破碎细胞,可提高提取物内有效成分的含量。
53.本发明实施例的离心条件为0~6℃条件下,8000~10000rpm,离心时间为8~12min。
54.可选的,在s2中,破碎前还包括洗涤的步骤,洗涤的目的是为了除去菌体中的培养基。洗涤的条件为:采用浓度为75mm的磷酸盐缓冲液pbs洗涤菌体2~4次。
55.可选的,在s3中,将上清液过滤除菌后进行冷冻干燥,冷冻干燥的条件为:
56.放在-80~-70℃条件下预冷过夜,在真空冷冻干燥机中进行冻干,冷阱温度为-60~-55℃,真空度为3~5pa,,冷冻时间为36~48h。
57.经体内实验发现,本发明实施例的乳酸菌提取物能够增加辐射后小鼠的白细胞数目和红细胞数目,并且能够减轻辐射后小鼠血清中的氧化应激水平。超氧化物歧化酶(sod)是机体抗氧化体系中一种重要的酶类,能够催化超氧阴离子自由基的歧化反应,可以缓解细胞的氧化损伤。机体通过酶系统和非酶系统产生氧自由基,后者能攻击生物膜中多不饱
和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物,如丙二醛(mda)等,因此mda含量可反应体内脂质过氧化的程度,间接反映出细胞损伤的程度。谷胱甘肽过氧化物酶(gsh-px)是一种重要的过氧化物分解酶,能够特异地催化还原型谷胱甘肽(gsh)对脂质类过氧化物的还原反应,清除细胞内有害的过氧化物代谢产物。gsh是gsh-px催化分解过氧化物所必须的底物,是细胞内最重要的抗氧化剂之一,对维持细胞生物功能有重要的作用。辐射能够显著降低小鼠血清中sod酶活、gsh-px酶活以及gsh含量,同时增加mda含量,说明辐射能够导致小鼠体内的氧化应激。灌胃本发明实施例的乳酸菌冻干粉能够减缓辐射后小鼠血清内的氧化应激水平,提高血清内抗氧化酶活力,降低脂质过氧化产物mda含量。
58.本发明实施例经研究发现,乳酸菌胞内物能显著提高乳酸菌在h2o2氧化胁迫下的存活率。说明乳酸菌在给予低剂量、缓慢辐照的过程中,会启动多种应激机制来抵御不良环境,乳酸菌提高了自身的抗氧化能力,其胞内物能够清除h2o2,降低了h
202
对乳酸菌的伤害。
59.实施例1
60.1、将乳酸菌进行两次活化,第二代培养至对数期:使用mrs培养基,将甘油管中冻存的乳酸乳球菌乳酸亚种il1403(lactococcus lactis subsp.lactis il1403)进行两次活化,保持培养箱温度在35℃左右,第二代培养至对数期(16h);
61.2、进行
60
co-γ射线辐射处理:采用
60
co-γ射线进行辐射处理,辐射总剂量为500gy,辐射处理时间为120min。
62.3、离心收集菌体,洗涤:4000rpm离心10min收集菌体,用75mm的磷酸盐缓冲液洗涤两遍菌体;
63.4、超声破碎:将200ml发酵液培养得到的菌体悬浮到50ml的磷酸盐缓冲液中进行超声破碎,用超声破碎的方法将菌体破碎。超声破碎的条件:功率为300w,工作3s,暂停5s,共破碎15min;
64.5、离心收集上清液;破碎后以10000rpm转速离心10min获得上清液;
65.6、将上清液用滤膜过滤后冷冻干燥:用0.22μm的滤膜过滤上清,置于超低温冰箱(-80℃)中预冷过夜,最后在真空冷冻干燥机中进行冻干,冷阱温度为-60℃,真空度为5pa,冻干时间为36~48h,获得乳酸菌的冻干粉。
66.上述所用的培养基为mrs培养基,每升培养基组分如表1所示:
67.表1
[0068][0069]
实验例1不同辐射剂量对乳酸菌存活数的影响
[0070]
操作步骤:将乳酸菌进行两次活化,第二代培养至对数期后进行辐射外理,辐射剂量分别为:
[0071]
组1;总剂量为250gy、辐射时间分别为60min;
[0072]
组2:总剂量为500cy、辐射时间分别为120min;
[0073]
组3:总剂量为750cy,辐射时间分别为180min。
[0074]
处理后进行乳酸菌存活数的测定,具体方法为:
[0075]
处理后各取0.5ml发酵液,加入4.5ml的无菌去离子水,依依进行梯度稀释,稀释倍数为10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
,取合适的稀释梯度(10-4
、10-5
和10-6
)吸取200μl样液进行涂平板,每个梯度三次重复
。
在培养箱中37℃培养48h后,计活菌数,与对照组比较,考察不同辐射剂量对乳酸菌存活数的影响。实验结果如图m(稀弹梯度为10-5
和10-6
)所示(*p<0.05和***p<0.001与control组比较)。
[0076]
如图1所示,与对照组相比,组3中750gy的辐射剂量能够显著降低乳酸菌的存活数,对乳酸菌的生长造成严重的影响,而组2中的500gy和组1中的250gy对乳酸菌的存活影响不大。乳酸菌在应对外界环境的应激胁迫时,会启动一系列防御机制来适应外界环境,此过程需要一段适应时间。因此选择辐射剂量为500gy、辐射时间为120min作为最优选择,此辐射剂量对乳酸菌的生长没有太大影响,并且辐射时间较长。
[0077]
实验例2
[0078]
正常的乳酸菌胞内物(cfe)冻干粉的制备,步骤为:
[0079]
1、将乳酸菌进行两次活化,第二代培养至对数期:
[0080]
2、收集菌体,洗涤;
[0081]
3、超声破碎;
[0082]
4、离心收集上清液:
[0083]
5、将上清液用滤膜过滤后冷冻干燥。
[0084]
具体条件同实施例1。
[0085]
进行抗氧化损伤实验,具体实验方法为:
[0086]
1、将乳酸菌乳球菌乳酸亚种il1403(lactococcus lactis subsp.lactis il1403)培养到对数期,得乳酸菌悬液;
[0087]
2、将实施例1和cfe冻干粉溶于水,分别配制成浓度10mg/ml的溶液;
[0088]
3、将以下各组混合物进行孵育:
[0089]
pbs组:将含有3ml乳酸菌悬液、1ml pbs和1ml的5mmol/l的h2o2溶液的混合物在30℃下孵育1h;
[0090]
cfe组:将含有3ml乳酸菌悬液、1ml浓度为10mg/ml(最终浓度为2mg/ml)的对比药物溶液、和1ml的5mmol/l的h2o2溶液的混合物在30℃下孵育1h;
[0091]
ir-cfe组:将含有3ml乳酸菌悬液、1ml浓度为10mg/ml(最终浓度为2mg/ml)的实施例1药物溶液和1ml的5mmol/l的h2o2溶液的混合物在30℃下孵育1h;
[0092]
4、孵育后各取0.5ml发酵液,加入4.5ml的无菌去离子水,依次进行梯度稀释,稀释倍数为10-1
、10-2
、10-3
、10-4
、10-5
、10-6
、10-7
,取合适的稀释梯度(10-4
、10-5
和10-5
)吸取200μl样液进行涂平板,每个梯度三次重复。在培养箱中37℃培养48h后,计活菌数,与对照组比较,考察辐射处理的乳酸菌胞内物对h2o2损伤乳酸菌的保护效果。实验结果如图2(稀释梯度为10-4
)所示(
**
p<0.01和
***
p<0.001与pbs组比较;
##
p<0.01与cfe组比较)。
[0093]
如图2所示,乳酸菌胞内物能显著提高乳酸菌在5mmol/l的h2o2氧化胁迫下的存活
率,并且辐射处理的胞内物比正常的胞内物保护效果更好。乳酸菌在给予低剂量、缓慢辐照的过程中,会启动多种应激机制来抵御不良环境,在此过程中,乳酸菌提高了自身的抗氧化能力,其胞内物能够清除h2o2,降低了h2o2对乳酸菌伤害。
[0094]
实验例3
[0095]
按照实验例2中的方法制备正常的乳酸菌胞内物(cfe)冻干粉和按照实施例1中的方法制备辐射诱导后的乳酸菌胞内物(ir-cfe)冻干粉。
[0096]
利用mtt法检测cfe和ir-cfe对aml一12细胞的辐射防护作用,具体步骤如下:
[0097]
1、将实施例1和对比药物的乳酸菌提取物溶于水,配制浓度分别为0μg/ml、1000μg/ml、2000μg/ml、4000μg/ml、6000μg/ml、8000μg/ml的溶液;
[0098]
2、收集对数生长期的小鼠正常肝细胞aml-12细胞制备为单细胞悬液,接种于96孔板中,每孔细胞个数为4000个,每孔加90μl培养基,在培养箱中培养12h后,加入不同浓度的胞内物10μl,具体分组情况如下:
[0099]
正常的乳酸菌胞内物未辐照组(cfe)、正常的乳酸菌胞内物辐照组(cfe+ir):加入不同浓度的cfe胞内物10μl,使cfe胞内物的最终浓度分别为100μg/ml、200μg/ml、400μg/ml、600μg/ml、800μg/ml,同时设置加入培养基10μl作为对照孔,设置加入表没食子儿茶素没食子酸酯(egcg)10μl作为阳性对照孔,egcg最终浓度为10μg/ml。
[0100]
实施例1试剂未辐照组(ir-cfe)、实施例1试剂辐照组(ir-cfe+ir):加入不同浓度的cfe胞内物10μl,使ir-cfe胞内物的最终浓度分别为100μg/ml、200μg/ml、400μg/ml、600μg/ml、800μg/ml,同时设置加入培养基10μl作为对照孔,设置加入表没食子儿茶素没食子酸酯(egcg)10μl作为阳性对照孔,egcg最终浓度为10μg/ml。
[0101]
3、将对比试剂辐照组(cfe+ir)、实施例1试剂辐照组(ir-cfe+ir)继续培养12h后对细胞进行
60
co-γ射线辐射处理,辐射剂量为6gy;
[0102]
对比试剂未辐照组(cfe)、实施例1试剂未辐照组(ir-cfe)不进行辐射,培养24h。
[0103]
4、培养完成后将培养基吸出,每孔加入10μl血清、10μl mtt溶液(5mg/ml)、90μl培养基,继续培养4h后,将培养液吸出,每孔加入100μl dmso溶液,振荡10min后,用酶标仪测定492nm下的吸光度。
[0104]
得到的实验结果如图3~图5所示。其中,图3为正常乳酸菌胞内物(cfe)对aml一12细胞的辐射防护作用,图4为实施例1的乳酸菌胞内物(ir-cfe)对aml一12细胞的辐射防护作用,图5为正常乳酸菌胞内物辐照组(cfe+ir)与实施例1试剂辐照组(ir-cfe+ir)对aml-12细胞的辐射防护作用对比结果。(
**
p<0.01和
***
p<0.001与0μg/ml的cfe组比较;
##
p<0.01与0μg/ml的ir-cfe组比较;^^^p<0.001与同浓度的cfe+ir组比较)。
[0105]
如图3~图5所示,当样品浓度为0μg/ml时(即不加样品时),辐照可明显降低细胞数;加入100~800μg/ml的cfe和ir-cfe时,可显著增加辐射后的细胞数,说明胞内物可保护细胞免受辐射的伤害。在600μg/ml的浓度下,样品对细胞的增殖作用和辐射防护作用达到最大。在相同浓度下,ir-cfe比cfe的吸光值更高,说明辐照诱导后的胞内物对细胞的保护效果更好。
[0106]
实验例4
[0107]
1、药物和实验设备
[0108]
阳性药物:利克君片、实施例1的冻干粉;
[0109]
实验设备:
60
co-γ射线辐射源。
[0110]
2、实验动物和方法
[0111]
实验对象:昆明小鼠,由河南省动物实验中心提供。
[0112]
实验方法:将105只小鼠适应性培养一周,随机分为7组,每组15只。分为对照组(nc组)、模型组(ir组)、阳性对照组(pc组)、乳酸菌胞内物高剂量组(cfe-h组)、辐射诱导乳酸菌胞内物低剂量组(ir-cfe-l组)、辐射诱导乳酸菌胞内物中剂量组(ir-cfe-m组)、辐射诱导乳酸菌胞内物高剂量组(ir-cfe-h组)。
[0113]
每组小鼠连续灌胃30天后,除对照组外均进行
60
co-γ射线一次性全身均匀辐射处理,总辐照剂量为6gy,剂量率为2gy/min。小鼠辐射处理以后,断粮不断水,测后续各项指标。
[0114]
对照组(nc组):10ml/kg生理盐水,连续灌胃30天,不进行
60
c0-γ辐射处理。
[0115]
模型组(ir组):10ml/kg生理盐水,连续灌胃30天后进行
60
co-γ辐射处理。
[0116]
阳性对照组(pc组):12mg/kg的利克君片水溶液,连续灌胃30天后进行
60
co-γ辐射处理。
[0117]
乳酸菌胞内物高剂量组(cfe-h组):200mg/kg的乳酸菌胞内物冻干粉(实施例1)水溶液,连续灌胃30天后进行
60
co-γ辐射处理。
[0118]
辐射诱导乳酸菌胞内物低剂量组(ir-cfe-l组):50mg/kg辐射诱导的乳酸菌胞内物冻干粉(实施例1)水溶液,连续灌胃30天后进行
60
co-γ辐射处理。
[0119]
辐射诱导乳酸菌胞内物中剂量组(ir-cfe-m组):100mg/kg辐射诱导的乳酸菌胞内物冻干粉(实施例1)水溶液,连续灌胃30天后进行
60
co-γ辐射处理。
[0120]
辐射诱导乳酸菌胞内物高剂量组(ir-cfe-h组):200mg/kg辐射诱导的乳酸菌胞内物冻干粉(实施例1)水溶液,连续灌胃30天后进行
60
co-γ辐射处理。
[0121]
3、评价方法
[0122]
3.1外周血测定
[0123]
小鼠眼球取血20μl,放入缓冲液中,采用血液细胞分析仪检测外周血自细胞和红细胞数目。
[0124]
实验结果如图6、图7所示。其中,图6为乳酸菌胞内物对辐射后小鼠外周血白细胞的影响,图7为乳酸菌胞内物对辐射后小鼠外周血红细胞的影响,(
#
p<0.05和
#s#
p<0.001与nc组比较;*p<0.05、**p<0.01和***p<0.001与ir组比较;^^p<0.01与ir-cfe-h组比较(n=7))。
[0125]
由图6、图7可知,辐射能够显著降低小鼠血液中的白细胞和红细胞数目。灌胃辐射诱导后乳酸菌胞内物能够增加辐射后小鼠的白细胞数目和红细胞数目,并且灌胃高剂量效果更好。
[0126]
3.2抗氧化酶测定
[0127]
(1)血清中抗氧化酶测定:小鼠眼球取血后,血液样品在转速为4000rpm,温度为4℃,时间为10min的条件下离心,制备血清。利用南京建成sod试剂盒、mda试剂盒、gsh-px试剂盒和gsh试剂盒检测血清中sod酶活gsh-px酶活、gsh含量和mda含量。
[0128]
实验结果如图8~图11所示。图8为乳酸菌胞内物对辐射后小鼠血清中sod的影响,图9为乳酸菌胞内物对辐射后小鼠血清中mda的影响,图10为乳酸菌胞内物对辐射后小鼠血
清中gsh-px的影响,图11为乳酸菌胞内物对辐射后小鼠血清中gsh的影响(
##
p<0.01和
###
p<0.001与nc组比较;
*
p<0.05、
**
p<0.01和
***
p<0.001与ir组比较;^p<0.05、^^p<0.01和^^^p<0.001与cfe-h组比较(n=7))。
[0129]
由图8~图11可知,辐射能够显著降低小鼠血清中sod酶活、gsh-px酶活以及gsh含量,同时增加mda含量,说明辐射能够导致小鼠体内的氧化应激水平升高。灌胃本发明实施例的乳酸菌冻干粉能够减缓小鼠血液内的氧化应激水平,升高血液内抗氧化酶活力,降低血液内脂质过氧化产物mda含量,并且灌胃实施例的乳酸菌冻干粉比正常的乳酸菌冻干粉效果更好。
[0130]
综上所述,动物实验结果表明,辐射诱导的乳酸菌胞内物(实施例1)能够增加辐射后小鼠白细胞、红细胞数目,提高辐射后小鼠血清中抗氧化酶活性和降低mda含量,说明辐射诱导的乳酸菌胞内物是通过造血系统和抗氧化系统发挥辐射防护作用。
[0131]
本技术虽然以较佳实施例公开如上,但并不是用来限定权利要求,任何本领域技术人员在不脱离本技术构思的前提下,都可以做出若干可能的变动和修改,因此本技术的保护范围应当以本技术权利要求所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1