含有叠氮基的经修饰的氨基酸的制作方法
本申请要求2012年8月31日提交、标题为“经修饰的氨基酸”、序列号为61/696,087的美国临时专利申请的权益和优先权,其以其整体通过引用并入本文。
技术领域
本文提供包含叠氮基团的经修饰的氨基酸、包含所述经修饰的氨基酸的多肽、抗体和偶联物、以及制备所述包含经修饰的氨基酸的多肽、抗体和偶联物的方法。所述多肽、抗体和偶联物在治疗和预防的方法、检测方法和诊断方法中是有用的。
背景技术:
工程化的多肽广泛用于治疗和诊断应用。在例如癌症和炎性病症的治疗中,多年来治疗性抗体都是有用的。治疗性多肽也用于治疗和预防血液病症和病毒感染。诊断性多肽已被成功地用于鉴定体内健康和患病的细胞和组织。
许多多肽可以对特定的细胞提供靶向功能。某些多肽的选择性亲和力可以用于靶向几乎任何所期望的细胞或组织,例如表达抗原的细胞。多肽可以携带分子有效载荷,以减缓或破坏靶细胞或组织。因此发现多肽在治疗诸如癌症、炎性疾病、自身免疫性疾病和移植排斥反应等病症中的用途。
在某些应用中,将治疗性多肽链接到分子屏蔽(molecular shields),以增加它们在生物体内的寿命。还发现抗体用作诊断工具(diagnostics)。这些多肽可以携带标记物,以指示在细胞上或组织中的靶受体的存在。这些标记物通常通过共价键与多肽连接。
迄今为止,用于连接多肽到诸如分子有效载荷等分子实体(包括分子屏蔽和标记物)的技术受限于它们连接到多肽的程度和位置的不均一性、受限于它们的低产量、以及受限于活性的损失。通常的偶联(conjugation)位点包括多肽链上的随机位置,例如,氨基酸侧链上的随机的胺和某些多 肽链的N末端。在这样的技术中,一些多肽可能在一个位置连接到偶联物(conjugate),而一些多肽在另一位置连接相同的偶联物,以及一些多肽可能根本不进行连接。
因此,需要针对均匀性、产量和/或活性进行优化的在位点特异的位置被修饰的多肽,以促进多肽在例如治疗和诊断中的有前景的应用。
技术实现要素:
本文提供包含叠氮基团的经修饰的氨基酸、包含所述经修饰的氨基酸的多肽、抗体和偶联物、以及制备所述包含经修饰的氨基酸的多肽、抗体和偶联物的方法。所述多肽、抗体和偶联物在治疗和预防的方法、检测方法和诊断方法中是有用的。
在一方面,提供根据式I的化合物:
或其盐,其中:D是–Ar-W3–或–W1-Y1-C(O)-Y2-W2–;Ar是
W1、W2、和W3各自独立地是单键或低级亚烷基;各X1独立地是-NH-、-O-、或-S-;各Y1独立地是单键、-NH-、或-O-;各Y2独立地是单键、-NH-、-O-、或N-连接的或C-连接的亚吡咯烷基;以及Z1、Z2、和Z3中的一个是-N-,且Z1、Z2、和Z3中的其余者独立地是-CH-。
在进一步的方面,提供包含对应于式I的化合物的氨基酸残基的多肽和抗体。在特定的实施方案中,提供多肽和有效载荷的偶联物。在进一步的实施方案中,提供抗体和有效载荷的偶联物。
在另一个方面,提供以对应于式I的化合物的氨基酸残基所氨酰化的 正交tRNA。在相关的方面,提供制备多肽的方法,所述方法包括使多肽与以对应于式I的化合物的氨基酸残基所氨酰化的正交tRNA接触。
本文所描述的式I的化合物可以并入到本领域技术人员已知的任意多肽中。这样的多肽包括但不限于,蛋白质、抗体、抗体片段、酶和核酸。
具体实施方式
图1提供化合物(30)、(40)、和(50)与化合物(60)的反应的A原理图。
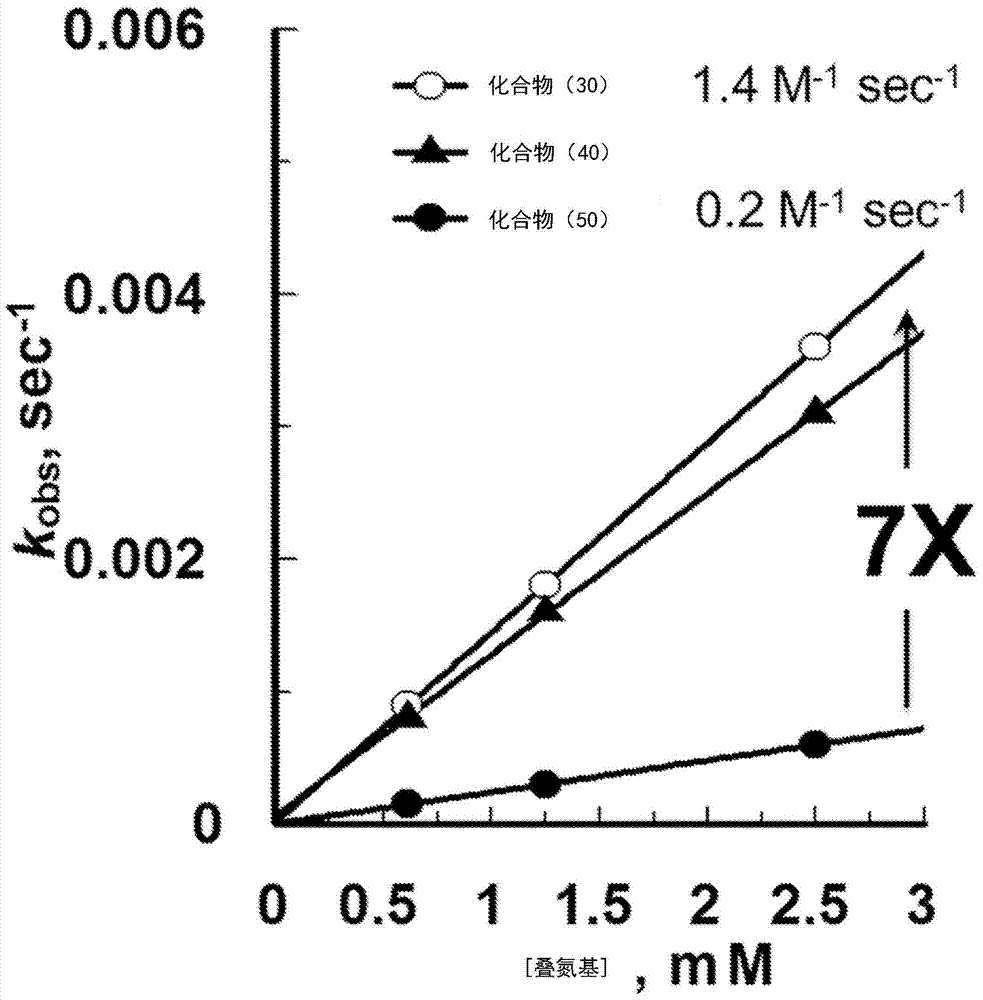
图2提供化合物(30)、(40)、和(50)与化合物(60)的反应的kobs相对于[叠氮化物]的曲线图。在图2中,kobs以sec–1为单位从0至0.006被标绘在纵轴上,而[Azide]以mM为单位从0至3被标绘在横轴上。在图2中,化合物(30)的结果被提供为空心圆,化合物(40)的结果被提供为实心三角形,以及化合物(50)的结果被提供为实心圆。如在图2中所提供的,化合物(30)和(40)表现出1.4M–1sec–1的一级速率常数,比化合物(50)的0.2M–1sec–1的一级速率常数高约7倍。
图3提供在GFP中的Y50TAG位点的pAMF的并入的时间过程的曲线图。在图3中,RFU从0至400000被标绘在纵轴上,而时间以分钟为单位从0至600被标绘在横轴上。在图3中,turboGFP的结果被提供为实心方块(顶部),pCNFRS D286R pAMF的结果被提供为实心菱形(中间),以及Y50TAG的结果被提供为实心三角形(底部)。如图3中所提供的,在200分钟时turboGFP是约250,000RFU,在200分钟时pCNFRS D286R pAMF是约130,000RFU,以及在200分钟时Y50TAG是约0RFU。如图3中所提供的,在400分钟时turboGFP是约340,000RFU,在400分钟时pCNFRS D286R pAMF是约160,000RFU,以及在400分钟时Y50TAG是约0RFU。如图3中所提供的,在600分钟时turboGFP是约370,000RFU,在600分钟时pCNFRS D286R pAMF是约170,000RFU,以及在600分钟时Y50TAG是约0RFU。
图4提供在与氨基酸类似物(30)、(1)、和(2)的反应过程中,剩余的DBCO-NH2(61)的级分相对于时间(小时)的曲线图。在图4中,剩余的DBCO-NH2(61)的级分以从0至1.2的无单位的值被标绘在纵轴上,而时间以0小时至20小时的单位被标绘在横轴上。在图4中,化合物(30)的结果被提供为实心菱形,化合物(1)的结果被提供为实心正方形,以及化合物(2)的结果被提供为实心三角形。如图4中所提供的,化合物(1)和 (30)以可比较的速率与化合物(61)反应,而化合物(2)和化合物(61)之间的反应速率比化合物(1)和化合物(61)之间以及化合物(30)和化合物(61)之间的反应速率慢两到四倍。
具体实施方式
本文提供式I的化合物,包含对应于式I的化合物的氨基酸残基的多肽、抗体和偶联物、以及制备包含对应于式I的化合物的经修饰的氨基酸残基的多肽、抗体和偶联物的方法。
定义
当提及本文所提供的化合物时,下列术语具有以下含义,除非另有说明。除非另有定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员所通常理解的相同的含义。如果对于本文的术语有多个定义,以该部分的定义为准,除非另有说明。
除非另有说明,否则本文所用术语“烷基”是指饱和的直链或支链烃。在某些实施方案中,所述烷基为伯烃、仲烃或叔烃。在某些实施方案中,所述烷基包括1-10个碳原子,即C1至C10烷基。在某些实施方案中,所述烷基选自由甲基、CF3、CCl3、CFCl2、CF2Cl、乙基、CH2CF3、CF2CF3、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、己基、异己基、3-甲基戊基、2,2-二甲基丁基和2,3-二甲基丁基所构成的组。该术语包括取代的烷基和未取代的烷基,包括卤化烷基。在某些实施方案中,所述烷基为氟化烷基。可用来取代烷基的部分的非限制性实例选自卤素(氟、氯、溴或碘)、羟基、羰基、巯基(sulfanyl)、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯(sulfate)、膦酸、磷酸酯或膦酸酯,其是未保护的或必要时如本领域技术人员已知的被保护的,例如在以下文献中所教导的:Greene等,Greene,et al.,Protective Groups in Organic Synthesis,John Wiley and Sons,第2版,1991,通过引用并入本文中。
除非另有说明,否则本文所用术语“低级烷基”是指具有1-6个碳原子的饱和的直链或支链烃,即C1-C6烷基。在某些实施方案中,所述低级烷基为伯烃、仲烃或叔烃。该术语包括取代的部分和未取代的部分。
除非另有说明,否则本文所用术语“环烷基”是指饱和的环状烃。在某些实施方案中,所述环烷基可以是饱和的、和/或桥联的、和/或非桥联的、 和/或稠合的二环基团。在某些实施方案中,所述环烷基包含3-10个碳原子,即C3至C10环烷基。在一些实施方案中,所述环烷基具有3-15(C3-15)、3-10(C3-10)或3-7(C3-7)个碳原子。在某些实施方案中,所述环烷基为环丙基、环丁基、环戊基、环己基、环己基甲基、环庚基、双环[2.1.1]己基、双环[2.2.1]庚基、十氢化萘基或金刚烷基。该术语包括取代的环烷基和未取代的环烷基,包括卤化的环烷基。在某些实施方案中,所述环烷基为氟化环烷基。可用来取代环烷基的部分的非限制性实例选自卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯,其是未保护的或必要时被保护的。
“亚烷基”是指可以是直链或支链的、特别是具有1-11个碳原子的二价饱和脂肪族烃基。在某些实施方案中,亚烷基含有1-10个碳原子。该术语包括取代的部分和未取代的部分。该术语以下列基团为例:诸如亚甲基(-CH2-)、亚乙基(-CH2CH2-)、亚丙基异构体(例如-CH2CH2CH2-和-CH(CH3)CH2-)等。该术语包括具有多于一个双键的基团,诸如包含亚联烯基(allenylene)(>C=C=C<)或联烯基(>C=C=CH2)的联烯。该术语包括卤化的亚烷基。在某些实施方案中,所述亚烷基为氟化亚烷基。可用来取代亚烷基的部分的非限制性实例选自由未被保护的或必要时被保护的、卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、烷基芳基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯和膦酸酯所构成的组。
“烯基”是指一价烯属不饱和烃基,在某些实施方案中,具有至多约11个碳原子、2-8个碳原子或2-6个碳原子,可以为直链或支链,并具有至少1个或1-2个烯属不饱和的部位。该术语包括取代的部分和未取代的部分。示例性烯基包括乙烯基(即vinyl或-CH=CH2)、正丙烯基(-CH2CH=CH2)、异丙烯基(-C(CH3)=CH2)等。该术语包括卤化的烯基。在某些实施方案中,所述烯基为氟化烯基。可用来取代烯基的部分的非限制性实例选自由未被保护的或必要时被保护的、卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯所构成的组。
除非另有说明,否则本文所用术语“环烯基”是指不饱和的环状烃。在某些实施方案中,环烯基是指包括至少一个双键的单环或多环的环系统。在某些实施方案中,桥联的、非桥联的、和/或稠合的二环基团。在某些实 施方案中,所述环烷基包含3-10个碳原子,即C3至C10环烷基。在一些实施方案中,所述环烯基具有3-7(C3-10)或4-7(C3-7)个碳原子。该术语包括取代的环烯基和未取代的环烯基,包括卤化的环烯基。在某些实施方案中,所述环烯基为氟化环烯基。可用来取代环烯基的部分的非限制性实例选自由未被保护的或必要时被保护的、卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯所构成的组。
“亚烯基”是指二价烯属不饱和烃基,在某些实施方案中,具有至多约11个碳原子或2-6个碳原子,其可以为直链或支链,并具有至少1个或1-2个烯属不饱和的部位。该术语以下列基团为例:诸如亚乙烯基(-CH=CH-)、亚丙烯基异构体(例如-CH=CHCH2-和-C(CH3)=CH-和-CH=C(CH3)-)等。该术语包括取代的亚希基和未取代的亚希基,包括卤化的亚希基。在某些实施方案中,所述亚希基为氟化亚希基。可用来取代亚希基的部分的非限制性实例选自由未被保护的或必要时被保护的、卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯所构成的组。
“炔基”是指炔属不饱和烃基,在某些实施方案中,具有至多约11个碳原子或2-6个碳原子,其可以为直链或支链,并具有至少1个或1-2个炔基不饱和的部位。炔基的非限制性实例包括炔属乙炔基(-C≡CH)、炔丙基(-CH2C≡CH)等。该术语包括取代的炔基和未取代的炔基,包括卤化的炔基。在某些实施方案中,所述炔基为氟化炔基。可用来取代炔基的部分的非限制性实例选自由未被保护的或必要时被保护的、卤素(氟、氯、溴或碘)、羟基、羰基、巯基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯所构成的组。
除非另有说明,否则本文所用术语“芳基”是指苯基、联苯基或萘基。该术语包括取代的的部分和未取代的部分两种。芳基可以被任何上述部分取代,包括但不限于选自由以下所构成的组的一个以上部分:未被保护的或必要时按本领域技术人员所已知的例如在Greene等,Protective Groups in Organic Synthesis,John Wiley and Sons,第2版,1991中所教导的进行保护的、卤素(氟、氯、溴或碘)、烷基、卤代烷基、羟基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸酯、膦酸、磷酸酯或膦酸酯。
“烷氧基”是指基团-OR′,其中R′为烷基或环烷基。举例来说,烷氧 基包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、仲丁氧基、正戊氧基、正己氧基、1,2-二甲基丁氧基等。
“烷氧基羰基”是指-C(O)-烷氧基基团(radical),其中烷氧基如本文所定义。
“氨基”是指-NH2基团。
“羧基”是指-C(O)OH基团。
术语“烷基氨基”或“芳基氨基”是指分别具有一个或两个烷基或芳基取代基的氨基。在某些实施方案中,所述烷基取代基为低级烷基。在另一个实施方案中,所述烷基或低级烷基是未取代的。
“卤素”或“卤代”是指氯、溴、氟或碘。
“硫代烷氧基”是指基团-SR′,其中R′为烷基或环烷基。
术语“杂环基”或“杂环”是指含有至少一个非芳环的一价单环非芳环系统和/或多环环系统,其中一个以上非芳环原子为独立选自O、S或N的杂原子;且其余环原子为碳原子。在某些实施方案中,杂环基或杂环基团具有3-20、3-15、3-10、3-8、4-7或5-6个环原子。杂环基通过非芳环与分子的其余部分键合。在某些实施方案中,所述杂环基为单环、二环、三环或四环环系统,其可以包括稠合的或桥联的环系统,并且其中氮或硫原子可任选被氧化,氮原子可任选被季铵化,且一些环可以是部分或完全饱和的或芳香性的。所述杂环基可于任何杂原子或碳原子处与该主要结构连接以导致形成稳定的化合物。这样的杂环基的实例包括但不限于氮杂环庚三烯基(azepinyl)、苯并二氧杂环己烷基、苯并二氧杂环戊烯基、苯并呋喃酮基、苯并吡喃酮基、苯并呲喃基、苯并四氢呋喃基、苯并四氢噻吩基、苯并四氢噻喃基、苯并噁嗪基、β-咔啉基、苯并二氢吡喃基、色酮基、噌啉基、香豆素基(coumarinyl)、十氢异喹啉基、二氢苯并异噻嗪基、二氢苯并异噁嗪基、二氢呋喃基、二氢异吲哚基、二氢吡喃基、二氢吡唑基、二氢吡嗪基、二氢吡啶基、二氢嘧啶基、二氢吡咯基、二氧戊环基(dioxolanyl)、1,4-二噻烷基、呋喃酮基、咪唑烷基、咪唑啉基、二氢吲哚基、异苯并四氢呋喃基、异苯并四氢噻吩基、异色满基、异香豆素基、异二氢吲哚基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、噁唑烷酮基(oxazolidinonyl)、噁唑烷基、环氧乙烷基、哌嗪基、哌啶基、4-哌啶酮基、吡唑烷基、吡唑啉基、吡咯烷基、吡咯啉基、奎宁环基、四氢呋喃基、四氢异喹啉基、四氢吡喃基、四氢噻吩基、硫吗啉基、噻唑烷基、四氢喹啉基和1,3,5-三噻烷基。在某些实施方案中,杂环基还可以如本文所述被 任选取代。
术语“杂芳基”是指含有至少一个芳环的一价单环芳基和/或多环芳基,其中至少一个芳环在环中含有一个以上独立选自O、S和N的杂原子。杂芳基通过芳环与分子的其余部分键合。杂芳基的每个环可以含有一个或两个O原子、一个或两个S原子和/或1-4个N原子,条件是各环中杂原子的总数为4个或更少,且每个环含有至少一个碳原子。在某些实施方案中,杂芳基具有5-20、5-15或5-10个环原子。单环杂芳基的实例包括但不限于呋喃基、咪唑基、异噻唑基、异噁唑基、噁二唑基、噁二唑基、噁唑基、吡嗪基、吡唑基、哒嗪基、吡啶基、嘧啶基、吡咯基、噻二唑基、噻唑基、噻吩基、四唑基、三嗪基和三唑基。二环杂芳基的实例包括但不限于苯并呋喃基、苯并咪唑基、苯并异噁唑基、苯并呲喃基、苯并噻二唑基、苯并噻唑基、苯并噻吩基、苯并三唑基、苯并噁唑基、呋喃并吡啶基、咪唑并吡啶基、咪唑并噻唑基、吲哚嗪基、吲哚基、吲唑基、异苯并呋喃基、异苯并噻吩基、异吲哚基、异喹啉基、异噻唑基、萘啶基、噁唑并吡啶基、酞嗪基、蝶啶基、嘌呤基、吡啶并吡啶基、吡咯并吡啶基、喹啉基、喹喔啉基、喹唑啉基、噻二唑并嘧啶基和噻吩并吡啶基。三环杂芳基的实例包括但不限于吖啶基、苯并吲哚基、咔唑基、二苯并呋喃基、咟啶基(perimidinyl)、菲咯啉基、菲啶基、吩吡嗪基(phenarsazinyl)、吩嗪基、吩噻嗪基、吩噁嗪基和呫吨基。在某些实施方案中,杂芳基还可以如本文所述被任选取代。
术语“烷基芳基”是指具有烷基取代基的芳基。术语“芳烷基”或“芳基烷基”是指具有芳基取代基的烷基。
除非另有定义,否则本文使用的术语“保护基”是指加在氧、氮或磷原子上以防其进一步反应或为了其它目的的基团。多种氧和氮的保护基是有机合成领域技术人员已知的。
“药学上可接受的盐”是指本文提供的化合物的任何盐,其保留它的生物学特性并且没有毒性或药物用途不期望的其他方面性质。这样的盐可来源于本领域公知的各种有机和无机抗衡离子。这样的盐包括但不限于:(1)由诸如以下的有机酸或无机酸形成的酸加成盐:盐酸、氢溴酸、硫酸、硝酸、磷酸、氨基磺酸、乙酸、三氟乙酸、三氯乙酸、丙酸、己酸、环戊基丙酸、乙醇酸、戊二酸、丙酮酸、乳酸、丙二酸、琥珀酸、山梨酸、抗坏血酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、苦味酸、肉桂酸、扁桃酸、邻苯二甲酸、月桂酸、甲磺酸、 乙磺酸、1,2-乙烷-二磺酸、2-羟基乙磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑酸、樟脑磺酸、4-甲基二环[2.2.2]-辛-2-烯-1-羧酸、葡庚糖酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、十二烷基硫酸、葡萄糖酸、苯甲酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、环己基氨基磺酸、奎宁酸、粘康酸等酸;或(2)当存在于母体化合物中的酸性质子在下列情况时所形成的碱加成盐:(a)被金属离子置换,例如碱金属离子、碱土离子或铝离子或者碱金属或碱土金属氢氧化物,例如氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁、氢氧化铝、氢氧化锂、氢氧化锌和氢氧化钡、氨或(b)与以下有机碱配位:诸如脂肪族、脂环族或芳香族有机胺,诸如氨、甲胺、二甲胺、二乙胺、甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、乙二胺、赖氨酸、精氨酸、鸟氨酸、胆碱、N,N'-二苄基乙二胺、氯普鲁卡因、二乙醇胺、普鲁卡因、N-苄基苯乙胺、N-甲基葡糖胺哌嗪、三(羟基甲基)-氨基甲烷、氢氧化四甲铵等。
药学上可接受的盐进一步包括(仅举例来说而无限制)钠盐、钾盐、钙盐、镁盐、铵盐、四烷基铵盐等,且当化合物包含碱性官能团时,包括无毒有机酸或无机酸的盐,诸如氢卤化物(例如盐酸盐和氢溴酸盐)、硫酸盐、磷酸盐、氨基磺酸盐、硝酸盐、乙酸盐、三氟乙酸盐、三氯乙酸盐、丙酸盐、己酸盐、环戊基丙酸盐、羟乙酸盐、戊二酸盐、丙酮酸盐、乳酸盐、丙二酸盐、琥珀酸盐、山梨酸盐、抗坏血酸盐、苹果酸盐、马来酸盐、富马酸盐、酒石酸盐、柠檬酸盐、苯甲酸盐、3-(4-羟基苯甲酰基)苯甲酸盐、苦味酸盐、肉桂酸盐、扁桃酸盐、邻苯二甲酸盐、月桂酸盐、甲烷磺酸盐(甲磺酸盐)、乙磺酸盐、1,2-乙烷二磺酸盐、2-羟基乙磺酸盐、苯磺酸盐、4-氯苯磺酸盐、2-萘磺酸盐、4-甲苯磺酸盐、樟脑酸盐、樟脑磺酸盐、4-甲基双环[2.2.2]-辛-2-烯-1-羧酸盐、葡庚糖酸盐、3-苯基丙酸盐、三甲基乙酸盐、叔丁基乙酸盐、月桂硫酸盐、葡糖酸盐、苯甲酸盐、谷氨酸盐、羟基萘甲酸盐、水杨酸盐、硬脂酸盐、环己基氨基磺酸盐、奎尼酸盐、粘康酸盐等。
术语“酰基”“O-连接酯”是指式C(O)R’的基团,其中R’为烷基或环烷基(包括低级烷基)、氨基酸的羧酸残基、芳基包括苯基、烷芳基、芳基烷基包括苄基、烷氧基烷基包括甲氧基甲基、芳氧基烷基例如苯氧基甲基;或取代的烷基(包括低级烷基)、芳基包括被氯、溴、氟、碘、C1-C4烷基或C1-C4烷氧基任选取代的苯基、磺酸酯例如烷基或芳基烷基磺酰基包括甲磺酰基、一、二或三磷酸、三苯甲基或一甲氧基-三苯甲基、取代的 苄基、烷芳基、芳基烷基包括苄基、烷氧基烷基包括甲氧基甲基、芳氧基烷基例如苯氧基甲基。酯中的芳基最好包含苯基。具体地,酰基包括乙酰基、三氟乙酰基、甲基乙酰基、环丙基乙酰基、丙酰基、丁酰基、己酰基、庚酰基、辛酰基、新庚酰基、苯基乙酰基、2-乙酰氧基-2-苯基乙酰基、二苯基乙酰基、α-甲氧基-α-三氟甲基-苯基乙酰基、溴乙酰基、2-硝基-苯乙酰基、4-氯-苯乙酰基、2-氯-2,2-二苯基乙酰基、2-氯-2-苯基乙酰基、三甲基乙酰基、氯二氟乙酰基、全氟乙酰基、氟乙酰基、溴二氟乙酰基、甲氧基乙酰基、2-噻吩乙酰基、氯磺酰基乙酰基、3-甲氧基苯基乙酰基、苯氧基乙酰基、叔丁基乙酰基、三氯乙酰基、一氯-乙酰基、二氯乙酰基、7H-十二氟-庚酰基、全氟-庚酰基、7H-十二-氟庚酰基、7-氯十二氟-庚酰基、7-氯-十二氟-庚酰基、7H-十二氟庚酰基、7H-十二-氟庚酰基、九氟-3,6-二氧杂-庚酰基、九氟-3,6-二氧杂庚酰基、全氟庚酰基、甲氧基苯甲酰基、甲基3-氨基-5-苯基噻吩-2-羧基、3,6-二氯-2-甲氧基-苯甲酰基、4-(1,1,2,2-四氟-乙氧基)-苯甲酰基、2-溴-丙酰基、ω-氨基癸酰基、癸酰基、正十五烷酰基、硬脂酰、3-环戊基-丙酰基、1-苯-羧基、O-乙酰基苦杏仁基(mandelyl)、新戊酰基乙酰基、1-金刚烷-羧基、环己烷-羧基、2,6-吡啶联羧基、环丙烷-羧基、环丁烷-羧基、全氟环己基羧基、4-甲基苯甲酰基、氯甲基异噁唑基羰基、全氟环己基羧基、巴豆酰基、1-甲基-1H-吲唑-3-羰基、2-丙烯基、异戊酰基、1-吡咯烷羰基、4-苯基苯甲酰基。
术语“氨基酸”是指天然存在的和合成的α、β、γ或δ氨基酸,包括但不限于存在于蛋白质中的氨基酸,即甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、色氨酸、脯氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。在某些实施方案中,氨基酸呈L-构型。或者,氨基酸可以是丙氨酰基、缬氨酰基、亮氨酰基、异亮氨酰基、脯氨酰基、苯丙氨酰基、色氨酰基、甲硫氨酰基、甘氨酰基、丝氨酰基、苏氨酰基、半胱氨酰基、酪氨酰基、天冬酰胺酰基、谷氨酰胺酰基、天门冬氨酰基、谷氨酰基、赖氨酰基、精氨酰基、组氨酰基、β-丙氨酰基、β-缬氨酰基、β-亮氨酰基、β-异亮氨酰基、β-脯氨酰基、β-苯丙氨酰基、β-色氨酰基、β-甲硫氨酰基、β-甘氨酰基、β-丝氨酰基、β-苏氨酰基、β-半胱氨酰基、β-酪氨酰基、β-天冬酰胺酰基、β-谷氨酰胺酰基、β-天门冬氨酰基、β-谷氨酰基、β-赖氨酰基、β-精氨酰基或β-组氨酰基的衍生物。
术语“多肽”、“肽”和“蛋白质”在本文中可互换地用来指氨基酸残 基的聚合物。也就是说,针对多肽的描述同样适用于肽的描述和蛋白质的描述,反之亦然。该术语适用于天然存在的氨基酸聚合物,以及其中一个以上氨基酸残基是经修饰的氨基酸的氨基酸聚合物。另外,这样的“多肽”、“肽”和“蛋白质”包括其中的氨基酸残基通过共价肽键连接的任何长度的氨基酸链,包括全长蛋白质。
关于核苷组合物的术语“实质上不含”或“实质上不存在”是指是指包含至少85%或90%重量、在某些实施方案中95%、98%、99%或100%重量的该核苷的指定对映异构体的核苷组合物。在某些实施方案中,在本文提供的方法和化合物中,所述化合物实质上不含对映异构体。
类似地,关于核苷组合物的术语“分离”是指包含至少85%、90%、95%、98%、99%至100%重量的核苷,其余部分包含其他化学物种或对映异构体的核苷组合物。
“溶剂化物”是指进一步包含通过非共价分子间力结合的化学计量的或非化学计量的量的溶剂的本文提供的化合物或其盐。当所述溶剂为水时,所述溶剂化物为水合物。
“同位素组成”是指对于给定原子存在的各同位素的量,而“天然同位素组成”是指对于给定原子天然存在的同位素组成或丰度。包含其天然同位素组成的原子在本文中也可以被称为“非富集的”原子。除非另有说明,本文所述化合物的原子意味着表示该原子的任何稳定同位素。例如,除非另有说明,当将一位置特别地指定为“H”或“氢”时,则应理解为该位置的氢具有它的天然同位素组成。
“同位素富集”是指分子中指定原子并入一定量的特定同位素代替该原子的天然同位素丰度的百分比。例如,在给定位置处1%的氘富集意味着给定样品中1%的分子包含在该指定位置的氘。由于氘的天然存在分布为约0.0156%,因此在利用非富集起始原料合成的化合物中任何位置处的氘富集为约0.0156%。可以使用本领域普通技术人员已知的常规分析方法(包括质谱法和核磁共振波谱法)来测定本文提供的化合物的同位素富集。
“同位素富集的”是指具有非该原子的天然同位素组成的同位素组成的原子。“同位素富集的”还可以指含有具有非该原子的天然同位素组成的具有同位素组成的至少一个原子的化合物。
本文使用的“烷基”、“环烷基”、“烯基”、“环烯基”、“炔基”、“芳基”、“烷氧基”、“烷氧基羰基”、“氨基”、“羧基”、“烷基氨基”、“芳基氨基”、“硫代烷氧基”、“杂环基”、“杂芳基”、“烷基杂环基”、“烷基杂芳基”、“酰 基”、“芳烷基”、“烷芳基”、“嘌呤”、“嘧啶”、“羧基”和“氨基酸”基团任选在一个以上存在氢原子的位置包含氘,并且其中该(一个以上)原子的氘组成不是天然同位素组成。
此外本文所用的“烷基”、“环烷基”、“烯基”、“环烯基”、“炔基”、“芳基”、“烷氧基”、烷氧基羰基”、“羧基”、“烷基氨基”、“芳基氨基”、“硫代烷氧基”、“杂环基”、“杂芳基”、“烷基杂环基”、“烷基杂芳基”、“酰基”、“芳烷基”、“烷芳基”、“嘌呤”、“嘧啶”、“羧基”和“氨基酸”基团任选以非天然同位素组成的量含有碳-13。
本文所用的EC50是指特定试验化合物的剂量、浓度或量,该剂量、浓度或量诱发的剂量依赖性反应为由该特定试验化合物所诱导、引发或增强的特定反应的最大表现的50%。
本文所用的IC50是指在测量这样反应的测定法中达到最大反应的50%的抑制的特定试验化合物的量、浓度或剂量。
本文所用术语“宿主”是指病毒可在其中复制的任何单细胞或多细胞生物体,包括细胞系和动物,在某些实施方案中,为人类。或者,宿主可携带部分病毒基因组,所述病毒基因组的复制或功能可以通过本文的化合物而改变。术语宿主具体包括受感染的细胞、用全部或部分病毒基因组转染的细胞和动物,特别是灵长类(包括黑猩猩)和人。在大部分动物应用中,宿主为人类患者。然而在某些适应症中,本公开明确预期可用于兽医应用(诸如黑猩猩)。
本文所用术语“对象”和“患者”在本文可互换地使用。术语“对象”是指动物,诸如哺乳动物,包括非灵长类(例如牛、猪、马、猫、狗、大鼠和小鼠)和灵长类(例如诸如食蟹猴(cynomolgous monkey)等猴、黑猩猩和人类),例如人类。在某些实施方案中,对象对C型肝炎感染的现行治疗而言是难治的或无反应的。在另一个实施方案中,对象为家畜(例如马、牛、猪等)或宠物(例如狗或猫)。在某些实施方案中,对象为人类。
本文所用术语“治疗剂”是指可用于治疗或预防病症或其一种以上症状的任何药剂。在某些实施方案中,术语“治疗剂”包括本文提供的化合物。在某些实施方案中,治疗剂是已知可用于或已经用于或目前正用于治疗或预防病症或其一种以上症状的作用剂。
“治疗有效量”是指当施用至对象用于治疗疾病时,化合物或组合物的量足以实现对该疾病的这样的治疗。“治疗有效量”尤其可随化合物、疾病及其严重程度、待治疗的对象的年龄、体重等而变化。
在某些实施方案中,任何疾病或病症的“治疗”是指改善存在于对象中的疾病或病症。在另一个实施方案中,“治疗”包括改善对象可能察觉不出的至少一个身体参数。在另外又一个实施方案中,“治疗”包括在身体上(例如可觉察症状的稳定)或在生理上(例如身体参数的稳定)或在两者上同时调节疾病或病症。在另外又一个实施方案中,“治疗”或“疗法”包括延缓疾病或病症的发作。
本文所用术语“预防剂”是指可以用于预防病症或其一种以上症状的任何药剂。在某些实施方案中,术语“预防剂”包括本文提供的化合物。在某些其他实施方案中,术语“预防剂”并非指本文提供的化合物。例如,预防剂为已知可用于或已经用于或目前正在用于预防或防止病症的发作、发展、恶化和/或严重程度的药剂。
本文所用的短语“预防有效量”是指足以防止或减少与病症有关的一种以上症状的发展、复发或发作,或增强或改进另一疗法(例如另一预防剂)的预防效果的疗法(例如预防剂)的量。
对于包含经修饰的氨基酸残基的组合物,术语“实质上纯的”是指组合物以重量计(例如干重)包含至少80%、85%、90%、或95%,在某些实施方案中,95%、98%、99%、或100%的相对于所述组合物的剩余部分的经修饰的氨基酸残基。重量百分比可以相对于所述组合物中的蛋白质的总重或相对于所述组合物中的经修饰的氨基酸残基的总重。纯度可以通过对本领域技术人员而言是显而易见的技术(例如SDS-PAGE)来测定。
术语“抗体”是指本领域技术人员所公认为是抗体的任意大分子。抗体共享常见的性质,包括结合(binding)和至少一个多肽链,所述多肽链与能够由本领域技术人员所公认的任意的免疫球蛋白基因所编码的多肽链实质上是相同的。所述免疫球蛋白基因包括但不限于κ、λ、α、γ(IgG1、IgG2、IgG3和IgG4)、δ、ε和μ恒定区基因、以及免疫球蛋白可变区基因。该术语包括本领域技术人员所公认的全长的抗体和抗体片段,以及它们的变体。该术语进一步包括糖基化的和非糖基化的(aglycosylated)抗体。
术语“抗体片段”是指除全长形式之外的任意形式的抗体。本文的抗体片段包括存在全长抗体内的为更小的组分的抗体、和已经被工程化的抗体。抗体片段包括但不限于Fv、Fc、Fab、和(Fab')2、单链Fv(scFv)、双体、三体、四体、双功能的杂交抗体、CDR1、CDR2、CDR3、CDR's的组合、可变区、构架区、恒定区等(Maynard&Georgiou,2000,Annu.Rev.Biomed.Eng.2:339-76;Hudson,1998,Curr.Opin.Biotechnol.9:395-402)。
术语“免疫球蛋白(Ig)”是指由一种以上实质上由免疫球蛋白基因中的一种所编码的多肽所组成的蛋白质,或是指氨基酸序列与其实质上相同的蛋白质。免疫球蛋白包括但不限于抗体。免疫球蛋白可以具有许多结构形式,包括但不限于全长抗体、抗体片段和包括但不限于VH、Cγ1、Cγ2、Cγ3、VL和CL的个别免疫球蛋白域(immunoglobulin domain)。
术语“免疫球蛋白(Ig)域”是指由实质上由免疫球蛋白基因所编码的多肽组成的蛋白质结构域(protein domain)。Ig域包括但不限于VH、Cγ1、Cγ2、Cγ3、VL和CL。
术语抗体的“可变区”是指由VH免疫球蛋白域、VL免疫球蛋白域、或VH和VL免疫球蛋白域所组成的多肽。可变区可以是指分离的这个或这些多肽,如Fv片段、如scFv片段、如在更大的抗体片段环境中的该区、或如在全长的抗体片段或替代性的非抗体骨架分子环境中的该区。
术语“可变的”是指这样的事实:抗体之间的可变区的某些部分的序列是普遍不同的,其是各个特定的抗体对它的特定的抗原的结合特异性的原因。然而,可变性并不是遍及抗体的可变区均匀分布的。在轻链和重链可变区中,它都集中在被称为互补性决定区(CDRs)的三个区段中。可变区的更高度保守的部分被称为构架区(FR)。天然的重链和轻链的可变区各包含四个FR区,所述四个FR区基本上采用β-折叠构型,通过三个或四个CDR进行连接,其形成连接β-折叠结构的环,在某些情况下形成β-折叠结构的一部分。各链中的多个CDR通过FR区很靠近地连在一起,且利用来自其它链的多个CDR有助于形成抗体的抗原结合位点(参见Kabat等,Sequences of Proteins of Immunological Interest,第五版.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。
恒定区通常不直接参与抗体与抗原的结合,但显示了效应子功能。根据它们的重链的恒定区的氨基酸序列,抗体或免疫球蛋白可以被归属到不同的类别。有五种主要类别的免疫球蛋白:IgA、IgD、IgE、IgG和IgM,且这些中的一些可以进一步被划分成子类(同种型),例如IgG1、IgG2、IgG3、和IgG4;IgA1和IgA2。对应于免疫球蛋白的不同类别的重链恒定区分别被称为α、δ、ε、γ和μ。各种人类免疫球蛋白类别中,已知只有人类IgG1、IgG2、IgG3和IgM活化补体。
术语“偶联物”指的是可以连接到如本文所述的经修饰的氨基酸残基的任何部分。在一些实施方案中,术语“偶联物”和“有效载荷”可以互换使用。偶联物可以是小分子或大分子。在一些实施方案中,所述偶联物 是生物活性分子,包括但不限于,蛋白质、肽、核酸活性物(nucleic active)或其杂交体。在一些实施方案中,所述偶联物是聚合物,诸如聚乙二醇。在一些实施方案中,偶联物是治疗剂,包括市售的药物。在一些实施方案中,偶联物是能够识别和结合特定靶标的标记物,诸如对靶细胞有害的分子有效载荷,或是对检测或诊断有用的标记物。在一些实施方案中,偶联物通过连接基团而连接于经修饰的氨基酸残基。在一些实施方案中,偶联物直接连接到经修饰的氨基酸残基,而没有连接基团。
“变体蛋白质序列”是指具有一个以上残基在氨基酸同一性(identity)上不同于另外的类似蛋白质序列的蛋白质序列。所述类似的蛋白质序列可以是天然的野生型蛋白质序列、或野生型序列的另外的变体。变体包括具有一个以上氨基酸的插入、删除、或置换的蛋白质。变体还包括具有一个以上翻译后经修饰的氨基酸。
术语“亲本抗体”是指根据本文所提供的描述进行修饰的、本领域技术人员已知的抗体。所述修饰可以是确确实实的(physical),即,以化学方法或生物化学方法置换或修饰亲本抗体的一个以上氨基酸,以产生在本描述的范围内的抗体。所述修饰也可以是概念上的,即,使用亲本抗体的一个以上多肽链的序列来设计包含根据本描述的一个以上位点特异性的经修饰的氨基酸的抗体。亲本抗体可以是天然存在的抗体或在实验室中设计或开发的抗体。亲本抗体也可以是人工抗体或工程化的抗体,例如嵌合抗体或人源化抗体。
术语“保守性修饰的变体”是指通过氨基酸序列中的保守性置换而不同于相关的蛋白质的蛋白质。本领域技术人员将理解对在经编码的序列中改变、添加或删除单个氨基酸或小百分比的氨基酸的针对肽、多肽或蛋白质序列的个别置换、删除、或添加是“保守性修饰的变体”,其中所述改变引起以化学上类似的氨基酸进行氨基酸的置换。提供功能上类似的氨基酸的保守性置换表在本领域是公知的。这样的保守性修饰的变体是加上且不排除多态变体、物种间同源物和等位基因。
以下八个组各自包含彼此为保守性置换的氨基酸:
1)丙氨酸(A)、甘氨酸(G);
2)天冬氨酸(D)、谷氨酸(E);
3)天冬酰胺(N)、谷氨酰胺(Q);
4)精氨酸(R)、赖氨酸(K);
5)异亮氨酸(I)、亮氨酸(L)、蛋氨酸(M)、缬氨酸(V);
6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W);
7)丝氨酸(S)、苏氨酸(T);和
8)半胱氨酸(C)、蛋氨酸(M)。
参见例如,Creighton,Proteins:Structures and Molecular Properties,W H Freeman&Co.;第二版(1993年12月)。
术语“相同的”或“同一性”,在两个以上的多肽序列的情况中,是指是相同的两个以上序列或子序列。当在比较窗口或在利用以下的序列比较算法之一或通过手工对准和肉眼观察所测定的指定区针对最大一致性进行比较和对准时,如果它们具有一定百分比的相同的氨基酸残基或核苷酸(即,在特定的区域,约60%的同一性、任选地约65%、约70%、约75%、约80%、约85%、约90%、或约95%的同一性),则序列是“实质上相同的”。所述同一性可以存在于在长度上是至少约50个氨基酸或核苷酸的区,或存在于在长度上是75-100个氨基酸或核苷酸的区,或存在于非特定的、跨越(across)整个序列或多肽的区。在抗体的情况下,可以在可变的CDRs之外测定同一性。包括但不限于通过局部同源性算法(Smith和Waterman(1970)Adv.Appl.Math.2:482c)、通过同源性对准算法(Needleman和Wunsch(1970)J.Mol.Biol.48:443)、通过寻找相似法(Pearson和Lipman(1988)Proc.Nat'l.Acad.Sci.USA 85:2444)、通过这些算法的计算机化实施(Wisconsin Genetics Software Package,Genetics Computer Group,575Science Dr.,Madison,Wis.中的GAP、BESTFIT、FASTA和TFASTA)、或通过手工对准和肉眼观察(参见例如,Ausubel等,Current Protocols in Molecular Biology(1995年增刊)),而可以进行用于比较的序列的最佳对准。
适用于测定百分序列同一性和序列相似性百分比的算法的实例包括BLAST和BLAST 2.0算法,它们分别记载在Altschul等,(1977)Nuc.Acids Res.25:3389-3402和Altschul等,(1990)J.Mol.Biol.215:403-410中。用于执行BLAST分析的软件通过国家生物技术信息中心是公开可利用的。BLAST算法参数W、T和X确定对准的灵敏度和速度。BLASTN程序(对于核苷酸序列)使用的默认值:字长(W)为11、期望值(E)为10、M=5、N=-4和两条链的比较。对于氨基酸序列,BLASTP程序使用的默认值:字长为3、期望值(E)为10、BLOSUM62打分矩阵(参见Henikoff和Henikoff(1989)Proc.Natl.Acad.Sci.USA 89:10915)对准(B)为50、期望值为10、M=5、N=-4、和两条链的比较。BLAST算法通常用“低复杂度”的关闭的过滤器(filter)来执行。在一些实施方案中,BLAST算法通常用“低复杂度”的 打开的过滤器来执行。
BLAST算法也执行两种序列之间的相似性的统计学分析(参见例如,Karlin和Altschul(1993)Proc.Natl.Acad.Sci.USA 90:5873-5787)。BLAST算法所提供的相似性的一种测定是最小加和概率(sum probability)(P(N)),其提供两种核苷酸或氨基酸序列之间偶然出现匹配的概率的指示。例如,如果在测试核苷酸与参考核苷酸的比较中,最小加和概率小于约0.2、更优选小于约0.01、最优选小于约0.001,那么则认为核苷酸与参考序列相似。
术语“氨基酸”是指天然存在和非天然存在的氨基酸,以及诸如脯氨酸等氨基酸、氨基酸类似物和以类似于天然存在的氨基酸方式发挥作用的氨基酸模拟物。
天然编码的氨基酸是本领域技术人员已知的蛋白氨基酸。它们包括20种常见的氨基酸(丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸)和较不常见的吡咯赖氨酸和硒代半胱氨酸。天然编码的氨基酸包括22种天然存在的氨基酸的翻译后的变体,诸如戊二烯基化的氨基酸、异戊二烯基化的氨基酸、豆蔻酰化的氨基酸、棕榈酰化氨基酸、N-连接糖基化的氨基酸、O-连接糖基化的氨基酸、磷酸化的氨基酸和酰化的氨基酸。
术语“经修饰的氨基酸”是指不是蛋白氨基酸或其翻译后修饰的变体的氨基酸。特别是,该术语是指不是20种常见氨基酸、或吡咯赖氨酸或硒代半胱氨酸或其翻译后修饰的变体中的一种的氨基酸。
化合物
本文提供根据式I的化合物:
或其盐,其中:D是-Ar-W3-或-W1-Y1-C(O)-Y2-W2-;Ar是
W1、W2、和W3各自独立地是单键或低级亚烷基;各X1独立地是-NH-、-O-、或-S-;各Y1独立地是单键、-NH-、或-O-;各Y2独立地是单键、-NH-、-O-、或N-连接的或C-连接的亚吡咯烷基;以及Z1、Z2、和Z3中的一个是-N-,且Z1、Z2、和Z3中的其余者独立地是-CH-。
在实施方案中,D是-Ar-W3-;且Ar和W3是如在式I的情况中所定义的。在特定的实施方案中,D是-Ar-W3-;且Ar是
以及Ar、Z1、Z2、Z3和W3是如在式I的情况中所定义的。在某些实施方案中,D是-Ar-W3-;且Ar是
以及Ar、Z1、Z3、X1和W3是如在式I的情况中所定义的。在某些实施方案中,D是-Ar-W3-;W3是-CH2-;且Ar是
其中Z1和Z2是如在式I的情况中所定义的。
在实施方案中,D是-W1-Y1-C(O)-Y2-W2-;且W1、W2、Y1和Y2是如在式I的情况中所定义的。在特定的实施方案中,D是-W1-Y1-C(O)-Y2-W2-;且Y1各自独立地是-NH-或-O-;且W1,W2和Y2是如在式I的情况中所定义的;在某些实施方案中,D是-W1-Y1-C(O)-Y2-W2-;Y2各自独立地是N- 连接的或C-连接的亚吡咯烷基;且W2各自是单键;且W1和Y1是如在式I的情况中所定义的。在特定的实施方案中,D是-W1-Y1-C(O)-Y2-W2-;Y2各自独立地是单键、-NH-或-O-;且W2各自是低级亚烷基;且W1和Y1是如在式I的情况中所定义的。
在实施方案中,提供根据式Ia的化合物:
其中D是如在式I的情况中所定义的。
在实施方案中,提供式I和式Ia两者中的任一式的化合物,其中W2和W3各自独立地是C1-C3亚烷基。在另一个实施方案中,提供式I和式Ia两者中的任一式的化合物,其中W2和W3各自独立地是C1-C2亚烷基。
在实施方案中,提供根据式II的化合物:
或其盐,其中W4是C1-C10亚烷基。在进一步的实施方案中,W4是C1-C5亚烷基。在实施方案中,W4是C1-C3亚烷基。在实施方案中,W4是C1亚烷基。
在实施方案中,提供根据式30的化合物:
或其盐。
在实施方案中,提供根据式1-29和式40中的任一式的化合物:
或其盐。
在实施方案中,提供多肽,所述多肽包含对应于式I、Ia、II、1-30或40的化合物的氨基酸残基。在实施方案中,提供包含多肽的偶联物,所述多肽包含对应于式I、Ia、II、1-30或40的化合物的氨基酸残基且连接于有效载荷,且任选地,所述偶联物包含在所述多肽和所述有效载荷之间的连接部分。
在实施方案中,提供抗体,所述抗体包含对应于式I、Ia、II、1-30或40的化合物的氨基酸残基。在实施方案中,提供包含抗体的偶联物,所述抗体包含对应于式I、Ia、II、1-30或40的化合物的氨基酸残基且连接于有效载荷,且任选地,所述偶联物包含在所述抗体和所述有效载荷之间的连接部分。
在实施方案中,提供正交tRNA,所述正交tRNA以对应于式I、Ia、II、1-30或40的化合物的氨基酸残基所氨酰化。在相关的实施方案中,提 供制备多肽的方法,所述方法包括在适于将氨基酸残基并入所述多肽的条件下,使所述多肽与以所述氨基酸残基所氨酰化的正交tRNA接触,所述氨基酸残基对应于式I、Ia、II、1-30或40的化合物。在一方面中,所述正交tRNA的碱基与密码子配对,所述密码子通常与氨基酸不相关联。在另一方面,所述接触发生在反应混合物中,所述反应混合物包括tRNA合成酶,所述tRNA合成酶能够用式I、Ia、II、1-30或40的化合物氨酰化正交tRNA。
在某些实施方案中,根据以下任一式提供包含经修饰的氨基酸残基的多肽,其中D是如在式I的情况中所定义的:
本领域技术人员将承认蛋白质通常由L-氨基酸构成。然而,利用经修饰的氨基酸,本方法和组合物提供给从业者使用L-、D-或外消旋经修饰的氨基酸的能力。在某些实施方案中,本文所描述的经修饰的氨基酸包括D-型(versions)天然氨基酸和外消旋型天然氨基酸。
Huisgen环加成反应
有利地,本文提供的所述包含叠氮基团的经修饰的氨基酸(诸如根据式I、Ia、II、1-30或40的任一式的化合物)和包含它们的多肽促进与包含炔基团(alkyne group)的第二化合物的选择性且有效的反应。认为叠氮基团和炔基团以1,3-偶极环加成反应进行反应而形成1,2,3-亚三唑基(1,2,3-triazolylene)部分,该1,2,3-亚三唑基部分将所述经修饰的氨基酸(或包含所述经修饰的氨基酸的多肽)连接到所述第二化合物。该叠氮化物和炔之间的形成三唑的反应作为Huisgen环加成反应而为本领域技术人员所熟知。
叠氮和炔官能团的独特的反应性使得它们对于选择性修饰多肽的其他生物分子是极其有用的。有机叠氮化物,特别是脂肪族叠氮化物和炔烃通常对一般的反应化学条件是稳定的。特别是,叠氮官能团和炔官能团均对存在于天然存在的多肽中的20种常见的氨基酸的侧链(即,R基团)是惰性的。然而,当使它们紧密靠近时,则显示出叠氮和炔官能团的“弹簧 承载式的(spring-loaded)”的性质,它们经由生成相应的三唑的Huisgen[3+2]环加成反应而选择性且有效地反应。参见例如Chin J.,等,Science301:964-7(2003);Wang,Q.,等,J.Am.Chem.Soc.125,3192-3193(2003);Chin,J.W.,等,J.Am.Chem.Soc.124:9026-9027(2002)。
由于Huisgen环加成反应涉及选择性环加成反应(参见例如,Padwa,A.,COMPREHENSIVE ORGANIC SYNTHESIS,第4卷,(ed.Trost,B.M.,1991),第1069-1109页;Huisgen,R.1,3-DIPOLAR CYCLOADDITION CHEMISTRY,(ed.Padwa,A.,1984),第1-176页)而不是亲核取代,具有含有叠氮和炔的侧链的非天然编码的氨基酸的并入允许生成的肽在所述非天然编码的氨基酸的位置被选择性地修饰。涉及含有叠氮或炔的化合物的环加成反应可以通过在催化量的还原剂的存在下,添加Cu(II)(包括但不限于催化量的CuSO4的形式)而在水性条件(aqueous conditions)下在室温进行,所述还原剂用于将Cu(II)原位还原至Cu(I)。参见例如Wang,Q.,等,J.Am.Chem.Soc.125,3192-3193(2003);Tornoe,C.W.,等,J.Org.Chem.67:3057-3064(2002);Rostovtsev,等,Angew.Chem.Int.Ed.41:2596-2599(2002)。示例性的还原剂包括但不限于抗坏血酸盐、金属铜、奎宁、对苯二酚、维生素K、谷胱甘肽、半胱氨酸、Fe2+、Co2+、和施加的电位。
多肽
本文提供在至少一个多肽链的氨基酸序列中的位点特异性位置包含一个以上经修饰的氨基酸残基的多肽。在实施方案中,所述组合物是抗体,所述抗体在至少一个多肽链的氨基酸序列中的位点特异性位置包含一个以上经修饰的氨基酸残基。
所述多肽可以与本领域技术人员所公认的任意多肽(即,亲本多肽)共享高序列同一性。在某些实施方案中,除了所述在位点特异性位置的经修饰的氨基酸外,多肽的氨基酸序列与亲本多肽的氨基酸序列是相同的。在进一步的实施方案中,本文提供的多肽相对于亲本多肽除了在位点特异性位置具有一个以上经修饰的氨基酸之外,还可以具有一个以上插入、删除、或突变。在某些实施方案中,本文提供的多肽可以具有独特的一级序列,只要其被本领域技术人员公认为是多肽即可。在该实施方案的某些方面,所述多肽是抗体。
本文所述的组合物和方法使得可以将至少一个经修饰的氨基酸并入多肽。所述经修饰的氨基酸可以存在于所述多肽上的任何位置,包括所述 多肽的任何末端位置或所述多肽的任何内部位置。优选地,所述经修饰的氨基酸不破坏与同源的天然存在的氨基酸的多肽相应的多肽活性和/或三级结构,除非这样的活性和/或三级结构的破坏是将所述经修饰的氨基酸并入到所述多肽的目的之一。此外,将经修饰的氨基酸并入多肽可以在一定程度上改变与同源的天然存在的氨基酸的多肽相应的多肽的活性(例如,控制所述多肽的治疗有效性、提高所述多肽的安全特性、调节所述多肽的药物动力学、药理学和/或药效学(例如,增加水溶性、生物利用度、增加血清半衰期、增加治疗半衰期、调节免疫原性、调节生物活性或延长循环时间)、对所述多肽提供附加的功能、将标签(tag)、标记物或可检测的信号并入到所述多肽、简化所述多肽的分离性质以及前述改变的任何组合)和/或三级结构,而没有完全造成活性和/或三级结构的破坏。活性和/或三级结构的这样的改变通常是实现这样的并入的目标之一,虽然将经修饰的氨基酸并入多肽可能也对与同源的天然存在的氨基酸的多肽相应的多肽的活性和/或三级结构影响不大。相应地,经修饰的氨基酸的多肽、包含经修饰的氨基酸的多肽的组合物、用于制备这样的多肽和多肽的组合物的方法、用于纯化、分离和表征这样的多肽和多肽的组合物的方法,和用于使用这样的多肽和多肽的组合物的方法也被考虑在本公开的范围内。此外,本文描述的经修饰的氨基酸的多肽也可以被连接到另一种多肽(包括,举例来说,经修饰的氨基酸的多肽或天然存在的氨基酸的多肽)。
本文所描述的方法、组合物、策略和技术不限于多肽或蛋白质的特定类型、类别或家族。实际上,几乎任何多肽可包括本文所描述的至少一个经修饰的氨基酸。仅以举例的方式,所述多肽可以同源于选自由以下所构成的组的治疗性蛋白质:α-1抗胰蛋白酶、血管抑素、抗溶血因子、抗体、载脂蛋白、脱辅基蛋白、心房利钠因子、心房利钠多肽、心房肽、C-X-C趋化因子、T39765、NAP-2、ENA-78、gro-a、gro-b、gro-c、IP-10、GCP-2、NAP-4、SDF-1、PF4、MIG、降钙素、C-kit配体、细胞因子、CC趋化因子、单核细胞趋化蛋白-1、单核细胞趋化蛋白2、单核细胞趋化蛋白-3、单核细胞炎性蛋白-1α、单核细胞炎性蛋白-1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40配体、C-kit配体、胶原蛋白、集落刺激因子(CSF)、补体因子5a、补体抑制剂、补体受体1、细胞因子、上皮中性粒细胞活化肽-78、MIP-16、MIP-1、表皮生长因子(EGF)、上皮中性粒细胞活化肽、促红细胞生成素(EPO)、去角质毒素、因子IX、因子VII、因子VIII、因子X、成纤维细胞生长因子(FGF)、 纤维蛋白原、纤连蛋白、四螺旋束蛋白、G-CSF、glp-1、GM-CSF、葡糖脑苷脂酶、促性腺激素、生长因子、生长因子受体、刺猬蛋白、血红蛋白、肝细胞生长因子(hGF)、水蛭素、人体生长激素(hGH)、人血清白蛋白、ICAM-1、ICAM-1受体、LFA-1、LFA-1受体、胰岛素、胰岛素样生长因子(IGF)、IGF-I、IGF-II、干扰素(IFN)、IFN-α、IFN-β、IFN-γ、白介素(IL)、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、角质细胞生长因子(KGF)、乳铁蛋白、白血病抑制因子、荧光素酶、神经生长因子(neurturin)、中性粒细胞抑制因子(NIF)、制瘤素M、成骨蛋白、癌基因产物、paracitonin、甲状旁腺激素、PD-ECSF、PDGF、肽激素、多效生长因子(pleiotropin)、蛋白A、蛋白G、pth、致热外毒素A、致热外毒素B和致热外毒素C、pyy、松弛素、肾素、SCF、小的生物合成的蛋白质、可溶性补体受体I、可溶性I-CAM 1、可溶性白介素受体、可溶性TNF受体、生长调节素、生长抑素、生长激素、链激酶、超抗原、葡萄球菌肠毒素、SEA、SEB、SECT、SEC2、SEC3、SED、SEE、类固醇激素受体、超氧化物歧化酶、中毒性休克综合征毒素、胸腺素α1、组织型纤溶酶原激活物、肿瘤生长因子(TGF)、肿瘤坏死因子、肿瘤坏死因子α、肿瘤坏死因子β、肿瘤坏死因子受体(TNFR)、VLA-4蛋白、VCAM-1蛋白、血管内皮生长因子(VEGF)、尿激酶、mos、ras、raf、met、p53、tat、fos、myc、jun、myb、rel、雌激素受体、孕激素受体、睾丸激素受体、醛固酮受体、LDL受体、和皮质酮。在相关的或进一步的实施方案中,所述经修饰的氨基酸多肽也可以与生长激素超基因家族的任何多肽成员是同源的。
在某些实施方案中,经修饰的氨基酸可以在多肽内的任意位置—在N末端、C末端或多肽内。在有利的实施方案中,经修饰的氨基酸位于多肽中的精选的位置。这些位置被识别为对所述经修饰的氨基酸的置换提供最佳位点。各位点能够承受具有最佳结构、功能和/或用于制备所述多肽的方法的经修饰的氨基酸。
在某些实施方案中,用于置换的位点特异性位置提供稳定的多肽。稳定性可以通过对本领域技术人员而言是显而易见的的任意技术来测定。
在某些实施方案中,用于置换的位点特异性位置提供具有最佳功能性质的多肽。例如,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示对它的靶标的极小的降低或没有降低的结合亲和力。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比, 所述多肽可以显示增强的结合。在该实施方案的某些方面,所述多肽是抗体,且所述靶标是抗原。
在某些实施方案中,用于置换的位点特异性位置提供可以被有利地制备的多肽。例如,在某些实施方案中,所述多肽在下文论述的它的合成方法中显示了有利的性质。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示制备中的极小的降低或没有降低的收率。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示制备中的提高的收率。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示极小的降低或没有降低的本文所描述的tRNA抑制。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,在制备中,所述多肽可以显示提高的本文所描述的tRNA抑制。在该实施方案的某些方面,所述多肽是抗体。
在某些实施方案中,用于置换的位点特异性位置提供具有有利的溶解性的多肽。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示极小的降低或没有降低的溶解性。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示提高的溶解性。在该实施方案的某些方面,所述多肽是抗体。
在某些实施方案中,用于置换的位点特异性位置提供具有有利的表达的抗体。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示极小的降低或没有降低的表达。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示提高的表达。在该实施方案的某些方面,所述多肽是抗体。
在某些实施方案中,用于置换的位点特异性位置提供具有有利的折叠的多肽。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示极小的降低或没有降低的适当的折叠。在某些实施方案中,与不具有所述位点特异性经修饰的氨基酸的多肽相比,所述多肽可以显示提高的折叠。在该实施方案的某些方面,所述多肽是抗体。
在某些实施方案中,用于置换的位点特异性位置提供能够有利的偶联的多肽。如本文所描述的,一些经修饰的氨基酸具有促进多肽直接或经由连接基团偶联到第二试剂的侧链或官能团。在某些实施方案中,与在其他位置不具有相同的或其他经修饰的氨基酸的多肽相比,所述多肽可以显示提高的偶联效率。在某些实施方案中,与在其他位置不具有相同的或其他 经修饰的氨基酸的多肽相比,所述多肽可以显示提高的偶联收率。在某些实施方案中,与在其他位置不具有相同的或其他经修饰的氨基酸的多肽相比,所述多肽可以显示提高的偶联特异性。在该实施方案的某些方面,所述多肽是抗体。
在某些实施方案中,本文进一步提供本文所描述的多肽和抗体的保守性修饰的变体。多肽的保守性修饰的变体包含一个以上插入、删除或置换,所述插入、删除或置换在本领域技术人员进行评估时,不影响所述多肽的结构和/或功能。在某些实施方案中,保守性修饰的变体包含20个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含15个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含10个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含9个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含8个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含7个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含6个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含5个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含4个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含3个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含2个或更少的氨基酸的插入、删除或置换。在某些实施方案中,保守性修饰的变体包含1个氨基酸的插入、删除或置换。在特定的实施方案中,所述置换是保守性的,如本文所描述的,在相同的种类内置换氨基酸。在特定的实施方案中,所述多肽是抗体。
在某些实施方案中,可以修饰所述多肽以调整结构、稳定性和/或活性。在这样的实施方案中,所述修饰可以是保守性的或非保守性的。所述修饰只需要适于实践者执行所述方法和使用本文所描述的组合物。在所述多肽是抗体的某些实施方案中,所述修饰降低了但没有消除抗原结合亲和力。在所述多肽是抗体的某些实施方案中,所述修饰提高了抗原结合亲和力。在某些实施方案中,所述修饰增强了所述多肽的结构或稳定性。在某些实施方案中,所述修饰减弱了但没有消除所述多肽的结构或稳定性。在某些实施方案中,经修饰的变体包括20个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括15个或更少的氨基酸的插入、 删除或置换。在某些实施方案中,经修饰的变体包括10个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括9个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括8个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括7个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括6个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括5个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括4个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括3个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括2个或更少的氨基酸的插入、删除或置换。在某些实施方案中,经修饰的变体包括1个或更少的氨基酸的插入、删除或置换。
翻译后修饰的变体也在范围内。可以以本领域技术人员所公认的任意方式对本文所提供的任意多肽进行翻译后修饰。用于多肽的典型的翻译后修饰包括链间的二硫键、链内的二硫键、N-连接糖基化和蛋白酶解。本文还提供了其他翻译后修饰的多肽,所述翻译后修饰的多肽具有诸如磷酸化、O-连接糖基化、甲基化、乙酰化、脂化、GPI锚定、豆蔻酰化和异戊烯化等修饰。所述翻译后修饰可以在活体内、体外或其它方式的制备过程中发生。在某些实施方案中,所述翻译后修饰可以是实践者例如利用本文提供的方法的有意的修饰。在特定的实施方案中,所述多肽是抗体。
进一步包括融合了进一步的肽或多肽的多肽。示例性的融合包括但不限于例如在其中蛋氨酸连接到来源于重组表达的多肽的N末端的甲硫氨酰基多肽,为了纯化目的的融合(包括但不限于融合到多组氨酸或亲和性抗原表位)、为了连接到其它生物活性分子目的的融合、与血清白蛋白结合肽的融合、以及与诸如血清白蛋白等血清蛋白质的融合。所述多肽可以包含蛋白酶切割序列、反应基团、多肽结合域(包括但不限于FLAG或多组氨酸)或其他基于亲和力的序列(包括但不限于FLAG、多组氨酸、GST等)。所述多肽也可以包含改善所述多肽的检测(包括但不限于GFP)、纯化或其他特征的连接分子(包括但不限于生物素)。在某些实施方案中,所述多肽包含促进全长多肽的纯化的C末端亲和性序列。在某些实施方案中,这样的C末端亲和性序列是多组氨酸序列,例如6-组氨酸序列。在特定的实施方案中,所述多肽是抗体。
本文还提供偶联到一个以上偶联部分的多肽。所述偶联部分可以是本 领域技术人员认为有用的任意偶联部分。例如,所述偶联部分可以是能够改善体外或活体内的多肽的稳定性的聚合物,诸如聚乙二醇。所述偶联部分可以具有治疗活性,从而产生多肽-药物偶联物。所述偶联部分可以是对靶细胞有害的分子有效载荷。所述偶联部分可以是对检测或诊断有用的标记物。在某些实施方案中,所述偶联部分经由直接的共价键连接到所述多肽。在某些实施方案中,所述偶联部分经由连接基团连接到所述多肽。在有利的实施方案中,经由所述多肽的一个经修饰的氨基酸来附接(attached)所述偶联部分或所述连接基团。本文描述了示例性的偶联部分和连接基团。在特定的实施方案中,所述多肽是抗体。
所述亲本多肽可以是本领域技术人员已知的、或后来发现的任意多肽,而没有限制。在特定的实施方案中,所述多肽是抗体。所述亲本多肽可以实质上由多肽基因或来自任意生物体的多肽基因进行编码,所述生物体包括但不限于人类、小鼠、大鼠、兔、骆驼、美洲驼、单峰骆驼、猴子、特别是哺乳动物、以及特别是人类、以及特别是小鼠和大鼠。在一个实施方案中,所述亲本多肽可以是全人源的,例如通过使用转基因小鼠或其他动物而获得自患者或受试者(对于抗体的实例,参见Bruggemann&Taussig,1997,Curr.Opin.Biotechnol.8:455-458),或获得自与筛选方法结合的人多肽库(对于抗体的实例,参见Griffiths&Duncan,1998,Curr.Opin.Biotechnol.9:102-108)。所述亲本多肽可以来自任何来源,包括人造或天然存在的。例如亲本多肽可以是工程多肽,包括但不限于嵌合多肽和人源化多肽(对于抗体的实例,参见Clark,2000,Immunol.Today 21:397-402),或源自组合文库。此外,所述亲本多肽可以是实质上由一种以上天然的多肽基因所编码的多肽的工程变体。例如,在一个实施方案中,所述亲本多肽是通过亲和力成熟而被识别的多肽。
亲本多肽可以是本领域已知的任意多肽或本领域技术人员所开发的任意多肽而没有限制。抗体的实例包括但不限于:抗TNF抗体(美国专利号6,258,562)、抗IL-12和/或抗IL-12p40抗体(美国专利号6,914,128);抗IL-18抗体(美国专利号2005/0147610)、抗05、抗CBL、抗CD147、抗gp120、抗VLA-4、抗CD11a、抗CD18、抗VEGF、抗CD40L、抗CD-40(例如,参见PCT公开号WO 2007/124299)抗Id、抗ICAM-1、抗CXCL13、抗CD2、抗EGFR、抗TGF-β2、抗HGF、抗cMet、抗DLL-4、抗NPR1、抗PLGF、抗ErbB3、抗E-选择素、抗Fact VII、抗Her2/neu、抗F gp、抗CD11/18、抗CD14、抗ICAM-3、抗RON、抗SOST、抗CD-19、抗CD80 (例如参见,PCT公开号WO 2003/039486、抗CD4、抗CD3、抗CD23、抗β2-整合素、抗α4β7、抗CD52、抗HLA DR、抗CD22(例如参见美国专利号5,789,554)、抗CD20、抗MIF、抗CD64(FcR)、抗TCRαβ、抗CD2、抗Hep B、抗CA 125、抗EpCAM、抗gp120、抗CMV、抗gpIIbIIIa、抗IgE、抗CD25、抗CD33、抗HLA、抗IGF1,2、抗IGFR、抗VNR整合素、抗IL-1α、抗IL-1β、抗IL-1受体、抗IL-2受体、抗IL-4、抗IL-4受体、抗IL5、抗IL-5受体、抗IL-6、抗IL-8、抗IL-9、抗IL-13、抗IL-13受体、抗IL-17、抗IL-6R、抗RANKL、抗NGF、抗DKK、抗αVβ3、抗IL-17A、抗IL23p19和抗IL-23(参见Presta,L.G.(2005)J.Allergy Clin.Immunol.116:731-6)。
亲本多肽也可以选自在临床试验中或用于临床使用的开发中所批准使用的各种治疗性多肽。这样的治疗性多肽的抗体的实例包括但不限于,利妥昔单抗(IDEC/Genentech/罗氏)(参见,例如,美国专利号5,736,137)、批准用于治疗非何杰金淋巴瘤的嵌合抗CD20抗体;HuMax-CD20、目前正由Genmab开发的CD20,在专利号为5,500,362的美国专利中描述的抗CD20抗体、AME-133(Applied Molecular Evolution)、hA20(Immunomedics,Inc.)、HumaLYM(Intracel)、和PRO70769(PCT申请号PCT/US2003/040426),曲妥珠单抗(Genentech)(参见例如,美国专利号5,677,171),批准用于治疗乳腺癌的人源化抗Her2/neu抗体;帕妥珠单抗(rhuMab-2C4,),目前正在开发由Genentech;抗Her2抗体(美国专利号4753894);西妥昔单抗(Imclone)(美国专利号4,943,533;PCT公开号WO 96/40210),是用于多种癌症的、处于临床试验中的嵌合抗EGFR抗体;BX-EGF(美国专利号6,235,883),目前正由Abgenix-Immunex-Amgen开发;HUMAX-EGFR(美国专利号7,247,301),目前正由Genmab开发;425、EMD55900、EMD62000和EMD72000(Merck KGaA)(美国专利号5,558,864;Murthy等(1987)Arch.Biochem.Biophys.252(2):549-60;Rodeck等,(1987)J.Cell.Biochem.35(4):315-20;Kettleborough等,(1991)Protein Eng.4(7):773-83);CR62(Institute of Cancer Research)(PCT公开号WO 95/20045;Modjtahedi等,(1993)J.Cell.Biophys.22(I-3):129-46;Modjtahedi等,(1993)Br.J.Cancer 67(2):247-53;Modjtahedi等,(1996)Br.J.Cancer 73(2):228-35;Modjtahedi等(2003)Int.J.Cancer 105(2):273-80);TheraCIM hR3(YM Biosciences,Canada和Centro de Immunologia Molecular,Cuba(美国专利号5,891,996;美国专利号 6,506,883;Mateo等,(1997)Immunotechnol.3(1):71-81);mAb-806(Ludwig Institue for Cancer Research,Memorial Sloan-Kettering)(Jungbluth等(2003)Proc.Natl.Acad.Sci.USA.100(2):639-44);KSB-102(KS Biomedix);MR1-1(IVAX,美国国家癌症研究所)(PCT公开号WO 01/62931A2);和SC100(Scancell)(PCT公开号WO 01/88138);阿仑单抗(Millenium),目前批准用于治疗B细胞慢性淋巴细胞白血病的人源化的mAb;莫罗单抗CD3其是由Ortho Biotech/强生公司开发的抗CD3抗体;替伊莫单抗其是由IDEC/Schering AG开发的抗CD20抗体;吉妥珠单抗奥唑米星其是由Celltech/Wyeth研制开发的抗CD33(P67蛋白)抗体;阿法赛特由Biogen开发的抗LFA-3Fc融合);阿昔单抗由Centocor/礼来开发;巴利昔单抗由诺华公司开发;帕利珠单抗(由Medimmune公司开发;英夫利昔单抗由Centocor公司开发的抗TNFα抗体,阿达木单抗由Abbott开发的抗TNFα抗体;由Celltech公司开发的抗TNFα抗体;戈利木单抗(CNTO-148),由Centocor公司开发的全人源的TNF抗体;依那西普由Immunex/Amgen开发的p75TNF受体Fc融合;Ienercept,由罗氏先前开发的p55TNF受体Fc融合;ABX-CBL,正由Abgenix开发的抗CD147抗体;ABX-IL8,正由Abgenix开发的抗IL8抗体;ABX-MA1,正由Abgenix开发的抗MUC18抗体;Pemtumomab(R1549,90Y-muHMFG1),Abgenix的开发中的抗MUC1;Therex(R1550),正由Antisoma开发的抗MUC1抗体;AngioMab(AS1405),正由Antisoma开发;HuBC-1,正由Antisoma开发;正由Antisoma开发的Thioplatin(AS1407); (那他珠单抗),正由Biogen开发的抗α-4-β-1(VLA-4)和α-4-β-7抗体;VLA-1mAb,正由Biogen开发的抗VLA-1整合素抗体;LTBR mAb,正由Biogen开发的抗淋巴毒素β受体(LTBR)抗体;CAT-152,正由Cambridge抗体Technology公司开发的抗TGF-β抗体;ABT 874(J695),正由Abbott公司开发的抗IL-12p40抗体;CAT-192,正由Cambridge抗体Technology和Genzyme开发的抗TGFβ1抗体;CAT-213,正由Cambridge抗体Technology公司开发的抗Eotaxin1抗体;正由Cambridge抗体Technology和Human Genome Sciences Inc.开发的抗Blys抗体;TRAIL-R1mAb,正由Cambridge抗体Technology和Human Genome Sciences Inc.开发的抗TRAIL-R1抗体;贝伐单抗;rhuMAb-VEGF, 正由Genentech开发的抗VEGF抗体;正由Genentech开发的抗HER受体家族抗体;抗组织因子(ATF),正由Genentech开发的抗组织因子抗体; (奥马珠单抗),正由Genentech开发的抗IgE抗体;(依法利珠单抗),正由Genentech和Xoma开发的抗CD11a抗体;MLN-02抗体(原名LDP-02),正由Genentech和Millenium Pharmaceuticals开发;HuMax CD4,其是正由Genmab开发的抗CD4抗体;HuMax-IL15,其是正由Genmab和Amgen开发的抗IL15抗体;HuMax-Inflam,其正由Genmab和Medarex开发;HuMax-Cancer,其是正由Genmab和Medarex和Oxford GcoSciences开发的抗乙酰肝素酶I抗体;HuMax-Lymphoma,正由Genmab和Amgen开发;HuMax-TAC,正由Genmab开发;正由IDEC Pharmaceuticals开发的IDEC-131和抗CD40L抗体;IDEC-151(克立昔单抗(Clenoliximab)),正由IDEC Pharmaceuticals开发的抗CD4抗体;IDEC-114,正由IDEC Pharmaceuticals开发的抗CD80抗体;IDEC-152,正由IDEC Pharmaceuticals开发的抗CD23;正由IDEC Pharmaceuticals开发的抗巨噬细胞移动因子(MIF)抗体;BEC2,其是正由Imclone开发的抗独特型抗体;IMC-1C11,其是正由Imclone开发的抗KDR抗体;DC101,其是正由Imclone开发的抗flk-1抗体;正由Imclone开发的抗VE钙粘蛋白抗体;(拉贝珠单抗(Iabetuzumab))、正由Immunomedics开发的抗VE钙粘蛋白抗体;正由Immunomedics开发的抗癌胚抗原(CEA)抗体;(依帕珠单抗),其是正由Immunomedics开发的抗CD22抗体;正由Immunomedics开发的AFP-Cide;正由Immunomedics开发的MyelomaCide;正由Immunomedics开发的MyelomaCide;正由Immunomedics开发的LkoCide;正由Immunomedics开发的ProstaCide;正由Medarex开发的抗CTLA4抗体;MDX-060,其是正由Medarex开发的抗CD30抗体;正由Medarex开发的MDX-070;正由Medarex开发的MDX-018;正由Medarex和Immuno-Designed Molecules开发的 (IDM-1)和抗Her2抗体;其是正由Medarex和Genmab开发的抗CD4抗体;HuMax-IL15,其是正由Medarex和Genmab开发的抗IL15抗体;CNTO 148,其是正由Medarex和Centocor/J&J开发的抗TNFα抗体;CNTO 1275,其是正由Centocor/J&J开发的抗细胞因子抗体;MOR101和MOR102,正由MorphoSys开发的抗细胞间黏附分子-1(ICAM-1)(CD54)抗体;MOR201,其是正由MorphoSys开发的抗成纤维细胞生长因子受体3(FGFR-3)抗体;(维西珠单抗),其是正由 Protein Design Labs开发的抗CD3抗体;其是正由Protein Design Labs开发的抗γ干扰素抗体;正由Protein Design Labs开发的抗α5β1干扰素抗体;正由Protein Design Labs开发的抗IL-12;ING-1,其是正由Xoma开发的抗Ep-CAM抗体;(奥马珠单抗),其是正由Genentech和诺华开发的人源化抗IgE抗体;以及MLN01,其是正由Xoma开发的人源化抗β2整合素抗体。在另一实施方案中,所述治疗剂包括KRN330(Kirin);huA33抗体(A33,路德维格癌症研究所);CNTO95(αV整合素,Centocor);MEDI-522(αVβ3integrin,Medimmune);伏洛昔单抗(αVβ1整合素,Biogen/PDL);人类mAb 216(B细胞糖基化抗原表位,NCL);BiTE MT103(双特异性CD19×CD3,MedImmune公司);4G7×H22(双特异性B细胞×FcγR1,Medarex/Merck KGa);rM28(双特异性CD28×MAPG,欧洲专利号EP1444268);MDX447(EMD82633)(双特异性CD64×EGFR,Medarex);卡妥索单抗(removab)(双特异性的EpCAM×抗CD3,Trion/Fres);厄妥索单抗(双特异性HER2/CD3,Fresenius Biotech);奥戈伏单抗(oregovomab)(OvaRex)(CA-125,ViRexx);(WX G250)(碳酸酐酶IX,Wilex);CNTO888(CCL2,Centocor);TRC105(CD105(内皮糖蛋白),Tracon);BMS-663513(CD137激动剂,Brystol Myers Squibb);MDX-1342(CD19,Medarex公司);希普利珠单抗(Siplizumab)(MEDI-507)(CD2,Medimmune);奥法木单抗(Humax-CD20)(CD20,Genmab公司);利妥昔单抗(Rituxan)(CD20,Genentech);维妥珠单抗(veltuzumab)(hA20)(CD20,Immunomedics);依帕珠单抗(CD22,Amgen);鲁昔单抗(IDEC 152)(CD23,Biogen);莫罗莫那-CD3(CD3,邻位);HuM291(CD3fc受体,PDL Biopharma);HeFi-1,CD30,NCL);MDX-060(CD30,Medarex);MDX-1401(CD30,Medarex);SGN-30(CD30,西雅图Genentics);SGN-33(林妥珠单抗)(CD33,西雅图Genentics);Zanolimumab(HUMAX-CD4)(CD4,Genmab);HCD122(CD40,诺华);SGN-40(CD40,Seattle Genentics);Campath1h(阿仑单抗)(CD52,Genzyme);MDX-1411(CD70,Medarex);hLL1(EPB-1)(CD74.38,Immunomedics);Galiximab(IDEC-144)(CD80,Biogen);MT293(TRC093/D93)(断裂的胶原蛋白,Tracon);HuLuc63(CS1,PDL Pharma);易普利单抗(ipilimumab)(MDX-010)(CTLA4,Brystol Myers Squibb);Tremelimumab(Ticilimumab,CP-675,2)(CTLA4,辉瑞);HGS-ETR1(马帕木单抗)(DR4TRAIL-R1激动剂,Human Genome Science/Glaxo Smith Kline);AMG-655(DR5,Amgen);Apomab(DR5, Genentech);CS-1008(DR5,Daiichi Sankyo);HGS-ETR2(来沙木单抗)(DR5TRAIL-R2激动剂,HGS);西妥昔单抗(爱必妥)(EGFR,Imclone);IMC-11F8,(EGFR,Imclone);尼妥珠单抗(EGFR,YM Bio);帕尼单抗(Vectabix)(EGFR,Amgen);扎妥木单抗(Zalutumumab)(HuMaxEGFr)(EGFR,Genmab公司);CDX-110(EGFRvIII,AVANT Immunotherapeutics);阿德木单抗(adecatumumab)(MT201)(Epcam,Merck);依决洛单抗(Panorex,17-1A)(Epcam,Glaxo/Centocor);MORAb-003(叶酸受体a,Morphotech);KW-2871(神经节苷脂GD3,Kyowa);MORAb-009(GP-9,Morphotech);CDX-1307(MDX-1307)(hCGb,Celldex);曲妥珠单抗(赫赛汀)(HER2,Celldex);帕妥珠单抗(rhuMAb 2C4)(HER2(DI),Genentech);阿泊珠单抗(apolizumab)(HLA-DRβ链,PDL Pharma);AMG-479(IGF-1R,Amgen);抗-IGF-1R R1507(IGF1-R,Roche);CP751871(IGF1-R,辉瑞);IMC-A12(IGF1-R,Imclone);BIIB022(IGF-1R,Biogen);MIK-β-1(IL-2Rb(CD122),Hoffman LaRoche);CNTO328(IL6,Centocor);抗KIR(1-7F9)(杀伤细胞Ig样受体(KIR),Novo);Hu3S193(Lewis(y),惠氏,癌症研究路德维格研究所);hCBE-11(LTβR,Biogen);HuHMFG1(MUC1,Antisoma/NCL);RAV12(N-连接的碳水化合物抗原表位,Raven);CAL(甲状旁腺激素相关蛋白(PTH-RP),加利福尼亚大学);CT-011(PD1,CureTech);MDX-1106(ONO-4538)(PD1,PD1,Medarex/Ono);MAb CT-011(PD1,Curetech);IMC-3G3(PDGFRa,Imclone);巴维昔单抗(bavituximab)(磷脂酰丝氨酸,Peregrine);huJ591(PSMA,Cornell Research Foundation);muJ591(PSMA,Cornell Research Foundation);GC1008(TGFb(泛)抑制剂(IgG4),Genzyme);英夫利昔单抗(Remicade)(TNFa,Centocor);A27.15(转铁蛋白受体,Salk Institute,INSERN WO 2005/111082);E2.3(转铁蛋白受体,Salk Institute);贝伐单抗(Avastin)(VEGF,Genentech);HuMV833(VEGF,Tsukuba Research Lab,PCT公开号WO/2000/034337,University of Texas);IMC-18F1(VEGFR1,Imclone);IMC-1121(VEGFR2,Imclone)。
在某些实施方案中,本文提供的多肽包含在位点特异性位置的1个经修饰的氨基酸。在某些实施方案中,本文提供的多肽包含在位点特异性位置的2个经修饰的氨基酸。在某些实施方案中,本文提供的多肽包含在位点特异性位置的3个经修饰的氨基酸。在某些实施方案中,本文提供的多肽包含在位点特异性位置的多于3个的经修饰的氨基酸。
抗体
在某些实施方案中,本文提供包含一个以上多肽的抗体,所述多肽包含如本文所描述的一个以上经修饰的氨基酸。在某些实施方案中,所述抗体是包含两个相同的轻(L)链和两个相同的重(H)链的异四聚体。各轻链可以通过一个共价的二硫键而连接到重链。各重链可以通过一个以上共价的二硫键而连接到其它重链。各重链和各轻链也可以具有一个以上链内二硫键。如本领域技术人员所已知的,各重链通常包含可变区(VH),接着许多恒定区。各轻链通常包含在一端的可变区(VL)和恒定区。如本领域技术人员所已知的,抗体通常对它们的靶分子(即,抗原)具有选择性亲和力。
本文所提供的抗体可以具有本领域技术人员所已知的任意多肽形式。它们可以是全长或片段。示例性的全长抗体包括IgA、IgA1、IgA2、IgD、IgE、IgG、IgG1、IgG2、IgG3、IgG4、IgM等。示例性的片段包括Fv、Fab、Fc、sFv等。
一个以上经修饰的氨基酸可以位于抗体的至少一个多肽链中的所选的位点特异性位置。所述多肽链可以是所述抗体的任意多肽链而没有限制,包括轻链或重链。所述位点特异性位置可以是所述抗体的任意区域,包括任意的可变区和任意的恒定区。
用于置换的位点特异性位置可以用本领域技术人员已知的任意多肽命名系统来描述。在所述多肽是抗体的实施方案中,所述编号系统可以是Kabat编号系统,其中所述位点特异性位置在重链残基H005、H023、H042、H065、H074、H084、H118、H119、H132、H134、H135、H136、H137、H138、H139、H155、H160、H162、H165、H172、H174、H176、H177、H191、H194、H219、H238、H239、H241、H243、H246、H262、H264、H265、H267、H268、H269、H270、H271、H272、H274、H275、H278、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H356、H358、H359、H360、H375、H383、H384、H386、H389、H392、H398、H420、H421、H436、和H438。具体而言,本文提供包含在选自以下Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H005、H023、H042、H065、H074、H084、H118、H119、H132、H134、H135、H136、H137、H138、H139、H155、H160、H162、H165、H172、H174、H176、H177、H191、H194、H219、H238、 H239、H241、H243、H246、H262、H264、H265、H267、H268、H269、H270、H271、H272、H274、H275、H278、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299,H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H356、H358、H359、H360、H375、H383、H384、H386、H389、H392、H398、H420、H421、H436、和H438。
在某些实施方案中,本文提供包含在选自以下的Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H005、H023、H074、H084、H118、H119、H132、H134、H135、H136、H137、H139、H160、H162、H165、H172、H191、H194、H239、H241、H246、H267、H268、H269、H270、H271、H272、H274、H275、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299,H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H359、H375、H386、H389、H392、H398、H420、H421、和H438。
在某些实施方案中,本文提供包含在选自以下的Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H005、H084、H118、H132、H136、H239、H293、H334、H355、H359、和H389。
在某些实施方案中,本文提供包含在选自以下的Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H023、H074、H119、H134、H135、H137、H139、H160、H162、H165、H172、H191、H194、H241、H246、H267、H268、H269、H270、H271、H272、H274、H275、H280、H281、H282、H283、H286、H289、H292、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H335、H337、H339、H344、H355、H375、H386、H392、H398、H420、H421、H340和H438。
在某些实施方案中,本文提供包含在选自以下的Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H042、H065、H138、H155、H174、H176、H177、H219、H238、H243、H262、H264、H265、H278、H356、H358、H360、H383、H384、、和H436。
在某些实施方案中,本文提供包含在选自相当于以下残基的Kabat残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H292-H301、H303、 和H305。
在Chothia抗体编号系统中,这些位置在重链残基H005、H023、H042、H065、H074、H084、H118、H119、H132、H134、H135、H136、H137、H138、H139、H155、H160、H162、H165、H172、H174、H176、H177、H191、H194、H219、H238、H239、H241、H243、H246、H262、H264、H265、H267、H268、H269、H270、H271、H272、H274、H275、H278、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H356、H358、H359、H360、H375、H383、H384、H386、H389、H392、H398、H420、H421、H436、和H438。具体而言,本文提供包含在选自以下Chothia残基的一个以上位置的一个以上非天然氨基酸的抗体:H005、H023、H042、H065、H074、H084、H118、H119、H132、H134、H135、H136、H137、H138、H139、H155、H160、H162、H165、H172、H174、H176、H177、H191、H194、H219、H238、H239、H241、H243、H246、H262、H264、H265、H267、H268、H269、H270、H271、H272、H274、H275、H278、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H356、H358、H359、H360、H375、H383、H384、H386、H389、H392、H398、H420、H421、H436、和H438。
在某些实施方案中,本文提供包含在选自以下Chothia残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H005、H023、H074、H084、H118、H119、H132、H134、H135、H136、H137、H139、H160、H162、H165、H172、H191、H194、H239、H241、H246、H267、H268、H269、H270、H271、H272、H274、H275、H280、H281、H282、H283、H286、H289、H292、H293、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H334、H335、H337、H339、H340、H344、H355、H359、H375、H386、H389、H392、H398、H420、H421和H438。
在某些实施方案中,本文提供包含在选自以下Chothia残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H005、H084、H118、H132、 H136、H239、H293、H334、H355、H359和H389。
在某些实施方案中,本文提供包含在选自相当于以下残基的Chothia残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H292-H301、H303、和H305。
在某些实施方案中,本文提供包含在选自以下Chothia残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H023、H074、H119、H134、H135、H137、H139、H160、H162、H165、H172、H191、H194、H241、H246、H267、H268、H269、H270、H271、H272、H274、H275、H280、H281、H282、H283、H286、H289、H292、H294、H295、H296、H297、H298、H299、H300、H301、H303、H305、H317、H320、H324、H326、H327、H329、H330、H332、H333、H335、H337、H339、H344、H355、H375、H386、H392、H398、H420、H421、H340和H438。
某些实施方案中,本文提供包含在选自以下Chothia残基的一个以上位置的一个以上经修饰的氨基酸的抗体:H042、H065、H138、H155、H174、H176、H177、H219、H238、H243、H262、H264、H265、H278、H356、H358、H360、H383、H384和H436。
在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L22、L7和L152。
在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L043、L049、L056、L057、L060、L067、L068、L109、L112、L114、L144、L153、L156、L157、L168、L184、L202、L203、和L206。在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L043、L049、L056、L057、L060、L067、L068、L109、L112、L114、L144、L153、L156、L168、L184、L202、和L203。某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L043、L049、L056、L057、L060、L067、L068、L109、L144、L153、L156、L184、L202、和L203。某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L049、L056、L057、L060、L067、L109、L153、L202和L203。
在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-)L001、L003、L005、L007、L008、L009、L010、L016、L017、L018、L020、L022、L026、L027、L045、L058、L063、L065、L066、L070、L077、L079、L107、L138、L142、L143、L152、L171、L182、L188、L199、和L201。在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:-1、L003、L005、L007、L008、L009、L010、L016、L017、L018、L020、L022、L026、L027、L045、L058、L063、L065、L066、L070、L077、L079、L107、L142、L143、L152、L171、L182、L188、L199、和L201。在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-)L001、L003、L005、L007、L008、L009、L016、L017、L018、L020、L022、L026、L027、L045、L058、L063、L065、L066、L070、L077、L079、L107、L142、L152、L171、L182、L188、和L199。在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-1)L005、L007、L008、L016、L017、L018、L020、L022、L027、L045、L058、L063、L077、L079、L107、L142、L152、L182、L188、和L199。在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-)L001、L016、L063、和L199。
在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-)L001、L007、L008、L016、L022、L063、L014、L070、L138、L142、L143和L152。
在某些实施方案中,本文提供包含在选自以下根据Kabat或Chothia编号方案的残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:(-)L001、L007、L008、L016、L022、L063、L070、L138、L142、L143、L152和L201。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:22、7和152。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经 修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:1、3、5、7、8、9、10、16、17、18、20、22、26、27、45、58、63、65、66、70、77、79、107、138、142、143、152、171、182、188、199、和201。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:1、3、5、7、8、9、16、17、18、20、22、26、27、45、58、63、65、66、70、77、79、107、142、143、152、171、182、188、199、和201。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:-1、3、5、7、8、9、16、17、18、20、22、26、27、45、58、63、65、66、70、77、79、107、142、152、171、182、188、和199。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:-1、5、7、8、16、17、18、20、22、27、45、58、63、77、79、107、142、152、182、188、和199。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:-1、16、63和199。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:-1、7、8、16、22、63、14、70、138、142、143和152。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:-1、7、8、16、22、63、70、138、142、143、152、和201。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:43、49、56、57、60、67、68、109、112、114、144、153、156、157、168、184、202、203、和206。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:43、49、56、57、60、67、68、109、112、144、153、156、168、184、202、和203。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:43、49、56、57、60、67、68、109、144、153、156、184、202、和203。
在某些实施方案中,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:49、56、57、60、67、109、153、202、和203。
换而言之,本文提供包含在至少一个以上位置的两个以上经修饰的氨基酸的抗体,所述至少一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链多肽的残基的位置:407、124、183、139、25、40、119、193、225、19、52、71、117或224,以及所述至少一个以上位置选自相当于以下根据SEQ ID NO:2的代表性轻链多肽的残基的位置:22、7和152。
也可以相对于参考抗体的多肽链的氨基酸序列来识别所述位点特异性位置。例如,在SEQ ID NO:1中提供了参考重链的氨基酸序列。在所述参考重链中,所述位点特异性位置位于残基5、23、42、66、75、88、121、122、135、137、138、139、140、141、142、158、163、165、168、175、177、179、180、194、197、222、241、242、244、246、249、265、267、268、270、271、272、273、274、275、277、278、281、283、284、285、286、289、292、295、296、297、298、299、300、301、302、303、304、306、308、320、323、327、329、330、332、333、335、336、337、338、340、342、343、347、358、359、361、362、363、378、386、387、389、392、395、401、423、424、439和441。具体而言,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:5、23、42、66、75、88、121、122、135、137、138、139、140、141、142、158、163、165、168、175、177、179、180、194、197、222、241、242、244、246、249、265、267、268、270、271、272、273、274、275、277、278、281、283、284、285、286、289、292、295、296、297、298、299、300、301、 302、303、304、306、308、320、323、327、329、330、332、333、335、336、337、338、340、342、343、347、358、359、361、362、363、378、386、387、389、392、395、401、423、424、439和441。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:5、23、75、88、121、122、135、137、138、139、140、142、163、165、168、175、194、197、242、244、249、270、271、272、273、274、275、277、278、283、284、285、286、289、292、295、296、297、298、299、300、301、302、303、304、306、308、320、323、327、329、330、332、333、335、336、337、338、340、342、343、347、358、362、378、389、392、395、401、423、424、和441。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:5、88、121、135、139、242、296、337、358、362、和392。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:23、75、122、137、138、140、142、163、165、168、175、194、197、244、249、270、271、272、273、274、275、277、278、283、284、285、286、289、292、295、297、298、299、300、301、302、303、304、306、308、320、323、327、329、330、332、333、335、336、338、340、342、343、347、358、378、389、395、401、423、424、和441。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:42、66、141、158、177、179、180、222、241、246、265、267、268、281、359、361、363、386、387和439。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自相当于以下根据SEQ ID NO:1的代表性重链抗体的残基的位置:292-301、303、和305。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自由根据Kabat或Chothia编号方案的以下重链或轻链残基:H404、H121、H180、H241、L22、L7、L152、 H136、H25、H40、H119、H190、H222、H19、H52、或H70。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自由根据Kabat或Chothia编号方案的以下重链或轻链残基:H404、H121、H180、H241、L22、L7、L152、H136、H25、H40、H119、H190、和H222。
在某些实施方案中,本文提供包含在一个以上位置的一个以上经修饰的氨基酸的抗体,所述一个以上位置选自由根据Kabat或Chothia编号方案的以下重链或轻链残基:H404、H121、H180、H241、L22、L7、L152、和H136。
在某些实施方案中,本文提供包含多肽链的抗体,所述多肽链与SEQ ID NO:1具有至少70%、80%或90%的同源性,且在选自相当于根据SEQ ID NO:1的代表性重链多肽的以下残基的位点的位点具有一个以上经修饰的氨基酸:404、121、180、241、136、25、40、119、190、222、19、52、或70。
在某些实施方案中,本文提供包含多肽链的抗体,所述多肽链与SEQ ID NO:2具有至少70%、80%或90%的同源性,且在选自相当于根据SEQ ID NO:2的代表性轻链多肽的以下残基的位点的位点具有一个以上经修饰的氨基酸:22、7和152。
在某些实施方案中,本文提供包含两个以上位点特异性的经修饰的氨基酸的抗体。在某些实施方案中,各经修饰的氨基酸独立地在特异性位点,所述特异性位点选自由所述抗体的任意多肽链的最佳可置换的位置所构成的组。
在某些实施方案中,所述抗体包含在单一的轻链多肽中的两个以上位点特异性的经修饰的氨基酸。在某些实施方案中,所述抗体包含在单一的重链多肽中的两个以上位点特异性的经修饰的氨基酸。在某些实施方案中,所述抗体包含在轻链多肽中的至少一个位点特异性的经修饰的氨基酸和在重链多肽中的至少一个位点特异性的经修饰的氨基酸。
在某些实施方案中,所述抗体包含在轻链多肽中的至少一个位点特异性的经修饰的氨基酸和在两个重链多肽的每个中的至少一个位点特异性的经修饰的氨基酸。在某些实施方案中,所述抗体包含在两个轻链多肽的每个中的至少一个位点特异性的经修饰的氨基酸和在重链多肽中的至少一个位点特异性的经修饰的氨基酸。在某些实施方案中,所述抗体包含在两个轻链多肽的每个中的至少一个位点特异性的经修饰的氨基酸和在两个重链 多肽的每个中的至少一个位点特异性的经修饰的氨基酸。
在某些实施方案中,所述抗体包含三个以上、四个以上、五个以上、或六个以上位点特异性的经修饰的氨基酸。在某些实施方案中,所述抗体包含两个至六个经修饰的氨基酸。
用于置换的位点特异性位置可以用本领域技术人员已知的任意抗体命名系统来描述。在Kabat编号系统中,这些位置在重链或轻链残基H404、H121、H180、L22、L7、L152、H136、H25、H40、H119、H190、H222、H19、H52、H70、H110、和H221。换而言之,本文提供包含在选自以下Kabat残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:H404、H121、H180、L22、L7、L152、H136、H25、H40、H119、H190、H222、H19、H52、H70、H110、和H221。
在某些实施方案中,本文提供包含在选自以下Kabat残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:H404、H121、H180、H136、H25、H40、H119、H190、H222、H19、H52、H70、H110、和H221。
在某些实施方案中,本文提供包含在选自根据Kabat或Chothia编号方案的以下残基的至少一个以上位置的两个以上经修饰的氨基酸的抗体:L22、L7和L152。
在某些实施方案中,本文提供包含在序列位置的两个以上位点特异性的经修饰的氨基酸的抗体,所述序列位置相当于选自根据Kabat或Chothia编号方案的以下重链或轻链残基的残基:H404、H121、H180、L22、L7、L152、H136、H25、H40、H119、H190、H222、H19、H52、H70、H110、或H221。
在某些实施方案中,本文提供包含在序列位置的两个以上位点特异性的经修饰的氨基酸的抗体,所述序列位置相当于选自根据SEQ ID NO:1的代表性重链的以下残基的残基:407、124、183、139、25、40、119、193、225、19、52、71、117或224。
在某些实施方案中,本文提供包含在序列位置的两个以上位点特异性的经修饰的氨基酸的抗体,所述序列位置相当于选自根据SEQ ID NO:2的代表性轻链的以下残基的残基:22、7或152。
所述抗体可以具有本领域技术人员所公认的任意抗体形式。所述抗体可以包含单一的多肽链—单一的重链或单一的轻链。所述抗体也可以形成本领域技术人员所公认的多聚体,所述多聚体包括同二聚体(homodimers)、异二聚体、同多聚体、和异多聚体。这些多聚体可以是连接的或未连接的。 有用的连接(linkage)包括通常用于多肽分子的链间二硫键。所述多聚体还可以通过其他氨基酸(包括本文描述的经修饰的氨基酸)进行连接。所述抗体可以是诸如任意种类或子类的免疫球蛋白,包括IgA、IgA1、IgA2、IgD、IgE、IgG、IgG1、IgG2、IgG3、IgG4和IgM。所述抗体可以是包括Fv、Fc、Fab、以及(Fab')2和scFv的任意抗体片段的形式。
亲本抗体可以对本领域技术人员已知的、或后来发现的任意抗原具有亲和性。几乎任何物质都可以是亲本抗体、或本描述的抗体的抗原,或本说明书的抗体。有用的抗原的实例包括但不限于,α-1抗胰蛋白酶、血管抑素、抗溶血因子、多肽、载脂蛋白、脱辅基蛋白、心房利钠因子、心房利钠多肽、心房肽、C-X-C趋化因子(例如,T39765、NAP-2、ENA-78、Gro-a、Gro-b、Gro-c、IP-10、GCP-2、NAP-4、SDF-1、PF4、MIG)、降钙素、CC趋化因子(例如、单核细胞趋化蛋白-1、单核细胞趋化蛋白2、单核细胞趋化蛋白-3、单核细胞炎性蛋白-1α、单核细胞炎性蛋白-1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262)、CD40配体、C-kit配体、胶原蛋白、集落刺激因子(CSF)、补体因子5a、补体抑制剂、补体受体1、细胞因子、(例如、上皮中性粒细胞活化肽-78、GRO/MGSA、GRO、GRO、MIP-1、MIP-1、MCP-1)、表皮生长因子(EGF)、促红细胞生成素(“EPO”)、去角质毒素A和B、因子IX、因子VII、因子VIII、因子X、成纤维细胞生长因子(FGF)、纤维蛋白原、纤连蛋白、G-CSF、GM-CSF、葡糖脑苷脂酶、促性腺激素、生长因子、刺猬蛋白(例如、Sonic、Indian、Deser)、血红蛋白、肝细胞生长因子(HGF)、水蛭素、人血清白蛋白、胰岛素、胰岛素样生长因子(IGF)、干扰素(例如、IFN-α、IFN-、IFN-γ)、白介素(例如、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8的、IL-9、IL-10、IL-11、IL-12等)、角质细胞生长因子(KGF)、乳铁蛋白、白血病抑制因子、荧光素酶、神经生长因子(neurturin)、中性粒细胞抑制因子(NIF)、制瘤素M、成骨蛋白、甲状旁腺激素、PD-ECSF、PDGF、肽激素(例如人生长激素)、多效生长因子(pleiotropin)、蛋白A、蛋白G、致热外毒素A、B和C、松弛素、肾素、SCF、可溶性补体受体I、可溶性I-CAM 1、可溶性白介素受体(IL-1、2、3、4、5、6、7、9、10、11、12、13、14、15)、可溶性TNF受体、生长调节素、生长抑素、生长激素、链激酶、超抗原、即、葡萄球菌肠毒素(SEA、SEB、SEC1、SEC2、SEC3、SED、SEE)、超氧化物歧化酶、中毒性休克综合征毒素(TSST-1)、胸腺素α1、组织型纤溶酶原激活物、肿瘤坏死因子(TNFβ)、肿瘤坏死因子受 体(TNFR)、肿瘤坏死因子α(TNFα)、血管内皮生长因子(VEGF)、尿激酶等。这些抗原可以通过本领域技术人员已知的方法,从例如商业来源或已公开的多肽或多核苷酸序列(例如Gen基因库)来获得。
附加的抗原包括但不限于,转录和表达激活物。示例性的转录和表达激活物包括调节细胞生长,分化,调控等的基因和蛋白质。表达和转录激活物存在于原核生物、病毒、和真核生物(包括真菌、植物和包括哺乳动物的动物),提供了广泛的治疗靶标。应该理解的是,表达和转录激活物通过以下的许多机制来调控转录:例如,通过结合到受体、刺激信号转导级联、调控转录因子的表达、结合到启动子和增强子、结合到结合于启动子和增强子的蛋白质、解旋DNA,剪接前体mRNA、聚腺苷酸化RNA和降解RNA。抗原包括但不限于,表达激活物,诸如细胞因子、炎症分子、生长因子、它们的受体、和致癌基因产物,例如,白介素(例如、IL-1、IL-2、IL-8等)、干扰素、FGF、IGF-I、IGF-II、FGF、PDGF、TNF、TGF-α、TGF-β、EGF、KGF、SCF/c-Kit、CD40L/CD40、VLA-4VCAM-1、ICAM-1/LFA-1、和透明质酸苷(hyalurin)/CD44;信号转导分子和相应的癌基因产物,例如,Mos、Ras、Raf和Met;以及转录激活物和抑制因子,例如,p53、Tat、Fos、Myc、Jun、Myb、Rel和类固醇激素受体如雌激素、孕酮、睾酮、醛固酮、LDL受体配体和皮质酮。
疫苗蛋白质可以是抗原,该抗原包括但不限于在来自感染性真菌,例如,曲霉、念珠菌属;细菌,特别是提供病原菌模型的大肠杆菌,和医学上重要的细菌如葡萄球菌属(例如,金黄色(葡萄球菌))或链球菌属(例如,肺炎链球菌);原生动物如孢子虫纲(例如疟原虫)、根足虫类(例如内变形虫属)和鞭毛虫类(锥虫属、利什曼虫属、毛滴虫属、贾第虫属等);病毒如(+)RNA病毒(例子包括痘病毒,如牛痘;小核糖核酸病毒,例如脊髓灰质炎病毒;披膜病毒,例如风疹病毒;黄病毒,例如HCV;和冠状病毒),(-)RNA病毒(例如,弹状病毒,例如VSV;副粘病毒,例如RSV;正粘病毒,例如流感病毒;布尼亚病毒(Bunyaviruses)和沙粒病毒),dsDNA病毒(例如呼肠弧病毒),RNA至DNA病毒,即逆转录病毒,如HIV和HTLV,以及某些DNA至RNA病毒,如乙肝病毒。
抗原可以是酶,包括但不限于,例如,酰胺酶、氨基酸消旋酶、酰化酶(acylases)、脱卤酶、加双氧酶、二芳基丙烷过氧化物酶、差向异构酶、环氧化物水解酶、酯酶、异构酶、激酶、葡萄糖异构酶、糖苷酶、糖基转移酶、卤代过氧化物酶、单加氧酶(如p450s)、脂肪酶、木质素过氧化物酶、 腈水合酶、腈水解酶、蛋白酶、磷酸酶、枯草杆菌蛋白酶、转氨酶和核酸酶。
农业相关蛋白,如昆虫抗性蛋白(例如,Cry蛋白)、淀粉和脂质生产酶、植物和昆虫毒素、毒素抗性蛋白、真菌毒素解毒蛋白、植物生长酶(例如,核酮糖1,5-二磷酸羧化酶/加氧酶,“RUBISCO”)、脂肪氧合酶(LOX)和磷酸烯醇丙酮酸(PEP)羧化酶,也可以是抗原。
例如,所述抗原可以是疾病相关的分子,如肿瘤表面抗原(如B细胞独特型、恶性B细胞上的CD20、白血病原始细胞上的CD33、和乳腺癌上的HER2/neu)。替代性地,所述抗原可以是生长因子受体。生长因子的实例包括但不限于,表皮生长因子(EGFs)、转铁蛋白、胰岛素样生长因子、转化生长因子(TGFs),白细胞介素-1,和白细胞介素-2。例如,在多种人类上皮原发性肿瘤已经发现EGF受体的高表达。已经发现TGF-α在癌细胞中介导自分泌刺激途径。已证明几种鼠单克隆抗体能够结合EGF受体,阻断配体结合到EGF受体,以及抑制培养中的和异种移植模型中的多种人类癌细胞系的增殖。Mendelsohn和Baselga(1995)Antibodies to growth factors and receptors,in Biologic Therapy of Cancer,第2版,J B Lippincott,Philadelphia,第607-623页。因此,抗体可以用来治疗多种癌症。
所述抗原还可以是与以下疾病有关的细胞表面蛋白或受体:冠状动脉疾病(诸如血小板糖蛋白IIb/IIIa受体)、自身免疫性疾病(如CD4、CAMPATH-1和革兰氏阴性细菌脂多糖的脂质A区)。针对CD4的人源化抗体已经在治疗患有蕈样肉芽肿、泛发性脓疱性银屑病(generalized postular psoriasis)、重度银屑病和类风湿性关节炎的患者的临床试验中进行了测试。针对抗脂质革兰氏阴性细菌脂多糖的脂质A区的抗体已经在脓毒症休克的治疗中进行了临床测试。针对CAMPATH-1的抗体也已经在针对难治性类风湿性关节炎的治疗中进行了临床测试。因此,本文所提供的抗体可以用来治疗各种自身免疫疾病。
有用的抗原还包括与人类过敏性疾病,如炎性介体的蛋白质,例如,相关联的蛋白或肽白细胞介素-1(IL-1),肿瘤坏死因子(TNF),白三烯受体和5-脂氧合酶,和粘附分子如V-CAM/VLA-4。有用的抗原也可以包括与人类过敏疾病相关的蛋白或肽,例如炎性介导蛋白,例如白细胞介素-1(IL-1)、肿瘤坏死因子(TNF)、白三烯受体及5-脂氧合酶,和粘附分子,例如V-CAM/VLA-4。此外,因为IgE在诸如哮喘等的I型立即过敏过敏反应(immediate hypersensitive allergic reactions)中起至关重要的作用,所以 IgE也可以充当抗原。研究表明,总血清IgE的水平趋向于与疾病(尤其是在哮喘中)的严重程度相关。Burrows等人(1989)“Association of asthma with serum IgE levels and skin-test reactivity to allergens”New Engl.L.Med.320:271-277。因此,在治疗过敏疾病中针对IgE所选择的抗体可以用于降低IgE水平或阻断IgE与肥大细胞和嗜碱细胞的结合,而不实质地影响正常免疫功能。
所述抗原也可以是可以充当引发宿主免疫应答的抗原的病毒表面或核心蛋白。这些病毒蛋白的实例包括但不限于糖蛋白(或表面抗原,例如GP120和GP41)和衣壳蛋白(或结构蛋白,例如P24蛋白);表面抗原或甲、乙、丙、丁或戊型肝炎病毒的核心蛋白(例如乙型肝炎病毒的小乙型肝炎表面抗原(small hepatitis B surface antigen,SHBsAg)和丙型肝炎病毒的核心蛋白,NS3、NS4和NS5抗原);呼吸道合胞病毒(respiratory syncytial virus,RSV)的糖蛋白(G-蛋白)或融合蛋白(F-蛋白);单纯疱疹病毒HSV-l和HSV-2的表面和核心蛋白(例如来自HSV-2的糖蛋白D)。
所述抗原也可以是丧失其肿瘤抑制功能且可以使细胞更易患癌症的突变肿瘤抑制基因产物。肿瘤抑制基因是有抑制细胞生长和分裂周期并因此阻止新生瘤发育作用的基因。肿瘤抑制基因中的突变引起细胞忽视抑制信号网络中的一种以上组分,从而克服细胞周期检查点并导致较高的受控细胞生长速率—癌症。肿瘤抑制基因的实例包括但不限于DPC-4、NF-l、NF-2、RB、p53、WTl、BRCAl和BRCA2。DPC-4涉及胰腺癌并且参与抑制细胞分裂的细胞质途径。NF-l编码抑制Ras的蛋白(其是细胞质抑制蛋白)。NF-l涉及到神经系统和髓系白血病的神经纤维瘤和嗜铬细胞瘤。NF-2编码涉及到神经系统的脑膜瘤、神经鞘瘤(schwanoma)和室管膜瘤(ependymoma)的核蛋白。RB编码pRB蛋白,pRB蛋白是细胞周期的主要抑制剂的核蛋白。RB涉及到视网膜母细胞瘤以及骨癌、膀脱癌、小细胞肺癌和乳腺癌。p53编码调控细胞分裂且可以诱导细胞凋亡的p53蛋白。在许多癌症中发现p53的突变和/或不活动。WTl涉及肾脏的肾母细胞瘤(Wilms tumor)。BRCA1涉及到乳腺癌和卵巢癌,而BRCA2涉及到乳腺癌。因此,抗体可以用于阻断基因产物与肿瘤发生和发展途径中其它蛋白和生物化学物质的相互作用。
所述抗原可以是CD分子,所述CD分子包括但不限于,CD1a、CD1b、CD1c、CD1d、CD2、CD3γ、CD3δ、CD3ε、CD4、CD5、CD6、CD7、CD8α、CD8β、CD9、CD10、CD11a、CD11b、CD11c、CDw12、CD13、CD14、 CD15、CD15s、CD16a、CD16b、CD18、CD19、CD20、CD21、CD22、CD23、CD24、CD25、CD26、CD27、CD28、CD29、CD30、CD31、CD32、CD33、CD34、CD35、CD36、CD37、CD38、CD39、CD40、CD41、CD42a、CD42b、CD42c、CD42d、CD43、CD44、CD45、CD45R、CD46、CD47、CD48、CD49a、CD49b、CD49c、CD49d、CD49e、CD49f、CD50、CD51、CD52、CD53、CD54、CD55、CD56、CD57、CD58、CD59、CDw60、CD61、CD62E、CD62L、CD62P、CD63、CD64、CD65、CD66a、CD66b、CD66c、CD66d、CD66e、CD66f、CD67、CD68、CD69、CDw70、CD71、CD72、CD73、CD74、CDw75、CDw76、CD77、CD79α、CD79β、CD80、CD81、CD82、CD83、CD84、CD85、CD86、CD87、CD88、CD89、CD90、CD91、CDw92、CD93、CD94、CD95、CD96、CD97、CD98、CD99、CD100、CD101、CD102、CD103、CD104、CD105、CD106、CD107a、CD107b、CDw108、CDw109、CD110-113、CD114、CD115、CD116、CD117、CD118、CD119、CD120a、CD120b、CD121a、CD121b、CD122、CD123、CDw124、CD125、CD126、CDw127、CDw128a、CDw128b、CD129、CDw130、CD131、CD132、CD133、CD134、CD135、CD136、CDw137、CD138、CD139、CD140a、CD140b、CD141、CD142、CD143、CD144、CDw145、CD146、CD147、CD148、CDw149、CD150、CD151、CD152、CD153、CD154、CD155、CD156、CD157、CD158a、CD158b、CD161、CD162、CD163、CD164、CD165、CD166、和TCRζ。所述抗原可以是VEGF、VEGF受体、EGFR、Her2、TNFa、TNFRI受体、GPIIb/IIIa、IL-2Rα链、IL-2Rβ链、RSV F蛋白、α4整合素、IgE、IgE受体、地高辛(digoxin)、锯鳞蝰蛇毒(carpet viper venom)、补体C5、OPGL、CA-125肿瘤抗原、葡萄球菌蛋白、表皮葡萄球菌(Staphylococcus epidermidis)蛋白、金黄色葡萄球菌蛋白、葡萄球菌感染相关蛋白(包括但不限于金黄色葡萄球菌和表皮葡萄球菌)、IL-6受体、CTLA-4、RSV、IL-2受体的Tac亚单位、IL-5和EpCam。所述抗原可以是分子片段。
有用的双特异性亲本抗体的实例包括但不限于,具有针对肿瘤细胞抗原的一种抗体和针对细胞毒触发分子的另一种抗体的那些双特异性亲本抗体,诸如抗FcγRI/抗CD15、抗p185HER2/FcγRIII(CD16)、抗CD3/抗恶性B细胞(1D10)、抗CD3/抗p185HER2,抗CD3/抗P97,抗CD3/抗肾细胞癌,抗FcγRI/抗CD15、抗p185HER2/FcγRIII(CD16)、抗CD3/抗恶性B细胞(1D10)、抗CD3/抗p185HER2、抗CD3/抗P97、抗CD3/抗肾细胞癌、抗 CD3/抗OVCAR-3、抗CD3/L-D1(抗结肠癌)、抗CD3/抗黑色素细胞刺激激素类似物、抗EGF受体/抗CD3、抗CD3/抗CAMA1、抗CD3/抗CD19、抗CD3/MoV18、抗神经细胞粘附分子(NCAM)/抗CD3、抗叶酸结合蛋白(FBP)/抗CD3、防泛癌相关抗原(AMOC-31)/抗CD3;具有特异性与肿瘤抗原结合的一种抗体和与毒素结合的另一种抗体的双特异性抗体,诸如抗皂草素/抗Id-1、抗CD22/抗皂草素、抗CD7/抗皂草素、抗CD38/抗皂草素、抗CEA/抗蓖麻毒蛋白A链、抗干扰素α(IFN-α)/抗杂交瘤独特型、抗CEA/抗长春花生物碱;用于转化酶激活前药的双特异性抗体,诸如抗CD30/抗碱性磷酸酶(其将磷酸丝裂霉素(mitomycin phosphate)前药催化转化成丝裂霉素醇);可被用作纤维蛋白溶解剂的双特异性抗体,诸如抗血纤维蛋白/抗组织纤溶酶原激活剂(tPA)、抗血纤维蛋白/抗尿激酶型纤溶酶原激活剂(uPA);用于靶向细胞表面受体的免疫复合物双特异性抗体,如抗低密度脂蛋白(LDL)/抗Fc受体(例如FcγRI、FcγRII或FcγRIII);用于治疗感染性疾病的双特异性抗体,如抗CD3/抗单纯疱疹病毒(HSV)、抗T细胞受体:CD3复合物/抗流感、抗FcγR/抗HIV;用于体外或活体内的肿瘤检测的双特异性抗体,如抗CEA/抗EOTUBE、抗CEA/抗DPTA,抗抗p185HER2/抗半抗;作为疫苗佐剂的双特异性抗体(参见Fanger,M W等,Crit Rev Immunol.1992;12(34):101-24,通过引用将其并入本文);和作为诊断工具的双特异性抗体,诸如抗兔IgG/抗铁蛋白、抗辣根过氧化物酶(HRP)/抗激素、抗促生长素抑制素/抗物质P、抗HRP/抗FITC、抗CEA/抗β半乳糖苷酶(参见Nolan,O et R.O'Kennedy,Biochim Biophys Acta.1990Aug.1;1040(1):1-11,通过引用将其并入本文)。三特异性抗体的实例包括抗CD3/抗CD4/抗CD37、抗CD3/抗CD5/抗CD37和抗CD3/抗CD8/抗CD37。
连接基团和有效载荷
在某些实施方案中,所述多肽包含如本文所描述的具有反应基团的经修饰的氨基酸。本领域技术人员可以使用所述反应基团来直接地或间接地经由连接基团将多肽连接到能够与所述经修饰的氨基酸形成共价键的任意分子实体。因此,本文提供包含多肽的偶联物,所述多肽包含对应于式I、Ia、II、1-30或40的化合物的氨基酸残基且连接于有效载荷,且任选地,所述偶联物包含在所述多肽和所述有效载荷之间的连接部分。
有用的连接基团包括本文所描述的那些。在某些实施方案中,所述连 接基团是本领域技术人员已知的任意二价或多价连接基团。一般而言,所述连接基团能够与所述经修饰的氨基酸的官能部分和α碳形成共价键。有用的二价连接基团包括键、亚烷基、取代的亚烷基、亚杂烷基、取代的亚杂烷基、亚芳基、取代的亚芳基、亚杂芳基和取代的亚杂芳基。在某些实施方案中,所述连接基团是C1-10亚烷基或C1-10亚杂烷基。
所述分子有效载荷可以是本领域技术人员期望偶联到多肽的任意分子实体。在某些实施方案中,所述有效载荷是治疗性部分。在这样的实施方案中,所述多肽偶联物可以用于将所述治疗性部分靶向它的分子靶标。在某些实施方案中,所述有效载荷是标记部分。在这样的实施方案中,所述多肽偶联物可以用于检测所述多肽与它的靶标的结合。在某些实施方案中,所述有效载荷是细胞毒部分。在这样的实施方案中,所述偶联物可以用于将所述细胞毒部分靶向病变细胞,例如癌细胞,以引发对该细胞进行破坏或消除。包含对本领域技术人员而言是显而易见的的其他分子有效载荷的偶联物在本文所描述的偶联物的范围内。
在某些实施方案中,偶联物可以具有选自由以下所构成的组的有效载荷:标记物、染料、聚合物、水溶性聚合物、聚乙二醇、聚乙二醇衍生物、光交联剂、细胞毒化合物、放射性核素、药物、亲和标记物、光亲和标记物、反应化合物、树脂、第二蛋白或多肽或多肽类似物、抗体或抗体片段、金属螯合剂、辅因子、脂肪酸、碳水化合物、多核苷酸、DNA、RNA、反义多核苷酸、肽、水溶性树枝形聚合物、环糊精、抑制性核醣核酸、生物材料、纳米粒子、自旋标记物、荧光团、含金属的部分、放射性部分、新官能团、与其他分子共价或非共价地相互作用的基团、光笼蔽部分、可光异构的部分、生物素、生物素衍生物、生物素类似物、并入重原子的部分、可化学切割的基团、可光切割的基团、延长的侧链、碳连接的糖、氧化还原活性剂、氨基硫代酸、有毒部分、同位素标记的部分、生物物理探针、磷光基团、化学发光基团、电子致密基团、磁性基团、嵌入基团、发色团、能量转移剂、生物活性剂、可检测的标记物、小分子、或其任意组合。在实施方案中,所述有效载荷是标记物、染料、聚合物、细胞毒化合物、放射性核素、药物、亲和标记物、树脂、蛋白质、多肽、多肽类似物、抗体、抗体片段、金属螯合剂、辅因子、脂肪酸、碳水化合物、多核苷酸、DNA、RNA、肽、荧光团或碳连接的糖。在另一实施方案中,所述有效载荷是标记物、染料、聚合物、药物、抗体、抗体片段、DNA、RNA或肽。
有用的药物有效载荷包括任意细胞毒剂、抑制细胞生长剂或免疫调节 剂。有用的细胞毒或免疫调节剂种类包括例如抗微管蛋白剂、阿里他汀(auristatin)、DNA小沟结合剂、DNA复制抑制剂、烷化剂(例如,诸如顺铂、单(铂)、双(铂)和三核铂配合物和卡铂等铂配合物)、蒽环类、抗生素、叶酸拮抗剂、抗代谢物、钙调蛋白抑制剂、化疗增敏剂、倍癌霉素(duocarmycins)、依托泊苷、氟化的嘧啶、离子载体、莱希特平(lexitropsins)、类美坦素(maytansinoids)、亚硝基脲、氨氯铂、成孔化合物、嘌呤抗代谢物、嘌呤霉素、放疗增敏剂、雷帕霉素、类固醇、拓朴异构酶抑制剂、长春花生物碱等。
单个的细胞毒或免疫调节剂包括例如雄性激素、安曲霉素(AMC)、天冬酰胺酶、5-氮胞苷、硫唑嘌呤、博莱霉素、白消安、丁硫氨酸亚砜亚胺、卡里奇霉素(calicheamicin)、卡里奇霉素衍生物、喜树碱、卡铂、卡莫司汀(BSNU)、CC-1065、苯丁酸氮芥、顺铂、秋水仙碱、环磷酰胺、阿糖胞苷、胞苷阿拉伯糖苷(cytidine arabinoside)、细胞松弛素B、达卡巴嗪、放线菌素D(原名放线菌素)、柔红霉素、氨烯咪胺(decarbazine)、DM1、DM4、多西紫杉醇、阿霉素、依托泊苷、雌性激素、5-氟脱氧尿苷、5-氟尿嘧啶、吉西他滨、短杆菌肽D、羟基脲、伊达比星、异环磷酰胺、伊立替康、洛莫司汀(CCNU)、美登素、氮芥、米尔法兰、6-巯基嘌呤、甲氨蝶呤、光辉霉素、丝裂霉素C、米托蒽醌、硝基咪唑、紫杉醇、岩沙海葵毒素、普卡霉素、甲基苄肼(procarbizine)、利索新(rhizoxin)、链脲佐菌素、替尼泊苷(tenoposide)、6-硫代鸟嘌呤、噻替哌、拓扑替康、长春碱、长春新碱、长春瑞滨、VP-16和VM-26。
在一些实施方案中,合适的细胞毒剂包括例如DNA小沟结合剂(例如烯二炔类和莱希特平,CBI化合物;还参见专利号为6,130,237的美国专利)、倍癌霉素、紫杉烷(例如紫杉醇和多西紫杉醇)、嘌呤霉素、长春花生物碱、CC-1065、SN-38、拓扑替康、吗啉代阿霉素、利索新、氰基吗啉代阿霉素、棘霉素、康普瑞汀、纺锤菌素、埃博霉素A和B、雌莫司汀、念珠藻素(cryptophycins)、西马多丁(cemadotin)、类美坦素、圆皮海绵内酯、艾榴塞洛素(Eleutherobin)、和米托蒽醌。
在一些实施方案中,所述有效载荷是抗微管蛋白剂。抗微管蛋白剂的实例包括但不限于紫杉烷(例如(紫杉醇)、(多西紫杉醇))、T67(Tularik)、和长春花生物碱(vinca alkyloids)(例如,长春新碱、长春碱、长春地辛、和长春瑞滨)。其他的抗微管蛋白剂包括例如巴卡丁衍生物、紫杉烷类似物、埃博霉素(例如埃博霉素A和B)、诺考达唑、秋水 仙碱和colcimid、雌莫司汀、念珠藻素、西马多丁、类美坦素、康普瑞汀、圆皮海绵内酯和艾榴塞洛素。
在某些实施方案中,所述细胞毒剂是类美坦素、另一抗微管蛋白剂组。例如,在特定的实施方案中,所述类美坦素可以是美登素或DM-1(ImmunoGen公司;还参见Chari等,1992,Cancer Res.52:127-131)。
在一些实施方案中,所述有效载荷是阿里他汀,诸如阿里他汀E或其衍生物。例如,阿里他汀E衍生物可以是阿里他汀E和酮酸之间形成的酯。例如,阿里他汀E可以与对乙酰基苯甲酸或苯甲酰基戊酸反应以分别生成AEB和AEVB。其他典型的阿里他汀衍生物包括AFP、MMAF和MMAE。阿里他汀衍生物的合成和结构在以下文献中有描述:公开号为2003-0083263、2005-0238649和2005-0009751的美国专利申请;公开号为WO 04/010957的国际专利、公开号为WO 02/088172的国际专利、以及专利号为以下的美国专利:6,323,315;6,239,104;6,034,065;5,780,588;5,665,860;5,663,149;5,635,483;5,599,902;5,554,725;5,530,097;5,521,284;5,504,191;5,410,024;5,138,036;5,076,973;4,986,988;4,978,744;4,879,278;4,816,444;和4,486,414。
在一些实施方案中,所述有效载荷不是放射性同位素。在一些实施方案中,所述有效载荷不是放射性的。
在一些实施方案中,所述有效载荷是抗代谢物。所述抗代谢物可以是例如嘌呤拮抗剂(例如硫唑嘌呤或霉酚酸酯)、二氢叶酸还原酶抑制剂(例如甲氨蝶呤)、阿昔洛韦、更昔洛韦(gangcyclovir)、齐多夫定、阿糖腺苷、利巴伟林(ribavarin)、叠氮胸苷、胞苷阿拉伯糖苷、金刚烷胺、二脱氧尿苷、碘脱氧尿苷、膦甲酸(poscarnet)、三氟尿苷。
在其他实施方案中,所述有效载荷是他克莫司、环孢菌素、FU506或雷帕霉素。在进一步的实施方案中,所述药物是阿地白介素、阿仑单抗、阿利维A酸(alitretinoin)、别嘌呤醇、六甲蜜胺、氨磷汀、阿那曲唑、三氧化二砷、蓓萨罗丁、蓓萨罗丁、卡鲁睾酮(calusterone)、卡培他滨、塞来昔布、克拉屈滨、阿法达贝泊汀、地尼白介素(Denileukin diftitox)、右丙亚胺、屈他雄酮丙酸酯、表阿霉素、阿法依伯汀、雌莫司汀、依西美坦、非格司亭、氟尿苷、氟达拉滨、氟维司群、吉西他滨、吉妥珠单抗奥唑米星(gemtuzumab ozogamicin)(MYLOTARG)、戈舍瑞林、伊达比星、异环磷酰胺、甲磺酸伊马替尼、干扰素α-2a中、伊立替康、来曲唑、亚叶酸、左旋咪唑、双氯乙基甲胺(meclorethamine)或氮芥、甲地孕酮、美司钠、 甲氨蝶呤、甲氧沙林、丝裂霉素C、米托坦、苯丙酸诺龙、奥普瑞白介素、奥沙利铂、帕米膦酸盐(pamidronate)、培加酶(pegademase)、培门冬酶(pegaspargase)、培非格司亭(pegfilgrastim)、喷司他丁、哌泊溴烷、普卡霉素、卟菲尔钠、甲基苄肼、阿的平、拉布立酶、利妥昔单抗、沙格司亭、链脲霉素、他莫昔芬、替莫唑胺、替尼泊苷、睾内酯、硫鸟嘌呤、托瑞米芬、托西莫单抗、曲妥珠单抗(赫赛汀)、维甲酸、尿嘧啶氮芥、戊柔比星、长春碱、长春新碱、长春瑞滨或唑来膦酸盐。
在一些实施方案中,所述有效载荷是是免疫调节剂。所述免疫调节剂可以是例如更昔洛韦、依那西普、他克莫司、环孢菌素、雷帕霉素、环磷酰胺、硫唑嘌呤、霉酚酸酯或甲氨蝶呤。替代性地,所述免疫调节剂可以是,例如,糖皮质激素(如皮质醇或醛固酮)或糖皮质激素类似物(例如,泼尼松或地塞米松)。
在一些实施方案中,所述免疫调节剂是抗炎剂,诸如芳基羧基衍生物,含吡唑衍生物,昔康类衍生物和烟酸衍生物。抗炎剂的种类包括例如环氧合酶抑制剂、5-脂氧合酶抑制剂、白三烯受体拮抗剂。
合适的环氧合酶抑制剂包括甲氯芬那酸、甲芬那酸、卡洛芬、双氯芬酸、二氟尼柳、芬布芬(fenbufen)、非诺洛芬、吲哚美辛、酮洛芬、萘丁美酮、舒林酸、替诺昔康和托美丁。
合适的脂氧合酶抑制剂包括氧化还原抑制剂(例如,儿茶酚丁烷衍生物、去甲二氢愈创木酸(NDGA)、马索罗酚(masoprocol)、菲尼酮、Ianopalen、吲唑啉酮(indazolinones)、naphazatrom、苯并呋喃、烷基羟胺)和非氧化还原抑制剂(例如,羟基噻唑、甲氧基烷基噻唑、苯并吡喃及其衍生物、甲氧基四氢吡喃、乳香酸和乳香酸的乙酰化了的衍生物,和用环烷基取代的喹啉甲氧基苯乙酸),以及氧化还原抑制剂的前体。
其它合适的脂氧合酶抑制剂包括抗氧化剂(例如,酚类、没食子酸丙酯、黄酮类和/或天然存在的底物,所述天然存在的底物含有黄酮类,黄酮类的羟基化的衍生物、黄酮醇、二氢槲皮素、木犀草素、高良姜素、奥洛波尔(orobol)、查耳酮的衍生物、4,2',4'-三羟基查耳酮、邻氨基苯酚、N-羟基脲、苯并呋喃、依布硒和增加还原含硒酶的活性的物种)、铁螯合剂(例如,异羟肟酸及其衍生物、N-羟基脲、2-苄基-1-萘酚、儿茶酚、羟胺、鼠尾草酚trolox C、儿茶酚、萘酚、柳氮磺胺吡啶、zyleuton、5-羟基邻氨基苯甲酸和4-(ω-芳烷基)苯基烷酸)、含咪唑化合物(例如,酮康唑和伊曲康唑)、吩噻嗪、和苯并吡喃衍生物。
还有其他的合适的脂氧合酶抑制剂包括类花生酸抑制剂(例如,十八碳四烯酸、二十碳四烯酸、二十二碳五烯酸、二十碳六烯酸和二十二碳六羧酸及其酯、PGE1(前列腺素E1)、PGA2(前列腺素A2)、维前列醇(viprostol)、15-单羟基二十碳四烯酸、15-单羟基-二十碳三烯酸、和15-单羟基-二十碳五烯酸、和白三烯B5、C5和D5)、干扰钙流的化合物、吩噻嗪、二苯基丁胺、维拉帕米、fuscoside、姜黄素、绿原酸、咖啡酸干扰,5,8,11,14-eicosatetrayenoic酸(ETYA)、羟基苯基维甲酰胺(hydroxyphenylretinamide)、Ionapalen、七叶苷、乙胺嗪、菲咯啉(phenantroline)、黄芩素、普昔罗米、硫醚、二烯丙基硫醚和二-(1-丙烯基)硫醚。
白三烯受体拮抗剂包括骨化三醇、昂唑司特(ontazolast)、Bayer Bay-x-1005、Ciba-Geigy CGS-25019C、依布硒、Leo Denmark ETH-615、Lilly LY-293111、Ono ONO-4057、Terumo TMK-688、Boehringer Ingleheim BI-RM-270、Lilly LY213024、Lilly LY264086、Lilly LY292728、Ono ONO LB457、Pfizer 105696、Perdue Frederick PF10042、Rhone-Poulenc Rorer RP66153、SmithKline Beecham SB-201146、SmithKline Beecham SB-201993、SmithKline Beecham SB-209247、Searle SC-53228、Sumitamo SM15178、American Home Products WAY 121006、Bayer Bay-o-8276、Warner-Lambert CI-987、Warner-Lambert CI-987BPC-15LY 223982、Lilly LY 233569、Lilly LY-255283、MacroNex MNX-160、Merck and Co.MK-591、Merck and Co.MK-886、Ono ONO-LB-448、Purdue Frederick PF-5901、Rhone-Poulenc Rorer RG14893、Rhone-Poulenc Rorer RP 66364、Rhone-Poulenc Rorer RP 69698、Shionoogi S-2474、Searle SC-41930、Searle SC-50505、Searle SC-51146、Searle SC-52798、SmithKline Beecham SK&F-104493、Leo Denmark SR-2566、Tanabe T-757和Teijin TEI-1338。
其他有用的药物有效载荷包括可用于癌症的治疗的化学化合物。化学治疗剂的实例包括厄洛替尼(基因泰克/OSI制药公司)、硼替佐米(Millennium Pharm)、氟维司群(阿斯利康)、舒尼替尼(SU11248,辉瑞)、来曲唑(诺华)、甲磺酸伊马替尼(诺华)、PTK787/ZK222584(诺华)、奥沙利铂(赛诺菲)、5-FU(5-氟尿嘧啶)、醛氢叶酸(Leucovorin)、雷帕霉素(西罗莫司,惠氏)、拉帕替尼(GSK572016,葛兰素史克)、洛那法尼(Lonafarnib)(SCH66336)、索拉非尼(BAY43-9006, 拜耳实验室)、和吉非替尼(阿斯利康)、AG1478、AG1571(SU5271;SUGEN)、诸如塞替派和环磷酰胺等烷基化剂;诸如白消安、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan)等烷基磺酸盐;氮丙啶,如苯并多巴(benzodopa)、卡波醌(carboquone)、美妥替哌(meturedopa)和乌瑞替派;乙撑亚胺类和甲基蜜胺类(methylamelamines),包括六甲蜜胺(altretamine)、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;乙酰类(acetogenins)(尤其是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括合成的类似物拓扑替康);苔藓抑素;海绵多烯酮类物(callystatin);CC-1065(包括它的阿多来新、卡折来新和比折来新合成的类似物);念珠藻素(cryptophycin)(尤其是念珠藻素1和念珠藻素8);海兔毒素;倍癌霉素(duocarmycin)(包括合成性类似物KW-2189和CB1-TM1);艾榴塞洛素(eleutherobin);水鬼蕉碱;匍枝珊瑚醇(sarcodictyin);海绵素(spongistatin);氮芥类如苯丁酸氮芥、萘氮芥(chlomaphazine)、胆磷酰胺(cholophosphamide)、雌莫司汀、异环磷酰胺、双氯乙基甲胺、盐酸氧氮芥(mechlorethamine oxide hydrochloride)、美法仓、新氮芥、苯芥胆甾醇、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲类如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀、和雷莫司汀;抗生素如烯二炔类抗生素(例如,卡奇霉素(calicheamicin),尤其刺孢霉素λll和刺孢霉素ωll(Angew Chem.Intl.Ed.Engl.(1994)33:183-186);达内霉素,包括达内霉素A;二膦酸盐类如氯膦酸盐;埃斯培拉霉素(esperamicin);以及新制癌菌素发色团和相关的色蛋白烯二炔抗生素发色团、阿克拉霉素、放线菌素、安曲霉素(anthramycin)、偶氮丝氨酸、博来霉素、放线菌素C、卡柔比星(carabicin)、去甲柔红霉素(caminomycin)、嗜癌霉素、色霉素(chromomycinis)、放线菌素D、柔红霉素(daunorubicin)、地托比星、6-重氮基-5-氧代-L-正亮氨酸、(阿霉素)、吗啉代-阿霉素、氰基吗啉代-阿霉素、2-吡咯啉代-阿霉素和去氧阿霉素、表柔比星、依索比星、伊达比星、麻西罗霉素(marcellomycin)、丝裂霉素类如丝裂霉素C、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、泊非霉素、嘌呤霉素、三铁阿霉素、罗多比星、链黑霉素、链佐星、杀结核菌素、乌苯美司、净司他丁(zinostatin)、佐柔比星;抗代谢物如甲氨蝶呤和5-氟尿嘧啶(5-FU);叶酸类似物如二甲叶酸、甲氨蝶呤、蝶罗呤、曲美沙特;嘌呤类似物如氟达拉滨、6-巯基嘌呤、硫咪嘌呤(thiamniprine)、硫鸟嘌呤;嘧啶类似物如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、二脱氧尿苷、去氧氟尿 苷、依诺他滨、氟尿苷;雄激素类如卡普睾酮(calusterone)、屈他雄酮丙酸酯、环硫雄醇、美雄烷、睾内酯;抗肾上腺类如氨鲁米特、米托坦、曲洛司坦;叶酸补充物如亚叶酸(frolinic acid);醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;嗯尿嘧啶;安吖啶;bestrabucil;比生群;依达曲沙;地磷酰胺(defofamine);秋水仙胺;地吖醌(diaziquone);依氟鸟氨酸(delformithine);依利醋铵(elliptinium acetate);埃博霉素;依托格鲁;硝酸镓;羟脲;香菇多糖;氯尼达明(lonidainine);类美坦素(maytansinoid)类如美登素和安丝菌素(ansamitocin);米托胍腙;米托蒽醌;莫哌达醇(mopidanmol);尼曲吖啶(nitraerine);喷司他丁;苯来美特(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基酰肼(2-ethylhydrazide);丙卡巴肼;多糖复合物(JHS Natural Products,Eugene,Oreg.);丙亚胺(razoxane);利索新;西佐喃(sizofuran);锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2”-三氯三乙胺;单端孢霉烯族毒素(trichothecenes)(尤其是T-2毒素、疣孢菌素A(verracurin A)、杆孢菌素A(roridin A)和蛇形菌素(anguidine));乌拉坦;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;gacytosine;阿拉伯糖苷(“Ara-C”);环磷酰胺;塞替派;紫杉烷类,例如,paclitaxel;Bristol-Myers Squibb Oncology,Princeton,N.J.)、(无乳浮(Cremophor))、紫杉醇的白蛋白工程化纳米粒子制剂((American Pharmaceutical Partners,Schaumberg,Ill.)和(多西他赛(doxetaxel);Rhone-Poulenc Rorer,Antony,France);苯丁酸氮芥(chloranmbucil);(吉西他滨);6-硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂类似物如顺铂和卡铂;长春碱;依托泊苷(VP-16);异环磷酰胺;米托蒽醌;长春新碱;(长春瑞滨);诺安托(novantrone);替尼泊苷;依达曲沙;道诺霉素;氨基蝶呤;卡培他滨伊班膦酸盐;CPT-11;拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类维生素A(retinoids)如维甲酸;以及以上任意药物的药学上可接受的盐、酸或衍生物。
其他有用的有效载荷包括:(i)起到调节或抑制针对肿瘤的激素作用的抗激素剂,如抗雌激素剂和选择性雌激素受体调节剂(SERMs),包括例如他莫昔芬(包括枸橼酸他莫昔芬)、雷洛昔芬、屈洛昔芬、4-羟他莫昔芬、曲沃昔芬、雷洛昔芬(keoxifene)、LY117018、奥那司酮和 (枸橼酸托瑞米芬(toremifine citrate));(ii)抑制酶芳香酶的芳香酶抑制剂,所述芳香酶调节肾上腺中的雌激素产生,诸如,例如4(5)-咪唑类、氨鲁米特、醋酸甲地孕酮、(依西美坦,辉瑞)、福美司坦(formestanie)、法倔唑(fadrozole)、伏氯唑(vorozole)、(来曲唑,诺华)和(阿那曲唑;阿斯利康);(iii)抗雄激素剂如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林(leuprolide)和戈舍瑞林;以及曲沙他滨(troxacitabine)(1,3-二氧戊环核苷胞嘧啶类似物);(iv)蛋白激酶抑制剂;(v)脂质激酶抑制剂;(vi)反义寡核苷酸,尤其抑制了涉及异常细胞增殖的信号通路中的基因(例如PKC-α、Ralf、H-Ras)的表达的那些反义寡核苷酸;(vii)核酶,如VEGF表达抑制剂(例如, )和HER2表达抑制剂;(viii)疫苗,如基因治疗疫苗,例如,和拓扑异构酶1抑制剂如和(ix)抗血管生成剂,如贝伐单抗(Genentech),和(x)上述药物中任意者的药学上可接受的盐、酸或衍生物。其他抗血管生成剂包括MMP-2(基质金属蛋白酶2)抑制剂、MMP-9(基质-金属蛋白酶9)抑制剂、COX-II(环氧合酶II)抑制剂、及VEGF受体酪氨酸激酶抑制剂。这样的有用的、可与本发明的化合物/组合物联合使用的基质金属蛋白酶抑制剂的实例在以下文献中有描述:WO 96/33172、WO 96/27583、EP 818442、EP 1004578、WO 98/07697、WO 98/03516、WO 98/34918、WO 98/34915、WO 98/33768、WO 98/30566、EP 606,046、EP 931,788、WO 90/05719、WO 99/52910、WO 99/52889、WO 99/29667、WO 99/07675、EP 945864、U.S.Pat.No.5,863,949、U.S.Pat.No.5,861,510、和EP 780,386,将它们全部通过引用以其整体并入到本文中。VEGF受体酪氨酸激酶抑制剂的实例包括4-(4-溴-2-氟苯胺基)-6-甲氧基-7-(1-甲基哌啶-4-基甲氧基)喹唑啉(ZD6474;WO01/32651中的实施例2)、4-(4-氟-2-甲基吲哚-5-基氧基)-6-甲氧基-7-(3-吡咯烷-1-基丙氧基)-喹唑啉(AZD2171;WO00/47212中的实施例240)、瓦他拉尼(PTK787;WO 98/35985)和SU11248(舒尼替尼;WO01/60814),和诸如在PCT公开号为以下的专利申请中所公开的化合物:WO97/22596、WO 97/30035、WO 97/32856和WO 98/13354。
在某些实施方案中,所述有效载荷是抗体或抗体片段。在某些实施方案中,所述有效载荷抗体或抗体片段可以通过由本领域技术人员所公认的任意免疫球蛋白基因进行编码。所述免疫球蛋白基因包括,但不限于,κ、 λ、α、γ(IgG1、IgG2、IgG3和IgG4)、δ、ε和μ恒定区基因,以及免疫球蛋白可变区基因。该术语包括本领域技术人员所公认的全长抗体和抗体片段、以及它们的变体。示例性的片段包括但不限于的Fv、Fc的、Fab和(Fab')2、单链Fv(scFv)、双体、三体、四体、双功能杂交多肽、CDR1、CDR2、CDR3、CDR's的组合、可变区、构架区、恒定区、和类似物。
在某些实施方案中,有效载荷是一种以上水溶性聚合物。多种大分子聚合物和其它分子可以连接到本文描述的多肽,以调节多肽的生物学特性,和/或向多肽提供新的生物学特性。这些大分子聚合物可经由天然编码的氨基酸、经由非天然编码的氨基酸、或天然或经修饰的氨基酸的任意官能取代基、或附加到天然或经修饰的氨基酸的任意取代基或官能团,而连接到多肽。聚合物的分子量可以是宽范围的,包括但不限于,在约100Da和100,000Da之间,或更大。
所选的聚合物可以是水溶性的,以使其所附接的蛋白质在水性环境(诸生理环境)中不沉淀。该聚合物可以是支化的或非支化的。优选地,用于治疗用途的最终产品的制备,该聚合物将是药学上可接受的。
在某些实施方案中,聚乙二醇分子与多肽分子的比例将变化,如同在反应混合物中它们的浓度将变化一样。一般而言,最佳比例(在有最低的过量的未反应的蛋白质或聚合物的反应效率方面)可通过所选择的聚乙二醇的分子量和可用的反应基团的数目来确定。当涉及分子量,通常聚合物的分子量越高,可以附接到蛋白质的聚合物分子的数目越少。同样地,当优化这些参数时,应当考虑聚合物的支化。一般而言,分子量越大(或分枝越多),聚合物:蛋白质的比率越高。
水溶性聚合物可以为任意结构形式,包括但不限于线性、叉状或分支的。典型地,所述水溶性聚合物是聚(亚烷基二醇),例如聚(乙二醇)(PEG),但也可使用其他的水溶性聚合物。举例来说,使用PEG来描述本发明的某些实施方案。
PEG是众所周知的水溶性聚合物,其是可商购的或可以按照本领域公知的方法(Sandler和Karo,Polymer Synthesis,Academic Press,纽约,第3卷,138-161页)通过乙二醇的开环聚合来制备。术语“PEG”广泛用于涵盖任意聚乙二醇分子,而不考虑大小或在所述PEG末端的修饰,并且可以通过式被表示为连接到多肽:XO-(CH2CH2O)n-CH2CH2-Y,其中n为2到10,000,且X为H或末端修饰,所述末端修饰包括但不限于C1-4烷基。
在一些情况下,PEG在一端用羟基或甲氧基进行终止,即,X是H 或CH3(“甲氧基PEG”)。替代性地,所述PEG可以用反应性基团来终止,从而形成双官能聚合物。典型反应基团可以包括通常用于与以下官能团进行反应的那些反应基团:存在于20种常见氨基酸中的官能团(包括但不限于,马来酰亚胺基团、活化的碳酸酯(包括但不限于,对硝基苯基酯)、活化的酯(包括但不限于,N-羟基琥珀酰亚胺、对硝基苯酯)和醛);以及对20种常见氨基酸是惰性的、但与存在于非天然编码氨基酸中的增补的官能团特异性反应的官能团(包括但不限于,叠氮基、炔基)。应注意的是,在上式中由Y表示的、所述PEG的另一端,将通过天然存在或非天然编码的氨基酸直接或间接地附接到多肽。举例来说,Y可以是多肽的胺基团(包括但不限于,赖氨酸的ε胺或N末端)的酰胺、氨基甲酸酯或脲连接。替代性地,Y可以是硫醇基团(包括但不限于,半胱氨酸的硫醇基团)的马来酰亚胺连接。替代性地,Y可以是经由20种常见氨基酸通常不可获得的残基的连接。例如,PEG上的叠氮基团可以与多肽上炔基团进行反应,以形成Huisgen[3+2]环加成产物。替代性地,PEG上的炔基可以与存在于非天然编码的氨基酸(诸如本文所描述的经修饰的氨基酸)中的叠氮基团反应,以形成类似产物。在一些实施方案中,如适用,强亲核试剂(包括但不限于,肼、酰肼、羟胺、氨基脲)可与存在于非天然编码的氨基酸中的醛或酮基团反应以形成腙、肟或缩氨基脲,所述腙、肟或缩氨基脲在某些情况下,可以通过用适当的还原剂处理被进一步还原。替代性地,所述强亲核试剂可以经由非天然编码的氨基酸并入到多肽,并用于与存在于水溶性聚合物中的酮或醛基团进行优先反应。
根据实际所需,可以使用任何分子质量的PEG,包括但不限于,根据所需从约100道尔顿(Da)至100,000Da或更大(包括但不限于有时0.1-50kDa或10-40kDa)。支链PEG包括但不限于,其中各个链具有从1-100kDa(包括但不限于,1-50kDa或5-20kDa)的范围的分子量的PEG分子。广泛的PEG分子描述于,包括但不限于,Shearwater Polymers公司的产品目录、Nektar Therapeutics Nektar Therapeutics的产品目录,其通过引用并入本文。
通常,PEG分子的至少一个末端可用于与非天然编码的氨基酸反应。例如,具有用于与氨基酸侧链反应的炔和叠氮部分的PEG衍生物可以用于将PEG附接到如本文所述的非天然编码的氨基酸。如果所述非天然编码的氨基酸包含叠氮,那么PEG通常将要么含有炔部分以实现形成[3+2]环加成产物,或要么含有含有膦基团的活化的PEG物种(即,酯,碳酸酯)以 实现形成酰胺连接。替代性地,如果非天然编码氨基酸包含炔,那么PEG通常将含有叠氮部分以实现形成[3+2]Huisgen环加成产物。如果非天然编码的氨基酸包含羰基,所述PEG通常将包含有效的亲核试剂(包括但不限于,酰肼、肼、羟胺、或氨基脲官能团),以便实现分别形成相应的腙、肟、和缩氨基脲键。在其它替代性方案中,可以使用本文所描述的反应基团的相反的定位,即,非天然编码的氨基酸中的叠氮基部分可以与含有炔的PEG衍生物反应。
在一些实施方案中,具有PEG衍生物的多肽变体包含化学官能团,所述化学官能团与存在于非天然编码的氨基酸的侧链上的化学官能团反应。
在某些实施方案中,所述有效载荷是含有叠氮化物或乙炔的、包含水溶性聚合物主链的聚合物,其具有从约800Da至约100,000Da的平均分子量。所述水溶性聚合物的聚合物主链可以是聚(乙二醇)。然而,应该理解,包括但不限于聚乙二醇和其它相关聚合物(包括聚(葡聚糖)(poly(dextran))和聚(丙二醇))的多种水溶性聚合物,也适合于使用,并且术语PEG或聚(乙二醇)的使用旨在涵盖和包括所有这样的分子。术语PEG包括但不限于,任一种形式的聚(乙二醇),包括双官能的PEG、多臂的PEG、衍生化的PEG、叉状的PEG、支化的PEG、悬垂的PEG(即,具有悬垂于聚合物主链的一个以上官能团的PEG或相关聚合物),或其中具有可降解的键的PEG。
所述聚合物主链可以是线型的或支化的。支化的聚合物主链在本领域中通常是已知的。通常,支化的聚合物具有中央分支核部分和连接到该中央分支核的多个线型聚合物链。PEG通常以支化的形式使用,所述支化的形式可以通过将环氧乙烷加成至各种多元醇,例如甘油、甘油寡聚物、季戊四醇和山梨糖醇来制备。所述中央分支部分也可源自于数个氨基酸,例如赖氨酸。所述支化的聚(乙二醇)可以通式的形式表示为R(-PEG-OH)m,其中R源自核部分,例如甘油、甘油寡聚物、或季戊四醇,且m表示臂的数目。多臂的PEG分子,例如在以下文献中所描述的那些,也可以用作所述聚合物主链:专利号为5,932,462、5,643,575、5,229,490、4,289,872的美国专利;美国专利申请2003/0143596;WO 96/21469;和WO 93/21259,通过引用将其每一个以其整体的形式并入本文。
支化的PEG也可以是由PEG(-YCHZ2)n表示的叉状的PEG的形式,其中Y是连接基团,且Z是以限定长度的原子链连接于CH的活化的末端基团。
为另一种支化的形式的悬垂的PEG,具有反应基团,如羧基,该羧基是沿所述PEG主链而不是在PEG链的末端。
除了这些形式的PEG之外,所述聚合物还可以用在主链中的弱的或可降解的键来制备。例如,PEG可以用聚合物主链中的受到水解的酯键来制备。如本文所示,该水解导致聚合物裂解成较低分子量的片段:-PEG-CO2-PEG-+H2O→PEG-CO2H+HO-PEG-。本领域技术人员理解,术语聚(乙二醇)或PEG表示或包括本领域中已知的所有形式,包括但不限于本文所公开的那些。
许多其它聚合物也适合于使用。在一些实施方案中,特别是具有从2至约300个末端的、水溶性的聚合物主链。合适的聚合物的实例包括但不限于,其他聚(亚烷基二醇)(如聚(丙二醇)(“PPG”))、它们的共聚物(包括但不限于乙二醇和丙二醇的共聚物)、它们的三元共聚物、它们的混合物等。尽管聚合物主链的各链的分子量可以变化,但通常在约800Da至约100,000Da的范围内,通常为约6,000Da至约80,000Da。
本领域的普通技术人员将认识到,实质上水溶性的主链的前述清单决不是详尽无遗的,其仅仅是说明性的,具有本文所描述的性质的所有聚合物材料都被认为适合于使用。
在一些实施方案中,聚合物衍生物是“多官能”,意味着聚合物主链具有至少两个末端,并可能多达约300个末端用官能团进行官能化或活化。多官能聚合物衍生物包括但不限于,具有两个末端的线型聚合物,其中各末端被与结合到可以是相同或不同的官能团。
叠氮官能团也可以选择性地与含有芳基酯且以芳基膦部分适当官能化的有效载荷部分进行反应,以生成酰胺键。芳基膦基团原位还原叠氮化物,然后生成的胺有效地与邻近的酯键反应,以生成相应的酰胺。参见例如E.Saxon和C.Bertozzi,Science 287,2007-2010(2000)。在一些实施方案中,含有叠氮的氨基酸是烷基叠氮化物(包括但不限于2-氨基-6-叠氮基-1-己酸)或芳基叠氮化物(对叠氮基-苯丙氨酸)。
含有芳基酯和膦部分的示例性有效载荷部分可以以下式表示:
其中,X是-O-、-NH-、-S-或单键,Ph是苯基,W是有效载荷部分,且R是H、烷基、芳基、取代的烷基和取代的芳基。示例性的R基团包括但不 限于-CH2、-C(CH3)3、-OR'、-NR'R”、-SR'、-卤素、-C(O)R'、-CONR'R”、-S(O)2R'、-S(O)2NR'R”、-CN和-NO2。R'、R”、R”'和R””各自独立地是氢、取代或未取代的杂烷基、取代或未取代的芳基(包括但不限于以1-3个卤素取代的芳基)、取代或未取代的烷基、取代或未取代的烷氧基、取代或未取代的硫代烷氧基、或烷基芳基。当本文所描述的化合物包括多于一个的R基团时,例如,当存在多于一个的R'、R”、R”'和R””基团时,各R基团独立选择为各R'、R”、R”'和R””。当R'和R”连接到相同的氮原子时,它们可以与氮原子一起形成5、6、7元环。例如-NR'R”是指包括但不限于1-吡咯烷基和4-吗啉基。从取代基的上述论述,本领域技术人员将理解术语“烷基”意指包括包括与非氢的基团连接的碳原子的基团,诸如卤代烷基(包括但不限于-CF3和-CH2CF3)和酰基(包括但不限于-C(O)CH3、-C(O)CF3、-C(O)CH2OCH3等)。
叠氮官能团也可以选择性地与含有硫酯且以芳基膦部分适当官能化的有效载荷部分进行反应,以生成酰胺键。芳基膦基团原位还原叠氮化物,然后生成的胺有效地与硫酯键反应,以生成相应的酰胺。含有硫酯和膦部分的示例性水溶性聚合物可以以下式表示:
其中,n是1-10;X可以是O、N、S或是不存在的,Ph是苯基,且W是有效载荷部分。
在一个实施方案中,所述聚合物衍生物具有以下结构:X-A-PAY-B-炔基,其中:B是连接部分,其可以是存在或不存在的;PAY是有效载荷部分;A是连接部分,其可以是存在或不存在的,并且其是可以与B相同或不同;且X为第二官能团。用于A和B的连接部分的实例包括但不限于,含有至多18个、且更优选为1-10个碳原子的多官能化的烷基。如氮、氧或硫等杂原子可以与烷基链一起被包括在内。所述烷基链也可以在杂原子处是支化的。用于A和B的连接部分的其它实例包括但不限于,含有至多10个、且更优选为5-6个碳原子的多官能化的芳基。所述芳基可以以一个以上碳原子、氮、氧或硫原子进行取代。合适的连接基团的其它实例包 括在以下文献中描述的那些连接基团:专利号为5,932,462;5,643,575的美国专利;以及美国申请公开2003/0143596,通过引用将其每一个并入本文。本领域普通技术人员将认识到,连接部分的前述清单决不是详尽无遗的,其仅仅是说明性的,具有本文所描述的性质的所有连接部分都被认为适合于使用。
用作X的合适的官能团的实例包括但不限于,羟基、经保护的羟基、烷氧基、活性酯(例如N-羟基琥珀酰亚胺基酯和1-苯并三唑基酯)、活性碳酸酯(例如N-羟基琥珀酰亚胺基碳酸酯和1-苯并三唑基碳酸酯)、缩醛、醛、醛水合物、烯基、丙烯酸酯、甲基丙烯酸酯、丙烯酰胺、活性砜、胺、氨基氧基、经保护的胺、酰肼、经保护的酰肼、经保护的硫醇、羧酸、经保护的羧酸、异氰酸酯、异硫氰酸酯、马来酰亚胺、乙烯基砜、二硫代吡啶、乙烯基吡啶、碘乙酰胺、环氧化物、乙二醛、二酮、甲磺酸酯、甲苯磺酸酯、三氟乙基磺酸酯(tresylate)、烯烃和酮。如本领域技术人员所理解的,所选的X部分应与炔基团相兼容,以便与炔基团的反应不会发生。所述含炔基的聚合物衍生物可以是同双官能的,这意味着第二官能团(即,X)也为炔部分,或异双官能的,意味着第二官能团为不同的官能团。
经保护的”术语是指防止在某些反应条件下化学反应性官能团的反应的保护基或部分的存在。该保护基将根据被保护的化学反应性基团的类型而变化。举例来说,如果化学反应性基团为胺或酰肼,那么保护基可以选自由叔丁氧羰基(t-Boc)和9-芴甲氧羰基(Fmoc)所构成的组。如果化学反应性基团为硫醇,那么保护基可以为邻吡啶基二硫化物(orthopyridyldisulfide)。如果化学反应性基团是羧酸(如丁酸或丙酸)、或羟基,那么保护基可以是苄基或烷基,如甲基、乙基或叔丁基。也可以使用本领域中已知的其他保护基。
在文献中的末端官能团的具体实例包括但不限于,N-琥珀酰亚胺基碳酸酯(参见例如,专利号为5281698、5468478的美国专利)、胺(参见例如,Buckmann等,Makromol.Chem.182:1379(1981),Zaplipsky等Eur.Polym.J.19:1177(1983))、酰肼(参见例如,Andresz等,Makromol.Chem.179:301(1978))、丙酸琥珀酰亚胺酯和丁酸琥珀酰亚胺酯(参见例如,Olson等,Poly(ethylene glycol)Chemistry&Biological Applications中,第170-181页,Harris&Zaplipsky编,ACS,华盛顿,1997;还参见专利号为5,672,662的美国专利)。琥珀酰亚胺琥珀酸酯(参见例如,Abuchowski等,C Cancer Biochem.Biophys.7:175(1984)和Joppich等,Macrolol.Chem.180:1381 (1979)),琥珀酰亚胺基酯(参见例如,专利号为4670417的美国专利)、苯并三唑碳酸酯(参见例如,专利号为5650234的美国专利),缩水甘油醚(参见例如,Pitha等Eur.J Biochem.94:11(1979)、Elling et al.,Biotech.Appl.Biochem.13:354(1991))、氧羰基咪唑(参见例如,Beauchamp等,Anal.Biochem.131:25(1983)、Tondelli等,J.Controlled Release 1:251(1985))、对-硝基苯基碳酸酯(参见例如,Veronese等,Appl.Biochem.Biotech.,11:141(1985);和SARTORE等,Appl.Biochem.Biotech.,27:45(1991))、醛(参见例如,Harris等,Polym.Sci.Chem.Ed.22:341(1984)、专利号为5824784的美国专利、专利号为5252714的美国专利)、马来酰亚胺(参见例如,Goodson等,Bio/Technology 8:343(1990)、Romani等,in Chemistry of Peptides and Proteins 2:29(1984))、和Kogan,Synthetic Comm.22:2417(1992))、邻吡啶基二硫化物(参见例如,Woghiren,等,Bioconj.Chem.4:314(1993))、丙烯酰氧(acrylol)(参见例如,Sawhney等,Macromolecules,26:581(1993))、乙烯砜(参见例如,专利号为5,900,461的美国专利)。以上所有的文献和专利通过引用并入本文。
在某些实施方案中,聚合物衍生物包含具有以下结构的聚合物主链:X-CH2CH2O-(CH2CH2O)n-CH2CH2-炔基,其中:X是如本文所描述的官能团;且n是约20到约4000。在另一个实施方案中,本发明的聚合物衍生物包含具有以下结构的聚合物主链:X-CH2CH2O-(CH2CH2O)n-CH2CH2-O-(CH2)m-W-炔基,其中:W是包含1-10个碳原子的脂肪族或芳香族连接部分;n为约20到约4000;X是如本文所描述的官能团;且m为1-10。合适的官能团的实例包括但不限于,羟基、经保护的羟基、缩醛、烯基、胺、氨基氧基、经保护的胺、经保护的酰肼、经保护的硫醇、羧酸、经保护的羧酸、马来酰亚胺、二硫代吡啶、和乙烯基吡啶、和酮。
可以通过本领域中已知的和/或本文所公开的各种方法来制备已知含炔基的PEG衍生物。在用于制备含炔基的聚合物衍生物的方法中,具有炔基官能团的连接剂与有效载荷部分接触,其中所述连接剂具有将选择性地与PEG聚合物上的化学官能团进行反应的化学官能团,以形成含炔基的聚合物衍生物产物,其中所述炔基团通过连接基团与所述聚合物主链隔开。
本文示出了示例性的反应方案:X-PEG-M+N-连接基团-炔基→PG-X-PEG-连接基团-炔基,其中:PEG为聚(乙二醇),且X为封端基团如烷氧基或本文所描述的官能团;且M是不与炔基官能团反应、但将有 效地和选择性地与N官能团进行反应的官能团。合适的官能团的实例包括但不限于,如果N为胺,则M为羧酸、碳酸酯或活性酯;如果N为酰肼或氨基氧基部分,则M为酮;如果N是亲核试剂,则M是离去基团。
粗产物的纯化可以通过已知方法实现,所述已知的方法包括但不限于,对产物进行沉淀,如果需要的话,随后进行层析。
本文示出了更具体的例子,在PEG二胺的情况下,其中胺中的一个通过保护基部分(如叔丁基-Boc)进行保护,且所得到的单保护的PEG二胺与具有炔基官能团的连接部分进行反应:BocHN-PEG-NH2+HO2C-(CH2)3-炔基。在该实例中,可以利用各种活化剂,如亚硫酰氯或碳化二亚胺试剂和N-羟基琥珀酰亚胺或N-羟基苯并三唑,将胺基团结合到羧酸基团,以创建在单胺PEG衍生物与具有炔基的连接基团部分之间的酰胺键。成功形成酰胺键后,所得的N-叔丁基-Boc-保护的、含炔基的衍生物可以直接用于修饰生物活性分子,或者其可以被进一步设计,以设置其他有用的官能团。例如,N-t-Boc基团可以通过用强酸处理来进行水解,以产生ω-氨基-PEG-炔基化物。所得的胺可以用作合成把手(synthetic handle)来设置其它有用的官能团,例如马来酰亚胺基团、活化的二硫化物、活性酯等,用于形成有价值的异双功能剂。
在另一实施方案中,所述聚合物衍生物具有以下结构:X-A-PAY-B-C≡C-R,其中:R可以是H或烷基、烯烃(alkene)、烷氧基、或芳基或取代的芳基;B是连接部分,其可以是存在或不存在的;PAY是有效载荷部分;A是连接部分,其可以是存在或不存在的,且其可以是与B相同或不同的;且X为第二官能团。
用于A和B的连接部分的实例包括但不限于,含有多至18个、更优选为1-10个碳原子的多官能的烷基。如氮、氧或硫等杂原子可以与烷基链一起被包括在内。所述烷基链也可以在杂原子处是支化的。用于A和B的连接部分的其它实例包括但不限于,含有至多10个、且更优选为5-6个碳原子的多官能化的芳基。所述芳基可以以一个以上碳原子、氮、氧或硫原子进行取代。合适的连接基团的其它实例包括在以下文献中描述的那些连接基团:专利号为5,932,462;5,643,575的美国专利;以及美国申请公开2003/0143596,通过引用将其每一个并入本文。本领域普通技术人员将认识到,连接部分的前述清单决不是详尽无遗的,其仅仅是说明性的,具有本文所描述的性质的各种连接部分都被认为是有用的。
用作X的合适的官能团的实例包括但不限于,羟基、经保护的羟基、 烷氧基、活性酯(例如N-羟基琥珀酰亚胺基酯和1-苯并三唑基酯)、活性碳酸酯(例如N-羟基琥珀酰亚胺基碳酸酯和1-苯并三唑基碳酸酯)、缩醛、醛、醛水合物、烯基、丙烯酸酯、甲基丙烯酸酯、丙烯酰胺、活性砜、胺、氨基氧基、经保护的胺、酰肼、经保护的酰肼、经保护的硫醇、羧酸、经保护的羧酸、异氰酸酯、异硫氰酸酯、马来酰亚胺、乙烯基砜、二硫代吡啶、乙烯基吡啶、碘乙酰胺、环氧化物、乙二醛、二酮、甲磺酸酯、甲苯磺酸酯、三氟乙基磺酸酯、烯烃、酮和叠氮化物。如本领域技术人员所理解的,所选的X部分应与乙炔基团相兼容,以便与乙炔基团的反应不会发生。所述含乙炔的聚合物衍生物可以是同双官能的,这意味着第二官能团(即,X)也为乙炔部分,或异双官能的,意味着第二官能团为不同的官能团。
在另一实施方案中,聚合物衍生物包含具有以下结构的聚合物主链:X-CH2CH2O-(CH2CH2O)n-CH2CH2-O-(CH2)m-C≡CH,其中:X是如本文所描述的官能团;且n是约20到约4000;且m为1-10。本文示出了各异双官能的PEG聚合物的具体实例。
含乙炔的PEG衍生物可以利用本领域技术人员已知的和/或本文中所公开的方法来制备。在一种方法中,具有从约800Da至约100,000Da的平均分子量、具有键合到第一官能团的第一末端和键合到合适的亲核基团的第二末端的水溶性聚合物主链,与同时具有乙炔官能团和离去基团的化合物反应,所述离去基团适合用于与PEG上的亲核基团反应。当具有亲核部分的PEG聚合物和具有离去基团的分子相结合时,所述离去基团经历亲核置换,被叠亲核部分取代,得到了所需的含乙炔的聚合物:X-PEG-Nu+L-A-C→X-PEG-Nu-A-C≡CR'。
如所显示的,用于在反应中使用的优选的聚合物主链具有式X-PEG-NU,其中PEG为聚(乙二醇),Nu为亲核部分,且X为不与Nu、L或乙炔官能团反应的官能团。
Nu的实例包括但不限于,将主要经由SN2型机理进行反应的胺、烷氧基、芳氧基、巯基、亚氨基、羧酸、酰肼、氨基氧基。Nu基团的其它实例包括将主要经由亲核加成反应进行反应的那些官能团。L基团的实例包括氯、溴、碘、甲磺酸酯、三氟乙基磺酸酯、和甲苯磺酸酯和预期经历亲核置换的其它基团,以及酮、醛、硫酯、烯烃、α-β不饱和羰基、碳酸酯和预期经历亲核试剂的加成的其它亲电基团。
在另一个实施方案中,A为碳原子数在1-10之间的脂肪族连接基团 或碳原子数在6-14之间的取代的芳基环。X为不与炔基基团和L反应的官能团,且L是合适的离去基团。
在用于制备含乙炔的聚合物衍生物的另一种方法中,具有为约800Da至约100,000Da的平均分子量的、在一末端具有经保护的官能团或封端剂且在另一末端具有合适的离去基团的PEG聚合物,与乙炔阴离子接触。
水溶性聚合物可以被连接到多肽。可以经由并入到所述多肽的非天然编码的氨基酸、或非天然编码的或天然编码的氨基酸的任意官能团或取代基,或附加到非天然编码的或天然编码的氨基酸中的任意官能团或取代基,而连接所述水溶性聚合物。在实施方案中,所述非天然编码的氨基酸是如本文所描述的经修饰的氨基酸。替代性地,所述水溶性聚合物被连接到抗原结合的抗体,所述抗原结合的多肽经由天然存在的氨基酸(包括但不限于,半胱氨酸、赖氨酸或N末端残基的胺基)并入非天然编码的氨基酸。在一些情况下,所述多肽包含1、2、3、4、5、6、7、8、9、10个经修饰的氨基酸,其中一个以上非天然编码的氨基酸(多个)连接到水溶性聚合物(包括但不限于,PEG和/或寡糖)。在一些情况下,本发明的多肽还包含1、2、3、4、5、6、7、8、9、10或更多个连接到水溶性聚合物的非天然编码的氨基酸。在一些情况下,多肽包含连接到水溶性聚合物的一种以上非天然编码的氨基酸和连接到水溶性聚合物的一种以上天然存在的氨基酸的。在一些实施方案中,相对于未偶联的形式,水溶性聚合物提高了多肽的血清半衰期。
可以调节连接到多肽的水溶性聚合物的数目(即,聚乙二醇化或糖基化的程度),以提供改变的(包括但不限于,提高的或降低的)的药理学、药代动力学或药效学特性,如活体内半衰期。在一些实施方案中,相对于未修饰的多肽,多肽的半衰期增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、2倍、5倍、10倍、50倍、或至少约100倍。
在一个实施方案中,包含含有羰基的非天然编码的氨基酸的抗原结合的多肽用PEG衍生物进行修饰,所述PEG衍生物包含直接连接到PEG主链的末端肼、羟胺、酰肼或氨基脲部分。
在一些实施方案中,羟胺末端PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-O-NH2,其中R为简单烷基(甲基、乙基、丙基等),m是2-10,且n是100-1,000(即,平均分子量在5-40kDa之间)。
在一些实施方案中,含有肼或酰肼的PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-X-NH-NH2,其中R为简单烷基(甲基、乙基、 丙基等。),m是2-10,且n是100-1,000,且X任选地是羰基(C═O),其可以存在或不存在。
在一些实施方案中,含有氨基脲的PEG衍生物将具有以下结构:氨RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-NH-NH2,其中R是简单烷基(甲基、乙基、丙基等),m是2-10且n是100-1,000。
在另一实施方案中,包含含有羰基的氨基酸的多肽用PEG衍生物进行修饰,所述PEG衍生物含有经由酰胺键连接到PEG主链的末端的羟胺、酰肼、肼或氨基脲部分。
在一些实施方案中,羟胺末端的PEG衍生物具有以下结构:RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-O-NH2,其中R是简单烷基(甲基、乙基、丙基等),m为2-10且n为100-1,000(即,平均分子量在5-40kDa之间)。
在一些实施方案中,含有肼或酰肼的PEG衍生物具有以下结构:RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-X-NH-NH2,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,n为100-1,000,且X任选地是羰基(C═O),其可以存在或不存在。
在一些实施方案中,含氨基脲的PEG衍生物具有以下结构:RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-NH-C(O)-NH-NH2,其中R是简单烷基(甲基、乙基、丙基等),m为2-10,n为100-1,000。
在另一实施方案中,包含含有羰基的氨基酸的多肽用支化的PEG衍生物进行修饰,所述支化的PEG衍生物含有末端肼、羟胺、酰肼或氨基脲部分,其中所述支化的PEG的各链具有10kDa-40kDa、更优选5kDa-20kDa的分子量范围。
在另一实施方案中,包含非天然编码的氨基酸的多肽用具有支化结构的PEG衍生物进行修饰。例如,在一些实施方案中,肼或酰肼末端PEG衍生物将具有以下结构:[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-NH-NH2,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,且n为100-1,000,且X任选地是羰基(C═O),其可以存在或不存在。
在一些实施方案中,含有氨基脲基团的的PEG衍生物将具有以下结构:[RO-(CH2CH2O)n-O-(CH2)2-C(O)-NH-CH2-CH2]2CH-X-(CH2)m-NH-C(O)-NH-NH2,其中R为简单烷基(甲基、乙基、丙基等),X任选地是NH、O、S、C(O)或是不存在的,m为2-10,且 n为100-1,000。
在一些实施方案中,含有羟胺基团的的PEG衍生物将具有以下结构:[RO-(CH2CH2O)n-O-(CH2)2-C(O)-NH-CH2--CH2]2CH-X-(CH2)m-O-NH2,其中R为简单烷基(甲基、乙基、丙基等),X任选地是NH、O、S、C(O)或是不存在的,m为2-10且n为100-1,000。
水溶性聚合物连接到多肽的程度和位点可以调节抗体对抗原或受体的结合。
用于聚合物的活化以及用于肽的偶联的方法和化学性质在文献中有描述,且在本领域中是已知的。用于活化聚合物的常用方法包括但不限于,用溴化氰、高碘酸盐、戊二醛、双环氧化物、表氯醇、二乙烯基砜、碳化二亚胺、磺酰卤、三氯三嗪等活化官能团。(参见,R.F.Taylor,(1991),PROTEIN IMMOBILISATION.FUNDAMENTAL AND APPLICATIONS,Marcel Dekker,N.Y.;S.S.Wong,(1992),CHEMISTRY OF PROTEIN CONJUGATION AND CROSSLINKING,CRC出版社,Boca Raton;G.T.Hermanson等,(1993),IMMOBILIZED AFFINITY LIGAND TECHNIQUES,Academic出版社,N.Y.;Dunn,R.L.等,Eds.POLYMERIC DRUGS AND DRUG DELIVERY SYSTEMS,ACS Symposium Series Vol.469,American Chemical Society,华盛顿,1991)。
关于PEG的功能化和偶联的一些综述和论文是可以获得的。参见例如Harris,Macronol.Chem.Phys.C25:325-373(1985);Scouten,Methods in Enzymology 135:30-65(1987);Wong等,Enzyme Microb.Technol.14:866-874(1992);Delgado等,Critical Reviews in Therapeutic Drug Carrier Systems 9:249-304(1992);Zalipsky,Bioconjugate Chem.6:150-165(1995)。
也可以在以下文献中找到用于活化聚合物的方法:WO 94/17039、专利号为5,324,844,的美国专利、WO 94/18247、WO 94/04193、专利号为5,219,564的美国专利、专利号为5,122,614的美国专利、WO 90/13540、专利号为5,281,698的美国专利、和WO 93/15189,以及用于活化的聚合物和酶之间的偶联,所述酶包括但不限于凝血因子VIII(WO 94/15625)、血红蛋白(WO 94/09027)、载氧分子(专利号为4,412,989的美国专利)、核糖核酸酶和超氧化物歧化酶(Veronese等,App.Biochem.Biotech.11:141-45(1985))。本文所引用的所有文献和专利通过引用以其整体并入本文中。
通过任意方便的方法,进行含有非天然编码氨基酸(诸如对叠氮基-L-苯丙氨酸)的多肽的PEG化(即,任意水溶性聚合物的附加)。例如,多 肽用炔末端mPEG衍生物进行PEG化。简言之,在室温下,在搅拌下,向含对叠氮基-L-苯丙氨酸的多肽的水性溶液中添加过量的固体mPEG(5000)-O-CH2-C≡CH。通常,该水性溶液是以缓冲剂进行缓冲,所述缓冲剂具有接近要进行该反应所需的pH值(通常约为pH 4-10)的pKa。用于在pH 7.5进行PEG化的合适的缓冲剂的实例,例如,包括但不限于,HEPES、磷酸盐、硼酸盐、TRIS-HCl、EPPS和TES。持续监测pH值,并在必要时进行调整。通常使该反应持续进行约1-48小时。
随后对反应产物进行疏水层析,以从游离的mPEG(5000)-O-CH2-C≡CH和聚乙二醇化的多肽的任意高分子量的复合物中分离聚乙二醇化的多肽变体,所述聚乙二醇化的多肽的任意高分子量的复合物在未封端的PEG在分子的两端被活化时,可以形成,从而将多肽变体分子进行交联。在疏水层析过程中的条件是这样的:游离的mPEG(5000)-O-CH2-C═CH流经柱,而在所需的形式(包含偶联到一种以上PEG基团的一种多肽变体分子)之后,洗脱出任意的交联的聚乙二醇化的多肽变体复合物。合适的条件根据交联复合物相对于所需的偶联物的相对尺寸而变化,并且容易被本领域技术人员确定。含有所需结偶联物的洗脱液通过超滤而浓缩并通过渗滤进行脱盐。
如果需要的话,从疏水层析得到的聚乙二醇化的多肽可以进一步通过本领域技术人员已知的一种以上程序进行纯化,包括但不限于,亲和层析;阴离子或阳离子交换色谱(使用,包括但不限于,DEAE琼脂糖凝胶);硅胶上的层析;反相HPLC;凝胶过滤(使用,包括但不限于,SEPHADEX G-75);疏水层析;尺寸排阻色谱法、金属螯合物色谱;超滤/渗滤;乙醇沉淀;硫酸铵沉淀;聚焦层析;置换色谱;电泳程序(包括但不限于制备型等电聚焦)、差别性溶解度(differential solubility)(包括但不限于硫酸铵沉淀),或萃取。表观分子量可以通过GPC通过与球状蛋白质标准(PROTEIN PURIFICATION METHODS,A PRACTICAL APPROACH(Harris&Angal,编)IRL出版社1989,293-306)进行比较来估算。多肽-PEG偶联物的纯度可以通过蛋白水解降解进行评估(包括但不限于,胰蛋白酶裂解),随后进行质谱分析。Pepinsky B.,等,J.Pharmcol.&Exp.Ther.297(3):1059-66(2001)。
连接到多肽的氨基酸的水溶性聚合物可以进一步被衍生化或取代,而没有限制。
在另一个实施方案中,多肽用包含叠氮部分的PEG衍生物进行修饰, 所述叠氮部分将与存在于非天然编码的氨基酸的侧链上的炔部分进行反应。一般而言,所述PEG衍生物将具有从1kDa-100kDa、且在一些实施方案中,从10kDa-40kDa的平均分子量范围。
在一些实施方案中,叠氮末端的PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-N3,其中R为简单烷基(甲基、乙基、丙基等),m为2-10且n为100-1,000(即,平均分子量在5kDa-40kDa之间)。
在另一实施方案中,叠氮末端的PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-(CH2)p-N3,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,p为2-10且n为100-1,000(即,平均分子量在5kDa-40kDa之间)。
在另一实施方案中,包含含炔的氨基酸的多肽用含有叠氮末端部分的支化的PEG衍生物进行修饰,其中所述支化的PEG的各链具有的分子量范围为从10kDa-40kDa,且更优选地,从5kDa-20kDa。例如,在一些实施方案中,叠氮末端的PEG衍生物将具有以下结构:[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-(CH2)p-N3,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,p为2-10,且n为100-1000,并且X任选地为O、N、S或羰基(C═O),在每一种情况下,其可以是存在或不存在的。
在另一个实施方案中,多肽用包含炔部分的PEG衍生物进行修饰,所述炔部分将与存在于非天然编码的氨基酸(诸如本文所描述的经修饰的氨基酸)的侧链上的叠氮部分进行反应。
在一些实施方案中,炔末端PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-C≡CH,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,且n为100-1,000(即,平均分子量在5kDa-40kDa之间)。
在另一实施方案中,包含含有炔的非天然编码的氨基酸的多肽用PEG衍生物进行修饰,所述PEG衍生物含有经由酰胺键连接到PEG主链的末端叠氮或末端炔部分。
在一些实施方案中,炔末端PEG衍生物将具有以下结构:RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-(CH2)p-C≡CH,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,p为2-10且n为100-1,000。
在另一实施方案中,包含含叠氮的氨基酸的多肽用含有末端炔部分的支化的PEG衍生物进行修饰,其中所述支化的PEG的各链具有的分子量范围为从10kDa-40kDa,且更优选地,从5kDa-20kDa。例如,在一些 实施方案中,炔末端PEG衍生物将具有以下结构:[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-(CH2)pC≡CH,其中R为简单烷基(甲基、乙基、丙基等),m为2-10,p为2-10,且n为100-1000,并且X任选地为O、N、S或羰基(C═O),或是不存在的。
在另一实施方案中,多肽用含有活化的官能团(包括但不限于,酯、碳酸酯)的PEG衍生物进行修饰,所述活化的官能团进一步含有芳基膦基团,所述芳基膦基团将与存在于非天然编码的氨基酸的侧链上的叠氮部分反应。一般而言,般而言,所述PEG衍生物将具有从1kDa-100kDa、且在一些实施方案中,从10kDa-40kDa的平均分子量范围。
可以连接到多肽的其它示例性的PEG分子,以及聚乙二醇化方法包括在以下专利中描述的那些:例如,美国专利公开号2004/0001838;2002/0052009;2003/0162949;2004/0013637;2003/0228274;2003/0220447;2003/0158333;2003/0143596;2003/0114647;2003/0105275;2003/0105224;2003/0023023;2002/0156047;2002/0099133;2002/0086939;2002/0082345;2002/0072573;2002/0052430;2002/0040076;2002/0037949;2002/0002250;2001/0056171;2001/0044526;2001/0027217;2001/0021763;美国专利号6,646,110;5,824,778;5,476,653;5,219,564;5,629,384;5,736,625;4,902,502;5,281,698;5,122,614;5,473,034;5,516,673;5,382,657;6,552,167;6,610,281;6,515,100;6,461,603;6,436,386;6,214,966;5,990,237;5,900,461;5,739,208;5,672,662;5,446,090;5,808,096;5,612,460;5,324,844;5,252,714;6,420,339;6,201,072;6,451,346;6,306,821;5,559,213;5,612,460;5,747,646;5,834,594;5,849,860;5,980,948;6,004,573;6,129,912;WO 97/32607、EP 229,108、EP 402,378、WO 92/16555、WO 94/04193、WO 94/14758、WO 94/17039、WO 94/18247、WO 94/28024、WO 95/00162、WO 95/11924、W095/13090、WO 95/33490、WO 96/00080、WO 97/18832、WO 98/41562、WO 98/48837、WO 99/32134、WO 99/32139、WO 99/32140、WO 96/40791、WO 98/32466、WO 95/06058、EP 439508、WO 97/03106、WO 96/21469、WO 95/13312、EP 921131、WO 98/05363、EP 809996、WO 96/41813、WO 96/07670、EP605963、EP 510356、EP 400472、EP 183503和EP 154316,通过引用将它们并入本文中。可以以任意形式使用本文所描述的任一PEG分子,包括但不限于,单链、支链、多臂链、单官能、双官能、多官能、或其任意组合。
在某些实施方案中,用一个以上能够与经修饰的氨基酸反应的连接基 团可以将多肽连接到有效载荷。所述一个以上连接基团可以是对本领域技术人员而言是显而易见的任意连接基团。术语“连接基团”在本文中用于指通常作为化学反应的结果而形成的、且通常是共价键的基团或键。水解稳定的键是指在水中实质上是稳定的、且在有用pH值下(包括但不限于,在生理条件下),在延长的时间段内,或许甚至无限期地不与水反应的键。水解不稳定或可降解的键是指该键在水中或在水性溶液中(包括例如血液)是可降解的。酶促不稳定或可降解的键是指该可被一种以上酶降解。如本领域理解的,PEG和相关聚合物可以在聚合物主链中或聚合物主链与聚合物分子的一个以上末端官能团之间的连接基团中包含可降解的键。例如,通过PEG羧酸或活化的PEG羧酸与生物活性剂上的醇基团的反应而形成的酯键一般在生理条件下水解以释放所述试剂。其它水解可降解的键包括但不限于碳酸酯键;源自胺和醛的反应的亚胺键;通过醇与磷酸基团的反应形成的磷酸酯键;为酰肼和醛的反应产物的腙键;为醛和醇的反应产物的缩醛键;为甲酸盐和醇的反应产物的原酸酯键;通过胺基团(包括但不限于在诸如PEG等聚合物的末端)和肽的羧基而形成的肽键;以及通过亚磷酰胺基团(包括但不限于在聚合物的末端)和寡核苷酸的5'羟基而形成的寡核苷酸键。可以在多肽中使用支化的连接基团。许多不同的可断裂的连接基团对本领域技术人员而言是已知的。参见专利号为4,618,492;4,542,225和4,625,014的美国专利。用于从这些连接基团释放的试剂的机制包括,例如,照射对光不稳定的键、和酸催化水解。专利号为4,671,958的美国专利,例如包括对包含连接基团的免疫偶联物的描述,所述连接基团通过患者补体系统的蛋白水解酶在活体内的靶位点处被切断。可以根据多肽和连接到该多肽的分子之间的所需的空间关系来预先确定或选择连接基团的长度。鉴于已报道了大量的用于将各种放射性诊断化合物、放射治疗化合物、药物、毒素、和其它试剂附接到多肽的方法,本领域技术人员将能够确定用于将给定试剂附接到多肽的合适方法。
可以使用任意异双官能或同双官能的连接基团来所述偶联物。所述连接体可以具有宽范围的分子量或分子长度。更大或更小分子量的连接基团可以用来提供所述多肽和所述连接的实体之间所需的空间关系或构型。具有更长或更短的分子长度的连接基团也可以用来提供所述多肽和所述连接的实体之间的所需的空间或灵活性。类似地,在所述多肽到达它的靶标之前或之后,具有特定形状或构型的连接基团可以用于对所述多肽或所述连接的实体赋予特定的形状或构型。可以选择存在于所述连接基团的各个端 部的官能团,以在所需的条件下调节多肽或有效载荷的释放。多肽和连接的实体之间的空间关系的这种优化可以对分子提供新的、经调节的,或所需的性质。
在一些实施方案中,本文提供具有哑铃结构的水溶性双官能连接基团,所述哑铃结构包含:a)在聚合物主链的至少第一端的叠氮、炔、肼、酰肼、羟胺、或含羰基的部分;和b)在聚合物主链的第二端的至少第二官能团。所述第二官能团可以与所述第一官能团是相同或不同的。在一些实施方案中,所述第二个官能团是不与所述第一官能团反应的。在一些实施方案中,提供了水溶性化合物,所述水溶性化合物包含支化的分子结构的至少一个臂。例如,所述支化的分子结构可以是树枝状结构。
多肽组合物
利用本领域中可得的方法和本文所公开的那些方法可以将本文中所描述的多肽配制成组合物。本文公开的任何化合物都可以以合适的药物组合物提供,并且由合适的施用途径施用。
在某些实施方案中,本文中提供的多肽组合物进一步包含药学上可接受的载体。所述载体可以是与药物组合物一起施用的稀释剂、赋形剂或媒介物(vehicle)。这样的药物载体可以是无菌液体,如水和油,包括石油、动物、植物或合成来源的油,如花生油、大豆油、矿物油、芝麻油等。盐水溶液和水性葡萄糖和甘油溶液也可以用作液体载体,特别是用于可注射的溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙烯、二醇、水、乙醇等。如果需要,组合物也可以包含少量的润湿剂或乳化剂、或pH缓冲剂。这些组合物可以采用溶液、混悬剂、乳剂、片剂、丸剂、胶囊剂、散剂、缓释制剂等形式。口服制剂可以包括标准载体,如药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载体的实例在.W.Martin,1990,Remington's Pharmaceutical Sciences,Mack Publishing Co中有描述。
在一些实施方案中,药物组合物以适于施用给人类受试者的形式提供。在一些实施方案中,药物组合物将包含预防或治疗有效量的抗体以及合适量的载体,以便提供用于适当地施用给患者的形式。所述制剂应该适合施用方式。
在一些实施方案中,以适合于静脉内施用的形式提供所述药物组合物。 通常情况下,适用于静脉内施用的组合物是在无菌等渗水性缓冲液中的溶液。必要时,组合物也可以包括增溶剂和缓解注射部位疼痛的局部麻醉剂如利诺卡因(lignocamne)。然而,这样的组合物可以通过除静脉内施用以外的途径施用。
在特定的实施方案中,药物组合物适合于皮下施用。在特定的实施方案中,药物组合物适合于肌肉内施用。
药物组合物的成分可以以单位剂型(例如,作为干燥的冻干粉剂或无水浓缩物提供)分开地或混合在一起提供。当组合物通过输注施用时,可以用包含无菌药物级水或盐水的输液瓶来分配。当组合物通过注射施用时,可以提供注射用无菌水或盐水的安瓿,以便可以在施用之前混合成分。
在一些实施方案中,药物组合物作为干燥灭菌的冻干粉末被提供,其能够被重新配制至适当浓度,用于施用给受试者。在一些实施方案中,多肽作为无水浓缩物被提供。在一些实施方案中,多肽作为干燥灭菌的冻干粉末以以下的单位剂量被提供:至少0.5mg、至少1mg、至少2mg、至少3mg、至少5mg、至少10mg、至少15mg、至少25mg、至少30mg、至少35mg、至少45mg、至少50mg、至少60mg、或至少75mg。
在另一实施方案中,药物组合物以液体形式提供。在一些实施方案中,药物组合物以液体形式提供,并且实质上不含表面活性剂和/或无机盐。在一些实施方案中,以以下单位剂量以液体形式提供抗体:至少0.1mg/ml、至少0.5mg/ml、至少1mg/ml、至少2.5mg/ml、至少3mg/ml、至少5mg/ml、至少8mg/ml、至少10mg/ml、至少15mg/ml、至少25mg/ml、至少30mg/ml、或至少60mg/ml。
在一些实施方案中,将药物组合物配制成盐的形式。药学上可接受的盐包括用如来自盐酸、磷酸、乙酸、草酸、酒石酸等的那些阴离子形成的盐,以及用如来自氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙、氢氧化铁、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等。
在治疗应用中,医生将根据预防性疗法或根治疗法并且根据年龄、体重、感染阶段和对待治疗的受试者是特有的其它因素决定他认为是最合适的剂量。在某些实施方案中,对于成人,剂量为约1-约1000mg/天,或对于成人为约5-约250mg/天或约10-50mg/天。在某些实施方案中,剂量为约5-约400mg/天或25-200mg/天/成人。在某些实施方案中,还考虑了约50-约500mg/天的剂量率。
用于治疗或预防的方法
本文所提供的某些多肽可用于治疗或预防本领域医生认为合适的任何疾病或病症。通常,治疗或预防的方法,包括将治疗或预防有效量的多肽或多肽组合物的施用给需要其进行治疗或预防疾病或病症的受试者。
多肽或组合物的治疗有效量是能有效降低特定的疾病或病症的严重程度、持续时间和/或症状的量。可以通过标准临床技术来确定在特定疾病的预防、控制、治疗和/或改善中将是治疗有效的多肽或组合物的量。待施用的多肽或组合物的确切量,在某种程度上取决于施用途径、特定的疾病或病症的严重性,并应根据医生的判断和各受验试者的情况来决定。
在一些实施方案中,本文提供的多肽的有效量为约0.025mg/kg至约1000mg/kg体重的人类受试者。在某些实施方案中,以以下量将多肽施用给人类受试者:约1000mg/kg体重或更少、约950mg/kg体重或更少、约900mg/kg体重或更少、约850mg/kg体重或更少、约800mg/kg体重或更少、约750mg/kg体重或更少、约700mg/kg体重或更少、约650mg/kg体重或更少、约600mg/kg体重或更少、约550mg/kg体重或更少、约500mg/kg体重或更少、约450mg/kg体重或更少、约400mg/kg体重或更少、约350mg/kg体重或更少、约300mg/kg体重或更少、约250mg/kg体重或更少、约200mg/kg体重或更少、约150mg/kg体重或更少、约100mg/kg体重或更少、约95mg/kg体重或更少、约90mg/kg体重或更少、约85mg/kg体重或更少、约80mg/kg体重或更少、约75mg/kg体重或更少、约70mg/kg体重或更少、或约65mg/kg体重或更少。
在一些实施方案中,本文提供的多肽的有效量为约0.025mg/kg至约60mg/kg体重的人类受试者。在某些实施方案中,本文提供的药物组合物中的多肽的有效量是约0.025mg/kg或更少、约0.05mg/kg或更少、约0.10mg/kg或更少、约0.20mg/kg或更少、约0.40mg/kg或更少、约0.80mg/kg或更少、约1.0mg/kg或更少、约1.5mg/kg或更少、约3mg/kg或更少、约5mg/kg或更少、约10mg/kg或更少、约15mg/kg或更少、约20mg/kg或更少、约25mg/kg或更少、约30mg/kg或更少、约35mg/kg或更少、约40mg/kg或更少、约45mg/kg或更少、约50mg/kg或约60mg/kg或更少。
可以利用本领域技术人员已知的的任何方法施用所述方法的药物组合物。例如,可以于肌内、皮内、腹膜内、静脉内、皮下给药,或它们的任意组合施用药物组合物。在一些实施方案中,于皮下施用药物组合物。 在一些实施方案中,于静脉施用药物组合物。在一些实施方案中,于肌内施用药物组合物。
用于检测或诊断的方法
本文提供的多肽可用于任意靶标的检测或本领域医生认为适合的任意疾病或病症的诊断。该方法包括检测多肽与在合适部位(例如,合适的身体、组织或细胞)的靶标的结合。在这些方法中,多肽和靶标之间的复合物的形成可以通过本领域技术人员已知的任意方法来检测。实例包括使用用于检测的二级试剂的测定法、ELISA以及免疫沉淀和凝集测定法。这些测定法的详细描述,例如提供于Harlow和Lane,Polypeptides:(Cold Spring Harbor Laboratory,纽约1988555-612)、Maertens和Stuyver的WO96/13590、Zrein等.(1998)和WO96/29605。
对于原位诊断,可以通过本领域中已知的方法,诸如,例如,静脉内、鼻内、腹膜内、脑内、动脉内注射等,而将多肽施用给受试者,以使多肽与淀粉样蛋白的表位区域之间的特定结合可以发生。可以通过附接到多肽的标记物或任意其它本领域公知的检测方法而方便地检测多肽/靶标复合物。
本文还提供用于检测或诊断的试剂盒。示例性试剂盒包含连同一种以上试剂一起的一种以上多肽,所述一种以上试剂可用于检测一种以上多肽和它们的靶标之间的复合物。
包含经修饰的氨基酸的多肽的制备
本文所描述的多肽可通过对本领域技术人员而言是显而易见的任意技术来制备。而没有限制。用于制备的有用的技术包括活体内合成(例如利用修饰的tRNA和tRNA合成酶)、无细胞合成(例如利用修饰的tRNA和tRNA合成酶)、固相多肽合成和液相多肽合成。本部分和本文的实例描述了示例性技术。在特定的实施方案中,所述多肽是抗体或抗体片段。
在某些方法中,自编码多肽的一种以上多核苷酸翻译和/或转录抗体。因此,本文提供能够编码在一个以上多肽链中具有在位点特异性位置的一个以上经修饰的氨基酸的多肽的多核苷酸。在某些实施方案中,所述多核苷酸包含通常与对应于经修饰的氨基酸的位点特异性多肽位置的核苷酸位置处的氨基酸不相关联的密码子。这样的密码子的实例包括终止密码子、4碱基密码子、5碱基密码子等等。反应混合物通常包括能够制备补充(抑 制)所述密码子的tRNA的tRNA合成酶。将这些抑制型tRNA连接到经修饰的氨基酸,以促进其在抑制型密码子的位点并入到多肽。
多肽可以通过本领域技术人员以知的技术来制备,所述多肽用于表达将经修饰的氨基酸并入到多肽的位点特异性位置的多核苷酸。这样的技术描述于例如以下专利中:美国专利号7,045,337和7,083,970;在美国公布的专利申请号US 2008/0317670、US 2009/0093405、US 2010/0093082、US 2010/0098630、US 2008/0085277;以及国际专利公开号WO 2004/016778 A1和WO 2008/066583A2,,其内容通过引用以其整体并入本文。
在某些实施方案中,多肽可以在无细胞反应混合物中制备,所述无细胞反应混合物包含至少一种用经修饰的氨基酸氨酰化的正交tRNA,其中,所述正交tRNA的碱基对具有通常与氨基酸不相关联的密码子,例如,终止密码子;4碱基密码子等。该反应混合物还包含tRNA合成酶,所述tRNA合成酶能够用经修饰的氨基酸氨酰化正交tRNA。在公布号为2008/0233611的美国专利中,可以使用的一种tRNA合成酶被示出为SEQ ID NO:55和SEQ ID NO:56。也可以使用野生型酪氨酰m.janashcii tRNA。通常外源合成易于被存在于细菌细胞提取物中的蛋白酶降解的正交tRNA合成酶,并在引发多肽合成之前将其加入到反应混合物中。正交tRNA可以在自其中获得细胞提取物的细菌细胞中合成、可以在多肽合成反应过程中从头合成、或可以外源添加到反应混合物中。
在某些实施方案中,任选地向反应混合物中添加影响经修饰的氨基酸插入和蛋白质插入或折叠的组分。这样的组分包括提高的浓度的翻译因子,以减小释放因子1和2的影响,并进一步优化正交组分的浓度。蛋白伴侣(氧化还原酶和异构酶的Dsb系统、GroES、GroEL、DNAJ、DNAK、Skp等)可以外源加入到反应混合物中,或可以在用于制备细胞提取物的源细胞中过表达。该反应可以利用大规模反应器、小规模反应器或可以多路进行多个同时合成。连续反应使用进料机构(feed mechanism)以引入试剂流,并且可以将终产物作为过程的一部分而分离。分批体系也是有利的,其中可以引入附加的试剂以延长有效合成期。可以以任何模式运行反应器,如分批模式、扩展分批模式、半分批(semi-batch)模式、半连续模式、分批补料模式以及连续模式,根据应用目的来选择使用何种方式。该反应可以是任意体积的,可以是小规模的(通常至少约1μl且不大于约15μl),或规模增加的(其中反应体积为至少约15μl、通常至少约50μl,更通常至少约100μl,并且可以是500μl、1000μl、或更大)。原则上,反应可以以任 何规模进行,只要在需要时提供足够的氧(或其它电子受体)即可。
用于在伸长期间其中至少一个经修饰的氨基酸引入到多肽链的合成的方法,包括但不限于:(I)向无细胞反应中添加外源纯化的正交合成酶、经修饰的氨基酸、和正交tRNA,(II)向反应混合物中添加外源纯化的正交合成酶和经修饰的氨基酸,但其中正交tRNA在无细胞反应过程中被转录;(III)添加外源纯化的正交合成酶和经修饰的氨基酸到反应混合物中,但其中正交tRNA由细胞提取物源生物体合成。在某些实施方案中,正交的组分通过可调节的启动子驱动,以便可以控制合成水平,尽管可以使用其他措施,如通过添加或特定的消化而控制相关的DNA模板的水平。
在某些实施方案中,外源合成tRNA合成酶,并将其添加到无细胞反应混合物。在某些实施方案中,自细菌细胞制备反应混合物,其中在所述细菌细胞中ompT已经失活或是天然失活的。认为OmpT降解反应混合物的组分(包括tRNA合成酶)。
除了上述组分(诸如无细胞提取物、基因模板和氨基酸)之外,还可以向该反应中添加蛋白质合成特定所需的材料。所述材料包括盐、亚叶酸、环AMP、蛋白质或核酸降解酶抑制剂、蛋白合成抑制剂或调节剂、氧化/还原电位调节剂、非变性表面活性剂、缓冲液组分、精胺、亚精胺、腐胺等。
所述盐优选包括钾盐、镁盐和铵盐(例如乙酸或谷氨酸的)。一种以上这样的盐可以具有供选择的氨基酸作为抗衡阴离子。在最适浓度的离子种类之间存在互相依赖性。通常就蛋白质的产量对这些离子种类进行优化。当改变反应介质的特定组分的浓度时,可以相应地改变另一种组分的浓度。例如,若干组分(诸如核苷酸和能量源化合物)的浓度,可以根据其它组分的浓度的变化同时进行调整。另外,反应器中的组分的浓度水平可随时间而变化。氧化/还原电位的调节剂可以是二硫苏糖醇、抗坏血酸、谷胱甘肽和/或它们的氧化形式。
在某些实施方案中,反应可以以透析模式、以分批透析方式、以半连续操作模式中的分批补料模式进行。在某些实施方案中,进料溶液可以通过膜或通过注射单元(unit)而供给到反应器中。合成的多肽可以在反应器中累积,随后在系统操作完成之后,进行分离或纯化。例如在将反应流体泵送通过吸附基质时,可以通过自反应混合物的原位或在循环回路中的亲和吸附,而连续地分离含有多肽的囊泡。
在蛋白质在反应器中合成的过程中,用于选择性地分离所需的蛋白质 的该蛋白质分离装置可以包括填充有微粒的单元,所述微粒涂覆有多肽分子或用于吸附所合成的所需的蛋白质的其他分子。优选地,所述蛋白分离装置包括两根用于交替使用的柱。
可以通过标准技术将所得多肽进行纯化或分离。在本文的实施例中提供了示例性技术。
测定方法
根据对本领域技术人员而言是显而易见的的任意测定法,可以针对多肽的预期活性、或针对新的活性对多肽进行测定。所得多肽的活性可以在功能性测定中进行测定,或通过定量非功能性测定中存在的蛋白的量(例如免疫染色、ELISA、考马斯亮蓝或银染凝胶定量等),以及测定生物活性蛋白与总蛋白的比率进行测定。
在翻译反应中产生的蛋白质的量可以以各种方式进行测量。一种方法依赖于测量正被翻译的特定蛋白质的活性的测定法的可用性。用于测量蛋白质活性的测定法的实例是荧光素酶测定系统,或氯霉素乙酰转移酶测定系统。这些测定法测量从翻译反应产生的功能活性蛋白质的量。活性测定法将不能测量因不正确的蛋白质折叠或缺乏蛋白质活性所必需的其它翻译后修饰而无活性的全长蛋白。
测量组合的体外转录和翻译反应中所产生的蛋白质的量的另一种方法是通过以下方法进行:使用已知量的放射性标记的氨基酸,诸如35S-蛋氨酸、3H-亮氨酸或14C-亮氨酸,并随后测量并入到新翻译的蛋白质的放射性标记的氨基酸的量。并入测定法将测量在体外翻译反应中所产生的所有蛋白质(包括截短蛋白质产物)中放射性标记的氨基酸的量。放射性标记的蛋白质可进一步在蛋白凝胶上分离,并经放射自显影证实该产物具有合适的尺寸,以及证实次级蛋白产物尚未生产。
经修饰的氨基酸的制备
本文提供的化合物可以通过对本领域技术人员是显而易见的的任何方法制备、分离或获得。本文提供的化合物可以根据本文所提供的通用制备方案而制备。在通用制备方案中没有提供的反应条件、步骤和反应物对本领域技术人员来说将是显而易见且已知的。
通用制备方案1a
通用制备方案1b
在通用制备方案1a中,D是按在式I的情况中所描述的进行定义的,在通用制备方案1b中,W4是按在式II的情况中所描述的进行定义的。
实施例
如本文使用的,在这些方法、方案和实施例中使用的符号和约定,不论是否是具体定义特定的缩写,都与当代科学文献(例如生物化学杂志(Journal of Biological Chemistry))中使用的那些一致。
对于所有下述实施例,可以使用本领域技术人员已知的标准后处理和纯化方法。除非另有说明,否则所有的温度都以℃(摄氏度)表示。除非另有说明,所有的方法都在室温下进行。
实施例1
2-氨基-3-(5-叠氮甲基-吡啶-2-基)-丙酸(1)的制备
化合物A2的制备
在室温下,将乙酸酐(0.42mL,4.5mmol,1.1eq)缓慢加入到在水(20mL)中的A1(HCl盐,1.0g,4.1mmol,1eq)和K2CO3(1.18g,8.6mmol,2.1eq)的溶液中。将该反应混合物在室温下搅拌1小时。在旋转蒸发仪(rotovapor)上除去水,将残余物用甲醇进行处理。固体通过过滤除去。将甲醇溶液浓缩,残余物通过FCC(MeOH/DCM=1/10)纯化,得到为白色固体的乙酰胺A2(0.73g,71%)。LCMS m/z:253(M+1)。
化合物A3的制备
在室温下,将氯化亚砜(0.32mL,4.3mmol,1.5eq)缓慢加入到在CHCl3(25mL)中的乙酰胺A2(0.73g,2.9mmol,1eq)和DMF(22μL,0.29mmol)的溶液中。4h后,添加另外的SOCl2(80μL,1.1mmol),并对混合物再搅拌另外的4h。用CHCl3(50mL)稀释反应混合物,然后用NaHCO3饱和洗涤。水层(aqueous layer)用CHCl3萃取两次。将合并的有机层用MgSO4干燥。将粗产物A3(0.74g,95%)直接用于接下来的反应。LCMS m/z:271(M+1)。
化合物A4的制备
在60℃,将在DMF(20mL)中的氯化物A3(1.33g,4.9mmol,1eq)、 NaN3(0.64g,9.8mmol,2eq)和NaI(73mg,0.49mmol,0.1eq)的混合物搅拌15h。然后将反应混合物浓缩至干燥。将粗产物通过FCC(EA)纯化,得到叠氮基-产物A4(0.95g,71%)。LCMS m/z:278(M+1)。
化合物A5的制备
将在THF/水(6mL/3mL)中的甲酯A4(0.95g,3.4mmol,1eq)和LiOH-H2O(0.29g,6.8mmol,2eq)的混合物在室温下搅拌3h。用1N HCl将反应混合物中和至pH7,然后浓缩至干燥。将粗产物A5(~0.91g,定量的)直接用于下一步反应。LCMS m/z:264(M+1),262(M-1)。
化合物(1)的制备
酰化酶I(100mg,Sigma公司,A3010,I级)加入到在水(60mL)中的乙酰胺A5(0.91g,3.4mmol)的溶液中。用1N氢氧化锂水溶液将溶液的pH调节至7.8后,将反应混合物在38℃下搅拌16小时。添加活性炭(2克),并将该溶液搅拌10min。将混合物通过硅藻土(Celite)垫过滤。将滤液浓缩到大约20mL,将其直接通过HPLC进行纯化。将含有纯产物(1)的级分合并并浓缩至干燥。最终样品通过冷冻干燥法进行干燥,得到为白色粉末的氨基酸(1)。LCMS m/z:222(M+1),220(M-1)。1H NMR(300MHz,D2O)δ8.36(s,1H),7.71(d,J=7.5Hz,1H),7.26(d,J=7.5Hz,1H),4.36(s,2H),3.98(dt,J=2.7和6.5Hz,1H),3.32-3.16(m,2H)
实施例2
化合物(3)的制备
用于制备化合物(3)的通用步骤
向在DCM中的吡啶取代的氨基酸P(2g,8.6mmol,1.0eq)的溶液中加入三乙胺(3mL,21.5mmol,2.5eq)。在冰浴中将反应混合物冷却至0℃,并以5min的时间滴加乙酸酐(0.974mL,10.3mmol,1.2eq)。将混合物升温至室温,并搅拌3小时。将所有的溶剂和挥发物除去,将残余物(粗P1)真空干燥并用于下一个步骤而无需进一步的纯化。
将上述粗P1溶解于无水甲醇(20mL)中,并在冰浴中冷却至0℃。以10min的时间滴加亚硫酰氯(1.87mL,25.8mmol,3.0eq)。使混合物升温至室温,并搅拌过夜。除去溶剂,并以乙酸乙酯/NaHCO3(3x)溶解,经Na2SO4干燥并浓缩,得到粗P2,将其用硅胶柱(DCM:MeOH=9:1)纯化,得到P2(550mg,25%)。
向在氯仿(10mL)中的P2(550mg,2.18mmol,1.0eq)的溶液中加入2滴DMF。在冰浴中将反应混合物冷却至0℃,并以5min的时间逐滴添加亚硫酰氯(634μL,8.72mmol,4eq)。将混合物温热至室温并搅拌过夜。该反应用DCM/NaHCO3进行后处理。有机层用Na2SO4干燥,并通过硅胶柱纯化(DCM:MeOH=9:1),得到产物P3(450mg,76%)。
向在DMF(10mL)中的P3(450mg,1.67mmol,1.0eq)的溶液中加入NaN3(217mg,3.34mmol,2.0eq)和NaI(25mg,0.167mmol,0.1eq)。将反应 混合物在60℃加热过夜。该反应用DCM/NaHCO3进行后处理。将有机层用硫酸钠干燥并通过制备型HPLC纯化,得到产物P4(400mg,86%)。
向在MeOH(5mL)中的P4(400mg,1.44mmol,1.0eq)的溶液中加入LiOH(303mg,7.2mmol,5eq,在5mL的H2O中)。将反应在室温下搅拌2h。除去溶剂,残余物直接用于下一个步骤而不需要进一步的纯化。
向在少量的DMSO和50mM NaH2PO4-Na2HPO4缓冲液(20mL)中的上述残余物的溶液中加入在5mL缓冲液中的酰化酶(100mg)。将混合物加热至37℃,并在该温度加热72h。将炭(200mg)加入到该反应中,并在室温下搅拌10min钟,通过硅藻土垫过滤。浓缩滤液并通过制备型HPLC纯化,得到产物(3)(85mg),为HCl盐。LC-MS(ESI):222(M+1),220(M-1)。 1HNMR(300MHz,CD3OD)δ8.50(d,J=4.8Hz,1H),8.17(s,1H),7.33(s,1H),7.27(d,J=5.4Hz,1H),4.49(s,2H),4.03(m,1H),3.42(dd,1H,J=3.6和12.0Hz,1H),3.27(m,2H)。
实施例3
化合物(2)的制备
用于制备化合物(2)的通用步骤
向在0℃的在甲醇(20mL)中的吡啶取代的氨基酸N(2g,8.6mmol,1.0eq)的溶液中滴加亚硫酰氯(1.25mL,17.82mmol,2.0eq),滴加时间为10min。将混合物在室温搅拌过夜。除去溶剂,得到残余物(粗N1),将其真空干燥并用于下一个步骤而无需进一步纯化。
向在0℃的在THF(20mL)中的粗N1和三乙胺(4.8mL,34.4mmol,4.0eq)的溶液中逐滴加入乙酸酐(1.22mL,12.9mmol,1.5eq),滴加时间为10分钟。将该混合物在室温下搅拌33h。将该反应用DCM稀释,并用NaHCO3(3x)洗涤,经硫酸钠干燥,并通过硅胶柱(DCM:MeOH=9:1)纯化,得到产物N2(1.0g,46%)。
向在氯仿(20mL)中的N2(2g,7.94mmol,1.0eq)的溶液中加入4滴DMF。在冰浴中将反应混合物冷却至0℃,并以10min的时间逐滴加入亚硫酰氯(2.3mL,31.76mmol,4eq)。将混合物在室温搅拌过夜。将该反应用DCM/NaHCO3进行后处理。将有机层用Na2SO4干燥,并通过硅胶柱(DCM:MeOH=9:1)纯化,得到产物N3(1g,47%)。
向在DMF(20mL)中的N3(1g,3.7mmol,1.0eq)的溶液中加入NaN3(481mg,7.4mmol,2.0eq)和NaI(55.5mg,0.37mmol,0.1eq)。将反应混合物在60℃的油浴中加热过夜。将该反应用DCM稀释。有机层用NaHCO3洗涤,以硫酸钠干燥并通过硅胶柱(DCM:MeOH=9:1)纯化,得到为黄色油状物的产物N4(1.8g,98%)。
向在MeOH(20mL)中的N4(1g,3.6mmol,1.0eq)的溶液中加入LiOH(757mg,18mmol,5eq,在10mL的水中)。将该反应在室温下搅拌2h。除去溶剂,将残余物直接用于下一个步骤而无需进一步纯化。
向在少量的DMSO和50mM NaH2PO4-Na2HPO4缓冲液(100mL)中的上述残余物的溶液中加入酰化酶(100mg)。将混合物加热至37℃,并在该温度加热48小时。将炭((200mg)加入到反应混合物中,并在室温搅拌10min,在硅藻土上过滤。将滤液浓缩,并自MeOH中重结晶得到产物(2)(1.3g)。LC-MS(ESI):222(M+1),220(M-1)。1HNMR(300MHz,DMSO-d6)δ8.44(s,1H),7.76(d,J=7.8Hz,1H),7.33(d,J=7.8Hz,1H),4.44(s,2H),3.45(m,1H),2.98-3.12(m,2H),3.27(m,2H)。
实施例4
化合物(30)的制备
用于制备化合物(30)的通用步骤
在0℃,向在DCM(300mL)中的Phe甲酯B1(50g,232mmol,1.0eq) 的溶液中加入三乙胺(81mL,580mmol,2.5eq),并滴加乙酸酐(33mL,348mmol,1.5eq),滴加时间为15min。将该混合物在室温下搅拌3h。将该反应用NaHCO3(2x)洗涤,经硫酸钠干燥,并通过硅胶柱(DCM:MeOH=9:1)纯化(DCM:MeOH=9:1),得到为白色固体的产物B2(50g,97%)。
在6-8℃搅拌酯B2(52g,0.235mole,1.0eq)、MOM-Cl(136mL,1.79mole,7.6eq)和ZnCl2(128g,0.94mole,4.0eq)的混合物8h。在6-8℃,在旋转蒸发仪上除去挥发物后,将残余物倒入冰-水中,并用乙酸乙酯(3x)萃取。将合并的有机层用NaHCO3洗涤并经硫酸钠干燥,并浓缩至小体积。然后加入醚(50mL)。将醚溶液保持在-20℃的冰箱中过夜。将该结晶产物过滤并进行真空干燥,得到为白色固体的产物B3(31g,49%)。
向在DMF(100mL)中的B3(20g,74.2mmol,1.0eq)的溶液中加入NaN3(9.64g,148mmol,2.0eq)和NaI(1.11g,7.42mmol,0.1eq)。将反应混合物在60℃的油浴中加热过夜。在旋转蒸发仪上除去溶剂DMF,将反应混合物溶解在乙酸乙酯中,并用NaHCO3(3x)洗涤,经Na2SO4干燥,以及通过硅胶柱(DCM:MeOH=9:1)纯化,得到为黄色油状物的产物B4(20.5g,100%)。
向在THF:MeOH:H2O(50mL:50mL:20mL)的混合溶液中的B4(20g,724mmol,1.0eq)的溶液中加入LiOH-H2O(6.94g,144.8mmol,2eq)。将反应在室温搅拌2h。除去溶剂得到残余物,将其用乙酸乙酯进行后处理。将有机层用1N HCl(3x)洗涤,经Na2SO4干燥并浓缩,得到为黄色油状物的产物B5(18.3g,96%)。
向在DMSO(20mL)和50mM NaH2PO4-Na2HPO4缓冲液(1.8L)中的上述酰胺B5(18g,68.7mmol)的溶液中,加入酰化酶(1g)。将该溶液在37℃加热48h。将炭(20g)加入到反应混合物中,并在室温下搅拌10min,通过硅藻土过滤。滤液用乙酸乙酯洗涤。将水层浓缩至小体积,析出为白色固体的产物。将该固体过滤并真空干燥,得到产物(30)(10g,66%),为白色固体。LC-MS(ESI):221(M+1)。1HNMR(300MHz,DMSO-d6)δ7.27(brs,4H),4.37(s,2H),3.43(m,2H),3.17(m,1H),2.84(m,1H)。
实施例5
化合物(40)的制备
用于制备化合物(40)的通用步骤
向在DMSO(100mL)中的J(10g,55.2mmol,1.0eq)的溶液中,在搅拌下分批加入叠氮化钠(5.4g,82.8mmol,1.5eq)。将混合物在40-50℃加热5h。在冷却到室温后,将混合物用水(200mL)稀释,并用醚(3x)萃取。将合并的有机层用盐水洗涤,经硫酸钠干燥并浓缩,得到产品J1(7.8g,98.7%),为油状物。
将上述产品J1(7.8g,54.5mmol)悬浮在在水(100mL)和MeOH(20mL)中的LiOH(11.4g,274mmol,5.0eq)的混合物中。将该混合物在室温搅拌1h,用水(200mL)稀释,并用醚(3x)萃取。将水层用1N HCl酸化至pH 2,并用醚(3x)萃取。将合并的有机层用Na2SO4干燥并浓缩,得到产物J2(7g,100%),为油状物。
在0℃,向在DCM中的J2(500mg,3.88mmol,1.0eq)的溶液中,加入N-甲基吗啉(N-methyl morphorline)(NMM,510μL,4.65mmol,1.2eq)和氯甲酸异丁酯(607μL,4.65mmol,1.2eq)。将混合物在室温搅拌2h。向上述溶液中加入Boc-Lys甲酯(1.15g,3.88mmol,1.0eq)。将混合物在室温下搅拌3小时,用水淬灭。将反应用DCM(3x)萃取。有机层用盐水洗涤,并经Na2SO4干燥,然后浓缩,得到产物J3(900mg,63%),为油状物。
向在THF:MeOH:H2O(5mL:3mL:2mL)的混合物中的J3(900mg,2.42mmol,1.0eq)的溶液中加入LiOH(508mg,12.1mmol,5.0eq)。将混合物在室温下搅拌1小时,浓缩至干燥,得到粗钠盐J4。
将粗的J4用在二恶烷(10mL)中的4N HCl处理,并在室温搅拌1h,浓缩得到粗产物(40),将其通过制备型HPLC纯化,得到纯的(40)(332mg,53%),为白色固体。LC-MS(ESI):258(M+1),256(M-1)。1HNMR(300MHz,D2O)δ3.52(t,J=6.9Hz,1H),3.15(t,J=6.6Hz,2H),2.99(t,J=6.9Hz,2H),2.12(t,J=7.5Hz,2H),1.66(m,4H),1.35(m,2H),1.18(m,2H)。
实施例6
评估化合物(30)和(40)的反应性
本实施例提供了与参考化合物(50)对-叠氮基-苯丙氨酸相比的化合物(30)和(40)的反应速率的评估。
将DBCO类似物(60)溶解在乙腈中至60μM的浓度。在96孔微量滴定板的孔中,将氨基酸类似物(30)、(40)、和(50)以PBS缓冲液进行连续稀释至180μL的体积。将20μL的DBCO类似物储备溶液(stock solution)加入到各个孔,并在在25℃,利用Spectramax板阅读器在310nm处通过吸光度监测形成加成加合物的DBCO的减少的动力学。化合物(30)、(40)、和(50)与化合物(60)的反应的示意图显示为图1。该动力学以 A310=A0*(1-exp(-kobs*t))准确拟合了一阶衰减,其中kobs是在[叠氮化合物]>>[DBCO]条件下的、以sec-1为单位的伪一阶速率常数。kobs相对于[叠氮化物]的图产生了各氨基酸的二阶速率常数(M-1sec-1的单位)为每个氨基酸,其是各氨基酸的固有化学反应性的量度。
实验结果显示为图2。令人惊奇的是,化合物(30)和(40)表现出1.4M-1sec-1的一阶速率常数,其是化合物(50)的一阶速率常数0.2M-1sec-1的约7倍高。进行了评估化合物(1)、(2)、和(3)的反应性的类似的实验;化合物(1)、(2)、和(3)在30min内的反应完全性大于90%,在不到2个小时内反应完全,这表明化合物(1)、(2)、和(3)表现出与化合物(30)和(40)的速率常数相似的速率常数。
实施例7
将化合物(30)并入示例性多肽GFP中
该实施例描述将化合物(30)并入绿色荧光蛋白中。为了监测GFP的合成,将在发色团之前含有琥珀密码子(终止密码子)的编码turboGFP的DNA克隆到OCFS表达载体pYD317中。在对应于根据turboGFP(pdb2G6X)的晶体结构的第50个氨基酸处的氨基酸酪氨酸的核苷酸处,通过重叠PCR突变而插入终止密码子(TAG)。对该位点的先前的研究证明,在该位置的非芳族的取代导致了没有荧光,以及证明了在终止密码子处以芳香族的nnAA进行抑制将会产生荧光。
用粘合剂盖(adhesive cover)(VWR,9503130),在分光光度计(Molecular Devices,,SpectraMaxM5)中将反应物在30℃培养5小时,以10分钟的间隔、λEx=476nm和λEm=51测定荧光强度。以30μL的最终反应体积将OCFS反应混合物立即加入到微孔板(microplate),所述OCFS反应混合物包含30%S30提取物、24μg/mL T7RNA聚合酶、1mM L-酪氨酸(Sigma公司,T8566)、预混合物*(pre-mix)、10μM tRNA、5μM pCNFRS D286R、1mM化合物(30)、和在DEPC-处理的水(G Biosciences公司,786-109)中的3nM turboGFP质粒(Evrogen,俄罗斯,亚克隆到PYD317载体)。使用使用没有终止密码子的turboGFP的阳性对照反应来确保该反应以类似于先前观察到的速率进行,同时在没有tRNA的情况下也使含有turboGFP Y50TAG的反应运行,以确保在没有负责pAMF的并入的系统的情况下,没有荧光被检测到(阴性对照)。将PAMF并入到GFP中以位点特异性的方式实现了蛋白的相对高的产率。图3示出了在GFP中的 Y50TAG位点的pAMF并入的时间过程。
实施例8
将化合物(30)并入示例性多肽GM-CSF中
将编码具有琥珀密码子的人类GMCSF的DNA克隆到表达载体pYD317。在对应于在位置6的氨基酸丝氨酸的核苷酸处,通过重叠PCR突变,而将TAG密码子插入。
将含有tRNA CUA的无细胞提取物解冻到室温,并用50μM的碘乙酰胺培养30分钟。在30℃将无细胞反应运行最高达10小时,所述无细胞反应中含有30%(v/v)碘乙酰胺处理的提取物与8mM二谷氨酸镁、10mM谷氨酸铵、130mM谷氨酸钾、35mM丙酮酸钠、1.2mM AMP、各自0.86mM的GMP、UMP、和CMP、2mM的氨基酸(针对除了以0.5mM进行添加的酪氨酸和苯丙氨酸外的18种氨基酸)、4mM草酸钠、1mM腐胺、1.5mM亚精胺、15mM磷酸钾、100nM T7RNAP、1.3uM大肠杆菌DsbC、2mM的氧化的(GSSG)谷胱甘肽、1μM tRNA合成酶和1mM化合物(30)。GMCSF TAG变体质粒的浓度为5μg/mL。为了用14C标记合成的蛋白质,将3.33%(v/v)的1-[U-14C]-亮氨酸(300mCi/mmole;GE Life Sciences,Piscataway,NJ)也加入到反应中。
对于还原性凝胶,将4μL的样品、1μL的1M DTT、7μL的DI H2O和4μL的4X LDS缓冲液(Invitrogen公司,卡尔斯巴德,CA)混合,并在70℃的热印迹(hot blot)中加热5分钟。根据制造者的建议,样品通过4-12%的Bis-Tris SDS-PAGE凝胶(Invitrogen公司,卡尔斯巴德,CA)进行分析。将凝胶干燥,并在约16小时的曝光后,通过使用Storm 840PhosphoImager的放射自显影而进行分析。
放射自显影表明,制备了含有化合物(30)的完整的全长GMCSF。
实施例9
将化合物(30)并入示例性多肽IgG中
为了证明将化合物(30)的并入到IgG的可行性,将编码含有琥珀密码子的曲妥珠单抗重链的DNA和编码曲妥珠单抗轻链的DNA克隆到表达载体pYD317。在对应于在CH1结构域中的EU索引的位置136的氨基酸丝氨酸的核苷酸处,通过重叠PCR突变,而插入TAG密码子。
将无细胞提取物解冻到室温,并用50μM的碘乙酰胺培养30分钟。在30℃将无细胞反应运行最高达10小时,所述无细胞反应中含有30%(v/v)碘乙酰胺处理的提取物与8mM二谷氨酸镁、10mM谷氨酸铵、130mM谷氨酸钾、35mM丙酮酸钠、1.2mM AMP、各自0.86mM的GMP、UMP、和CMP、2mM的氨基酸(针对除了以0.5mM进行添加的酪氨酸和苯丙氨酸外的18种氨基酸)、4mM草酸钠、1mM腐胺、1.5mM亚精胺、15mM磷酸钾、100nM T7RNAP、1.3μM大肠杆菌DsbC、5μM的酵母PDI、2mM的氧化的(GSSG)谷胱甘肽、15μM tRNA、1μM tRNA合成酶和1mM化合物(30)。重链TAG变体质粒的浓度和野生型轻链质粒的浓度分别为7.5μg/mL和2.5μg/mL。为了用14C标记合成的蛋白质,将3.33%(v/v)的1-[U-14C]-亮氨酸(300mCi/mmole;GE Life Sciences,Piscataway,NJ)也加入到反应中。
对于非还原性凝胶,在加载到凝胶上之前,将4μL的样品、8μL的DI H2O和4μL的4X LDS缓冲液(Invitrogen公司,卡尔斯巴德,CA)混合。对于还原性凝胶,将4μL的样品、1μL的1M DTT、7μL的DI H2O和4μL的4X LDS缓冲液(Invitrogen公司,卡尔斯巴德,CA)混合,并在70℃的热印迹中加热5分钟。根据制造者的建议,样品通过4-12%的Bis-Tris SDS-PAGE凝胶(Invitrogen公司,卡尔斯巴德,CA)进行分析。将凝胶干燥,并在约16小时的曝光后,通过使用Storm 840PhosphoImager的放射自显影而进行分析。
放射自显影表明,制备了含有化合物(30)的完整的全长IgG。
实施例10
化合物(30)、(1)和(2)的反应性评估
本实施例提供化合物(30)、(1)和(2)与(如下所示的)DBCO-NH2(61)的反应速率的评估。
将DBCO-NH2(61)溶解于pH 7.4的磷酸盐缓冲盐水,以得到500μm 的溶液。将氨基酸类似物(30)、(1)和(2)溶解在相同的缓冲液中,得到5mM的透明溶液,然后使用相同的缓冲液稀释至500μM的浓度。将100微升的各氨基酸类似物与100微升的化合物(61)混合并涡旋。使用NANODROP 1000 UV分光光度计在310nm处监测化合物(61)的吸收。在第0、0.5、2、6和20小时时获得的测量值。化合物(61)的吸收的降低表明其与氨基酸类似物反应。
实验结果示于图4。化合物(1)和(30)以1:1的当量很容易与化合物(61)反应,以在6个小时内产生几乎定量的产率。化合物(1)和化合物(61)之间的反应速率与化合物(30)和化合物(61)之间的反应速率是相当的。化合物(2)和化合物(61)之间的反应速率比其他两个氨基酸类似物和化合物(61)之间的反应速率慢两到四倍。然而,基于作为共同的比较物的化合物(30),化合物(2)的反应速率应比实施例6的化合物(50)的反应速率更快。
- 还没有人留言评论。精彩留言会获得点赞!