防治泌尿系结石的泽泻排石防石颗粒剂及制法和质量检测方法与流程
本发明属于医药领域,涉及治疗泌尿系统结石的药物及其制备方法和质量检测方法。
背景技术:
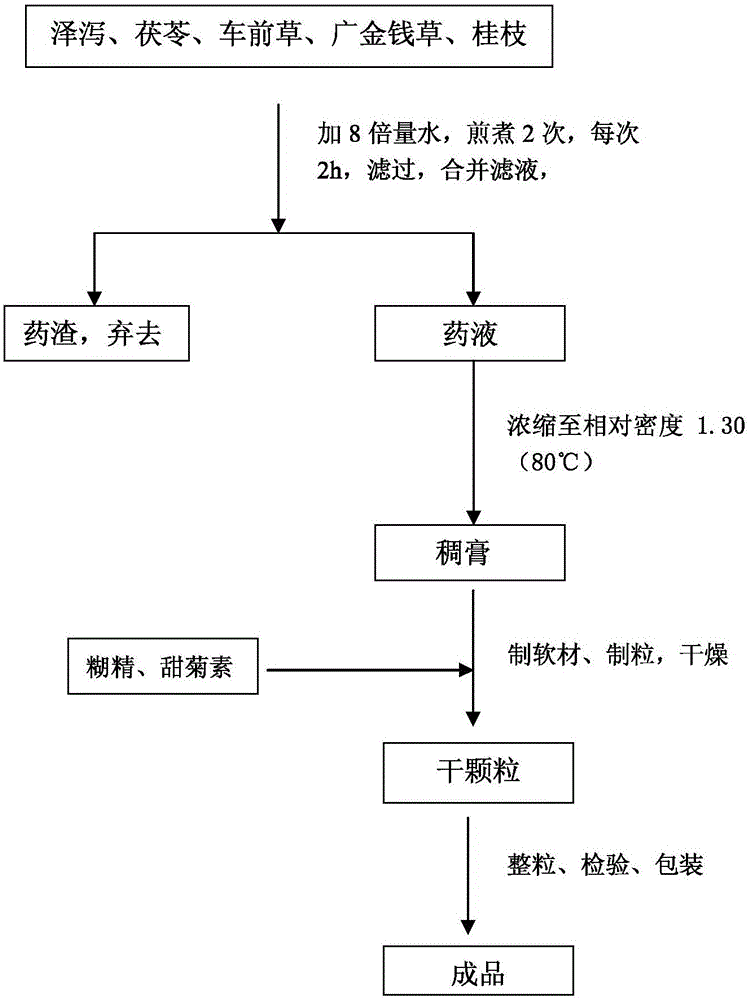
:泌尿系统结石是一种常见的泌尿系统疾病,也称为尿石症,包括肾脏、输尿管、膀胱和尿道结石,其中以肾脏和输尿管结石最为常见。有很多因素影响结石形成,主要有性别,年龄、种族、遗传、饮食习惯,环境因素、和职业等[1]。在人类一生中泌尿系统结石的发病概率约为10%-15%,一些中东国家甚至达到20%-25%,而且患病率逐年上升[2]。我国泌尿结石疾病也很常见,好发于青壮年,且近年来发病率逐渐上升。据文献资料报道,我国泌尿系结石发病率为1%-5%,南方地区泌尿系结石发病率更是高达5-10%[3]。而且,复发率高更是泌尿系结石的一个非常显著的特点。据报道,在没有采取任何预防措施的情况下,泌尿系结石1年的复发率接近10%,5年的复发率是33%,10年的复发率是50%,15年的复发率则高达75%[4]。至今没有有效方法预防泌尿系结石的复发。结石一旦生成,常会造成尿路梗阻,继发感染和上皮病变,这些都是它对肾脏产生继发性损害的表现。结石很小时常常不被病人所察觉,有在正常运动时可以从身体排出的结石。然而,随着结石体积的增大,大多数患者会伴有肾区钝、血尿等症状,也有一些结石会进入输尿管导致肾积水或肾绞痛,使患者疼痛难忍[5]。此外,尽管石头通常被认为是一种急性疾病,但是越来越多的证据表明结石是一种可以导致终末期肾病[6],并可造成患高血压[7]、冠心病[8]、代谢综合征[9]及糖尿病[10]的风险升高的系统性功能失调疾病。因此,泌尿结石要引起高度重视,并在结石尚未发病及发病初期,结石尚未变大之时就应及时进行预防及治疗。目前,体外冲击波碎石术(ESWL)和腔内泌尿技术可以通过微创技术治愈大多数泌尿系结石患者,然而,接受ESWL和泌尿外科腔内手术的患者的肾脏功能可能会发生损伤,泌尿系结石的复发率也会上升[11]。因此,寻找有效预防和治疗泌尿系结石的药物具有重要意义,也是该领域主要的研究方向和共同致力于解决的重要课题。技术实现要素:本发明的任务是提供一种预防和治疗泌尿系统结石的泽泻排石防石颗粒剂及其制备方法。本发明的另一个任务是提供所述排石防石颗粒剂的质量检测方法。实现本发明的技术方案是:本发明提供的预防和治疗泌尿系统结石的泽泻排石防石颗粒剂,是以泽泻、车前草、广金钱草、茯苓和桂枝五味药材为原料,按以下方法制成的药剂:取上述五味药材,加8倍量水,煎煮二次,每次2小时,合并煎液,滤过,滤液浓缩至80℃下得相对密度约1.30的浸膏,加入1.5倍糊精作为填充剂、0.004倍的甜菊素为矫味剂,以80%浓度的乙醇为湿润剂,乙醇用量为10%倍浸膏量,混匀,按常法制成颗粒,干燥,整粒即得。本发明提供的排石防石颗粒剂的质量检测方法,是以药剂中广金钱草和/或桂枝的薄层色谱作为鉴别方法,具体是对药剂中德大车前苷和/或夏佛塔苷两种有效成分含量进行测定。经动物实验和临床研究证明本发明提供的泽泻排石防石颗粒剂在动物体内、体外及人体内均具有明显的抑制草酸钙结石形成的作用。本发明剂型选择为颗粒剂,其优点在于:①中药颗粒剂既不会出现汤剂在使用过程中的问题,比如:汤剂的服用的剂量较大、汤剂煎煮不方便、汤剂易发生霉败变质,又能拥有一些优势,比如汤剂吸收快、汤剂作用迅速等;②颗粒剂的制备工艺适于工业生产;③颗粒剂在携带、储藏、运输、服用等方面都非常便利。此外,本方的一日处方量为54g,干膏收率约为10%,从服用量来考虑,选择颗粒剂比较合适。本发明泽泻排石防石颗粒剂为无糖型颗粒,缩小了辅料的比例,使服用量大幅减少,使产品的等级得到了提高。另外,在中医药理论方面,甘味过浓,会滋腻碍邪,不利于疾病的治疗,胃肠功能弱的人群尤为不适。在现代医学方面,现代研究已经证明尿石症病人如果摄入的糖份过量,不利于结石的治疗,而且会使促进结石的生长,使结石变大。无糖型颗粒剂的糖粉含量低,更加适宜于患有糖尿病、高脂血或者年老体弱的患者服用。本项目选择无糖型颗粒剂,减少了患者对糖份的摄取,特别适合泌尿系统结石患者使用,解决了上述问题,扩大了临床应用范围,创造更大的经济和社会效益,使本处方的医疗价值得到更大的发挥和利用,同时在同类产品中更具有竞争力。实验资料提取工艺研究仪器:硅胶G薄层板(上海科兴商贸有限公司);聚酰胺薄膜(浙江省台州市路桥四甲生化塑料厂出品);玻璃点样毛细管(华西医科大学仪器厂生产);双量程电子分析天平AUW-220D型;Agilent1100series高效液相色谱仪;岛津LC-20A型高效液相色谱仪;AgilentTC-C18(4.6×250mm)色谱柱;RE-52A型旋转蒸发仪(巩义市英峪予华仪器厂);DZF-6020型真空干燥箱(上海索谱仪器有限公司);粉碎机(HY-02,河北汇博云海科技发展有限公司);HH-4型数显恒温水浴锅(江苏省金坛市阳光仪器厂);电子天平(JD1000-2,沈阳龙腾电子称量仪器有限公司);可见紫外光谱扫描仪(UV-1601PC型,岛津国际贸易有限公司)。试剂:乙腈(美国TEDIA公司,色谱纯)、甲醇(美国TEDIA公司,色谱纯)、纯化水;甲醇、甲苯、乙醇、丁酮、三氯甲烷、正丁醇、乙醚、石油醚、乙酸乙醋、环己烷、甲酸、冰醋酸、硫酸、香草醛、三氯化铝、硅钨酸、二硝基苯肼(均为分析纯);中性氧化铝(青岛硕远化工有限公司,层析用);23-乙酰泽泻醇B(批号为:111846)、大车前苷(批号为:111914)、桂皮醛(批号为:110710)、广金钱草对照药材(批号为:121248)、车前草对照药材(批号为:110710)、茯苓对照药材(批号为:121117)、桂枝对照药材(批号为:121191),均购于中国药品生物制品检定所;夏佛塔苷(批号为:110227),购于成都蒲菲德生物制品有限公司。药材:泽泻(批号为:130212)、车前草:(批号为:130123)、广金钱草:(批号为:121209)、茯苓(批号为:130712)、桂枝(批号为:130110),以上药材均购于湖北康圣医药有限公司。鉴定人:华中科技大学同济医学院尹春萍副教授。药材药材检验:1.药材质量标准:泽泻是2010年版《中国药典》一部收载的泽泻科植物泽泻Alismaorientalis(Sam.)Juzep.的块茎。所购买的泽泻药材应该符合2010年版《中国药典》一部泽泻品种项下有关规定。广金钱草是2010年版《中国药典》一部收载的豆科植物广金钱草Desmodiumstyracifolium(Osb.)Merr.的干燥地上部分[43]。所购买的广金钱草药材应该符合2010年版《中国药典》一部广金钱草品种项下有关规定。车前草是2010年版《中国药典》一部收载的车前科植物车前PlantagoasiaticaL.或平车前PlantagodepressaWilld.的干燥全草。所购买的车前草药材应该符合2010年版《中国药典》一部车前草品种项下有关规定。茯苓是2010年版《中国药典》一部收载的多孔菌科真菌茯苓Poriacocos(Schw.)Wolf的干燥菌核[43]。所购买的茯苓药材应该符合2010年版《中国药典》一部茯苓品种项下有关规定。桂枝是2010年版《中国药典》一部收载的樟科植物肉桂CinnamomumcassiaPresl的干燥嫩枝[43]。所购买的桂枝药材应该符合2010年版《中国药典》一部桂枝品种项下有关规定。2.药材的定性鉴别:泽泻按照《中国药典》2010年版一部泽泻品种鉴别项下有关规定进行薄层鉴别。泽泻供试品与23-乙酰泽泻醇B及泽泻对照药材在相应位置上显相同颜色斑点,符合规定。车前草按照《中国药典》2010年版一部车前草品种鉴别项下有关规定进行薄层鉴别。紫外灯下,车前草供试品与车前草对照药材及车前草对照品大车前苷在相应位置上显相同颜色荧光斑点,符合规定。广金钱草按照《中国药典》2010年版一部广金钱草品种鉴别项下有关规定进行薄层鉴别。紫外灯下,广金钱草供试品与广金钱草对照品夏佛塔苷及广金钱草对照药材在相应位置上显相同颜色荧光斑点,符合规定。茯苓按照《中国药典》2010年版一部茯苓品种鉴别项下有关规定进行薄层鉴别。茯苓供试品与茯苓对照药材在相应位置上显相同颜色斑点,符合规定。桂枝按照《中国药典》2010年版一部桂枝品种鉴别项下有关规定进行薄层鉴别。桂枝供试品与桂枝对照品桂皮醛及桂枝对照药材在相应位置上显相同颜色斑点,符合规定。2.2.2.3药材的含量测定:1.泽泻按照《中国药典》2010年版一部泽泻品种含量测定项下有关规定进行含量测定。测得泽泻药材中23-乙酰泽泻醇B的含量为0.059%,大于0.050%,符合规定。2.车前草按照《中国药典》2010年版一部车前草品种含量测定项下有关规定进行含量测定。测得车前草药材中大车前苷的含量为0.72%,大于0.10%,符合规定。3.广金钱草按照《中国药典》2010年版一部广金钱草品种含量测定项下有关规定进行含量测定。测得广金钱草药材中夏佛塔苷的含量为0.14%,大于0.13%,符合规定。4.茯苓《中国药典》2010年版一部茯苓品种项下无含量测定要求。5.桂枝按照《中国药典》2010年版一部桂枝品种含量测定项下有关规定进行含量测定。测得的桂枝药材中桂皮醛含量为0.10%,等于0.10%,符合规定。2.2.3药材吸水率与浸泡时间考察:中药药材提取工艺是提高浸膏质量的基础,提取工艺必须以制备的浸膏在保证疗效的前提下,尽可能的提高质量和收率,缩短工时,降低成本,减少物耗能耗。根据有效成分或有效部位的理化性质设计提取工艺,以水煎煮提取。为保证本方有稳定的疗效,提高有效成分的提取量,应先进行浸泡,由于浸泡时间与其他因素交互作用较小,对其进行单因素考察。浸泡时间与吸水率对提取很有影响。但因此项考查可以直观评价,不用测有效成分含量,未列入正式筛选项目中。2.2.3.1实验方法:分别准确称取一日处方量(54g)的中药材,共9份,置于500ml烧杯中,编号,再分别加入水300ml,开始浸泡,9份药材的浸泡时间依次为10、20、30、40、50、60、70、80、90(min),然后滤过至尽,将药渣称重,最后计算吸水率。计算公式:吸水率(%)=(药渣湿重-药材干重)/药材干重×100%。2.2.3.2实验结果:结果如下,见表1,图1。表1药材吸水率和浸泡时间考察表2.2.3.3结果分析:药材在浸泡40min之后,吸水量基本达到平衡,说明在40分钟时药材的吸水量已经达到最大值,此时的吸水量为药材总量的179.63%。从生产实际出发,为了让药材充分浸泡,利于提取,最终选择药材的浸泡时间为40min。2.2.4提取正交试验研究2.2.4.1正交因素水平表:应用“正交设计助手3.1”软件,以夏佛塔苷、大车前苷提取量和干膏收率为三个考察指标,以提取次数、加水量、提取时间为考察因素,进行正交试验,其因素水平见表2。表2水提取因素水平表2.2.4.2试验方法:在确定浸泡时间为40min以后,还需要考查提取次数、提取时间、加水量等影响因素对药材的提取率的影响。因此设计正交试验,以干膏收率、有效成分提取量为指标对其进行考察,筛选最佳提取工艺。本方水提工艺中有五味药材,根据五味药的成分及剂型要求,选用干膏收率、大车前苷、夏佛塔苷三项为评价指标,进行综合评价。干膏收率:a作为选择剂型的参考指标,若其太高,难以制成颗粒;b影响除杂方法的选择、干燥的程度、成品的稳定性;c是颗粒剂日服量及包装规格确定的依据。因此必须以干膏收率作为评价指标之一,但其与疗效强度不成量效关系,故综合评价时权重系数应较小,以0.1较为合适。大车前苷、夏佛塔苷分别是车前草、广金钱草的指标成分及排石防石的有效成分之一,权重系数应相对较大,各以0.45为宜。根据上述设计的因素水平表,选择L9(34)正交实验表安排实验:取0.2倍处方量药材,共720g,按正交实验表的要求进行实验(第一次加水时,按药材吸水率180%补加1296ml水),将滤液合并后浓缩至500ml(1.44g生药/ml),备用。另根据大车前苷、夏佛塔苷的含量测定方法来测定大车前苷及夏佛塔苷在浓缩液中的含量,并计算0.2倍处方量药材的提取量;测定干膏收率。2.2.4.2.1大车前苷的含量测定方法(参见3.2.7):1.色谱条件与系统适应性试验:以乙腈-水(18:82)为流动相;以十八烷基硅胶为填充剂;紫外检测器。理论板数按大车前苷计算不低于3000。2.对照品溶液的制备:精密称取大车前苷对照品适量,记录,加60%的甲醇溶液制成每1ml约含15μg的溶液,计算,即得。3供试品溶液的制备:精密量取正交水煎煮提取液1ml,将它置于蒸发皿中,水浴蒸干,残渣用60%的甲醇溶解并转移至10ml的容量瓶中,加60%的甲醇溶液至容量瓶刻度,摇匀,微孔滤膜(0.45μm)滤过,即得。4测定法:精密吸取大车前苷对照品溶液、供试品溶液各10μl,注入高效液相色谱仪中,测定,然后计算大车前苷的含量,即得。2.2.4.2.2夏佛塔苷含量测定的方法(参见3.2.7):1.色谱条件与系统适应性试验:以乙腈-水(16:84)为流动相;以十八烷基硅胶为填充剂;紫外检测器。理论板数按夏佛塔苷计算不低于3000。2.对照品溶液的制备:精密称取夏佛塔苷对照品适量,记录,加50%甲醇制成每1ml约含30μg的溶液,计算,即得。3.供试品溶液的制备:精密量取正交水煎煮提取液1ml,将它置于蒸发皿中,水浴蒸干,残渣用50%的甲醇溶解并转移至10ml的容量瓶中,再加50%的甲醇溶液至容量瓶刻度,摇匀,微孔滤膜(0.45μm)滤过,即得。4.测定法:精密吸取夏佛塔苷对照品溶液、供试品溶液各10μl,注入高效液相色谱仪中,进行测定,然后计算夏佛塔苷的含量,即得。2.2.4.2.3干膏收率测定方法:分别精密量取各组正交水煎煮浓缩液各50ml,再分别置于已经干燥至恒重的干净蒸发皿中,将其水浴蒸干,然后,放置烘箱中于105℃干燥3h,取出,置于干燥器中放置30min,称量,计算干膏收率。2.2.4.3试验结果:试验结果见表3、表4。表3.水提工艺正交试验设计及结果注:干膏收率评分=(10/最大干膏收率)×干膏收率大车前苷评分=(45/最大大车前苷量)×大车前苷量夏佛塔苷评分=(45/最大夏佛塔苷量)×夏佛塔苷量综合评分=干膏收率评分+大车前苷评分+夏佛塔苷评分表4方差分析方差来源偏差平方自由度方差F比显著性A119.20259.602.21B208.422104.213.86C2579.2021289.6047.82*D53.95226.97F0.05(2,2)=19,*显著性由上表直观分析可知,影响提取效果的实验因数顺序为:提取时间>提取次数>加水量,其中以提取时间影响最大。然后又经上述方差分析可知,提取次数、加水量对提取效果均无显著性影响,提取时间有显著性影响,最佳的提取时间为2h,综合考虑提取效率及成本。最终确定的水煎煮最佳工艺为:A1B2C3,即:8倍量水,提取2次,每次提取时间为2h。2.2.4.4提取工艺验证:称取药材,共三份,按A1B2C3进行验证试验,平行操作,结果见表5。表5水提工艺验证试验结果表明,该工艺稳定、可行。2.3分离、纯化、浓缩工艺研究2.3.1分离、纯化工艺研究:中药药材经煎煮后的煎液中会有很多泥沙、药渣碎片和无效物的大分子杂质,这些物质是影响中药制剂服用量及口感的主要因素。根据工业化生产的设备条件和工艺要求,选择过滤法和沉降法进行处理。过滤法:使用不锈钢板框过滤机。将药液从提取罐通过板框过滤器过滤可以除去大多数固体杂质。沉降法:经过板框过滤器过滤后的药液贮藏于立式沉降罐中静置过夜,在沉降罐的底部有许多沉淀,沉淀主要是药材的碎片和不溶性的杂质。工业化操作中,考虑到实际情况,确定按下列顺序除杂:2.3.2浓缩与干燥工艺研究:浓缩条件:经过过滤、沉降处理后的药液,使用减压浓缩罐,将药液浓缩至相对密度为1.30(80℃)。干燥条件:颗粒的干燥采用60℃~80℃干燥。2.4.制剂成型工艺研究:中药浸膏与适量的赋形剂混合,制软材后,过筛,干燥,整粒之后就可以制备成颗粒剂。应用比较广泛的中药制剂赋形剂有蔗糖、淀粉、糊精、乳糖等。据报道,泌尿系结石病人吃糖过多,不仅有碍结石治疗,还会促进结石进一步生长[44,45],故本品的辅料不能用蔗糖。而且,本颗粒剂是水溶性颗粒剂,故也不能选用淀粉为赋形剂。中药无糖型颗粒剂,目前比较常用的赋形剂有糊精、可溶性淀粉、乳糖、微晶纤维素等。加入不同种类的赋形剂,会对中药颗粒的质量产生很大影响。本实验根据有关文献资料和预试验结果,对糊精、可溶性淀粉、及乳糖等进行比较分析。以成型率、水分、溶化性为考察指标,进行综合性评价。2.4.1仪器与试药2.4.1.1仪器:筛子(一号、四号,药典筛);电热恒温鼓风干燥箱(DHG-914,上海一恒科技有限公司)。2.4.1.2试剂:可溶性淀粉(天津市天力化学试剂有限公司);糊精、甘露醇、微晶纤维素(MCC)(北京奥博星生物技术责任有限公司);乳糖(上海试剂三厂);酒精(天津市化学试剂三厂);甜菊素(曲阜香州甜菊制品有限责任公司)。2.4.2辅料筛选2.4.2.1最小辅料用量考察2.4.2.1.1实验方法:称取2.3.2项下的浸膏l0g,共12份,分别与可溶性淀粉、糊精、乳糖、甘露醇、微晶纤维素按表6中的比例混匀,以85%的乙醇溶液为湿润剂,至“手捏成团,压之即散”,制成软材,再用一号的筛子制成颗粒,及时放置于烘箱中,于80℃干燥5小时,将颗粒取出,最后用四号的筛子整粒,即得。2.4.2.1.2实验结果:结果见表6。表6辅料最小用量考察表2.4.2.1.3结果分析:从上表6可以得出以下结论,浸膏与辅料可溶性淀粉、糊精的最小用量比例为1:1.5;浸膏与辅料乳糖、甘露醇的最小比例为1:3;浸膏与微晶纤维素的最小比例为1:1。2.4.2.2单一辅料的考察2.4.2.2.1试验方法:称取2.3.2项下的浸膏10g,共5份,分别与辅料可溶性淀粉、糊精、乳糖、甘露醇、微晶纤维素混匀,辅料的用量均为30g,以85%的乙醇溶液为湿润剂,制成软材,用一号筛制成颗粒,将颗粒置于烘箱中,80℃干燥5小时,取出放凉,再用12目的筛子整粒,即得。分别用以下方法测定已经制备的五份颗粒样品的成型率、溶化性、吸湿性。成型率的测定:将已经制备好的泽泻排石防石颗粒称重,记录,然后先过一号筛,收集通过一号筛的颗粒,这部分颗粒再过四号筛,收集不能通过四号筛的颗粒,称重,记录。再用下面的公式分别计算各组颗粒成型率。成型率=过筛后颗粒质量/过筛前颗粒质量×100%。溶化性的测定:依照《中国药典》2010版一部附录IC颗粒剂“溶化性”所规定,取已经制备好的颗粒剂10g,加入热水200ml,搅拌至全部,记录时间,观察。吸湿性的测定:称取一定量的泽泻排石防石颗粒样品,置于30℃的烘箱中恒重48小时。在底部放有NaCl饱和溶液的玻璃干燥器中定时放入NaCl,直到形成NaCl的过饱和溶液,此时放有NaCl饱和溶液的玻璃干燥器内的相对湿度是75%。在已恒重的扁称量瓶底部放入约2mm厚的颗粒,准确称重后置于上述干燥器中(扁称量瓶打开)48个小时后再次称量,计算吸湿百分率,各做两组,计算其平均值。再用下面的公式分别计算各组颗粒的吸湿率。吸湿百分率%=(吸湿后重量-吸湿前重量)/吸湿前重量×100%2.4.2.2.2试验结果:结果见表7。表7颗粒性能指标测定表辅料成型率(%)溶化时间(S)72h吸湿率(%)糊精91.4012519.16乳糖92.308012.74甘露醇91.609011.96可溶性淀粉87.20150(呈混悬状)19.86Mcc92.10有沉淀14.35成型率:乳糖>MCC>甘露醇>糊精>可溶性淀粉。融化时间:可溶性淀粉>糊精>甘露醇>乳糖。吸湿率:可溶性淀粉>糊精>MCC>乳糖>甘露醇。2.4.2.2.3结果分析:综合各项结果,MCC不溶于水,不可用;乳糖、甘露醇成型率高、溶化时间短、吸湿率小,但是辅料用量较大,价格较贵,也不适用;糊精、可溶性淀粉最小辅料用量较小,可以考虑。2.4.2.3混合辅料的考察2.4.2.3.1试验方法:称取2.3.2项下的浸膏10g,共6份,按表8分别与不同比例的混合辅料混合,混合辅料的用量均为30g,以85%的乙醇溶液为湿润剂,制成软材,用一号筛制成颗粒,将颗粒置于烘箱中,80℃干燥5小时,取出放凉,再用一号筛整粒,即得。按2.4.2.2.1中的方法分别测定已经制备的六份颗粒样品的成型率、溶化性、吸湿性。2.4.2.3.2试验结果:结果见表8。表8不同比例混合辅料优选辅料比例溶化时间(s)成型率(%)糊精:可溶性淀粉5:012095.264:113093.383:213093.262:313093.351:414089.830:515087.222.4.2.3.3结果分析:单独用糊精制粒的效果明显优于糊精可溶性淀粉混合辅料混合制粒;最终选择以糊精为稀释剂;用量取其最小辅料用量1:1.5。2.4.2.4矫味剂的选择及用量的筛选:泽泻排石防石颗粒原药液较苦,口服难以下咽,需要对其口感进行改善。根据泽泻排石防石颗粒所含药物成分及剂型的特点,选择加入矫味剂较为合适。为掩盖药液的苦味应加入甜味剂。甜菊素又称作甜菊糖,是甜叶菊叶子提取物,不含糖分和热量;色泽白色至微黄色,口感适宜、无异味,其天然低热值并且非常接近蔗糖口味,甜度约为蔗糖的150~300倍,是发展前景广阔的新糖源。甜菊素属非发酵性物质,性质稳定,不易霉变,长期食用不会引起龋齿,同时有利于降低粘稠度,抑制细菌生长,延长产品保质期。甜菊素是目前世界已发现并经我国卫生部批准使用的甜味剂,是继甘蔗、甜菜糖之外第三种有开发价值和健康推崇的天然甜味剂,被国际上誉为“世界第三糖源”。总之,甜菊素具有价格低廉、受热稳定、安全性强、甜度高、低热量、口感纯正等优点,是理想的甜味剂。故选择甜菊素代替蔗糖作为甜味剂。2.4.2.4.1试验方法:取2.3.2项下的浸膏30g,加入1.5倍的糊精(45g),以85%的酒精为湿润剂,制成颗粒。取制得的颗粒30g,平均分为6份,每份5g,按表9比例加入甜菊素,混匀,分别加入100ml开水溶化后,多人品尝。2.4.2.4.2试验结果:结果见表9。表9甜菊素用量优选试验结果取样量(g)甜菊素用量比例(%)口感50.1苦50.2苦50.3略苦50.4适中50.5过甜50.6过甜2.4.2.4.3结果分析:从上表可知,甜菊素用量在0.4%时,口感适中,最为合适。2.4.3制粒正交试验研究:目前工业化生产中应用最广泛的一种制粒方法就是湿法制粒,主要原因的它对设备要求不高,操作简便。因此泽泻排石防石颗粒亦选择湿法制粒。即浸膏中加入1.5倍糊精与0.004倍的甜菊素,制成颗粒,干燥。并用正交实验法筛选最佳制粒工艺条件。2.4.3.1试验方法:由预实验及文献资料可知,浸膏相对密度,湿润剂酒精的用量与浓度为影响颗粒成型率的主要因素,各取三个水平,进行正交试验,表头设计见表10。表10因素水平表根据上述因素水平表,选择L9(34)正交实验表进行实验,即:取100g清膏,加入1.5倍的糊精,0.4%倍的甜菊素,按设计的正交表要求进行实验。另分别计算颗粒的成型率。2.4.3.2试验结果:试验结果如下表11、12中所示。表11.正交试验设计及结果表12方差分析方差来源偏差平方和自由度F比显著性A684.14219*B71.28219C79.20219D33.95219“*”表示显著性。2.4.3.3结果分析:对表11、表12数据进行处理及方差分析,以合格颗粒的百分率为评价指标,结果表明因素A有显著性:A2>A3>A1,应取最佳值A2,因素B、C不具有显著性;实验选定最佳工艺条件组合为A2B2C2,即浸膏相对密度为1.30,喷入10%倍量80%乙醇制粒。2.4.3.4试验验证:按已经选定的实验方法验证3次,分别计算颗粒的成型率,结果见表13。表13验证试验结果以上结果表明,泽泻排石防石颗粒成型工艺的验证试验结果与正交试验结果一致,说明本工艺稳定、可行。本发明药剂制法及工艺流程图见图2和实施例。3.2泽泻排石防石颗粒的质量标准制定及起草说明3.2.1名称:泽泻排石防石颗粒:本方由泽泻、车前草、广金钱草、茯苓和桂枝五味药组成。临床上可用于膀胱气化不利,湿热蕴结下焦,尿液受湿热煎熬,浊质凝结,阻碍气机,气血运行不畅所致的砂淋、石淋。方中“利水第一良品”泽泻为君药,组方具有清热利湿、通淋排石之功效,故名“泽泻排石防石”。颗粒剂具有方便,稳定,口感好,可以冲入水中饮入,应用和携带比较方便,溶出和吸收速度较快等优点,故剂型选择为颗粒剂。根据《中国药品通用名称》命名原则中的相关规定“制剂药品的命名,药品名称列前,剂型名列后”、“制剂药品名称中说明用途或特点等的形容词宜列于药名之前”、“采用主要药材名和功能结合并加剂型命名”,将本品命名为“泽泻排石防石颗粒”3.2.2处方:同正文,见前文。3.2.3制法:同正文,见前文。3.2.4性状同正文。中试各批成品均与正文描述一致。3.2.5鉴别3.2.5.1仪器与试剂:硅胶G薄层板(上海科兴商贸有限公司)、聚酰胺薄膜(浙江省台州市路桥四甲生化塑料厂出品)、玻璃点样毛细管(华西医科大学仪器厂生产)、HH-4型数显恒温水浴锅(江苏省金坛市阳光仪器厂)、超声波清洗机(MP5200H,陕西鹏展科技有限公司)、十万分一电子分析天平(沈阳龙腾电子有限公司);甲醇、水、乙酸、丁酮、甲酸、三氯甲烷、乙醚、石油醚、乙酸乙酯、、硫酸、香草醛、三氯化铝;夏佛塔苷对照品(批号为:110227)购于成都蒲菲德生物制品有限公司;广金钱草对照药材(供鉴别用,批号为:121248)、桂枝对照药材(供鉴别用,批号为:121191),购于中国药品生物制品检定所;泽泻排石防石颗粒(20130912、20130916、20130920,自制)。3.2.5.2广金钱草的薄层鉴别:供试品溶液的制备取泽泻排石防石颗粒样品1g,研细,置具塞锥形瓶中,加入80%的甲醇25ml,超声处理20min,过滤,滤液蒸干,残渣用10ml50%的甲醇溶液溶解,既得。同法制备3批样品。对照药材溶液的制备:取广金钱草对照药材粉末0.2g,与供试品同法制备。对照品溶液的制备:取广金钱草对照品夏佛塔苷适量,加50%甲醇制得约75ug/ml的夏佛塔苷对照品溶液。阴性对照溶液的制备:按照处方量称取除广金钱草以外的各味药材,按泽泻排石防石颗粒的制备方法制得阴性颗粒样品,再取1g,按照供试品溶液的制备方法制备缺广金钱草阴性对照溶液。薄层层析:取三批供试品溶液、对照品溶液、阴性样品溶液、对照药材溶液各1ul,分别点于同一聚酰胺薄膜上,以甲醇-水-乙酸(10:10:0.5)溶液为展开剂,展开,取出,晾干,喷以1%AlCl3显色剂,吹干,置紫外灯(365nm)下检视。供试品色谱中,在与对照品色谱、对照药材色谱相应的位置上,显相同淡蓝色荧光斑点。阴性对照溶液无相应的斑点,无干扰,见图3。收入本品的质量标准正文中。3.2.5.3桂枝的薄层鉴别:1、供试品溶液的制备取泽泻排石防石颗粒样品5g,研细,置于具塞锥形瓶中,加入乙醚30ml,浸泡20min,时时振摇,过滤,滤液蒸干,残渣加三氯甲烷1ml,使溶解,即得。同法制备3批样品。2、对照药材溶液的制备取桂枝对照药材粉末5g,加200ml水煎煮30min,滤过,药渣再加200ml水煎煮30min,合并煎煮液浓缩至20ml,用乙醚20ml振摇提取2次,合并乙醚层,水浴蒸干,残渣加三氯甲烷1ml,使溶解,即得。3、阴性样品溶液的制备取处方量除桂枝以外的各味药材按成品的制备方法制得阴性样品,再取5g,按制备供试品溶液的制备方法同法制备缺桂枝阴性样品溶液。4、薄层层析取供试品溶液、阴性样品溶液、对照药材溶液各10ul,分别点于同一硅胶G薄层板上,以石油醚(60-90℃)-乙酸乙酯(15:5)溶液为展开剂,展开,取出,晾干,喷以2%香草醛硫酸溶液显色剂,105℃加热至显色均匀。供试品色谱中,在与对照药材色谱相应的位置上,显相同黄色主斑点。阴性对照溶液则无相应斑点,没有干扰见图4。收入本品的质量标准正文中。3.2.5.4泽泻的薄层鉴别:采用各种方法,供试品色谱中,在与对照品色谱、对照药材色谱相应的位置上,都无相应的斑点。故没有收入本品的质量标准正文中。3.2.5.5车前草的薄层鉴别:采用各种方法,供试品色谱中,在与对照品色谱、对照药材色谱相应的位置上,都无相应的斑点。故没有收入本品的质量标准正文中。3.2.5.6茯苓的薄层鉴别:采用各种方法,都无法排除阴性干扰。故没有收入本品的质量标准正文中。3.2.6检查3.2.6.1粒度:依照2010年版《中国药典》一部附录IC颗粒剂项下“粒度”中所规定的测定方法:采用双筛分法对泽泻排石防石颗粒的粒度进行检查,取供试品30g(取单剂量包装颗粒6包),称定其重量,置于一号筛中,下放四号筛上。左右往返,保持水平状态过筛,边筛动边轻叩3分钟,取不能过一号筛和能通过四号筛的颗粒及粉末,称定总重量,计算其所占颗粒总重的百分比,不得过15%[43]。结果见表14。表14粒度检查结果表结果表明,泽泻排石防石颗粒的粒度符合规定。3.2.6.2水分:依照2010年版《中国药典》一部附录IC颗粒剂项下“水分”中所规定的测定方法:取颗粒2-5g,精密称定,平铺于已经干燥至恒重的扁形称量瓶中,其厚度不超过5mm,精密称定,打开盖子,在105℃烘箱中干燥5小时,将瓶盖盖好,移于干燥器中,冷却0.5小时后,精密称定,再在上述温度条件下干燥1小时,至恒重为止,根据颗粒减轻的重量,计算颗粒的含水量(%),不得过6.0%[43]。结果见表15。表15水分检查察结果表批号123Mean(%)RSD(%)1309124.374.344.514.412.061309163.953.954.083.991.881309204.184.124.264.191.68结果表明,泽泻排石防石颗粒的水分符合规定。3.2.6.3溶化性:依照《中国药典》2010版一部附录IC颗粒剂“溶化性”中所规定的测定方法:取供试品颗粒剂一袋,加热水200ml,搅拌五分钟,立即观察[43];结果见表16。表16溶化性检查结果表批号溶化性130912全部溶解130916全部溶解130920全部溶解结果表明,泽泻排石防石颗粒的溶化性符合规定。3.2.6.4装量差异:按照《中国药典》2010版一部附录IC颗粒剂“装量差异”中所规定的测定方法[43]:取供试品10袋,分别称定每袋内容物的重量,每袋装量与标示装量相比较。对泽泻排石防石颗粒的装量差异进行检查,结果见表17。表17装量差异检查结果表批号重量差异130912符合规定130916符合规定130920符合规定结果表明,泽泻排石防石颗粒的装量差异符合规定。3.2.6.5微生物限度:依照《中国药典》2010版一部附录IC颗粒剂“微生物限度”中所规定的检测方法[43]:细菌的数目应≤1000个/g;霉菌、酵母菌的数目≤100个/g;大肠杆菌不得检出。用常规法对泽泻排石防石颗粒进行检查。结果见表18。表18微生物限度检查结果表明,泽泻排石防石颗粒的微生物限度符合规定。综上所述,泽泻排石防石颗粒的相关检查项目均符合规定,可以执行上述标准。3.2.7含量测定3.2.7.1仪器与试药:十万分之一电子分析天平(沈阳龙腾电子有限公司)、双量程电子分析天平AUW-220D型(SHIMADZUCORPORATIONJAPAN)、Agilent1100series高效液相色谱仪、AgilentTC-C18(4.6mm×250mm)色谱柱;乙腈(美国TEDIA公司,色谱纯)、重蒸水;大车前苷对照品(批号为:111914),供含测用,购于中国药品生物制品检定所;夏佛塔苷对照品(批号为:110227)供含测用,购于成都蒲菲德生物制品有限公司。3.2.7.2大车前苷含量测定方法的建立3.2.7.2.1色谱条件:确定UV检测波长为330nm,进样量为10μl,通过改变流动相比例,以及流速等,以目标峰保留时间T、峰型、分离度以及对称度等作为考察指标,选择最佳色谱条件,最终确定的色谱条件为:色谱柱:AgilentTC-C18(4.6mm×250mm)色谱柱;流动相:乙腈-水(18:82);流速:0.7ml/min;UV检测波长:330nm;柱温:30℃;进样量:10μl。在选定的条件下,大车前苷与其他组分色谱峰可达到基线分离,大车前苷色谱峰与相邻色谱峰分离度大于1.5;理论塔板数按大车前苷计算大于3000。3.2.7.2.2对照品溶液的配制:精密称取大车前苷对照品适量,加60%甲醇制成对照品溶液(0.0212mg/ml),0.45um滤膜过滤,取续滤液,即得。3.2.7.2.3供试品溶液的配制:取装量差异项下的本品,混匀,取适量,研细,取约2.5g,精密称定,置于具塞锥形瓶中,精密量取50ml60%甲醇溶液,称重,超声(功率250W,频率50KHZ)30min,放冷,称重,用60%甲醇溶液补足减失的重量,用0.45μm滤膜过滤,取续滤液,即得。3.2.7.2.4专属性试验:制备缺车前草阴性颗粒样品,按供试品溶液的配制方法配制。分别吸取对照品溶液、供试品溶液、阴性样品溶液各10μl,注入液相色谱仪中测定,结果表明:车前草阴性样品溶液没有干扰。见图5、图6、图7。3.2.7.2.5线性关系的考察:分别精密移取0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml对照品溶液于1ml容量瓶中,60%甲醇定容为系列浓度的对照品。在已确定的色谱条件下测定各组浓度大车前苷对照品的峰面积,以进样量(C)为横坐标,峰面积(A)为纵坐标,建立标准曲线。求得回归方程为:y=35456x–18.539,r=0.9992;结果表明大车前苷进样量在0.0212~0.212μg内呈线性(见表19、图8)。表19线性关系考察结果3.2.7.2.6精密度试验:精密吸取大车前苷对照品溶液,在确定的色谱条件下重复进样6次,记录峰面积,求RSD值。表20大车前苷精密度试验(n=6)3.2.7.2.7稳定性试验:取一定浓度大车前苷对照品溶液,在HPLC条件下于0、1、2、4、6、8h分别进样,记录峰面积,求RSD值。结果见下表所示。表21大车前苷稳定性试验3.2.7.2.8重复性试验:按供试品处理方法,精密称取同一批次样品6份,按确定的色谱条件测定各组峰面积,计算含量及RSD值结果如下表所示表22大车前苷重复性试验(n=6)3.2.7.2.9准确度试验(回收率试验):分别精密称取0.25g本品粉末于6个10ml具塞锥形瓶中,分别吸取0.212mg/ml的夏佛塔苷溶液1.5ml加入,另加入8ml60%甲醇溶液,另取1.5ml夏佛塔苷溶液,不加样品,设为空白组,按供试品制备方法处理定容后,按建立的HPLC方法测定各组峰面积,计算大车前苷的含量,计算回收率。因在重复性试验中已经测定样品中大车前苷的平均含量为0.1296%,则加入样品的已知量(mg)=称取粉末质量(mg)×0.1296%,其结果见下表。表23大车前苷回收率结果(n=6)回收率试验结果表明:大车前苷回收率在95%~100%之间,加样回收良好。3.2.7.2.10含量限度的确定:对泽泻排石防石颗粒十批样品进行测定,结果见表24。表24样品中大车前苷含量测定结果据上述测定结果,综合考虑车前草药材的实际含量及制备工艺、大生产等因素,暂定本品每袋(每袋装5g颗粒),以大车前苷(C29H36O16)计,不得少于5.0mg。3.2.7.3夏佛塔苷含量测定方法的建立3.2.7.3.1色谱条件:确定UV检测波长为272nm,进样量为10μl,通过改变流动相比例,以及流速等,以目标峰保留时间T、峰型、分离度以及对称度等作为考察指标,选择最佳色谱条件,最终确定的色谱条件为:色谱柱:AgilentTC-C18(4.6mm×250mm)色谱柱;流动相:乙腈-水(16:84);流速:0.8ml/min;UV检测波长:272nm;进样量:10μl。在选定的条件下,夏佛塔苷与其他组分色谱峰可达到基线分离,夏佛塔苷色谱峰与相邻色谱峰分离度大于1.5;理论塔板数按夏佛塔苷计算大于3000。3.2.7.3.2对照品溶液的配制:精密称取夏佛塔苷对照品适量,加50%甲醇制成对照品溶液(0.01288mg/ml),0.45μm滤膜过滤,取续滤液,即得。3.2.7.3.3供试品溶液的配制:取装量差异项下的本品,混匀,取适量,研细,取约1g,精密称定,置于具塞锥形瓶中,精密量取50ml50%甲醇溶液,称重,超声(功率250W,频率50KHZ)30min,放冷,称重,用50%甲醇溶液补足减失的重量,用0.45μm滤膜过滤,取续滤液,即得。3.2.7.3.4专属性试验:制备缺广金钱草阴性颗粒样品,按照供试品溶液的配制方法进行配制。分别吸取对照品溶液、供试品溶液、阴性样品溶液各10μl,注入液相色谱仪中进行测定,结果表明:阴性样品溶液没有产生干扰(见图9、图10、图11)。3.2.7.3.5线性关系考察:取夏佛塔苷对照品溶液(0.01288mg/ml),分别精密移取0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml对照品溶液于1ml容量瓶中,50%甲醇定容为系列浓度的对照品。在已确定的色谱条件下测定各组浓度对照品的峰面积,以各组溶液夏佛塔苷的浓度为横坐标,峰面积A为纵坐标,建立标准曲线。求得回归方程为:y=37299X-16.1114,r=0.9995。结果表明夏佛塔苷进样量在0.01288~0.1288μg内呈线性(见表25,图12)。表25线性关系考察结果3.2.7.3.6精密度考察精密吸取夏佛塔苷对照品溶液,在确定的色谱条件下重复进样6次,记录峰面积,求RSD值。表26夏佛塔苷精密度试验(n=6)3.2.7.3.7稳定性试验:取一定浓度夏佛塔苷对照品溶液,在HPLC条件下于0、1、2、4、6、8h分别进样,记录峰面积,求RSD值。结果见下表所示。表27夏佛塔苷稳定性试验3.2.7.3.8重复性试验:按供试品处理方法,精密称取同一批次样品6份,按确定的色谱条件测定各组峰面积,计算含量及RSD值结果如下表所示表28夏佛塔苷重复性试验(n=6)3.2.7.3.9准确度试验(回收率):分别精密称取0.1g本品粉末于6个10ml具塞锥形瓶中,移液管吸取0.1288mg/ml夏佛塔苷对照品溶液2ml,另加入7ml50%甲醇溶液,另取2ml对照品溶液,不加样品,设为空白组,按供试品制备方法处理定容后,按建立的HPLC方法测定各组峰面积,计算夏佛塔苷的含量,计算回收率。因在重复性试验中已经测定样品中夏佛塔苷含量为0.2581%,则加入样品的已知量(mg)=称取粉末质量(mg)×0.2581%,其结果见下表。表29夏佛塔苷回收率结果(n=6)3.2.7.3.10含量限度的确定:对泽泻排石防石颗粒的十批样品进行含量测定,测定的结果见表30。表30样品中夏佛塔苷含量测定表据上述测定结果,综合考虑广金钱草药材的实际含量及制备工艺、大生产等因素,暂定本品每袋(每袋装5g)以夏佛塔苷(C26H28O14)计算,不得少于8.0mg。3.2.7.4小结:泽泻排石防石颗粒的质量标准中建立了广金钱草、桂枝的薄层鉴别方法;建立了大车前苷、夏佛塔苷的高效液相色谱含量测定方法。经验证,方法科学、稳定、可靠。附图说明图1药材吸水率考察图。图2泽泻排石防石颗粒的工艺流程图。图3薄层层析图。图4薄层层析图。图5大车前苷对照品HPLC图。图6泽泻排石防石颗粒样品HPLC图。图7阴性样品溶液HPLC图。图8大车前苷标准曲线。图9夏佛塔苷对照品HPLC图。图10泽泻排石防石颗粒样品HPLC图。图11阴性样品溶液HPLC图。图12夏佛塔苷标准曲线。具体实施方式实施例1:取泽泻、车前草、广金钱草、茯苓和桂枝五味药材,加8倍量水,煎煮二次,每次2小时,合并煎液,滤过,滤液浓缩至适量相对密度约1.30(80℃),加入1.5倍糊精、0.004倍的甜菊素及10%倍量的80%乙醇,混匀,制成颗粒,干燥,整粒,制成1000g,即得。本发明提供的泽泻排石防石颗粒剂的工艺流程图见图2。本发明提供的泽泻排石防石颗粒剂的功能主治:清热利尿,排石防石。主治下焦湿热所致的热淋、石淋,症见尿黄尿痛,腰腹疼痛;尿路结石(肾结石、输尿管结石),见上述症候者。预防泌尿系结石的形成及复发。建议的用法用量:开水冲服。一次1袋,一日3次。建议规格:每袋装5g。密封贮藏,有效期暂定12个月。工艺流程图见图2。本颗粒一个处方量(54g)的药材能出膏6g左右,以每日服用三次计算,每次需服用干膏量为2g。药物与辅料的比例为1:1.5。因此本品颗粒规格约为每袋装5g。按1000个制剂单位即(l000g)计算,泽泻排石防石颗粒一个制剂处方生药量为3600g,制成颗粒l000g。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1