一种掺杂纳米羟基磷灰石的多孔仿生骨支架的制备方法与流程
本发明涉及新型生物材料和组织工程技术领域,具体涉及一种掺杂纳米羟基磷灰石的多孔仿生骨支架的制备方法。
背景技术:
:
本发明以组织工程为依托。骨组织工程是临床上修复骨缺损的有效途径之一,近年来受到国内外学者的广泛关注。骨组织工程的三要素或四要素,主要包括支架材料、种子细胞、细胞与支架材料的整合以及植入物与体内微环境的整合,其过程是指将种子细胞在体外进行扩增培养,然后将扩增的细胞移植到具有良好生物相容性、可降解性的支架材料上继续培养,使细胞粘附在支架上形成细胞-支架复合物;将该复合物植入骨缺损部位,随着支架的降解和被吸收,植入的细胞在体内不断增殖并分泌细胞外基质,最终形成骨组织,从而达到修复创伤和重建功能的目的。支架材料作为骨组织工程的重要组成部分,为细胞获取营养、生长和代谢提供了良好的微环境。骨组织工程的发展提供了一种组织再生的技术手段,将改变外科传统的“以创伤修复创伤”的治疗模式,迈入无创伤修复的新阶段。
骨组织工程支架材料分为人工合成高分子材料和天然高分子材料两大类。合成高分子材料主要有聚乳酸、聚己内酯、聚乙烯醇等。其最显著特点是具有良好的力学和加工性能,能满足许多组织工程的要求,显示出良好的成骨效应。缺点是难降解,残余的溶剂对机体产生不利影响。天然高 分子材料有胶原、明胶、透明质酸、壳聚糖、羟基磷灰石等,它们均无毒,具备良好的生物相容性及细胞亲和性,形成的支架可仿生机体细胞外基质,为细胞增殖、分化提供仿生3D空间。
透明质酸属蛋白多糖,广泛存在于身体组织的基质中,是骨组织的重要有机成分。透明质酸具有高度的吸水能力和固有的膨胀性,在生物介质中透明质酸能够促进细胞渗透进入支架内部,透明质酸可以通过与成骨细胞表面特异性受体α整合素亚单位紧密结合,增强细胞迁移、黏附、增殖和分化来诱导新骨形成,也可以诱导间充质细胞分化从而加速形成新骨。明胶是胶原蛋白部分水解的产物,无毒、几乎无抗原性,并且仍然保留着胶原的细胞粘附信号肽序列RGD,能够提高细胞粘附能力,生物降解性和生物相容性好。采用明胶制备的骨支架具有一系列优良的特性,如提高抗压强度和细胞粘附能力,可促进细胞的粘附、增殖、分化等行为。明胶-羟基磷灰石复合支架中成骨细胞的粘附、增殖能力,碱性磷酸酶活性和骨钙蛋白表达能力很强。羟基磷灰石同骨的无机成分相近,有较好的生物相容性和骨传导性,可与人体骨形成牢固的化学键合,因而被认为是一种最具潜力的人体硬组织替换材料。人工合成的纳米羟基磷灰石具有更强的生物活性,其生物力学强度比天然羟基磷灰石好。
近年来,透明质酸、明胶和纳米羟基磷灰石因其独特的理化性质和生理功能,在医学方面已得到广泛应用。文献已报道采用透明质酸-明胶、明胶-羟基磷灰石、透明质酸-羟基磷灰石等为材料构建的支架,而透明质酸-明胶-纳米羟基磷灰石复合支架的制备却尚未报道,因此综合透明质酸、明胶的理化和生理特性,羟基磷灰石的骨传导特性,本发明制备了一种多孔 透明质酸-明胶-纳米羟基磷灰石仿生骨支架。
技术实现要素:
本发明的目的是提供一种掺杂纳米羟基磷灰石的多孔仿生骨支架的制备方法,该方法制备过程稳定,产物形貌均一可控,操作简单。
本发明采用冷冻干燥法和化学交联相结合,制备多孔透明质酸-明胶-纳米羟基磷灰石仿生复合骨支架,具体步骤如下:
(1)、分别配置透明质酸和明胶水溶液,搅拌去除气泡,将上述两种溶液混合,配置成透明质酸-明胶溶液;
(2)、将纳米羟基磷灰石超声分散处理后,加入到步骤(1)的混合溶液中,形成纳米羟基磷灰石的透明质酸-明胶悬浮液;
(3)、将步骤(1)所得脱泡的透明质酸-明胶溶液和步骤(2)所得脱泡的透明质酸-明胶-纳米羟基磷灰石混合溶液注入到模具中,预冷冻至结晶,移入冷冻干燥机中冷冻干燥,即得到复合支架;
(4)、将冻干后的复合支架取出,并转移至24孔板,加入化学交联剂,室温交联,确保交联完全;将所有支架反复冲洗至中性,将支架在预冷冻至结晶,再次冷冻干燥即得交联后的复合多孔仿生骨支架。
本发明所述多孔仿生骨支架各组分均为天然生物材料,透明质酸和明胶具有良好的生物相容性,为细胞提供粘附位点和三维多孔结构;纳米羟基磷灰石是人骨骼的重要无机组分,具有良好的生物活性和骨传导作用,同时提高了支架的力学性能。相比于透明质酸、明胶和透明质酸-明胶支架,纳米羟基磷灰石的引入,提高了该复合支架的力学性能和骨传导性。
本发明所述多孔仿生骨支架制备过程中,纳米羟基磷灰石经超声分散处理,防止纳米颗粒在透明质酸-明胶溶液中聚团;溶液混合后尽快注入模具,防止纳米颗粒沉降,造成纳米颗粒在溶液中分散不均。
本发明所述多孔仿生骨支架采用化学交联方法制备,交联剂为碳化二亚胺和N-羟基琥珀酰亚胺的乙醇水混合溶液(优选pH=5),交联温度为室温,交联时间为6~48h。
本发明所述多孔仿生骨支架的制备过程中,通过调节透明质酸、明胶、纳米羟基磷灰石的浓度、质量百分比及冷冻干燥条件(预冷冻时间、冻干时间)和化学交联时间等,可制备出具有不同孔径、孔隙率、降解率、吸水率和机械强度的复合支架。
本发明所述掺杂纳米羟基磷灰石的多孔仿生骨支架的制备方法,其特征在于:
步骤(1)中配置的透明质酸溶液浓度为5mg/ml~15mg/ml,明胶溶液浓度为5mg/ml~0.2g/ml;上述两种溶液混合时,透明质酸溶液和明胶溶液的体积比为1:9~9:1。
步骤(2)所述混合溶液中纳米羟基磷灰石的质量浓度为1~50mg/ml。
步骤(3)、(4)中预冷冻温度在-20℃~-80℃之间;冷冻干燥时间为12~48h。
步骤(4)中所有支架用PBS反复冲洗至中性。
采用本发明所述方法制得的多孔仿生骨支架孔径为90~240μm,孔隙率>90%,细胞平均粘附率为80%,具备一定的吸水能力和降解能力。
本发明所述多孔仿生骨支架的降解实验采用溶菌酶检测,溶菌酶的浓 度为0.05~0.5mg/ml(pH=5.2),降解时间为5周。
本发明所述多孔仿生骨支架随着透明质酸含量的增加,孔径和孔隙率增加,吸水率减小,降解率增加;所述多孔仿生骨支架随着纳米羟基磷灰石含量的增加,孔径和孔隙率减小,吸水率减小,降解率增加。
采用本发明所述方法制备的透明质酸-明胶-纳米羟基磷灰石多孔复合支架孔径均一、孔壁薄、孔隙贯穿,具有很好的细胞粘附能力和机械强度,具有骨传导性。本发明的优点在于该复合支架能够更加真实的模拟骨组织微环境,通过调节各组分的浓度、体积比及冷冻干燥条件,可调控支架的孔径、孔隙率、降解率、吸水率、机械强度等参数;所用材料均具备良好的生物相容性,形成的支架满足骨组织的内部多孔结构;材料来源充足,制备工艺简单。
附图说明
图1:掺杂纳米羟基磷灰石的多孔仿生骨支架的制备示意图。
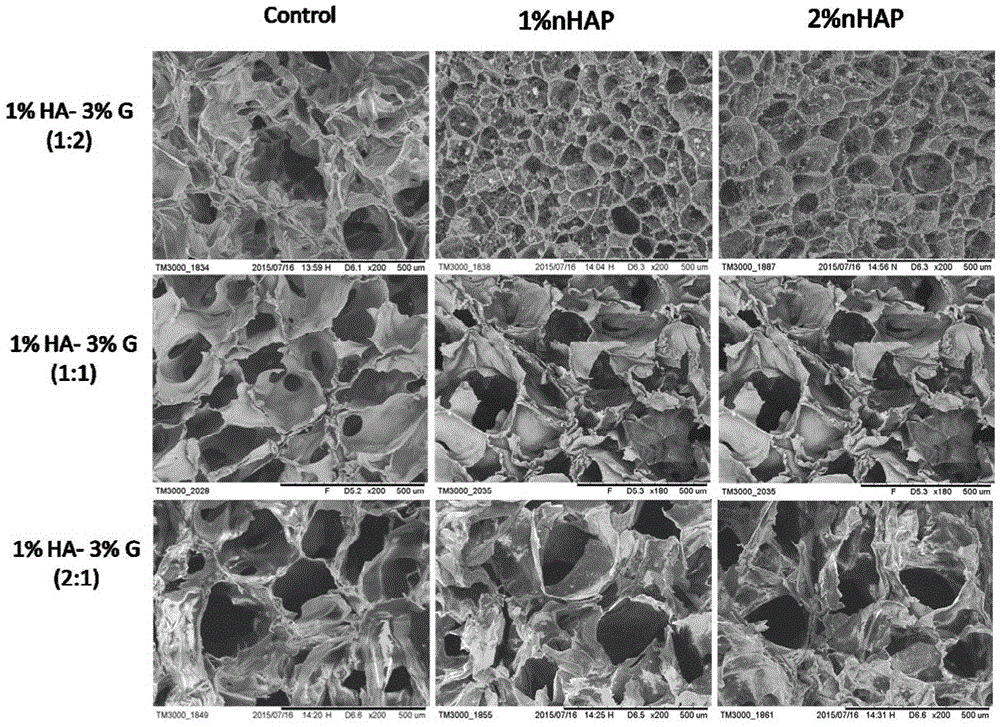
图2:不同组分掺杂纳米羟基磷灰石的多孔仿生骨支架的扫描电镜图片。
图3:不同组分掺杂纳米羟基磷灰石的多孔仿生骨支架的降解率。
图4:掺杂纳米羟基磷灰石的多孔仿生骨支架的傅里叶红外图谱。
图5:复合支架与成骨前体细胞共培养的扫描电镜图片。
图6:复合支架与成骨前体细胞共培养的ALP染色图片。
具体实施方式
实施例1:
掺杂纳米羟基磷灰石的多孔透明质酸(5mg/ml)-明胶(5mg/ml)复合 支架的制备:
在60℃水浴下,将透明质酸、明胶分别溶于三蒸水制得5mg/ml透明质酸溶液和5mg/ml明胶混合液;搅拌去除气泡,将上述两种溶液混合,配置成体积比为1:9和9:1的透明质酸-明胶溶液;
纳米羟基磷灰石超声分散处理后,按不同质量比加入到上述溶液中(其中一种溶液不添加纳米羟基磷灰石),形成不含纳米羟基磷灰石的透明质酸-明胶悬浮液、含有1mg/ml纳米羟基磷灰石和50mg/ml纳米羟基磷灰石的透明质酸-明胶悬浮液;
将上述透明质酸-明胶、透明质酸-明胶-纳米羟基磷灰石混合液静置除泡,注入模具,-80℃预冷冻3h以上,真空冷冻干燥24h,即得到不同比例复合支架。
冻干后的复合支架用水溶性碳化二亚胺和N-羟基琥珀酰亚胺进行化学交联,交联剂使支架发生官能团反应。将冻干后的三组复合支架小心取出,将支架转移至24孔板,每孔加入2mL含50mM碳化二亚胺、20mM N-羟基琥珀酰亚胺的95%乙醇-5%水混合溶液(pH=5),室温交联24h,确保交联完全;交联后吸出交联剂,将所有支架用PBS反复冲洗至中性;将支架在-80℃预冷冻3h,再次冷冻干燥即得交联后的复合支架。
实施例2:
掺杂纳米羟基磷灰石的多孔透明质酸(15mg/ml)-明胶(0.2g/ml)复合支架的制备:
在60℃水浴下,将透明质酸、明胶分别溶于三蒸水制得15mg/ml透明 质酸溶液和0.2g/ml明胶混合液;搅拌去除气泡,将上述两种溶液混合,配置成体积比为1:9和9:1的透明质酸-明胶溶液;
纳米羟基磷灰石超声分散处理后,按不同质量比加入到上述溶液中(其中一种溶液不添加纳米羟基磷灰石),形成不含纳米羟基磷灰石的透明质酸-明胶悬浮液、含有1mg/ml纳米羟基磷灰石和50mg/ml纳米羟基磷灰石的透明质酸-明胶悬浮液;
将上述透明质酸-明胶、透明质酸-明胶-纳米羟基磷灰石混合液静置除泡,注入模具,-80℃预冷冻3h以上,真空冷冻干燥24h,即得到不同比例复合支架。
冻干后的复合支架用水溶性碳化二亚胺和N-羟基琥珀酰亚胺进行化学交联,交联剂使支架发生官能团反应。将冻干后的三组复合支架小心取出,将支架转移至24孔板,每孔加入2mL含50mM碳化二亚胺、20mM N-羟基琥珀酰亚胺的95%乙醇-5%水混合溶液(pH=5),室温交联24h,确保交联完全;交联后吸出交联剂,将所有支架用PBS反复冲洗至中性;将支架在-80℃预冷冻3h,再次冷冻干燥即得交联后的复合支架。
图1为掺杂纳米羟基磷灰石的多孔仿生骨支架的制备流程示意图。复合支架的扫描电镜如图2所示,扫描电镜观察复合支架呈多孔结构,孔隙及内部结构均匀,孔内部贯穿性很高,大孔内部有许多小孔,有利于营养物质和代谢物质在支架内部的传输。支架表面及孔壁粗糙,孔壁较薄,有利于细胞粘附。由表1和图3可知,复合支架的孔径、孔隙率、吸水率、粘附率、降解率各不相同。上述参数均与复合支架各组分的最终质量浓度有关。随着透明质酸含量的增加,复合支架的孔径和孔隙率增加,吸水率 降低,粘附率增加,降解率增加;所述复合支架随着纳米羟基磷灰石含量的增加,孔径和孔隙率减小,吸水率减小,降解率增加,粘附率变化不大。傅里叶红外图谱显示仿生骨支架中纳米羟基磷灰石掺杂成功(图4)。
实施例3:
掺杂纳米羟基磷灰石的多孔仿生骨支架的细胞培养以及分析评价:
将实验室自行设计并制备的复合支架灭菌处理,支架经75%乙醇浸泡3h,紫外照射1h,浸泡入含10%双抗的PBS深度灭菌。采用Ⅰ型胶原进行表面修饰后上述9组复合支架接种成骨前体细胞,接种密度为2×106个/mL,待6h细胞贴壁后补加培养基,细胞培养7天后,进行细胞死活、凋亡等方面的相关染色,细胞增殖、分化检测,Image Pro软件分析。由图5可知,成骨前体细胞呈团簇或单细胞状态分布于支架的孔隙和表面,细胞与支架、细胞与细胞之间相互连接。成骨前体细胞与复合支架共培养至第3天,只有加诱导培养基的复合支架组表达碱性磷酸酶(ALP),其他组均为表达ALP;培养至第7天,对照组和复合支架组均表达ALP;ALP表达的关系如下:加诱导培养基的复合支架组>未加诱导培养基的复合支架组>对照组,说明复合支架与诱导培养基协同作用促进成骨前体细胞分化为成骨细胞的能力(图6)。因此,本发明掺杂纳米羟基磷灰石的多孔仿生骨支架可作为一种骨组织工程支架材料。
表1不同组分的多孔仿生骨支架的孔径、孔隙率、吸水率、粘附率
其中HA:透明质酸,G:明胶水溶液,HAP:羟基磷灰石,括号中的比例关系为体积比,百分数指羟基磷灰石在质酸-明胶悬浮液中的质量百分比。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有多级缓控释效果的羟基磷灰石载药微球的制备方法与流程
- 一种羟基磷灰石包覆PRB填充材料及其制备方法和地下水除铀应用方法与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 壳聚糖/羟基磷灰石复合纤维的制备方法与制造工艺
- 一种羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石‑碳纳米管复合生物陶瓷的制备方法与制造工艺
- 羟基磷灰石吸附特性对水中钴离子的富集检测方法与制造工艺
- 以羟基磷灰石晶须增强可降解共聚物‑硅酸钙复合骨修复材料为原料的骨修复用制品的制造方法与工艺
- 一种胶原蛋白/羟基磷灰石复合人工骨及其制备方法与制造工艺