眼睛引流装置及其制造方法与流程
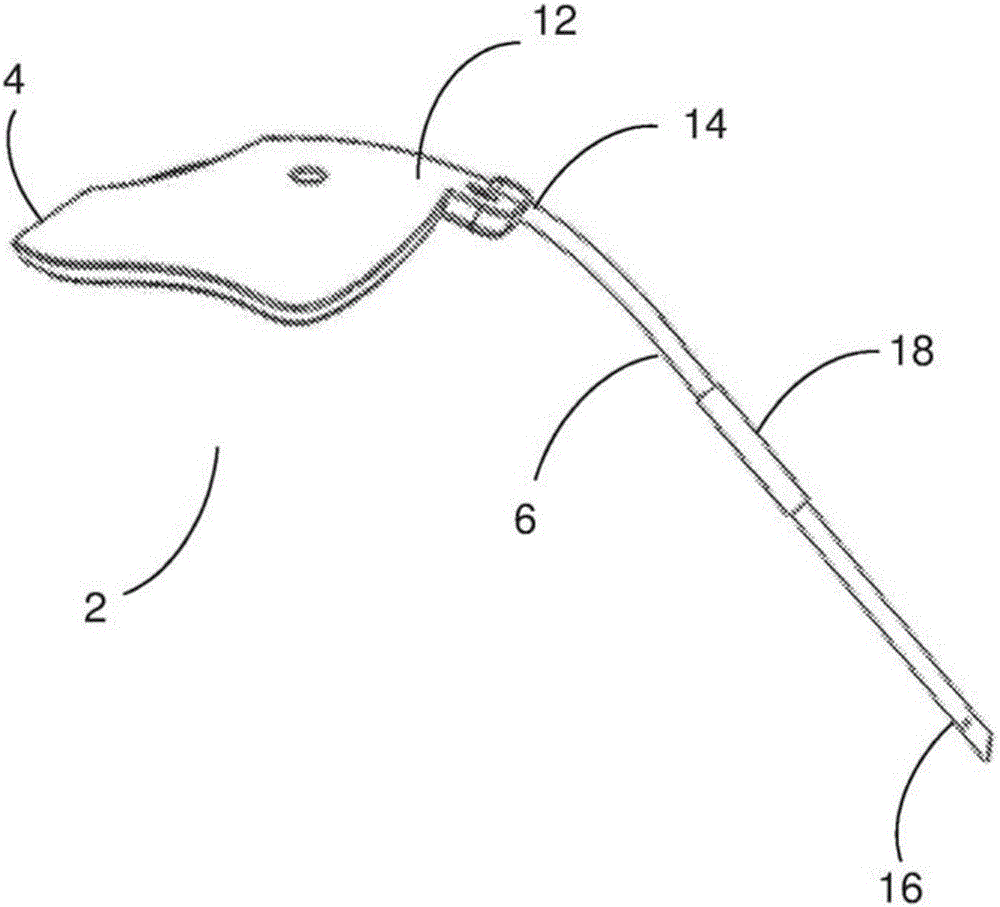
本发明通常涉及眼科领域。具体说,本发明涉及可植入的眼部装置,其包括眼部引流装置。更具体地,本发明涉及青光眼引流装置(下文称为‘GDD’),制造GDD的方法,和植入GDD的方法。
背景技术:
:青光眼如果任其发展不治疗会导致不可逆转的失明。在2010年有六千万人被诊断患有青光眼,且其中的八百万发展为失明。在由于水性流体的流入比流出更高而造成眼睛中的眼内压力(IOP)增加到正常水平以上时会发生青光眼。尽管药物疗法是有效的,但是由于药物疗法通常使用多种药物,所以一种问题是依从性(compliance)。例如,研究已经显示对于经历药物疗法的患者来说,在6个月的药物疗法中有50%的不依从性。小梁切除术,其是有创的,通常在药物疗法失败时使用。尽管小梁切除术可以是有效的,但是已经显示主要由于疤痕组织的形成而在手术之后的5年中其具有46.9%的失效率。青光眼引流装置(以下称为‘GDD’)可用于对药物治疗不依从的患者和经历了失效的小梁切除术的患者。越来越多的证据表明,在IOP控制方面,GDD(通常仅用在最不依从的情况下)与小梁切除术同样安全且有效。在一些情况下,在IOP控制方面,GDD已经被认为比小梁切除术更有效。GDD也称为青光眼过滤装置或眼液分流器,是外科植入物,其允许从眼睛内部向眼睛外部的眼内流体引流,由此降低眼内压力。GDD已经自1970年代早期使用且坚持使用两项设计标准。目前,对GDD的设计还没有显著的进步。在改善GDD的设计以消除目前可用GDD相关的问题方面存在挑战。例如,针对目前可用的GDD,在外科植入常规Baerveldt装置之后的5中显示出36%的失效率,常规的Ahmed装置可以44%的失效率。这种失效率是由于与目前可用的GDD相关的堵塞的流动、炎症和纤维包裹造成的。因此,存在的需要是,提供一种青光眼引流装置(GDD),其避免或至少改善如上所述的一个或多个缺陷。本发明的GDD的非限制性的实施例能满足这种需要。技术实现要素:本发明涉及青光眼引流装置(GDD),其具有优于目前可用的青光眼引流装置(GDD)的改善设计。本发明GDD的改善设计可允许用于植入GDD的改善手术植入技术。另外,本发明GDD的改善设计可防止与目前可用的GDD相关的并发症。进一步地,与目前可用的GDD相比,本发明GDD的改善设计可用于将减少眼内压力(IOP)的性能改善到可接受的水平。通常,与本发明的GDD相关的改善和成功率可取决于GDD的设计,用于制造GDD的材料,和/或制造GDD的方法。本发明还涉及GDD的板,其中板设计可针对水泡形成和/或流体控制而被优化。本发明还涉及GDD的管,其中管可被设计为用于流体控制,在管远端处的更容易插入,和/或在管近端处的更容易的长度修正和/或修改。本发明还涉及一机构,其设计为控制GDD的管的直径,其中针对手术植入之后的第一个四(4)到八(8)周,机构可形成用于管的更小直径。在手术植入之后八(8)周和/或超过手术植入之后八(8)周时,管的直径可增加尺寸到其原始直径和/或最终直径且因此影响离开眼睛的流体速率。另外,本发明涉及稳定性系统或流体流动控制系统,其中稳定性系统可防止与目前可用的GDD相关的并发症。稳定性系统可提供对流体流动的额外阻力,由此用作限流器,以防止术后/手术植入后立即发生的压力过低。此外,稳定性系统可用作间隔件,其防止结膜与巩膜瓣粘连,由此实现更好的水泡形成。改善的水泡形成可实现更好的长期流体流动控制,由此改善高血压阶段,该高血压阶段通常发生在术后/手术植入后一个月之后。本发明GDD的新的和独特的设计可利用经验证和可调整的可接受材料。本发明的GDD可用于改善手术植入技术;良好的术后结果。患者舒适性;和/或超过手术植入五(5)年的装置寿命,五(5)年通常是手术植入之后的目前可用的GDD的寿命。本发明的第一方面提供了用于可植入眼睛装置的板,其中板可包括:柔性材料;和管保持结构,与板整体地形成;其中管保持结构配置为在管运动时将管固定到板。在一些实施例中,可植入眼睛装置可包括眼睛引流装置。在一些实施例中,可植入眼睛装置可包括青光眼引流装置。在一些实施例中,管保持结构可包括低矮轮廓凸脊。在一些实施例中,管保持结构可包括具有马蹄铁形状的管接收通道。在一些实施例中,板可进一步包括至少一个板通道。在一些实施例中,至少一个板通道可被底切到板中。在一些实施例中,至少一个板通道可包括直径,其与管的外部直径对应。在一些实施例中,板可进一步包括贮存器。在一些实施例中,贮存器可以是被凹入的。在一些实施例中,板可进一步具有包括胶原的材料,覆盖板顶表面的至少一部分和/或贮存器的至少一部分。在一些实施例中,包括胶原的材料可包括材料,所述材料包括心包膜、心包组织、心包补片、异体巩膜或其一个或多个组合。在一些实施例中,板可进一步包括粘弹性物质,其覆盖板顶表面的至少一部分和/或贮存器的至少一部分。在一些实施例中,粘弹性材料可覆盖包括胶原的材料的至少一部分。在一些实施例中,板可包括大约24mm或更小的宽度(从左到右)。在一些实施例中,板可包括大约16mm或更小的长度(从前到后)。在一些实施例中,板可包括大约250mm2到大约360mm2的表面面积。在一些实施例中,板可进一步包括管接收孔,其中管接收孔可包括与管的外部直径对应的直径。本发明的第二方面提供用于可植入眼睛装置的管,其中管可包括:具有近端和远端的长度;和生物可降解管套。本发明的第三方面提供用于可植入眼睛装置的管,其中管可包括:具有近端和远端的长度;和0.7mm或更小的外部直径。本发明的第四方面提供用于可植入眼睛装置的管,其中管可包括:具有近端和远端的长度;其中远端被倒角。本发明的第五方面提供用于可植入眼睛装置的管,其中管可包括:具有近端和远端的长度;和一个或多个微孔。在一些实施例中,如上所述的管可包括引流管。在一些实施例中,可植入眼睛装置可包括眼睛引流装置。在一些实施例中,可植入眼睛装置可包括青光眼引流装置。在一些实施例中,如上所述的管可包括大约10mm到大约20mm的长度。在一些实施例中,管可包括大约0.3mm或更小的内部直径。在一些实施例中,管可包括大约0.1mm到大约0.3mm的内部直径。在一些实施例中,管可包括大约0.1mm或更小的内部直径。在一些实施例中,一个或多个微孔可包括大约等于管内部直径尺寸的内部直径。在一些实施例中,管可进一步包括两个或多个微孔,其中两个或多个微孔管长度沿同一轴线定位。在一些实施例中,管可进一步包括两个或多个微孔,其中两个或多个微孔沿管长度交错排列。在一些实施例中,管的近端可拆卸地附接到可植入眼睛装置的板,且其中远端配置用于插入到眼睛中。在一些实施例中,管的倒角远端可以大约30°倒角。在一些实施例中,生物可降解管套可具有的材料包括PLGA(聚乳酸聚乙醇酸)、PDLGA(聚乳酸-聚羟基乙酸共聚物)、生物可降解聚合物、生物适应性聚合物、或其一个或多个组合。在一些实施例中,生物可降解管套可具有的长度符合眼睛的曲率。在一些实施例中,生物可降解管套可包括大约2mm或更小的长度。在一些实施例中,生物可降解管套可包括的直径使得管的内部直径被变窄,其中管的变窄的内部直径允许通过管的大约2μL/min或更小的流体流率。在一些实施例中,生物可降解管套可包括大约0.5mm或更小的壁厚度。在一些实施例中,生物可降解管套可在植入之后的大约4周到植入之后的大约8周之间开始在机械、结构或成分方面降解,但是不早于植入之后的4周且不迟于植入之后的8周。在一些实施例中,生物可降解管套可定位为距管的远端大约6mm到大约10mm。本发明的第六方面提供一种可植入眼睛装置,其可包括:如上所述的板;和如上所述的管。在一些实施例中,可植入眼睛装置可包括眼睛引流装置。在一些实施例中,可植入眼睛装置可包括青光眼引流装置。本发明的第七方面提供制造如上所述板的方法,其中方法可包括:提供医用等级弹性体材料;和模制医用等级弹性体材料。在一些实施例中,制造板的方法可进一步包括将模制的医用等级弹性体材料抛光。本发明的第八方面提供制造如上所述管的方法,其中方法可包括:提供医用等级弹性体材料;和挤出医用等级弹性体材料以形成管。本发明的第九方面提供制造如上所述可植入眼睛装置的方法,其中方法可包括:提供如上所述的板;和提供如上所述的管。在一些实施例中,制造如上所述可植入眼睛装置的方法可进一步包括将管旋拧通过管接收孔。在一些实施例中制造如上所述可植入眼睛装置的方法可进一步包括通过手将管旋拧通过管接收孔。在一些实施例中,制造如上所述可植入眼睛装置的方法可进一步包括在管上包覆模制板。本发明的第十方面提供植入如上所述可植入眼睛装置的方法,其中方法可包括:在眼睛中形成筋膜下腔/结膜下腔,其具有与板的尺寸相应的尺寸;将板在结膜下腔中置于眼睛的巩膜上方且通过缝合将板固定;和将管的远端插入眼睛的前房;和经由切割管的近端定制管的长度。本发明的第十一方面提供控制眼内压力的方法,其中方法可包括:提供如上所述的可植入眼睛装置;和使用如上所述的植入可植入眼睛装置的方法将如上所述的可植入眼睛装置植入眼睛中。本发明的第十二方面提供防止与目前可用的青光眼引流装置相关的并发症的方法,其中方法可包括:提供如上所述的可植入眼睛装置;和使用如上所述的植入可植入眼睛装置的方法将如上所述的可植入眼睛装置植入眼睛中。本发明的第十三方面提供用于可植入眼睛装置的稳定性系统,其中稳定性系统可包括:板;包括胶原的材料,覆盖板顶表面的至少一部分;和/或粘弹性物质,其覆盖板顶表面的至少一部分。在一些实施例中,板可包括贮存器。附图说明参考附图在本文描述的本发明的实施例,其中:图1A–图1B示出了根据本发明实施例的青光眼引流装置(GDD)的不同视图。图2A–图2F示出了根据本发明实施例的板。具体说,图2A–图2C示出了根据本发明实施例的板的不同视图,其中板包括具有凸脊的管保持结构。图2D–图2E示出了根据本发明实施例的板,其中板包括具有马蹄铁结构的管保持结构。图2F示出了根据本发明实施例的板,其中板包括多于一个板通道。图3A–3B示出了根据本发明实施例的板的视图。图3B示出了了根据本发明实施例的板的管保持结构的截面视图,其中管保持结构包括凸脊。图4A–图4C示出了根据本发明不同实施例的板。图5A–图5B示出了根据本发明实施例的管的不同视图。图6A–图6C示出了根据本发明实施例的管的不同视图,其中管包括微孔。图7A–图7B显示了将使用经修改目前可用青光眼引流装置植入物(经修改以包括牛心包组织(例如Tutopatch))和交联透明质酸(例如Healaflow))与使用未经修改目前可用青光眼引流装置植入物(作为对照)相比的临床研究结果。具体说,图7A显示了来自实验组(用经修改目前可用青光眼引流装置植入物治疗的组)的所有患者/主体的眼睛和来自对照组(用未经修改目前可用青光眼引流装置治疗的组)的所有患者/主体眼睛的IOP趋势。图7B显示了在术前和随后的术后6个月后用Tutopatch和Healaflow治疗的实验组所需的抗青光眼药物数量和没有Tutopatch和Healaflow的对照组所需的抗青光眼药物数量。图8A–8H显示了使用根据本发明的青光眼引流装置(GDD)2与使用经修改Baerveldt装置(200形成在管中的200微米缝合部)比较的重力流动模拟的试验数据结果。更具体地,图8A和8C分别显示了随流体通过经修改的Baerveldt装置引流,第一和第二组的模拟眼压下降趋势vs时间的情况。图8B和8D分别显示了第一组和第二组的模拟眼睛压力vs流量趋势,显示了通过经修改Baerveldt装置的压力和流体流量之间的关系。图8E和8G分别显示根据本发明的青光眼引流装置(GDD)2的第一和第二组的模拟眼睛压力下降趋势vs时间;和图8F和8H分别显示了第一组和第二组的模拟眼睛压力vs流量趋势,显示了通过根据本发明的这种青光眼引流装置(GDD)2的压力和流体流动之间的关系随压力改变。图9A–9D显示了使用根据本发明的青光眼引流装置(GDD)2与使用经修改Baerveldt装置(200形成在管中的200微米缝合部)比较的恒流模拟的试验数据结果。更具体地,图9A显示使用经修改Baerveldt装置的三组模拟眼睛压力vs流量趋势。图9B显示了图9A的三组模拟眼睛压力vs流量趋势的平均值。图9C显示使用根据本发明的青光眼引流装置(GDD)2的两组模拟眼睛压力vs流量趋势;和图9D显示了图9C的两组模拟眼睛压力vs流量趋势的平均值。具体实施方式在以下的详细描述,对附随附图做出参考,附图形成本说明书的一部分。在附图中,相似的附图标记通常表示相似的部件,除非在上下文另有说明。详细描述、附图和权利要求中的说明性的实施例不是限制性的。其他实施例可利用,且可做出其他改变,而不脱离本文所述主题的精神或范围。除非另有说明,本文使用的术语“包括”和“包含”和其语法变形目的是提供开放或包含式的含义,使得其包括所述元件且还允许包括额外的未描述的元件。如在本文使用的,术语“大约”在针对组分浓度、条件、测量或计算值等描述时意味着所述值的+/-10%,例如所述值的+/-5%,或所述值的+/-4%,或所述值的+/-3%,或所述值的+/-2%,或所述值的+/-1%,或所述值的+/-0.5%,或所述值的+/-0%。在本说明书中,某些实施例是以范围的方式给出的。应理解,范围方式的描述仅仅用于方便和简洁且不应被认为是对所述范围的无灵活性的限制。因而,范围的描述应被认为是具有特定公开的所有可能替代范围以及该范围中的个别数值。例如,从1到6的范围的描述应被认为是具有特定公开的替代范围,例如1到3,1到4,1到5,2到4,2到6,3到6等,以及该范围的个别数,例如1、2、3、4、5和6。无论对于何种范围宽度来说都适用。青光眼引流装置根据本发明的实施例涉及青光眼引流装置,其结构设置方式是(a)在植入过程期间极大地有助于容易地植入和操作;(b)极大地有助于术后前房稳定的维护;(c)几乎或基本消除术后并发症,例如压力过低;和(d)使得通常与浅前房情况下的植入相关的并发症减少或最小化,且因此适用于这种情况的使用。图1A–图1B示出了根据本发明实施例的青光眼引流装置(GDD)2的不同视图。GDD2可包括板4和管6(例如板4配置为沿管长度的一些部分携带细长管6)。管6可包括引流管6。管6可包括前房管6。在一些实施例中,管6可被调节和/或修改。在一些实施例中,板4可包括贮存器8。在板4上和/或中的贮存器8可在GDD2植入期间用作房水的收集点,其会改善水泡形成(blebformation)。在一些实施例中,贮存器8可在板4的一些部分上方和/或周围保持包括胶原的材料。在一些实施例中,包括胶原的材料可进一步包括弹力蛋白。在一些实施例中,包括胶原的材料可包括心包膜、心包组织和/或异体巩膜。在一些实施例中,包括胶原的材料可是柔性的。在一些实施例中,包括胶原的材料可以是经过冷冻干燥的。在一些实施例中,包括胶原的材料可包括补片(patch)。在一些实施例中,贮存器8可在板4上方和/或周围保持粘弹性物质。在一些实施例中,粘弹性物质可包括玻璃酸钠和/或交联透明质酸。在一些实施例中,粘弹性物质可包括惰性的粘弹性物质。在一些实施例中,贮存器8可在板4的上方和/或周围保持包括胶原的材料和/或可在板4的上方和/或周围保持粘弹性物质。在一些实施例中,板4排出或不包括贮存器。在一些实施例中,在板4不包括贮存器的情况下,包括胶原的材料和/或粘弹性物质可应用于板4的一些部分上方和/或周围。在一些实施例中,板4可包括在板4上和/或中的一个或多个板通道10。管6可插入板通道10。板通道10可允许将管6切到期望长度且装配到板通道10中。板通道10可用于在植入期间和植入后将管6固定在板4上和/或中。在一些实施例中,板通道10可被底切到板4的上表面12中,使得板通道10包括一长度,其中凹形部分沿板通道10的长度延伸。沿板通道10的长度延伸的凹形部分可将管6保持和/或固定在板通道10中。板4可允许改善的植入、改善的锚固和/或改善的流体向经结膜下空间的释放。在一些实施例中,板4可用柔性材料制造(例如硅树脂)。在一些实施例中,板4可具有低矮轮廓(lowprofile)。板4的低矮轮廓可允许板4占据更少的眼窝空间,使得可在植入期间容易地插入板4和/或容易地让结膜闭合。板4的低矮轮廓还可实现改善的水泡形成。板4的低矮轮廓可实现通过结膜的更少挤出和/或结膜的更少拉伸,这随后可实现改善的水泡形成。在长期方面,对患者来说,良好水泡可允许更好的眼球可动性和流体流动控制。在一些实施例中,板4可被处理(例如通过表面抛光)以为板4赋予平滑轮廓。平滑轮廓可减少纤维症和/或瘢痕组织,由此实现改善的水泡形成。在一些实施例中,板4可用柔性材料制造(例如硅树脂),其中柔性材料具有的模量可类似于巩膜的模量。板4和/或可调节管6可允许容易地将GDD2植入到患者,以及减少植入之后患者的不适。在一些实施例中,管6可包括一长度,其具有用于插入到板通道10中的近端14和用于插入到眼睛中的远端16。在一些实施例中,管6可包括或带有沿管6长度的一部分定位和/或就位的管套18,其中管套18覆盖通过管6的该部分限定的外周表面。在一些实施例中,管套18可包括生物可降解管套18或生物适应性的易蚀管套18,其中管套18可沿管6长度的一部分定位和/或就位,其中管套18覆盖通过管6的该部分限定的外周表面。管6的远端16可插入到患者眼睛的前房中。在一些实施例中,管6可被调节和/或修改。在一些实施例中,管6的设计允许外科医生或临床医生将管6针对每一个患者定制为具有所需长度,而管6的近端14保持连接/附接到板4,且管6的远端16保持在患者眼睛的前房中。一旦识别出期望长度,则管6的近端14可被切断,而管6的远端16保持在患者眼睛的前房。相反,对目前可用的GDD的当前实践是,基于估计将管的远端切割出期望长度或将管的远端插入到眼睛中,识别期望长度,将管的远端从眼睛取出,切割管的远端,且随后再将管的被切割的远端插入到眼睛中。在一些实施例中,管6的远端16可以是平滑的,使得远端16具有无创边缘,由此在管6插入和保留在眼睛中的过程中进一步减少对患者的任何可能伤害。在一些实施例中,管6的远端16不包括会伤害到眼睛的切割边缘。相反,目前可用的GDD的当前实践是,在远端处切割管,以便达到管的期望长度,其中切割的远端可能具有在插入和/或保留期间会潜在地伤害到眼睛的一个或多个边缘。在一些实施例中,管6可具有缩减的轮廓(例如减小的直径和/或小的直径),以防止对眼内组织的损坏。在一些实施例中,管6的近端14连接到板4,而管6的远端16置于或插入眼睛的前房(AC)中。板4可在结膜下方植入。一旦附接到眼睛,则多余的流体可从AC经由管6向外引出并通过板4散出,由此减少多余的眼内压力(IOP)。在一些实施例中,管套18可沿管6长度的一部分定位和/或就位。在一些实施例中,沿管6长度的该部分定位和/或就位的管套18可减少管6的该部分的原始直径(管套18从外腔覆盖该部分),以在GDD2植入之后的第一个四(4)到八(8)周期间限制和/或控制流体流动。随管套18降解,管套18慢慢地减小对管套18所覆盖的管6的该部分上的约束,由此逐渐释放和/或逐渐允许管套18所覆盖的管6的该部分恢复到管6的该部分的原始直径。在一些实施例中,在管6长度的该部分上定位和/或就位的管套18可在植入之后的最少大约四(4)周中对迅速的流体流动形成阻力,由此防止会在早阶段导致压力过低的多余流体引流,以及可在植入之后的最多大约八(8)周中对迅速的流体流动形成阻力,由此允许额外的流出以使得多余流体存留(其会导致术后IOP升高)最小化。在一些实施例中,管套18会在植入之后的大约四(4)周到植入之后的大约八(8)周中降解和/或分解(且由此开始遗失其机械强度和/或机械性能),但是不会早于植入之后的4周且不迟于植入之后的8周。在一些实施例中,管套18可在不早于植入之后四(4)周开始降解(且由此开始失去其机械强度和/或机械性能),由此防止会造成早期(例如在GDD2的板4上形成纤维组织之前)压力过低的过多流体引流,且在植入之后不迟于八(8)周开始降解由此允许额外的流出以使得造成术后IOP升高的过度流体存留最小化。由此,管套18可限制和/或控制向眼睛以外的初始流体流动,以防止在板4上形成纤维组织之前压力过低。另外,管套18的机械强度和/或机械性能的逐渐下降可在更晚阶段(例如在板上形成纤维组织后)防止术后IOP升高。在一些实施例中,管套18覆盖的管6该部分的直径可在植入之后的大约八(8)周时尺寸增加到其原始直径和/或最终直径,由此通过允许流体流动增加而影响离开眼睛的流体流量。在一些实施例中,管套18覆盖的管6该部分的直径可在植入之后的大约八(8)周之后尺寸增加到其原始直径和/或最终直径,由此通过允许流体流动增加而影响离开眼睛的流体流量。在一些实施例中,管套18仍然可在失去其机械强度和/或机械性能之后具有实体存在。在一些实施例中,管套18仍然可在降解以失去其机械强度和/或机械性能之后和/或消散以失去其机械强度和/或机械性能之后具有实体存在。在一些实施例中,管套18可在植入之后的大约八(8)时或在植入之后的大约八(8)周之后完全降解和完全失去其机械强度和/或机械性能。在一些实施例中,管套18可在植入之后的大约八(8)周时或在植入之后的大约八(8)周之后完全降解和完全失去其机械强度和/或机械性能,使得管套18覆盖的管6的该部分的直径可增加到在将管套18定位和/或就位在管6上之前的管6的原始直径。在植入之后的大约四(4)周时,将在GDD2的板4部分周围形成一些程度的纤维包封,形成对流体流动的一些阻力并防止压力过低。图2A–图2F示出了根据本发明实施例的板4。图2A–图2C示出了根据本发明实施例的板4的不同视图,其中板4包括管保持结构20。在一些实施例中,管保持结构20可包括凸脊20。在一些实施例中,板4可与管保持结构20整体地形成。在一些实施例中,板4可与凸脊20整体地形成。在一些实施例中,凸脊20可包括低矮轮廓。在一些实施例中,凸脊20可包括大约0.3mm或更少的高度,其中板4的总高度(包括板高度和凸脊高度)大约为1.3mm或更少。在一些实施例中,凸脊20可包括大约0.3mm或更少的高度,其中板4的总高度为大约1.25mm或更少。在一些实施例中,凸脊20可包括至少2mm到大约4mm的长度。在一些实施例中,凸脊20可包括大约4mm的长度。在一些实施例中,凸脊20可包括至少大约1mm的宽度。在一些实施例中,凸脊20可包括大约1mm的宽度。低矮轮廓的凸脊20可允许板4具有用于改善水泡形成的减小轮廓。换句话说,包括凸脊20的板4可具有总体减小的厚度和/或总体减小的高度,由此实现改善的水泡形成。在一些实施例中,板4的低矮轮廓的凸脊20可有助于植入后改善水泡形成。在一些实施例中,板4上的贮存器8可有助于植入后改善水泡形成。在一些实施例中,板4的低矮轮廓凸脊20和板4上的贮存器8可有助于植入后改善水泡形成。在一些实施例中,贮存器8可将包括胶原的材料(例如心包膜、心包组织和/或异体巩膜)在板4的上方和/或周围保持就位。在一些实施例中,包括胶原的材料可是柔性的。在一些实施例中,包括胶原的材料可以是经过冷冻干燥的。在一些实施例中,包括胶原的材料可包括补片。在一些实施例中,贮存器8将粘弹性物质(例如玻璃酸钠和/或交联透明质酸)在板4的上方和/或周围保持就位。在一些实施例中,粘弹性物质可包括惰性的粘弹性物质。在一些实施例中,贮存器8可将包括胶原的材料(例如心包膜、心包组织和/或异体巩膜)、粘弹性物质(例如玻璃酸钠和/或交联透明质酸)或其组合在板4的上方和/或周围保持就位。参见图2A–图2C,根据本发明的实施例,板4可包括管接收端22,其中管接收端22包括底表面24和顶表面12、26,其中管接收端22与管保持结构20整体地形成,其中管保持结构20包括凸脊20,其中凸脊20形成在管接收端22的顶表面12、26上和/或附近,其中凸脊20包括顶部暴露表面28和宽度,其中管接收孔30、孔30或开口30设置和/或形成在管接收端22的底表面24和凸脊20的顶端暴露表面28之间的部分处,其中管接收孔30与管接收通道30’整体地形成和/或与之连接,其中管接收通道30’包括一长度,其中管接收通道30’的长度沿凸脊20的整个宽度延伸,其中板4进一步包括板通道10,其中管接收通道30’连接到板通道10。在一些实施例中,管接收通道30’可与板通道10整体地形成和/或与之整体连接。在一些实施例中,管接收通道30’可包括圆柱形形状,其中管接收通道30’可覆盖管6的整个外周。在一些实施例中,管6的外部直径、沿板通道10的整个长度延伸的凹形部分的直径、管接收孔30的直径和管接收通道30’的直径可为大约相同的尺寸或相当的尺寸。根据本发明的实施例,板4、管接收端22、管保持结构20、凸脊20、管接收孔30、和管接收通道30’可整体地形成为一个结构。在一些实施例中,板4、管保持结构20、凸脊20、管接收孔30和管接收通道30’可经由模制过程整体地形成为一个结构。在一些实施例中,管6的近端14可插入到管接收孔30中且随后插入到管接收通道30’中。管接收通道30’可沿凸脊20的整个宽度延伸且连接到板通道10。在植入期间的管6运动和/或位移过程中;在植入过程中;和/或植入过程后,凸脊20可用于将管6固定和/或保持在管接收孔30和管接收通道30’中。例如,一旦管6插入到管接收孔30且随后插入到管接收通道30’中,并通过凸脊20固定和/或保持在管接收孔30和/或管接收通道30’中,则通过将管6向远端(即远离板4)拉动、推动、移位、滑动和/或运动以增加管6的长度(超过接收孔30),和/或通过将管6向近端(即朝向板4)拉动、推动、移位、滑动和/或运动以缩短管6的长度(超过接收孔30),从而调整或修改管6的长度。在管6插入到管接收孔30且随后插入到管接收通道30’中并通过凸脊20固定和/或保持在管接收孔30和/或管接收通道30’中,管6可被拉动、推动、移位和/或运动,而不从板4去除,因为凸脊20将管6牢固或固定地保持在管接收通道30’中就位。管6可从板4的管接收端22被拉动、推动和/或运动到板4的贮存器8和/或相反端。从而,任何多余的管6长度可从管6的近端14切割,所述近端远离凸脊20向近端延伸,同时管6保持固定在被凸脊20覆盖且沿凸脊20的宽度延伸的管接收通道30’中。由此,管6不需要从板4去除以在管6的近端14处修改或调整管6的长度。此外,在管6长度的修改或调整期间的任何时候,管6的远端16不需要从眼睛的前房(AC)去除。如果需要,则通过将管6向远端远离板4拉动和/或推动,管6可从管接收通道30’和板4去除。参见图2D–图2E,在一些实施例中,管接收孔30和管接收通道30’可形成在板4中,使得管接收通道30’将管6固定和/或保持在管接收通道30’中。在这种实施例中,管接收通道30’可用作管保持结构20。例如,管接收通道30’可底切到板4的顶表面12中,其中管接收通道30’具有一长度,其中马蹄铁形状部分30”沿管接收通道30’的整个长度延伸,其中管接收通道30’的马蹄铁形状部分30”允许管接收通道30’用作管保持结构20,使得管6可向近端和向远端被拉动通过管接收通道30’,而不从管接收通道30’去除。在一些实施例中,管接收通道30’可覆盖管6的整个外周,其中位于管接收通道30’中的一部分管6的外周没有任何部分暴露。在一些实施例中,管接收通道30’可覆盖管6外周的大部分,其中位于管接收通道30’中的一部分管6的外周的一部分可暴露。在一些实施例中,管接收通道30’可覆盖管6外周的第一部分,其中位于管接收通道30’中的管6的外周的第二部分可暴露。在一些实施例中,管6的整个外周可位于板通道10中,其中管6外周的一部分可暴露。在一些实施例中,管6外周的大部分可位于板通道10中,其中管6外周的一部分可暴露。在一些实施例中,管6外周的第一部分可位于板通道10中,其中管6外周的第二部分可暴露。如图2F所示,在一些实施例中,板4可包括一个或多个板通道10。在一些实施例中,板4可具有一个或多个底切板通道10。在一些实施例中,一个或多个板通道10可从管保持结构20(例如凸脊20或用作管保持结构20的包括马蹄铁形状30”的管接收通道30’)延伸到贮存器8和/或从贮存器8延伸到板4的一个或多个端部。在一些实施例中,可通过将材料从板4去除以形成一个或多个板通道10,而形成一个或多个底切板通道10。一个或多个底切板通道10可允许GDD2具有总体低矮的轮廓(例如减小的厚度和/或减小的高度)。例如,根据本发明的一些实施例,一个或多个底切板通道10可允许管6凹入到板4中,使得GDD2的总体轮廓仅与管保持结构20(例如凸脊20或用作管保持结构20的包括马蹄铁形状部分30”的管接收通道30')的高度一样高。在一些实施例中,如图2A–图2C所示,管保持结构20可包括凸脊20。在一些实施例中,凸脊20可包括低矮轮廓凸脊20。在一些实施例中,一个或多个底切板通道10可允许管6凹入到板4中,使得GDD2的总体轮廓仅与凸脊20的高度一样高。在一些实施例中,一个或多个底切板通道10可允许管6凹入到板4中,使得GDD2的总体轮廓仅与低矮轮廓凸脊20的高度一样高。在一些实施例中,如图2D–图2E所示,管保持结构20可包括管接收通道30',其中管接收通道30'包括一长度,其中马蹄铁形状部分30”沿管接收通道30'的整个长度延伸,其中管接收通道30'的马蹄铁形状部分30”允许管接收通道30'用作和/或当做管保持结构20。在一些实施例中,一个或多个底切板通道10可允许管6凹入到板4中,使得GDD2的总体轮廓仅与包括管接收通道30'的管保持结构20的高度一样高,所述管接收通道30'包括马蹄铁形状部分30”。图3A–3B示出了根据本发明实施例的板4。图3B示出了根据本发明实施例的管保持结构20的截面,其中管保持结构20包括凸脊20,其中凸脊20包括管接收孔30和管接收通道30',其中管6可被插入到管接收孔30中且随后插入到管接收通道30'中。根据本发明的实施例,GDD2的板4具有的尺寸和/或形状可允许容易地插入和/或良好的效力。在一些实施例中,GDD2的可具有凹入贮存器8。在一些实施例中,GDD2的板4可具有一个或多个底切板通道10。在一些实施例中,GDD2的板4可包括管保持结构20,其中管保持结构20包括低矮轮廓凸脊20。在一些实施例中,GDD2的板4可包括管保持结构20,其中管保持结构20包括管接收通道30',其包括马蹄铁形状部分30”,其中管接收通道30'用作和/或当做管保持结构20。在一些实施例中,板4的长度(前后方向)可大约为16mm或更少。在一些实施例中,板4的长度(前后方向)可大约为16mm。在一些实施例中,板4的宽度(左右方向)可大约为24mm或更少。在一些实施例中,板4的宽度(左右方向)可为大约24mm。在一些实施例中,板4的厚度可大约为1mm或更少。在一些实施例中,板4的厚度可大约为1mm。在一些实施例中,板4的表面面积可为大约250mm2到大约350mm2。在一些实施例中,板4的表面面积可为大约250mm2到大约360mm2。在一些实施例中,板4的表面面积可为大约267mm2、302mm2、313mm2、或315mm2。在一些实施例中,板4可以是柔性的,以允许板4符合患者或受体的眼睛。在一些实施例中,板4可具有大约A60到A80的邵氏硬度。在一些实施例中,板4可具有大约A80的邵氏硬度。在一些实施例中,板4可包括至少一个开窗(fenestration)32。在一些实施例中,板4可包括两个开窗32。在一些实施例中,板4可包括高达四个(4)开窗32。在一些实施例中,每一个开窗32可具有大约0.95mm的直径。在一些实施例中,板4可包括至少一个缝合孔34。在一些实施例中,板4可包括两个缝合孔34。在一些实施例中,每一个缝合孔34可具有大约0.8mm的直径。在一些实施例中,板4的表面可以是平滑的且具有低矮轮廓。在一些实施例中,板4的表面可包括医用等级弹性体。在一些实施例中,板4的表面可包括医用等级硅树脂。在一些实施例中,板4的表面可被抛光。在一些实施例中,板4的表面可包括抛光的医用等级硅树脂。在一些实施例中,板4可包括形成用于流体累积的贮存器8的凹入区域。贮存器8可具有任何形状。在一些实施例中,贮存器8可包括椭圆形形状。板4可包括一个或多个板通道10,其可从管保持结构20(例如凸脊20或用作管保持结构20的包括马蹄铁形状部分30”的管接收通道30')延伸到贮存器8和/或从贮存器8延伸到板4的一个或多个端部。板通道10可将管6保持就位。在一些实施例中,板4可包括板通道10在板4中的底切部分,以使得管6与板4齐平且板4与管6齐平。换句话说,板通道10可被底切到板4中。在一些实施例中,板通道10可包括沿板通道10的整个长度延伸的凹形部分或弧,其可将管6固定在板通道10中。在一些实施例中,板通道10的直径可大约与所使用的管6的外部直径尺寸相同。在一些实施例中,板通道10的直径可对应于管6的外部直径、管接收孔30的直径和/或管接收通道30'的直径。在一些实施例中,沿板通道10的整个长度的凹形部分或弧可包括大约0.7mm或更小、大约0.63或更小、大约0.6mm或更小、大约0.45mm或更小、大约0.43mm或更小、或大约0.35mm的直径。在一些实施例中,板4可包括低矮轮廓凸脊20。凸脊20可有助于控制水泡形成。凸脊20可将管6保持到板4且可防止管6在管6长度被调整时脱出。凸脊20可允许管6沿凸脊20的宽度自由地运动,由此允许通过改变或调整在凸脊18前方的管6的近端14的长度而改变或调整管长度6。管接收孔30的直径可对应于管6的外部直径,板通道10的直径,和/或管接收通道的直径。例如,在一些实施例中,管接收孔30可具有0.7mm或更小、0.63mm或更小、0.6mm或更小、0.45mm或更小、0.43mm或更小、或0.35mm的直径,且管6可具有0.7mm或更小、0.63mm或更小、0.6mm或更小、0.45mm或更小、0.43mm或更小、或0.35mm的外部直径。图4A示出了本发明实施例的GDD2的板4,其中贮存器8包括圆形形状。图4B示出了了根据本发明实施例的GDD2的板4,其中贮存器8包括钟形或梨形。图4C示出了根据本发明实施例的GDD2的板4,其中贮存器8包括椭圆形形状。还可想到用于贮存器8的其他形状。图5A–图5B示出了根据本发明实施例的管6的不同透视图。管6可包括引流管6。管6可包括前房管6。在一些实施例中,管6可被调节和/或修整。在一些实施例中,管6可包括在管6的远端16处的倒角边缘36。管6远端16处的倒角边缘36可允许管6容易的插入到眼睛中。在一些实施例中,管6的远端16可以以大约30°倒角。在一些实施例中,倒角边缘36可被预先切出。预先切出的倒角边缘36可提供具有无创轮廓的管6,其可防止在管6插入期间和/或在管6被保持在眼睛中时对眼睛的损坏。在一些实施例中,管6可具有大约10mm到大约20mm的长度。在一些实施例中,管6可具有大约17mm的长度。在一些实施例中,管6可具有大约17mm的固定长度。在一些实施例中,管6可具有大约0.7mm或更小的外部直径。在一些实施例中,管6可具有大约0.3mm或更小的内部直径。在一些实施例中,管6可具有大约0.45mm或更小的外部直径。在一些实施例中,管6可具有大约0.1mm或更小的内部直径。在一些实施例中,管6可具有大约0.43mm或更小的外部直径。在一些实施例中,管6可具有大约0.1mm或更小的内部直径。在一些实施例中,管6可具有大约0.35mm的外部直径。在一些实施例中,管6可具有大约0.050mm的内部直径。在一些实施例中,管6可具有大约0.63mm的外部直径。在一些实施例中,管6可具有大约0.3mm的内部直径。在一些实施例中,管6可具有大约0.6mm的外部直径。在一些实施例中,管6可具有大约0.3mm的内部直径。在一些实施例中,管6可具有大约0.1mm到大约0.3mm的内部直径。在一些实施例中,管6可包括大约0.2mm的壁厚度。在一些实施例中,管6可包括大约0.165mm的壁厚度。在一些实施例中,管6可包括大约0.175mm的壁厚度。在一些实施例中,管6可包括大约0.15mm的壁厚度。在一些实施例中,与常规的商业可获得管相比,管的外部直径、壁厚度和内部直径被选择为使得管6呈现增加的刚性和对流体流动的更大阻力。增加的管刚性可有助于或极大地有助于管6的插入和操作,由此使得全部植入过程更简单且耗时更少。在一些实施例中,管6可包括沿管6长度的一部分定位的生物可降解管套18或生物适应性易蚀管套18,其中管套18覆盖通过管6的该部分限定的外周表面。管套18可用作流动限定器。在一些实施例中,管套18可包括PLGA、PDLGA、生物可降解聚合物、生物适应性聚合物、或其一个或多个组合的生物可降解材料。在一些实施例中,管套18可包括PDLGA。在一些实施例中,管套18可包括符合眼睛曲率的长度。在一些实施例中,管套18可包括符合患者或主体的眼睛曲率的长度。在一些实施例中,管套18可具有大约2mm或更小的长度。在一些实施例中,管套18可具有大约2mm的长度。在一些实施例中,管套18可具有大约1mm的长度。在一些实施例中,管套18包括的直径可使得管6变窄到大约10微米的直径。在一些实施例中,管套18可包括大约1.0mm的外部直径。在一些实施例中,管套18可包括大约0.5mm的内部直径。在一些实施例中,管套18可包括大约0.9mm的外部直径。在一些实施例中,管套18可包括大约0.35mm的内部直径。在一些实施例中,管套18可包括大约0.85mm的外部直径。在一些实施例中,管套18可包括大约0.35mm的内部直径。在一些实施例中,管套18可包括大约0.86mm的外部直径。在一些实施例中,管套18可包括大约0.36mm的内部直径。在一些实施例中,管套18可包括大约0.5mm或更小的壁厚度,以提供允许管套18在植入之后大约四(4)周到植入之后大约八(8)周之间(不早于植入之后4周且不迟于GDD2植入之后8周)开始降解的降解率(且由此开始失去其机械强度和/或机械性能)。在一些实施例中,管套18可包括大约0.5mm或更小的壁厚度以提供允许管套18在植入之后大约八(8)周时或GDD2植入之后大约8周之后完全降解的降解率。管套18的壁厚度和/或用于制造管套18的材料可确定管套18的降解率。在一些实施例中,管套18可包括大约0.5mm的壁厚度。在一些实施例中,管套18可包括生物可降解材料,其在GDD2的植入之后的大约四(4)周到植入之后的大约八(8)周之间但是不早于植入之后4周且不迟于植入之后8周开始降解(且由此开始失去其机械强度和/或机械性能)。在一些实施例中,管套18可包括生物可降解材料,其在GDD2的植入之后的大约八(8)周时或在植入之后大约8周之后完全降解,由此允许完全流体流动。在一些实施例中,管套18可定位在管6上且距管6的远端16大约6mm到大约10mm。在一些实施例中,管套18可被定位在管6上且距管6的远端16大约8mm。在一些实施例中,管6可包括在管6的远端16处的倒角边缘36或倒角尖端36。在一些实施例中,管6可包括一个或多个微孔38。图6A–图6C示出了根据本发明实施例的管6的不同视图,其中管6包括微孔38。在一些实施例中,管6可包括一个或多个微孔38。图6A示出了管6的左视图(例如9点钟位置)。图6B示出了管6的俯视图(例如12点钟位置)。图6C示出了管6的右视图(例如3点钟位置)。在一些实施例中,一个或多个微孔38可包括与管6的内部直径相同或基本上相同的直径。在一些实施例中,两个或多个微孔38可以沿与管6长度所沿轴线相同的轴线定位,位于大约12点钟位置、3点钟位置和/或9点钟位置。在一些实施例中,两个或多个微孔38可沿管6的长度在大约12点钟位置、3点钟位置和/或9点钟位置交错排列。在一些实施例中,一个或多个微孔38可包括大约0.3mm的直径。在一些实施例中,管6可包括在管6的12点钟位置处的微孔38、在管6的3点钟位置处的微孔38、和/或在沿管6的9点钟位置处的微孔38。在一些实施例中,在存在多于一个微孔38的情况下,微孔38可以沿与管6长度所沿轴线相同的轴线定位。在一些实施例中,在存在多于一个的微孔38的情况下,微孔38可沿管6的长度交错排列。在一些实施例中,一个或多个微孔38可包括大约0.1mm的直径。在一些实施例中,管6可包括在管6的12点钟位置处的微孔38、在管6的3点钟位置处的微孔38、和/或在沿管6的9点钟位置处的微孔38。在一些实施例中,在存在多于一个微孔38的情况下,微孔38可沿与管6长度所沿轴线相同的轴线定位。在一些实施例中,在存在多于一个的微孔38的情况下,微孔38可沿管6的长度交错排列。在一些实施例中,管6可包括在管6的12点钟位置处的微孔38、在管6的3点钟位置处的微孔38、和在沿管6的9点钟位置处的微孔38。在一些实施例中,微孔38可以沿与管6长度所沿轴线相同的轴线定位。在一些实施例中,微孔38可沿管6长度交错排列。在一些实施例中,在管6的6点钟位置处没有微孔38,因为6点钟位置通常直接在眼睛虹膜的上方。这防止虹膜压靠和/或挤入微孔,和由此造成的任何随后损坏。本发明的板4和/或管6的设计可减少与目前可用的青光眼引流装置(GDD)相关的失效率和/或减少与目前可用的GDD相关的术后并发症。进一步地,板4和/或管6的设计可允许更容易的植入和/或置放。本发明还涉及稳定性系统或流体流动控制系统。根据本发明实施例,稳定性系统可包括GDD2的板4(GDD2包括板4和管6)加上应用于板4上方和/或周围的包括胶原的材料(例如心包膜,心包组织和/或异体巩膜)和/或应用于板4上方和/或周围的粘弹性物质(例如玻璃酸钠和/或交联透明质酸)。板4与应用于板4上方和/或周围的包括胶原的材料和/或具有应用于板4的上方和/或周围的粘弹性物质的组合可提供流体流动控制机构,其可防止会在手术植入之后立即发生的压力过低和/或可防止长期可能发生的升高IOP。在一些实施例中,板4可包括贮存器8。GDD2的板4加应用于板上方和/或周围的包括胶原的材料和/或应用于板上方和/或周围的粘弹性物质可一起工作以控制离开眼睛的流体,由此提供长期的更好流体控制。GDD2的流体流动控制可在包括胶原的材料应用于GDD2的板4的上方和/或周围和/或粘弹性物质应用于GDD2的板4的上方和/或周围时被加强。在一些实施例中,稳定性系统可包括GDD2的板4和应用于板4的上方和/或周围的包括胶原的材料。在一些实施例中,稳定性系统可包括GDD2的板4和应用于板4的上方和/或周围的粘弹性物质。在一些实施例中,稳定性系统可包括GDD2的板4加应用于板4的上方或周围的包括胶原的材料或应用于板4的上方和/或周围的粘弹性物质。在一些实施例中,稳定性系统可包括GDD2的板4加应用于板4的上方和/或周围的包括胶原的材料和应用于板4的上方和/或周围的粘弹性物质。在一些实施例中,包括胶原的材料可是柔性的。在一些实施例中,包括胶原的材料可以是经过冷冻干燥的。在一些实施例中,包括胶原的材料可包括补片。在一些实施例中,粘弹性物质可包括惰性的粘弹性物质。根据本发明实施例,稳定性系统可包括具有贮存器8的板4加应用于贮存器8上方和/或板4周围的包括胶原的材料(例如心包膜,心包组织和/或异体巩膜)和/或应用于贮存器8上方和/或板4周围的粘弹性物质(例如玻璃酸钠和/或交联透明质酸)。板4与包括胶原的材料和/或粘弹性物质的组合提供流体流动控制机构,其可防止会在手术植入之后立即发生的压力过低和/或可防止长期可能发生的升高IOP。图7A–图7B和表格1显示了经修改的目前可用青光眼引流装置植入物(其修改为在板顶端置放的包括牛心包组织/心包补片(例如Tutopatch)和在板-tutopatch复合结构上方和板两侧注入的交联透明质酸(例如Healaflow))的使用与未经修改的目前可用青光眼引流装置植入物(作为一种控制)相比较的临床研究或临床病例系列的结果。本领域技术人员应理解与Tutopatch相似的、基本上相似的、等效的、基本上等效或类似的材料已经可能用于临床研究,以实现相似的或基本上相似的结果。还有,本领域技术人员应理解与Healaflow相似的、基本上相似的、等效的、基本上等效或类似的材料已经可能用于临床研究,以实现相似的或基本上相似的结果。进一步地,使用临床研究目前可用的青光眼引流装置是Ahmed引流装置。但是,本领域技术人员应理解其他目前可用的引流装置可能已经使用。用三十(30)名人类患者执行临床研究或临床病例系列。针对手术植入之前、手术植入后一(1)天、手术植入后一(1)周、手术植入后一个(1)月、手术植入后三个(3)月和手术植入后六个(6)月的升高IOP和压力过低来研究患者。患者的IOP被监测,以确定是否发生压力过低和/或晚期升高IOP。主要结果的衡量如下:(1)基于平均眼内压力(IOP)的成功和失效;(2)高血压阶段的发生,限定为IOP>21mmHg;(3)眼睛压力过低的发生,限定为IOP<6mmHg;和(4)所需的术后抗青光眼药物(例如抗青光眼滴眼液)的数量。在用目前可用青光眼引流装置(包括牛心包组织/心包补片(例如Tutopatch)和交联透明质酸(例如Healaflow))治疗的患者中,手术六个月之后,IOP(15.6±4.2mmHg)和所使用的抗青光眼药物的数量(0.4±1.0)与术前值(IOP=22.5±12.3mmHg,p=0.026;抗青光眼药物数量=3.2±1.2,p<0.001)相比时低得多。在术后6个月时具有Tutopatch和Healaflow的经修改的目前可用的青光眼引流装置的成功率为95.2%。在术后的一个到三个月之间16%的经手术眼睛发生高血压阶段,IOP范围为22-26mmHg。在用未经修改的目前可用青光眼引流装置(不包括Tutopatch和Healaflow)治疗的患者对照组或对照眼睛(controleyes)中,术后6个月的平均值IOP为17.4±5.1mmHg。在术后6个月,所使用的抗青光眼药物的数量从2.10±1.5减小到0.9±0.9(p=0.01,学生t-测试)。未经修改的目前可用青光眼引流装置(不包括Tutopatch和Healaflow)的成功率在术后或植入后6个月时为70%。50%的对照眼睛在术后1-3个月的高血压阶段中具有25-43mmHg范围的IOP。图7A显示了来自实验组(用具有Tutopatch和Healaflow的经修改目前可用青光眼引流装置植入物治疗的组)的所有患者/主体的眼睛和来自对照组(用没有Tutopatch和Healaflow的未经修改目前可用青光眼引流装置治疗的组)的所有患者/主体眼睛的IOP趋势。具有空心三角形的虚线代表具有Tutopatch和Healaflow的实验组的IOP趋势。具有菱形的实线代表没有Tutopatch和healaflow的对照组的IOP趋势。图7A清楚地显示了在手术植入后1个月、手术植入后3个月和手术植入后6个月的实验组(具有包括Tutopatch和Healaflow的经修改目前可用青光眼引流装置植入物)的平均值IOP遵循了平坦直线,显示了与对照组(没有Tutopatch和Healaflow的未经修改目前可用青光眼引流装置)相比的稳定且更低的IOP水平。图7B显示术前和术后6个月的实验组(具有包括Tutopatch和Healaflow的经修改目前可用青光眼引流装置植入物)所需的抗青光眼药物的数量和对照组(使用不具有Tutopatch和Healaflow的未经修改目前可用青光眼引流装置)所需的抗青光眼药物数量。具有空心三角形的虚线代表具有Tutopatch和Healaflow的实验组所需的抗青光眼药物数量。具有菱形的实线代表没有Tutopatch和healaflow的对照组所需的抗青光眼药物数量。如图7A–图7B和下方表格1所示,包括胶原的材料(例如牛心包组织/心包补片)的使用和粘弹性物质(例如交联透明质酸)的使用改善青光眼引流装置植入手术的结果。包括胶原的材料的使用和粘弹性物质的使用实现相当低的IOP、相当少的抗青光眼药物数量和相当低的高血压阶段发生率。表格1.临床研究或临床病例系列的结果,将经修改目前可用青光眼引流装置植入物(经修改以包括置于板顶部的牛心包组织/心包补片(Tutopatch)和在板-Tutopatch复合结构上方和板两侧注入的交联透明质酸(Healaflow))的使用与作为对照的未经修改目前可用青光眼引流装置的使用相比较。临床研究或临床病例系列显示包括胶原的材料(例如心包膜,心包组织,异体巩膜和/或心包补片)和粘弹性物质(例如玻璃酸钠和/或交联透明质酸)与青光眼引流装置一起使用实现手术植入后IOP的增加稳定性,由此减少眼睛的升高IOP和眼压过低的发生。本发明的制造青光眼引流装置的方法本发明还涉及制造如上所述的青光眼引流装置(GDD)2的方法。根据本发明实施例,板4可通过以下方法制造:提供医用等级弹性体材料(例如医用等级硅树脂);和模制医用等级弹性体材料以形成板4。包括模制的医用等级弹性体材料的板4可随后被抛光以提供平滑表面。板4可形成为包括管保持结构20、管接收孔30、管接收通道30'、贮存器8、一个或多个板通道10、一个或多个开窗32、和/或一个或多个缝合孔34。根据本发明实施例,管6可通过以下方法制造:提供医用等级弹性体材料(例如医用等级硅树脂)和挤出医用等级弹性体材料以形成管6。激光切割可用于在管6的远端16处/入口端16/流入端16处的倒角边缘36。激光钻孔可用于沿管6的长度或侧部形成一个或多个微孔。在一些实施例中,制造管6的方法可包括:提供医用等级弹性体材料;挤出医用等级弹性体材料以形成管6;激光切割管6的远端16或入口端16以在管6的远端16或入口端16形成倒角边缘36;和/或通过激光钻孔沿管6的长度或侧部形成一个或多个微孔38。在一些实施例中,制造管6的方法可包括:提供医用等级弹性体材料;和医用等级弹性体材料;和模制医用等级弹性体材料以形成管6,其具有在远端16处的倒角边缘36和/或具有沿管6的长度或侧部的一个或多个微孔38。在一些实施例中,制造管6的方法可包括:提供医用等级弹性体材料;模制医用等级弹性体材料以形成具有倒角边缘36的管6;和经由激光钻孔沿管6的长度或侧部形成一个或多个微孔38。根据本发明实施例,生物可降解管套18可通过以下步骤制造:提供包括PDLGA、PLGA、生物可降解聚合物、生物适应性聚合物或其一个或多个组合的材料;和挤出材料以形成管套18或管套管18。根据本发明实施例,青光眼引流装置(GDD)2可通过以下步骤制造:提供或制造板4和管6;和将板4装配到管6。在一些实施例中,可通过用手将管6旋拧通过板4的管接收孔30和管接收通道30'来组装板4和管6。在一些实施例中,可通过利用自动装置/自动设备将管6旋拧通过板4的管接收孔30和管接收通道30'来组装板4和管6。在一些实施例中,板4可包覆模制在管6上。根据本发明实施例,管套18和管6可被制造为分开的部件。在一些实施例中,管套18和管6可预先切割到期望长度。在一些实施例中,管6可通过手旋拧通过管套18。在一些实施例中,管6可利用自动装置/自动设备旋拧通过管套18。植入本发明青光眼引流装置的方法本发明还涉及在患者或主体中植入如上所述青光眼引流装置(GDD)2的方法。根据本发明实施例,临床医生可解剖大约为GDD2的板4尺寸的筋膜下(sub-Tenon’s)腔/结膜下腔(subconjuctivalpocket)。包括胶原的材料可被置于板4的顶部和/或板4的周围,以在板-胶原复合结构插入之前形成板-胶原复合结构。在一些实施例中,包括胶原的材料可包括心包膜、心包组织和/或异体巩膜。在一些实施例中,包括胶原的材料可是柔性的。在一些实施例中,包括胶原的材料可包括补片。板4可被适于被置于眼睛的巩膜上方。板4可具有的形状和/或尺寸允许板4和GDD2更容易的植入。GDD2的管6可包括近端14/流出端14,其可拆卸地连接到板4。管6还可包括远端16/入口端16/流入端16,其延伸远离板4,其中远端16/入口端16/流入端16具有的长度足够长以延伸到眼睛的前房中。远端16/入口端16/流入端16是插入到眼睛中的一端。外科医生或临床医生可将管6插入通过在眼睛中制造的切口。管6可包括在管6的远端16/入口端16/流入端16的倒角边缘36,其中倒角边缘36有助于管6的插入。在管6插入到眼睛中之后,管6可被从管保持结构20的任一端(例如经由靠近管保持结构20的管6的近端14/流出端14;和/或经由不在眼睛的前房中的、正好在管保持结构20远端的管6的部分)被拉动,且调整到用于患者眼睛的合适长度。管6可从靠近板4的近端14/流出端14切出,由此消除了外科医生或临床医生将管6从眼睛取出以将管6切到适当长度的需要。这还可实现保持在进入眼睛中的远端16/入口端16/流入端16处的管6的平滑轮廓。管套18用作在管6上的限流器且GDD2可消除必须通过使用缝合结形成临时流动限制的额外步骤。在使用目前可用的无阀的青光眼引流装置时,使用缝合结形成临时流动限制的额外步骤是常见的。板4可经由一个或多个缝合孔34而在角膜缘(limbus)后大约8.5mm处在巩膜上固定就位。在关闭结膜下腔/筋膜下腔之前,惰性的粘弹性物质(例如交联透明质酸)可被注入在板-胶原复合结构的顶部和/或板4的周围。GDD2的板4与板4上方和/或周围的包括胶原的材料和/或与板4上方和/或周围的粘弹性物质的组合可用作稳定性系统。包括板4加上板4上方和/或周围的包括胶原的材料和/或板4上方和/或周围的惰性粘弹性物质的稳定性系统可有助于流体流动控制。图8A–8H和表格2显示了使用根据本发明的代表性青光眼引流装置(GDD)2与使用经修改的商业上可用Baerveldt装置相比较的、重力流动模拟(gravityflowsimulations)的试验数据结果。在经修改的Baerveldt装置中,200微米的缝合部被并入且形成在其管中以减少管的直径,且因此增加对在管中/通过管的流体流动的阻力。该修改有时应用于临床实践。重力流动模拟了眼睛具有最初的大于等于21mmHg的高压力的情况。压差实现流体从眼睛的引流。图8A和8C分别显示了随流体通过经修改的Baerveldt装置引流,第一和第二组的模拟眼压下降趋势vs时间的情况。具有菱形的虚线代表模拟眼睛压力趋势,且实线代表拟合到模拟数据的指数曲线。图8B和8D分别显示了第一组和第二组的模拟眼睛压力vs流量趋势,显示了通过经修改Baerveldt装置的压力和流体流量之间的数学关系(例如对应于基于Poiseuille等式或使用Poiseuille等式导出的关系)。具有菱形的虚线代表模拟压力vs流量趋势。实线代表拟合到模拟数据的直线。拟合直线的斜率限定了装置对在其管中/通过其管的流体流动的阻力。因此,经修改Baerveldt装置的阻力大约为5×1010(mmHg/(m3/s)),从图8B和8D读出。图8E和8G分别显示了使用根据本发明的青光眼引流装置(GDD)2的第一和第二组的模拟眼睛压力下降趋势vs时间。具有菱形的虚线代表模拟的眼睛压力下降趋势,且实线代表拟合到模拟数据的指数曲线。图8F和8H分别显示了第一组和第二组的模拟眼睛压力vs流量趋势,显示了通过根据本发明的青光眼引流装置(GDD)2的压力和流体流量之间的数学关系(例如对应于基于Poiseuille等式或使用Poiseuille等式导出的关系)。具有菱形的虚线代表模拟的眼睛压力趋势。实线代表拟合到模拟数据的线性曲线。拟合直线的斜率限定了装置对在其管中/通过其管的流体流动的阻力。因此,根据本发明的该青光眼引流装置(GDD)2的阻力大约为2×1011(mmHg/(m3/s)),从图8F和8H读出。下方的表格2总结了重力流动模拟计算的根据本发明的青光眼引流装置(GDD)2的平均阻力和经修改Baerveldt装置的平均阻力。在表格2中,““系统R”是指使用实验装置(没有流体联接到实验装置的根据本发明的青光眼引流装置(GDD)2或经修改Baerveldt装置)的获得的实验测量结果。结果显示,根据本发明的青光眼引流装置(GDD)2呈现或产生比经修改Baerveldt装置更高的阻力。更高的阻力降低流体流出眼睛的眼房的速率。这可以防止在眼睛中的眼内压力最初较高时立即造成术后压力过低。阻力平均(系统+装置)系统R平均RMBD5x10102.5x1094.75x1010GDD2x10114x1091.96x1011表格2.从重力流动模拟计算经修改Baerveldt装置(MBD)和根据本发明的青光眼引流装置(GDD)2的平均阻力。图9A–9D和表格3A–3C显示了以与如上所述相同或基本相同的方式使用根据本发明的青光眼引流装置(GDD)2与使用经修改商业上可用的Baerveldt装置(在其管中包括200微米缝合部)相比较的恒流模拟的试验数据结果。针对图9A–9D和表格3A–3C所示的结果,压力在实验开始之前被设置为零。恒流模拟了在从高压力初始引流且眼睛达到大约15-20mmHg的稳定压力之后的情况。眼睛继续生产大约2μl/min的流体,这是通过流体泵模拟的,而流体不断地通过装置向外引流,以将眼睛压力维持在15-20mmHg。图9A和表格3A显示了使用具有包括在其管中的200微米缝合部的经修改Baerveldt装置的三组模拟眼睛压力vs流量趋势。在图9A中,具有菱形、方形和三角形的虚线分别代表第一、第二、和第三组的模拟眼睛压力vs流量趋势。图9B中具有菱形的虚线代表图9A的三组模拟眼睛压力vs流量结果的平均。图9B中的实线代表拟合到模拟数据平均值的直线。拟合直线的斜率给出装置阻力。因此,经修改Baerveldt装置的阻力大约为0.263(mmHg/(μl/min)),如从图9B读取。流率/组123平均1-1.727699557-1.41047196-1.41047196-1.5162144922-1.491226415-1.402491676-1.402491676-1.4320699223-1.265882353-1.135077691-1.135077691-1.1786792454-1.074108828-0.770976693-0.770976693-0.8720207385-0.822609661-0.310510544-0.310510544-0.48121025表格3A.在恒流模拟中,在不同流率(μl/min)下三组模拟眼睛压力(mmHg)的结果,图9C和表格3B显示了使用根据本发明青光眼引流装置(GDD)2的两组模拟眼睛压力vs流量趋势。在图9C中,具有菱形和方形的虚线分别代表第一和第二组的模拟眼睛压力vs流量趋势。图9D中具有圆圈的虚线代图9C的表两组模拟眼睛压力vs流量结果的平均值。图9D中的粗虚线代表拟合到模拟数据平均值的直线。拟合直线的斜率给出装置阻力。因此,根据本发明的青光眼引流装置(GDD)2的阻力大约为1.8051(mmHg/(μl/min)),如从图9D读出。流率/组12平均1-0.4043507210.135480289-0.13443521621.2734092171.7344975011.50395335933.3226859053.0209716823.17182879345.2111830364.2028801334.70703158458.9533962265.6256548287.289525527表格3B.使用根据本发明的青光眼引流装置(GDD)2的,在恒流模拟中,不同流率(μl/min)下两组模拟眼睛压力(mmHg)的结果。表格3C总结了从恒流计算的经修改Baerveldt装置的平均阻力和根据本发明的青光眼引流装置(GDD)2的平均阻力。在表格3C中,“系统R”是指使用实验装置(没有流体联接到实验装置的根据本发明的青光眼引流装置(GDD)2或经修改Baerveldt装置)的获得的实验测量结果。结果显示了根据本发明的青光眼引流装置(GDD)2产生比经修改Baerveldt装置更高的阻力。这可以防止在眼睛中达到稳定压力之后可能发生的术后压力过低。阻力平均(系统+装置)系统R平均RMBD0.26300.00330.2597GDD1.80510.05931.7458表格3C.从恒流模拟计算根据本发明的青光眼引流装置(GDD)2和经修改Baerveldt装置(MBD)的平均阻力(mmHg/(μl/min))的结果。还执行了兔子模型的临证前期研究,以评价根据本发明的用于治疗青光眼的引流装置(GDD)2的活体安全性和技术性能。针对以下安全目标评价了根据本发明的青光眼引流装置(GDD)2:生物适合性和可能的眼睛刺激、术后并发症和置入容易性。在与商业获得装置比较时,该装置应具有至少等效的安全状况,如通过术后并发症(包括炎症、感染、装置封堵、装置暴露/挤出、角膜或晶体损坏、眼睛分泌物、斜视、眼睛不适等)来评价。根据本发明的GDD2被确定为比当前商业可获得装置更容易植入。在动物中没有发现炎症或感染,显示了根据本发明的青光眼引流装置(GDD)2的生物适合性。在摘除方面,GDD2是可见的,没有观察到不良反应。下方的表格4显示了对照组和实验组的动物的眼内压力(IOP)(mmHg)。对照组是没有植入/使用GDD2的动物,且实验组是已经植入和使用GDD2的动物。在表格4中,对照组包括样品No.0637(对照)、0638(对照),且实验组包括样品No.0637、0638和0639(其中L表示左眼,且R表示右眼)。表格4显示了术前、实验组术后1周、2周、6周和12周时的IOP结果。表格4。在术前和在实验组术后1周、2周、6周和12周来自对照组和实验组的动物的眼内压力(IOP)(mmHg)眼内压力(IOP)(mmHg)。如表格4所示,在2周之后在实验组中观察到没有持续的压力过低。虽然在样品No.0639R中存在低眼内压力(IOP),但是图像为表示浅的前房。结果还显示所有眼睛具有接近生理值的眼内压力。这表示在所考虑的时间段在GDD2中流体是流动的。控制眼内压力的方法本发明进一步涉及经由使用如上所述的青光眼引流装置(GDD)2在患者或主体中控制眼内压力(IOP)的方法。根据本发明实施例,IOP可通过以下方法控制:提供GDD2;和在患者或主体中植入GDD2。GDD2包括板4和管6。在一些实施例中,管6可包括管套18,其中管套18包括生物可降解管套18或生物适应性易蚀管套18。在一些实施例中,管套18可使得管6被限制为一直径,由此通过管6的流体流率(flowrate)为大约2μL/min,由此防止早期压力过低。管套18可逐渐降解使得通过管套18在管6上造成的收缩降低,因为在板4上形成纤维组织(例如水泡形成),由此防止晚期IOP升高。在一些实施例中,管套18可在不早于植入之后四(4)周开始降解(且由此开始失去其机械强度和/或机械性能),由此防止会造成早期(例如在GDD2的板4上形成纤维组织之前)压力过低的过多流体引流,且在植入之后不迟于八(8)周开始降解由此允许额外的流出以使得造成术后IOP升高的过度流体存留最小化。在一些实施例中,管套18可在植入之后的大约八(8)时或在植入之后的大约八(8)周之后完全降解和完全失去其机械强度和/或机械性能。在一些实施例中,板4可包括贮存器8,其中贮存器8在板4上方和/或周围保持包括胶原的补片材料(例如心包膜,心包组织和/或异体巩膜)和/或在板4上方和/或周围保持惰性粘弹性物质(例如玻璃酸钠和/或交联透明质酸)。GDD2的板4与在板4上方和/或周围的包括胶原的材料和/或在板4上方和/或周围的粘弹性物质一起可用作稳定性系统。在一些实施例中,稳定性系统可包括GDD2的板4、应用于板4的上方和/或周围的包括胶原的材料和应用于板4的上方和/或周围的粘弹性物质。在一些实施例中,包括胶原的材料可是柔性的。在一些实施例中,包括胶原的材料可以是经过冷冻干燥的。在一些实施例中,包括胶原的材料可包括补片。在一些实施例中,粘弹性物质可包括惰性的粘弹性物质。贮存器8可允许初始流体流动以立即降低眼睛压力。包括胶原的材料可在板4上增加额外的压力,减慢去往结膜的流体流动且防止可大致压力过低的过度引流。包括胶原的材料还可支撑结膜,由此防止人为变厚和拉伸,且有助于水泡形成,这可防止晚期IOP升高。粘弹性物质可使得结膜提升和扩张且防止瘢痕。粘弹性物质还可有助于水泡形成且可有助于防止晚期IOP升高。管套18和稳定性系统(例如板4加包括胶原的材料和/或粘弹性物质)可一起使用以控制IOP或可彼此独立地使用以控制IOP。防止并发症的方法本发明进一步涉及防止与目前可用的青光眼引流装置(GDD)相关的并发症的方法。根据本发明实施例,与目前可用的GDD相关的并发症可通过以下方法防止:提供如上所述的青光眼引流装置(GDD)2;和在患者或主体中植入GDD2。GDD2可具有低矮轮廓,以有助于水泡形成和/或防止结膜的拉伸。结膜的拉伸和/或变形会阻止结膜毛细血管中的血液流动,大致局部缺血和随后的结膜侵蚀。GDD2可具有平滑轮廓和平滑边缘以防止伤害和瘢痕。更小的管6直径可使得在管6向眼睛中插入期间和/或在管6保持在眼睛中时使得损伤角膜的风险最小化。由此,更小的管6尺寸和/或直径可有助于防止角膜失代偿(corneadecompensation)和/或角膜损坏。更小的管6尺寸和/或直径可在结膜上形成更低矮的轮廓,其可使得管6侵蚀最小化。预切割、预倒角的管6可提供无创轮廓,其可防止在插入期间和/或在保持在眼睛中时对眼睛的损坏。GDD2的管6的长度可被轻易地调整和定制,而不必将管6从眼睛去除且不必执行管6向眼睛中的再次插入。结果,可由此对前房角和虹膜可能造成的损伤。还有,作为结果,可防止前房角和虹膜可能的出血。进一步地,因为本发明的可调节管6消除了将管从眼睛去除的需要,能定制管的长度,和重新将管插入眼中,由此防止管6插入所通过的通道可能扩大,减少管周围泄漏和/或压力过低的相关风险。管6中的一个或多个微孔38可确保GDD2持续发挥功能。管6中的一个或多个微孔38可提供管6的尖端被堵塞情况下的流出。由此,沿管6长度的一个或多个微孔38可防止堵塞。管套18用作GDD2上的限流器和/或稳定性系统(例如板4加包括胶原的材料和/或粘弹性物质),用于控制GDD2中的流体流动,可有助于防止早期压力过低和/或晚期IOP升高。早期压力过低和晚期IOP升高通常与差的流体流动控制有关。包括胶原的材料(例如心包膜、心包组织和/或异体巩膜)可支撑结膜且可使得认为拉伸和/或变厚最小化。由此,包括胶原的材料可使得瘢痕最小化和/或防止瘢痕。包括胶原的材料还可使得升高的IOP阶段的发生和/或严重性最小化。粘弹性物质(例如玻璃酸钠和/或交联透明质酸)可使得结膜提升和扩张,以防止瘢痕和相关的差的水泡形成。在一些实施例中,GDD2、板4和/或管6可被用于治疗哺乳动物(一种或多种)。在一些实施例中,哺乳动物可以是人。在一些实施例中,人可以是成年人。在一些实施例中,人可以是小孩。应用在非限制性的示例性应用中,本发明的青光眼引流装置可用于降低青光眼患者的眼内压力(IOP)。尽管在本文已经公开了各个方面和实施例,但是应理解,在阅读前述内容之后本领域技术人员可理解本发明的各种其他修改和改变,而不脱离本发明的精神和范围,且目的是将所有这些修改和改变包括在所附权利要求的范围内。本文公开的各个方面和实施例用于提出例子且不是限制性的,本发明的实际范围通过所附权利要求限定。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1