用于减少或预防肝性脂肪变性的组合物和方法与流程
援引并入
本说明书中提到的所有出版物、专利和专利申请均在此通过引用而并入,其程度如同具体地和单独地指出每个单独的出版物、专利或专利申请通过引用而并入。如果通过引用而并入的出版物与本说明书存在任何不一致,则以本说明书为准。
背景技术:
肝性脂肪变性(Hepatic steatosis)(有时也被称为脂肪肝病)是一种通常以肝细胞中脂质的不正常滞留为特征的病况。肝性脂肪变性影响全世界数百万人。例如,估计在全球范围内的不同的国家中,脂肪肝病的患病率在10-24%的范围内。脂肪肝病可具有不同病因。例如,非酒精性脂肪肝病(NAFLD)通常是指以没有已知的次要病因的肝性脂肪变性为特征的一系列肝脂质病症。NAFLD可以细分为以下类别:(a)非酒精性脂肪肝(NAFL),其被定义为在不存在肝细胞损伤的组织学证据的情况下存在脂肪变性,和(b)非酒精性脂肪性肝炎(NASH),即伴随肝细胞损伤和炎症的肝性脂肪变性;NASH可能与或不与纤维化一起出现,但可进展为纤维化和硬化。NAFLD通常与能量代谢病理学(包括肥胖、血脂异常、糖尿病和代谢综合征)相关。NAFLD的患病率很高。其在普通人群中的患病率估计为20%,而NASH的患病率估计为3-5%。在患有肥胖或糖尿病的患者中,NAFLD的患病率估计为约70%,而在患有血脂异常的患者中,NAFLD的患病率估计为约50%。然而,目前尚没有已经批准的用于治疗NAFLD/NASH的药物。
抗衰老酶(Sirtuins)是高度保守的蛋白质去乙酰化酶和/或ADP-核糖基转移酶,已显示其能够延长低等模型生物如酵母、秀丽线虫(C.elegans)和果蝇的寿命。在哺乳动物中,抗衰老酶已显示能充当代谢传感器,其响应于环境信号,以协调调节多种能量稳态途径的基因的活性。例如,研究表明,抗衰老酶激活模拟卡路里限制(caloric restriction)——一种经证明能显著延长寿命的干预——的效应,并激活能改善葡萄糖稳态和脂肪通过脂肪酸氧化转化为能量的基因。
抗衰老酶途径可被定义为合并或聚合了由磷酸二酯酶(PDE)介导的途径的任何途径。PDE是与环腺苷一磷酸(cAMP)和环鸟苷一磷酸(cGMP)相互作用的酶。PDE酶家族包含多个子类,包括人类中的PDE-11。这些磷酸二酯酶的抑制剂可防止cAMP和cGMP的失活,并且可具有多种不同的生理学效应。PDE抑制剂可以是选择性的,即与另一子类相比优先抑制一个PDE子类,或是非选择性的,即对于各个PDE子类具有基本上较低程度的选择性。西地那非是选择性PDE抑制剂的一个实例,其对PDE5已经显示出选择性抑制。西地那非是已经用于治疗肺动脉高压、勃起功能障碍和高空病的药学活性剂。
技术实现要素:
本发明总体上涉及细胞和/或组织中的脂肪积累的调节。在一些实施方案中,本发明提供了用于减少、治疗或预防有需要的受试者的肝性脂肪变性的组合物、方法和试剂盒。本发明总体上涉及细胞和/或组织中的脂肪积累的调节。在一些实施方案中,本发明提供了用于减少、治疗或预防有需要的受试者的肝性脂肪变性的组合物、方法和试剂盒。
本发明提供了用于减少有需要的受试者的肝性脂肪变性的方法,该方法包括向所述受试者施用:(a)一定量的游离氨基酸形式的亮氨酸和/或其代谢物;和(b)一定量的抗衰老酶途径激活剂,其中施用(a)和(b)比单独施用(a)更大程度地减少肝性脂肪变性,从而减少所述受试者的肝性脂肪变性。本发明还提供了减少有需要的受试者的肝性脂肪变性的方法,该方法包括向所述受试者施用:(a)一定量的游离氨基酸形式的亮氨酸和/或其代谢物,和(b)一定量的PDE-5特异性抑制剂,其中施用(a)和(b)比单独施用(a)更大程度地减少肝性脂肪变性,从而减少所述受试者的肝性脂肪变性。在一些实施方案中,所述受试者已被诊断为患有所述肝性脂肪变性。在一些实施方案中,所述受试者表现为非酒精性脂肪肝病(NAFLD)。在一些实施方案中,所述NAFLD选自非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)和NASH相关肝硬化。在一些实施方案中,所述受试者表现出选自下组的肝性脂肪变性的一种或多种症状:虚弱、疲劳、原因不明的体重减轻、疼痛和黄疸。在一些实施方案中,肝性脂肪变性的减少的特征为肝泡数目或大小或密度的减少。在一些实施方案中,所述方法可进一步包括向所述受试者施用(c)第二抗衰老酶途径激活剂。
本发明还提供了预防表现出肝性脂肪变性倾向的受试者的肝性脂肪变性的方法,该方法包括在表现出肝性脂肪变性症状前向所述受试者施用:(a)一定量的游离氨基酸形式的亮氨酸和/或其代谢物,和(b)一定量的抗衰老酶途径激活剂,其中施用(a)和(b)比单独施用(a)更大程度地减少肝性脂肪变性,从而预防所述受试者的肝性脂肪变性。本发明还提供了预防表现出肝性脂肪变性倾向的受试者的肝性脂肪变性的方法,该方法包括在表现出肝性脂肪变性症状前向所述受试者施用:(a)一定量的游离氨基酸形式的亮氨酸和/或其代谢物,和(b)一定量的PDE-5特异性抑制剂,其中施用(a)和(b)比单独施用(a)更大程度地减少肝性脂肪变性,从而预防所述受试者的肝性脂肪变性。在一些实施方案中,所述方法可进一步包括向所述受试者施用(c)第二抗衰老酶途径激活剂。
本发明还提供了减少有需要的受试者的肝性脂肪变性的方法。所述方法包括向所述受试者施用一种组合物,该组合物包含:(a)一定量的游离氨基酸形式的亮氨酸;(b)一定量的二甲双胍;和(c)一定量的西地那非。在一些实施方案中,施用(a)、(b)和(c)比单独施用(a)更大程度地减少肝性脂肪变性,从而减少所述受试者的肝性脂肪变性。
本发明还提供了预防表现出肝性脂肪变性倾向的受试者的肝性脂肪变性的方法,该方法包括在表现出肝性脂肪变性症状前向所述受试者施用一种组合物,该组合物包含:(a)一定量的游离氨基酸形式的亮氨酸;(b)一定量的二甲双胍;和(c)一定量的西地那非。在一些实施方案中,施用(a)、(b)和(c)比单独施用(a)更大程度地减少肝性脂肪变性,从而预防所述受试者的肝性脂肪变性。在一些实施方案中,所述方法可进一步包括向所述受试者施用第二抗衰老酶途径激活剂。
在上述方法中任何一种方法的一些实施方案中,所述受试者在至少2个月的时程内定期进行施用。在一些实施方案中,所述肝性脂肪变性由通过选自下组的一种或多种方法可检测到的肝细胞中脂肪的积累来证实:超声波检查、计算机断层扫描(CT)、磁共振成像、血清丙氨酸转氨酶和天冬氨酸转氨酶的测量以及活检。在一些实施方案中,所述受试者的肝性脂肪变性的减少由通过选自下组的一种或多种方法可检测到的肝脂肪的减少来证实:超声波检查、计算机断层扫描(CT)、磁共振成像、血清丙氨酸转氨酶和天冬氨酸转氨酶的测量以及活检。在一些实施方案中,所述亮氨酸代谢物为β-羟基β-甲基丁酸酯(HMB)或酮异己酸(KIC)。
在一些实施方案中,向所述受试者施用的亮氨酸的量为约0.25-3g/天。在一些实施方案中,向所述受试者施用的亮氨酸的量为约0.25-3g。在一些实施方案中,向所述受试者施用的亮氨酸代谢物的量为约0.2-3g/天。在一些实施方案中,向所述受试者施用的亮氨酸代谢物的量为约0.2-3g。在一些实施方案中,在排除填充剂的情况下,所述组合物中亮氨酸的重量(wt)%为50-95wt%。在一些实施方案中,在排除填充剂的情况下,所述组合物中亮氨酸代谢物的wt%为50-95wt%。在一些实施方案中,在排除填充剂的情况下,所述组合物中抗衰老酶途径激活剂的wt%为5-50wt%。在一些实施方案中,亮氨酸与抗衰老酶途径激活剂的摩尔比为至少约20。在一些实施方案中,组分(a)为羟基甲基丁酸酯,且组分(b)为二甲双胍。在一些实施方案中,(a)为以游离氨基酸形式存在的亮氨酸,且组分(b)为二甲双胍。
在一些实施方案中,所述抗衰老酶途径激活剂为抗衰老酶激活剂。在一些实施方案中,所述抗衰老酶激活剂为白藜芦醇。在一些实施方案中,所述抗衰老酶激活剂为选自下组的多酚:绿原酸、白藜芦醇、咖啡酸、肉桂酸、阿魏酸、白皮杉醇、鞣花酸、表没食子儿茶素没食子酸酯、葡萄籽提取物,以及它们的任何类似物。在一些实施方案中,向所述受试者施用的白藜芦醇的量为0.5-100mg/天。在一些实施方案中,向所述受试者施用的绿原酸、咖啡酸、肉桂酸、阿魏酸、白皮杉醇、鞣花酸、表没食子儿茶素没食子酸酯或葡萄籽提取物或它们的任何类似物的量为0.5-500mg/天。
在一些实施方案中,所述PDE-5特异性抑制剂选自淫羊藿苷、西地那非、他达拉非、伐地那非、阿伐那非、伊地那非(lodenafil)、米罗那非和乌地那非。在一些实施方案中,向所述受试者施用的淫羊藿苷的量为1-2000mg/天。在一些实施方案中,向所述受试者施用的西地那非的量为0.05-100mg/天。在一些实施方案中,向所述受试者施用的他达拉非的量为0.01-20mg/天。在一些实施方案中,向所述受试者施用的伐地那非的量为0.01-20mg/天。在一些实施方案中,向所述受试者施用的阿伐那非的量为1-200mg/天。在一些实施方案中,向所述受试者施用的伊地那非的量为1-200mg/天。在一些实施方案中,向所述受试者施用的米罗那非的量为1-100mg/天。在一些实施方案中,向所述受试者施用的乌地那非的量为1-200mg/天。在一些实施方案中,向所述受试者施用的扎普司特的量为1-2000mg/天。
在一些实施方案中,所述抗衰老酶途径激活剂为AMPK激活剂。在一些实施方案中,AMPK激活剂为双胍。在一些实施方案中,该双胍为二甲双胍。在一些实施方案中,二甲双胍的量为二甲双胍的治疗量。在一些实施方案中,二甲双胍的治疗量为约1g/天至约2.55g/天。在一些实施方案中,二甲双胍的治疗量为约0.5g至约1.25g。在一些实施方案中,二甲双胍的量为二甲双胍的亚治疗量。在一些实施方案中,二甲双胍的亚治疗量为约20-1000mg二甲双胍/天。在一些实施方案中,二甲双胍的亚治疗量为约10-500mg二甲双胍。
在一些实施方案中,所述抗衰老酶途径激活剂为PGC-1α激活剂。在一些实施方案中,该PGC-1α激活剂为噻唑烷二酮。在一些实施方案中,该噻唑烷二酮选自罗格列酮和吡格列酮。在一些实施方案中,施用的罗格列酮的量为0.1-4mg。在一些实施方案中,施用的吡格列酮的量为0.1-45mg。在一些实施方案中,抗衰老酶途径激活剂的量为亚治疗量。
在一些实施方案中,所述方法进一步包括向所述受试者施用第二抗衰老酶途径激活剂。在一些实施方案中,所述抗衰老酶途径激活剂包括双胍,且所述第二抗衰老酶途径激活剂包括抗衰老酶激活剂。在一些实施方案中,所述抗衰老酶途径激活剂包括抗衰老酶激活剂,且所述第二抗衰老酶途径激活剂包括噻唑烷二酮。在一些实施方案中,所述抗衰老酶途径激活剂包括抗衰老酶激活剂,且所述第二抗衰老酶途径激活剂包括PDE5特异性抑制剂。在一些实施方案中,所述抗衰老酶途径激活剂包括双胍,且所述第二抗衰老酶途径激活剂包括噻唑烷二酮。在一些实施方案中,所述抗衰老酶途径激活剂包括双胍,且所述第二抗衰老酶途径激活剂包括PDE5特异性抑制剂。在一些实施方案中,所述抗衰老酶途径激活剂包括噻唑烷二酮,且所述第二抗衰老酶途径激活剂包括PDE5特异性抑制剂。
在一些实施方案中,共施用所述量的(a)和(b)。在一些实施方案中,所述量的(a)和(b)作为单个组合物同时施用。在一些实施方案中,所述量的(a)和(b)按顺序施用。在一些实施方案中,所有的所述量在15分钟、60分钟或2小时内按顺序施用。在一些实施方案中,所述组合物的所有组分在15分钟、60分钟或2小时内施用。在一些实施方案中,所述方法包括每日施用(a)和(b)1、2、3、4、5次或更多次。在一些实施方案中,所述方法包括每日施用(a)和(b)3次,并且所述受试者的肝质量在6周内减少了25%。在一些实施方案中,所述组合物基本不含选自下组的一种或多种游离氨基酸:丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。
在一些其他的实施方案中,本发明涉及一种组合物,其包含:(a)一定量的游离氨基酸形式的亮氨酸;(b)一定量的二甲双胍;和(c)一定量的西地那非。在一些实施方案中,亮氨酸的量为(a)、(b)和(c)的总重量的约50-95wt%,二甲双胍的量为(a)、(b)和(c)的总重量的约5-50wt%,且西地那非的量为(a)、(b)和(c)的总重量的约0.01-1wt%。在一些实施方案中,所述组合物被配制成包含约900-1200mg亮氨酸、约200-550mg二甲双胍和约0.1至10mg西地那非的单位剂量。在一些实施方案中,所述组合物每天施用两次。
援引并入
本说明书中提到的所有出版物、专利和专利申请均在此通过引用而并入,其程度如同具体地和单独地指出每个单独的出版物、专利或专利申请通过引用而并入。
附图说明
本专利或申请文件含有至少一张以彩色绘制的图。在请求并支付必要的费用后,专利局将会提供具有彩图的该专利或专利申请公布文本的副本。
本发明的新特征在随附的权利要求中具体阐述。通过参考以下对在其中利用到本发明原理的说明性实施方案加以阐述的详细描述和附图,将会获得对本发明的特征和优点的更好的理解,在附图中:
图1描绘了抗衰老酶途径。
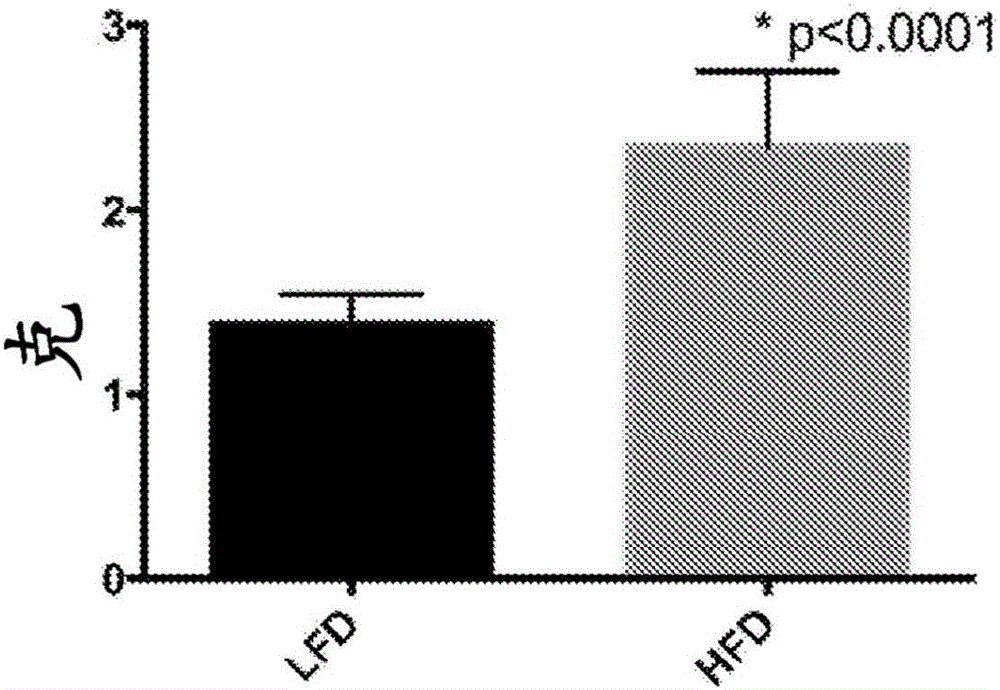
图2描绘了长期高脂肪饮食对C57Bl/6小鼠的肝质量的影响。
图3描绘了长期高脂肪饮食对C57Bl/6小鼠的肝脂质积累的影响。
图4描绘了长期高脂肪饮食后,施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸、白藜芦醇和二甲双胍的各种组合对肝质量的影响。
图5描绘了长期高脂肪饮食后,施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸、白藜芦醇和二甲双胍的各种组合对肝脂质积累的影响。
图6描绘了长期高脂肪饮食后,施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸和二甲双胍对肝质量的影响。
图7描绘了长期高脂肪饮食后,施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸和二甲双胍对肝甘油三酯含量的影响。
图8描绘了长期高脂肪饮食后,施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸和二甲双胍对肝脂质积累的组织学证据的影响。
图9描绘了施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸和二甲双胍对脂肪生成基因的肝表达的影响。
图10描绘了施用亮氨酸、施用治疗量的二甲双胍以及施用低剂量亮氨酸和二甲双胍对炎症基因的肝表达的影响。
图11描绘了长期高脂肪饮食后,施用治疗量的二甲双胍以及施用低剂量二甲双胍和HMB对肝质量的影响。
图12描绘了长期高脂肪饮食后,施用治疗量的二甲双胍以及施用低剂量二甲双胍和HMB对肝脂质积累的影响。
图13描绘了长期高脂肪饮食后,施用低剂量亮氨酸和淫羊藿苷对肝质量的影响。
图14描绘了长期高脂肪饮食后,施用低剂量亮氨酸和淫羊藿苷对肝脂质积累的影响。
图15描绘了施用低剂量亮氨酸和淫羊藿苷对脂肪酸氧化基因的肝表达的影响。
图16描绘了施用低剂量亮氨酸和淫羊藿苷对炎症基因的肝表达的影响。
图17描绘了施用低剂量亮氨酸和淫羊藿苷对C-反应蛋白的循环水平的影响。
图18描绘了亚治疗量的亮氨酸、二甲双胍和西地那非对HepG2肝细胞中的脂肪氧化(上图)和棕榈酸酯诱导的甘油三酯积累(下图)的影响。
图19描绘了长期致动脉粥样化饮食后,施用低剂量亮氨酸、二甲双胍和西地那非两周对丙氨酸氨基转移酶(ALT)的循环水平的影响。
图20描绘了长期致动脉粥样化饮食后,施用低剂量亮氨酸、二甲双胍和西地那非六周对丙氨酸氨基转移酶(ALT)的循环水平的影响。
图21描绘了施用低剂量亮氨酸、二甲双胍和西地那非六周对相对于体重归一化的肝质量的影响。
具体实施方式
本发明的几个方面参考用于说明的应用示例描述如下。应当理解,为了提供对本发明的完整理解,阐述了很多具体的细节、关系和方法。然而,相关领域普通技术人员将会容易认识到,可以不使用一种或多种所述具体细节或者可以用其他方法来实施本发明。除非另有说明,否则本发明不限于所述的行为或事件的顺序,因为一些行为可能以不同的顺序发生和/或与其他行为或事件同时发生。此外,并非需要所有描述的行为或事件来实施根据本发明的方法。所公开的组合物中多种组分的浓度是示例性的,并不意味着被限制于所提及的浓度本身。
除非上下文另有明确说明,否则如本文使用的单数形式“一个”、“一种”和“该”包括复数引用。例如,术语“一个细胞”包括多个细胞,包括它们的混合物。
术语“确定”、“测量”、“评价”、“评估”、“测定”、“探询”和“分析”在本文中可互换使用以指代任何形式的测量,并且这些术语包括确定要素是否存在。这些术语包括定量和/或定性测定。评估可以是相对的或绝对的。
如本文使用的,术语“受试者”或“个体”包括哺乳动物。哺乳动物的非限制性实例包括人和小鼠,包括转基因和非转基因小鼠。本文描述的方法可用于人类治疗、临床前和兽医应用。在一些实施方案中,受试者为哺乳动物,在一些实施方案中,受试者为人。其他哺乳动物包括但不限于,猿、黑猩猩、猩猩、猴子;驯养动物(宠物),如狗、猫、豚鼠、仓鼠、小鼠、大鼠、兔和雪貂;驯养家畜,如牛、水牛、野牛、马、驴、猪、绵羊和山羊;或通常在动物园中见到的野生动物,例如熊、狮、虎、豹、象、河马、犀牛、长颈鹿、羚羊、树懒、瞪羚、斑马、角马、草原犬鼠、无尾熊、袋鼠、熊猫、大熊猫、鬣狗、海豹、海狮和海象。
如本文使用的,“药剂”或“生物活性剂”是指生物学、药学或化学化合物或其他部分。非限制性的实例包括简单或复杂的有机或无机分子、肽、蛋白质、肽核酸(PNA)、寡核苷酸(包括,例如,适体和多核苷酸)、抗体、抗体衍生物、抗体片段、维生素衍生物、碳水化合物、毒素、游离氨基酸形式的支链氨基酸或其代谢物,或化疗化合物。可以合成各种化合物,例如,小分子和寡聚物(例如,寡肽和寡核苷酸),以及基于多种核心结构的合成有机化合物。另外,多种天然来源也可以提供化合物以供筛选,例如植物或动物提取物等。熟练技术人员可以容易地认识到,对于本发明的药剂的结构性质没有限制。
术语“施用”和“给药”被定义为通过本领域已知的途径向受试者提供组合物,该途径包括但不限于静脉内、动脉内、口服、肠胃外、颊部、局部、经皮、直肠、肌肉内、皮下、骨内、经粘膜或腹膜内给药途径。在本申请的某些实施方案中,施用组合物的口服途径可能是优选的。
如本文使用的,术语“共施用”、“联合施用”以及它们在语法上的等同表述意指包括向单个受试者施用本发明组合物和额外的治疗剂。共施用可以包括向动物施用两种或更多种药剂,使得药剂和/或它们的代谢物同时存在于受试者体内。共施用可以包括通过相同或不同的给药途径或在相同或不同的时间施用组合物和额外的治疗剂的治疗方案。共施用包括以单独的组合物的形式同时施用,在不同的时间以单独的组合物的形式施用,或以存在两种药剂的组合物的形式施用。共施用可以包括以单独的组合物的形式同时施用药剂,在不同的时间以单独的组合物的形式施用,和/或以包含每一种有待共施用的药剂的单一组合物的形式施用。
术语“有效量”或“治疗有效量”是指本文所述的化合物的量,其足以实现预期的应用,包括但不限于如下定义的疾病治疗。治疗有效量可根据预期的应用(体外或体内)或所治疗的受试者和疾病状况(例如,受试者的体重和年龄、病情的严重程度、给药方式等)而不同,其可以由本领域普通技术人员容易地确定。该术语也适用于将会诱导靶细胞中的特定应答(例如,增殖的减少或靶蛋白活性的下调)的剂量。具体剂量将根据所选的具体化合物、要遵循的给药方案、其是否与其他化合物联合施用、给药时机、其所施用到的组织和携带它的物理递送系统而不同。
如本文使用的术语“能量代谢”是指伴随体内生化反应的能量的转化,该生化反应包括细胞代谢和线粒体生物发生。能量代谢可以用本文描述的多种测量方法来量化,例如但不限于,体重减轻、脂肪损失、胰岛素敏感度、脂肪酸氧化、葡萄糖利用、甘油三酯含量、Sirt 1表达水平、AMPK表达水平、氧化应激和线粒体生物量。
当应用于本发明的组分,例如PDE 5抑制剂,包括但不限于西地那非和淫羊藿苷,亮氨酸和亮氨酸代谢物(如HMB)和白藜芦醇时,术语“分离的”是指缺乏至少一些其他组分的物质的制品,这些组分还可能存在于该物质或类似物质天然存在或最初获得之处。因此,例如,分离的物质可通过使用纯化技术从来源混合物中富集该物质来制备。富集可基于绝对量来测量,例如每单位体积的溶液的重量,或者其可相对于来源混合物中存在的第二、潜在干扰性物质来测量。本发明实施方案的越来越高的富集是逐渐更优选的。因此,例如,2倍富集是优选的,10倍富集是更优选的,100倍富集是更加优选的,1000倍富集是甚至更加优选的。物质还可以通过人工组装过程(如通过化学合成)以分离的状态提供。
途径的“调节剂”是指调节定位(mapped)到相同的特定信号转导途径的一种或多种细胞蛋白质的活性的物质或药剂。调节剂可以增强或抑制信号分子的活性和/或表达水平或模式。调节剂可以通过直接与途径中的组分结合来激活该组分。调节剂也可以通过与一种或多种相关组分相互作用来间接地激活途径中的组分。途径的输出可以依照蛋白质的表达或活性水平来测量。途径中的蛋白质的表达水平可以由相应的mRNA或相关转录因子的水平以及该蛋白质在亚细胞定位中的水平来反映。例如,某些蛋白质通过在特定的亚细胞组分内部或外部改变位置而被激活,该亚细胞组分包括但不限于细胞核、线粒体、核内体、溶酶体或细胞的其他膜性结构。途径的输出也可以依照生理效应如线粒体生物发生、脂肪酸氧化或葡萄糖摄取来测量。
“激活剂”是指以增加途径输出的方式影响途径的调节剂。特定靶标的激活可以是直接的(例如,通过与靶标相互作用)或间接的(例如,通过与包含靶标的信号传导途径中的靶标上游的蛋白质相互作用)。
术语“选择性抑制”或“选择性地抑制”当涉及生物活性剂时,是指该药剂通过与靶标的直接或间接相互作用,与脱靶信号活性相比,优先降低靶信号活性的能力。
如本文使用的术语“基本不含”是指具有少于约10%、少于约5%、少于约1%、少于约0.5%、少于0.1%或更少的特定组分的组合物。例如,基本不含非支链氨基酸的组合物可以含有少于约1%的非支链氨基酸赖氨酸。例如,基本不含非支链氨基酸可以通过与给定组合物中的其余氨基酸相比少于1%的非支链氨基酸来证实。
药剂、激活剂或疗法的“亚治疗量”是这样的量:其小于该药剂、激活剂或疗法的有效量,但是当与有效量或亚治疗量的另一种药剂或疗法联合时,由于例如得到的有效作用中的协同效应和/或减少的副作用,可以产生期望的结果。药剂或组分的亚治疗量可以是这样的量:它低于被认为是治疗量的量。例如,FDA指南可建议用于治疗特定病况的指定的给药水平,而亚治疗量将是低于FDA建议的给药水平的任何水平。亚治疗量可比被认为是治疗量的量低约1%、5%、10%、15%、20%、25%、30%、35%、50%、75%、90%或95%。可对受试者个体或受试者组评估治疗量。该受试者组可以是所有的潜在受试者,或具有特定特征如年龄、体重、种族、性别或体力活动水平的受试者。
“协同的”或“协同”效应可以是这样的,其使得联合组合物的一种或多种效应大于类似给药水平下每种单独组分的一种或多种效应,或者其可以大于类似给药水平下所有组分的效应之预测总和,假定每种组分单独作用。协同效应可以比单独使用其中一种组分时对受试者的效应或当每种组分单独施用时测定的叠加效应高大约或大于约10%、20%、30%、50%、75%、100%、110%、120%、150%、200%、250%、350%或500%或更多。该效应可以是本文描述的任何可测量的效应。
如本文所用的术语“游离氨基酸形式”或“单独的氨基酸形式”可指没有与其他氨基酸结合(例如通过肽键)的氨基酸。例如,“游离的”或“单独的”亮氨酸是指没有与其他氨基酸通过肽键结合的亮氨酸。
概述
本发明提供了用于减少或预防有需要的受试者的肝性脂肪变性的方法、组合物和试剂盒。例如,本发明提供了减少有需要的受试者的肝性脂肪变性的方法,该方法包括向受试者施用包含一定量的抗衰老酶途径激活剂如二甲双胍的组合物。减少或预防肝性脂肪变性的另一种示例性方法包括施用(a)一定量的以游离氨基酸形式存在的支链氨基酸和/或其代谢物,以及(b)额外的药剂。在一些实施方案中,该支链氨基酸和/或其代谢物是亮氨酸。在一些实施方案中,所述额外的药剂是一种或多种抗衰老酶途径激活剂。在一些实施方案中,所述额外的药剂是二甲双胍,和/或PDE抑制剂,例如西地那非。在一些实施方案中,共施用这样的支链氨基酸和/或其代谢物以及额外的药剂比单独施用任意一种所述药剂更大程度地减少或预防肝性脂肪变性。在一些实施方案中,共施用游离氨基酸形式的支链氨基酸(或其代谢物)和额外的药剂具有协同效应,例如,比单独施用游离氨基酸形式的支链氨基酸(或其代谢物)和单独施用额外的药剂的叠加效应更大程度地减少或预防肝性脂肪变性。
肝性脂肪变性的评估
本文所述的任何发明方法可包括对受试者的肝性脂肪变性的评估。例如,对受试者的肝性脂肪变性的评估可用来确定受试者是否需要减少肝性脂肪变性。对受试者的肝性脂肪变性的评估可用来确定受试者的肝性脂肪变性是否和/或多大程度上得到了预防或减少。可以通过本领域技术人员已知或本文描述的任何方法对肝性脂肪变性进行评估。受试者的肝性脂肪变性可以通过例如受试者肝脏内的脂肪积累(例如,通过受试者的肝细胞内的脂肪积累)来证实。肝脏内的脂肪积累可以通过若干种方法来指示,例如,通过超声波检查、计算机断层扫描(CT)、磁共振成像、血清丙氨酸转氨酶和天冬氨酸转氨酶的测量、肝脏大小或重量的测量或活检。
用于评估肝脏的超声波检查法可以是如本领域技术人员已知的或如本文描述的。超声波检查评估肝性脂肪变性(例如,肝脏内的脂肪积累)可以包括使用常规的B型超声波检查。对各种肝超声波检查参数的评估可用于评估肝性脂肪变性。用于评估肝性脂肪变性的示例性超声波检查参数包括但不限于(1)实质亮度,(2)肝肾对比度,(3)深度光束衰减,(4)血管壁亮度,和(5)胆囊壁清晰度。对这些超声波检查参数的评估可用来计算超声检查脂肪变性评分(USS)。例如,可如下计算USS:没有(评分0)脂肪变性被定义为正常的肝回声特性;轻度(评分1)脂肪变性被定义为细微实质回声的轻微弥漫性增强,伴随膈膜和门静脉边界的正常显现;中度(评分2)脂肪变性被定义为细微回声的中等弥漫性增强,伴随门静脉边界和膈膜的轻微受损的显现;重度(评分3)脂肪变性被定义为细微回声,没有或具有较差的门静脉边界、膈膜和右叶后段的显现。
用于评估肝脏的CT方法可以是本领域技术人员已知的或本文描述的任何方法。CT图像可由例如放射科医生进行评估。受试者的肝脏的CT图像可以通过例如测量图像中感兴趣的区域的密度进行评估。可以选择图像中感兴趣的区域以便不包含血管或其他伪影(例如,运动伪影)。CT图像中感兴趣的区域的密度可以以亨斯菲尔德(Hounsfield)单位(HU)来测量。正常肝组织可具有40-60HU的HU测量值。相反地,脂肪通常具有较低的密度。例如,脂肪可具有例如约-100至约-500的HU测量值。肝性脂肪变性可由小于40HU的HU测量值来证实。肝性脂肪变性可由-500至40HU的HU测量值,例如,-500-1HU、-100-10HU、0-20HU、5-30HU或20-39.9HU的HU测量值来证实。可被诊断为患有肝性脂肪变性的受试者是表现出39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1、0或小于0HU的HU测量值的受试者。肝性脂肪变性可由脾与肝之间的HU测量值的差(例如,HU脾-HU肝)来证实。例如,如果HU脾-HU肝大于0,例如,如果HU脾-HU肝为1-10、10-20或大于20,则可以证实肝性脂肪变性。在一些实施方案中,18.5的脾与肝之间的HU测量值差用来诊断肝性脂肪变性。
用于评估肝脏的MRI方法可以是本领域技术人员已知的或本文描述的任何方法。利用MRI确定脂肪变性例如肝性脂肪变性的示例性方法描述于美国专利申请公开号20050215882中,该专利申请通过引用并入于此。
肝性脂肪变性可以通过测量血清丙氨酸转氨酶(ALT)和/或天冬氨酸转氨酶水平来证实。测量血清丙氨酸转氨酶和/或天冬氨酸转氨酶水平的方法可以是本领域技术人员已知的或本文描述的任何方法。肝性脂肪变性可以通过与未患有肝性脂肪变性的对照受试者相比,血清ALT水平的升高来指示。在一些情况下,肝性脂肪变性可以通过与未患有肝性脂肪变性的对照受试者相比,血清ALT水平和血清天冬氨酸转氨酶水平的升高来指示。在一些情况下,肝性脂肪变性可以通过大于1的天冬氨酸转氨酶与丙氨酸转氨酶之比来指示。
肝性脂肪变性可以通过测量肝脏重量和/或大小来证实。测量肝脏重量和/或大小的方法可以是本领域技术人员已知的或本文描述的任何方法。肝性脂肪变性可以通过与未患有肝性脂肪变性的对照受试者相比,肝脏重量和/或大小的增加来指示。在一些实施方案中,与未患有肝性脂肪变性的对照受试者相比,肝脏重量/大小增加10%或更多、15%或更多、20%或更多、25%或更多、30%或更多、35%或更多、40%或更多、45%或更多、50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、100%或大于100%可以指示受试者的肝性脂肪变性。
肝性脂肪变性可通过组织活检来证实。肝活检样品可通过本领域技术人员已知的任何方法例如通过针吸活检来获得。可通过本领域技术人员已知的或本文描述的任何方法处理该样品。该样品可以是固定的(例如,用福尔马林)或者可以是不固定的。可以将该样品快速冷冻。例如,可将该样品切成薄切片。可采用例如苏木精和曙红将切片染色。肝脏内的脂肪积累可由充满脂质如(仅举例来说)甘油三酯的空泡的出现来证实。这样的空泡可能在视觉上看起来是“空的”,因为脂肪可以在组织学组织处理过程中溶解。因此,可通过测量肝脂质空泡的数目、大小或密度来确定肝性脂肪变性的水平。
可以使用本文描述的任何评估方法来确定肝性脂肪变性的水平。仅举非限制性实例来说,可将肝性脂肪变性的水平定量为肝脏中脂肪积累的百分比(例如,脂肪含量)。在一些实施方案中,按照0-3分对肝性脂肪变性进行评分,其中0=肝脏中<5%的脂肪积累,1=肝脏中5%-33%的脂肪积累,2=肝脏中33%-66%的脂肪积累,3=肝脏中>66%的脂肪积累。肝脏脂肪含量可通过本领域技术人员已知的任何方法来评估,这些方法包括例如质子磁共振波谱法、活检或本文描述的任何其他方法。
有需要的受试者的肝性脂肪变性的减少
施用和/或共施用本文描述的任何化合物可以减少有需要的受试者的肝性脂肪变性。需要减少肝性脂肪变性的示例性受试者可以包括被诊断为患有肝性脂肪变性的受试者。本文描述的用于评估肝性脂肪变性的或本领域已知的任何方法可用于诊断受试者的肝性脂肪变性。例如,如果受试者表现出5%或更高的肝脂肪含量、10%或更高的肝脂肪含量、20%或更高的肝脂肪含量、30%或更高的肝脂肪含量、40%或更高的肝脂肪含量、50%或更高的肝脂肪含量、60%或更高的肝脂肪含量、或70%或更高的肝脂肪含量,则可将该受试者诊断为患有肝性脂肪变性。如果受试者表现出肝脏内5%-33%的脂肪积累,则可将该受试者诊断为患有1期肝性脂肪变性。如果受试者表现出肝脏内33%-66%的脂肪积累,则可将该受试者诊断为患有2期肝性脂肪变性。如果受试者表现出肝脏内超过66%的脂肪积累,则可将该受试者诊断为患有3期肝性脂肪变性。
所述受试者可能表现为非酒精性脂肪肝病(NAFLD)。NAFLD的诊断可以包括肝性脂肪变性的诊断。NAFLD的诊断可以进一步包括测定该受试者的平均每天饮酒量。在一些情况下,如果受试者被诊断为患有肝性脂肪变性并被确定为平均每天消耗少于20克的酒精(例如,平均少于25mL酒精/天),则将该受试者诊断为患有NAFLD。受试者的NAFLD可进展为非酒精性脂肪性肝炎(NASH)。
所述受试者可表现为NASH。NASH的诊断可包括NAFLD的诊断。NASH的诊断可进一步包括测定与肝性脂肪变性并发的受试者的肝内炎症。例如,一旦检测到肝脂肪积累(脂肪变性)以及以下肝脏状况中的一种或多种:炎症、肝细胞气球样变性(有时伴随可识别的马洛里小体)、糖原生成的肝细胞核和细胞外周纤维化,则可将受试者诊断为患有NASH。可通过三色染色法鉴定细胞外周纤维化。一经三色染色,细胞外周纤维化便可表现出例如特征性的“养鸡网(chicken wire)”图案。受试者的NASH可进展为肝硬化。
需要减少肝性脂肪变性的受试者可能具有肝性脂肪变性的症状。示例性症状包括但不限于疲劳、不适、原因不明的体重减轻、虚弱、缺乏食欲、恶心、皮肤下出现小而红的蜘蛛状静脉、易擦伤、黄疸、内出血(例如,食管或肠内充血静脉出血)、性冲动丧失、腹水、瘙痒、水肿、精神错乱以及痛或疼痛(例如,右上腹的痛或疼痛)。在一些实施方案中,所述受试者是无症状的。
肝性脂肪变性的减少可通过与对照受试者和/或对照群体的比较来确定。如果与对照受试者和/或对照群体相比,受试者的如通过本文描述的任何方法测得的肝脂肪含量、肝脏大小或重量、肝泡数目、肝泡的大小、肝泡密度、血清丙氨酸转氨酶(ALT)和/或天冬氨酸转氨酶水平中的任何一个或多个减少,则可以认为该受试者的肝性脂肪变性减少。对照受试者可以是没有施用本文描述的一种或多种化合物的个体。同样地,对照群体可以包括没有施用本文描述的一种或多种化合物的多个个体。对照受试者可以是没有施用本文描述的一种或多种化合物的患有肝性脂肪变性的受试者。对照受试者可以是不同的受试者。
对照受试者不必是不同于所述受试者的个体。例如,对照受试者可以是在较早的时间点,例如,在接受第一剂量的本文描述的任何化合物之前的相同受试者。在一些实施方案中,将施用本文描述的一种或多种化合物后受试者的肝性脂肪变性的水平与第一次施用所述一种或多种化合物前该受试者的肝性脂肪变性的水平进行比较。
评估有需要的受试者的肝性脂肪变性减少的示例性方法可以包括在第一时间点测量该受试者或来源于该受试者的生物样品中的肝性脂肪变性的水平。该第一时间点可以是施用本文描述的一种或多种化合物之前的时间点。所述方法可以进一步包括在第二时间点测量该受试者或来源于该受试者的生物样品中的肝性脂肪变性的水平。该第二时间点可以在施用本文描述的一种或多种化合物之后。可将在第二时间点测得的水平与在第一时间点测得的水平进行比较,以确定是否已发生减少。肝性脂肪变性的减少可以指示施用本文描述的一种或多种化合物的临床功效。如果受试者的肝性脂肪变性的水平降低,则所述方法可以进一步包括施用附加剂量的本文描述的一种或多种化合物。
实施本发明的任何一种方法可以使肝性脂肪变性减少至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或大于99%。例如,实施本发明的任何一种方法可以使肝性脂肪变性减少5-20%、10-40%、30-60%、40-80%、60-95%或75-99%。在一些实施方案中,施用本文描述的药剂的任意组合在约六周或更短的时间内减少了肝性脂肪变性。施用本文描述的药剂的任意组合可以在约六周内例如使肝脏重量减少25%。仅举例来说,施用本文描述的药剂的任意组合可以在约六周内使肝泡数目、大小和/或密度减少超过25%、超过50%、超过75%或超过90%。
肝性脂肪变性的预防
施用和/或共施用本文描述的任何化合物可以减少有需要的受试者的肝性脂肪变性。需要减少肝性脂肪变性的示例性受试者可以包括表现出肝性脂肪变性倾向或具有发展为肝性脂肪变性的高风险的受试者。
已发现多个环境和遗传风险因素增加受试者发展为肝性脂肪变性的倾向。如果受试者表现出本文描述的风险因素的任意组合,则该受试者可表现出发展为肝性脂肪变性的倾向。与表现出较少数目的风险因素的受试者相比,受试者表现出的风险因素的数目越大,可表明发展为肝性脂肪变性的倾向越高。应当理解,如果受试者表现出甚至1个、2个、3个或更多个本文描述的风险因素,则可以认为该受试者表现出发展为肝性脂肪变性的倾向。
发展为肝性脂肪变性的示例性风险因素是肥胖。因此,如果受试者是肥胖的,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。受试者的肥胖可以利用身体质量指数(BMI)测量值来评估。受试者的BMI可以通过受试者的体重(以kg计)除以受试者的身高的平方(m2)来计算。如果受试者表现出超过25kg/m2、超过26kg/m2、超过27kg/m2、超过28kg/m2、超过29kg/m2、超过30kg/m2、超过31kg/m2、超过32kg/m2、超过33kg/m2、超过34kg/m2、超过35kg/m2、超过36kg/m2、超过37kg/m2、超过38kg/m2、超过39kg/m2或超过40kg/m2的BMI,则可以认为该受试者是肥胖的。如果受试者表现出腹部肥胖,则也可以认为该受试者表现出发展为肝性脂肪变性的倾向。腹部肥胖可以通过测量受试者的腰围来评估。例如,受试者为成年男性时,如果该受试者表现出102cm或更大的腰围,则可以认为该受试者表现出腹部肥胖。对于其他实例,受试者为成年女性时,如果该受试者表现出88cm或更大的腰围,则可以认为该受试者表现出腹部肥胖。
发展为肝性脂肪变性的另一个示例性风险因素是高血压。因此,如果受试者表现出高血压,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。受试者的血压可以通过测量受试者的收缩压和/或舒张压(bp)来评估。如果受试者表现出120或更高、121或更高、122或更高、123或更高、124或更高、125或更高、126或更高、127或更高、128或更高、129或更高、130或更高、131或更高、132或更高、133或更高、134或更高、135或更高、136或更高、137或更高、138或更高、139或更高或140或更高的收缩血压,则可以认为该受试者表现出高血压。如果受试者表现出80或更高、81或更高、82或更高、83或更高、84或更高、85或更高、86或更高、87或更高、88或更高、89或更高、90或更高、91或更高、92或更高、93或更高、94或更高、95或更高、96或更高、97或更高、98或更高、99或更高或100或更高的舒张血压,则可以认为该受试者表现出高血压。
发展为肝性脂肪变性的另一个示例性风险因素是高胆固醇。因此,如果受试者表现出高胆固醇,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。受试者的胆固醇可以通过测量受试者的血总胆固醇水平来评估。如果受试者表现出例如超过200mg/dl的血总胆固醇、超过210mg/dl的血总胆固醇、超过220mg/dl的血总胆固醇、超过230mg/dl的血总胆固醇或超过240mg/dl的血总胆固醇,则可以认为该受试者表现出高胆固醇。如果受试者表现出200-220mg/dl的血总胆固醇、220-240mg/dl的血总胆固醇、或240mg/dl的血总胆固醇或更高的血总胆固醇,则可以认为该受试者表现出高胆固醇。受试者的胆固醇也可以通过测量受试者的血液低密度脂蛋白(LDL)水平来评估。如果受试者表现出例如130mg/dl LDL或更高的LDL、135mg/dl LDL或更高的LDL、140mg/dl LDL或更高的LDL、145mg/dl LDL或更高的LDL、150mg/dl LDL或更高的LDL、155mg/dl LDL或更高的LDL、160mg/dl LDL或更高的LDL、165mg/dl LDL或更高的LDL、170mg/dl LDL或更高的LDL、175mg/dl LDL或更高的LDL、180mg/dl LDL或更高的LDL、185mg/dl LDL或更高的LDL或190mg/dl LDL或更高的LDL,则可以认为该受试者表现出高胆固醇。受试者的胆固醇也可以通过测量受试者的血液高密度脂蛋白(HDL)水平来评估。如果受试者表现出例如60mg/dl HDL或更低的HDL、55mg/dl HDL或更低的HDL、50mg/dl HDL或更低的HDL、45mg/dl HDL或更低的HDL或40mg/dl HDL或更低的HDL,则可以认为该受试者表现出高胆固醇。
发展为肝性脂肪变性的另一个示例性风险因素是胰岛素抗性。因此,如果受试者表现出胰岛素抗性,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。受试者的胰岛素抗性可以通过本领域已知或本文描述的任何方法来评估。仅举例来说,胰岛素抗性可以通过测量受试者的胰岛素抗性稳态评价(HOMAIR)来评估。HOMAIR可以通过本领域已知的任何方法,例如,通过下式:HOMAIR=[胰岛素(uU/mL)X葡萄糖(mM)]/22.5来确定。HOMAIR值随胰岛素抗性的增加而增加,并且通常值大于(2.6)被认为是胰岛素抗性的。如果受试者表现出高于第75个百分位的HOMAIR,或超过2.6的HOMAIR值,则可以认为该受试者表现出胰岛素抗性。胰岛素抗性也可以通过测量受试者的空腹血清胰岛素水平来评估。如果受试者表现出60pmol/L或更高的空腹血清胰岛素水平,则可以认为该受试者表现出胰岛素抗性。胰岛素抗性也可以通过测量受试者的定量胰岛素敏感度检查指数(QUICKI)来评估。QUICKI可以通过下式来确定:QUICKI=1/(log(空腹胰岛素μU/mL)+log(空腹血糖mg/dL))。如果受试者表现出0.30或更小的QUICKI,则可以认为该受试者表现出胰岛素抗性。对于其他实例,胰岛素抗性在一些情况下可以通过测量施用团剂量(bolus)的胰岛素后一段时间内受试者的血糖水平来确定。与不具有胰岛素抗性的受试者相比,具有胰岛素抗性的受试者在施用胰岛素后通常表现出减弱的血糖水平下降。
发展为肝性脂肪变性的另一个示例性风险因素是糖尿病。因此,如果受试者患有或被诊断为患有糖尿病,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。该糖尿病可以是I型或II型糖尿病。糖尿病可以通过本领域技术人员已知或本文描述的任何方法进行诊断。例如,如果受试者表现出高空腹血浆葡萄糖水平(例如,126mg/dl或更高),则可将该受试者诊断为患有糖尿病。如果受试者在施用团剂量的葡萄糖后表现出高血浆葡萄糖水平(例如,在葡萄糖耐量试验中),则可将该受试者诊断为患有糖尿病。例如,如果受试者在施用75g团剂量的葡萄糖后2h,表现出200mg/dl或更高的血浆葡萄糖,则可将该受试者诊断为患有糖尿病。
遗传学可能是发展为肝性脂肪变性的一个风险因素。例如,印度、亚洲和/或墨西哥血统的男性可能具有发展为肝性脂肪变性的高风险。因此,如果受试者是非洲、亚洲和/或墨西哥血统的男性,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。遗传多态性也可能与增加的发展为肝性脂肪变性的倾向相关。例如,如果受试者表现出APOC3基因中的T455C或C482T多态性,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。
某些药物增加发展为肝性脂肪变性的风险。这些增加发展为肝性脂肪变性的风险的药物包括但不限于口服皮质类固醇(例如,泼尼松、氢化可的松等)、合成雌激素(例如,Premarin、Ortho-Est、他莫昔芬等)、胺碘酮(可达龙(Cordarone)、胺碘酮片(Pacerone))、地尔硫抗逆转录病毒药物如茚地那韦以及甲氨蝶呤。因此,如果受试者已经服用了本文描述的任何增加发展为肝性脂肪变性的风险的药物,则可以认为该受试者表现出增加的发展为肝性脂肪变性的倾向。
在一些实施方案中,表现出发展为肝性脂肪变性的倾向的受试者还没有发展为肝性脂肪变性。例如,受试者可能还没有表现出肝性脂肪变性的症状。对于其他实例,受试者可能不表现出升高的肝脂肪含量。在一些实施方案中,受试者未被诊断出患有肝性脂肪变性。在一些实施方案中,与未患有肝性脂肪变性的对照受试者相比,受试者未表现出血清ALT水平的升高。
实施本发明的任何一种方法可以预防或减少至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或大于99%的经治疗受试者的肝性脂肪变性的发生。例如,实施本发明的任何一种方法可以预防肝性脂肪变性或将肝性脂肪变性的发生率减少5-20%、10-40%、30-60%、40-80%、60-95%或75-99%。在一些实施方案中,施用本文描述的药剂的任意组合大约、少于约或长于约1、2、3、4、5、6、7、8周或2、4、6、12或24个月,并且这样的施用预防或减少了给药受试者的肝性脂肪变性的发生。肝性脂肪变性的预防可通过与参照受试者和/或参照群体的比较来确定。如果与参照受试者和/或参照群体相比,受试者的如通过本文描述的任何方法测得的肝脂肪含量、肝脏大小或重量、肝泡数目、肝泡大小、肝泡密度、血清丙氨酸转氨酶(ALT)和/或天冬氨酸转氨酶水平中的任何一个或多个没有增加或较小程度地增加,则可以认为该受试者的肝性脂肪变性得到了预防或发生率减小。参照受试者和/或参照群体可以是尚未发展为肝性脂肪变性且没有用本文描述的一种或多种化合物治疗的、表现出相当的发展为肝性脂肪变性的倾向的另一受试者或受试者群体。
示例性化合物
本发明提供了用于减少和/或预防肝性脂肪变性的化合物。例如,共施用游离氨基酸形式的支链氨基酸或其代谢物以及额外的药剂可减少和/或预防受试者的肝性脂肪变性。所述额外的药剂可以是抗衰老酶途径激活剂和/或PDE抑制剂如PDE5抑制剂。
支链氨基酸
支链氨基酸可具有脂肪族侧链,该侧链具有与两个或更多个其他原子结合的分支碳原子。所述其他原子可以是碳原子。支链氨基酸的实例包括亮氨酸、异亮氨酸和缬氨酸。支链氨基酸也可包括其他化合物,如4-羟基异亮氨酸。这些支链氨基酸可以以游离氨基酸形式施用于受试者。在一些实施方案中,游离氨基酸形式的支链氨基酸是游离氨基酸形式的亮氨酸。在一些实施方案中,包含游离氨基酸形式的支链氨基酸的组合物基本不含一种或多种或所有非支链氨基酸。在一些实施方案中,所述组合物基本不含一种或多种或所有游离氨基酸形式的非支链氨基酸。例如,所述组合物可以基本不含丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、组氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸和/或酪氨酸。所述组合物可以基本不含游离氨基酸形式的丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、组氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸和/或酪氨酸。在一些实施方案中,所述组合物基本不含游离形式的异亮氨酸和/或缬氨酸。
在一些实施方案中,本文描述的方法可包括施用任何支链氨基酸的盐、衍生物、代谢物、分解代谢产物、合成代谢产物、前体和/或类似物。该代谢物可以是亮氨酸的代谢物,如HMB。支链氨基酸的代谢物可包括羟基甲基丁酸酯(HMB)、α-羟基异己酸和酮异己酸(KIC)、酮异戊酸酯/盐和酮异己酸酯/盐。支链氨基酸的非限制性的示例性合成代谢产物可包括谷氨酸、谷氨酰胺、苏氨酸、α-酮丁酸、α-乙酰-α-羟基丁酸酯、α,β-二羟基-β-甲基戊酸酯、α-酮-β-甲基戊酸酯、α,β-二羟基异戊酸酯和α-酮异戊酸酯。
在本发明的某些实施方案中,可配制向受试者施用的任意组合物,以使它们不含(或排除)一种或多种选自赖氨酸、谷氨酸、脯氨酸、精氨酸、缬氨酸、异亮氨酸、天冬氨酸、天冬酰胺、甘氨酸、苏氨酸、丝氨酸、苯丙氨酸、酪氨酸、组氨酸、丙氨酸、色氨酸、甲硫氨酸、谷氨酰胺、牛磺酸、肉碱、胱氨酸和半胱氨酸的氨基酸。可以配制本文公开的任意组合物,以使它们不含(或排除)一种或多种选自赖氨酸、谷氨酸、脯氨酸、精氨酸、缬氨酸、异亮氨酸、天冬氨酸、天冬酰胺、甘氨酸、苏氨酸、丝氨酸、苯丙氨酸、酪氨酸、组氨酸、丙氨酸、色氨酸、甲硫氨酸、谷氨酰胺、牛磺酸、肉碱、胱氨酸和半胱氨酸的氨基酸。在一些情况下,组合物不含任何非支链氨基酸。在一些情况下,组合物不含任何游离氨基酸形式的非支链氨基酸。组合物中非支链氨基酸的质量或摩尔量可小于总组合物的0.01%、0.1%、0.5%、1%、2%或5%。游离氨基酸形式的非支链氨基酸的质量或摩尔量可小于总组合物的0.01%、0.1%、0.5%、1%、2%或5%。除亮氨酸或其代谢物外的任何支链氨基酸或其代谢物的质量或摩尔量可小于总组合物的0.01%、0.1%、0.5%、1%、2%或5%。除亮氨酸或其代谢物外的任何游离氨基酸形式的支链氨基酸或其代谢物的质量或摩尔量可小于总组合物的0.01%、0.1%、0.5%、1%、2%或5%。
示例性抗衰老酶途径激活剂
抗衰老酶途径激活剂可包括激活抗衰老酶途径中的一种或多种组分的任何药剂。抗衰老酶途径包括但不限于信号分子,如Sirt 1、Sirt 3和AMPK。该途径的输出可以通过表达水平和/或途径的活性和/或生理效应来测定。在一些实施方案中,Sirt1途径的激活包括PGC1-α的刺激和/或随后的线粒体生物发生和脂肪酸氧化的刺激。抗衰老酶途径的增强或激活可通过途径中的组分蛋白质活性的升高而观察到。例如,该蛋白质可以是Sirt1、PGC1-α、AMPK、Epac1、腺苷酸环化酶、Sirt3或任意其他蛋白质及其相应的沿着图1所示信号途径的相关蛋白质(Park等人,“Resveratrol Ameliorates Aging-Related Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases,”Cell 148,421-433,2012年2月3日)。可充当抗衰老酶途径输出的量度的生理效应的非限制性实例包括线粒体生物发生、脂肪酸氧化、棕榈酸酯摄取、氧消耗、二氧化碳生成、体重减轻、热量产生、内脏脂肪组织减少、呼吸交换率、胰岛素敏感度、炎症标志物水平、血管舒张、脂肪细胞褐化和鸢尾素产生。脂肪细胞褐化的指标的实例包括但不限于增加的脂肪酸氧化和一种或多种褐色脂肪选择性基因(例如Ucp1、Cidea、Prdm16和Ndufs1)的表达。在一些实施方案中,可充当抗衰老酶途径输出量度的一种或多种生理效应的变化通过增加鸢尾素产量而诱导。
线粒体生物发生的升高可以通过新线粒体形成的增加和/或通过线粒体功能的增强来证实,例如受试者中脂肪酸氧化增加、热量产生增加、胰岛素敏感度升高、葡萄糖摄取增加、血管舒张增强、体重减轻、脂肪体积减小和炎性应答或标志物减少。
在一些实施方案中,所述抗衰老酶途径激活剂为抗衰老酶激活剂。该抗衰老酶激活剂可以是Sirt1激活剂、Sirt2激活剂和/或Sirt3激活剂。Sirt1活性可以通过测定可使用荧光团检测的底物的去乙酰化来确定。通过将相应的底物应用于在体外进行的去乙酰化分析中而观察sirt1、sirt2或sirt3的升高。用于测定SIRT1活性的底物可以是本领域已知的任何底物(例如包含人p53的氨基酸379-382(Arg-His-Lys-Lys[Ac])的肽)。用于测定SIRT3活性的底物可以是本领域已知的任何底物(例如包含人p53的氨基酸317-320(Gln-Pro--Lys-Lys[Ac])的肽)。
示例性的抗衰老酶激活剂可包括在Howitz等人(2003)Nature 425:191中描述的那些激活剂,包括,例如,白藜芦醇(3,5,4′-三羟基-反式-茋)、紫铆因(3,4,2′,4′-四羟基查耳酮)、白皮杉醇(3,5,3′,4′-四羟基-反式-茋)、异甘草素(4,2′,4′-三羟基查耳酮)、漆黄素(3,7,3′,4′-四羟基黄酮)、槲皮素(3,5,7,3′,4′-五羟基黄酮)、脱氧土大黄苷(3,5-二羟基-4′-甲氧基茋3-O-β-D-葡萄糖苷);反式-茋;土大黄苷(3,3′,5-三羟基-4′-甲氧基茋3-O-β-D-葡萄糖苷);顺式-茋;紫铆因(3,4,2′,4′-四羟基查耳酮);3,4,2′4′6′-五羟基查耳酮;查耳酮;7,8,3′,4′-四羟基黄酮;3,6,2′,3′-四羟基黄酮;4′-羟基黄酮;5,4′-二羟基黄酮5,7-二羟基黄酮;桑色素(3,5,7,2′,4′-五羟基黄酮);黄酮;5-羟基黄酮;(-)-表儿茶素(羟基位点:3,5,7,3′,4′);(-)-儿茶素(羟基位点:3,5,7,3′,4′);(-)-没食子儿茶素(羟基位点:3,5,7,3′,4′,5′);(+)-儿茶素(羟基位点:3,5,7,3′,4′);5,7,3′,4′,5′-五羟基黄酮;木犀草素(5,7,3′,4′-四羟基黄酮);3,6,3′,4′-四羟基黄酮;7,3′,4′,5′-四羟基黄酮;茨非醇(3,5,7,4′-四羟基黄酮);6-羟基芹黄素(5,6,7,4′-四羟基黄酮);野黄芩素);芹黄素(5,7,4′-三羟基黄酮);3,6,2′,4′-四羟基黄酮;7,4′-二羟基黄酮;大豆苷(7,4′-二羟基异黄酮);染料木素(5,7,4′-三羟基黄烷酮);柚皮素(5,7,4′-三羟基黄烷酮);3,5,7,3′,4′-五羟基黄烷酮;黄烷酮;氯化天竺葵色素(3,5,7,4′-四羟基花色基元黄盐氯化物);扁柏酚(b-苧侧素;2-羟基-4-异丙基-2,4,6-环庚三烯-1-酮);L-(+)-麦角硫因((S)-a-羧基-2,3-二氢-N,N,N-三甲基-2-硫基-1H-咪唑-4-乙胺内盐);咖啡酸苯基酯;MCI-186(3-甲基-1-苯基-2-吡唑啉-5-酮);HBED(N,N′-二-(2-羟基苄基)乙二胺-N,N′-二乙酸-H2O);氨溴索(反-4-(2-氨基-3,5-二溴苄基氨基)环己烷-HCl;以及U-83836E((-)-2-((4-(2,6-二-1-吡咯烷基-4-嘧啶基)-1-哌嗪基)甲基)-3,4-二氢-2,5,7,8-四甲基-2H-1-苯并吡喃-6-醇.2HCl)。也可使用其类似物和衍生物。
在一些实施方案中,所述抗衰老酶途径激活剂为AMPK途径激活剂。AMPK活性可以通过本领域已知的任何方法,例如,经由ELISA测定或通过Western印迹法测量AMPK磷酸化来确定。该AMPK途径激活剂可以是双胍。双胍的实例包括但不限于双胍的实例包含但不限于二甲双胍、丁双胍、苯乙双胍、氯胍等。
在一些实施方案中,所述抗衰老酶途径激活剂(例如,AMPK途径激活剂)是多酚。示例性的多酚包括,例如,绿原酸、白藜芦醇、咖啡酸、白皮杉醇、鞣花酸、表没食子儿茶素没食子酸酯(EGCG)、茋、羟基肉桂酸、葡萄籽提取物或其任意类似物。在一些实施方案中,该抗衰老酶途径激活剂是白藜芦醇、其类似物或其代谢物。例如,该激活剂可以是紫檀茋或白藜芦醇的小分子类似物。白藜芦醇的小分子类似物的实例描述在美国专利申请号20070014833、20090163476和20090105246中,这些申请通过引用而整体并入本文。
所述多酚可以是基本上均质的一组多酚。该多酚可以是一种类型的多酚,其中该组合物可以排除所有其他类型的多酚。在一些实施方案中,本发明方法包括施用一种类型的多酚,并排除所有其他类型的多酚。在一些实施方案中,本发明方法包括施用两种、三种或四种类型的多酚,并排除所有其他类型的多酚。在一些实施方案中,本发明方法包括施用1种、2种、3种或4种类型的多酚,以及少于0.1%、0.5%、1%或2%的任何其他类型的多酚。
抗衰老酶途径激活剂也可以包括PDE抑制剂。PDE抑制剂可以包括非特异性PDE抑制剂。PDE抑制剂可以是天然存在的或非天然存在的(例如制造的),并且可以以包含该PDE抑制剂的天然来源或其提取物(例如纯化的)的形式提供。非特异性PDE抑制剂的实例包括但不限于咖啡因、茶碱、可可碱、3-异丁基-1-甲基黄嘌呤(IBMX)、己酮可可碱(3,7-二氢-3,7-二甲基-1-(5氧代己基)-1H-嘌呤-2,6-二酮)、氨茶碱、副黄嘌呤,以及它们的盐、衍生物、代谢物、分解代谢产物、合成代谢产物、前体及类似物。PDE抑制剂的天然来源的非限制性实例包括咖啡、茶、瓜拉那、巴拉圭茶、可可和巧克力(例如黑巧克力)。
抗衰老酶途径激活剂可以包括鸢尾素、奎尼酸、肉桂酸、阿魏酸、岩藻黄质、罗格列酮或它们的任何类似物。抗衰老酶途径激活剂也可以包括异黄酮、吡咯并喹啉(PQQ)、槲皮素、L-肉碱、硫辛酸、辅酶Q10、丙酮酸酯/盐、5-氨基咪唑-4-甲酰胺核糖酸(ALCAR)、苯扎贝特、奥替普拉和/或染料木黄酮。
抗衰老酶途径激活剂可以是刺激Fndc5、PGC1-α或UCP1表达的药剂。该表达可在基因或蛋白质表达水平方面进行测定。或者,抗衰老酶途径激活剂可以是鸢尾素。提高鸢尾素水平的方法描述于等人,“A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogeneis,”Nature,2012年1月11日。
抗衰老酶途径激活剂可包括噻唑烷二酮。示例性的噻唑烷二酮包括,例如,罗格列酮、吡格列酮、曲格列酮以及它们的任何类似物。
示例性PDE抑制剂
本发明的一种或多种方法可以进一步包括向受试者施用PDE抑制剂。PDE抑制剂可充当抗衰老酶途径激活剂。该PDE抑制剂可以是选择性的或非选择性的。该PDE抑制剂可以对PDE子类如PDE 5表现出选择性抑制。选择性PDE抑制剂的实例包括针对PDE 1、2、3、4、5、6、7、8、9、10或11的抑制剂。非选择性PDE抑制剂可以是无法区分磷酸二酯酶的子类的PDE抑制剂。此外,一些非选择性PDE抑制剂可以与超过一种代谢途径相互作用。例如,一些非选择性PDE抑制剂可以是黄嘌呤衍生物且充当腺苷拮抗剂,并且具有未知的与其他代谢途径的相互作用。选择性PDE抑制剂可以是对选定的PDE表现出优先相互作用的PDE抑制剂。例如,PDE抑制剂可具有与PDE 5的强相互作用,而具有很弱的与其他PDE子类的相互作用。
PDE抑制剂可以是天然存在的或非天然存在的(例如制造的),并且可以以包含该PDE抑制剂的天然来源或其提取物(例如纯化的)的形式提供。在一些实施方案中,该PDE抑制剂是非特异性PDE抑制剂。非特异性PDE抑制剂的实例包括但不限于咖啡因、茶碱、可可碱、3-异丁基-1-甲基黄嘌呤(IBMX)、己酮可可碱(3,7-二氢-3,7-二甲基-1-(5氧代己基)-1H-嘌呤-2,6-二酮)、氨茶碱、副黄嘌呤,以及它们的盐、衍生物、代谢物、分解代谢产物、合成代谢产物、前体及类似物。该PDE抑制剂可以来源于PDE抑制剂的天然来源。PDE抑制剂的天然来源的非限制性实例包括咖啡、茶、瓜拉那、巴拉圭茶、可可和巧克力(例如黑巧克力)。
选择性地和负面地调节PDE子类如PDE 5的表达或活性的任何药剂可在本发明的组合物和方法中用作选择性PDE抑制剂。
例如,选择性PDE抑制剂备选地可以是这样一种药剂,其对PDE子类如PDE 5表现出的50%抑制浓度(IC50)比该抑制剂对一、二、三种或更多种其他PDE子类的IC50低至少10倍、至少20倍、至少50倍、至少100倍、至少1000倍、至少10,000倍。在一些实施方案中,选择性PDE抑制剂可以是这样一种药剂,其对PDE子类如PDE 5表现出的50%抑制浓度(IC50)比该抑制剂对所有其他PDE子类的IC50低至少10倍、至少20倍、至少50倍、至少100倍、至少1000倍、至少10,000倍或更多倍。
在一个方面,IC50是在基于细胞的试验中给定PDE的50%受到抑制时的浓度的测定值。IC50测定可以通过使用本领域已知的任何常规技术来实现。通常,IC50可如下测定:在一系列浓度的所研究的抑制剂的存在下测定给定酶的活性。然后将经实验获得的酶活性值针对所用的抑制剂浓度作图。显示50%酶活性(与不存在任何抑制剂下的活性相比)的抑制剂的浓度被当作“IC50”值。类似地,其他抑制浓度可以通过适当的活性测定来定义。例如,在一些设置中,确立90%抑制浓度,即IC90等是所期望的。
测定PDE抑制剂的选择性的方法描述在Zoraghi的“Phosphodiesterase-5Gln-817is critical for cGMP,vardenafil,or sildenafil affinity:its orientation impacts cGMP but not cAMP affinity”(2006)和Bender的“Cyclic Nucleotide Phosphodiesterases:Molecular Regulation to Clinical Use”(2006)中,其均通过引用而整体并入本文。
本发明的生物活性剂可抑制PDE活性,如在基于细胞的试验或体外激酶试验中所确定的,其IC50值为约100nM或更低,优选约50nM、约25nM、约10nM、约5nM、约1nM、100pM、50pM、25pM、10pM、1pM或更低。
在一些实施方案中,所述PDE抑制剂是PDE 1抑制剂,如尼莫地平、长春西汀(vinopocetine)和IC 224。PDE 1抑制剂可以与PDE 1相互作用,PDE 1是Ca2+/钙调蛋白调节的磷酸二酯酶,其可用于降解cAMP和cGMP两者。长春西汀可以来源于长春花提取物,并且可作为脑血管的血管扩张药。长春西汀可以是膳食补充剂的形式。
在其他实施方案中,所述PDE抑制剂是PDE3抑制剂,如美立苯旦、arinone和西洛酰胺。所述PDE抑制剂可以是PDE4抑制剂,如阿普斯特(apremilast)、松叶菊碱、异丁司特、吡拉米司特、木犀草素、罗氟司特、西洛司特、地西泮、咯利普兰和YM796。所述PDE抑制剂可以是PDE4抑制剂,如咯利普兰和YM796。该PDE4抑制剂可与PDE4相互作用,PDE 4是在免疫细胞中占主导地位的cAMP特异性磷酸二酯酶。
在一些实施方案中,所述PDE抑制剂是PDE5特异性抑制剂,淫羊藿苷、西地那非、他达拉非、伐地那非、阿伐那非、伊地那非、米罗那非、乌地那非和扎普司特。在一些实施方案中,该PDE5抑制剂是淫羊藿苷。在一些实施方案中,该PDE5抑制剂是西地那非。在一些实施方案中,该PDE5抑制剂是他达拉非。在一些实施方案中,该PDE5抑制剂是伐地那非。在一些实施方案中,该PDE5抑制剂是阿伐那非。在一些实施方案中,该PDE5抑制剂是伊地那非。在一些实施方案中,该PDE5抑制剂是米罗那非。在一些实施方案中,该PDE5抑制剂是乌地那非。在一些实施方案中,该PDE5抑制剂是扎普司特。该PDE 5抑制剂可以与PDE 5相互作用,PDE 5是cGMP特异性PDE。cGMP信号传导的增强可以在体外和体内均增加线粒体生物发生。PDE 5抑制剂可以增强一氧化氮信号传导,并且是一种有效的血管扩张药。PDE 5抑制剂的其他实例描述在美国专利号5,250,534和6,469,012中,这些专利均通过引用而整体并入本文。
在一些实施方案中,作为白藜芦醇或其他抗衰老酶途径激活剂的替代或补充来施用PDE抑制剂。在一些实施方案中,包含本文所述的一种或多种组分的组合物包含PDE抑制剂以作为白藜芦醇或其他抗衰老酶途径激活剂的替代或补充。
一种减少和/或预防受试者的肝性脂肪变性的方法可包括向该受试者共施用(a)抗衰老酶途径激活剂,(b)游离氨基酸形式的支链氨基酸或其代谢物,以及任选的(c)PDE抑制剂。在一些实施方案中,所述抗衰老酶途径激活剂是AMPK激活剂。在一些实施方案中,该AMPK激活剂是双胍。在特定的实施方案中,该双胍是二甲双胍。在一些实施方案中,所述游离氨基酸形式的支链氨基酸是亮氨酸。在一些实施方案中,所述PDE抑制剂是PDE5抑制剂。示例性的PDE5抑制剂在本文中进行了描述。该PDE5抑制剂可以是例如淫羊藿苷。该PDE5抑制剂可以是西地那非、他达拉非、伐地那非、乌地那非或扎普司特中的任意一种。在一些实施方案中,二甲双胍与亮氨酸的代谢物共施用。在特定的实施方案中,亮氨酸的代谢物是HMB。在特定的实施方案中,亮氨酸的代谢物是KIC。在一些实施方案中,多于一种抗衰老酶途径激活剂与游离氨基酸形式的支链氨基酸或其代谢物共施用(例如,与游离氨基酸形式的亮氨酸、HMB或KIC共施用)。例如,本发明的方法可包括共施用双胍、多酚和游离氨基酸形式的支链氨基酸或其代谢物。例如,本发明的方法可包括向受试者共施用二甲双胍、白藜芦醇和游离氨基酸形式的亮氨酸。本发明的方法可包括向受试者共施用二甲双胍、白藜芦醇和HMB。本发明的方法可包括向受试者共施用二甲双胍、白藜芦醇和KIC。在一些实施方案中,本发明的方法可包括向受试者共施用二甲双胍、亮氨酸和西地那非。
另一种减少和/或预防受试者的肝性脂肪变性的方法可包括向该受试者共施用(a)PDE抑制剂,和(b)游离氨基酸形式的支链氨基酸或其代谢物。在一些实施方案中,该游离氨基酸形式的支链氨基酸是亮氨酸。在一些实施方案中,共施用亮氨酸的代谢物。该代谢物可以是例如HMB或KIC。在一些实施方案中,所述PDE抑制剂是PDE5抑制剂。示例性的PDE5抑制剂在本文中进行了描述。该PDE5抑制剂可以是例如淫羊藿苷。该PDE5抑制剂可以是西地那非、他达拉非、伐地那非、乌地那非或扎普司特中的任意一种。
在一些实施方案中,化合物的具体选择依赖于主治医师的诊断和他们对个体的状况与适当的治疗方案的判断。这些化合物任选地同时(例如,同时地、基本上同时地或在同一治疗方案内)或按顺序施用,这取决于于疾病、病症或病况的性质,个体的状况,以及所用化合物的实际选择。在某些情况下,治疗方案中每种治疗剂的施用顺序和施用重复次数是基于对正在治疗的疾病与个体状况的评价。
在一些实施方案中,当药物在联合治疗中使用时,治疗有效剂量有所变化。文献中描述了经实验确定供联合治疗方案使用的药物和其他药剂的治疗有效剂量的方法。
在本文所述的联合疗法的一些实施方案中,共施用的化合物的剂量根据所用的联合药物的类型、所用的具体药物、正在治疗的疾病或病况等而变化。此外,当与一种或多种生物活性剂共施用时,本文提供的化合物任选地与该生物活性剂同时或按顺序施用。在某些情况下,如果按顺序施用,主治医师将决定本文所述的治疗化合物联合额外治疗剂的适当顺序。
多种治疗剂任选地按任何顺序或甚至同时地施用。如果同时施用,则治疗剂任选地以单一的统一形式或以多种形式(仅举例来说,作为单一的丸剂或作为两种分开的丸剂)提供。在某些情况下,治疗剂中的一种任选地以多剂量提供。在其他情况下,两者均任选地作为多剂量提供。如果不是同时的,则在多个剂量之间的时机是任何合适的时机,例如从多于零周至少于四周。此外,该组合方法、组合物和制剂不限于仅两种药剂的使用;还设想到多种治疗组合的使用(包括两种或更多种本文所述的化合物)。
在某些实施方案中,根据多种因素修改用于治疗、预防或改善寻求缓解的病况的剂量方案。这些因素包括受试者罹患的病症,以及受试者的年龄、体重、性别、饮食和医疗状况。因此,在多个实施方案中,实际使用的剂量方案是不同的且偏离本文所述的剂量方案。
在一些实施方案中,组成本文所述的联合疗法的药物剂以组合剂型或目的在于基本上同时施用的分开的剂型提供。在某些实施方案中,按顺序施用组成联合疗法的药物剂,任一种治疗化合物通过需要两步施用的方案来施用。在一些实施方案中,两步施用方案需要活性剂的按顺序施用或分开的活性剂的空间隔离施用。在某些实施方案中,根据每种药物剂的性质,例如药物剂的效能、溶解度、生物利用度、血浆半衰期和动力学谱,多个施用步骤之间的时间段,作为非限制性的实例,从几分钟到数小时不等。
在多个不同的其他实施方案中,用于实施本发明的一种或多种方法的组合物被配制为使得它们不含(或排除)以下成分中的一种或多种:咖啡因、绿茶提取物或来自瓜拉那种子或瓜拉那植物的提取物。组合物也可被配制为使得它们基本不含高血糖指数碳水化合物,例如简单碳水化合物,包括糖,例如但不限于蔗糖、葡萄糖、右旋糖、麦芽糖、果糖和半乳糖等。
给药量
在本文所述的联合组合物中使用的药剂或任意其他组分的量可以是治疗有效量。在本文所述的联合组合物中使用的药剂或任意其他组分的量可以是亚治疗量。在一些实施方案中,使用亚治疗量的药剂或组分能够减少该药剂的副作用。亚治疗量的使用仍然可以是有效的,特别是当与其他药剂或组分协同使用时。
药剂或组分的亚治疗量可以是这样的量:它低于被认为是治疗量的量。例如,FDA指南可建议用于治疗特定病况的指定的给药水平,而亚治疗量将是低于FDA建议的给药水平的任何水平。亚治疗量可以比被认为是治疗量的量低约1%、5%、10%、15%、20%、25%、30%、35%、50%、75%、90%或95%。可以对受试者个体或受试者组评估治疗量。该受试者组可以是所有的潜在受试者,或具有特定特征如年龄、体重、种族、性别或生理活性水平的受试者。
在二甲双胍的情况下,医师建议的起始剂量可以是每天1000mg,受试者特定的剂量范围为每天500mg到最大2500mg(盐酸二甲双胍延长释放片标签www.accessdata.fda.gov/drugsatfda_docs/label/2008/021574s010lbl.pdf)。对受试者的特定给药量可以由临床医师通过对剂量进行滴定和测定治疗反应来确定。治疗给药水平可以通过测定空腹血浆葡萄糖水平和测定糖化血红蛋白来确定。亚治疗量可以是低于推荐的二甲双胍给药量的任何水平。例如,如果受试者的治疗给药水平被确定为每天700mg,则600mg的剂量将是亚治疗量。或者,亚治疗量可以相对于一组受试者而非单个受试者来确定。例如,如果对于体重超过300lbs的受试者,二甲双胍的平均治疗量是2000mg,那么亚治疗量可以是低于2000mg的任何量。在一些实施方案中,该给药量可以由包括但不限于患者的医生、护士、营养师、药剂师或其他健康护理专业人员的医疗保健提供者推荐。卫生保健专业人员可包括与卫生保健系统相关的个人或实体。卫生保健专业人员的实例可包括外科医生、牙医、听力学家、言语病理学家、内科医生(包括全科医生和专科医生)、助理医师、护士、助产士、药师/药剂师、营养师、治疗师、心理学家、物理治疗师、刺络医师、职业治疗师、验光师、脊医、临床医务人员、紧急医疗技术人员、护理人员、医疗化验员、放射技师、医疗假肢技师社会工作者,以及众多的经过培训以便提供某种类型的医疗保健服务的其他人力资源。
本发明提供了可以包含以下已经从一种或多种来源分离出的物质的任意组合的组合物:药剂,例如亮氨酸、亮氨酸的代谢物如HMB或KIC,PDE抑制剂(例如,PDE5抑制剂,仅举例来说,例如西地那非、淫羊藿苷),抗衰老酶途径激活剂,例如AMPK激活剂,多酚如白藜芦醇,以及抗衰老酶激活剂。所述药剂可以从天然来源中分离出或由合成来源生成,随后进行富集以提高该组分的纯度。例如,西地那非可以由合成来源生成,随后通过一种或多种纯化方法进行富集。另外,亮氨酸(例如游离亮氨酸)可以从天然来源中分离出,随后通过一种或多种分离进行富集。分离并富集的组分,例如二甲双胍、白藜芦醇、淫羊藿苷、西地那非、游离亮氨酸、HMB和KIC,随后可被配制用于以任意组合向受试者施用。
支链氨基酸的剂量
本发明的任何方法可以包括施用一定剂量的游离氨基酸形式的支链氨基酸和/或一定剂量的其代谢物。游离氨基酸形式的支链氨基酸或其代谢物的剂量可以是治疗剂量。游离氨基酸形式的支链氨基酸或其代谢物的剂量可以是亚治疗剂量。游离氨基酸形式的亮氨酸的亚治疗剂量可以是大约、少于约或多于约0.25–3.0g(例如,0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3g或更多)。游离氨基酸形式的亮氨酸的亚治疗剂量可以是大约、少于约或多于约0.25–3.0g/天(例如,0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3g/天或更多)。在一些实施方案中,该方法包括每天施用少于3.0g的游离氨基酸形式的亮氨酸。HMB的亚治疗剂量可以是大约、少于约或多于约0.05–3.0g(例如,0.05、0.1、0.2、0.4、0.5、0.75、1、1.5、2、2.5、3g或更多)。HMB的亚治疗剂量可以是大约、少于约或多于约0.05–3.0g/天(例如0.05、0.1、0.2、0.4、0.5、0.75、1.5、2、2.5、3g/天或更多)。KIC的亚治疗剂量可以是大约、少于约或多于约0.1–3.0g(例如0.1、0.2、0.4、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3g或更多)。KIC的亚治疗剂量可以是大约、少于约或多于约0.1–3.0g/天(例如0.1、0.2、0.4、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3g/天或更多)。
本发明的任何方法可包括施用一定剂量的二甲双胍。二甲双胍的剂量可以是治疗剂量。该治疗剂量可以高于500mg、高于600mg、高于700mg、高于800mg、高于900mg或高于1000mg(1g)。二甲双胍的治疗剂量可以是约1g、约1.1g、约1.2g、约1.3g、约1.4g、约1.5g、约1.6g、约1.7g、约1.8g、约1.9g、约2g或多于2g。该治疗剂量可以是高于500mg/天、高于600mg/天、高于700mg/天、高于800mg/天、高于900mg/天、高于1000mg/天(1g/天)。二甲双胍的治疗剂量可以是约1g/天、约1.1g/天、约1.2g/天、约1.3g/天、约1.4g/天、约1.5g/天、约1.6g/天、约1.7g/天、约1.8g/天、约1.9g/天、约2g/天或多于2g/天。二甲双胍的剂量可以是亚治疗剂量。二甲双胍的亚治疗剂量可以是约1-1000mg、约5-500mg、约10-100mg、约30-90mg、约50-70mg或约62.5mg。二甲双胍的亚治疗剂量可以是例如1、5、10、15、25、50、125、250或500mg。二甲双胍的剂量可以是亚治疗剂量。二甲双胍的亚治疗剂量可以是约40-70mg/天、25-1000mg/天、约50-500mg/天、约100-500mg/天。二甲双胍的亚治疗剂量可以是大约、少于约或大于约1、5、10、15、25、50、60、125、250或500mg/天。二甲双胍可以作为单位剂量施用。二甲双胍的单位剂量可以是1、5、10、15、25、50、62.5、125或250mg。
多酚的剂量
本发明的任何方法可包括施用一定剂量的多酚,例如白藜芦醇。该剂量可以每日施用。该剂量可以是低剂量、中等剂量或高剂量。白藜芦醇的低剂量可包括大约、少于约或多于约0.5mg、1mg、2.5mg、5mg、7.5mg、10mg、12.5mg、15mg、20mg、25mg、50mg、75mg、100mg或更多;白藜芦醇的中等剂量可包括大约、少于约或多于约20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、250mg或更多;白藜芦醇的高剂量可包括大约、少于约或多于约150mg、175mg、200mg、225mg、250mg、300mg、350mg、400mg或更多。白藜芦醇的每日低剂量可包括大约、少于约或多于约0.5mg、1mg、2.5mg、5mg、7.5mg、10mg、12.5mg、15mg、20mg、25mg、50mg、75mg、100mg或更多;白藜芦醇的每日中等剂量可包括大约、少于约或多于约20mg、25mg、50mg、75mg、100mg、125mg、150mg、175mg、200mg、250mg或更多;白藜芦醇的每日高剂量可包括大约、少于约或多于约150mg、175mg、200mg、225mg、250mg、300mg、350mg、400mg或更多。
噻唑烷二酮的剂量
本发明的任何方法可包括施用一定剂量的噻唑烷二酮。本文描述了示例性的噻唑烷二酮。噻唑烷二酮的剂量可以是治疗剂量或亚治疗剂量。该噻唑烷二酮可以是罗格列酮。罗格列酮的剂量可以是至少100μg。罗格列酮的剂量可以是大约或少于约4mg。罗格列酮的剂量可以是100μg-4mg,可以是200μg-2mg,可以是400μg-1000μg。该噻唑烷二酮可以是吡格列酮。吡格列酮的剂量可以是至少100μg。吡格列酮的剂量可以是大约或少于约15mg。吡格列酮的剂量可以是100μg-45mg,可以是200μg-10mg,可以是400μg-5mg,可以是500μg-1mg。
PDE抑制剂的剂量
在一些实施方案中,组合物包含一定量的选择性PDE抑制剂(例如PDE-5抑制剂,包括但不限于西地那非或淫羊藿苷)。PDE抑制剂的量可以是亚治疗量,和/或与该组合物中的一种或多种其他化合物或与该组合物同时或在相近时间施用的一种或多种化合物协同的量。在一些实施方案中,该PDE抑制剂以低剂量、中等剂量或高剂量施用,这描述了两种剂量之间的关系,而通常不限定任何具体的剂量范围。
西地那非的剂量可以是大约或少于约0.05、0.1、0.5、1、2、5、10、20、40、60、80或100mg西地那非。西地那非的剂量可以是约0.05-100、1-50或5-20mg西地那非。淫羊藿苷的剂量可以是大约或少于约1、10、12.5、20、25、50、100、150、300、400、500、750、1000、1500或2000mg淫羊藿苷。淫羊藿苷的剂量可以是约1-100、5-60或10-30mg淫羊藿苷。他达拉非的剂量可以是约0.01、0.05、0.1、0.5、1、15、2、2.5、5、10、15或20mg。他达拉非的剂量可以是约0.1-50、0.5-20或1-10mg。伐地那非的剂量可以是约0.01、0.05、0.1、0.5、1、15、2、2.5、5、10、15或20mg。伐地那非的剂量可以是约0.1-50、0.5-20或1-10mg。阿伐那非的剂量可以是约1、10、20、50、100、150、300、400、500、750、1000、1500或2000mg。阿伐那非的剂量可以是约1-100、5-50或10-40mg。罗地那非的剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。伊地那非的剂量可以是约0.05-100、1-50或5-20mg。米罗那非的剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。米罗那非的剂量可以是约0.05-100、1-50或5-20mg。乌地那非的剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。乌地那非的剂量可以是约0.05-100、1-50或5-20mg。
西地那非的每日剂量可以是大约或少于约0.05、0.1、0.5、1、2、5、10、20、40、60、80或100mg西地那非。西地那非的每日剂量可以是约0.05-100、1-50或5-20mg西地那非。淫羊藿苷的每日剂量可以是大约或少于约1、10、20、25、50、100、150、300、400、500、750、1000、1500或2000mg淫羊藿苷。淫羊藿苷的每日剂量可以是约1-100、10-75或20-40mg淫羊藿苷。他达拉非的每日剂量可以是约0.01、0.05、0.1、0.5、1、15、2、2.5、5、10、15或20mg。他达拉非的每日剂量可以是约0.1-50、0.5-20或1-10mg。伐地那非的每日剂量可以是约0.01、0.05、0.1、0.5、1、15、2、2.5、5、10、15或20mg。伐地那非的每日剂量可以是约0.1-50、0.5-20或1-10mg。阿伐那非的每日剂量可以是约1、10、20、50、100、150、300、400、500、750、1000、1500或2000mg。阿伐那非的每日剂量可以是约1-100、5-50或10-40mg。伊地那非的每日剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。伊地那非的每日剂量可以是约0.05-100、1-50或5-20mg。米罗那非的每日剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。米罗那非的每日剂量可以是约0.05-100、1-50或5-20mg。乌地那非的每日剂量可以是约0.05、0.1、0.5、1、2、5、10、20、50、80、100、150、300、400、500、750、1000、1500或2000mg。乌地那非的每日剂量可以是约0.05-100、1-50或5-20mg。
本发明的另一个方面提供了包含与亮氨酸、HMB、KIC和/或白藜芦醇组合的协同量的PDE-5抑制剂,例如西地那非、淫羊藿苷、他达拉非、伐地那非、阿伐那非、伊地那非、米罗那非和乌地那非的组合物。因此,一个实施方案提供了包含约0.25至约3.0g的量的亮氨酸和约0.05至约100mg的量的西地那非的组合物。另一个实施方案提供了包含0.40-3.0g的量的HMB和约0.05-100mg的量的西地那非的组合物。另一个实施方案提供了包含约0.25-约3.0g的量的亮氨酸、约0.10至约3.0g的量的HMB和约0.05-100mg的量的西地那非的组合物。在包含PDE抑制剂的组合物或包括(与一种或多种其他组分分开或同时)施用PDE抑制剂的方法中,可以以产生大约、小于约或大于约0.1、1、5、10、25、50、100、500、1000、2500、5000、10000nM或更高的血浆峰值浓度的量提供PDE抑制剂。
因此,本发明方法的实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸和约50至约500mg/天的量的白藜芦醇。其他实施方案包括共施用0.10-3.0g/天的量的HMB和约50-500mg/天的量的白藜芦醇。其他实施方案包括共施用0.20-3.0g/天的量的KIC和约50-500mg/天(或50至500mg/天)的量的白藜芦醇。其他实施方案包括共施用约0.5至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.10至约3.0g/天的量的HMB和约50至约500mg/天的量的白藜芦醇。其他实施方案包括共施用约0.5至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.20至约3.0g/天的量的KIC和约50至约500mg/天的量的白藜芦醇。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.10至约3.0g/天的量的HMB、约0.20至约3.0g/天的量的KIC和约50至约500mg/天的量的白藜芦醇。
本发明方法的一些实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸和约25至约500mg/天的量的二甲双胍。其他实施方案包括共施用0.10-3.0g/天的量的HMB和约25-500mg/天的量的二甲双胍。其他实施方案包括共施用0.20-3.0g/天的KIC和约25-500mg/天的二甲双胍。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.40至约3.0g/天的量的HMB和约25至约500mg/天的量的二甲双胍。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.20至约3.0g/天的量的KIC和约25至约500mg/天的量的二甲双胍。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.10至约3.0g/天的量的HMB、约0.20至约3.0g/天的量的KIC和约25至约500mg/天的量的二甲双胍。在一些实施方案中,这些方法进一步包括共施用约50至约500mg/天的量的白藜芦醇。
本发明方法的一些实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸和约0.05至约2000mg/天的量的PDE5抑制剂。其他实施方案包括共施用0.10-3.0g/天的量的HMB和约0.05至约2000mg/天的量的PDE5抑制剂。其他实施方案包括共施用0.20-3.0g/天的量的KIC和约0.05至约2000mg/天的量的PDE5抑制剂。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.40至约3.0g/天的量的HMB和约0.05至约2000mg/天的量的PDE5抑制剂。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.20至约3.0g/天的量的KIC和约0.05至约2000mg/天的量的PDE5抑制剂。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.10至约3.0g/天的量的HMB、约0.20至约3.0g/天的量的KIC和约0.05至约2000mg/天的量的PDE5抑制剂。该PDE5抑制剂可以是本文所述的任意PDE5抑制剂。该PDE5抑制剂的每日剂量可以如本文所述。在一些实施方案中,这些方法进一步包括共施用约50至约500mg/天的量的白藜芦醇或共施用约25至约500mg/天的量的二甲双胍。
本发明方法的一些实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约25至约500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂。在一些实施方案中,该PDE5抑制剂是西地那非。其他实施方案包括共施用0.10-3.0g/天的量的HMB、约25-500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂如西地那非。其他实施方案包括共施用0.20-3.0g/天的量的KIC、约25-500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂如西地那非。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.40至约3.0g/天的量的HMB、约25至约500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂如西地那非。其他实施方案包括共施用约0.25-约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.20至约3.0g/天的量的KIC、约25至约500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂如西地那非。其他实施方案包括共施用约0.25至约3.0g/天的量的游离氨基酸形式的亮氨酸、约0.10至约3.0g/天的量的HMB、约0.20至约3.0g/天的量的KIC、约25至约500mg/天的量的二甲双胍和约0.05至约2000mg/天的量的PDE5抑制剂如西地那非。在一些实施方案中,这些方法进一步包括共施用约50至约500mg/天的量的白藜芦醇。
以上任意药剂可以以单位剂量施用。本文所述的一定量的以上任意药剂可以以单位剂量施用。单位剂量可以是每日剂量的分数,例如每日剂量除以每天将要施用的单位剂量的数目。单位剂量可以是每日剂量的分数,即每日剂量除以每天将要施用的单位剂量的数目,并进一步除以每次施用的单位剂量(例如片剂)的数目。每次施用的单位剂量的数目可以是大约、小于约或大于约1、2、3、4、5、6、7、8、9、10或更大。每天的剂量数目可以是大约、小于约或大于约1、2、3、4、5、6、7、8、9、10或更大。每天的单位剂量的数目可以通过每日剂量除以单位剂量来确定,并且可以是每天大约、小于约或大于约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、6、17、18、19、20个或更多个单位剂量。例如,单位剂量可以是约为每日剂量或每日剂量的约1/2、1/3、1/4、1/5、1/6、1/7、1/8、1/9、1/10。单位剂量可以是约1/3的每日量,并每日向受试者施用3次。单位剂量可以是每日量的约1/2,并且每日向受试者施用2次。单位剂量可以是每日量的约1/4,并且每日向受试者施用2次且每次2个单位剂量。在一些实施方案中,单位剂量包含大约、小于约或大于约50mg白藜芦醇。在一些实施方案中,单位剂量包含大约、小于约或大于约50mg二甲双胍。在一些实施方案中,单位剂量包含大约、小于约或大于约550mg亮氨酸。在一些实施方案中,单位剂量包含大约、小于约或大于约200mg一种或多种亮氨酸代谢物。在一些实施方案中,单位剂量(例如包含亮氨酸的单位剂量)每日施用两次且每次两个单位剂量。在一些实施方案中,单位剂量(例如包含一种或多种亮氨酸代谢物如HMB的单位剂量)每日施用两次且每次一个单位剂量。
本文所述的药剂(例如游离氨基酸形式的支链氨基酸、其代谢物、抗衰老酶途径激活剂、PDE抑制剂)可以通过口服或任何其他方法施用于受试者。口服施用的方法包括施用作为液体、固体或半固体的组合物,其可以采用膳食补充剂或食品的形式。
可以共施用本文所述的药剂。所述药剂可以例如以单一组合物的形式同时施用或者可以按顺序施用。所述药剂可以在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、30、60、90或120分钟内一个接一个地按顺序施用。
可以定期施用本文所述的药剂。例如,所述药剂可以每天施用1、2、3、4次或更频繁。可以每隔1、2、3、4、5、6或7天对受试者进行施用。在一些实施方案中,所述药剂每天施用3次。该施用可以与受试者的用餐时间同时。治疗或饮食补充的周期可以是约1、2、3、4、5、6、7、8或9天、2周、1-11个月或1年、2年、5年或更久。在一些实施方案中,受试者施用所述药剂6周或更长。在本发明的一些实施方案中,对受试者施用的剂量可以在治疗期发生变化或保持不变。例如,可以在施用期增加或减少每日给药量。
施用期的长度和/或给药量可以由医师、营养师或其他任何类型的临床医生来确定。医师、营养师或临床医生可观察受试者对施用的组合物的反应并基于受试者的表现调节给药。例如,对表现出能量调节效果减弱的受试者可以增加给药量,以获得期望的结果。
组合物
本文所述的任意药剂可以以一种或多种组合物的形式施用于受试者。用于实施本发明的任何方法的组合物可包含本文所述的药剂的任意组合。例如,本发明组合物可包含1、2、3、4种或多于4种本文所述的药剂。
本文所述的组合物可以被配制成多种不同的剂型。例如,组合物可以被配制用于口服给药,例如作为片剂、可咀嚼片剂、囊片、胶囊、软明胶胶囊、锭剂或溶液。组合物可以在其溶液形式下配制成鼻腔喷雾剂或用于注射。在一些实施方案中,该组合物是适于口服的液体组合物。
在一些实施方案中,所述药剂被配制成适于口服给药的组合物。适于口服给药的本发明组合物可以呈现为离散的剂型,如各自含有作为粉末或颗粒的预定量的活性成分的胶囊、扁囊剂或片剂,或液体或气雾喷雾剂,溶液,或水性或非水性液体中的悬浮液,水包油乳剂或油包水液体乳剂,包括液体剂型(例如,悬浮液或浆液),和口服固体剂型(例如,片剂或散装粉末)。口服剂型可以配制成片剂、丸剂、糖锭剂、胶囊、乳剂、亲脂性和亲水性悬浮液、液体、凝胶、糖浆、浆液、悬浮液等,用于待治疗的个体或患者口服摄入。这样的剂型可以通过任何配制方法来制备。例如,活性成分可以与构成一种或多种必要成分的载体联合。适于口服给药的胶囊包括由明胶制成的推入配合(push-fit)胶囊,以及由明胶和增塑剂如甘油或山梨糖醇制成的软密封胶囊。推入配合胶囊可以包含与填充剂如乳糖、粘合剂如淀粉和/或润滑剂如滑石或硬脂酸镁和任选的稳定剂混合的活性成分。任选地,可通过将组合物与固体赋形剂混合,任选地研磨所得到的混合物,并在加入合适的助剂(如果需要)后加工颗粒混合物以获得片剂或糖锭剂芯,来获得用于口服使用的本发明的组合物。合适的赋形剂尤其是填充剂,如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素制剂,例如,玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。通常,通过将活性成分与液体载体或细碎的固体载体或两者均匀地且紧密地混合,然后,如果需要,将产品成型为所需的形式,来制备组合物。例如,片剂可以通过任选地与一种或多种辅助成分一起压制或模制来制备。压制片剂可通过在合适的机器中压缩自由流动形式如粉末或颗粒的活性成分来制备,该活性成分任选地与赋形剂混合,该赋形剂例如是但不限于粘合剂、润滑剂、惰性稀释剂和/或表面活性剂或分散剂。模制片剂可通过在合适的机器中对用惰性液体稀释剂润湿的粉状化合物的混合物进行模制来制备。
所述组合物可以是液体形式。可配制用于口服给药或用于注射给药的示例性液体形式包括水溶液、适当调味的糖浆、水性或油性悬浮液和调味的含食用油如棉籽油、芝麻油、椰子油或花生油的乳剂以及酏剂和类似的药物载体。用于水性悬浮液的合适的分散剂或悬浮剂包括合成的天然树胶如黄蓍胶、阿拉伯胶、藻酸盐、葡聚糖、羧甲基纤维素钠、甲基纤维素、聚乙烯吡咯烷酮或明胶。本发明的方法可包括向受试者施用可注射组合物和用于口服给药的组合物的组合。
用于口服给药的液体制剂可采用例如溶液、糖浆或悬浮液的形式,或者它们可以呈现为干产品,以供在使用前用水或其他合适的载体进行重建。这类液体制剂可以通过常规手段用药学上可接受的添加剂如悬浮剂(例如,山梨糖醇糖浆、甲基纤维素或氢化食用脂肪)、乳化剂(如卵磷脂或阿拉伯胶)、非水性载体(例如,杏仁油、油酯或乙醇)、防腐剂(例如,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸)以及人造的或天然的增色剂和/或甜味剂来制备。
本发明的药物组合物的制备可以按照普遍接受的药物制剂制备程序进行。参见,例如Remington's Pharmaceutical Sciences第18版(1990),E.W.Martin编,Mack Publishing Co.,PA。根据预期用途和施用方式,可能需要在药物组合物的制备中进一步处理镁-平衡离子化合物。合适的处理可以包括与适当的非毒性和非干扰性组分混合、灭菌、分成剂量单位并包入递送装置内。
本发明的实施方案进一步包括含有活性成分的无水组合物和剂型,因为水可以促进一些化合物的降解。例如,本领域中可以采用加水(例如5%)作为模拟长期贮存的手段,以确定诸如贮存期限或制剂随时间的稳定性等特性。本发明的无水组合物和剂型可以使用无水或低含水成分在低水分或低湿度条件下制备。如果在制造、包装和/或储存过程中预期到会与水分和/或潮湿大量接触,那么可将含有乳糖的本发明的组合物和剂型制成无水的。可以制备和贮存无水组合物,使其无水性质得以保持。因此,无水组合物可以使用已知能防止暴露于水的材料来包装,使得它们可以包含在合适的处方药剂盒中。合适的包装的实例包括但不限于密封的箔、塑料等、单位剂量容器、泡罩包装和条状包装。
本文所述的药剂可以按照常规药物配制技术与药物载体在紧密掺合物中进行组合。取决于施用所需的制剂形式,载体可以采取多种形式。在制备用于口服剂型的组合物时,任何常用的药物介质都可用作载体,例如,在口服液体制剂(如悬浮液、溶液剂和酏剂)或气雾剂的情况下采用水、二醇、油、醇、调味剂、防腐剂、着色剂等;或者在口服固体制剂的情况下可以使用诸如淀粉、糖、微晶纤维素、稀释剂、成粒剂、润滑剂、粘合剂和崩解剂等载体,在一些实施方案中不使用乳糖。例如,对于固体口服制剂,合适的载体包括粉末、胶囊和片剂。如果需要,片剂可以通过标准含水或非含水技术来包衣。
可以充当药学上可接受的载体的材料的一些实例包括:(1)糖,如乳糖、葡萄糖和蔗糖;(2)淀粉,如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;(4)黄蓍胶粉;(5)麦芽;(6)明胶;(7)滑石;(8)赋形剂,如可可脂和栓剂蜡;(9)油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;(10)二元醇,如丙二醇;(11)多元醇,如甘油、山梨糖醇、甘露醇和聚乙二醇;(12)酯,如油酸乙酯和月桂酸乙酯;(13)琼脂;(14)缓冲剂,如氢氧化镁和氢氧化铝;(15)藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)磷酸盐缓冲溶液;和(21)在药物制剂中使用的其他无毒的相容性物质。
适用于剂型中的粘合剂包括但不限于玉米淀粉、马铃薯淀粉或其他淀粉、明胶、天然和合成树胶如阿拉伯胶、藻酸钠、藻酸、其他藻酸盐、黄蓍胶粉、瓜尔豆胶、纤维素及其衍生物(例如乙基纤维素、醋酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠)、聚乙烯吡咯烷酮、甲基纤维素、预胶化淀粉、羟丙基甲基纤维素、微晶纤维素,以及它们的混合物。
可用于形成本发明的组合物和剂型的润滑剂包括但不限于硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨糖醇、甘露醇、聚乙二醇、其他二醇、硬脂酸、十二烷基硫酸钠、滑石、氢化植物油(例如花生油、棉籽油、葵花籽油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂,或它们的混合物。其他润滑剂包括,例如,syloid硅胶、合成二氧化硅的凝聚型气溶胶或其混合物。可任选地加入少于组合物的约1重量%的润滑剂。润滑剂还可以与组织屏障结合使用,该组织屏障包括但不限于多糖、多聚糖、生物膜(seprafilm)、interceed和透明质酸。
崩解剂可用于本发明的组合物中,以提供当暴露于水性环境中时发生崩解的片剂。太多的崩解剂可能会产生在瓶中可崩解的片剂。太少可能不足以导致崩解的发生,并因此可能改变活性成分从剂型中释放的速率和程度。因此,可以使用既不太少也不太多而不会有害地改变活性成分的释放的足量的崩解剂,以形成本文所公开的化合物的剂型。所用的崩解剂的量可以根据制剂类型和施用方式而变化,并且本领域普通技术人员可以容易地辨别。在药物组合物中可使用约0.5%至约15%(重量)的崩解剂或约1%至约5%(重量)的崩解剂。可用于形成本发明的组合物和剂型的崩解剂包括但不限于琼脂、藻酸、碳酸钙、微晶纤维素、交联羧甲基纤维素钠、交聚维酮、聚克立林钾、羟基乙酸淀粉钠、马铃薯或木薯淀粉、其他淀粉、预胶化淀粉、其他淀粉、粘土、其他藻胶、其他纤维素、树胶或其混合物。
用于本文所公开的组合物和剂型的合适的填充剂的实例包括但不限于滑石、碳酸钙(例如颗粒或粉末)、微晶纤维素、粉状纤维素、葡聚糖结合剂(dextrates)、高岭土、甘露醇、硅酸、山梨糖醇、淀粉、预胶化淀粉,以及它们的混合物。
当期望使用水性悬浮液和/或酏剂进行口服给药时,其中的活性成分可以与多种甜味剂或调味剂、着色物质或染料组合,并且如果需要的话,可以与乳化剂和/或悬浮剂以及稀释剂如水、乙醇、丙二醇、甘油及其各种组合进行组合。
片剂可以不包衣或通过已知的技术包衣以延迟在胃肠道中的崩解和吸收,并由此在较长时期内提供持续作用。例如,可采用延时材料如单硬脂酸甘油酯或二硬脂酸甘油酯。供口服使用的制剂还可以呈现为硬明胶胶囊,其中活性成分与惰性固体稀释剂例如碳酸钙、磷酸钙或高岭土混合,或者作为软明胶胶囊,其中活性成分与水或油介质例如花生油、液体石蜡或橄榄油混合。
组合物可包含增溶剂以确保本发明的化合物的良好的溶解和/或溶出,并使本发明的化合物的沉淀最小化。这对于非口服使用的组合物,例如,用于注射的组合物是有益的。也可加入增溶剂来增加亲水性药物和/或其他组分如表面活性剂的溶解度,或者维持该组合物作为稳定或均一的溶液或分散液。
该组合物可以进一步包含一种或多种药学上可接受的添加剂和赋形剂。这样的添加剂和赋形剂包括但不限于防粘剂、消泡剂、缓冲剂、聚合物、抗氧化剂、防腐剂、螯合剂、粘度调节剂(viscomodulators)、张力调节剂(tonicifier)、调味剂、着色剂、增味剂、遮光剂、助悬剂、粘合剂、填充剂、增塑剂、润滑剂及其混合物。赋形剂的实例的非穷举列表包括单酰甘油、硬脂酸镁、改性食用淀粉、明胶、微晶纤维素、甘油、硬脂酸、二氧化硅、黄蜂蜡、卵磷脂、羟丙基纤维素、交联羧甲基纤维素钠和交聚维酮。
本文描述的组合物也可以配制成延长释放、持续释放或定时释放,以使得一种或多种组分随时间而释放。延迟释放可通过将该一种或多种组分配制在各种材料的基质中或通过微囊化来实现。该组合物可以配制为经4、6、8、12、16、20或24小时的时间段释放一种或多种组分。一种或多种组分的释放可以以恒定的或变化的速率进行。
使用本文提供的控制释放剂型,一种或多种辅因子在其剂型中可以比在组分量相同的立即释放制剂中所观察到的更慢的速率释放。在一些实施方案中,对于控制释放制剂根据从施用至其最大浓度的规定时间段上的浓度变化所测得的生物样品的改变速率小于立即释放制剂速率的约80%、70%、60%、50%、40%、30%、20%或10%。此外,在一些实施方案中,浓度随时间的改变速率小于立即释放制剂速率的约80%、70%、60%、50%、40%、30%、20%或10%。
在一些实施方案中,通过以相对成比例的方式增加达到最大浓度的时间来降低浓度随时间的改变速率。例如,达到最大浓度的时间增加2倍可使浓度改变速率降低约2倍。因此,可以提供一种或多种辅因子从而使其以显著低于立即释放制剂的速率达到其最大浓度。可将本发明的组合物配制为到24小时、16小时、8小时、4小时、2小时或至少1小时时提供最大浓度的改变。浓度改变速率的相关减少可以是约0.05、0.10、0.25、0.5或至少0.8倍。在某些实施方案中,这通过在这种施用后的1小时内向循环系统释放少于约30%、50%、75%、90%或95%的该一种或多种辅因子来实现。
任选地,控制释放制剂表现出的血浆浓度曲线具有小于含相同剂量的相同辅因子的立即释放制剂的75%、50%、40%、30%、20%或10%的起始(例如,施用后2小时至施用后4小时)斜率。
在一些实施方案中,在最初1、2、4、6、8、10或12小时,溶出研究中测定的辅因子释放速率小于含相同辅因子的立即释放制剂的约80%、70%、60%、50%、40%、30%、20%或10%。
本文提供的控制释放制剂可采用多种形式。在一些实施方案中,该制剂为口服剂型,包括液体剂型(例如,悬浮液或浆液)和口服固体剂型(例如,片剂或整装粉剂),例如但不限于本文描述的那些剂型。
本文公开的制剂的控制释放片剂可以是基质、贮库(reservoir)或渗透系统的。虽然三个系统都适用,但是后两个系统可具备更优的包封相对较大质量的能力,例如用于容纳大量的单一辅因子或容纳多种辅因子,其取决于个体的遗传构成。在一些实施方案中,缓释片剂基于贮库系统,其中包含一种或多种辅因子的核心被多孔膜包衣包裹,该包衣在水化时允许该一种或多种辅因子扩散通过。由于有效成分的组合质量通常是克级数量,所以有效的递送系统能够提供最优的结果。
因此,片剂或丸剂也可以被包衣或以其他方式复合,以提供具有延长作用的优点的剂型。例如,片剂或丸剂可以包含内剂量和外剂量组分,后者为在前者之上的包被的形式。这两种组分可被肠溶层隔开,肠溶层在胃中能够抵抗崩解并允许内部组分完整地进入十二指肠或延迟释放。多种材料可用于这样的肠溶层或包衣,这些材料包括多种聚合酸和聚合酸与诸如紫胶、鲸蜡醇和醋酸纤维素这样的材料的混合物。在一些实施方案中,含有多种辅因子的制剂可以具有以不同速率或在不同时间释放的不同辅因子。例如,可以存在夹杂有肠溶层的额外的辅因子层。
制备持续释放片剂的方法是本领域已知的,例如参见美国专利公开2006/051416和2007/0065512或本文公开的其他参考文献。例如在美国专利号4,606,909、4,769,027、4,897,268和5,395,626中描述的方法可用来制备由个体的遗传构成决定的一种或多种辅因子的持续释放制剂。在一些实施方案中,使用例如在美国专利号6,919,373、6,923,800、6,929,803和6,939,556中描述的技术来制备制剂。例如在美国专利号6,797,283、6,764,697和6,635,268中描述的其他方法也可用来制备本文公开的制剂。
在一些实施方案中,所述组合物可以配制成食物组合物。例如,该组合物可以是饮料或其他液体、固体食品、半固体食品,其含有或不含食物载体。例如,该组合物可以包括补充有本文描述的任意组合物的红茶。该组合物可以是补充有本文描述的任意组合物的乳制品。在一些实施方案中,该组合物可以配制成食物组合物。例如,该组合物可以包含饮料、固体食品、半固体食品或食物载体。
在一些实施方案中,可以使用液体食物载体,如作为饮料的形式,如补充性果汁、咖啡、茶、汽水、加味水等。例如,该饮料可以包含制剂以及液体组分,如各种除臭剂或存在于常规饮料中的天然碳水化合物。天然碳水化合物的实例包括但不限于:单糖,如葡萄糖和果糖;二糖,如麦芽糖和蔗糖;传统糖,如糊精和环糊精;和糖醇,如木糖醇和赤藓糖醇。也可使用天然除臭剂如索马甜、甜叶菊提取物、莱包迪苷A(levaudioside A)、甘草苷,和合成的除臭剂如糖精和天冬甜素。也可以使用例如调味剂、着色剂以及其他试剂。例如,也可使用果胶酸及其盐、藻酸及其盐、有机酸、保护性胶体粘合剂、pH调节剂、稳定剂、防腐剂、甘油、醇或碳化剂。也可以在制备含有本文讨论的制剂的食品或饮料中使用水果和蔬菜。
备选地,所述组合物可以是补充有本文所述的任何组合物的小吃棒。例如,该小吃棒可以是巧克力棒、燕麦(granola)棒或什锦杂果(trail mix)棒。在另一个实施方案中,本发明的膳食补充剂或食物组合物被配制成具有合适的和期望的口感、质地和粘度以供消费。任何合适的食物载体可在本发明的食物组合物中使用。本发明的食物载体包括几乎任何食品。这类食物载体的实例包括但不限于食物棒(燕麦棒,蛋白棒、糖果棒等)、谷物制品(燕麦片、早餐麦片、燕麦等)、烘焙食品(面包、甜甜圈、饼干、百吉饼、糕点、蛋糕等)、饮料(牛奶为主的饮料、运动饮料、果汁、酒精饮料、瓶装水)、面食、谷物(大米、玉米、燕麦、黑麦、小麦、面粉等)、蛋制品、零食(糖果、薯片、口香糖、巧克力等)、肉类、水果和蔬菜。在一个实施方案中,本文所采用的食物载体可掩盖不良的味道(例如苦味)。当需要时,本文中所提出的食物组合物比本文描述的任何组分表现出更理想的质地和香味。例如,根据本发明可以使用液体食物载体来获得本发明的食物组合物的饮料形式,如补充性果汁、咖啡、茶等。在其他实施方案中,可以根据本发明使用固体食物载体来获得代餐形式的本发明食物组合物,如补充性小吃棒、面食、面包等。在其他实施方案中,可以根据本发明使用半固体食物载体来获得本发明的食物组合物的口香糖、咀嚼糖果或零食等形式。
联合组合物的给药可以每天施用大约、少于约或多于约1、2、3、4、5、6,7、8、9、10次或更多次。受试者可以在大约、少于约或大于约1、2、3、4、5、6,7、8、9、10、11、12、13、14或更多天、周或月内接受给药。单位剂量可以是日剂量的一部分,例如日剂量除以每天待施用的单位剂量数。单位剂量可以是日剂量的一部分,其为日剂量除以每天待施用的单位剂量数,再除以每次施用的单位剂量数(例如片数)。每次施用的单位剂量数可以为大约、少于约或多于约1、2、3、4、5、6,7、8、9、10或更多。每天的剂量数可以为大约、少于约或多于约1、2、3、4、5、6、7、8、9、10或更多。每天的单位剂量数可以通过用日剂量除以单位剂量来确定,且其可以为大约、少于约或多于约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、6、17、18、19、20或更多单位剂量每天。例如,单位剂量可以是约1/2、1/3、1/4、1/5、1/6、1/7、1/8、1/9、1/10。单位剂量可以是每日量的约三分之一并对受试者每天施用三次。单位剂量可以是每日量的约二分之一并对受试者每天施用两次。单位剂量可以是每日量的约四分之一并对受试者每天施用两次,每次两个单位剂量。在一些实施方案中,单位剂量包含大约、少于约或多于约50mg白藜芦醇。在一些实施方案中,单位剂量包含大约、少于约或多于约550mg亮氨酸。在一些实施方案中,单位剂量包含大约、少于约或多于约200mg的一种或多种亮氨酸代谢物。在一些实施方案中,单位剂量(例如包含亮氨酸的单位剂量)每天施用两次,每次两个单位剂量。在一些实施方案中,单位剂量(例如包含一种或多种亮氨酸代谢物如HMB的单位剂量)每天施用两次,每次一个单位剂量。本文公开的组合物可以进一步包含增香剂,并且可以是固体、液体、凝胶或乳剂。
示例性组合物:
包含单位剂型的组合物可被配制用于提供一定剂量的游离氨基酸形式的支链氨基酸或其代谢物。游离氨基酸形式的支链氨基酸或其代谢物的剂量可以是治疗剂量或亚治疗剂量。例如,单位剂量组合物可以包含约10-3000mg(例如,50、100、200、250、300、400、500、750、1000、1125、1500或3000mg)游离氨基酸形式的亮氨酸、5-500mg HMB(例如,5、10、20、50、100、200、300、400或500mg HMB)、约20至约300mg KIC(例如,20、50、100、200、300mg KIC)或它们的任意组合。在一些实施方案中,在排除赋形剂(例如填充剂)的情况下,该组合物中游离氨基酸形式的支链氨基酸或其代谢物(例如亮氨酸、HMB或KIC)的重量百分比为50-95%。
以上任何单位剂量组合物可以进一步包含额外的药剂。所述额外的药剂可以是抗衰老酶途径激活剂和/或PDE抑制剂。本文描述了示例性的抗衰老酶途径激活剂和PDE抑制剂。在一些实施方案中,在排除赋形剂(例如填充剂)的情况下,该组合物中额外的药剂的重量百分比为5-50%。在特定的实施方案中,所述额外的药剂是二甲双胍。二甲双胍在单位剂量组合物中可以以治疗或亚治疗剂量存在。例如,该单位剂量组合物可以进一步包含约2.5至约500mg二甲双胍(例如,约2.5、5、10、20、25、50、100、125、150、175、200、250、300、350、400、450或500mg二甲双胍)。在一些实施方案中,所述额外的药剂是PDE抑制剂(例如PDE5抑制剂)。在一些实施方案中,所述额外的药剂是淫羊藿苷。淫羊藿苷在单位剂量组合物中可以以治疗或亚治疗剂量存在。例如,该单位剂量组合物可以进一步包含约1至约2000mg淫羊藿苷(例如,约1、10、25、50、100、500、600、700、800、900、1000、1500或2000mg淫羊藿苷)。在一些实施方案中,所述额外的药剂是西地那非。西地那非在单位剂量组合物中可以以治疗或亚治疗剂量存在。例如,该单位剂量组合物可以进一步包含约1至约2000mg西地那非(例如,约1、10、25、50、100、500、600、700、800、900、1000、1500或2000mg西地那非)。
单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可以包含约900至约1300mg亮氨酸。单位剂量可以进一步包含二甲双胍。二甲双胍与亮氨酸的重量比可以为0.01-0.6。二甲双胍与亮氨酸的重量比可以为0.1-0.5。二甲双胍与亮氨酸的重量比可以为0.15-0.3。单位剂量可以任选地进一步包含白藜芦醇。示例性单位剂量组合物包含约125mg二甲双胍、1.125g亮氨酸和任选的50mg白藜芦醇。单位剂量可以包含约50mg二甲双胍、1.125g亮氨酸和任选的50mg白藜芦醇。单位剂量可以包含约250mg二甲双胍、1.125g亮氨酸和任选的50mg白藜芦醇。单位剂量可以包含约500mg二甲双胍、1.125g亮氨酸和任选的50mg白藜芦醇。表1中示出了包含亮氨酸和二甲双胍的单位剂量的示例性制剂:
表1:制剂1
表2中示出了包含亮氨酸、二甲双胍和白藜芦醇的单位剂量的另一种示例性制剂:
表2:制剂2
在一些实施方案中,单位剂量包含亮氨酸和淫羊藿苷。单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可包含约900至约1300mg亮氨酸。淫羊藿苷与亮氨酸的重量比可以为0.01-0.1。淫羊藿苷与亮氨酸的重量比可以为0.02-0.06。淫羊藿苷与亮氨酸的重量比可以为0.03-0.05。表3中示出了包含亮氨酸和淫羊藿苷的单位剂量的示例性制剂:
表3:制剂3
在一些实施方案中,单位剂量包含亮氨酸、淫羊藿苷和白藜芦醇。单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可包含约900至约1300mg亮氨酸。淫羊藿苷与亮氨酸的重量比可以为0.01-0.1。淫羊藿苷与亮氨酸的重量比可以为0.02-0.06。淫羊藿苷与亮氨酸的重量比可以为0.03-0.05。白藜芦醇与亮氨酸的重量比可以为0.01-0.1。白藜芦醇与亮氨酸的重量比可以为0.02-0.06。白藜芦醇与亮氨酸的重量比可以为0.03-0.05。表4中示出了包含亮氨酸、淫羊藿苷和白藜芦醇的单位剂量的示例性制剂:
表4:制剂4
在一些实施方案中,单位剂量包含亮氨酸、淫羊藿苷和二甲双胍。单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可以包含约900至约1300mg亮氨酸。淫羊藿苷与亮氨酸的重量比可以为0.01-0.1。淫羊藿苷与亮氨酸的重量比可以为0.02-0.06。淫羊藿苷与亮氨酸的重量比可以为0.03-0.05。二甲双胍与亮氨酸的重量比可以为0.01-0.6。二甲双胍与亮氨酸的重量比可以为0.1-0.5。二甲双胍与亮氨酸的重量比可以为0.15-0.3。二甲双胍与亮氨酸的重量比可以为0.22-0.23。表5中示出了包含亮氨酸、淫羊藿苷和二甲双胍的单位剂量的示例性制剂:
表5:制剂5
在一些实施方案中,单位剂量包含亮氨酸、西地那非和任选的白藜芦醇。单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可以包含900-1300mg亮氨酸。白藜芦醇与亮氨酸的重量比可以为0.00001-0.05。白藜芦醇与亮氨酸的重量比可以为0.0001-0.03。白藜芦醇与亮氨酸的重量比可以为0.001-0.02。西地那非与亮氨酸的重量比可以为0.00001-0.05。西地那非与亮氨酸的重量比可以为0.0001-0.03。西地那非与亮氨酸的重量比可以为0.001-0.02。西地那非与亮氨酸的重量比可以为0.005-0.015。表6中示出了包含亮氨酸和西地那非的单位剂量以及包含亮氨酸、白藜芦醇和西地那非的另一个单位剂量的两种示例性制剂。
表6:
制剂6A
制剂6B
单位剂量可以包含约5-1000mg HMB。单位剂量可以包含约100-500mg HMB。单位剂量可以包含150-400mg HMB。单位剂量可以包含200-300mg HMB。单位剂量可以进一步包含二甲双胍。二甲双胍与HMB的重量比可以为0.01-1。二甲双胍与HMB的重量比可以为0.5-0.5。二甲双胍与HMB的重量比可以为0.1-0.3。单位剂量可以任选地进一步包含白藜芦醇。示例性单位剂量组合物包含约125mg二甲双胍、250mg HMB和任选的50mg白藜芦醇。单位剂量可以包含约50mg二甲双胍、1250mg HMB和任选的50mg白藜芦醇。单位剂量可以包含约250mg二甲双胍、250mg HMB和任选的50mg白藜芦醇。单位剂量可以包含约500mg二甲双胍、500mg HMB和任选的50mg白藜芦醇。表7中示出了包含HMB和二甲双胍的单位剂量的示例性制剂:
表7:制剂7
表8中示出了包含HMB、二甲双胍和白藜芦醇的单位剂量的另一种示例性制剂:
表8:制剂8
在一些实施方案中,单位剂量包含HMB和淫羊藿苷。单位剂量可以包含约5-1000mg HMB。单位剂量可以包含约100-500mg HMB。单位剂量可以包含150-400mg HMB。单位剂量可以包含200-300mg HMB。淫羊藿苷与HMB的重量比可以为0.05-0.5。淫羊藿苷与HMB的重量比可以为0.07-0.4。淫羊藿苷与HMB的重量比可以为0.1-0.3。表9中示出了包含HMB和淫羊藿苷的单位剂量的示例性制剂:
表9:制剂9
在一些实施方案中,单位剂量包含HMB、淫羊藿苷和白藜芦醇。单位剂量可以包含约5-1000mg HMB。单位剂量可以包含约100-500mg HMB。单位剂量可以包含约150-400mg HMB。单位剂量可以包含200-300mg HMB。淫羊藿苷与HMB的重量比可以为0.05-0.5。淫羊藿苷与HMB的重量比可以为0.07-0.4。淫羊藿苷与HMB的重量比可以为0.1-0.3。白藜芦醇与HMB的重量比可以为0.05-0.5。白藜芦醇与HMB的重量比可以为0.07-0.4。白藜芦醇与HMB的重量比可以为0.1-0.3。表10中示出了包含HMB、淫羊藿苷和白藜芦醇的单位剂量的示例性制剂。
表10:制剂10
在一些实施方案中,单位剂量包含HMB、淫羊藿苷和二甲双胍。单位剂量可以包含约5至约1000mg HMB。单位剂量可以包含约100至约500mg HMB。单位剂量可以包含约150至约400mg HMB。单位剂量可以包含约200至约300mg HMB。淫羊藿苷与HMB的重量比可以为0.05-0.5。淫羊藿苷与HMB的重量比可以为0.07-0.4。淫羊藿苷与HMB的重量比可以为0.1-0.3。二甲双胍与HMB的重量比可以为0.2-4。二甲双胍与HMB的重量比可以为0.5-2。二甲双胍与HMB的重量比可以为0.75-1.25。表11中示出了包含HMB、淫羊藿苷和二甲双胍的单位剂量的示例性制剂。
表11:制剂11
在一些实施方案中,单位剂量包含HMB和西地那非。单位剂量可以包含约5-1000mg HMB。单位剂量可以包含约100-500mg HMB。单位剂量可以包含约150-400mg HMB。单位剂量可以包含200-300mg HMB。西地那非与HMB的重量比可以为0.01-0.1。西地那非与HMB的重量比可以为0.02-0.08。西地那非与HMB的重量比可以为0.03-0.05。表12中示出了包含HMB和西地那非的单位剂量的示例性制剂。
表12:制剂12
在一些实施方案中,单位剂量包含HMB、西地那非和白藜芦醇。单位剂量可以包含约5-1000mg HMB。单位剂量可以包含约100-500mg HMB。单位剂量可以包含约150-400mg HMB。单位剂量可包含200-300mg HMB。西地那非与HMB的重量比可以为0.01-0.1。西地那非与HMB的重量比可以为0.02-0.08。西地那非与HMB的重量比可以为0.03-0.05。白藜芦醇与HMB的重量比可以为0.01-0.1。白藜芦醇与HMB的重量比可以为0.02-0.08。白藜芦醇与HMB的重量比可以为0.03-0.05。表13中示出了包含HMB和西地那非的单位剂量的示例性制剂。
表13:制剂13
单位剂量可以包含约20-1000mg KIC。单位剂量可以包含约100-500mg KIC。单位剂量可以包含150-400mg KIC。单位剂量可以包含200-300mg KIC。单位剂量可以进一步包含二甲双胍。二甲双胍与KIC的重量比可以为0.01-1。二甲双胍与KIC的重量比可以为0.5-0.5。二甲双胍与KIC的重量比可以为0.1-0.3。单位剂量可以任选地进一步包含白藜芦醇。示例性单位剂量组合物包含约50mg二甲双胍、250mg KIC和任选的50mg白藜芦醇。单位剂量可以包含约100mg二甲双胍、1250mg KIC和任选的50mg白藜芦醇。单位剂量可以包含约250mg二甲双胍、250mg KIC和任选的50mg白藜芦醇。单位剂量可以包含约500mg二甲双胍、500mg KIC和任选的50mg白藜芦醇。表14中示出了包含KIC和二甲双胍的单位剂量的示例性制剂:
表14:制剂14
表15中示出了包含KIC、二甲双胍和白藜芦醇的单位剂量的另一种示例性制剂:
表15:制剂15
在一些实施方案中,单位剂量包含KIC和淫羊藿苷。单位剂量可以包含约20-1000mg KIC。单位剂量可以包含约100-500mg KIC。单位剂量可以包含150-400mg KIC。单位剂量可以包含200-300mg KIC。淫羊藿苷与KIC的重量比可以为0.05-0.5。淫羊藿苷与KIC的重量比可以为0.07-0.4。淫羊藿苷与KIC的重量比可以为0.1-0.3。表16中示出了包含KIC和淫羊藿苷的单位剂量的示例性制剂:
表16:制剂16
在一些实施方案中,单位剂量包含KIC、淫羊藿苷和白藜芦醇。单位剂量可以包含约20-1000mg KIC。单位剂量可以包含约100-500mg KIC。单位剂量可以包含约150-400mg KIC。单位剂量可以包含200-300mg KIC。淫羊藿苷与KIC的重量比可以为0.05-0.5。淫羊藿苷与KIC的重量比可以为0.07-0.4。淫羊藿苷与KIC的重量比可以为0.1-0.3。白藜芦醇与KIC的重量比可以为0.05-0.5。白藜芦醇与KIC的重量比可以为0.07-0.4。白藜芦醇与KIC的重量比可以为0.1-0.3。表17中示出了包含KIC、淫羊藿苷和白藜芦醇的单位剂量的示例性制剂:
表17:制剂17
在一些实施方案中,单位剂量包含KIC、淫羊藿苷和二甲双胍。单位剂量可以包含约50至约1000mg KIC。单位剂量可以包含约100至约500mg KIC。单位剂量可以包含约150至约400mg KIC。单位剂量可以包含约200至约300mg KIC。淫羊藿苷与KIC的重量比可以为0.05-0.5。淫羊藿苷与KIC的重量比可以为0.07-0.4。淫羊藿苷与KIC的重量比可以为0.1-0.3。二甲双胍与KIC的重量比可以为0.2-4。二甲双胍与KIC的重量比可以为0.5-2。二甲双胍与KIC的重量比可以为0.75-1.25。表18中示出了包含KIC、淫羊藿苷和二甲双胍的单位剂量的示例性制剂:
表18:制剂18
在一些实施方案中,单位剂量包含KIC和西地那非。单位剂量可以包含约20-1000mg KIC。单位剂量可以包含约100-500mg KIC。单位剂量可以包含约150-400mg KIC。单位剂量可以包含200-300mg KIC。西地那非与KIC的重量比可以为0.01-0.1。西地那非与KIC的重量比可以为0.02-0.08。西地那非与KIC的重量比可以为0.03-0.05。表19中示出了包含KIC和西地那非的单位剂量的示例性制剂:
表19:制剂19
在一些实施方案中,单位剂量包含KIC、西地那非和白藜芦醇。单位剂量可以包含约20-1000mg KIC。单位剂量可以包含约100-500mg KIC。单位剂量可以包含约150-400mg KIC。单位剂量可以包含200-300mg KIC。西地那非与KIC的重量比可以为0.01-0.1。西地那非与KIC的重量比可以为0.02-0.08。西地那非与KIC的重量比可以为0.03-0.05。白藜芦醇与KIC的重量比可以为0.01-0.1。白藜芦醇与KIC的重量比可以为0.02-0.08。白藜芦醇与KIC的重量比可以为0.03-0.05。表20中示出了包含KIC和西地那非的单位剂量的示例性制剂:
表20:制剂20
在一些实施方案中,单位剂量包含亮氨酸、二甲双胍和西地那非。单位剂量可以包含约250至约2000mg亮氨酸。单位剂量可以包含约500至约1500mg亮氨酸。单位剂量可以包含900-1300mg亮氨酸。二甲双胍与亮氨酸的重量比可以为0.15-0.3。二甲双胍与亮氨酸的重量比可以为0.22-0.23。西地那非与亮氨酸的重量比可以为0.00001-0.05。西地那非与亮氨酸的重量比可以为0.0001-0.03。西地那非与亮氨酸的重量比可以为0.001-0.02。西地那非与亮氨酸的重量比可以为0.005-0.015。表21中示出了包含亮氨酸、二甲双胍和西地那非的单位剂量的示例性制剂:
表21:制剂21
在一些实施方案中,(a)支链氨基酸和/或其代谢物与(b)选择性PDE抑制剂的摩尔比为大约或大于约20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、100、120或150。在其他实施方案中,本发明组合物中包含的一种或多种支链氨基酸和/或其代谢物与选择性PDE抑制剂的摩尔比为大约或大于约20、30、40、50、60、70、80、90、95、100、105、110、120、130、140、150、160、170、180、190、200、220、250、300、350、400或500。在一些实施方案中,所述组合物中组分(a)与(b)的摩尔比大于约20、40、60、80、100、120或150。在一些实施方案中,所述组合物中组分(a)与(b)的摩尔比大于约80、100、120或150。在一些实施方案中,所述组合物中组分(a)与(b)的摩尔比大于约80、100、120或150。在一些实施方案中,所述组合物中组分(a)与(b)的摩尔比大于约200、250或300。在一些实施方案中,所述组合物中组分(a)与(b)的摩尔比大于约40、150、250或500。
在一些实施方案中,可设计亮氨酸、亮氨酸的任何代谢物、PDE抑制剂(如PDE 5抑制剂,如西地那非)的给药,以达到亮氨酸、亮氨酸代谢物和/或PDE 5抑制剂的指定生理学浓度或循环水平。该生理学浓度可以是在受试者的血流中测定的循环水平。该受试者可以是人或动物。选择的给药可以根据受试者的特性如体重、能量代谢速率、遗传学、种族、身高或任何其他特性而改变。单位剂量中亮氨酸的量可以是这样的量,其使得受试者中亮氨酸的循环水平约为或大于约0.25mM、0.5mM、0.75mM或1mM。约1,125mg亮氨酸(例如游离亮氨酸)的给药可在受试者中达到约0.5mM的亮氨酸循环水平。约300mg亮氨酸(例如游离亮氨酸)的给药可在受试者中达到约0.25mM的亮氨酸循环水平。西地那非的给药可达到约为或小于约0.1、0.5、1、2、5或10nM的循环浓度。在一些实施方案中,目标或已达到的西地那非的循环浓度小于约1nM。约20mg西地那非的单位剂量可达到约100nM西地那非的循环浓度。约0.2mg西地那非的单位剂量可达到约1nM西地那非的循环浓度。淫羊藿苷的给药可达到约为或小于约0.1、0.5、1、2、5或10nM的循环浓度。在一些实施方案中,目标或已达到的淫羊藿苷的循环浓度小于约1nM。约20mg淫羊藿苷的单位剂量可达到约100nM淫羊藿苷的循环浓度。约0.1mg淫羊藿苷的单位剂量可达到约1nM淫羊藿苷的循环浓度。
在一些实施方案中,摩尔比或质量比是向受试者施用一种或多种组合物后达到的循环摩尔比或质量比。该组合物可以是本文描述的联合组合物。可以调节给药形式中的联合组合物的摩尔比以达到期望的循环摩尔比。可以调节摩尔比以利于联合组合物的一种或多种组分的生物利用度、摄取和代谢加工。例如,如果一种组分的生物利用度低,那么该组分的摩尔量可以相对于联合组合物中的其他组分增加。在一些实施方案中,循环摩尔比或质量比在施用后约0.1、0.5、0.75、1、3、5或10、12、24或48小时内达到。循环摩尔比或质量比可维持大约或大于约0.1、1、2、5、10、12、18、24、36、48、72或96小时的一段时间。
在一些实施方案中,亮氨酸与西地那非的循环摩尔比约为或大于约100,000、250,000、500,000、750,000或更高。在一些实施方案中,HMB与西地那非的循环摩尔比约为或大于约1,000、2,500、5,000、7,500或更高。在一些实施方案中,白藜芦醇与西地那非的循环摩尔比约为或大于约50、100、200、400、800或更高。
可向受试者施用该组合物,以使得向该受试者施用选定的每日总剂量的该组合物。该每日总剂量可以取决于在24小时周期内施用的剂量的总和。该组合物的每日总剂量可包含约0.05、0.1、0.5、1、2、5、10、20、40、60、80或100mg西地那非。该组合物的每日总剂量可包含约1、10、20、50、100、150、300、400、500、750、1000、1500或2000mg淫羊藿苷。该组合物的每日总剂量可包含约1、10、20、50、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、900或1000mg二甲双胍。该组合物的每日总剂量可包含至少约250、500、750、1000、1125、2000、2250mg、2550mg或更多的支链氨基酸或其代谢物。该支链氨基酸可以是亮氨酸、HMB或本文所述的任何其他支链氨基酸。
在一些实施方案中,可向受试者施用选定剂量的组合物,以使得该受试者达到期望的循环水平的该组合物。期望的循环水平的亮氨酸可以是至少约0.25、0.5、0.75、1mM或更多的亮氨酸。期望的循环水平的西地那非可以是约0.1、0.5、1、2、5、10nM或更多的西地那非。期望的循环水平的淫羊藿苷可以是约0.1、0.5、1、2、5、10nM或更多的淫羊藿苷。期望的循环水平的二甲双胍可以是约1、2、4、5μM或更多的二甲双胍。期望的循环水平的罗格列酮可以是约1、10、25、50、100、400nM或更多的罗格列酮。期望的循环水平的吡格列酮可以是约0.25、0.50、1.0、2.0μM或更多的吡格列酮。选定的剂量可以根据受试者的特性如体重、身高、种族或遗传学来选择。
实施例
实施例1:长期高脂肪饮食对肝脏质量和肝脂质积累的影响。
将长期高脂肪饮食用于C57Bl/6小鼠,作为肝性脂肪变性的实验模型。使雄性C57/BL6小鼠在六周龄时维持在标准的低脂肪饮食(对照;LFD;10%能量来自脂肪)或置于高脂肪饮食(HFD;60%能量来自脂肪,Research Diets#D12492,Research Diets,Inc,New Brunswick,NJ),以诱导肥胖和肝脏的脂肪浸润。高脂肪饮食六周后,肝脏质量明显大幅度增加(p<0.0001,图2)。如图3的组织学所示,肝脏质量的这一增加伴随着肝脂质浸润的明显增加。用LFD喂养的动物在肝细胞中具有正常的细胞结构。黑点表示细胞核。通常,细胞核可以通过用苏木精、亚甲蓝、尼罗蓝(nile blue)或中性/二苯乙烯红染色来示出。相反,用HFD喂养的动物具有增加的肝脏质量和增加的肝脂质浸润,并示于HFD图中。在HFD图的肝细胞中发现了大量脂囊泡,箭头指向示例性脂囊泡。HFD图中的肝细胞还具有破坏的细胞结构,如由细胞核的分布所示的。这些结果表明,长期HFD诱导小鼠的肝性脂肪变性。随后将动物随机分组接受额外六周的治疗,每组10只动物,如在以下实施例中说明的。所有实施例的数据均通过单因素方差分析法进行分析;当ANOVA显示显著性差异时,通过Tukey多重比较检验(Graphpad Prism,6.0版)分离出平均值。
实施例2:二甲双胍、白藜芦醇和亮氨酸的各种组合对肝脏质量和肝性脂肪变性的影响。
在该研究中,评估了单独的二甲双胍(治疗剂量)、单独的亚治疗剂量(subtherapeutic)二甲双胍、亚治疗剂量亮氨酸以及亮氨酸、二甲双胍和白藜芦醇的各种组合对肝脏重量和肝脂质积累的影响。二甲双胍的1.5g/kg饮食对应于人体中二甲双胍的治疗有效剂量。其余的二甲双胍剂量(0.05–0.5g/kg)代表不产生独立影响的亚治疗剂量。同样地,亮氨酸的24g/kg剂量代表亚治疗剂量,预测其对肝脏质量或肝性脂肪变性不产生显著的独立影响。如实施例1中所述诱导肝性脂肪变性后,根据如表21中所示的以下治疗组对动物进行治疗:
表21:实施例2治疗组
图4和图5描绘了以上研究的结果。高脂肪饮食使肝脏重量增加约70%(图4)。施用治疗剂量的二甲双胍使高脂肪饮食对肝脏重量的影响部分地逆转回到对照水平(相对于HFD和LFD,p<0.02,图4)。单独施用亚治疗剂量亮氨酸对肝脏重量没有显著影响(图4)。同样地,施用亚治疗剂量亮氨酸+亚治疗剂量白藜芦醇对肝脏重量没有显著影响(图4)。令人惊讶的是,将亚治疗剂量亮氨酸、亚治疗剂量白藜芦醇和亚治疗剂量二甲双胍(0.15g/kg)组合显著地减少了高脂肪饮食对肝脏重量的影响(相对于HFD和LFD,p<0.02,图4)。此外,将亚治疗剂量亮氨酸、亚治疗剂量白藜芦醇和0.25g/kg二甲双胍组合实现了使高脂肪饮食对肝脏重量的影响完全逆转回到对照水平(相对于HFD,p<0.0002;相对于LFD未作说明(n.s.),图4)。
组织学分析揭示,用低脂肪饮食(LFD)喂养的动物具有正常的细胞结构并且没有显示可检测到的脂囊泡。相反,用高脂肪饮食(HFD)喂养的动物诱导了显著的肝性脂肪变性(图5)。施用治疗剂量的二甲双胍实现了HFD对肝性脂肪变性的影响的部分逆转(图5)。细胞看起来具有减少的肝积累和减少的脂囊泡。单独施用亮氨酸以及亮氨酸+白藜芦醇都似乎没有显著地减少肝性脂肪变性,如由脂囊泡的外观和脂质积累所示的(图5)。然而,亚治疗剂量的亮氨酸、白藜芦醇和二甲双胍的联合治疗看起来逆转了肝性脂肪变性,如由减少的肝脂质积累和减少的脂囊泡所示的(图5)。细胞看起来也显示出与LFD图中的细胞相当的细胞结构。
实施例3:二甲双胍和亮氨酸的各种组合对肝脏质量和肝性脂肪变性的影响。
在该研究中,评估了单独的二甲双胍(治疗剂量)与亚治疗量的二甲双胍和亮氨酸的联合治疗相比对肝脏重量和肝脂质积累的影响。如实施例1中所述诱导肝性脂肪变性后,根据如表22示出的以下治疗组将动物治疗六周:
表22:实施例3治疗组
图6-8描绘了以上研究的主要结果。高脂肪饮食使肝脏重量增加了约30%(图6)并使肝中的甘油三酯增加了约5倍(图7)。施用治疗剂量的二甲双胍使高脂肪饮食对肝脏重量的影响逆转回到对照水平(相对于HFD,p<0.02,相对于LFD,未作说明,图6)。令人惊讶的是,将亚治疗剂量的亮氨酸与亚治疗剂量的二甲双胍(0.25和0.5g/kg)组合也使高脂肪饮食对肝脏重量的影响逆转回到对照水平(相对于HFD,p<0.02,相对于LFD,未作说明,图6)。施用治疗剂量的二甲双胍部分地逆转了高脂肪饮食对肝中甘油三酯的影响(图7),但亚治疗剂量的二甲双胍(0.5g/kg)与亮氨酸的组合明显是更有效的,并且完全逆转了高脂肪饮食对肝中甘油三酯的影响(图7)。
组织学分析揭示,用低脂肪饮食(LFD)喂养的对照动物在肝细胞内没有可检测到的脂质积累。相反,用高脂肪饮食(HFD)喂养的动物诱导了显著的肝性脂肪变性(图8)。施用治疗剂量的亮氨酸部分地逆转了肝性脂肪变性,如通过肝细胞中减少的脂质积累和脂囊泡所显示的。施用治疗剂量的二甲双胍部分地逆转了肝性脂肪变性,如通过肝细胞中减少的脂质积累和脂囊泡所显示的(图8)。将亚治疗剂量的亮氨酸与二甲双胍(0.5g/kg)组合也逆转了肝性脂肪变性(图8)。肝细胞中脂囊泡的数目和脂质积累在用亮氨酸和二甲双胍组合治疗的动物中看起来大大减少。细胞结构也看起来与LFD图中的细胞相当。
高脂肪饮食显著地增加了包括乙酰基-辅酶A羧酶(ACC)、硬脂酰-辅酶A脱饱和酶1(SCD1)和脂肪酸合成酶(FAS)在内的脂肪生成基因的肝表达(图9),而添加亮氨酸和低剂量的二甲双胍导致脂肪生成基因表达的显著的剂量依赖性降低(图9)。值得注意的是,二甲双胍(0.5g/kg)和亮氨酸的组合相比于治疗剂量的二甲双胍对减少ACC产生明显更大的影响(图9)。
肝炎症基因白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF)-α和单核细胞趋化蛋白(MCP)-1的表达被高脂肪饮食显著增加,而被亮氨酸-二甲双胍组合显著减少;且低剂量组合比治疗剂量的二甲双胍对IL1β和MCP-1产生明显更大的影响(图10)。
实施例4:二甲双胍和HMB的各种组合对肝脏质量和肝性脂肪变性的影响。
在该研究中,评估了单独的二甲双胍(治疗剂量)与亚治疗量的二甲双胍和HMB的联合治疗相比对肝脏重量和肝脂质积累的影响。如实施例1中所述诱导肝性脂肪变性后,根据如表23所示的以下治疗组将动物治疗六周:
表23:实施例4治疗组
图11和图12描绘了以上研究的结果。高脂肪饮食使肝脏重量增加了约25%(图11)。施用治疗剂量的二甲双胍将高脂肪饮食对肝脏重量的影响逆转回到对照水平(p<0.03,图8)。令人惊讶的是,将亚治疗剂量的HMB与亚治疗剂量的二甲双胍(0.25和0.5g/kg)组合也将高脂肪饮食对肝脏重量的影响逆转回到对照水平(p<0.03,图11)。
组织学分析揭示,用低脂肪饮食(LFD)喂养的对照动物具有正常的细胞结构并且没有可检测到的脂质积累。相反,用高脂肪饮食(HFD)喂养的动物诱导了显著的肝性脂肪变性,如通过肝细胞中的脂质积累和大量脂囊泡的外观所显示的(图12)。施用治疗剂量的二甲双胍部分地逆转了肝性脂肪变性,如通过肝细胞中减少的脂质积累和减少的脂囊泡所显示的(图12)。将亚治疗剂量的HMB与二甲双胍(0.25g/kg)组合也逆转了肝性脂肪变性(图12)。肝细胞看起来具有与LFD图中的肝细胞相当的细胞结构。
实施例5:PDE5特异性抑制剂和亮氨酸的各种组合对肝脏质量和肝性脂肪变性的影响。
在该研究中,评估了单独的亮氨酸与亮氨酸和PDE5特异性抑制剂淫羊藿苷的联合治疗相比对肝脏重量和肝脂质积累的影响。之前发表的淫羊藿苷的研究已经表明25mg淫羊藿苷/kg饮食(对应于4mg/kg体重/天)对肝脏质量或肝脂质积累没有影响。如实施例1中所述诱导肝性脂肪变性后,根据如表24所示的以下治疗组将动物治疗六周:
表24:实施例5治疗组
图10和图11描绘了以上研究的结果。高脂肪饮食使肝脏重量增加了约75%(图13)。单独施用亮氨酸对肝脏重量没有影响(图10)。令人惊讶的是,将亚治疗剂量的亮氨酸与亚治疗剂量的淫羊藿苷(25mg/kg)组合显著地减少了高脂肪饮食对肝脏重量的影响(相对于HFD,p<0.01,图13)。
组织学分析揭示,用低脂肪饮食(LFD)喂养的对照动物具有正常的细胞结构并且没有可检测到的脂质积累。相反,用高脂肪饮食(HFD)喂养的动物诱导了显著的肝性脂肪变性,如通过肝细胞中脂囊泡的外观和脂质积累所显示的(图14)。将亚治疗剂量的亮氨酸与淫羊藿苷组合看起来逆转了肝性脂肪变性(图14)。肝细胞显示出与LFD图中的肝细胞相当的细胞结构。
将亚治疗剂量的亮氨酸和淫羊藿苷组合导致了对肝脂肪酸氧化基因表达的显著刺激(图15)。
同样地,将亚治疗剂量的亮氨酸和淫羊藿苷组合导致对肝炎症基因白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF)-α和单核细胞趋化蛋白(MCP)-1的显著抑制(图16)。此外,使用循环C-反应蛋白(CRP)作为肝炎症应激的综合标志物,亮氨酸-PDE5抑制剂的组合逆转了HFD诱导的CRP的升高,而单独的亮氨酸不产生独立影响(图17)。
实施例6:亮氨酸、二甲双胍和白藜芦醇的各种组合对肝性脂肪变性的预防性作用。
在该研究中,评估了单独的二甲双胍以及二甲双胍、亮氨酸和白藜芦醇的各种组合对肝脏质量和肝性脂肪变性的预防性作用。C57Bl/6小鼠被分配到表25中示出的以下实验组:
表25:实施例6实验组
药物治疗和高脂肪饮食喂养(如实施例1中所述)均在同一天开始,并进行六周。如上述实施例中所述评估了治疗和饮食对肝脏质量和肝脂质积累的影响。单独的高脂肪饮食导致肝脏质量和肝脂质积累的增加。单独施用治疗剂量的二甲双胍与高脂肪喂养同时进行减弱了HFD诱导的肝脏质量和肝脂质积累的增加。共施用亮氨酸和亚治疗剂量的二甲双胍(含有或不含白藜芦醇)防止了HFD诱导的肝脏质量和肝脂质积累的增加。
实施例7:HMB、二甲双胍和白藜芦醇的各种组合对肝性脂肪变性的预防性作用。
在该研究中,评估了单独的二甲双胍以及二甲双胍、HMB和白藜芦醇的各种组合对肝脏质量和肝性脂肪变性的预防性作用。C57Bl/6小鼠被分配到表26中示出的以下实验组:
表26:实施例7实验组
药物治疗和高脂肪饮食喂养(如实施例1中所述)均在同一天开始,并进行六周。如上述实施例中所述评估了治疗和饮食对肝脏质量和肝脂质积累的影响。单独的高脂肪饮食导致肝脏质量和肝脂质积累的增加。单独施用治疗剂量的二甲双胍与高脂肪喂养同时进行减弱了HFD诱导的肝脏质量和肝脂质积累的增加。共施用HMB和亚治疗剂量的二甲双胍(含有或不含白藜芦醇)防止了HFD诱导的肝脏质量和肝脂质积累的增加。
实施例8:亮氨酸和PDE5特异性抑制剂的各种组合对肝性脂肪变性的预防性作用。
在该研究中,评估了单独施用亚治疗剂量亮氨酸以及共施用亮氨酸和PDE5特异性抑制剂淫羊藿苷对肝脏质量和肝性脂肪变性的预防性作用。C57Bl/6小鼠被分配到表27中示出的以下实验组:
表27:实施例8实验组
药物治疗和高脂肪饮食喂养(如实施例1中所述)均在同一天开始,并进行六周。如上述实施例中所述评估了治疗和饮食对肝脏质量和肝脂质积累的影响。单独的高脂肪饮食导致肝脏质量和肝脂质积累的增加。单独施用治疗剂量的亚治疗剂量亮氨酸对HFD诱导的肝脏质量和肝脂质积累的增加没有显著影响。共施用亮氨酸和亚治疗剂量的淫羊藿苷防止了HFD诱导的肝脏质量和肝脂质积累的增加。
实施例9:亮氨酸、二甲双胍和西地那非在肝细胞中的交互作用。
在该研究中,在HepG2细胞中评价了亚治疗剂量的亮氨酸(0.5mM)、二甲双胍以及以西地那非(0.1-10nM)对PDE5进行抑制对肝细胞抗衰老酶信号传导、脂肪氧化和甘油三酯含量的体外影响。
尽管亮氨酸-二甲双胍和亮氨酸-西地那非刺激Sirt1和AMPK激活,但相比于任一个两方组合(亮氨酸-二甲双胍、亮氨酸-西地那非),三方组合以显著更大的程度刺激Sirt1和AMPK两者。
此外,尽管亮氨酸-二甲双胍和亮氨酸-西地那非均刺激肝细胞脂肪氧化并抑制棕榈酸酯诱导的肝细胞中的甘油三酯积累,但亮氨酸、二甲双胍和西地那非的三方组合的效果是任一个两方组合的效果的两倍(图18)。
实施例10:非酒精性脂肪性肝炎(NASH)小鼠模型中亮氨酸-二甲双胍-西地那非与亮氨酸-二甲双胍和亮氨酸-西地那非相比的交互作用。
在该研究中,作为两方组合和三方组合,比较亚治疗剂量的亮氨酸、二甲双胍和西地那非的影响。
C57Bl/6小鼠被分配到表28中示出的以下实验组:
表28:实施例10实验组
药物治疗和高脂肪饮食喂养(如实施例1中所述)均在同一天开始,并进行六周。如上述实施例中所述评估了治疗和饮食对肝脏质量和肝脂质积累的影响。
HF/ATH饮食导致明显的肝细胞损伤,如由丙氨酸氨基转移酶增加约6倍所证明的(ALT;图19)。亮氨酸-二甲双胍-西地那非组合的治疗功效在治疗两周内明显;尽管亮氨酸-二甲双胍和亮氨酸-西地那非均降低了ALT水平,但三方组合产生了显著更大的效果,导致在两周时ALT降低约50%(图19),且在六周时降低>60%(图20)。HF/ATH饮食也导致相对于体重归一化的肝脏质量显著增加29%(p<0.0001;图21)。亮氨酸-二甲双胍和亮氨酸-西地那非组合均导致肝脏质量的非显著性减少。然而,亮氨酸、二甲双胍和西地那非的三方组合导致肝脏质量减少12%(p<0.003),反映了肝脂质积累的减少。
实施例11:在患有非酒精性脂肪性肝炎(NASH)的人中亮氨酸-二甲双胍-西地那非与亮氨酸-二甲双胍和亮氨酸-西地那非相比的交互作用。
在该研究中,作为两方组合和三方组合,比较了亚治疗剂量的亮氨酸、二甲双胍和西地那非的影响。
患有非酒精性脂肪性肝炎的人被分配到表29中示出的以下实验组。这样的试验的持续时间包括约12个月。
表29:实施例11实验组
使用肝活检、血液检验、FibroTest、SteatoTest、实施例3和实施例4中提供的基因的基因表达谱分析或它们的组合来评估治疗和饮食对肝脂质积累的影响。进行了肝活检并评价了NAFLD活动评分(NAS)的改善。还评价了NASH分辨率的改善。
预期安慰剂组维持明显的肝细胞损伤。响应于治疗,在亮氨酸和二甲双胍两方组合中,预期NAFLD活动评分将改善至少两分,并改善纤维化中的NASH的分辨率,并且亮氨酸、二甲双胍和西地那非三方组合导致显著的进一步改善。
从上文应当可以理解,尽管已经示出和描述了特定实施方案,但仍可以对其作出各种修改,这些修改也是本文所设想到的。也并不打算由说明书中提供的具体实例来限制本发明。虽然本发明已参照前述说明书进行了描述,但本文优选的实施方案的描述和图示并不意味着以限制的意义来解释。此外,应当理解,本发明的所有方面都不限于本文提出的具体描述、构造或相对比例,其取决于多种条件和变量。对本发明的实施方案的形式和细节的各种修改对于本领域技术人员来说将是显而易见的。因此,可以预期,本发明还应当涵盖任何这样的修改、变化和等同方案。
- 还没有人留言评论。精彩留言会获得点赞!