用于疼痛治疗的BLT2激动剂的制作方法
本发明涉及用于治疗疼痛的新型止痛药,结果发现blt2激动剂可以脱敏感觉神经元中trpv1介导的信号,因此本发明提供blt2激动剂作为新的疼痛治疗剂。另一方面,本发明涉及blt2激动剂和blt1拮抗剂的组合物,用于治疗受试者疼痛。包括本发明所述的新型止痛药的药物组合物和试剂盒被进一步提供。
描述
疼痛是一种复杂的反映真实或潜在组织损伤的主观感觉和对于这种主观感受的情感反应。剧烈疼痛是指示潜在或真实损伤的生理信号。慢性疼痛可以是病理生理性的(原发的)或者精神心理性的,经常伴有或伴随导致抑郁的植物性症状。慢性疼痛导致个人受苦,以及巨大的社会经济成本。现有的药物止痛疗法在效果和安全性方面都不是很令人满意。病理生理性的疼痛可能是有伤害性起源的,炎症性的或神经病理性的。伤害性疼痛被判断为与躯体或内脏痛觉敏感神经纤维的持续激活相称。在外周神经系统中,神经病理性疼痛是由异常的躯体感觉过程所引起的神经系统紊乱造成的。
神经病理性疼痛是一种持续的或慢性的疼痛综合症,其可能是由神经系统、外周神经、背根神经节、背根神经或者中枢神经系统的损伤引起的。神经病理性疼痛的典型表现包括异常疼痛,各种神经痛如疱疹后神经痛、三叉神经痛和幻痛,和复杂的局部疼痛综合症如反射交感性营养不良和灼性神经痛。灼性神经痛的特点往往是伴随痛觉过敏和异常疼痛的自发灼痛。不幸的是,目前没有方法可以充分地、可预测地和明确地治疗确定的神经病理性疼痛,因为现有治疗神经病理性疼痛的方法只是试图帮助病人通过心理或职业治疗应付疼痛,而不是减少或消除疼痛。神经病理性或者慢性疼痛的治疗对于医生或病人都是一种挑战,因为目前还没有专门针对这种情况的药物,而且由于目前使用的药物只能产生一点宽慰,并基于其在急性疼痛条件下的疗效或减轻继发性影响(如焦虑和抑郁)的疗效。慢性疼痛的发病率呈上升趋势,其社会负担在医疗和生产力丧失两方面都是巨大的。目前还没有科学有效的方法用来缓解慢性疼痛,于是,公共卫生界把“疼痛管理”作为目标,同时使用多模式疗法,希望改善一些生活质量。因此,迫切需要一种能缓解慢性疼痛的药物。
最近的研究发现瞬时受体电位离子通道家族成员(trpv1,trpa1和trpv4)在奥沙利铂和紫杉醇诱导的神经病变中作为机械和冷性异常疼痛的参与者。trpv1和trpa1的激活或敏化能提高cgrp和p物质的释放,而cgrp和p物质均能引起神经源性炎症和t细胞的聚集。
辣椒素是一种高选择性瞬时受体电位香草酸受体1(trpv1,前身为香草酸受体1(vr1))激动剂,一种配体门控的非选择性阳离子通道,优先表达在小直径的感觉神经元,尤其是那些专门检测疼痛或伤害感觉的c纤维。trpv1对伤害性刺激包括辣椒素、热和细胞外酸化有响应,并将与同时接触的这些刺激物结合在一起。激活trpv1表达(辣椒素敏感)的伤害性感受器的初步影响有烧灼感、痛觉过敏、异常疼痛和红斑。然而,长期接触低浓度辣椒素或单次接触高浓度辣椒素或其他trpv1激动剂后,小直径的感觉神经元对各种刺激,包括辣椒素或热刺激变得不敏感。这种长期接触的特点也是降低疼痛响应。这种辣椒素的后期效应经常被称为“脱敏”,是开发用于治疗各种疼痛综合症和其他疾病的局部辣椒素制剂的理论基础。
到目前为止,两类止痛药主要被用于治疗疼痛:非阿片类止痛药,主要是对乙酰氨基酚和nsaids(非甾体类消炎药);阿片类(麻醉药)激动剂(所述“阿片类”是一种天然或合成物质的总称,该物质可结合到中枢神经系统中特定的阿片受体,并产生激动作用)。不幸的是,两类止痛药,阿片类和非阿片类,都有一些不想要的副作用。阿片类最严重的副作用是呼吸系统抑制的可能性和长期治疗后成瘾的可能性。另一方面,nsaids,主要的非阿片类药物,可以诱发多种胃肠道并发症如溃疡和出血,而且还有肾脏损伤(scholich和geisslinger,2006)。
因此,直到今天,还没有找到特效的治疗神经病理性疼痛的疗法。本发明的目的是提供新型止痛药,以克服阿片类和nsaids的问题。
首先,上述问题通过白三烯b4受体2(blt2)激动剂来解决,所述blt2激动剂用于抑制受试者神经系统感觉,其中所述神经系统感觉通过瞬态电压感受器阳离子通道子类v成员1(trpv1)的激活来介导。
据悉,白三烯(lt)b4导致疼痛,并且是中性粒细胞强有力的趋化因子,从而促进炎症和诱导疼痛。两个g-蛋白偶联受体,blt1和blt2被证明可以被ltb4激活。先前显示,blt1介导ltb4的趋化性和疼痛刺激作用。
已经意外的发现,blt2激动剂的使用减少trpv1敏化(一个主要的伤害因子),其被各种刺激如ltb4、pge2受体(ep4)配体以及缓激肽诱导的蛋白激酶a(pka)激活诱导。发明人已经开发了一种新的工具来减少trpv1介导的感觉神经元的激活,并提供新化合物,它们是有用的止痛药。
本文中所使用的术语“blt2激动剂”是指导致blt2表达或活性的数量或比率增加的物质。此类物质可以直接起作用,例如通过结合blt2,并增加blt2表达或活性的数量或比率。blt2激动剂也能通过其它方式增加blt2表达或活性的数量或比率,例如,通过结合blt2这样一种方式来增强或促进blt2与blt2配体的相互作用;通过结合并修饰blt2影响blt2激活,如诱导构象变化,或除去或增加一部分;通过结合blt2并增加它的稳定性。blt2激动剂也能间接起作用,例如通过结合调控分子或基因区域,从而调节调控蛋白或基因区域的功能,并影响blt2表达或活性的数量或比率的增加。因此,blt2激动剂可以通过任何导致blt2表达或活性的数量或比率增加的机制起作用。
blt2激动剂可以是,例如,一个天然或非天然产生的分子如多肽、肽、肽类、核酸、碳水化合物和脂类。blt2激动剂还可以是一个抗体或其抗原结合片段如单克隆抗体,人源化抗体、嵌合抗体、微抗体、双功能抗体,单链抗体(scfv),可变区片段(fv或fd),fab或f(ab)2。blt2激动剂也可以是一个特定于blt2的多克隆抗体。blt2激动剂还可以是部分或全合成的衍生物、天然高分子的模拟或类似物、或者小的有机或无机分子。
blt2激动剂是一种抗体,该抗体可以,例如,结合blt2并通过模仿配体结合激活受体信号,或改变调节blt2表达或活性的分子的活性,致使blt2表达或活性的数量或比率增加。本发明方法中使用的抗体可以是天然产生的抗体包括单克隆或多克隆抗体或其片段,或非天然产生的抗体包括但不限于单链抗体、嵌合抗体、双功能抗体、互补决定区嫁接(cdr-grafted)抗体,以及人源化抗体或其抗原结合片段。
根据本发明的blt2激动剂也是表达blt2蛋白或其功能性片段的表达结构。术语“表达结构”指用于转录成rna的任何双链dna和双链rna,例如,一个结构包含至少一个可连接到下游感兴趣的基因或编码区的启动子(例如,cdna或基因组dna片段,它们能编码蛋白质或任何感兴趣的rna),尤其是blt2基因或其片段。受体细胞中表达结构的转染和表达允许细胞通过表达结构表达rna或蛋白质编码。表达结构可能是一个基因工程质粒、病毒、人工染色体(来自于例如噬菌体、腺病毒、逆转录酶病毒、痘病毒、疱疹病毒)、或在下面“表达载体”中描述的实施例。表达结构能在活体细胞中被复制,或者它也能被合成。就本申请而言,术语“表达结构”,“表达载体”,“载体”和“质粒”被互换使用,目的在于一般性、说明性地解释本发明申请,并不旨在限制本发明表达结构为特别的类型。此外,术语表达结构或载体也旨在包括实例,其用于检测的细胞已经内源性地包括这些dna序列。特别优选的是,表达结构特定地允许blt2在感觉神经元中表达。
本文中所使用的“表达”包括多核苷酸转录为mrna并翻译成肽、多肽或蛋白质的过程。如果多核苷酸来自基因组dna,且选择合适的宿主,表达可能包括mrna的剪接。表达所需要的调控因子包括结合rna聚合酶的启动子序列和与核糖体结合的转录起始序列。例如,细菌表达载体包括启动子如lac启动子、用于转录shine-dalgrarno的起始序列、以及起始密码子aug(sambrook,j。,fritsh,e.f.,andmaniatis,t.,molecularcloning:alaboratorymanual.2nd,ed.,coldspringharborlaboratory,coldspringharborlaboratorypress,coldspringharbor,n.y.,1989)。同样的,真核表达载体包括异源或同源的rna聚合酶ii启动子、下游多聚腺苷酸化信号、起始密码子aug和用于核糖体脱离的终止密码子。这些载体可以商业上获得,也可以通过现有技术已知的序列重组方法获得,例如,下面描述的一般构建载体的方法。
在一些实施例中,blt2激动剂是一种化合物,当其接触外周神经元时,能够通过ltb4或pka降低trpv1敏化。例如,这可以在下述实施例3和实施例4提供的实验装置中进行测试。总之,drg神经元与候选blt2激动剂,连同ltb4或pka激活剂(如onoae329)一起孵化。辣椒素刺激后,检测到细胞内钙增加。如果与对比化合物相比,使用候选blt2激动剂孵育能降低细胞内钙的增加,那么所述候选化合物是根据本发明的blt2激动剂。
在本发明优选的实施例中,blt2激动剂不是blt1激动剂;优选的,blt2激动剂是选择性的blt2激动剂;或者更优选的,blt2激动剂也是一种blt1拮抗剂。
本发明优选的blt2激动剂是4’-[[(氧代戊基)苯胺]甲基]-[1,1’-联苯]-2-羧酸(cay10583),以及该化合物的衍生物、类似物和盐。
blt2激动剂可以选自wo2005/102388中公开的任何blt2激动剂。
在本发明优选的实施例中,通过trpv1激活介导的神经系统感觉是任何种类的疼痛。
本文中所使用的术语“疼痛”指的是一种不愉快的感觉。例如受试者感觉不适、悲痛或痛苦。本领域技术人员已知的,不同痛苦的情况可以根据明显相反的或其他有用的类型进行分类。相反类型的例子包括伤害性疼痛与非伤害性疼痛,以及急性疼痛与慢性疼痛。本领域技术人员所使用的其它常见类型疼痛的例子包括伤害性疼痛和幻痛。
本文中所使用的术语“伤害性”是指将有害的或潜在的有害刺激转化成一种感觉。
本文中所使用的术语“伤害性疼痛”是指外周神经系统中初级感觉疼痛纤维激活引起的疼痛。外周神经系统的神经元通常对有害的或痛苦的刺激有响应,因此通常被称为伤害感受器或伤害性神经元。此外,伤害性途径延伸到躯体感觉皮层。
本文中所使用的术语“非伤害性疼痛”是指中枢神经系统中神经元激活引起的疼痛。引起非伤害性疼痛的中枢神经系统中神经元的例子包括,脊髓背角神经元如中间神经元和投射神经元,或已知参与疼痛感觉的大脑部分的神经元如延髓头端腹内侧区(rvm)和导水管周围灰质(pag)。
本文中所使用的术语“急性疼痛”是指短暂的或持续少于一个月的疼痛。急性疼痛通常与直接伤害过程有关,如软组织损伤、感染、或炎症,目的在于通知动物有害因素,从而治疗和预防进一步的伤害。
本文中所使用的术语“慢性疼痛”是指持续时间超过一个月、或超过急性组织损伤的分辨率、或复发的、或与组织损伤和/或慢性疾病有关的疼痛。所述慢性疾病预计会继续或发展,其例子包括癌症、关节炎、炎症疾病、慢性创面、心血管意外、脊髓病变、中枢神经系统病变或术后恢复。
本文中所使用的术语“神经病变”是指对神经系统的正常功能产生不利影响的任何因素。神经病变可以发生在中枢或外周神经系统的任何地方,但只有在某些情况下才产生神经病理性疼痛。
本文中所使用的术语“神经病理性疼痛”是指神经系统本身受损或功能异常所引起的疼痛,它可以独立存在于神经系统以外的任何形式的组织损伤。可导致神经病理性疼痛的因素的例子包括疾病(例如,hiv、疱疹、糖尿病、癌症、自身免疫疾病),急性创伤(外科手术、伤害、触电)和慢性创伤(重复性运动障碍、化学毒性,如乙醇、化疗和重金属)。
本文中所使用的术语“幻痛”是指一种情况,即病人感觉身体的一部分疼痛,而身体的这部分不是因截肢而不存在,就是因外周神经全部破坏而完全无感。
本文中所使用的术语“痛觉过敏”是指对伤害性或疼痛性刺激的敏感度增加。这里所使用的术语“异常疼痛”描述了一种情况,即正常的非伤害性刺激被认为是疼痛的。痛觉过敏和异常疼痛均可分为原发性和继发性两种类型或情况。原发性痛觉过敏/异常疼痛是指,已经发生了组织损伤的身体区域对疼痛和先前非疼痛刺激的敏感性增加。继发性痛觉过敏/异常疼痛是指全局性的疼痛敏感性增加,其需要从大脑中的各种疼痛处理中心下行输入到外围。
本发明的另一个实施例还涉及上述blt2激动剂的用途,其中所述blt2激动剂与至少一种其它抑制trpv1敏化的化合物组合使用。
根据本发明,为了预防和治疗疼痛,blt2激动剂被施用给疑似或者正在经历疼痛的受试者。进一步更有选的是,给疑似或者正在经历疼痛的受试者进一步施用至少一种其它抑制trpv1敏化的化合物。
在本发明的背景中,所述至少一种其它抑制trpv1敏化的化合物优选为白三烯b4受体1(blt1)拮抗剂或抑制剂。
通过用于预防和治疗疼痛的组合物,现有疼痛治疗的问题被进一步解决,其中所述组合物包括(i)如上文所述的blt2激动剂和(ii)至少一种其它抑制trpv1敏化的化合物。优选地,所述至少一种其它抑制trpv1敏化的化合物是blt1拮抗剂或抑制剂(见上文)。最优选的,所述组合物包括blt2激动剂和blt1拮抗剂。
在本发明的背景中,术语“组合物”指在一个配方中,两种或两种以上活性物质的组合,同时也指在治疗中个性化配方意义上的组合物,所述个性化配方为活性物质之间间隔固定的时间给药。因此,术语“组合物”应该包括两个或两个以上有疗效化合物的联合用药的临床现实,正如本发明的背景中描述的。
联合用药:在本发明的背景中,两种或两种以上的化合物的联合用药被定义为在一年内给病人用药两种或两种以上化合物,包括两种或两种以上药物的分别给药和同时给药,其中每种所述药物都含有所述化合物中的一种,不管两种或两种以上的化合物是合并在一个配方或它们是在两个或两个以上独立的配方中。
本发明一个实施例中,所述组合物包括,在所述预防和治疗过程中,通过给受试者连续或同时给药将(i)和(ii)组合在一起。优选的,在所述预防和治疗过程中,所述拮抗剂和化疗药物同时给药。
本文中所使用的术语“blt1拮抗剂”是指导致blt1表达或活性的数量或比率降低的物质。此类物质可以直接起作用,例如通过结合blt1,并降低blt1表达或活性的数量或比率。blt1拮抗剂也能通过其它方式降低blt1表达或活性的数量或比率,例如通过结合blt1这样一种方式来减少或阻止blt1与blt1配体的相互作用;通过结合并修饰blt1,如除去或增加一部分;通过结合blt1并降低它的稳定性等。blt1拮抗剂也能间接起作用,例如通过结合调控分子或基因区域,从而调节调控蛋白或基因区域的功能,并导致blt1表达或活性的数量或比率的降低。因此,blt1拮抗剂可以通过任何导致blt1表达或活性的数量或比率降低的机制起作用。
blt1拮抗剂可以是,例如,一个天然或非天然产生的分子如多肽、肽、肽类、核酸、碳水化合物和脂类。blt1拮抗剂还可以是一个抗体或其抗原结合片段如单克隆抗体,人源化抗体、嵌合抗体、微抗体、双功能抗体,单链抗体(scfv),可变区片段(fv或fd),fab或f(ab)2。blt1拮抗剂也可以是一个特定于blt1的多克隆抗体。blt1拮抗剂还可以是部分或全合成的衍生物、天然高分子的模拟或类似物、或者小的有机或无机分子。
blt1拮抗剂是一种抗体,该抗体可以,例如,结合blt1并抑制结合到blt1配体,或改变调节blt1表达或活性的分子的活性,致使blt2表达或活性的数量和比率被降低。本发明方法中使用的抗体可以是天然产生的抗体包括单克隆或多克隆抗体或其片段,或非天然产生的抗体包括但不限于单链抗体、嵌合抗体、双功能抗体,互补决定区嫁接(cdr-grafted)抗体,以及人源化抗体或其抗原结合片段。
本发明中的blt1拮抗剂也可以是,例如,反义核苷酸序列、rna分子、或适配子序列。在细胞内反义核苷酸序列能结合核苷酸序列,并调节blt1表达的水平,blt1配体调节其它控制blt1表达或活性的基因的表达。同样的,rna分子如催化核酶,能结合和改变blt1基因或其它控制blt1表达或活性的基因的表达。核酸适配体是一种核酸序列,其有三个尺寸可以结合到目标分子。
是核苷酸的blt1拮抗剂也可以是用于rna干扰方法的双链rna分子。rna干扰(rnai)是rna降解转录后序列特异性的基因沉默过程,其通过同源性双链rna(dsrna)序列启动基因沉默。适用于rnai的双链rna(dsrna)包含大约21个连续核苷酸的正义和反义链,其对应靶向形成19个rna碱基对的基因,剩下的两个核苷酸悬在每个3’末端(elbashir等,nature411:494-498(2001);bass,nature411:428-429(2001);zamore,nat.struct.biol.8:746-750(2001))。大约25-30个核苷酸也被成功用于rnai(karabinos等,proc.natl.acad.sci.usa98:7863-7868(2001))。dsrna可以在体外合成并通过现有的方法引入细胞。
本发明优选的blt1拮抗剂为6-(6-(3r-羟基-1e,5z-十一烯-1-基)-2吡啶基)-1,5s己二醇(u75302)。在本发明的背景中,其它有用的blt1和/或ltb4拮抗剂(或抑制剂)为化合物ly293111、ono4057、cp195543、cgs25019c、biomed101、biil284bs、dw1350、ly255283和上述任何类似物。
根据本发明可替代的实施例,也涉及trpv1介导的感觉,其为味觉、皮肤痒、灼热感或者伤害性(疼痛)感觉。如上面所述的,所述疼痛可以选自炎症性疼痛、炎症性痛觉过敏、痛觉过敏、神经痛、偏头痛、癌症疼痛、内脏痛、骨关节炎痛、慢性疼痛和术后疼痛。然而,神经病理性疼痛是最优选的。
神经病理性疼痛可以选自外周神经疼痛综合症、化疗引起的周围神经病变、复杂区域疼痛综合症、hiv感觉神经病变、继发于肿瘤浸润的神经病变、疼痛性糖尿病神经病变、幻肢疼痛、疱疹后神经痛、术后疼痛、三叉神经痛、中枢神经疼痛综合症、中枢性卒中后疼痛、多发性硬化症疼痛、帕金森病疼痛或者脊髓损伤疼痛。
本发明另一方面提供了一种用于预防和治疗疼痛的药物组合物,其包括本发明所定义的blt2激动剂或本发明所定义的组合物。所述药物组合物可以进一步包括药学上可接受的载体和/或辅药。
用于治疗和预防疼痛的药物组合物和试剂盒也构成本发明的一部分。在一些实施例中,所述制剂包括上述的blt2激动剂。
本文中所使用的术语“药学上可接受的载体”包括所有溶剂、增溶剂、填料、稳定剂、粘合剂、吸附剂、基质、缓冲剂、润滑剂、控释赋形剂,稀释剂、乳化剂、保湿剂、润滑剂、分散介质、涂料、抗菌和抗真菌剂、等渗剂,以及吸收延缓剂等,其符合药事管理。此种用于药物活性物质的媒介和试剂的使用是本领域所熟知的。除非任何常规媒介或试剂与活性化合物配伍禁忌,否则将其用于所述制剂是被考虑接受的。补充剂也可以加入到所述制剂中。在某些实施例中,药学上可接受的载体包括血清白蛋白。
将本发明的药物组合物配制成与其所期望的给药途径相容。给药途径的例子包括肠胃外,例如鞘内、动脉、静脉、皮内、皮下、口服、经皮(局部)和经粘膜给药。
用于肠胃外,皮内或皮下使用的溶液或悬浮液可以包括以下组分:无菌稀释剂如注射用水、生理盐水、固定油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂如苯甲醇或甲基对羟基苯甲酸酯;抗氧化剂如抗坏血酸或硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如醋酸盐、柠檬酸盐或磷酸盐;以及调节张力的制剂剂如氯化钠或葡萄糖。可以用酸或碱,如盐酸或氢氧化钠,来调节ph。可以将肠胃外制剂装入安瓶、一次性注射器或由玻璃或塑料制成的多剂量小瓶。
适用注射使用的药物组合物包括无菌水溶液(其中水溶性的)或分散体,以及用于临时制备无菌可注射溶液或分散体的无菌粉末。用于静脉内给药,适宜的载体包括生理盐水、抑菌水、cremophoreltm(basf,parsippany,n.j.)或磷酸盐缓冲溶液(pbs)。在所有情况下,制剂必须是无菌的,并且应该是流体可达到容易注射的程度。它在制备和贮藏条件下必须是稳定的,并且必须防止它受到微生物如细菌和真菌的污染。载体可以是溶剂或分散介质,其包括例如水、乙醇、多元醇(例如,甘油、丙二醇及液体聚乙二醇等),以及它们适宜的混合物。例如,通过使用涂料如卵磷脂、在分散体的情况下通过保持所需的颗大小,以及使用表面活性剂,可以保持适当的流动性。可以通过各种抗菌和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等,来防止微生物的作用。在许多情况下,优选的组合物包括等渗剂,例如糖、多元醇(如甘露醇、山梨醇)、氯化钠。可以通过在组合物中包括延缓吸收的试剂,例如硬脂酸铝和明胶,来延长可注射组合物的吸收。
可以通过将所需量的活性化合物(例如神经调节蛋白)加入包含上述的一种或多种辅料的适当溶剂中,当要求时,接着过滤灭菌,来制备无菌可注射液。通常,通过将活性化合物加入无菌赋形剂来制备分散体,其中无菌赋形剂包含基本的分散介质和需要的其它上述辅料。在用于制备无菌可注射液的无菌粉末得情况,优选的制备方法为真空干燥和冷干,此方法将先前无菌过滤得到的活性成分加上其它的所需辅料的溶液制成粉末。
口服制剂通常包括惰性稀释剂和可食用载体,可以将它们装入明胶胶囊或压制成片剂。对口服治疗给药来说,活性化合物可以结合于辅药并以片剂、含片或胶囊的形式加以使用。还可以用流体载体来制备口服制剂,用作漱口剂,其中所述液体载体中的化合物被口服使用和发出哗哗声,并且被吐出或咽下。药学上相容的粘合剂,和/或辅助材料可以作为制剂的一部分。片剂、丸剂、胶囊剂、含片等可以包含任何以下辅料,或类似性质的化合物:粘合剂如微晶纤维素、黄蓍树胶或明胶;辅药如淀粉或乳糖;崩解剂如海藻酸、primogel或玉米淀粉;润滑剂如硬脂酸镁或sterotes;助流剂如二氧化硅(胶体);甜味剂如蔗糖和糖精;或调味剂如薄荷、水杨酸甲酯或橙味香料。
为了通过吸入给药,可以以喷雾剂的形式递送化合物,其中喷雾剂来自加压容器或分配器(其含有适宜的推进剂,例如,气体如二氧化碳)或雾化器。
也可以通过粘膜或经皮肤方式进行系统给药。为了经粘膜或经皮肤给药,可以在剂型中使用适合于待渗透屏障的渗透剂。这样的渗透剂在本领域通常是已知的,并且包括,例如用于经粘膜给药的清洁剂、胆盐,以及梭链孢酸衍生物。经粘膜给药可以通过鼻腔喷雾剂或栓剂的使用来完成。如本领域通常所知的,为了经皮肤给药,所述药物组合物可被配制成油膏剂、药膏、凝胶剂或乳膏剂。
在一些实施例中,所述药物组合物被制成缓释或控释制剂。可以使用生物可降解的、生物相容的聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯、以及聚乳酸。用于制备此类剂型的方法对于本领域技术人员而言是显而易见的。这些原料还可以商业上获自,例如,alza公司、nova药物股份有限公司。脂质体悬浮液(包括靶向感染细胞的脂质体,其具有相对于病毒抗原的单克隆抗体)也可以用作药学上可接受的载体。这些脂质体悬浮液可以按照本领域技术人员已知的方法制备。
尤其有利的是,以剂量单位形式配制口服或肠胃外制剂,以便于给药并实现剂量的均勻性。如在本文中所使用的,剂量单位形式是指适合于作为单位剂量的物理上分离的单位,用于待治疗的受试者;每个单位包含预定量的活性化合物,用来连同所需要的药物载体而产生所期望的治疗效果。对本发明的剂量单位形式的技术要求受控于并依赖于活性化合物的独特的特性和要达到的特定的治疗效果、以及在复合这样的用于治疗个体的活性化合物的技术领域中所固有的限制。
可以在细胞培养或实验动物中,通过例如用于确定ld50(导致50%的群体死亡的剂量)和ed50(可有效治疗50%的群体的剂量)的标准制药程序来确定上述化合物的毒性和治疗效力。毒性和治疗效果之间的剂量比率是治疗指数并且它可以表示为比率ld50/ed50。呈现较大治疗指数的化合物是优选的。虽然可以使用呈现毒性副作用的化合物,但应当小心设计这样的递送系统,其将上述化合物靶向受影响组织的部位以将对未感染细胞的潜在损伤降低到最小程度,从而降低副作用。
获自细胞培养测定和动物研究的数据可以用于制定供人类之用的剂量范围。上述化合物的剂量优选在循环浓度的范围内,其中循环浓度包括ed50并具有很小或没有毒性。剂量可以在该范围内变化,其取决于所采用的剂型和所使用的给药途径。对于在本发明的方法中所使用的任何一种化合物,可以最初根据细胞培养测定来估计治疗有效剂量。可以在动物模型中配制一种剂量以达到这样的循环血浆浓度范围,其包括ic50(即,试验化合物的浓度,其达到症状的半最大抑制),如在细胞培养中确定的。上述信息可以用来更精确地确定在人类中的有用剂量。可以将药物组合物与给药说明书包括在容器,包装,或分配器中。
本发明中上述的技术问题也可以进一步通过用于细胞中trpv1脱敏的方法来解决,其中所述方法包括blt2激活的步骤。细胞中blt2激活更可能受到细胞和有效量的blt2激动剂接触的影响。
本文中,“细胞”优选为blt2表达细胞;优选的,其中所述细胞为神经元;优选的,为外周神经元;更优选的,为背根神经节神经元(drg)。
涉及上述方法的一些实施例是活体外或体外方法。
本发明的另一方面涉及一种用于给需要此类治疗的受试者trpv1脱敏的方法,所述方法包括给所述受试者使用有效量的blt2激动剂的步骤。所述脱敏是trpv1介导的感觉的脱敏,这些感觉优选为痒、灼热、味觉或疼痛。
本发明的一些实施例中,所述方法用于治疗和预防受试者疼痛。
优选的方法进一步包括给所述受试者施用治疗有效量的trpv1拮抗剂和/或blt1拮抗剂。
在本发明的背景中,术语“受试者”优选指哺乳动物;更优选的,指人。本发明的受试者可能处于遭受疼痛的危险之中或正在遭受疼痛,其中所述疼痛如上述定义。
本发明所描述的拮抗剂优选自此类化合物,包括抑制性rna、抑制性抗体或其片段、和/或小分子。
在本发明的背景中,优选的,至少一种其它有效疼痛治疗剂如吗啡、阿片类或非阿片类止痛药、或其它止痛药被施用给所述受试者。
本发明的另一方面,提供了一种预防和治疗受试者疼痛的方法,该方法包括给所述受试者施用治疗有效量的根据本发明的lbt2激动剂的步骤。
上述方法中可治疗的疾病在上面已被描述。
治疗和预防过程中,优选的是,至少一种其它有效的疼痛治疗剂如其它止痛药(例如阿片类或非阿片类止痛药)被施用给所述受试者。
本发明的另外一个方面涉及一种用于降低受试者瞬态电压感受器阳离子通道子类v成员1(trpv1)敏感度的方法,包括给所述受试者施用治疗有效量的blt2激动剂。
下面将在有参考附图和序号的例子中进一步描述本发明,但不限于此。为了本发明的目的,这里引用的所有参考资料均已引用的方式结合于全文。在附图中:
图1:ltb4剂量依赖性地敏化drg神经元中的trpv1。(a)drg神经元用辣椒素刺激两次(200nm,每次15秒),并在第二次辣椒素刺激之前,用赋形剂或ltb4孵育2分钟。(b)使用(a)中描述的方案,第一次和第二次辣椒素响应的剂量依赖性差异比。数据代表神经元数(n=20-86)的均值标准差;kruskal-wallis检测方差分析;dunn’s多重比较检验;*p<0.05,****p<0.0001t分布检验。
图2:在外周神经元中,blt1和blt2共同表达。制备一天后的drg神经元的melc分析图像。blt1、blt2、凝集素ib4和cgrp的图像被显示为虚的,白色棒代表xxμm,ib4阳性神经元(n=179)和cgrp阳性神经元(n=111)的百分比表达blt1或blt2。
图3:使用ltb4,blt1介导trpv1敏化,且blt2介导trpv1脱敏。(a)drg神经元用辣椒素刺激两次(200nm,每次15秒),且在第二次辣椒素刺激前,用赋形剂或指定的化合物孵育2分钟。使用blt1拮抗剂(u73502,1μm)或blt2激动剂(cay10583,400nm)预孵育后,ltb4(100nm或1μm)能降低trpv1敏化。然而,blt2拮抗剂(ly2552833,10μm)能增加trpv1敏化。数据代表20-105个细胞的均值标准差;kruskal-wallis检测方差分析;dunn’s多重比较检验;*p<0.05,**p<0.01,****p<0.0001,t分布检验;不显著。
图4:通过ep4和缓激肽激活lbt2来抑制trpv1脱敏。(a)drg神经元用辣椒素刺激两次(200nm,每次15秒),且在第二次辣椒素刺激前,用ep4激动剂onoae329(500nm),或onoae329和cya10583(400nm)孵育2分钟。(b)使用a组中描述的方案,第一次和第二次辣椒素响应的差异比,数据代表下面神经元数的均值标准差:52(赋形剂),109(onoae329),106(onoae329+cya10583);单因素方差分析;dunn’s多重比较检验;**p<0.0096。(c+d)除了500nm的缓激肽被用于trpv1敏化外,其余的均和a+b方案相同,数据代表下面神经元数的均值标准差:33(赋形剂),83(onoae329),93(onoae329+cya10583);单因素方差分析;holm-sidak’s多重比较检验;*p=0,0126。
图5:激活blt2降低小鼠热疼痛阈值。cay10583(10μl,5μm)或赋形剂被爪底注射给药。在指定的时间点热阈值被确定。数据代表6个动物的均值标准差:双向方差分析/bonferroni;*p<0.05,**p<0.005,****p<0.0005。
实施例
材料和方法
动物:
所有的实验动物根据美国国立卫生研究院实验动物指南和使用指南中的建议执行,并由当地的伦理委员会批准用于动物研究(darmstadt)。对于所有的行为实验,发明人使用6-12周龄的雄性c57bl/6n小鼠,其购买于商业育种公司(clarlesriver,sulzfeld,germany,janvier,legeneset-saint-isle,fr)。为了比较机械阈值,发明人使用年龄和性别相匹配的同窝仔畜加以控制。
行为检测:
对机械性异常疼痛或热过敏的测定,小鼠被留宿在高架网格上的测试笼中至少2小时,基线测量被用于热阈值的测定,其通过使用hargreaves装置(ugobasile,comerio,va,italy)检测机械刺激后后爪缩回潜伏期。第一天,小鼠被留宿在热玻璃板上(32℃)的测试笼中至少2小时,然后使用由高强度的投影灯构成的辐射热装置刺激足底中部区域,直到缩回发生。在5-10分钟的时间内,对未注射和注射的爪子交替进行测量。对于所有的行为测试,研究者对小鼠的治疗或基因型是不知情的。10μl的ltb4(5μm),cay10583(5μm)或赋形剂被爪底注射。
初级背根神经节(drg)培养:
小鼠的drgs取自脊髓节段,并直接转移到冰冷的包含cacl2和mgcl2的平衡盐溶液(invitrogen,carsbad,ca,usa)中。接下来,在含有l-谷氨酰胺(2nm)、青霉素(100u/ml)、链霉素(100g/ml)、b-27和庆大霉素(50μg/ml)(都来自于invitrogen,carsbad,ca,usa)的培养基中,分离的drgs在37℃下,被胶原酶/中性蛋白酶(500u/ml胶原酶;2.5u/ml中性蛋白酶)孵育75分钟。除去胶原酶/中性蛋白酶溶液后,细胞用含有10%fcs的培养基清洗两次,在用0.05%胰蛋白酶(invitrogen,carsbad,ca,usa)孵育10分钟。两次清洗的步骤被重复,并使用1mlgilson移液器将细胞进行机械分离。最后,神经元被接种在多聚赖氨酸包被的盖玻片上,并在含有l-谷氨酰胺(2nm)、青霉素(100u/ml)、链霉素(100g/ml)、b-27和庆大霉素(50μg/ml)的培养基中孵育过夜,直至通过钙离子成像评估。
钙离子成像:
钙离子成像实验按照已发布的方法操作。简单的说,使用了leica钙离子成像装置,其包括,配备了dfc360fx(ccd-)相机的leicadmi4000b倒置显微镜、fura-2的过滤器和nplan10x/0.25ph1物镜(所有的均来自于leicamicrosystems,wetzlar,germany)。每2秒成像一次,并用lasaf软件处理。对于每个实验,发明人选择有大量细胞的区域,并同时监测40至110个细胞。钙离子成像实验使用已制备好24至48小时的drg神经元。用5μmfura-2-am-ester和0.02%的pluronicf-127(均来自于biotium,hayward,ca)充满细胞,并在37℃孵育30到60分钟,然后使用外用溶液(包括,单位为mm,nacl[145],cacl2[1.25],mgcl2[1],kcl[5],d-葡萄糖[10],hepes[10]),ph值为7.3)清洗)。基线测量以1-2ml/min的流速在外用溶液中完成。用辣椒素(200nm)刺激神经元,其需要用ltb4(100-1000nm),blt2激动剂cay10583(400nm),blt2拮抗剂ly2552833(10μm),或blt1拮抗剂u75302(1μm)进行2分钟的预处理。
多表位配体图谱(melc):
melc技术已经被描述过(pierre等,2008;pierre,2010)。10μl的ltb4,cay10583或载体被注射入后爪,在指定的时间点杀死动物,水肿爪被放入组织冷冻剂(leicamicrosystemnussloch,germany)中,使用leicacm3050低温恒温器(-20℃,leica,wetzlar,germany)切成10μm厚冷冻切片,并将其放在硅烷包被的盖玻片上。组织被固定在4%多聚甲醛的pbs中,用0.1%triton的pbs透化,并在室温下,用3%bsa的pbs封闭1个小时。样品被放置在一个倒置的宽视场的荧光显微镜(leicadmire2;x63oillensna1.32)的操作台上。使用抗体之前的图片被取得。通过一个自动程序,首先用预定的荧光标记的抗体(补充数据1)将切片孵育15min,再用pbs冲洗。随后,相位对比度和荧光信号通过冷却电荷耦合器件照相机(apogeekx4;apogeeinstruments,roseville,ca,2x分级模式生成1024×1024像素的图像;最后的像素大小为286×286nm2)。为了在加入下一个之前删除抗体的特定信号,漂白步骤被执行,在数据分析过程中,漂白后的图像被记录,并从下面荧光标记的图像中去掉。使用相应的相衬图像,每个抗体产生的荧光图像像素对齐。使用平场校正,图像纠正了照明故障。
数据分析及统计:
所有的数据代表均值标准差。为了确定所有的行为实验的方差分析(anova)有统计学显著性差异,重复测量被使用,随后使用graphpad棱镜进行事后bonferroni校正。对于只有两组的体外实验比较,t分布检验被进行。p<0.05被认为有统计学显著性。
实施例1:ltb4浓度增加降低了ltb4介导的trpv1敏化
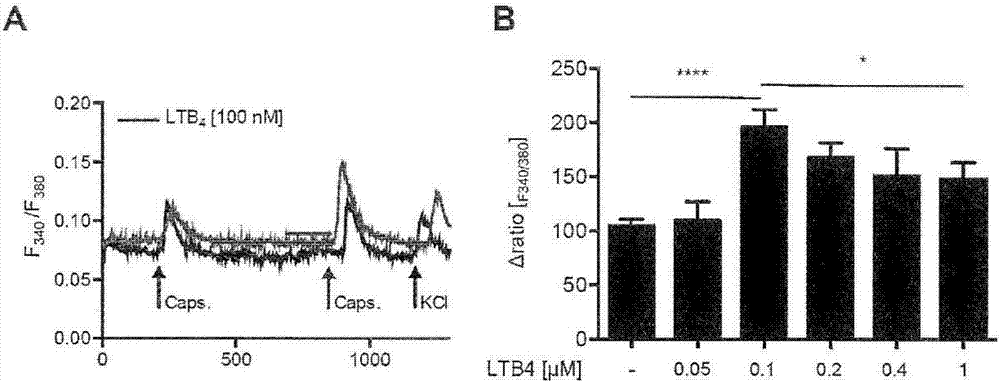
ltb4在高浓度trpv1的条件下被激活已被证明。在这一点上,发明人研究在低浓度下,是否ltb4能敏化trpv1激活。因此,发明人用选择性trpv1激动剂辣椒素刺激小鼠drg神经元的原代培养两次,并在第二次刺激前,用浓度增加的ltb4孵育细胞。发明人发现用100nmltb4预孵育将辣椒素诱导的细胞内钙离子增加一倍(图1a,b)。出乎意料的,当时用高浓度(200-1000nm;图1b)ltb4时,对于ltb4响应的增加被降低。
ltb4诱导trpv1敏化的窄的浓度范围导致我们假定ltb4受体、高亲和力受体blt1和低亲和力受体blt2均对trpv1敏化起到相反的作用。因此,在低浓度(10nm)ltb4下,敏化可能被高亲和力ltb4受体blt1介导。随着ltb4浓度增加,低亲和力ltb4受体blt2可能被激活并降低tpv1敏化。
实施例2:感觉神经元中blt2的表达
下一步,drg神经元中blt1和blt2的表达被确定。使用表明,使用melc系统的连续免疫组织化学显示在小鼠drg神经元中blt1和blt2共存(图2)。blt1和blt2表达神经元是感觉神经元,因为他们也表达降钙素基因相关肽(cgrp)(肽能感觉神经元的标记物)或凝集素b4(ib4)(非肽能感觉神经元的标记物)(图2)。总共约40%的所有ib4和cgrp表达的神经元也表达blt1和blt2。
实施例3:blt2激动剂cay10583消除了ltb4介导的trpv1敏化
为了研究是否blt1介导trpv1敏化,发明人检测了blt1拮抗剂u75302对于ltb4诱导的trpv1敏化。事实上,u75302能消除被100nmltb4介导的trpv1敏化(图3)。然后,发明人研究了blt2拮抗剂ly2552833对于trpv1敏化的作用。按照这个观点,blt2降低了trpv1敏化;ly255833对于被100nmltb4引起的trpv1敏化没有显著效果,但是可以降低被1000nmltb4引起的trpv1敏化(图3).最后,blt2激动剂cay10583本身对于辣椒素诱发的trpv1激活没有影响,但通过100nmltb4消除了trpv1敏化(图3)。
实施例4:blt2激动剂cay10583消除了onoae329和pkc介导的trpv1敏化。
然后,通过已知用于敏化trpv1的受体激活信号通路研究blt2激动剂cay10583对于trpv1敏化的影响。因此,使用pge2受体4(ep4)onoae329敏化trpv1。在这一点上,通过增加camp的合成达到敏化,随后蛋白激酶(pka)激活,且trpv1磷酸化(bhave等,2002)。用onoae329预处理的小鼠drg神经元对响应辣椒素的trpv1诱导了一个强的敏化,这种现象在blt2激动剂cay10583存在时消除了(图4a,b)。同样的,缓激肽介导的透过pkc的trpv1磷酸化和敏化在cay10583存在时显著下降(图4c,d)。
实施例5:blt2激动剂cay10583减少了大鼠的疼痛感
为了研究blt2激活潜在的镇痛效果,blt2激动剂cay10583或载体被注射到鼠的后爪,然后热疼痛阈值被测量。按照发明人的数据显示体外的trpv1敏化降低了,相比只接收载体的鼠,cay10583能显著提高热疼痛阈值(图5)。参考文献
andoht,kuraishiy(2005)expressionofblt1leukotrienceb4receptoronthedorsalrootganglionneuronsinmice.brainresearchmolecularbrainresearch137:263-266.
bhaveg,zhuw,wangh,brasierdj,oxfordgs,gereaurwt(2002)camp-dependentproteinkinaseregulatesdesensitizationofthecapsaicinreceptor(vr1)bydirectphosphorylation.neuron35:721-731.
hwangsw,choh,kwakj,leesy,kangcj,jungj,chos,minkh,suhyg,kimd,ohu(2000)directactivationofcapsaicinreceptorsbyproductsoflipoxygenases:endogenouscapsaicin-likesubstances.procnatlacadsciusa97:6155-6160.
iizukay,yokomizot,terawakik,kominem,tamakik,shimizut(2005)characterizationofamousesecondleukotrieneb4receptor,mblt2:blt2-dependenterkactivationandcellmigrationofprimarymousekeratinocytes.jbiolchem280:24816-24823.
okubom,yamanakah,kobayashik,fukuokat,daiy,noguchik(2010)expressionofleukotrienereceptorsintheratdorsalrootganglionandtheeffectsonpainbehaviors.molpain6:57.
pierres,maeurerc,costeo,beckerw,schmidtkoa,hollands,wittpothc,geisslingerg,scholichk(2008)toponomicsanalysisoffunctionalinteractionsoftheubiquitinligasepam(proteinassociatedwithmyc)duringspinalnociceptiveprocessing.molcellproteomics7:2475-2485.
pierres,andscholich,k.(2010)toponomics:studyingprotein-proteininteractionsandproteinnetworksinintacttissue.molecularbiosystems6:641-647.
scholichk,geisslingerg(2006)ismpges-1apromisingtargetforpaintherapy?trendspharmacolsci27:399-401.
sisignanom,parkck,angionic,zhangdd,vonhehnc,cobosej,ghasemloun,xuzz,kumarranv,lur,granta,fischermj,schmidtkoa,reehp,jirr,woolfcj,geisslingerg,scholichk,brenneisc(2012)5,6-eetisreleaseduponneurronalactivityandinducesmechanicalpainhypersensitivityviatrpv1oncentralafferenttermibals.jneurosci32:6364-6372.
yokomizot,izumit,changk,takuway,shimizut(1997)ag-protein-coupledreceptorforleukotrieneb4thatmediateschemotaxis.nature387:620-624.
yokomizot,katok,terawakik,lzumit,shimizut(2000)asecondleukotrieneb(4)receptor,blt2.anewtherapeutictargetininflammationandimmunologicaldisorders.jexpmed192:421-432.
- 还没有人留言评论。精彩留言会获得点赞!