黄体酮缓释微球及纳米粒、其制备方法和黄体酮缓释注射剂与流程
本发明涉及制药技术领域,尤其涉及一种黄体酮缓释微球及其制备方法、黄体酮缓释纳米粒及其制备方法和黄体酮缓释注射剂。
背景技术:
习惯性流产指的是连续发生≥3次的自然流产,其发病诱因尚不完全明确,给病人心理带来巨大的伤害。复发性流产发病诱因繁多,并较为复杂,其主要有免疫因素、遗传以及内分泌紊乱等,因此给临床治疗带来一定的难度。根据相关实践研究表明,患有这种疾病的病人身体当中的黄体功能不全的为24%-68%。对于黄体缺陷的发生,研究者多认为是由于绝大多数试管婴儿周期中使用促性腺激素释放激素激动剂(gonadotropin-releasinghormoneagonist,gnrha)进行降调节,gnrha引起垂体抑制,使得垂体功能恢复相对推迟,导致妊娠早期黄体功能缺陷。临床应用试管婴儿等人工助孕技术30多年以来,黄体期药物支持治疗逐渐被公认为是有利于妊娠结局的一种干预手段。
黄体酮(progesterone,可简称prg),又名孕酮,为白色或微黄色结晶粉末,熔点127~131℃,无臭,在空气中稳定,有右旋光性,不溶于水,溶于乙醇、乙醚、氯仿、丙酮、二氧六环和浓硫酸。黄体酮的化学名称为:孕甾-4-烯-3,20-二酮,分子式:c21h30o2,分子量:314.47,结构式如下:
黄体酮能够使增值期内膜转化成为分泌期内膜,为受精卵植入、着床以及初期胚胎的营养支持提供便利条件。孕酮可以使细胞当中钠离子浓度明显升高,使肌纤维兴奋性明显下降,以及使肌纤维明显松弛,进而使宫缩明显减少,最终使胚胎在子宫当中继续进行生长发育;黄体激素对妊娠的积极作用主要体现在诱导子宫内膜向分泌期转变,增加内膜容受性以利于受精卵着床,以及作用于子宫局部,经一氧化氮等因子促使血管及平滑肌舒张而抑制宫缩。
临床上黄体酮应用剂型主要有口服胶囊、凝胶栓剂、肌注油溶制剂等,其中,黄体酮口服制剂给药方便快捷,患者易于接受,但是口服黄体酮会在胃肠道及肝脏迅速破坏,难以起到补充和治疗作用。由于黄体酮溶解度极低,且首过效应严重,口服生物利用度仅为10%。口服制剂往往通过增加表面活性剂浓度来提高黄体酮溶解度,不能从根本上解决黄体酮首过效应强、生物利用度低的问题;每天的给药剂量仍需很大才能达到疗效,导致副作用较大。因此,临床上普遍使用油溶液肌注,价格也相对低廉。
但是,现有的黄体酮注射剂为油溶液注射剂,需每天注射,长期注射(约12周)。油溶液注射时极易引起患者不适,如疼痛、局部红肿、过敏等症状,个别病理报道甚至指出肌肉注射黄体酮可诱发急性嗜酸性粒细胞肺炎。且油剂黄体酮半衰期长,通常要数周时间才能恢复。长期高频次注射也会导致注射部位产生硬结等其他症状,不利于注射部位组织健康。患者均为孕妇,每天注射黄体酮极为不便,且黄体酮注射存在油溶剂易引起肌肉板结、疼痛等问题。
技术实现要素:
有鉴于此,本申请提供一种黄体酮缓释微球及其制备方法、黄体酮缓释纳米粒及其制备方法和黄体酮缓释注射剂,本发明提供的黄体酮缓释微球和纳米粒可用作肌肉注射剂,载药量高,体内外持续释放时间长,且注射刺激性小,患者顺应性好。
本发明提供一种黄体酮缓释微球,其由包括黄体酮和第一聚合物材料的物料制成,所述第一聚合物材料选自聚乳酸-羟基乙酸共聚物、聚乳酸、聚己内酯和聚乙醇酸中的一种或多种;所述第一聚合物材料的分子量为4000~40000道尔顿;所述黄体酮占缓释微球总质量的30%~40%;
所述黄体酮缓释微球的粒径为10~20μm。
本发明提供一种黄体酮缓释纳米粒,其由包括黄体酮和第二聚合物材料的物料制成,所述第二聚合物材料选自聚乳酸-羟基乙酸共聚物、聚乳酸、聚己内酯和聚乙醇酸中的一种或多种;所述第二聚合物材料的分子量为6000~60000道尔顿;所述黄体酮占缓释纳米粒总质量的10%~20%;
所述黄体酮缓释纳米粒的粒径为100~400nm。
为解决黄体酮临床应用剂型上的不足,本发明人经大量研究发明了可用于肌肉注射的黄体酮控释微球及纳米粒,药物包埋于生物可降解、组织相容性良好的聚合物内,体内外均可持续缓释一周以上,安全性较强,刺激性小,提高患者顺应性。
为实现上述目的,本发明提供了如下多种实施方案。
在一实施方案中,本发明的注射黄体酮控释微球包含黄体酮,以及生物可降解的药用高分子材料聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)、聚己内酯(pcl)和聚乙醇酸(pga)中的一种或多种,优选为plga,其在环保性和注射应用性等方面的效果最佳。考虑材料的降解周期,本发明首选降解时间短的聚合物材料plga,可使长效注射剂给药周期为一周一次。为便于区分,将微球中聚合物材料称为第一聚合物材料。
其中,黄体酮与第一聚合物材料投料重量比可为1:1.5-2;黄体酮占微球总重30-40%。在本发明中,所述第一聚合物材料的分子量为4000~40000道尔顿;具体地,所述聚乳酸-羟基乙酸共聚物的分子量可为10000-40000道尔顿;聚乳酸的分子量可为10000-20000道尔顿;聚己内酯的分子量可为4000-40000道尔顿;聚乙醇酸的分子量可为8000-20000道尔顿。在本发明的一些实施例中,所述聚乳酸-羟基乙酸共聚物的分子量为12000-30000道尔顿。
在本发明中,所述第一聚合物材料的封端方式可为羧基封端、酯封端和羟基封端中的一种或多种;具体地,所述plga为羧基封端、酯封端或羟基封端;所述pcl为羧基封端、酯封端或羟基封端;所述pla为羧基封端、酯封端或羟基封端。
在本发明的优选实施例中,所述聚乳酸-羟基乙酸共聚物中乳酸和羟基乙酸的摩尔比为(50~85):(15~50)。所述plga的乳酸和羟基乙酸的摩尔比优选为50:50、75:25或85:15,更优选为50:50或75:25;分子量为10000-40000道尔顿,一周持续释放药物90%以上。
在一实施方案中,本发明的注射黄体酮控释纳米粒包含黄体酮,以及生物可降解的药用高分子材料plga、pcl、pla、pga等中的一种或多种聚合物材料的混合,优选为plga。在本发明中,黄体酮与第二聚合物材料投料重量比可为1:1.5-2;黄体酮占纳米粒总重10-20%。
在本发明中,所述第二聚合物材料的分子量为6000~60000道尔顿;具体地,所述聚乳酸-羟基乙酸共聚物的分子量可为10000-60000道尔顿;聚乳酸的分子量可为20000-30000道尔顿;聚己内酯的分子量可为6000-50000道尔顿;聚乙醇酸的分子量可为10000-30000道尔顿。在本发明的一些实施例中,所述聚乳酸-羟基乙酸共聚物的分子量为10000-40000道尔顿。
在本发明中,所述第二聚合物材料的封端方式可为羧基封端、酯封端和羟基封端中的一种或多种;具体地,所述plga为羧基封端、酯封端或羟基封端;所述pcl为羧基封端、酯封端或羟基封端;所述pla为羧基封端、酯封端或羟基封端。
在本发明的优选实施例中,所述聚乳酸-羟基乙酸共聚物中乳酸和羟基乙酸的摩尔比为(50~85):(15~50)。所述plga的乳酸和羟基乙酸的摩尔比优选为50:50、75:25或85:15;分子量为10000-40000道尔顿,一周持续释放药物90%以上。
在上述实施方案中,本发明的注射用黄体酮控释微球中,所述plga的乳酸和羟基乙酸摩尔比具体可为50:50、75:25。在上述实施方案中,本发明的注射用黄体酮控释纳米粒中,所述plga的乳酸和羟基乙酸摩尔比可为85:15、75:25。
在上述实施方案中,本发明的注射用黄体酮控释微球的载药量可为30%-40%,优选为32%-40%;所述纳米粒载药量为10%-20%。在本发明的实施例中,所述的黄体酮缓释微球的比表面积为440~500m2/kg。
在上述实施方案中,本发明的注射用黄体酮控释微球的粒径控制在5-20μm范围内,优选10μm-20μm,更优选11-15μm;所述纳米粒粒径控制在100nm-400nm,优选200-300nm。
本发明提供一种黄体酮缓释微球的制备方法,包括以下步骤:
1)将黄体酮和第一聚合物材料溶于有机溶剂中,形成有机相;所述第一聚合物材料选自聚乳酸-羟基乙酸共聚物、聚乳酸、聚己内酯和聚乙醇酸中的一种或多种;所述第一聚合物材料的分子量为4000~40000道尔顿;2)将步骤1)得到的有机相倒入含乳化剂的水溶液中,经高速剪切乳化,得到水包油型乳液;3)将步骤2)得到的水包油型乳液用水稀释后,进行减压蒸馏,得到微球混悬液;4)将步骤3)得到的微球混悬液用水洗涤后,经固液分离,得到黄体酮缓释微球。
为实现上述目的,本发明一些实施例提供的黄体酮微球的制备的技术方案包括如下步骤:
(1)将黄体酮和聚合物材料如plga溶于一定量的有机溶剂中,形成有机相;(2)将步骤(1)中的有机相迅速倒入聚乙烯醇溶液中,经高速剪切乳化,得到o/w乳液;(3)将步骤(2)中的乳液用五倍体积蒸馏水稀释后,减压蒸馏除去有机溶剂而固化微球;(4)将步骤(3)所得微球混悬液用去离子水反复洗涤多次,除去多余的聚乙烯醇,离心收集,经冷冻干燥,即得黄体酮-plga微球等黄体酮缓释微球。
本发明实施例称取第一聚合物材料和黄体酮,溶解于有机溶剂中形成有机相。其中,所述第一聚合物材料的内容如前所述,在此不再一一赘述。此外,本发明对黄体酮的晶型没有特殊限制。在本发明中,黄体酮与第一聚合物材料投料重量比可为1:1.5-2。
在本发明中,所述有机溶剂如醇类、烃类、酯类等。本发明优选采用二氯甲烷(dcm)作为有机溶剂,其对黄体酮和plga等的溶解度高,且沸点低,易挥发除去。在本发明的一些实施例中,所述有机溶剂为二氯甲烷和苯甲醇的混合溶液;具体地,dcm和苯甲醇的体积比可为9:1、8:2、7:3。本发明实施例利用苯甲醇在有机相和水相均有一定亲和力,调节药物在微球中的扩散速率,从而改变药物在微球内的分布而影响释放情况。
本发明实施例将得到的有机相迅速倒入含乳化剂的水溶液中,高速剪切形成o/w乳液。其中,所述乳化剂优选为聚乙烯醇(pva),即本发明优选以含聚乙烯醇的水溶液作为水相。在本发明的一些实施例中,聚乙烯醇水溶液的质量浓度可为0.5%-2%,优选为1~1.5%,最优选为1%。所述有机相与水相体积比可为1:15~20,优选为1:16.6。
在本发明中,通过高速剪切进行乳化,得到水包油型乳液。所述高速剪切的转速优选为10000~14000rpm;剪切时间优选为1~2min。
乳化得到o/w乳液后,本发明实施例可用其5倍体积水稀释,然后减压蒸馏,挥发有机溶剂、固化微球,得到微球混悬液。其中,所述减压蒸馏的温度可为40~50℃;时间可为15min。
本发明实施例将得到的微球混悬液用水洗涤,去除多余的乳化剂pva等,然后离心收集微球,经冷冻干燥等本领域常规的固液分离方式,得到黄体酮缓释微球。
本发明还提供一种黄体酮缓释纳米粒的制备方法,包括以下步骤:
1)将黄体酮和第二聚合物材料溶于有机溶剂中,形成有机相;所述第二聚合物材料选自聚乳酸-羟基乙酸共聚物、聚乳酸、聚己内酯和聚乙醇酸中的一种或多种;所述第二聚合物材料的分子量为6000~60000道尔顿;2)将步骤1)得到的有机相倒入含乳化剂的水溶液中,经高速剪切乳化,得到水包油型初乳液;将所述水包油型初乳液进行高压匀质,得到终乳液;3)将步骤2)得到的终乳液用水稀释后,通过低温固化,得到微粒混悬液;4)将步骤3)得到的微粒混悬液用水洗涤后,经固液分离,得到黄体酮缓释纳米粒。
为实现上述目的,本发明另一些实施例提供的黄体酮纳米粒的制备的技术方案包括如下步骤:
(1)将黄体酮和聚合物材料溶于处方量的乙酸乙酯和苯甲醇中,形成有机相;(2)将步骤(1)中的有机相迅速倒入含有乳化剂的水溶液中经高速剪切乳化,得到o/w初乳,初乳经高压匀质机进一步降低粒径,得到终乳;(3)将步骤(2)所得终乳用冷水稀释,冰浴下搅拌3-4h固化微粒,得到微粒混悬液;(4)将步骤(3)所得微粒混悬液加入冷水,过空心膜组件除去有机溶剂,干燥后得到黄体酮缓释纳米粒。
此外,本发明可将除去有机溶剂的物质分装在西林瓶中,加入适合的冻干保护剂进行冷冻干燥(冻干),即得黄体酮缓释冻干粉针。
本发明称取第二聚合物材料和黄体酮,加入有机溶剂中溶解,作为有机相。其中,所述第二聚合物材料的内容如前所述,在此不再一一赘述。此外,本发明对黄体酮的晶型没有特殊限制。在本发明中,黄体酮与第二聚合物材料投料重量比可为1:1.5-2。
在上述本发明的纳米粒制备方法中,所述有机溶剂如醇类、烃类、酯类等。在本发明的一些实施例中,所述有机溶剂为乙酸乙酯和苯甲醇的混合溶液;具体地,乙酸乙酯和苯甲醇的体积比可为4:1。本发明优选采用乙酸乙酯和苯甲醇混合溶剂,将聚合物材料和黄体酮于30~40℃水浴搅拌,溶解后得到有机相。
在制备纳米粒的过程中,本发明实施例将得到的有机相迅速倒入含乳化剂的水溶液中,高速剪切形成o/w初乳液;将所述初乳液进行高压匀质,得到终乳液。其中,所用的乳化剂优选为泊洛沙姆188;还可采用苯甲醇作为助乳化剂。泊洛沙姆(poloxamer)为聚氧乙烯聚氧丙烯醚嵌段共聚物,商品名为普兰尼克(pluronic),属于高分子非离子表面活性剂。泊洛沙姆188也称f68,是一种水包油乳化剂。在本发明的一些实施例中,泊洛沙姆188在水相中的质量浓度为2%-5%;苯甲醇在水相中的质量浓度为1%-5%。此外,所述含乳化剂的水溶液中还可包含乙酸乙酯等,共同作为水相。具体地,所述油水相体积比可为1:8。
在本发明的一些实施例中,所述高速剪切的转速可为10000rpm;剪切时间可为5min。在本发明的一些实施例中,所述高压匀质的压力可为600bar;匀质次数为5-7次。
得到终乳后,本发明实施例用冷水稀释,通过冰浴下搅拌的低温固化方式,固化微粒得到微粒混悬液;再加入冷水过空心膜组件,除去有机溶剂,干燥即得黄体酮缓释纳米粒。所述干燥可采用冷冻干燥,具体的,冻干工艺可包括:-40℃预冻四小时,抽真空,-40℃维持两个小时,两个小时升至-20℃维持三个小时,一个小时升至-10℃维持两个小时,两个小时升至0℃维持两个小时,两个小时升至20℃维持两个小时。
或者,将除去有机溶剂的物质加入冻干保护剂,经冻干,得到冻干粉针。所述的冻干保护剂可选自乳糖、麦芽糖、葡萄糖、海藻糖、丙三醇、甘露醇、山梨醇、氯化钠、磷酸盐、聚乙烯吡咯烷酮(pvp)、羧甲基纤维素钠(cmc-na)、聚乙二醇和白蛋白中的一种或几种,优选为甘露醇。
本发明所述的注射用黄体酮控释微球和黄体酮纳米粒的外形圆整,粒度分布均匀,载药量和包封率高,体内外持续释放一周以上,累计释放90%以上,且释放均一稳定,可较长时间维持有效血药浓度,给药一次可维持一周治疗之久,注射刺激性小,患者顺应性好。
本发明的黄体酮长效制剂技术上分别采用乳化-溶剂挥发法制备黄体酮微球和纳米乳化法制备黄体酮纳米粒,分别在微米和纳米级别实现药物的控释。采用生物可降解高分子材料包裹药物制成注射用微球制剂给药后,药物通过在微球内的扩散和聚合物骨架的溶蚀控制释放,达到长效平稳缓释的目的。但微球粒径较大,注射给药时会产生一定刺激性(刺激性并不明显),因此开发了黄体酮纳米制剂。纳米粒相对于微球而言,能够更快的达到所需血药浓度,且释放更平稳。纳米粒注射刺激性小,但载药量相对微球低一些。
实验表明两种制剂在体内均可维持有效血药浓度,达到一周及以上的缓释效果,因而可以提高患者的依从性,提高疗效。
本发明还提供一种黄体酮缓释注射剂,其包括黄体酮颗粒和注射用溶剂;所述黄体酮颗粒为上文所述的黄体酮缓释微球或黄体酮缓释纳米粒。
本发明提供的黄体酮缓释注射剂为微球型或纳米粒黄体酮长效制剂,该长效制剂包括黄体酮及生物可降解聚合物plga(乙交酯丙交酯共聚物)、pla(聚乳酸)、pcl(聚己内酯)、pga(聚乙醇酸)等;工艺方面分别采用乳化-溶剂挥发法制备黄体酮微球和纳米乳化法制备黄体酮纳米粒。
本发明提供的黄体酮缓释注射剂采用肌肉注射,附有注射用溶剂。在本发明中,注射用溶剂可以使药物悬浮,从而使给药均匀、顺利。所述注射用溶剂即常规的注射用微球复溶剂,可包括注射用水、ph值调节剂、渗透压调节剂和稳定剂,如包含羧甲基纤维素钠(cmc-na)、甘露醇中的一种或其混合物。在本发明的具体实施例中,所述注射用溶剂的成分包括无水柠檬酸、无水磷酸氢二钠、聚山梨酯20、cmc-na、氯化钠以及注射用水。
本发明通过粒径、载药量、包封率、体外释放、体内药动学等对黄体酮长效注射剂进行表征,结果显示,本发明所制备微球粒径在5-20μm范围内,载药量30%-40%,包封率在90%以上;纳米粒粒径在100-400nm范围内,载药量可达到10%-20%,包封率在80%-90%。采用37℃水浴摇床法进行体外释放度测定,体内外相关性良好,达到了一周以上的缓释效果。
根据研究人员进行的临床调查,目前临床上治疗习惯性流产和辅助生殖剂量为肌注20mg/day和60mg/day。而本发明制剂设计剂量为140mg/周,140mg/支(以黄体酮计),一周给药一次。在给药剂量和频率上均少于临床普通制剂,而本品在后续药动和药效学学研究结果显示,本品生物利用度和治疗效果与市售制剂相当;而给药剂量和频率的减少可降低副作用的发生率,提高患者依从性。
附图说明
图1为本发明实施例黄体酮微球缓释制剂与现有产品的血药浓度曲线图;
图2为本发明实施例黄体酮纳米粒缓释制剂与现有产品的血药浓度曲线图;
图3为本发明实施例制备的黄体酮微球的显微镜图像(10×10);
图4为本发明实施例制备的黄体酮微球的扫描电镜图(sem);
图5为实施例1制备出的黄体酮缓释微球的粒度测定结果;
图6为实施例12制备出的黄体酮纳米粒的粒度测定结果;
图7为实施例2-4制备出的黄体酮缓释微球的体外释放曲线;
图8为实施例16-18制备出的黄体酮纳米粒的体外释放曲线。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为了进一步理解本申请,下面结合实施例对本申请提供的黄体酮缓释微球及其制备方法、纳米粒及其制备方法和黄体酮缓释注射剂进行具体地描述。
以下实施例中,所用的黄体酮为晶型ⅱ、厂家:湖北葛店人福药业有限责任公司,批号:htt151102。
实施例1黄体酮微球的制备
称取150mgplga(50/50(乳酸和羟基乙酸的摩尔比例),分子量13000道尔顿,以下实施例表示同实施例1),75mg黄体酮,溶于1.5ml二氯甲烷中形成有机相。将有机相迅速倒入25ml、1%pva(日本可乐丽)溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍体积水稀释后,40℃减压蒸馏15min,挥发有机溶剂固化微球。将固化微球用去离子水洗涤多余pva后,离心收集微球,冷冻干燥,即得肌肉注射用黄体酮控释微球。
其中,冷冻干燥工艺包括:-40℃预冻四小时,抽真空,-40℃维持两个小时,两个小时升至-20℃维持三个小时,一个小时升至-10℃维持两个小时,两个小时升至0℃维持两个小时,两个小时升至20℃维持两个小时。
实施例1中的处方及相关工艺参见表1:
表1实施例1中的处方及相关工艺参数
实施例2-4不同分子量plga制备微球
称取150mgplga(50/50),分子量分别为13000、25000、30000道尔顿;75mg黄体酮,溶于1.5ml二氯甲烷中形成有机相。将有机相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍体积水稀释后,40℃减压蒸馏15min,挥发有机溶剂固化微球。将固化微球用去离子水洗涤多余pva后,离心收集微球,冷冻干燥,即得肌肉注射用黄体酮控释微球。实施例2-4中的处方参见表2:
表2实施例2-4中的处方
实施例5-7不同理论载药量微球制备
称取150mgplga(50/50;13000),黄体酮称量分别为75mg、90mg、100mg,溶于1.5ml二氯甲烷中形成有机相。将有机相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍体积水稀释后,40℃减压蒸馏15min,挥发有机溶剂固化微球。将固化微球用去离子水洗涤多余pva后,离心收集微球,冷冻干燥,即得肌肉注射用黄体酮控释微球。实施例5-7制备出的黄体酮微球的理论载药量参见表3:
表3实施例5-7制备出的黄体酮微球的理论载药量
实施例8-11不同有机相微球制备
称取150mgplga(50/50;13000),黄体酮75mg,按处方各比例有机溶剂溶解形成有机相。将有机相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍体积水稀释后,40℃减压蒸馏15min,挥发有机溶剂固化微球。将固化微球用去离子水洗涤多余pva后,离心收集微球,冷冻干燥,即得肌肉注射用黄体酮控释微球。实施例8-11中的处方参见表4:
表4实施例8-11中的处方
黄体酮和plga在二氯甲烷极易溶解,且二氯甲烷沸点低,易挥发除去,故本发明首选二氯甲烷作为有机溶剂。苯甲醇在有机相和水相均有一定亲和力,可调节药物在微球中的扩散速率,从而改变药物在微球内的分布,从而影响释放情况。苯甲醇加入量不同,微球突释量有差异,考虑影响了药物在微球中的分布。
实施例12黄体酮纳米粒的制备
以处方量称取plga(20000;50/50)和黄体酮,加入乙酸乙酯和苯甲醇混合溶剂中,于35℃水浴搅拌溶解后作为有机相。将f68作为乳化剂溶于水溶液,再加入处方量的苯甲醇以及乙酸乙酯于35℃加热搅拌均匀后作为水相。在剪切条件下将有机相加入到水相中,得到初乳后,经过高压均质后,加冷水淬火(温度控制在<5℃),搅拌固化3-4h,加入冷水经过中空纤维膜组件除去有机溶剂,离心过滤后,得黄体酮纳米粒;再加入f68冻干后,得黄体酮冻干粉针。
其中,冷冻干燥工艺包括:-40℃预冻四小时,抽真空,-40℃维持两个小时,两个小时升至-20℃维持三个小时,一个小时升至-10℃维持两个小时,两个小时升至0℃维持两个小时,两个小时升至20℃维持两个小时。
实施例12中的处方及相关工艺参见表5:
表5实施例12中的处方及相关工艺参数
实施例13-15不同乳化剂浓度制备黄体酮纳米粒
以处方量称取plga(20000;50/50)和黄体酮,加入乙酸乙酯和苯甲醇混合溶剂中,于35℃水浴搅拌溶解后作为有机相。将f68作为乳化剂溶于水溶液,再加入处方量的苯甲醇以及乙酸乙酯于35℃加热搅拌均匀后作为水相。在剪切条件下将有机相加入到水相中,得到初乳后,经过高压均质后,加冷水淬火(温度控制在<5℃),搅拌固化3-4h,加入冷水经过中空纤维膜组件除去有机溶剂,离心过滤后,得黄体酮纳米粒;再加入甘露醇冻干后,得黄体酮冻干粉针。实施例13-15中的处方及相关工艺参见表6:
表6实施例13-15中的处方及相关工艺参数
本发明实施例中乳化剂浓度主要影响纳米粒的粒径及粒径分布,乳化剂浓度越高,粒径越小,分布越窄,但有极限值。
实施例16-18不同聚合物材料制备黄体酮纳米粒
以处方量分别称取plga、pla、pcl(分子量均为20000,各材料均为羧基端)和黄体酮,加入乙酸乙酯和苯甲醇混合溶剂中,于35℃水浴搅拌溶解后作为有机相。将f68作为乳化剂溶于水溶液,再加入处方量的苯甲醇以及乙酸乙酯于35℃加热搅拌均匀后作为水相。在剪切条件下将有机相加入到水相中,得到初乳后,经过高压均质后,加冷水淬火(温度控制在<5℃),搅拌固化3-4h,加入冷水经过中空纤维膜组件除去有机溶剂,离心过滤后,得黄体酮纳米粒;再加入甘露醇冻干后,得黄体酮冻干粉针。实施例16-18中的处方及相关工艺参见表7:
表7实施例16-18中的处方及相关工艺参数
实施例19-21不同工艺参数制备黄体酮纳米粒
以处方量分别称取plga、pla、pcl(分子量均为20000,各材料均为羧基端)和黄体酮,加入乙酸乙酯和苯甲醇混合溶剂中,于35℃水浴搅拌溶解后作为有机相。将f68作为乳化剂溶于水溶液,再加入处方量的苯甲醇以及乙酸乙酯于35℃加热搅拌均匀后作为水相。在剪切条件下将有机相加入到水相中,得到初乳后,经过高压均质后,加冷水淬火(温度控制在<5℃),搅拌固化3-4h,加入冷水经过中空纤维膜组件除去有机溶剂,离心过滤后,得黄体酮纳米粒;再加入甘露醇冻干后,得黄体酮冻干粉针。实施例19-21中的处方及相关工艺参见表8:
表8实施例19-21中的处方及相关工艺参数
本发明实施例中工艺参数主要是高压均质的压力及均值次数,其影响纳米粒的粒径及粒径分布;均质压力越大、次数越多,粒径越小、分布越窄,但压力过大或次数过多则会影响稳定性。
实施例22本发明的黄体酮长效制剂的药物动力学分析
1、根据实施例1方法所制备的2.52mg(以黄体酮计)的黄体酮微球,对sd大鼠(体重大约200g)的后腿股二头肌进行肌肉注射,并以市售的黄体酮注射液(厂家:浙江仙琚制药股份有限公司,批号:h33020828)为对照试验。本发明缓释制剂中的注射用溶剂即常规的注射用微球复溶剂,成分包括无水柠檬酸、无水磷酸氢二钠、聚山梨酯20、cmc-na、氯化钠以及注射用水(本注射用溶剂成分参考市售利培酮(恒德)说明书)。
对受试大鼠定期眼后静脉丛取血,通过建立lc-ms法测定血浆中黄体酮的药物浓度。给药0-180h的血药浓度参见图1,图1为本发明实施例黄体酮微球缓释制剂与现有产品的血药浓度曲线图。从图1药动力学试验结果可以看出,本发明长效注射剂大鼠体内突释量低于黄体酮注射剂,血药浓度较平稳,未有明显波动,可达到一周以上的缓释效果。
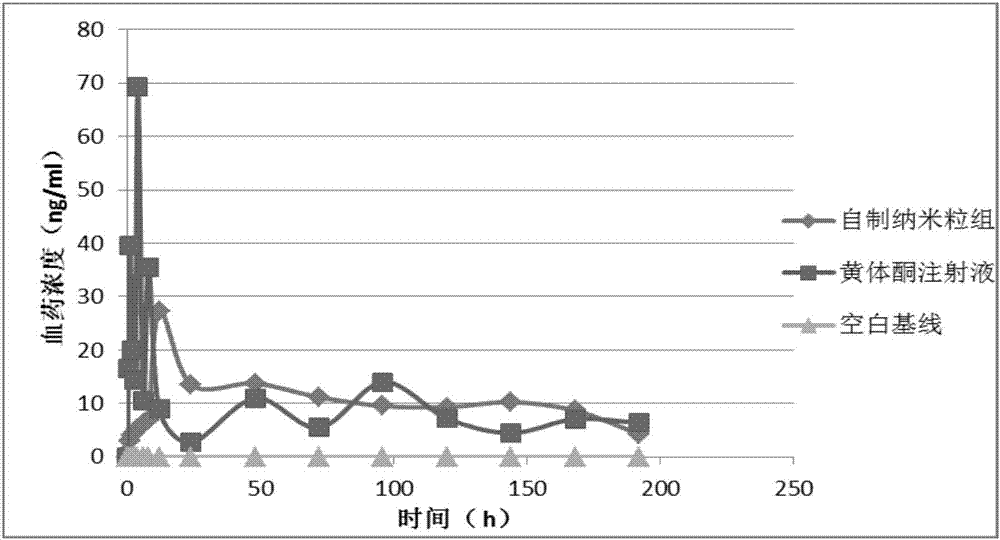
2、根据实施例12方法所制备的2.52mg(以黄体酮计)的黄体酮纳米粒,对sd大鼠(体重大约200g)的后腿股二头肌进行肌肉注射,并以市售的黄体酮注射液(1ml:20mg)为对照试验。本发明缓释制剂中的注射用溶剂即注射用微球复溶剂,成分包括无水柠檬酸、无水磷酸氢二钠、聚山梨酯20、cmc-na、氯化钠以及注射用水。
对受试大鼠定期眼后静脉丛取血,通过建立lc-ms法测定血浆中黄体酮的药物浓度。给药0-180h的血药浓度参见图2,图2为本发明实施例黄体酮纳米粒缓释制剂与现有产品的血药浓度曲线图。
通过对上述两种工艺制备的黄体酮长效制剂进行药动学比较,纳米乳化法制备长效注射剂可迅速达到所需血药浓度,释放曲线更加平稳。微球型长效制剂虽较晚达峰,释放亦平稳,且载药量高,注射体积小。
实施例23黄体酮长效制剂特性测试
1、外观检测。将上述实施例1制备出的黄体酮微球分别于光学显微镜和扫描电镜下观察,结果参见图3和图4,图3为本发明实施例制备的黄体酮微球的显微镜图像(10×10),图4为本发明实施例制备的黄体酮微球的扫描电镜图(sem)。从以上结果可见,本发明制备出的微球呈规则圆形。
2、粒径和粒径分布
将上述实施例1制备出的黄体酮-plga微球用蒸馏水及0.1%cmc-na配成混悬液,应用百特激光粒度仪进行粒度测定。实施例1制备出的黄体酮缓释微球的粒度测定结果见图5和表9,图5为实施例1制备出的黄体酮缓释微球的粒度测定结果。由以上结果可知,微球d50为11.42μm,span1.623,粒径分布较均一。
表9实施例1制备出的黄体酮缓释微球的粒度测定数据
取一定量上述实施例12中的黄体酮纳米粒,稀释至一定浓度,应用nicomp380粒度测定仪进行粒度测定。实施例12制备出的黄体酮纳米粒的粒度测定结果见图6和表10,图6为实施例12制备出的黄体酮纳米粒的粒度测定结果。由以上结果可知,平均径:175.4nm;pi0.059(pi<0.1),呈均一正态分布。
表10实施例12制备出的黄体酮纳米粒的粒度测定数据
3、载药量和包封率。精密量取上述实施例制备出的黄体酮长效制剂10mg置25ml容量瓶中,加入1ml乙腈振荡溶解,用乙腈定容置刻度,混匀,用0.45μm微孔滤膜过滤即可。用hplc法测定载药量和包封率,计算公式如下,结果为:载药量为36%,包封率为90%。
实施例24释放行为
关于体外释放度方法的建立,本发明考虑体内外相关性,采用37度、100rpm/min水浴摇床法测定体外释放。释放介质采用0.5%sds溶液以满足漏槽条件。取样时,2500rpm离心10min,取上清液进样分析,弃去9ml介质,更换新鲜介质。
实施例2、3、4的对比测定结果参见图7,图7为实施例2-4制备出的黄体酮缓释微球的体外释放曲线。
从图7可以看出,实施例2的微球在开始的24h内黄体酮释放了21.20%,在之后的时间内缓慢释放,在一周时间内累积释放量为92.13%;实施例3的微球在开始的24h内黄体酮释放了15.96%,在之后的时间内缓慢释放,在一周时间内累积释放量为80.65%;实施例4的微球在开始的24h内黄体酮释放了10.58%,在之后的时间内缓慢释放,在一周时间内累积释放量为65.90%。
实施例2、实施例3、实施例4的微球所用plga分子量在10000-30000间,在释放过程中没有突释现象,可连续释放一周。其他实施例具有如实施例2、实施例3、实施例4相似的释放特性;分子量越大的plga所制备的微球释放速度越慢。
实施例16、17、18的对比测定结果参见图8,图8为实施例16-18制备出的黄体酮纳米粒的体外释放曲线。
从图8可以看出,实施例16的纳米粒在开始的24h内黄体酮释放了23.43%,在之后的时间内缓慢释放,在一周时间内累积释放量为90.21%;实施例17的纳米粒在开始的24h内黄体酮释放了18.33%,在之后的时间内缓慢释放,在一周时间内累积释放量为69.30%;实施例18的纳米粒在开始的24h内黄体酮释放了14.08%,在之后的时间内缓慢释放,在一周时间内累积释放量为51.00%。
实施例16、实施例17、实施例18的纳米粒所用聚合物材料为plga(75:25;25000)、pla(10000),pcl(10000)。聚合物材料不同,降解特点不同,均可连续释放一周;材料降解速率为plga>pla>pcl。
综上所述,本发明的黄体酮长效注射剂可在一周内释放完,且释放过程平稳,无明显突释现象,保证了临床上一周给药一次的治疗方案。
- 还没有人留言评论。精彩留言会获得点赞!