药物微球动脉栓塞剂的药代动力模型及检测方法与流程
本发明涉及药物微球栓塞于动脉后药代动力学领域,具体涉及一种含药微球栓塞剂动脉栓塞后局部药物释放的药物代谢模型和检测方法。
背景技术:
介入治疗技术是目前医学治疗肿瘤、结核、咯血及血管性疾病的前沿医学手段,其中利用含药微球的介入治疗在肿瘤、结核的治疗上取得了明显的疗效,越来越得到临床的重视。其原理是:在透视引导下通过将微导管经外周血管送至目标病变组织血管中,然后将药物微球栓塞剂注入病变组织中,实现一方面阻断病变组织血运,另一方面利用微球所携带药物给病变组织带来针对性的治疗,实现控制病变组织进一步生长的目的。例如,海藻酸钠微球血管栓塞剂是一种天然、可降解的新型血管栓塞剂,已用于咯血、肝癌、脾功能亢进、动脉瘤、子宫肌瘤等动脉栓塞临床治疗。采用微囊技术将海藻酸钠微球包裹利福平,制备成一种新型载药微球血管栓塞剂,即利福平海藻酸钠微球栓塞剂(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg),rfp-kmg具有作用靶向性强、药物缓释、保持局部组织内的药物高浓度等优点,在机械栓塞的同时增强了药物生物利用度。
药物微球栓塞治疗后其所载药物如何进入周围组织及其药代动力学一直有较大争议,目前无一种理想的药代动力学模型。含药微球的应用目的是:保证病变组织局部药物的高浓度的同时进行局部栓塞治疗,实现药物和栓塞治疗的双重疗效。若微球不能释放药物,含药微球只能发挥栓塞的功效,若微球过快释放药物入血,则外周血药浓度过高会给人体带来副作用。所以明确微球局部药代动力学是含药微球在临床应用的关键。传统方法是通过动物实验,将药物微球于靶组织动脉栓塞后,然后分时间点测外周血药浓度,以及取样靶组织并匀浆后测组织血药浓度。但这种测量方法存在两个弊端:1.靶组织本身含有血管,组织血管中的血药浓度干扰组织血药浓度的准确性;2.靶组织含有微球栓塞剂,微球栓塞剂本身的药物浓度也会干扰组织的药物浓度的测定。
针对现有技术在药物微球检测方面所面临的困难,本发明提供一种可以准确反映药物微球动脉栓塞的局部组织药物浓度的药代动力学模型和检测方法。
技术实现要素:
本发明提供一种药物微球动脉栓塞的局部组织药物浓度的药代动力学模型和检测方法,能够排除血管内残留药物的干扰,准确检测局部组织内的药物浓度。
具体而言,本发明的技术方案主要是通过以下方式实现的:
本发明提供一种药物微球动脉栓塞的局部组织药物浓度的药代动力学模型,截试验动物的股动脉制成生物膜囊袋,并以药物微球填充形成药物囊袋,将药物囊袋包埋入活体试验动物的肝脏内,考察肝脏局部组织渗透释放特征。
进一步地,试验动物可选用雄性家兔。
进一步地,药物微球可为利福平海藻酸钠微球栓塞剂(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg)…等。
进一步地,采用实验动物的一段股动脉,一端缝扎,将药物微球塞入后缝扎另一端构建成含药微球药物囊袋。
本发明还提供一种药物微球动脉栓塞的局部组织药物浓度的检测方法,包含截取试验动物的股动脉,制成生物膜囊袋,以药物微球填充形成药物囊袋,将药物囊袋包埋入肝脏组织中,通过外周静脉取血,并在不同时间点取出包埋药物囊袋,检测药物代谢剩余量,以囊袋包埋肝脏点位中心,按照梯度远近的原则,通过高效液相色谱法(hplc)检测近端浓度、中端浓度和远端浓度,考察载药物微球栓塞剂的肝脏局部组织渗透释放特征。
进一步地,试验动物可选用雄性家兔。
进一步地,药物微球可为利福平海藻酸钠微球栓塞剂(rifampicinsodiumalginatemicrosphereembolicagents,rfp-kmg)…等。
进一步地,将药物囊袋包埋入肝脏组织后,可于1天、3天、1周、2周、1个月的不同时间点取出药物囊袋。
进一步地,可以在囊袋包埋肝脏点位中心,每隔1.5cm,取1cm3的肝脏组织。
进一步地,可通过试验动物耳缘取血。
进一步地,可于30分钟、1小时、2小时、4小时、6小时、12小时、1天、2天、3天、4天、5天、1周、2周、1个月经家兔耳缘静脉取血0.5ml。
进一步地,通过hplc检测药物囊袋剩余药量、肝脏局部组织梯度浓度,外周血药浓度等肝脏局部组织渗透释放特征
进一步地,可采用pksolver2.0药动学软件对血药浓度-时间数据进行拟合,根据理论血药浓度值与实验测定值的aic最小的原则,同时参考相关系数(r2)最大,作为判断标准,选择最佳房室模型,并分别求得药动学参数,计算出t1/2(α)、t1/2(β)、auc、cl、cmax等参数并拟合出血药浓度-时间曲线图。所有数据均用x±sd表示。其中,t1/2(α)表示分布半衰期,t1/2(β)表示消除半衰期,auc表示血药浓度-时间曲线下面积,cmax表示药峰浓度,aic表示akaike信息判据,r2表示相关指数。
本发明首次研究建立微球栓塞于动脉后其所载药物如何缓释进入周围组织及药代动力学模型和检测方法。通过模型可检测包括在活体动物体内微球药物释放通过动脉壁进入周围局部组织,动脉内代谢剩余量及外周血药浓度,从而检测药物微球栓塞剂药物缓释代谢及局部组织渗透释放特征,解决了待测组织的取材方法不能排除血管内残留药物的影响的难题,并且应用动物自体动脉制造囊袋,增加了模型的准确性。
附图说明
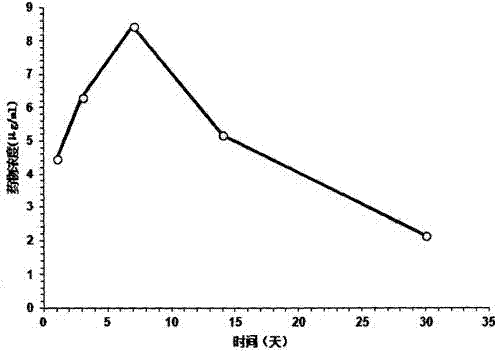
图1肝脏组织近端浓度-时间曲线
图2利福平海藻酸钠微球动脉囊袋在家兔体内血药浓度与时间曲线图
图3囊袋中利福平剩余百分率
图41周时的单室及二室模型的药动学参数结果
图51个月时的二室模型药动学参数结果
具体实施例说明
1实验动物
实验动物:清洁级实验雄性新西兰白兔30只,体重(2.3±0.2)kg,由解放军第三○九医院实验动物中心二级实验动物室提供,室温正常饲养1周。
2实验方法
2.1rfp-kmg动脉囊袋肝脏包埋动物实验
2.1.1以利福平海藻酸钠微球栓塞剂(rfp-kmg)为例,制作rfp-kmg动脉囊袋(药物囊袋)。30只雄性新西兰白兔均分为5组(1天组、3天组、1周组、2周组、1个月组,每组6只(rfp-kmg试验组5只;kmg空白对照组1只),试验兔麻醉,右后肢大腿内侧备皮,切口,分离出约3cm股动脉,远端双侧结扎,近端一侧结扎,剪取中间动脉血管,套管针辅助下,试验组将避光称量的定量(3mg·kg-1)rfp-kmg塞入血管,空白对照组填充入kmg,另一侧结扎,将制作好的囊袋,放入生理盐水中浸润备用,大腿内侧创口缝合。
2.1.2囊袋肝脏包埋
新西兰白兔胸腹部备皮,上腹部横向切口,暴露出肝脏,迅速将药物囊袋包埋入肝脏,用明胶海绵压住止血,腹部创口缝合。术后正常饲养。
2.1.3生物样本制备
2.1.3.1血样处理
新西兰白兔手术后,于不同时间点(30分钟、1小时、2小时、4小时、6小时、12小时、1天、2天、3天、4天、5天、1周、2周、1个月)经耳缘静脉取血0.5ml,置于肝素管中离心(温度4℃,转速30分钟、1小时、2小时、4小时、6小时、12小时、1天、2天、3天、4天、5天、1周、2周、1个月3000r·min-1,时间5min),取上清0.1ml,加乙腈0.1ml沉淀蛋白,旋涡混匀1min后离心(温度4℃,转速10000r·min-1,时间10min),取上清液再离心(温度4℃,转速10000r·min-1,时间10min),取上清液过0.45μm微孔滤膜,4℃保存,待测。
2.1.3.2肝脏组织样本处理
新西兰白兔手术后,于不同时间点(1天、3天、1周、2周、1个月)处死,立即解剖取出肝脏,首先将动脉载药囊袋剥离出(见图3),并以囊袋包埋点为中心,按照梯度远近的原则,每隔1.5cm,取约1cm3肝脏组织,用生理盐水清洗表面浮血,滤纸吸干后称重,剪碎,加入定量生理盐水(体重∶生理盐水=1∶3)匀浆,取匀浆液0.4ml,加乙腈0.4ml沉淀蛋白,旋涡混匀1min后离心(温度4℃,转速10000r·min-1,时间10min),取上清液0.4ml,加乙腈0.4ml沉淀蛋白,旋涡混匀1min后再离心(温度4℃,转速10000r·min-1,时间10min),取上清液过0.45μm微孔滤膜,4℃保存,待测。载药囊袋同上处理,4℃保存,待测。
2.2高效液相色谱法检测生物样本
2.2.1色谱条件
色谱柱:diamonsilods-2(4.6×250mm,5μm);流动相:甲醇-乙腈-0.075mol·l-1磷酸二氢钾溶液-1.0mol·l-1枸橼酸溶液(30∶32∶36∶4);流速为1.0ml·min-1;柱温35℃;检测波长254nm;进样量:10μl。
2.2.2标准溶液的配制
2.2.2.1标准溶液储备液
精密称取利福平对照品10mg,置于10ml的棕色容量瓶中,加入乙腈溶解后,乙腈定容,配制成浓度为1000μg·ml-1的标准品储备液,避光置于4℃冰箱备用。
2.2.2.2二级标准溶液储备液
移取1000μg·ml-1的利福平标准品储备液,配制浓度分别为100μg·ml-1和10μg·ml-1利福平二级浓度标准品储备液,避光置于4℃冰箱备用。
2.2.3系统适应性考察(空白、对照品、供试品、阴性)
2.2.4血浆样本检测方法学考察
2.2.4.1精密度试验
取10μg·ml-1利福平对照品储备液,精取0.25ml至5ml棕色容量瓶,加空白血浆样本定容至刻度,混匀,按“2.1.3.1”项下方法操作除蛋白,制备成0.5μg·ml-1对照品血浆生物样品,所制得的样品按“2.2.1”项下色谱条件,连续进样6次,计算精密度结果。
2.2.4.2重复性试验
平行制备6份0.5μg·ml-1对照品血浆生物样品(按“2.2.4.1”项下方法操作),所制得的样品按“2.2.1”项下色谱条件,分别进样1次,计算重复性结果。
2.2.4.3稳定性试验
配置对照品血浆生物样品,分别于0,2,4,6,8,12和24h时进样分析,计算该样品在24h内的稳定性;采用hplc测定对照品血浆生物样品经从-20℃到室温3次冻融稳定性。
2.2.4.1.4线性回归
使用乙腈将利福平对照品二级浓度储备液稀释,制得60,30,10,5,1μg·ml-1的利福平对照品溶液,见图3,充分混合均匀后避光置于4℃冰箱。移取上述系列浓度的标准溶液工作液50μl加入450μl空白血浆基质中,避光梯度配置0.1,0.5,1,3,6μg·ml-1的对照品血浆生物样品溶液,按“2.1.3.1”项下方法操作除蛋白后,涡旋混匀,过0.45μm微孔滤膜后进样,记录利福平的峰面积,绘制空白血浆利福平标准曲线。
2.2.4.5回收率试验
取空白血浆样本,分别加入适量利福平对照品溶液,制成高、中、低3个浓度的样品溶液,依“2.1.3.1”项下制备供试品溶液,每种浓度平行做3份,hplc测定,计算加样回收率。
2.2.5肝脏样本检测方法学考察
2.2.5.1精密度试验
取10μg·ml-1利福平对照品储备液,精取5ml至10ml棕色容量瓶,加空白肝脏组织匀浆样本定容至刻度,混匀,按“2.1.3.2”项下方法操作除蛋白,制备成5μg·ml-1对照品肝脏组织生物样品,所制得的样品按“2.2.1”项下色谱条件,连续进样6次,计算精密度结果。
2.2.5.2重复性试验
平行制备6份5μg·ml-1对照品肝脏组织生物样品(按“2.2.5.1”项下方法操作),所制得的样品按“2.2.1”项下色谱条件,分别进样1次,计算重复性结果。
2.2.5.3稳定性试验
配置对照品肝脏组织生物样品,分别于0,2,4,6,8,12和24小时进样分析,计算该样品在24小时内的稳定性;采用hplc测定对照品肝脏组织生物样品经从-20℃到室温3次冻融稳定性。
2.2.5.4线性回归
使用乙腈将利福平对照品二级浓度储备液稀释,制得500,300,100,70,50,30,10,7,3,1μg·ml-1的利福平对照品溶液,充分混合均匀后避光置于4℃冰箱。移取上述系列浓度的标准溶液工作液50μl加入450μl空白组织匀浆基质中,避光梯度配置0.1,0.3,0.7,1,3,5,7,10,30,50μg·ml-1的对照品肝脏组织生物样品溶液,按“2.1.3.2”项下方法操作除蛋白后,涡旋混匀,过0.45μm微孔滤膜后进样,记录利福平的峰面积,绘制空白肝脏组织利福平标准曲线。
2.2.5.5回收率试验
取空白肝脏组织匀浆样本,分别加入适量利福平对照品溶液,制成高、中、低3个浓度的样品溶液,依“2.1.3.2”项下制备供试品溶液,每种浓度平行做3份,hplc测定,计算加样回收率。
2.2.6生物样本检测
按“2.1.3.1”项下操作,取已制备好的血浆样品,hplc测定,记录利福平的峰面积,外标法测定血浆样本中药物的浓度。
按“2.1.3.2”项下操作,取已制备好的组织样品,hplc测定,记录利福平的峰面积,外标法测定组织样本中药物的浓度。
2.2.7数据处理
采用pksolver2.0药动学软件[24]对血药浓度-时间数据进行拟合,根据理论血药浓度值与实验测定值的aic最小的原则,同时参考相关系数(r2)最大,作为判断标准,选择最佳房室模型,并分别求得药动学参数,计算出t1/2(α)、t1/2(β)、auc、cl、cmax等参数并拟合出血药浓度-时间曲线图。所有数据均用均数±标准差表示。
3检测结果
3.1囊袋中利福平剩余百分率
包埋1d后,代谢剩余百分率为(74.59±1.48)%;包埋3d后,代谢剩余百分率为(52.56±1.24)%;包埋1周后,代谢剩余百分率为(33.11±1.95)%;包埋2周后,代谢剩余百分率为(19.48±1.87)%;包埋1个月后,代谢剩余百分率为(1.34±0.65)%。见图3。
3.2局部释放
肝脏组织近端浓度-时间曲线见图1,结果显示在释放前期有突释效应,在包埋植入7d后浓度最大,局部浓度可达8.46μg·ml-1,在前14天内的释放均保持在较高浓度,随后缓慢释放,1个月时,局部浓度为2.14μg·ml-1,仍高于对结核杆菌的最低杀菌浓度。相同时间点处死的平行实验新西兰大白兔,以囊袋包埋肝脏点为中心,按照梯度远近的原则,hplc检测结果显示:近端浓度>中端浓度>远端浓度。1个月处死时间点,个别样本出现:近端浓度>远端浓度>中端浓度。
3.3外周血药浓度
试验兔血药浓度检测发现,载药囊袋在局部包埋时,血药浓度在术后20h达到最高,保持有效药物浓度的缓释时间为96h。1周时的房室模型与药动学参数结果如图4、图5所示。利福平海藻酸钠微球动脉囊袋在家兔体内血药浓度与时间曲线如图2所示。利用pksolver2.0软件对其在家兔体内的血药浓度按一室模型,二室模型进行拟合,得到载药囊袋动脉包埋后在两种模型下理论血药浓度与实测血药浓度的相关系数(r2)与aic值。给药方式的药动学过程用二室模型来描述较为合理(权重系数1/c2)。
- 还没有人留言评论。精彩留言会获得点赞!