二肽基肽酶IV抑制剂在制备防治癫痫的药物中的应用的制作方法
本发明属于医药应用技术领域,具体涉及二肽基肽酶iv(dipeptidylpeptidase-4,dpp4)抑制剂在防治癫痫中的应用。
背景技术:
癫痫即俗称的“羊角风”或“羊癫风”,是大脑神经元突发性异常放电导致大脑功能障碍的一种常见的神经系统疾病。中国约有900万左右的癫痫患者,每年新增加癫痫患者约40万,癫痫已经成为神经科仅次于头痛的第二大常见病。
癫痫的发病机制非常复杂,迄今尚未完全阐明。癫痫反复发作对患者及其家庭乃至社会均造成很大危害,治疗方式从传统药物治疗逐渐拓展到手术治疗、基因疗法、细胞移植、神经刺激等多种治疗方式,但仍未找到特别理想的治疗方案。目前癫痫最常用、最重要的治疗手段仍是药物治疗,抗癫痫药物合理、规范、适时和正确的使用,近60%癫痫发作的患者可得到完全控制且停药后无发作。虽然大部分癫痫患者接受抗癫痫药物的治疗后可有效缓解癫痫发作,但是仍有约25%的患者发展为药物难治性癫痫。多次连用抗癫痫药物应警惕蓄积中毒,长期用于治疗癫痫时不可突然停药,以免引起癫痫发作,甚至出现癫痫持续状态。因此新型的抗癫痫药物的开发和研究是必要的。
二肽基肽酶iv(dipeptidylpeptidase4,dpp4)抑制剂是近年来治疗2型糖尿病的新型药物,于2007年获得欧盟批准用于治疗2型糖尿病,已是世界多个国家口服治疗糖尿病的药物。目前研究深入并已应用于临床的dpp4抑制剂有磷酸西他列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、阿格列汀(alogliptin)和利格列汀(linagliptin)。
dpp4的抑制剂降糖以外的靶器官保护作用,是目前临床关注的重点之一。目前没有dpp4的抑制剂应用于防治癫痫的相关报道。
技术实现要素:
为了克服现有技术中存在的不足,本发明提供了dpp4的抑制剂在制备防治癫痫的药物中的新应用,该dpp4的抑制剂毒副作用极小,药效持续时间长。
为了实现以上目的,本发明采取了以下技术方案:
第一方面,本发明提供二肽基肽酶iv的抑制剂在制备防治癫痫的药物中的应用。
进一步地,所述的二肽基肽酶iv的抑制剂是磷酸西他列汀、维格列汀、沙格列汀、阿格列汀和利格列汀中的任意一种。
进一步地,所述的二肽基肽酶iv的抑制剂是磷酸西他列汀或维格列汀。
本发明采用以下具体实施例来支持以上技术方案:
1、行为学检测癫痫发作的潜伏期、持续时间及发作等级。sd(spraguedawley,sd)大鼠经戊四氮(pentetrazole,ptz,35mg/kg,i.p.)诱导癫痫后,通过racine评分标准观察大鼠行为学变化,研究给予dpp4抑制剂后对大鼠癫痫发作潜伏期、持续时间及发作等级的影响。
2、脑电图检测癫痫发作后神经元放电情况。sd大鼠经ptz诱导癫痫后,脑电图观测给予dpp4抑制剂后对癫痫大鼠神经元放电的影响。
3、尼氏染色检测癫痫发作后皮层及海马区域神经元生存率。sd大鼠经ptz诱导癫痫后,尼氏染色研究给予dpp4抑制剂后对大鼠皮层和海马齿状回神经元生存率的影响。
4、tunel染色检测癫痫发作后皮层及海马区域神经元凋亡情况。sd大鼠经ptz诱导癫痫后,tunel染色研究给予dpp4抑制剂后对大鼠皮层和海马齿状回神经元凋亡的影响。
5、he染色检测癫痫发作后皮层及海马区域神经元变性坏死情况。sd大鼠经ptz诱导癫痫后,he染色研究给予dpp4抑制剂后对大鼠皮层和海马齿状回神经元变性坏死的影响。
6、膜片钳技术检测原代培养海马神经元的兴奋性。原代海马神经元培养成熟后无镁外液诱导癫痫细胞模型,单细胞膜片钳技术研究给予dpp4抑制剂后对神经元兴奋性的影响。
本发明具有以下优点和效果:
目前临床治疗癫痫的方法效果虽明显,但是可产生多种严重副作用,久用可产生耐受性及成瘾性。本发明涉及的药物,是经过批准已经在临床上使用的药品,毒副作用极小,药效持续时间长,可以节省药物研发的成本。
附图说明
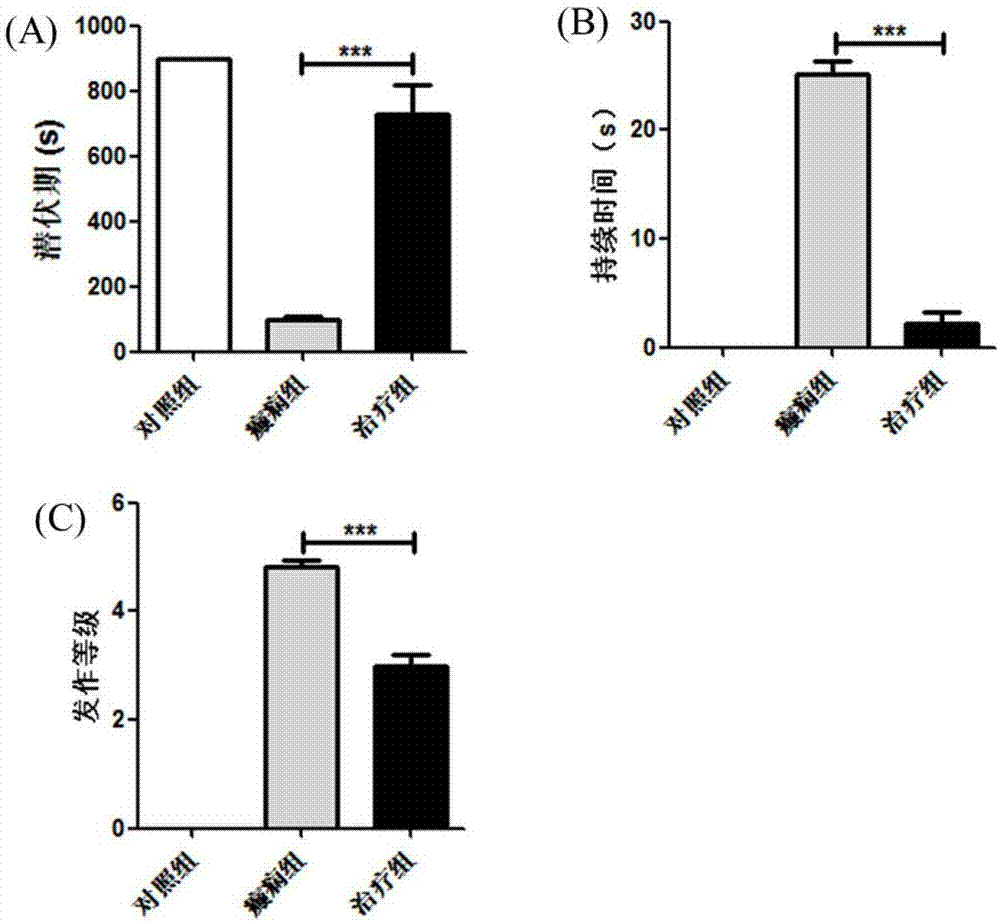
图1磷酸西他列汀延长癫痫发作潜伏期,降低癫痫发作持续时间和发作等级。
a图为癫痫发作潜伏期统计结果,***p<0.001,b图为癫痫发作持续时间统计结果,***p<0.001,c图为癫痫发作等级统计结果,***p<0.001。
图2磷酸西他列汀降低癫痫大鼠脑内神经元异常放电幅度和频率。
a、b、c图分别为对照组、癫痫组以及磷酸西他列汀治疗组神经元放电结果。
图3磷酸西他列汀增加癫痫大鼠皮层和海马齿状回神经元生存率。
a、d图为对照组尼氏染色,b、e图为癫痫组尼氏染色,c、f图为磷酸西他列汀治疗组尼氏染色,scalebar:50μm。
图4磷酸西他列汀降低癫痫大鼠皮层和海马齿状回神经元凋亡。
a、d图为对照组tunel染色,b、e图为癫痫组tunel染色,c、f图为磷酸西他列汀治疗组tunel染色,scalebar:50μm。
图5磷酸西他列汀降低癫痫大鼠皮层和海马齿状回神经元变性坏死。
a、d图为对照组he染色,b、e图为癫痫组he染色,c、f图为磷酸西他列汀治疗组he染色,scalebar:50μm。
图6维格列汀降低无镁溶液处理后原代培养海马神经元放电频率。
a图分别为对照组、癫痫组以及维格列汀治疗组神经元放电记录结果,b图为放电频率统计图,*p<0.05。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】研究dpp4抑制剂对癫痫大鼠行为学影响
选取30只(220±20g)雄性sd大鼠随机分为3组即对照组、癫痫组以及磷酸西他列汀治疗组。对照组:按35mg/kg腹腔注射生理盐水;癫痫组:按35mg/kg腹腔注射ptz构建癫痫模型;治疗组:提前20分钟按10mg/kg腹腔注射磷酸西他列汀,20分钟后按35mg/kg腹腔注射ptz构建癫痫模型。根据racine分级标准(1972年)癫痫发作等级分级为0~v级,其主要表现为:0级正常(无抽搐发作);i级呆立不动、面肌痉挛、眨眼、动须等面部自动症或抖动;ii级节律性点头、咀嚼;iii级单侧前肢痉挛;iv级全身性强直阵挛抽搐,伴站立、跌倒和后退;v级反复出现全身性强直阵挛发作,或呈癫痫持续状态或抽搐致死。实验连续观察7天,记录每天每组大鼠癫痫发作的潜伏期、持续时间以及发作等级。
实验结果显示,与癫痫模型组大鼠相比,磷酸西他列汀治疗组癫痫发作的潜伏期明显延长,癫痫发作持续时间以及发作等级明显降低,说明磷酸西他列汀可以降低癫痫的严重性(图1)。
【实施例2】研究dpp4抑制剂对癫痫大鼠神经元放电的影响
室温安静环境下,sd大鼠腹腔注射10%水合氯醛(0.3ml/100g)处于全麻状态后,使用直径为0.5mm的小手钻,分别在大鼠前囟门后4mm,中线两侧旁4mm处的颅骨钻出两个记录电极孔,在大鼠的鼻窦上方钻出一个参考电极孔。将两个绝缘的不锈钢电极分别置于参考电极孔和右侧的记录电极孔内,然后用牙科水泥将所有的电极固定在大鼠颅骨上(以上操作过程中注意无菌操作)。将电极引线连接到数字化脑电图机上,调整好脑电图参数后记录各组大鼠神经元放电情况。
实验结果显示,与癫痫模型组大鼠相比,磷酸西他列汀治疗组大鼠神经元异常放电的幅度和频率降低,说明磷酸西他列汀可以在一定程度上抑制癫痫异常放电(图2)。
【实施例3】研究dpp4抑制剂对癫痫大鼠神经元存活率的影响
主要步骤如下:
(1)组织切片:sd大鼠癫痫行为学观测结束24h后,腹腔注射10%水合氯醛(0.3ml/100g)使大鼠处于全麻状态,用4%多聚甲醛左心室灌注固定。在灌注过程中,可以观察到大鼠全身肌肉颤动,逐渐僵硬、强直,此时断头取脑,随后将组织石蜡包埋切片备用。
(2)尼氏染色:依次将切片放入二甲苯i15min-二甲苯ii15min无水乙醇i5min-无水乙醇ii5min-85%酒精5min-75%酒精5min-蒸馏水洗。将石蜡切片放入缓冲亚甲蓝染色液内染10min。在0.2mol/l醋酸盐缓冲液(ph=4.6)中分化1~3秒,并在显微镜下观察,尼氏体清晰时进行下一步试验。用4%的钼酸铵水溶液处理切片3~5min。蒸馏水洗脱后常规脱水透明、中性树胶封片。光学显微镜观察皮层和海马齿状回区尼氏体的变化。
实验结果显示:与癫痫模型组大鼠相比,磷酸西他列汀治疗组大鼠皮层和海马齿状回区神经元尼氏体明显减少,尼氏体层次致密整齐,说明磷酸西他列汀可以缓解癫痫大鼠神经元损伤(图3)。
【实施例4】研究dpp4抑制剂对癫痫大鼠神经元凋亡的影响
主要步骤如下:
(1)组织切片方法同前。
(2)tunel染色:按片子数量和组织大小取tunel试剂盒内适量试剂1(tdt)和试剂2(dutp)按2:29混合覆盖组织,37℃恒温孵育2小时。切片放入用甲醇配制的3%过氧化氢溶液室温避光孵育15min,摇床上晃动洗涤脱色。切片稍甩干后,每张切片加适量试剂3覆盖组织,切片平放于湿盒内,37℃温箱孵育30min。切片稍甩干后在圈内滴加新鲜配制的dab显色液,显微镜下控制显色时间,阳性为细胞核呈棕黑色,冲洗切片终止显色。harris苏木素复染3min左右,1%的盐酸酒精分化数秒,氨水返蓝,流水冲洗,最后脱水封片。
实验结果显示,与癫痫模型组大鼠相比,磷酸西他列汀治疗组大鼠皮层和海马齿状回区神经元凋亡细胞数量明显减少,说明磷酸西他列汀可以改善癫痫大鼠神经元凋亡(图4)。
【实施例5】研究dpp4抑制剂对癫痫大鼠神经元变性坏死的影响
主要步骤如下:
(1)组织切片方法同前。
(2)he染色:切片入苏木素染3~5min,1%的盐酸水溶液分化数秒;0.6%~0.7%氨水返蓝,流水冲洗;切片梯度酒精脱水,入伊红染液中染色5min。切片依次放入无水乙醇i5min-无水乙醇ii5min-无水乙醇iii5min-正丁醇5min-二甲苯i5min-二甲苯ii5min透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。显微镜镜检,图像采集分析。
实验结果显示,与癫痫模型组大鼠相比,磷酸西他列汀治疗组大鼠皮层和海马齿状回区神经元变性细胞指数有明显的下降,说明磷酸西他列汀可以减少癫痫大鼠神经元变性坏死(图5)。
【实施例6】研究dpp4抑制剂对无镁外液处理原代培养神经元兴奋性的影响
(1)原代海马神经元培养和癫痫细胞模型建立:提前将手术器械、圆形玻片和50ml去离子水高压蒸汽灭菌,灭完后将去离子水放到4度冰箱预冷。取sd大鼠新生鼠婴(1日龄)将剥离的海马放入离心管中,然后加入0.25%胰酶,放入37度培养箱中消化8~10min。消化结束30s时取出5%培养基,加入1ml5%培养基终止消化。用1ml枪轻微吹打均匀8~10次,用200目细胞滤网过滤细胞,待组织块沉淀下来,吸出30μl到每个孔的玻璃片上放入37度培养箱。培养第7天采用神经元标志物map2鉴定神经元纯度。培养的海马神经元随机分成3组:对照组:去除维持培养液,正常细胞外液处理3小时恢复继续维持培养液培养;癫痫细胞模型组:去除维持培养液,无镁细胞外液处理3小时,恢复维持培养液继续培养;维格列汀治疗组:去除维持培养液,无镁细胞外液(含维格列汀100μm)处理3小时,恢复维持培养液继续培养。
(2)原代海马神经元兴奋性记录:将目的细胞置于视野中央,灌有电极内液的玻璃微电极装入电极夹持器。通过三维微细操纵器调节电极尖端至视野中央。形成全细胞记录模式后用自带软件进行快慢电容和串联电阻补偿,数据采样频率为10khz,低频滤波频率为5khz。在电流钳记录模式(c-cmodel),记录膜电位和神经元放电情况。
实验结果显示,与模型组神经元相比,维格列汀治疗组神经元动作电位放电频率显著降低,说明维格列汀可以抑制神经元异常放电(图6)。
- 还没有人留言评论。精彩留言会获得点赞!