一种用于肝癌与肝癌微环境相互作用的新的长链非编码RNA检测及其应用的制作方法
本发明涉及生物领域,具体的,本发明涉及核酸在制备药物中的用途,所述药物用于预防或治疗肝癌。
背景技术:
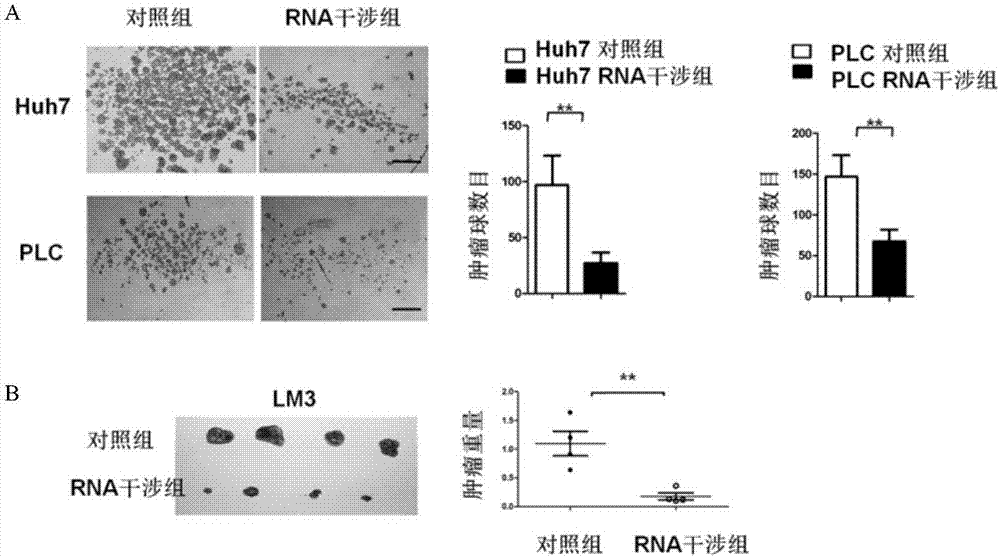
:肝细胞癌(hepatocellularcarcinoma,hcc)是全世界最常见的恶性肿瘤之一,其发病率在男性常见癌症中排名第5,在女性常见癌症中排名第7,但其死亡率在所有癌症中高居第3位。我国是全球肝癌最高发的地区之一,肝癌病人死亡率居我国癌症死亡原因的第2位。近年来,越来越多的研究表明,与肝癌的发生发展关系密切的肿瘤微环境在肝癌的进程中起着推波助澜的作用。肝癌组织中除了占核心地位的肝癌细胞外,还包括组成肿瘤微环境的多种基质细胞如间充质干细胞(mesenchymalstemcellsormultipotentmesenchymalstromalcells,mscs)、炎症细胞、内皮细胞、巨噬细胞、成纤维细胞等。近年来,越来越多的长链非编码rna(longnon-codingrna,lncrna)在机体正常生理及病理过程中的重要调控作用被发现。lncrna是一类转录本长度超过200核苷酸(nucleotide,nt)的功能性rna分子,其缺乏编码蛋白质的能力,定位于胞核或胞质内,以rna形式在多个层面(如表观遗传学、转录调控及转录后调控)调控基因的表达水平。然而,lncrna在肝癌中所扮演的角色仍有待科学家进一步探索和研究。技术实现要素:本申请是基于发明人对以下问题和事实的发现而提出的:发明人在实验中,研究发现肝癌msc能够促进肝癌细胞的转移,那么lncrna是否在肝癌msc微环境与肝癌癌细胞相互作用过程中发挥功能呢?带着这个疑问,发明人通过lncrna芯片技术,比较了肝癌msc共培养前后肝癌细胞中lncrna表达谱,结果惊奇地发现:长链非编码lncrna-muf在肝癌细胞中的上调表达非常显著。更进一步地,发明人通过干涉肝癌细胞中lncrna-muf的表达后,发现干涉lncrna-muf的表达能够显著抑制体外肝癌干细胞球的形成和体内肝癌肿瘤的形成。为此,在本发明的第一方面,本发明提出了核酸在制备药物中的用途,所述药物用于预防或治疗肝癌,所述核酸用于沉默lncrna-muf。发明人在实验中发现,长链非编码lncrna-muf在肝癌细胞中的高表达,能够促进肝癌上皮-间质转化、体内成瘤和转移。并且发明人也通过实验发现,沉默lncrna-muf可显著抑制体外肝癌干细胞球的形成和体内肝癌肿瘤的形成,利用用于沉默lncrna-muf的核酸所制备的药物,可有效用于预防或治疗肝癌。根据本发明的实施例,上述用途还可以进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述沉默是通过shrna、反义核酸、核酶、显性负突变、crispr和锌指核酸酶的至少之一实现的。通过上述方式沉默lncrna-muf,沉默效率更高、特异性更强,所述沉默lncrna-muf的核酸所制备的药物用于预防或治疗肝癌的效果更加显著。根据本发明的实施例,所述核酸具有seqidno:1~5所示的核苷酸序列。gagacagttgatagccaaa(seqidno:1)。gtctaaaggagacagttga(seqidno:2)。gcagattcaggccatccta(seqidno:3)。ggattcactgactgattat(seqidno:4)。gccctcgagaagtgtctaa(seqidno:5)。发明人发现,seqidno:1~5所示的核苷酸序列沉默lncrna-muf的效率高、特异性强、毒性小。根据本发明的实施例,所述药物用于抑制肝癌干细胞球的形成、体内肝癌肿瘤的形成、抑制肝癌干细胞的增殖或抑制肝癌细胞的增殖。发明人发现,沉默lncrna-muf可显著抑制体外肝癌干细胞球的形成和体内肝癌肿瘤的形成,这与沉默lncrna-muf具有抑制肝癌干细胞的增殖或抑制肝癌细胞的增殖分不开的。利用沉默lncrna-muf的核酸所制备的药物,可有效用于抑制肝癌干细胞球的形成、体内肝癌肿瘤的形成、抑制肝癌干细胞的增殖或抑制肝癌细胞的增殖。根据本发明的实施例,所述药物用于抑制肝癌细胞迁移。发明人发现,在肝癌组织中,非编码lncrna-muf能够显著促进肝癌细胞的迁移,利用沉默lncrna-muf的核酸所制备的药物,可有效用于抑制肝癌细胞迁移。根据本发明的实施例,所述药物用于抑制肝癌干细胞的分化或肝癌细胞的分化。发明人发现,在肝癌组织中,非编码lncrna-muf能够显著促进肝癌细胞的迁移或上皮-间质转化,这是与肝癌干细胞的分化或肝癌细胞的分化所分不开的,利用沉默lncrna-muf的核酸所制备的药物,可有效用于抑制肝癌干细胞的分化或肝癌细胞的分化。根据本发明的实施例,所述药物用于抑制肝癌上皮-间质转化。发明人发现,在肝癌组织中,非编码lncrna-muf能够显著促进肝癌细胞的上皮-间质转化,利用沉默lncrna-muf的核酸所制备的药物,可有效用于抑制肝癌上皮-间质转化。根据本发明的实施例,所述核酸是以包括选自下列至少之一的形式提供的:缀合物、脂质体、前体、模拟物、表达所述核酸的构建体。根据本发明的实施例,利用上述形式的至少之一,可实现核酸在患者体内的特异性靶向到目标和核酸在目标区域发挥相应的生理效应。根据本发明的实施例,所述缀合物包括所述核酸以及包括纳米颗粒、胆固醇、多肽的至少之一。纳米颗粒、胆固醇、多肽与核酸所形成的缀合物,可实现核酸在患者体内的特异性靶向到目标和核酸在目标区域发挥相应的生理效应,核酸以上述缀合物的形式提供,其稳定性、靶向性进一步提高。根据本发明的实施例,所述纳米颗粒为聚乙烯亚胺、半乳糖修饰巯基化壳聚糖季铵盐。发明人通过实验发现,以聚乙烯亚胺、半乳糖修饰巯基化壳聚糖季铵盐作为纳米颗粒结合核酸所获得的纳米颗粒-核酸缀合物的稳定性和靶向性进一步提高。根据本发明的实施例,所述构建体进一步包括控制序列,所述控制序列与所述核酸可操作的连接。控制序列可有序和高效地调控核酸在受体细胞中的高效表达,进而实现药物功能发挥的有效性和有序性。根据本发明的实施例,所述药物成注射剂、缓释微球制剂。药物以注射剂或缓释微球制剂的形式导入患者体内,可降低药物在人体内的降解速率,进一步提高药物在目标治疗位点的有效药量和药效。根据本发明的实施例,所述药物以注射、口服或灌肠原位给药的方式给药。发明人发现,上述给药方式可进一步提高药物在目标治疗位点的有效药量和药效。在本发明的第二方面,本发明提出了一种用于预防或治疗肝癌的药物组合物。根据本发明的实施例,所述药物组合物包括:核酸,所述核酸如前面所述。利用根据本发明实施例的药物组合物,可实现对肝癌的有效治疗或预防,可实现对肝癌干细胞球形成的有效抑制、可实现对体内肝癌肿瘤形成的有效抑制、可实现对肝癌干细胞的增殖或肝癌细胞的增殖的有效抑制,可实现对肝癌细胞迁移的有效抑制,可实现对肝癌干细胞分化或肝癌细胞分化的有效抑制,并可实现对肝癌上皮-间质转化的有效抑制。附图说明图1是根据本发明实施例的肝癌间充质干细胞与肝癌细胞共培养后,肝癌细胞中lncrna的表达情况;图2是根据本发明实施例的肝癌间充质干细胞与肝癌细胞共培养后或肝癌细胞在tgf-beta处理下,肝癌细胞中lncrna-muf的表达情况;图3是根据本发明实施例的肝癌组织中lncrna-muf的表达情况;图4是根据本发明实施例的lncrna-muf沉默后能够显著抑制体外干细胞球的形成能力及体内肿瘤形成能力的结果图;以及图5是根据本发明实施例的lncrna-muf沉默后能够显著抑制肿瘤干细胞侵袭能力的结果图。具体实施方式需要说明的是,本发明所使用的术语“包含”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。用途在本发明的第一方面,本发明提出了核酸在制备药物中的用途,所述药物用于预防或治疗肝癌,所述核酸用于沉默lncrna-muf。长链非编码lncrna-muf具有seqidno:6所示的核苷酸序列。tgaagtcagtcgggccgcccgcttgctgcacggcagccgtgggactggcacaggctcctcggcagcattatgggcagctggtagagcggccacttctgagagccggatgggccttccgaggtcgggccgtgccccgctgggcagcgcagagggggtgtgtagggcacgcgacttggagccaggtccagacccatcctggctcctctcagggctccttcccctgcccccattccaccccagccctgctggctgtcccgcaggacccagcgccgcggtagccttctctgaactgcggctcaggcggaggtgtcactcctgcctccagcccaggagggcaggtcaggttatgcaacgcgtgccgcgcgatctccccccacctccaacccccttttctcccgggtccacaccgcagttcccaccgctccgggtgtcctccccagtgcgccgcgatttttgtgtccaagccccagagtccctctgagaccaacccccagccagcacagacttcctgccttcccagctcggggatgtggtctcattaggttgcccaagctggacttgtactcttggcctcaagaggtccttccatctcagtctcccaagtagctgggactacaagcatgcaccactacactcagccaaatactttcaataatttgccagctgacaacttgattgggttctccttcaggtttgaagcgccctcgagaagtgtctaaaggagacagttgatagccaaacaacagttttggattcactgactgattatgaaagaagcagtagactggtatcaagaatcagtcagcaaggaggccctcaccagacgccagtgccatgttcttggacttctcagcctccatattcatgaactaagtttttggaatccttaggcttccacgtgtggaaagcctgagctaacctactggaggatgagccatcacctggagcagattcaggccatcctagttgaagcctccctaggccaagcaaccgtccaactaccagacattgaccattcagccttgaacattcagcacaaagacaaaacagaccagaccagaagagtcccacagaataggggaaactattcagagaaaacttaagccactaagttttatggtgttttgttctgtagcagaagcataggcatactgacaatacaaaccgaaatccttctaacgtagtggaccttttcaggccagcattttttccttgaaaacctggagcatgtatccatcttatagcagagatcactttcacaatgtttgggctcttgatttgaattgatgatgtaatgagccctctatccagattgtaactaattactctgcgaattgactggattccacacccttctaatattttacttttcctcttttatcaactctcattcttgctgccatgatcaatggaccaactatgcttataaccacaaattttgatatgcttaaacaaatgaacaaatatatttaataatttcttttttttttttgaaatagtatcttgctctgtcacccaggctgcagtgcagcagcgtgatctcagctcactataacctccacctcccgggttcaagtgattctcctgcctcagcctcccaagtagctgggactacaggcgcccaccaccatacctggctaattttttgtatttttagtagagacagggtttatccatgttggccaggctggtctcaaactcctgacctcaagtgatcctcctgcctcggcctcccaaagtgctgggattacaggtgtgagccaccatgcccagccaataatttcctgatataataaaaatgccaatactatacaattaaatagtaaagtgataaaaaataggataacatgataaccactaattaatatatactacataatcatc(seqidno:6)。发明人在实验中发现,在肝癌组织或肝癌间充质干细胞和肝癌细胞的共培养体系中,lncrna-muf在肝癌细胞中的高表达,lncrna-muf能够显著促进肝癌上皮-间质转化、体内成瘤和转移。并且发明人也通过实验发现,沉默lncrna-muf可显著抑制体外肝癌干细胞球的形成和体内肝癌肿瘤的形成。利用沉默lncrna-muf的核酸所制备的药物,可有效用于预防或治疗肝癌。根据本发明的具体实施例,发明人发现,在肝癌组织中,lncrna-muf在肝癌细胞中的高表达,非编码lncrna-muf能够显著促进肝癌细胞的迁移和上皮-间质转化,沉默lncrna-muf能够抑制体外肝癌干细胞球的形成、抑制体内肝癌肿瘤的形成。从机制角度,发明人也通过实验有力的证明,沉默lncrna-muf能够抑制肝癌干细胞的增殖、分化或迁移或抑制肝癌细胞的增殖、分化或迁移。利用沉默lncrna-muf的核酸所制备的药物,或可有效用于阻断肝癌间充质干细胞与肝癌细胞的相互作用,或可有效用于抑制肝癌干细胞球的形成、抑制体内肝癌肿瘤的形成、抑制肝癌干细胞的增殖、抑制肝癌细胞的增殖、抑制肝癌细胞迁移、抑制肝癌干细胞的分化、肝癌细胞的分化或抑制肝癌上皮-间质转化,进而有效用于肝癌的治疗或预防。根据本发明的实施例,所述沉默是通过shrna、反义核酸、核酶、显性负突变、crispr和锌指核酸酶的至少之一实现的。其中,小发夹rna或短发夹rna(shrna)是sirna(小干扰rna)的导入形式,sirna是一种小rna分子(由21~25个核苷酸组成),由dicer(rnaaseⅲ家族中对双链rna具有特异性剪切作用的酶)加工而成;sirna在rna沉默通路中起中心作用,对特定信使rna(mrna)进行降解,为转录水平后调控。反义核酸包括反义rna和反义dna,反义rna是指能和mrna完全互补的一段小分子rna或寡聚核苷酸片段,反义dna是指能与基因dna双链中的有义链互补结合的短小dna分子,反义rna和反义dna主要是通过mrna的翻译和基因dna的转录而发挥作用的;反义核酸一方面通过与靶mrna结合形成空间位阻效应,阻止核糖体与mrna结合,另一方面其与mrna结合后激活内源性rna酶或核酶,进而降解mrna;反义dna与基因dna双螺旋的调控区特异结合形成dna三聚体,或与dna编码区结合,终止正在转录的mrna链的延长;反义核酸还可抑制转录后mrna的加工修饰,如5'端加帽、3'端加尾、中间剪接和内部碱基甲基化等,并阻止成熟mrna由细胞核向细胞浆内运输,因此,反义rna是一种有效的沉默目的基因的技术。核酶是具有催化功能的rna分子,是生物催化剂,可降解特异的mrna序列,核酶通过催化转磷酸酯和磷酸二酯键水解反应参与rna自身剪切、加工过程,与一般的反义rna相比,核酶具有较稳定的空间结构,不易受到rna酶的攻击,更重要的是,核酶在切断mrna后,又可从杂交链上解脱下来,重新结合和切割其它的mrna分子。显性负性突变是指某些信号转导蛋白突变后不仅自身无功能,还能抑制或阻断同一细胞内的野生型信号转导蛋白的作用,其主要通过和野生型蛋白形成二聚物的方式实现,这种突变毒性作用大,能显著抑制或阻断细胞内目标信号转导蛋白的作用。锌指核酸酶由一个dna识别域和一个非特异性核酸内切酶构成,dna识别域是由一系列cys2-his2锌指蛋白串联组成(一般3~4个),每个锌指蛋白识别并结合一个特异的三联体碱基,锌指蛋白形成α-β-β二级结构,其中α螺旋的16氨基酸残基决定锌指的dna结合特异性,骨架结构保守,对决定dna结合特异性的氨基酸引入序列的改变可以获得新的dna结合特异性,从而可以针对不同的目的基因设计不同的氨基酸引入序列,实现不同目的基因的特异性沉默。crispr(clusteredregularlyinterspacedshortpalindromicrepeats,规律成簇间隔短回文重复),是一种基因编辑器,是细菌用以保护自身对抗病毒的一个系统。它可以用来删除、添加、激活或抑制其他生物体的目标基因,这些目标基因包括人细胞内的目标基因。crispr簇是一个广泛存在于细菌和古生菌基因组中的特殊dna重复序列家族,其序列由一个前导区(leader)、多个短而高度保守的重复序列(repeat)和多个间隔区(spacer)组成。前导区一般位于crispr簇上游,是富含at长度为300~500bp的区域,被认为可能是crispr簇的启动子序列。重复序列区长度为21~48bp,含有回文序列,可形成发卡结构。重复序列之间被长度为26~72bp的间隔区隔开。spacer区域由俘获的外源dna组成,当含有同样序列的外源dna入侵时,可被细菌机体识别,并进行剪切使之表达沉默,达到保护自身安全的目的。通过对crispr簇的侧翼序列分析发现,在其附近存在一个多态性家族基因。该家族编码的蛋白质均含有可与核酸发生作用的功能域(具有核酸酶、解旋酶、整合酶和聚合酶等活性),并且与crispr区域共同发挥作用,因此被命名为crispr关联基(crisprassociated),缩写为cas。目前发现的cas包括cas1~cas10等多种类型。cas基因与crispr共同进化,共同构成一个高度保守的系统。当细菌抵御噬菌体等外源dna入侵时,在前导区的调控下,crispr被转录为长的rna前体(prerisprrna,pre-crrna),然后加工成一系列短的含有保守重复序列和间隔区的成熟crrna,最终识别并结合到与其互补的外源dna序列上发挥剪切作用。pre-crrna的加工由cas家族中的cas9参与。cas9含有在氨基末端的ruvc和蛋白质中部的hnh2个独特的活性位点,在crrna成熟和双链dna剪切中发挥作用。pre-crrna转录的同时,与其重复序列互补的反式激活crrna(trans-activatingcrrna,tracrrna)也转录出来,并且激发cas9和双链rna特异性rnaseiii核酸酶对pre-crrna进行加工。加工成熟后,crrna、tracrrna和cas9组成复合体,识别并结合于crrna互补的序列,然后解开dna双链,形成r-loop,使crrna与互补链杂交,另一条链保持游离的单链状态,然后由cas9中的hnh活性位点剪切crrna的互补dna链,ruvc活性位点剪切非互补链,最终引入dna双链断裂(dsb)。通过人工设计rna,可以改造形成具有引导作用的sgrna(shortguiderna),以引导cas9对dna的定点目标基因切割。综上所述,shrna、反义核酸、核酶、显性负突变、crispr、锌指核酸酶为特异性沉默目标基因的有效手段,沉默基因的手段不受特别限制,本领域技术人员可根据具体的实验目的和条件选择,如本发明实施例所采用的shrna、反义核酸、核酶、显性负突变,crispr或锌指核酸酶的至少之一,实现目的基因的特异性沉默。通过上述方式沉默lncrna-muf,沉默效率更高、特异性更强,所述沉默lncrna-muf的核酸所制备的药物用于预防或治疗肝癌的效果更加显著。根据本发明的实施例,lncrna-muf被沉默优选采用shrna实现。shrna所携带的sirna分子通常是一个长度在10和30之间的碱基对的双重区域。本发明实施例的lncrna-mufsirna被设计为同源于lncrna-muf,通过mrna的降解来抑制基因表达。sirna关联于被称为诱导rna沉默复合物(risc)的多重蛋白复合物,在此期间正义链被酶裂解。被激活的risc中基于序列同源性,指引risc到对应的mrna;相同的核酸酶切割靶向lncrna-muf,产生特定lncrna-muf沉默,抑制特定lncrna-muf的表达。sirna以shrna的形式导入细胞(shrna包含大约18-23的核苷酸sirna序列,后跟一个9-15长度的核苷酸环和一个sirna序列的反向补充),shrna的设计较好的避免了在3’utr细胞基因中的匹配点;确保了适当的链选择。一个单一sirna分子可被重复应用于多靶向mrna分子的分裂。rnai(rna干扰)可通过引入合成sirna的方式被诱导。根据本发明的实施例,本发明实施例的shrna不断产自细胞内,因此其效果更加持久,从而延长shrna周期,本发明实施例采用的shrna具有高效、特异性的沉默lncrna-muf的作用,lncrna-muf的成功沉默,使得肝癌细胞的增殖、分化和迁移受到显著抑制,沉默lncrna-muf的shrna所制备的药物用于预防或治疗肝癌的效果更加显著。需要说明的是,基于lncrna缺乏编码蛋白质的能力,本申请所述的lncrna-muf“表达”是指lncrna-muf转录本的表达。根据本发明的具体实施例,沉默lncrna-muf的核酸具有seqidno:1~5所示的核苷酸序列。发明人发现,seqidno:1~5所示的核苷酸序列沉默lncrna-muf的效率高、特异性强、毒性小,其中,seqidno:1所示核苷酸沉默lncrna-muf的效率更高、特异性更强,以seqidno:1所示核苷酸所制备的药物用于预防或治疗肝癌的效果更加显著。根据本发明的一些具体实施例,所述核酸是以包括选自下列至少之一的形式提供的:缀合物、脂质体、前体、模拟物、表达所述核酸的构建体。需要说明的是,根据本发明的具体示例,所述缀合物包括所述核酸以及包括纳米颗粒、胆固醇、多肽的至少之一。纳米颗粒、胆固醇、多肽与核酸所形成的缀合物,可实现核酸在患者体内的特异性靶向到目标和核酸在目标区域发挥相应的生理效应,核酸以上述缀合物的形式提供,其稳定性、转染效率和靶向性进一步提高。根据本发明的再一具体实施例,所述纳米颗粒为聚乙烯亚胺、半乳糖修饰巯基化壳聚糖季铵盐。聚乙烯亚胺、半乳糖修饰巯基化壳聚糖季铵盐可为线性结构或分枝状结构,但其分子量并不受特别限制,聚乙烯亚胺、半乳糖修饰巯基化壳聚糖季铵盐作为纳米颗粒结合核酸所获得的纳米颗粒-核酸缀合物的稳定性和靶向性进一步提高,且更有利于药物的在体内的吸收和转染功效。根据本发明的具体实施例,本申请所述的脂质体适于包裹用于沉默lncrna-muf的核酸,脂质体的原料包括但不限于脂质体、胆固醇和聚乙二醇磷脂。根据本发明的实施例,所述脂质体具有毒性低、转染效率高、血液稳定定高的特点。根据本发明的具体实施例,本申请所述的“前体”,代表一种物质可在体内转化为用于沉默lncrna-muf的核酸。这样的转化受前体药物在血液中水解或在血液或组织中经酶转化为母体结构的影响。根据本发明的具体实施例,本申请所述的“模拟物”为用于沉默lncrna-muf的核酸的模拟物,其为用于沉默lncrna-muf的核酸的双链结构,克服了单链容易降解和不易转染的缺点。在本发明中所使用的术语“构建体”是指这样的一种遗传载体,其包含特定核酸序列,并且能够将目的核酸序列转入宿主细胞中与宿主细胞的基因组发生同源重组以获得重组细胞。根据本发明的实施例,构建体的形式不受特别限制,根据本发明的具体示例,其可以为质粒、噬菌体、人工染色体、粘粒(cosmid)、病毒的至少一种。根据本发明的具体示例,构建体呈质粒的形式。质粒作为遗传载体,具有操作简单,可以携带较大片段的性质,便于操作和处理。质粒的形式也不受特别限制,既可以是环形质粒,也可以是线性质粒,即可以是单链的,也可以是双链的。本领域技术人员可以根据需要进行选择。根据本发明的具体实施例,所述构建体还可以进一步包括控制序列,所述控制序列与所述核酸可操作的连接。控制序列包括但不限于cmv,ef-1,ltr或rsv,控制序列可有序和高效地调控核酸在受体细胞中的高效表达,进而实现药物功能发挥的有效性和有序性。根据本发明的具体实施例,所述药物成注射剂、缓释微球制剂。药物以注射剂或缓释微球制剂的形式导入患者体内,可降低药物在人体内的降解速率,进一步提高药物在目标治疗位点的有效药量和药效。根据本发明的再一具体实施例,所述药物以注射、口服或灌肠原位给药的方式给药。发明人发现,上述给药方式可进一步提高药物在目标治疗位点的有效药量和药效。药物组合物在本发明的第二方面,本发明提出了一种用于预防或治疗肝癌的药物组合物。根据本发明的实施例,所述药物组合物包括:核酸,所述核酸如前面所述。利用根据本发明实施例的药物组合物,可实现对肝癌的有效治疗或预防,可实现对肝癌干细胞球形成的有效抑制、可实现对体内肝癌肿瘤形成的有效抑制、可实现对肝癌干细胞的增殖或肝癌细胞的增殖的有效抑制,可实现对肝癌细胞迁移的有效抑制,可实现对肝癌干细胞分化或肝癌细胞分化的有效抑制,并可实现对肝癌上皮-间质转化的有效抑制。“治疗”在本发明中包括预防、缓解、抑制或治愈缺陷、功能障碍、疾病或其他有害过程,包括干扰治疗和/或由治疗引起的过程。由本文所述药物或药物组合物都可用于临床以处理受试者。“受试者”是脊椎动物,优选哺乳动物,更优选人。哺乳动物包括但不限于人、家畜、竞技动物和宠物。需要用本发明的药物或药物组合物治疗的受试者包括肝癌受试者。因此,在某些实施例中,所述核酸存在于适于给药即生理上相容的组合物中。因此,组合物通常还包括一种或多种缓冲剂(例如中性缓冲盐水或磷酸缓冲盐水)、碳水化合物(例如葡萄糖、甘露糖、蔗糖或葡聚糖)、甘露醇、蛋白、多肽或氨基酸例如甘氨酸、抗氧化剂、抑菌剂、螯合剂例如edta或谷胱甘肽、佐剂(例如氢氧化铝)、使所述制剂与接体的血液相比等渗、低渗或稍微高渗的溶质、助悬剂、增稠剂和/或防腐剂。在其他实施例中,所述核酸可以存在于适于冷冻或储藏的组合物中。在许多实施例中,用于给予受试者的所述核酸的纯度为约100%。在其他实施例中,其为95%-100%。在其他实施方式中,其为95%-100%。优选地,对于与其他核酸的混合物,所述百分比可为约10%-15%、15%-20%、20%-25%、25%-30%、30%-35%、35%-40%、40%-45%、45%-50%、60%-70%、70%-80%、80%-90%或90%-95%。或者,分离/纯度可以核酸倍增的形式表示,其中核酸已发生例如10-20、20-30、30-40、40-50或更多倍的核酸倍增。给定体积的核酸数量可通过广为人知的和常规的方法和仪器测定。给定体积的核酸混合物中的核酸的百分数可通过几乎一样的方法测定。可手动或通过使用自动核酸计数器容易地对核酸进行计数。给定体积的特定核酸可使用特异性染色和目测以及通过使用特异性结合试剂(一般为抗体)、荧光标记和荧光激活核酸分选器的自动化方法而测定。倚赖多种因素选择用于为给定用途给予所述核酸的剂型。在这些因素中,重要的是受试者的物种,待治疗的病症、功能障碍或疾病的性质及其在受试者中的状态和分布,其他待给予的疗法和试剂的性质,给药的最佳途径,经过该途径的残存性,给药方案以及其他本领域技术人员明了的因素。例如,具体地,合适载体和其他添加剂的选择会倚赖给药的确切途径和特定剂型的性质。例如,核酸活性可为基于核酸的疗法的效力的一个重要决定因素。这对于主要治疗和辅助治疗都是成立的当。目标位点不适于核酸接种时会产生另一个担心。这可能会阻止治疗性核酸到达该位点和/或移植到那里。本发明的多个实施例包括增加核酸活力和/或克服因接种和/或生长屏障而引起的问题的措施。受体细胞/培养基的水性悬液的最终配制一般包括将所述悬液的离子强度调节到等渗(即约0.1-0.2)以及将ph调节到生理ph(即约ph6.8-7.5)。所述最终制剂通常还含有液体润滑剂,例如麦芽糖,其必须为身体所耐受。示例性润滑剂成分包括甘油、糖原、麦芽糖等。基于有机聚合物的材料,例如聚乙二醇和透明质酸以及非纤维状胶原(优选琥珀酸化的胶原),也可用作润滑剂。这些润滑剂通常用于在注射位置上改善所注射生物材料的注射能力、润透性和分散性,以及通过改变所述组合物的粘性来降低推动力(spiking)。最后的配制是将所述核酸限定在可药用载体中。随后将所述核酸置于注射器或其他注射装置中以精确注射到组织缺损的位点上。术语“可注射”指所述制剂基本不需推动即可在正常压力和正常条件下以带有低至25号针头的注射器中给予。推动可导致组合物从注射器溢出而非注射到组织中。对于这一精确布置,需要细至27号(200μi.d.)甚至30号(150μi.d.)的针头。可通过这些针头挤出的最大颗粒大小是至少具有以下参数的复杂函数:颗粒最大尺寸、颗粒长宽比(长:宽)、颗粒刚性、颗粒表面粗糙度和影响颗粒之间粘性的有关因素、悬浮液的粘弹性,以及通过针头的流速。悬浮于牛顿流体种的刚性圆珠代表最简单的情况,而在粘弹性流体中的纤维性或有分支的颗粒似乎复杂得多。所述组合物的理想等渗性可使用氯化钠或其他可药用剂,例如右旋糖、硼酸、酒石酸钠、丙二醇、或其他无机或有机溶质实现。氯化钠特别优选用于含有钠离子的缓冲液。如果需要,可使用可药用的增稠剂将所述组合物的粘性保持在选定水平上。优选甲基纤维素,因为它可方便和经济地获得并且易于使用。其他合适的增稠剂包括例如黄原胶,羧甲基纤维素,羟丙基纤维素,卡波姆等。所述增稠剂的优选浓度取决于所选择的试剂。重要的是使用量可实现选定的浓度。粘性组合物通常是通过在溶液中加入所述增稠剂而制备的。可药用的防腐剂或稳定剂可用于增加细胞/培养基组合物的寿命。如果加入所述防腐剂,那么选择不影响所述核酸活性或效力的组合物完全在本领域技术人员的知识范围之内。本领域技术人员会认识到所述组合物的成分在化学上应为惰性的。这在化学和药学原理方面不对本领域技术人员构成问题。可使用本公开内容提供的信息、本文引用的和本领域通常可获得的文献,参考教科书或通过简单实验(不包括过度试验)可以容易地避免问题。无菌可注射溶液可通过以下方式制备:根据需要,将用于实现本发明的所述核酸与不同量的其他成分掺入所需量的合适溶剂中。在某些实施例中,所述核酸可被制成单位剂量的可注射形式,例如溶液、悬液或乳液。适于注射的药物制剂通常为无菌水性溶液和分散体系。用于可注射制剂的载体可为溶剂或分散介质,含例如水、盐水、磷酸缓冲盐水、多元醇(例如甘油、丙二醇和液体聚乙二醇等)以及它们的合适混合物。本领域技术人员可容易地确定将在本发明方法中给予的组合物中的细胞和可选添加剂、媒介(vehicle)和/或载体的量。通常,任何添加剂(除所述细胞以外)都以0.001wt%-50wt%的量存在于溶液例如磷酸缓冲盐水中。所述活性组分以微克至毫克量级存在,例如约0.0001wt%到约5wt%,优选约0.0001wt%到约1wt%,最优选约0.0001wt%到约0.05wt%,或者约0.001wt%到约20wt%,优选约0.01wt%到约10wt%,最优选0.05wt%到约5wt%。在某些实施例中,将细胞封装以给药,特别是当胶囊化可提高治疗效力时或者提供处理和/或贮藏寿命上的优点时。在某些实施例中,当胶囊化增加细胞介导的免疫抑制的效力时,它也因此降低对免疫抑制药物治疗的需要。此外,在某些实施例中,胶囊化提供可进一步降低受试者对所述细胞(通常在同种异体移植中不是免疫原性的或者只是微弱免疫原性的)的免疫反应的针对受试者免疫系统的屏障,从而减轻由于给予所述核酸而可能发生的任何移植排斥或炎症。核酸可在植入前通过膜以及胶囊进行封装。应考虑到,可使用可用于核酸胶囊化的多种方法中的任意一种。在某些实施例中,所述核酸被单独封装。在某些实施例中,许多核酸被封装在同一膜内。在其中所述核酸在植入后被取出的实施例中,一个例如在单个膜内封装许多核酸的较大尺寸的结构可提供方便的回收方法。在微囊化核酸的多种实施例中可使用多种材料。这些材料包括例如聚合物胶囊,藻酸盐-聚-l-赖氨酸-藻酸盐微胶囊、聚-l-赖氨酸藻酸钡胶囊、藻酸钡胶囊、聚丙烯腈/聚氯乙烯(pan/pvc)中空纤维以及聚醚砜(pes)中空纤维。某些实施例将所述核酸加入聚合物中,例如生物聚合物或合成聚合物。生物聚合物的实例包括但不限于纤维连接蛋白、纤维蛋白、纤维蛋白原、凝血酶、胶原和蛋白多糖。其他因子例如上面讨论的细胞因子也可被加入所述聚合物中。在其他实施例中,核酸可被加入三维凝胶的空隙中。大的聚合物或凝胶通常通过手术植入。可配制成足够小的颗粒或纤维的聚合物或凝胶可通过其他常规的、更方便的、非手术的途径给予。具体地,对于治疗肝癌的情况,所述核酸可被封装在一个可植入受试者的装置中。核酸可被植入到肝脏中或肝脏附近或其他位置以取代或补充肝脏功能。核酸也可不在装置中而植入,例如现有的肝脏组织中。组合物可根据诸如具体患者的年龄、性别、体重和病症,以及将给药的制剂(例如固体或液体)等因素,按剂量并通过医药和兽医领域技术人员公知的技术给药。人类或其他哺乳动物的剂量可由技术人员根据本公开内容、本文引用的文献以及本领域的知识,不需过度实验而得出。适用于本发明多个实施例的核酸剂量取决于多种因素。其对于不同的情况可发生相当大的变动。可确定主要和辅助治疗的最佳给药剂量的参数包括下面的一些或全部:要治疗的疾病及其阶段;受试者的物种、它们的健康、性别、年龄、体重和代谢速率;受试者的免疫活性;其他正在给予的疗法;以及根据受试者的历史或基因型预测的可能并发症。所述参数还可包括:所述细胞是同基因的、自体的、同种异体的还是异种的;它们的效能(具体活性);使所述核酸有效而必须靶向的位点和/或分布;以及所述位点的这些特性例如核酸的可达性和/或核酸的植入性。其他参数包括与其他因子(例如生长因子和细胞因子)的共给药。给定情况下的最佳剂量还要考虑将核酸制剂的方式、给予它们的方式、给药后核酸定位到靶标位点的程度。最后,最佳剂量的确定必须提供这样的有效剂量,即所述剂量既不低于最大有益效果的阈值也不高于剂量相关的有害作用超过增加剂量的益处的阈值。对于某些实施例,核酸的最佳剂量处在用于自体、单核骨髓移植的剂量范围内。对于非常纯的核酸制剂,在不同实施例中,每次给药的最佳剂量可为104~108个细胞/kg接受者质量。在某些实施例中,每次给药的最佳剂量为105~107个细胞/kg。在许多实施例中,每次给药的最佳剂量为5×105~5×106个细胞/kg。应理解,单份剂量可一次、分份或在一段时间内连续递送。也可将整份剂量递送到一个位置或分散到若干个位置。在各种实施例中,核酸可以一个初始剂量给药,然后通过再次给药保持。核酸可在开始通过一种方法给药,然后通过相同方法或者一种或多种不同方法给药。水平可通过继续给予所述核酸而保持。各种实施例通过静脉注射在开始时给予所述核酸和/或保持它们在受试者中的水平。在多种实施例中,可根据患者的病情和本文其他地方讨论的其他因素使用其他给药形式。应注意,人类受试者接受治疗的时间通常长于实验动物,然而,治疗的长度通常与疾病过程和治疗效果的长度成比例。本领域技术人员会考虑使用在人和/或动物(诸如大鼠、小鼠、非人灵长类等)中实行的其他方法的结果,以确定用于人的合适剂量。基于这些考虑并根据本公开内容和现有技术所提供的指导的,这种确定可使技术人员不需过度实验而确定剂量。初始给药和再次给药或连续给药的合适方案可以都相同或者可以是变化的。合适方案可由技术人员根据本公开内容、本文引用的文献以及本领域的知识,不需过度实验而得出。治疗的剂量、频率和持续时间取决于许多因素,包括疾病的性质、受试者以及可能给予的其他疗法。因此,多种方案可用于给予所述核酸的受体细胞/培养基。在某些实施例中,将所述核酸以一个剂量给予受试者。在其他一些实施例中,将所述核酸以一系列的两个剂量或多个剂量连续给予受试者。在其中以一个剂量、两个剂量和/或多于两个的剂量给予细胞的其他一些实施例中,剂量可相同或不同,并且给药之间的间隔可相同或不同。核酸可在各种不同时间内以多种频率给药。在某些实施例中,核酸在小于1天的时间内给药。在其他实施例中,它们在2、3、4、5或6天的时间内给药。在某些实施例中,核酸在数周的时间内以每周一次或多次给药。在其他实施例中,核酸在数周的时间内给药持续一到数月。在多种实施例中,核酸可在数月的时间内给药。在其他实施例中,核酸可在一或数年的时间内给药。通常治疗长度是与疾病过程的长度、所用疗法的效果以及要治疗的受试者的情况和反应成比例的。下面详细描述本发明的实施例,需要说明的是下面的实施例,仅仅是为了说明本发明,而不以任何方式限制本发明。另外,在下面实施例中所采用的试剂和材料也均是市售可得的,如果未明确说明,则所采用的方法和条件,也均按照公知的方法和条件进行相关处理。实施例1在本实施例中,发明人详细介绍了lncrna-muf的定量过程。1、总rna的提取(1)将实验组细胞以及对照组细胞消化后,pbs清洗一次,直接加入1mltrizol试剂,反复吹打至澄清,室温放置5min;-70℃保存。(2)融化后的trizol处理的细胞,加入0.2ml氯仿(1/5trizol体积),盖紧离心管盖剧烈振荡15s,室温放置2~3min,4℃,12000g,离心15min;(3)可见上层水相,中间混合相,下层红色的酚相,将上层水相(约0.5ml)转移至一个新的depc处理的1.5ml离心管中,加入0.5ml异丙醇后颠倒混匀,室温静置10min,4℃,12000rpm,离心10min;(4)弃上清,留下胶样粘液,加入75%的乙醇(depc水配置)1ml摇振洗涤后,4℃,7500rpm,离心5min;(5)弃上清,室温真空干燥5~10min,以20μldepc水反复抽吸溶解rna,rna浓度测定后,-70℃保存备用。注意:操作过程中戴口罩手套并注意更换,以防止rna被rna酶降解。2、cdna合成用m-mlv反转录酶进行cdna的合成,反应体系(20μl体系)及过程如下所述:(1)在0.2mlpcr管加入以下试剂:总rna1μgoligodt2μldepc水补至12μl于70℃保温10min,然后迅速置于冰上,冷却2min以上。(2)在另一个0.2ml的pcr管加入以下试剂:5×m-mlv缓冲液4μldntp混合物(10mm)2μlrna酶抑制剂(40u/μl)0.5μlm-mlvrt酶(5u/μl)1μldepc水补至8μl(3)将上述两管液体混合,按以下条件进行反转录反应:42℃60min→70℃15min→冰上冷却,最后将反转录产物用于pcr反应或于-20℃保存。3、pcr扩增目的基因反转录产物(cdna)进行pcr扩增,内参基因为gapdh。pcr扩增体系(20μl)构成及反应条件如下所述:10×pcr缓冲液2μldntp混合物(2.5mm)2μl引物(上下游)1μlrtaq酶0.2μlcdna1μlddh2o13.8μl反应条件:94℃5min,(94℃30s,tm30s,72℃30s)×30cycles,72℃7min,4℃∝。其中tm因不同基因而异。其中,用于扩增lncrna-muf的引物如下所示:上游引物:accactacactcagccaaatac(seqidno:7);下游引物:ggctatcaactgtctcctttagac(seqidno:8)。pcr产物分析:pcr产物于2%琼脂糖凝胶上电泳分离,紫外光下照相分析。实施例2发明人将肝癌细胞huh7、hepg2、7721、hep3b、97l与肝癌间充质干细胞共培养,通过lncrna芯片技术,比较了肝癌msc共培养前后肝癌细胞lncrna表达谱,条件设置为在任意三个细胞系均差异2倍以上的lncrna,结果显示,17个lncrna(约30%)下调表达,其余40个lncrna(约70%)显著上调,如图1所示。其中lncrna-muf显著上调的芯片分析统计结果如图2a所示。发明人进一步采用实施例1所述的方法,定量分析了肝癌msc共培养前后肝癌细胞lncrna-muf,结果如图2b所示,此结果与芯片分析结果一致,均显示肝癌msc与肝癌细胞共培养后,肝癌细胞lncrna-muf的表达量显著增高。另外,发明人将肝癌细胞在tgf-beta1处理后,肿瘤细胞中的lncrna-muf也显著上调表达,结果如图2c和图2d所示。更进一步地,发明人对取自不同患者的肝癌肿瘤组织及癌旁组织中lncrna-muf,依据实施例1所述的方法,进行了定量分析,结果如图3所示,结果显示,肝癌细胞中lncrna-muf的表达显著下调。实施例3在本实施例中,发明人详细介绍了携带有沉默lncrna-muf的核酸的慢病毒感染肝癌细胞的实验过程、肝癌干细胞肿瘤球的形成情况。(1)培养293t细胞。选择生长状态良好,长至80%汇合时即可转染,传代超过20代后不应使用。(2)制备dna-lipofectamine2000复合物。在一个无菌的5ml管中,加入1.5ml无血清opti-mem培养基,并依次加入4μgrre,2μgrsv-rev,2μgvsvg和8μg慢病毒表达沉默质粒,轻轻混匀。在另一个无菌的5ml管中,将42μllipofectaminetm2000稀释于1.5ml无血清opti-mem培养基中,轻轻混匀,室温放置5min。(注意,吸取lipofectaminetm2000前要轻轻混匀。)混合以上2管液体,轻轻混匀。室温孵育20min以形成dna-lipofectaminetm2000复合物。(3)在dna-lipid复合物形成过程中,将已生长至80%融合的293t细胞更换9ml新鲜的含血清的生长培养基。(注意:培养基中不能含有抗生素。)(4)将dna-lipofectaminetm2000复合物加入到含有新鲜生长培养基的10cm细胞培养皿中。(注意:培养基中不能含有抗生素。)(5)轻轻地前后移动培养皿混匀。将细胞置于37℃,5%co2细胞培养箱中培养8-10h。(6)用10ml包含丙酮酸钠的完全培养基(高糖dmem,10%胎牛血清,2mml-谷氨酰胺,1%青-链霉素,1mm丙酮酸钠)更换含有dna-lipofectamine复合物的培养基。vsvg糖蛋白会使293t融合形成多核合胞体,这种形态上的改变是正常的,不影响慢病毒的产生。(7)转染48h~72h后收集上清于15ml无菌离心管中。(注意:此时操作的是有感染性的病毒,请带口罩和手套。)(8)4℃,1000rpm离心5min去除细胞碎片,0.45μm滤膜过滤,按毒液/40%peg体积比3:1的比例加入15ml塑料离心管,4℃转式摇床摇动混匀5-6h。(9)4℃,3000rpm离心30min,用1ml含血清的新鲜培养基重悬病毒冻存于-70℃冰箱备用。(10)病毒感染肝癌huh7和plc细胞。取生长状态良好的huh7和plc细胞,加入上述制备的荧光素酶载体的慢病毒毒液,同时加入8μg/ml的polybrene,置于37℃,5%co2的细胞培养箱。培养24h后去除毒液,添加完全培养基,待细胞生长80~90%汇合时,传代扩增至75cm2培养瓶后,进行流式分选gfp阳性细胞进行培养。发明人进一步观察了上述转染了携带沉默lncrna-muf的核酸的慢病毒的肝癌细胞的肝癌干细胞球的形成情况,结果如图4a所示,结果显示,沉默(干涉)lncrna-muf能够显著抑制肝癌干细胞肿瘤球的形成。实施例4在本实施例中,发明人详细介绍了裸鼠皮下成瘤模型的构建过程和成瘤情况的观察。操作过程如下:1)常规培养所用的对照细胞(转染空载质粒的肝癌细胞)或转染了携带有沉默lncrna-muf的核酸的慢病毒载体的肝癌细胞,扩增足够数量,准备接种。2)胰酶消化细胞,离心收集后进行细胞计数,用含有20%matrigel的pbs重悬细胞。一般接种量是0.2ml/只,其中含有4×106个肿瘤细胞。将准备注射的细胞置于冰上。3)待注射的裸鼠用乙醚进行短暂昏迷,用1ml注射器将细胞悬液打到侧腹部皮下,或者肩背部皮下。每只裸鼠左右两侧分别为对照组和实验组。4)实验裸鼠继续饲养约一个月,定时观察肿瘤变化,如用游标卡尺测量肿瘤体积并记录数值,取出瘤体后测量重量并记录数值,进行统计学分析。实验结果如图4b所示,结果显示,沉默(干涉)lncrna-muf能够显著抑制肝癌体内肿瘤形成。实施例5在本实施例中,发明人详细介绍了matrigel侵袭实验的实验过程。(1)制备侵袭小室:matrigel胶在常温下很快会凝固,因此,将其从-20℃取出后置于4℃融解,且整个过程都置于冰上操作。用无血清培养基稀释(1:5~1:8)后,取400μl铺到transwell膜上,将transwell小室放在6孔板中,于37℃孵箱放置3h使其凝固。(2)接种细胞:实验用细胞(包括对照细胞,即转染空载质粒的肝癌细胞<97l和lm3细胞>或转染了携带有沉默lncrna-muf核酸的慢病毒质粒的肝癌细胞<97l和lm3细胞>)消化离心后,用无血清培养基重悬。在小室内加入1ml肿瘤细胞悬液,细胞数为3×105~6×105(依肿瘤细胞侵袭能力选择合适的细胞数)。小室外加入3ml含1.5%胎牛血清的培养基。(3)培养细胞:常规培养24~48h(依肿瘤细胞侵袭能力而定)。(4)固定及染色:取出transwell小室,pbs洗一次,用棉签擦去微孔膜上层的细胞,用1%结晶紫-甲醛溶液进行固定并染色20~30min,吸去染色液,然后用自来水缓慢洗去残留染色液,空气干燥。(5)镜检:在倒置显微镜下拍照,每个样品计数5个视野,计数后进行统计学分析。实验结果如图5所示,结果显示,沉默lncrna-muf能够显著抑制肝癌干细胞侵袭能力。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1