阿匹莫德在结肠直肠癌治疗中的用途的制作方法
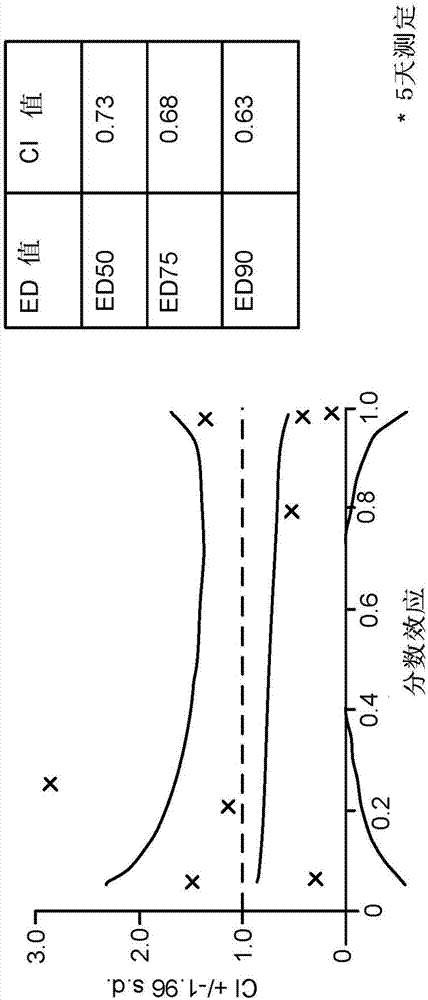
相关申请本申请要求2014年11月7日提交的美国专利申请序列号62/077127、2015年2月12日提交的美国专利申请序列号62/115228和2015年2月23日提交的美国专利申请序列号62/119540的优先权,其内容通过引用由此全文并入。发明领域本发明涉及包含阿匹莫德(apilimod)的组合物和使用其治疗结肠直肠癌的方法。发明背景结肠直肠癌持续是一个严重的健康问题。全球来看,它是第三最常见的癌症,占所有病例的10%。在2012年,有140万例新病例,并且694000人死于结肠直肠癌。在美国,5年生存率大约为65%,这凸显对于更有效的治疗的需要。对于结肠直肠癌的治疗可包括手术、放疗、化疗和靶向疗法的一些组合。局限于结肠壁内的癌症可用手术治愈。但是在许多情况下,一旦癌症已经转移,则不可能将其完全清除或治愈。取决于转移的位置和转移有多大,治疗可包括化疗、手术、基因疗法、免疫疗法、放疗和这些的组合。仍存在对于结肠直肠癌的更有效治疗选择的需要。本发明解决了该需要。技术实现要素:本发明部分基于以下令人惊讶的发现:阿匹莫德在结肠直肠癌细胞(包括对其它疗法有抗性的结肠直肠癌细胞)中,并进一步与某些化疗剂组合,是高度细胞毒性剂。在一方面,本公开提供用于治疗有其需要的受试者的结肠直肠癌的组合物,所述组合物包含治疗有效量的阿匹莫德,或其药学上可接受的盐、溶剂化物、包合物、水合物、多晶型物、前药、类似物或衍生物。在实施方案中,所述阿匹莫德是二甲磺酸阿匹莫德。在实施方案中,所述结肠直肠癌是难以治疗的或转移的。在实施方案中,所述结肠直肠癌是iii期或iv期结肠直肠癌,如由世界卫生组织(worldhealthorganization)的tnm分期系统所定义。在实施方案中,所述组合物是口服剂型或适合于静脉内施用的剂型。在实施方案中,所述组合物进一步包含至少一种另外的活性剂。在实施方案中,所述至少一种另外的活性剂是治疗剂或非治疗剂,或其组合。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自蛋白激酶抑制剂、铂基抗肿瘤剂、拓扑异构酶抑制剂、核苷代谢抑制剂、烷化剂、插入剂、微管蛋白结合剂、braf抑制剂、及其组合。在实施方案中,所述治疗剂选自威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康、5-氟尿嘧啶、及其组合。在一个实施方案中,所述治疗剂是威罗菲尼或瑞格菲尼。在实施方案中,所述组合物进一步包含非治疗剂,其经选择以减轻阿匹莫德的一种或更多种副作用。在实施方案中,所述非治疗剂选自昂丹司琼、格拉司琼、多拉司琼和帕洛诺司琼或选自吲哚洛尔和利培酮。在一个方面,本公开提供用于治疗有其需要的受试者的结肠直肠癌的方法,所述方法包括向受试者施用治疗有效量的阿匹莫德,或其药学上可接受的盐、溶剂化物、包合物、水合物、多晶型物、前药、类似物或衍生物。在实施方案中,所述阿匹莫德是二甲磺酸阿匹莫德。在实施方案中,所述方法进一步包括向受试者施用至少一种另外的活性剂。所述至少一种另外的活性剂可为治疗剂或非治疗剂、或其组合。所述至少一种另外的活性剂可以含有阿匹莫德的单一剂型施用或以分开的剂型施用。在实施方案中,所述至少一种另外的活性剂是治疗剂。在实施方案中,所述治疗剂是b-raf酶抑制剂。在实施方案中,所述治疗剂是威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康、5-氟尿嘧啶。在实施方案中,所述方法包括在用于治疗结肠直肠癌的联合治疗方案中一起施用阿匹莫德和威罗菲尼。在实施方案中,所述结肠直肠癌是晚期结肠直肠癌。在一个实施方案中,所述晚期结肠直肠癌对单独的威罗菲尼有抗性。在实施方案中,所述至少一种另外的活性剂选自烷化剂、插入剂、微管蛋白结合剂、pd-1/pdl-1通路抑制剂、及其组合。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自威罗菲尼、5-氟尿嘧啶伊立替康卡培他滨奥沙利铂和瑞格菲尼及其组合。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自贝伐珠单抗雷莫芦单抗西妥昔单抗帕尼单抗伊匹木单抗帕姆单抗(keytrudatm)、达拉菲尼(tafinlartm)、威罗菲尼(zelboraftm)、曲美替尼(mekinisttm)、zviv-aflibercept纳武单抗及其组合。在实施方案中,所述至少一种另外的活性剂是pd-1/pdl-1通路抑制剂。在实施方案中,所述pd-1/pdl-1通路抑制剂选自帕姆单抗(keytruda)、阿维鲁单抗(avelumab)、阿特朱单抗(mpdl3280a)、纳武单抗(bms-936558)、pidilizumab(mk-3475)、msb0010718c和medi4736。在实施方案中,所述至少一种另外的活性剂是非治疗剂,经选择以减轻阿匹莫德的一种或更多种副作用。在一个实施方案中,所述非治疗剂选自昂丹司琼、格拉司琼、多拉司琼和帕洛诺司琼。在一个实施方案中,所述非治疗剂选自吲哚洛尔和利培酮。在实施方案中,所述阿匹莫德可以任何合适的剂型施用。在一个实施方案中,所述阿匹莫德以口服剂型施用。在另一实施方案中,所述剂型适合于静脉内施用。在一个实施方案中,所述剂型适合于静脉内施用,通过单次注射或通过滴灌袋施用。在此处描述的方法的实施方案中,所述受试者是人类结肠直肠癌患者。在一个实施方案中,所述需要根据此处描述的方法治疗的人类结肠直肠癌患者是患有晚期、恶性或转移的结肠直肠癌的患者。在实施方案中,所述需要治疗的人类结肠直肠癌患者是其癌症对于标准化疗方案难以治疗的患者。在实施方案中,所述需要治疗的人类结肠直肠癌患者是其结肠直肠癌在用标准化疗方案治疗之后已复发的患者。在实施方案中,所述标准化疗方案包含免疫治疗方案或靶向治疗方案。在实施方案中,所述免疫治疗方案包含一种或更多种治疗剂,其选自抗ctla4抗体(例如,伊匹木单抗)、pd-1/pdl-1通路抑制剂(例如,帕姆单抗(keytruda)、msb0010718c、medi4736、mpdl3280a、bms-936559)、纳武单抗(opdivo)、pidilizumab、amp-224和白介素-2(il-2、阿地白介素、proleukin)。在实施方案中,所述靶向治疗方案包含一种或更多种治疗剂,其选自braf抑制剂(例如,达拉菲尼(tafinlar)、索拉非尼(nexavar)和威罗菲尼(zelboraf))、mek抑制剂(例如,曲美替尼(mekinist))和kit抑制剂(例如,达沙替尼(sprycel)、伊马替尼(gleevec)和尼罗替尼(tasigna))。在实施方案中,所述pd-1/pdl-1通路抑制剂选自帕姆单抗(keytruda)、阿维鲁单抗、阿特朱单抗(mpdl3280a)、纳武单抗(bms-936558)、pidilizumab(mk-3475)、msb0010718c和medi4736。在实施方案中,所述方法是使用包含阿匹莫德和用于治疗结肠直肠癌的化疗方案的联合疗法治疗结肠直肠癌的方法。在一个实施方案中,所述阿匹莫德作为化疗方案的辅助疗法施用。在实施方案中,所述化疗方案包含达卡巴嗪、替莫唑胺、nab-紫杉醇、卡莫司汀、顺铂、卡铂和长春碱中的一种或更多种用于治疗恶性或转移的结肠直肠癌。在实施方案中,所述化疗方案包含威罗菲尼、达拉菲尼和曲美替尼中的一种或更多种用于转移的结肠直肠癌。在一个实施方案中,所述化疗方案包含高剂量白介素-2和伊匹木单抗中的一种或更多种。在一个实施方案中,本公开提供用于诱导或加强结肠直肠癌细胞中的自噬或细胞凋亡的方法。根据该实施方案,所述结肠直肠癌细胞可以在体外或在体内。在一个实施方案中,所述结肠直肠癌细胞在体外。在一个实施方案中,所述结肠直肠癌细胞在哺乳动物受试者体内。在一个实施方案中,所述结肠直肠癌细胞是晚期结肠直肠癌。在一个实施方案中,所述结肠直肠癌细胞是转移性细胞或已转移的细胞。在实施方案中,所述结肠直肠癌细胞具有braf突变体表型。在实施方案中,所述braf突变体表型的特征在于人类braf的v600e或v600k突变。本公开还提供用于诱导或加强结肠直肠癌细胞中的自噬或细胞凋亡的方法,所述方法包括使细胞接触包含阿匹莫德或其药学上可接受的盐、溶剂化物、包合物、水合物、多晶型物、前药、类似物或衍生物的组合物。在实施方案中,所述阿匹莫德是二甲磺酸阿匹莫德。本公开还提供用于鉴定使用包含阿匹莫德组合物和威罗菲尼的联合疗法治疗的人类结肠直肠癌患者的方法,所述方法包括对受试者癌症的生物样品测定以下中的一种或更多种:v600ebraf蛋白突变、v600kbraf蛋白突变、或其基因等效物,其中具有这些突变中任一种的受试者被鉴定为使用包含阿匹莫德组合物和威罗菲尼的联合疗法治疗的患者。在实施方案中,本公开还提供用于鉴定对于阿匹莫德敏感的结肠直肠癌的方法,所述方法包括测定来自癌症的癌细胞样品(例如活组织检查)的snx10基因的表达,其中癌细胞样品中的snx10高表达水平表明该细胞对于阿匹莫德敏感。在实施方案中,snx10基因表达水平相对于参考细胞系的snx10基因表达水平被称为‘高的’。例如,出于表明对于阿匹莫德的敏感性的目的,高于colo205细胞的活组织检查样品中的snx10基因表达水平可被认为是“高的”。附图简述图1:lam-002(二甲磺酸阿匹莫德)+奥沙利铂组合在hct116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应(fractionaleffect)图。图2:lam-002+瑞格菲尼组合在hct116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图3:lam-002+瑞格菲尼组合在rko细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50,ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图4:lam-002+伊立替康组合在hct116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图5:lam-002+5-氟尿嘧啶组合在hct116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图6:lam-002+威罗菲尼组合在hct116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图7:lam-002+威罗菲尼组合在rko细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图8:lam-002+威罗菲尼组合在ht-29细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图9:lam-002+威罗菲尼组合在hct-15细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图10:lam-002+威罗菲尼组合在sw1116细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图11:lam-002+威罗菲尼组合在sw480细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。图12:lam-002+威罗菲尼组合在sw620细胞中(5天试验)。a,显示细胞活力(%)的条形图。b,显示在ed50、ed75和ed90下测定的协同作用的组合指数(ci)vs分数效应图。发明详述本发明提供涉及在需要使用阿匹莫德治疗结肠直肠癌的受试者,优选人类受试者中此类治疗阿匹的组合物和方法。本发明通常涉及阿匹莫德的新用途,其基于令人惊讶的发现:阿匹莫德针对一系列癌细胞(包括众多结肠直肠癌细胞系)的细胞毒活性。此外,基于使用阿匹莫德和至少一种另外的治疗剂的联合疗法,本发明对结肠直肠癌治疗提供了新的治疗方法。本文中描述的联合疗法利用了阿匹莫德的独特的细胞毒活性,其在与其它治疗剂,包括例如抗癌剂结合时可提供协同效应。本公开通篇所用的术语“阿匹莫德”可以指阿匹莫德本身(游离碱),或可以涵盖阿匹莫德的药学上可接受的盐、溶剂化物、包合物、水合物、多晶型物、前药、类似物或衍生物,如下所述。在此处描述的用于治疗结肠直肠癌的方法的实施方案中,所述阿匹莫德是二甲磺酸阿匹莫德。阿匹莫德游离碱的结构显示在式i中:阿匹莫德的iupac名称是(e)-4-(6-(2-(3-甲基亚苄基)肼基)-2-(2-(吡啶-2-基)乙氧基)嘧啶-4-基)吗啉,并且cas号为541550-19-0。阿匹莫德可以例如根据美国专利号7,923,557和7,863,270以及wo2006/128129中描述的方法来制备。本文中所用的术语“药学上可接受的盐”是由例如酸和阿匹莫德组合物的碱性基团形成的盐。说明性的盐包括但不限于硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、苯磺酸盐(besylate)、龙胆酸盐(gentisinate)、富马酸盐、葡糖酸盐、葡萄糖醛酸盐(glucaronate)、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(例如1,1’-亚甲基-双-(2-羟基-3-萘甲酸盐))。术语“药学上可接受的盐”也指由具有酸性官能团,如羧酸官能团的阿匹莫德组合物与药学上可接受的无机或有机碱制备的盐。术语“药学上可接受的盐”也指由具有碱性官能团,如氨基官能团的阿匹莫德组合物与药学上可接受的无机或有机酸制备的盐。本文中所述的化合物的盐可以由母体化合物通过常规化学方法来合成,如pharmaceuticalsalts:properties,selection,anduse,p.hemrichstalil(编者),camilleg.wermuth(编者),isbn:3-90639-026-8,2002年8月中描述的方法。通常,此类盐可以通过使母体化合物与适当的酸在水中或在有机溶剂中或在二者的混合物中反应来制备。本文中所述的化合物的一种盐形式可以通过本领域技术人员熟知的方法转化成游离碱和任选转化成另一种盐形式。例如,可以通过使盐溶液经过含有胺固定相的柱(例如strata-nh2柱)来形成该游离碱。或者,该盐的水溶液可以用碳酸氢钠处理以分解该盐并沉淀出该游离碱。该游离碱可以随后使用常规方法与另一种酸结合。本文中所用的术语“多晶型物”指的是本发明的化合物(例如,阿匹莫德)或其络合物的固体结晶形式。相同化合物的不同多晶型物可以展现出不同的物理、化学和/或光谱性质。不同的物理性质包括,但不限于稳定性(例如,对热或光)、可压缩性和密度(在制剂和产品制造中是重要的),以及溶解速率(这可以影响生物利用度)。稳定性方面的差异可能来自于化学反应性(例如不同的氧化,使得剂型在由一种多晶型物组成时比由另一种多晶型物组成时更快速地变色)或机械特性(例如,由于动力学有利的多晶型物转化成热力学更稳定的多晶型物,片剂在储存时破裂)或二者(例如,一种多晶型物的片剂更容易在高湿度下破碎)的变化。多晶型物的不同物理性质可影响它们的加工。例如,一种多晶型物比另一种多晶型物可能更可能形成溶剂化物或可能更难以过滤或洗涤至不含杂质,这归因于例如其粒子的形状或粒度分布。本文中所用的术语“水合物”指的是本发明的化合物(例如,阿匹莫德)或其盐,其进一步包括化学计算量或非化学计算量的通过非共价分子间力结合的水。本文中所用的术语“包合物”指的是晶格形式的本发明的化合物(例如,阿匹莫德)或其盐,所述晶格包含具有捕获在其中的客体分子(例如溶剂或水)的空间(例如,通道)。本文中所用的术语“前药”指的是本文中所述的化合物(例如,阿匹莫德)的衍生物,其可以在生物条件(体外或体内)下水解、氧化或以其它方式反应以提供本发明的化合物。前药可以仅在生物条件下在此类反应时变为活性,或它们可以以其未反应形式具有活性。在本发明中设想的前药的实例包括,但不限于本文中所述的化合物(例如,阿匹莫德)的类似物或衍生物,其包含可生物水解部分,如可生物水解的酰胺、可生物水解的酯、可生物水解的氨基甲酸酯、可生物水解的碳酸酯、可生物水解的酰脲和可生物水解的磷酸酯类似物。前药的其它实例包括包含-no、-no2、-ono或-ono2部分的本文中公开的任一化学式的化合物的衍生物。通常可以使用熟知方法,如由burger’smedicinalchemistryanddrugdiscovery(1995),172-178,949-982(manfrede.wolff编著,第5版)描述的那些方法制备前药。本文中所用的术语“溶剂化物”或“药学上可接受的溶剂化物”是一个或更多个溶剂分子与本文中公开的化合物之一(例如,阿匹莫德)的缔合所形成的溶剂化物。术语溶剂化物包括水合物(例如,半水合物、一水合物、二水合物、三水合物、四水合物等等)。本文中所用的术语“类似物”指的是结构上类似于另一种但是在组成上略微不同的化合物(如一个原子被不同元素的原子替代,或存在特定官能团,或一个官能团被另一个官能团替代)。因此,类似物是在功能和外观方面而非在结构或来源方面类似于参照化合物或与之相当的化合物。本文中所用的术语“衍生物”指的是具有共同的核心结构并被本文中所述的各种基团取代的化合物。结肠直肠癌结肠直肠癌(也称为结肠癌、直肠癌或肠癌)是癌症在结肠或直肠中的发展。结肠癌根据tnm分期系统进行分期。tnm系统是使用最为广泛的癌症分期系统之一,并已被国际抗癌联盟(unionforinternationalcancercontrol,uicc)和美国癌症联合委员会(americanjointcommitteeoncancer,ajcc)采纳。tnm系统基于原发性肿瘤(t)的尺寸和/或程度(范围)、扩散至附近淋巴结(n)的量、和由癌细胞扩散至身体的其它部分形成的转移(m)或继发性肿瘤的存在。各个字母添加一个数字以表示原发性肿瘤的尺寸和/或程度和癌症扩散的程度。在结肠癌和直肠癌两种癌症中,在某些情况下除了手术之外,可使用化疗。在结肠和直肠癌的管理中加入化疗的决定取决于疾病的阶段,并且与早期(i和ii)(其中单独的手术是标准治疗)相比较,更通常用于晚期,例如,iii期和iv期。对于iii期和iv期结肠癌(其中癌症已经扩散至淋巴结或远端器官的癌症),氟尿嘧啶、卡培他滨或奥沙利铂化疗是标准治疗。若癌症广泛转移或无法切除,则使用保守治疗。使用的典型的化疗药物可包括卡培他滨、氟尿嘧啶、伊立替康和奥沙利铂。还可使用抗血管生成药物例如贝伐珠单抗或表皮生长因子受体抑制剂,例如西妥昔单抗和帕尼单抗。治疗方法本发明提供了通过向受试者施用治疗有效量的本发明的阿匹莫德组合物,从而在有其需要的受试者中治疗结肠直肠癌的方法,所述组合物包含阿匹莫德,或其药学上可接受的盐、溶剂化物、包合物、水合物、多晶型物、前药、类似物或衍生物。在一个实施方案中,所述阿匹莫德组合物包含阿匹莫德游离碱或二甲磺酸阿匹莫德。本发明进一步提供了阿匹莫德组合物用于制备可用于治疗结肠直肠癌的药物的用途。在本文描述的方法的情况下,施用至受试者的阿匹莫德组合物的量为治疗有效量。术语“治疗有效量”是指足够用于治疗受治疗的受试者的结肠直肠癌、减轻受治疗的受试者的结肠直肠癌的症状、降低受治疗的受试者的结肠直肠癌的严重度、或稳定受治疗的受试者的结肠直肠癌或引起受治疗的受试者的结肠直肠癌的消退、或增强或改善另一疗法,例如威罗菲尼的治疗效果的量。根据本文描述的方法,“有其需要的受试者”是患有结肠直肠癌的受试者。在一方面,所述受试者是患有恶性结肠直肠癌或晚期结肠直肠癌的人类患者。在这种情况下,“期”是指癌症的临床阶段。例如,0至2期结肠直肠癌或3期或4期结肠直肠癌。在实施方案中,所述受试者是患有3期或4期结肠直肠癌的人类患者。需要治疗的受试者还可为对于目前可用的治疗“无响应”或“难以治疗”的受试者。例如,所述受试者癌症可以是对使用威罗菲尼,或者奥沙利铂、瑞格菲尼、伊立替康、5-氟尿嘧啶中的一种或更多种的治疗有抗性,或是使用威罗菲尼,或者奥沙利铂、瑞格菲尼、伊立替康、5-氟尿嘧啶中的一种或更多种的治疗是难以治疗的。在实施方案中,需要治疗的受试者是患有由人类braf的v600e或v600k突变表征的癌症的受试者。在本公开的情况下,术语“无响应”和“难以治疗”是指根据标准医疗实践中对于临床响应的定义,受试者对于治疗的响应不是临床上显著的。联合疗法本发明还提供了包含联合疗法的方法。本文中所用的“联合疗法”或“共同疗法”包括施用治疗有效量的阿匹莫德组合物与至少一种另外的活性剂,作为意在由阿匹莫德组合物与另外的活性剂的共同作用提供有益效果的特定治疗方案的一部分。“联合疗法”并非意在涵盖施用两种或更多种治疗化合物作为单独的单一治疗方案的一部分,所述单一治疗方案偶然和任意地导致并未设想或预测的有益效果。在一个实施方案中,所述方法是使用包含阿匹莫德和用于治疗结肠直肠癌的化疗方案的联合疗法治疗结肠直肠癌的方法。在实施方案中,所述化疗方案包含威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康或5-氟尿嘧啶中的一种或更多种。所述至少一种另外的活性剂可以是治疗剂,例如抗癌剂或癌症化疗剂,或非治疗剂,及其组合。对于治疗剂,该组合的有益效果包括但不限于治疗活性化合物的组合所产生的药代动力学或药效动力学共同作用。对于非治疗剂,该组合的有益效果可以涉及减轻与组合中的治疗活性剂相关的毒性、副作用或不良事件。在一个实施方案中,所述至少一种另外的药剂是减轻阿匹莫德组合物的一种或更多种副作用的非治疗剂,所述一种或更多种副作用选自恶心、呕吐、头痛、头晕(dizziness)、眩晕(lightheadedness)、嗜睡和应激中的任意一种。在该实施方案的一个方面,该非治疗剂是血清素受体(也称为5-羟色胺受体或5-ht受体)的拮抗剂。在一方面,所述非治疗剂是5-ht3或5-ht1a受体的拮抗剂。在一方面,所述非治疗剂选自昂丹司琼、格拉司琼、多拉司琼和帕洛诺司琼。在另一方面,所述非治疗剂选自吲哚洛尔和利培酮。在一个实施方案中,所述至少一种另外的活性剂是治疗剂。在一个实施方案中,所述治疗剂是抗癌剂。在实施方案中,所述抗癌剂是威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康或5-氟尿嘧啶、及其组合。在实施方案中,所述抗癌剂是威罗菲尼或瑞格菲尼。在实施方案中,包含阿匹莫德的组合物与所述至少一种另外的活性剂一起在单一剂型中或在分开的剂型中施用。在一个实施方案中,所述剂型是口服剂型。在另一实施方案中,所述剂型适于静脉内施用。在一个实施方案中,所述抗癌剂是批准用于治疗结肠直肠癌的药物。此类药物的非限制性实例包括奥沙利铂、瑞格菲尼、伊立替康和5-氟尿嘧啶。在实施方案中,所述抗癌剂选自威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康和5-氟尿嘧啶。在实施方案中,所述至少一种另外的药剂是单克隆抗体,诸如,例如阿仑珠单抗、贝伐珠单抗、卡妥索单抗、西妥昔单抗、依决可单抗、吉姆单抗、奥法木单抗、帕尼单抗、利妥昔单抗、曲妥珠单抗、依库珠单抗、依法珠单抗、莫罗单抗-cd3、那他珠单抗、阿达木单抗、阿非莫单抗、赛妥珠单抗、戈利木单抗、英夫利昔单抗、巴利昔单抗、卡那奴单抗、达克珠单抗、美泊利单抗、托珠单抗、优特克单抗、替伊莫单抗(ibritumomabtiuxetan)、托西莫单抗、阿巴伏单抗、阿德木单抗、阿仑珠单抗、抗cd30单克隆抗体xmab2513、抗met单克隆抗体metmab、阿泊珠单抗、apomab、阿西莫单抗、巴利昔单抗、双特异性抗体2b1、兰妥莫单抗(blinatumomab)、brentuximabvedotin、卡罗单抗喷地肽、西妥木单抗、claudiximab、可那木单抗、达西珠单抗、地舒单抗、依库珠单抗、依帕珠单抗、厄马索单抗、达珠单抗、芬妥木单抗(figitumumab)、夫苏木单抗(fresolimumab)、加利昔单抗、ganitumab、吉妥珠单抗奥佐米星、glembatumumab、替伊莫单抗、依珠单抗奥佐米星、伊匹木单抗、来沙木单抗、林妥珠单抗、林妥珠单抗、鲁卡木单抗、马帕木单抗、马妥珠单抗、米拉珠单抗、单克隆抗体cc49、奈昔妥珠单抗(necitumumab)、尼妥珠单抗、奥法木单抗、奥戈伏单抗、帕妥珠单抗、ramacurimab、雷珠单抗、希普利珠单抗、sonepcizumab、他尼珠单抗、托西莫单抗、曲妥珠单抗、曲美木单抗(tremelimumab)、西莫白介素单抗、维妥珠单抗、维西珠单抗、伏洛昔单抗和扎鲁木单抗。在实施方案中,所述至少一种另外的抑制剂是braf抑制剂、mek抑制剂、pd-1/pdl-1通路抑制剂、或关卡抑制剂。在实施方案中,所述pd-1/pdl-1通路抑制剂选自帕姆单抗(keytruda)、阿维鲁单抗、阿特朱单抗(mpdl3280a)、纳武单抗(bms-936558)、pidilizumab(mk-3475)、msb0010718c和medi4736。在联合疗法的情况下,阿匹莫德的施用可以与一种或更多种另外的活性剂的施用同时或相继进行。在另一实施方案中,联合疗法的不同组分的施用可以以不同的频率进行。所述一种或更多种另外的剂可以在施用本发明的化合物之前(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之前)、同时或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之后)施用。所述一种或更多种另外的活性剂可以配制用于与阿匹莫德一起在单一剂型中共同施用,如本文中更详细地描述的那样。所述一种或更多种另外的活性剂可以与包含本发明的化合物的剂型分开施用。当该另外的活性剂与阿匹莫德组合物分开施用时,其可以通过与阿匹莫德组合物相同或不同的途径施用。优选地,与一种或更多种另外的剂组合施用阿匹莫德在受治疗的受试者中提供协同响应。在此上下文中,术语“协同”指的是该组合的功效比任一单独的单一疗法的累加效应更有效。与该组合中至少一种药剂在该组合之外的剂量和/或频率相比,根据本发明的联合疗法的协同效应可以允许使用更低的剂量和/或更低频率地施用所述药剂。该组合的另外的有益效果可能表现为避免或减少与单独使用该组合中的任一疗法(也称为单一疗法)相关的不良或不想要的副作用。“联合疗法”还包括与非药物疗法(例如手术或放射治疗)进一步组合施用本发明的化合物。当该联合疗法进一步包括非药物治疗时,所述非药物治疗可以在任何合适的时间进行,只要实现来自该治疗性化合物与非药物治疗的组合的共同作用的有益效果。例如,在适当的情况下,当从施用治疗性化合物中暂时(可能数天或甚至数周)移除非药物治疗时,仍实现该有益效果。根据本文描述的任何方法,阿匹莫德,例如二甲磺酸阿匹莫德的治疗有效量可以为大约0.001毫克/千克至大约1000毫克/千克、大约0.01毫克/千克至大约100毫克/千克、大约10毫克/千克至大约250毫克/千克、大约0.1毫克/千克至大约15毫克/千克的范围;或其中该范围的下限为0.001毫克/千克至900毫克/千克之间的任意量且该范围的上限为0.1毫克/千克至1000毫克/千克之间的任意量的任何范围(例如,0.005毫克/千克至200毫克/千克、0.5毫克/千克至20毫克/千克)。如本领域技术人员公认的那样,有效剂量还将根据治疗的疾病、施用途径、赋形剂使用、以及与其它治疗性治疗(如使用其它药剂)共同使用的可能性而变化。参见例如美国专利号7,863,270,其通过引用并入本文。在更具体的方面,以30-1000毫克/天(例如30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275或300毫克/天)的剂量方案施用阿匹莫德,例如二甲磺酸阿匹莫德至少1周(例如1、2、3、4、5、6、7、8、9、10、11、12、36、48或更多周)。优选地,阿匹莫德以100-1000毫克/天的剂量方案施用4或16周。替代地或随后地,阿匹莫德以每天两次100毫克-300毫克的剂量方案施用8周,或任选52周。替代地或随后地,阿匹莫德以每天两次50毫克-1000毫克的剂量方案施用8周,或任选52周。治疗有效量的阿匹莫德可以每天施用一次、每天两次至五次、每天最多两次或最多三次,或每天最多八次。在一个实施方案中,所述阿匹莫德每天施用三次、每天两次、每天一次,在3周周期中施用十四天(每天四次、每天三次或每天两次、或每天一次)和停药7天,在3周周期中最多施用五天或七天(每天四次、每天三次或每天两次、或每天一次)和停药14-16天,或每两天一次,或一周一次,或每两周一次,或每三周一次。在本文描述的方法的上下文中使用的“受试者”优选是人类受试者,但也可包括其它哺乳动物。所述哺乳动物可以是例如任何哺乳动物,例如人、灵长类动物、脊椎动物、鸟、小鼠、大鼠、家禽、狗、猫、牛、马、山羊、骆驼、绵羊或猪。术语“患者”指的是人类受试者。本发明还提供了用于治疗本文中所述的结肠直肠癌的单一疗法。本文中所用的“单一疗法”指的是向有其需要的受试者施用单一的活性剂(也称为治疗剂),例如阿匹莫德,和在实施方案中,二甲磺酸阿匹莫德。本文中所用的“治疗”(“treatment”,“treating”或“treat”)描述了为了抗击结肠直肠癌的目的对患者进行的管理和护理并包括缓解癌症的一种或更多种症状或并发症,包括,例如减慢癌症的生长、减慢或防止发生癌转移或进一步转移,和促进受治疗的受试者体内的一个或更多个肿瘤的消退。在实施方案中,施用如本文所述的组合物导致消除了所治疗的癌症的症状或并发症,但是,消除并不是必须的。在一个实施方案中,降低了所述症状的严重程度。在癌症的情况下,此类症状可以包括严重程度或进展的临床指标,包括肿瘤分泌生长因子、降解细胞外基质、变得血管化、丧失对并置组织(juxtaposedtissue)的粘附、或转移的程度,以及转移灶的数量。根据本文中所述的方法治疗结肠直肠癌可以导致肿瘤尺寸的减小。肿瘤尺寸的减小也被称为“肿瘤消退”。优选地,在治疗后,肿瘤尺寸相对于其治疗前的尺寸减小5%或更多;更优选地,肿瘤尺寸减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;且最优选地,减小超过75%或更多。肿瘤的尺寸可以通过任何可再现的测量手段来测量。可以以肿瘤直径来测量肿瘤的尺寸。根据本文中所述的方法治疗结肠直肠癌可以导致肿瘤体积的减小。优选地,在治疗后,肿瘤体积相对于其治疗前的尺寸减小5%或更多;更优选地,肿瘤体积减小10%或更多;更优选地,减小20%或更多;更优选地,减小30%或更多;更优选地,减小40%或更多;甚至更优选地,减小50%或更多;且最优选地,减小超过75%或更多。肿瘤体积可以通过任何可再现的测量手段来测量。根据本文中所述的方法治疗结肠直肠癌可以导致肿瘤数量的减少。优选地,在治疗后,肿瘤数量相对于治疗前的数量减少5%或更多;更优选地,肿瘤数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;且最优选地,减少超过75%。肿瘤数量可以通过任何可再现的测量手段来测量。肿瘤的数量可以通过对肉眼可见或在规定放大倍数下可见的肿瘤计数来测量。所述规定放大倍数优选为2×、3×、4×、5×、10×或50×。根据本文中所述的方法治疗结肠直肠癌可以导致在远离肿瘤原发部位的其它组织或器官中转移病灶数量的减少。优选地,在治疗后,转移病灶的数量相对于治疗前的数量减少5%或更多;更优选地,转移病灶的数量减少10%或更多;更优选地,减少20%或更多;更优选地,减少30%或更多;更优选地,减少40%或更多;甚至更优选地,减少50%或更多;且最优选地,减少超过75%。转移病灶的数量可以通过任何可再现的测量手段来测量。转移病灶的数量可以通过对肉眼可见或在规定放大倍数下可见的转移病灶计数来测量。所述规定放大倍数优选为2×、3×、4×、5×、10×或50×。根据本文中所述的方法治疗结肠直肠癌可以导致受治疗的受试者群体与仅接受载体的群体相比平均存活时间增加。优选地,平均存活时间增加超过30天;更优选地,增加超过60天;更优选地,增加超过90天;且最优选地,增加超过120天。群体的平均存活时间的增加可以通过任何可再现手段测量。例如可以通过对一群体计算在开始用活性化合物治疗后的平均存活时长来测量群体的平均存活时间的增加。例如还可以通过对一群体计算在完成用活性化合物的第一轮治疗后的平均存活时长来测量群体的平均存活时间的增加。根据本文中所述的方法治疗结肠直肠癌可以导致受治疗的受试者群体与接受采用并非如本文所述的阿匹莫德组合物的药物的单一疗法的群体相比平均存活时间的增加。优选地,平均存活时间增加超过30天;更优选地,增加超过60天;更优选地,增加超过90天;且最优选地,增加超过120天。群体的平均存活时间的增加可以通过任何可再现手段测量。例如可以通过对一群体计算在开始用活性化合物治疗后的平均存活时长来测量群体的平均存活时间的增加。例如还可以通过对一群体计算在完成用活性化合物的第一轮治疗后的平均存活时长来测量群体的平均存活时间的增加。根据本文中所述的方法治疗结肠直肠癌可以导致受治疗的受试者群体与仅接受载体的群体相比死亡率的降低。根据本文中所述的方法治疗结肠直肠癌可以导致受治疗的受试者群体与未受治疗的群体相比死亡率的降低。根据本文中所述的方法治疗结肠直肠癌可以导致受治疗的受试者群体与接受采用并非阿匹莫德组合物的药物的单一疗法的群体相比死亡率的降低。优选地,死亡率降低超过2%;更优选地,降低超过5%;更优选地,降低超过10%;且最优选地,降低超过25%。受治疗的受试者群体的死亡率的降低可以通过任何可再现手段测量。例如可以通过对一群体计算在开始用活性化合物治疗后每单位时间疾病相关死亡的平均数量来测量群体的死亡率的降低。例如还可以通过对一群体计算在完成用活性化合物的第一轮治疗后每单位时间疾病相关死亡的平均数量来测量群体的死亡率的降低。根据本文中所述的方法治疗结肠直肠癌可以导致肿瘤生长速率降低。优选地,在治疗后,肿瘤生长速率相对于治疗前的数目降低至少5%;更优选地,肿瘤生长速率降低至少10%;更优选地,降低至少20%;更优选地,降低至少30%;更优选地,降低至少40%;更优选地,降低至少50%;甚至更优选地,降低至少50%;且最优选地,降低至少75%。肿瘤生长速率可以通过任何可再现的测量手段来测量。肿瘤生长速率可以根据每单位时间肿瘤直径的变化来测量。在一个实施方案中,在治疗后,肿瘤生长速率可以为大约0,并被确定为保持相同尺寸,例如已经停止生长。根据本文中所述的方法治疗结肠直肠癌可以导致肿瘤再生长的降低。优选地,在治疗后,肿瘤再生长少于5%;更优选地,肿瘤再生长少于10%;更优选地,少于20%;更优选地,少于30%;更优选地,少于40%;更优选地,少于50%;甚至更优选地,少于50%;且最优选地,少于75%。肿瘤再生长可以通过任何可再现的测量手段来测量。例如通过测量在治疗后的现有肿瘤收缩之后肿瘤直径的提高来测量肿瘤再生长。肿瘤再生长的降低显示为治疗停止后肿瘤未能复发。本文中所用的术语“选择性”指的是倾向于在一个群体中比在另一群体中以更高频率发生。对比群体可以是细胞群体。优选地,如本文所述的阿匹莫德组合物与正常细胞相比选择性作用于过度增殖细胞或异常增殖细胞。本文中所用的“正常细胞”是不能被归类为“细胞增殖性障碍”的部分的细胞。正常细胞缺乏未受控制或异常的生长,或两者,所述未受控制或异常生长可导致不希望的病症或疾病的发展。优选地,正常细胞通常具有功能细胞周期关卡控制机制。优选地,阿匹莫德组合物选择性作用以调节一种分子靶(例如,靶激酶),但是不显著调节另一分子靶(例如,非靶激酶)。本发明还提供了选择性抑制酶(如激酶)的活性的方法。优选地,如果一事件在群体a中与群体b相比以大于两倍的更高频率发生,该事件相对于群体b在群体a中选择性发生。如果一事件在群体a中以大于五倍的更高频率发生,该事件选择性发生。如果与群体b相比,一事件在群体a中以大于十倍的更高频率发生;更优选地,大于五十倍;甚至更优选地,大于100倍;且最优选地,大于1000倍的更高频率在群体a中发生,则该事件选择性发生。例如,如果细胞死亡在病变或过度增殖细胞中与正常细胞相比以大于两倍的频率发生的话,细胞死亡将被称作在病变或过度增殖细胞中选择性发生。药物组合物和制剂本发明提供阿匹莫德组合物,其优选为适合用于哺乳动物,优选人类的药学上可接受的组合物阿匹。在这方面,该组合物可以进一步包含至少一种药学上可接受的赋形剂或载体,其中所述量对于治疗结肠直肠癌有效。在一个实施方案中,所述阿匹莫德组合物包含阿匹莫德游离碱或二甲磺酸阿匹莫德。在一个实施方案中,所述阿匹莫德组合物与至少一种另外的活性剂在单一剂型中组合。在一个实施方案中,所述组合物进一步包含抗氧化剂。在一个实施方案中,所述至少一种另外的活性剂选自烷化剂、插入剂、微管蛋白结合剂、pd-1/pdl-1通路抑制剂、皮质类固醇、及其组合。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自威罗菲尼、依鲁替尼、利妥昔单抗、多柔比星、泼尼松龙、长春新碱、万珂和依维莫司、及其组合。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自威罗菲尼、奥沙利铂、瑞格菲尼、伊立替康和5-氟尿嘧啶。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自帕姆单抗(keytruda)、阿维鲁单抗、阿特朱单抗(mpdl3280a)、纳武单抗(bms-936558)、pidilizumab(mk-3475)、msb0010718c和medi4736。在实施方案中,所述至少一种另外的活性剂是治疗剂,其选自达卡巴嗪、替莫唑胺、nab-紫杉醇、卡莫司汀、顺铂、卡铂、长春碱、伊匹木单抗、白介素-2(il-2,proleukin)、帕姆单抗(keytruda)、达拉菲尼(tafinlar)、威罗菲尼(zelboraf)、曲美替尼(mekinist)、达沙替尼(sprycel)、伊马替尼(gleevec)和尼罗替尼(tasigna)及其组合。在实施方案中,所述至少一种另外的活性剂是经选择以改善该阿匹莫德组合物的一种或更多种副作用的非治疗剂。在一个实施方案中,所述非治疗剂选自昂丹司琼、格拉司琼、多拉司琼和帕洛诺司琼。在一个实施方案中,所述非治疗剂选自吲哚洛尔和利培酮。在实施方案中,所述至少一种另外的活性剂选自braf的抑制剂、raf/mek/erk通路的抑制剂、mtor通路的抑制剂、pi3k抑制剂、双重pi3k/mtor抑制剂、src抑制剂、vegf抑制剂、janus激酶(jak)抑制剂、raf抑制剂、erk抑制剂、法尼基转移酶抑制剂、组蛋白脱乙酰酶抑制剂、抗有丝分裂剂、多重耐药外排抑制剂、抗生素和治疗抗体。在一个实施方案中,所述至少一种另外的活性剂选自法尼基转移酶抑制剂(例如,替吡法尼)、抗有丝分裂剂(例如,多西他赛)、组蛋白脱乙酰酶抑制剂(例如,伏立诺他)和多重耐药外排抑制剂。在一个实施方案中,所述mtor抑制剂选自雷帕霉素(也称为西罗莫司)、依维莫司、坦罗莫司、地磷莫司(ridaforolimus)、umirolimus、唑罗莫司、azd8055、ink128、wye-132、torin-1、吡唑并嘧啶类似物pp242、pp30、pp487、pp121、ku0063794、ku-bmcl-200908069-1、wyeth-bmcl-200910075-9b、ink-128、xl388、azd8055、p2281和p529。参见例如liu等人drugdisc.todayther.strateg.,6(2):47-55(2009)。在一个实施方案中,所述mtor抑制剂是反式-4-[4-氨基-5-(7-甲氧基-1h-吲哚-2-基)咪唑并[5,1-f][1,2,4]三嗪-7-基]环己烷羧酸(也称为osi-027),及其任何盐、溶剂化物、水合物和其它物理形式、结晶或非晶的。参见us2007/0112005。osi-027可以根据us2007/0112005来制备,其通过引用并入本文。在一个实施方案中,所述mtor抑制剂是oxa-01。参见例如wo2013152342a1。在一个实施方案中,所述pi3k抑制剂选自gs-1101(艾代拉里斯)、gdc0941(pictilisib)、ly294002、bkm120(buparlisib)、pi-103、tgx-221、ic-87114、xl147、zstk474、byl719、as-605240、pik-75、3-甲基腺嘌呤、a66、pik-93、pik-90、azd6482、ipi-145(duvelisib)、tg100-115、as-252424、pik294、as-604850、gsk2636771、bay80-6946(copanlisib)、ch5132799、cay10505、pik-293、tg100713、czc24832和hs-173。在一个实施方案中,所述双重pi3k/mtor抑制剂选自gdc-094、way-001、wye-354、way-600、wye-687、wyeth-bmcl-200910075-16b、wyeth-bmcl-200910096-27、ku0063794和kubmcl-200908069-5、nvp-bez235、xl-765、pf-04691502、gdc-0980(apitolisib)、gsk1059615、pf-05212384、bgt226、pki-402、vs-558和gsk2126458。参见例如liu等人drugdisc.todayther.strateg.,6(2):47-55(2009),其通过引用并入本文。在一个实施方案中,所述mtor通路抑制剂是与mtor通路中的蛋白(或编码该蛋白的核酸)结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、锁定核酸或适配体)。例如,该多肽或核酸抑制mtor复合物1(mtorc1)、mtor的调控相关蛋白(raptor)、哺乳动物致死sec13蛋白8(mlst8)、40kda的富含脯氨酸的akt底物(pras40)、含有dep结构域的mtor相互作用蛋白(deptor)、mtor复合物2(mtorc2)、mtor的雷帕霉素不敏感性伴随物(rictor)、g蛋白β亚基样蛋白(gβl)、哺乳动物应激激活的蛋白激酶相互作用蛋白1(msin1)、桩蛋白、rhoa、ras-相关c3肉毒杆菌毒素底物1(rac1)、细胞分裂控制蛋白42同系物(cdc42)、蛋白激酶cα(pkcα)、丝氨酸/苏氨酸蛋白激酶akt、磷酸肌醇3-激酶(pi3k)、p70s6k、ras和/或真核细胞翻译起始因子4e(eif4e)结合蛋白(4ebp),或编码这些蛋白之一的核酸。在一个实施方案中,所述src抑制剂选自博舒替尼、塞卡替尼、达沙替尼、帕纳替尼、kx2-391、xl-228、tg100435/tg100855和dcc2036。参见例如puls等人oncologist.2011年5月;16(5):566–578。在一个实施方案中,所述src抑制剂是与所述src蛋白或编码该src蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、锁定核酸或适配体)。在一个实施方案中,所述vegf抑制剂选自贝伐珠单抗、舒尼替尼、帕唑帕尼、阿西替尼、索拉非尼、瑞格菲尼、乐伐替尼和莫特塞尼。在一个实施方案中,所述vegf抑制剂是与vegf蛋白、vegf受体蛋白或编码这些蛋白之一的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代(morpholino)、锁定核酸或适配体)。例如,该vegf抑制剂是可溶性vegf受体(例如可溶性vegf-c/d受体(svegfr-3))。在一个实施方案中,所述jak抑制剂选自facitinib、鲁索替尼、巴瑞克替尼、cyt387(cas编号1056634-68-4)、来他替尼、帕克替尼和tg101348(cas编号936091-26-8)。在一个实施方案中,所述jak抑制剂是与jak(例如jak1、jak2、jak3或tyk2)或编码该jak蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代、锁定核酸或适配体)。在一个实施方案中,所述raf抑制剂选自plx4032(威罗菲尼)、索拉非尼、plx-4720、gsk2118436(达拉菲尼)、gdc-0879、raf265、az628、nvp-bhg712、sb90885、zm336372、gw5074、tak-632、cep-32496和lgx818(encorafenib)。在一个实施方案中,所述raf抑制剂是与raf(例如a-raf、b-raf、c-raf)或编码该raf蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代、锁定核酸或适配体)。在一个实施方案中,所述mek抑制剂选自azd6244(司美替尼)、pd0325901、gsk1120212(曲美替尼)、u0126-etoh、pd184352、rdea119(rafametinib)、pd98059、bix02189、mek162(比尼替尼,binimetinib)、as-703026(pimasertib)、sl-327、bix02188、azd8330、tak-733和pd318088。在一个实施方案中,所述mek抑制剂是与mek(例如mek-1、mek-2)或编码该mek蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代、锁定核酸或适配体)。在一个实施方案中,所述akt抑制剂选自mk-2206、krx-0401(哌立福辛)、gsk690693、gdc-0068(ipatasertib)、azd5363、cct128930、a-674563、pht-427。在一个实施方案中,所述akt抑制剂是与akt(例如akt-1、akt-2、akt-3)或编码该akt蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代、锁定核酸或适配体)。在一个实施方案中,所述法尼基转移酶抑制剂选自lb42708或替吡法尼。在一个实施方案中,所述法尼基转移酶抑制剂是与法尼基转移酶或编码该法尼基转移酶蛋白的核酸结合并抑制其表达水平或活性的多肽(例如抗体或其片段)或核酸(例如双链小干扰rna、短发夹rna、微小rna、反义寡核苷酸、吗啉代、锁定核酸或适配体)。在一个实施方案中,所述组蛋白调节抑制剂选自漆树酸、c646、mg149(组蛋白乙酰转移酶)、gskj4hcl(组蛋白脱甲基酶)、gsk343(抗ezh2活性物)、bix01294(组蛋白甲基转移酶)、mk0683(伏立诺他)、ms275(恩替诺特)、lbh589(帕比司他)、曲古抑菌素a、mgcd0103(mocetinostat)、他喹莫德、tmp269、nexturastata、rg2833、pdx101(贝利司他)。在一个实施方案中,所述抗有丝分裂剂选自灰黄霉素、酒石酸长春瑞滨、紫杉醇、多西他赛、长春新碱、长春碱、埃博霉素a、埃博霉素b、abt-751、cyt997(lexibulin)、酒石酸长春氟宁、fosbretabulin、gsk461364、on-01910(rigosertib)、ro3280、bi2536、nms-p937、bi6727(volasertib)、hmn-214和mln0905。在一个实施方案中,所述聚醚抗生素选自莫能菌素、尼日利亚菌素、缬氨霉素、盐霉素的钠盐。“药物组合物”是适于施用于受试者的呈药学上可接受形式的含有本文中所述的化合物的制剂。本文中所用的短语“药学上可接受的”指的是在合理的医学判断范围内适于与人类和动物的组织接触使用而不具有过度的毒性、刺激、过敏反应或其它问题或并发症,与合理的益处/风险比相称的那些化合物、材料、组合物、载体和/或剂型。“药学上可接受的赋形剂”指的是可用于制备药物组合物的赋形剂,其通常是安全、无毒且既非生物学上也非在其它方面不合意的,并包括兽医用途以及人类药学用途可接受的赋形剂。药学上可接受的赋形剂的实例包括但不限于无菌液体、水、缓冲盐水、乙醇、多元醇(例如甘油、丙二醇、液体聚乙二醇等等)、油、洗涤剂、悬浮剂、碳水化合物(例如葡萄糖、乳糖、蔗糖或葡聚糖)、抗氧化剂(例如抗坏血酸或谷胱甘肽)、螯合剂、低分子量蛋白或其合适的混合物。药物组合物可以以散装或以剂量单位形式提供。为了便于施用和剂量的均匀性,尤其有利的是以剂量单位形式配制药物组合物。本文中所用的术语“剂量单位形式”指的是适于作为用于待治疗的受试者的单一剂量的物理上离散的单位;各单位含有经计算以与所需药物载体结合产生所需治疗效果的预定量的活性化合物。本发明的剂量单位形式的规格由活性化合物的独特特性和要实现的特定治疗效果决定并直接取决于此。剂量单位形式可以是安瓿、小瓶、栓剂、糖衣丸、片剂、胶囊、iv袋、或在气溶胶吸入器上的单泵。在治疗应用中,在影响所选剂量的其它因素中,该剂量取决于药剂、接受的患者的年龄、体重和临床症状、以及施用该疗法的临床医生或从业者的经验与判断而变化。通常,该剂量应当为治疗有效量。剂量可以以毫克/千克/天的测量单位来提供(该剂量可以针对患者的体重(以千克计)、体表面积(以平方米计)和年龄(以岁计)来进行调节)。药物组合物的有效量是提供由临床医生或其他合格的观察者所注意到的客观上可鉴定的改善的量。例如,缓解失调、疾病或病症的症状。本文中所用的术语“剂量有效方式”指的是在受试者或细胞中产生所需生物效应的药物组合物的量。例如,该剂量单位形式可以包含1纳克至2毫克、或0.1毫克至2克;或10毫克至1克,或50毫克至500毫克,或1微克至20毫克;或1微克至10毫克;或0.1毫克至2毫克。该药物组合物可以采取任何合适的形式(例如液体、气溶胶、溶液、吸入剂、雾、喷雾;或固体、粉末、软膏剂、糊剂、霜剂、洗剂、凝胶、贴剂等等)用于通过任何所需途径施用(例如经肺、吸入、鼻内、经口、口腔、舌下、胃肠外、皮下、静脉内、肌肉内、腹膜内、胸膜内、鞘内、透皮、透粘膜、直肠等等)。例如,本发明的药物组合物可以是用于通过吸入或吹入(经口或鼻)的气溶胶施用的水溶液或粉末形式、用于口服施用的片剂或胶囊形式、适于通过直接注射或通过添加到用于静脉内输注的无菌输注液中来施用的无菌水溶液或分散液形式;或用于透皮或透粘膜施用的洗剂、霜剂、泡沫、贴剂、悬浮液、溶液或栓剂的形式。药物组合物可以是口服可接受的剂型的形式,包括但不限于胶囊、片剂、含服形式、锭剂(troche)、含片(lozenge),和乳液、含水悬浮液、分散液或溶液形式的口服液。胶囊可以含有本发明的化合物与惰性填料和/或稀释剂如药学上可接受的淀粉(例如,玉米、马铃薯或木薯淀粉)、糖、人造甜味剂、粉末状纤维素如结晶纤维素和微晶纤维素、面粉、明胶、树胶等等的混合物。在用于口服使用的片剂的情况下,通常使用的载体包括乳糖和玉米淀粉。也可以加入润滑剂如硬脂酸镁。对于以胶囊形式口服施用,可用的稀释剂包括乳糖和干燥的玉米淀粉。当口服施用含水悬浮液和/或乳液时,本发明的化合物可以悬浮或溶解在油相中,所述油相与乳化剂和/或悬浮剂结合。如果需要的话,可以加入某些甜味剂和/或调味剂和/或着色剂。药物组合物可以为片剂形式。该片剂可以包含单位剂量的本发明的化合物以及惰性稀释剂或载体如糖或糖醇,例如乳糖、蔗糖、山梨糖醇或甘露糖醇。该片剂可以进一步包含非糖衍生的稀释剂如碳酸钠、磷酸钙、碳酸钙、或纤维素或其衍生物如甲基纤维素、乙基纤维素、羟丙基甲基纤维素、以及淀粉如玉米淀粉。该片剂可以进一步包含粘合剂和造粒剂(如聚乙烯基吡咯烷酮)、崩解剂(例如可溶胀的交联聚合物,如交联的羧甲基纤维素)、润滑剂(例如硬脂酸盐)、防腐剂(例如对羟苯甲酸酯)、抗氧化剂(例如bht)、缓冲剂(例如磷酸盐或柠檬酸盐缓冲剂)和泡腾剂如柠檬酸盐/碳酸氢盐混合物。该片剂可以是包衣片剂。该包衣可以是保护膜包衣(例如蜡或清漆)或设计为控制活性剂释放的包衣,例如缓释(在摄取后预定滞后时间后释放活性物)或在消化道中的特定位置处释放。后者可以例如使用肠溶膜包衣(如以商品名出售的那些)来实现。片剂制剂可以通过常规压缩、湿法造粒或干法造粒方法来制造,并使用药学上可接受的稀释剂、粘合剂、润滑剂、崩解剂、表面改性剂(包括表面活性剂)、悬浮剂或稳定剂,所述试剂包括但不限于硬脂酸镁、硬脂酸、滑石、月桂基硫酸钠、微晶纤维素、羧甲基纤维素钙、聚乙烯基吡咯烷酮、明胶、藻酸、阿拉伯树胶、黄原胶、柠檬酸钠、复合硅酸盐、碳酸钙、甘氨酸、糊精、蔗糖、山梨糖醇、磷酸二钙、硫酸钙、乳糖、高岭土、甘露糖醇、氯化钠、滑石、干淀粉和糖粉。优选的表面改性剂包括非离子和阴离子表面改性剂。表面改性剂的代表性实例包括但不限于泊洛沙姆188、苯扎氯铵、硬脂酸钙、鲸蜡硬脂醇、聚西托醇乳化蜡、脱水山梨糖醇酯、胶体二氧化硅、磷酸盐、十二烷基硫酸钠、硅酸镁铝和三乙醇胺。药物组合物可以为硬或软明胶胶囊形式。按照该制剂,本发明的化合物可以为固体、半固体或液体形式。药物组合物可以为适于胃肠外施用的无菌水溶液或分散液形式。本文中所用的术语胃肠外包括皮下、皮内、静脉内、肌肉内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内和颅内注射或输注技术。药物组合物可以为适于通过直接注射或通过添加到用于静脉内输注的无菌输注液来施用的无菌水溶液或分散液的形式,并包含溶剂或分散介质,所述溶剂或分散介质包含水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)、其合适的混合物、或一种或更多种植物油。作为游离碱或药理学上可接受的盐的本发明的化合物的溶液或悬浮液可以在适当地混有表面活性剂的水中制备。下面给出合适的表面活性剂的实例。还可以例如在甘油、液体聚乙二醇及其在油中的混合物中制备分散液。除了存在于该制剂中的任何载体或稀释剂(如乳糖或甘露糖醇)之外,用于本发明的方法的药物组合物可以进一步包含一种或更多种添加剂。所述一种或更多种添加剂可以包含一种或更多种表面活性剂或由一种或更多种表面活性剂组成。表面活性剂通常具有一个或更多个长脂族链如脂肪酸,这使其能够直接插入细胞的脂质结构以增强药物渗透和吸收。通常用于表征表面活性剂的相对亲水性和疏水性的经验参数是亲水亲油平衡(“hlb”值)。具有较低hlb值的表面活性剂更疏水,且在油中具有更大的溶解度,而具有较高hlb值的表面活性剂更亲水,且在水溶液中具有更大的溶解度。因此,亲水性表面活性剂通常被认为是具有大于大约10的hlb值的那些化合物,且疏水性表面活性剂通常是具有小于大约10的hlb值的那些。但是,这些hlb值仅仅是指导,因为对于许多表面活性剂来说,取决于选择用于测定hlb值的经验方法,该hlb值可以相差多达大约8个hlb单位。用于本发明的组合物的表面活性剂尤其是聚乙二醇(peg)-脂肪酸和peg-脂肪酸单酯和二酯、peg甘油酯、醇-油酯交换产物、聚甘油脂肪酸、丙二醇脂肪酸酯、固醇和固醇衍生物、聚乙二醇脱水山梨糖醇脂肪酸酯、聚乙二醇烷基醚、糖及其衍生物、聚乙二醇烷基酚、聚氧乙烯-聚氧丙烯(poe-pop)嵌段共聚物、脱水山梨糖醇脂肪酸酯、离子表面活性剂、脂溶性维生素及其盐、水溶性维生素及其两亲性衍生物、氨基酸及其盐、以及有机酸和它们的酯和酸酐。本发明还提供包含用于本发明方法的药物组合物的包装和试剂盒。该试剂盒可以包含一个或更多个选自瓶子、小瓶、安瓿、泡罩包装和注射器的容器。该试剂盒可以进一步包括用于治疗和/或预防本发明的疾病、病症或失调的一个或更多个使用说明、一个或更多个注射器、一个或更多个涂敷器、或适于重构本发明的药物组合物的无菌溶液。除非另行说明,本文中使用的所有百分比和比率均按重量计。本发明的其它特征和优点由不同实施例显而易见。提供的实施例说明了可用于实践本发明的不同组分和方法。所述实施例不限制要求保护的发明。基于本公开,本领域技术人员可以鉴定和采用可用于实践本发明的其它组分和方法。实施例实施例1:阿匹莫德抑制各种结肠癌细胞系的增殖结肠癌细胞系hct116(braf野生型)和ht-29(braf突变的,v600e)细胞在dmem(corning)中生长,rko(braf突变的,v600e)在mem(corning)中生长,且hct-15(braf野生型)、sw1116(braf野生型)、sw480(braf野生型)和sw620(braf野生型)在rpmi-1640(corning)中生长并补充有10%fbs(sigmaaldrichf2442-500ml,lot12d370)和青霉素/链霉素(100x)(cellgroref30-002)。对于药物研究,将hct116、ht-29、rko、hct-15、sw1116、sw480和sw620细胞分别以每孔750、8000、300、480、1600、2000和2000个细胞接种到96孔板中,最终体积为50μl。用于这些研究中的阿匹莫德是二甲磺酸阿匹莫德。术语“lam-002”是指二甲磺酸阿匹莫德。对于单一治疗研究,在接种24小时后,将细胞仅用阿匹莫德(最终浓度为0.5-10000nm;3倍稀释,总共是10个稀释物)处理,或用以下中的一种来处理:威罗菲尼(最终浓度为56.6–30000nm;2倍稀释,总共是10个稀释物)、瑞格菲尼、奥沙利铂、5-氟尿嘧啶或伊立替康(所有药物筛选为最终浓度2.5–50000nm;3倍稀释,总共是10个稀释物)。所有药物稀释物制备成2x储备液和以50μl添加至适当孔中。将细胞处理120h,之后使用(promega)评估活力,其中未处理细胞的相对发光设定为100%活力,且各药物浓度表示为未处理细胞的百分比。ec50值使用graphpadprism(graphpadsoftware,inc)来确定。简言之,将原始数据进行log转化并随后使用其中数据被约束(底部=0,顶部=100)的非线性回归(曲线拟合)进行分析。对于阿匹莫德和威罗菲尼、瑞格菲尼、奥沙利铂、5-氟尿嘧啶或伊立替康中的每一种之间的协同作用的测定,将hct116、ht-29、rko、hct-15、sw1116、sw480和sw620细胞进行如上所述的接种。24h之后,用单独的二甲磺酸阿匹莫德(最终浓度为2-250nm;2倍稀释,总共是8个稀释物)、单独的威罗菲尼(最终浓度为234–30000nm;2倍稀释,总共是8个稀释物)、单独的奥沙利铂、伊立替康、5-氟尿嘧啶或瑞格菲尼(全部的最终浓度为195–25000nm;2倍稀释,总共是8个稀释物),或各浓度的甲磺酸阿匹莫德与各浓度的威罗菲尼、奥沙利铂、伊立替康、5-氟尿嘧啶或瑞格菲尼的组合(8x8矩阵)处理细胞。将细胞处理120h,之后使用(promega)评估活力,其中未处理细胞的相对发光设定为100%活力,且各药物浓度表示为未处理细胞的百分比。条形图显示单一浓度的阿匹莫德、单一浓度的威罗菲尼在细胞活力上的效果,以及药物(在单一药剂浓度下)的组合对细胞活力的效果。计算并显示期望值(阿匹莫德的活力分数乘以威罗菲尼的活力分数)。对于协同作用的计算,使用calcusyn(2.11版,biosoft)来确定如由chou等人所定义的组合指数(ci)(choutc,talalayp.quantitativeanalysisofdose-effectrelationships:thecombinedeffectsofmultipledrugsorenzymeinhibitors.advenzymeregul1984;22:27–55)。我们约束该分析以评估ci值,其在临床可实现的浓度范围内,并且其中分数效应(fa)大于0.75(即,在使用药物联合的情况下,细胞活力降低大于75%)。显示了ci相对于分数效应图(数据点表示为‘x’,线显示95%的置信区间),并且产生ci值>1的药物联合是拮抗性的,ci=1的是累加性的,而ci<1的是协同性的。另外,对于阿匹莫德和威罗菲尼显示在ed50、ed75和ed90下的ci值。对于使用阿匹莫德与奥沙利铂、伊立替康、瑞格菲尼和5-氟尿嘧啶的联合处理的细胞应用相同的方法。使用该方法,发现阿匹莫德在hct116细胞中与奥沙利铂、伊立替康、瑞格菲尼和5-氟尿嘧啶中的每一种都协同作用。阿匹莫德还在rko细胞中证实与瑞格菲尼的协同活性。还发现阿匹莫德与威罗菲尼在hct116、ht-29、rko、hct-15、sw1116、sw480和sw620细胞中是协同性的。这些数据证实阿匹莫德既可单独也可与其它抗癌剂在对抗结肠癌细胞方面协同作用。另外,数据显示阿匹莫德与威罗菲尼的联合在具有野生型braf的细胞以及含有突变braf(v600e)的细胞中显示协同活性,所述细胞通常对标准治疗有抗性。表1:阿匹莫德和威罗菲尼在结肠直肠癌细胞中的协同作用(5天测定)。细胞系braf状态ec50(nm)hct116wt10hct-15wt15sw1116wt12sw480wt24sw620wt9rko突变体(v600e)52ht-29突变体(v600e)19实施例2:snx10表达作为结肠癌细胞系中的lam-002响应的生物标志物snx10是涉及胞内运输的基因,其在进行鉴定赋予对lam-002的抗性的基因的高通量筛选中鉴定。snx10的基因切除赋予其对于lam-002治疗的抗性。这意味着snx10的过度表达将诱导对于lam-002的敏感性。为了验证该假设,在各种结肠癌系中将snx10的表达水平与lam-002敏感性相关联。表达概况获自公共数据库ccle(barretina,caponigro,stransky等人,thecancercelllineencyclopediaenablespredictivemodellingofanticancerdrugsensitivity.nature.2012年3月28号;483(7391):603-7)和cosmic(forbessa1,beared2,gunasekaranp2等人,cosmic:exploringtheworld'sknowledgeofsomaticmutationsinhumancancer.nucleicacidsres.2015年1月;43(数据库版次):d805-11)。r统计软件包(rdevelopmentcoreteam(2008).r:alanguageandenvironmentforstatisticalcomputing.rfoundationforstatisticalcomputing,vienna,austria.isbn3-900051-07-0)用于表达的归一化和相关性分析。为了确定lam-002在结肠癌细胞系中的敏感性,使用如上文对于ec50确定所述的10点剂量响应来计算ec90。结果显示snx10表达和lam-002敏感性之间的关系,由此表达较高水平的snx10的结肠癌细胞对于lam-002最为敏感(表2)。这些发现支持了snx10表达作为lam-002在结肠癌细胞中的敏感性的预测性生物标志物。表2:ec90和snx10基因表达当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1