相变纳米粒子的制作方法
相关申请的交叉引用
本申请主张由霍夫(hof)于2014年11月25日申请的美国专利临时申请案申请号为62/083,978的优先权,临时申请案名称:"相变纳米粒子",其公开内容引入本文作为参考。
本申请引用美国专利申请号为us13/392,037(公开号为us2012/0221081),申请人为霍夫,其为由霍夫(hof)于2010年8月22日申请的申请号为pct/il2010/000683(公开号为wo11/024,159),申请案名称:"相变纳米粒子",的国际专利申请的美国国家阶段申请,其主张下列美国专利申请案的优先权,其公开内容引入本文作为参考:
由霍夫于2009年08月24日申请的美国专利临时申请案申请号为61/275,068,临时申请案名称:"相变植体";
由霍夫于2009年08月24日申请的美国专利临时申请案申请号为61/275,071,临时申请案名称:"植入组件的形状和功能变化";
由霍夫于2009年08月24日申请的美国专利临时申请案申请号为61/275,089,临时申请案名称:"用于治疗癌症的相变材料"。
上述所有申请案之内容均有相关并入此处作为参考。
本发明的一些应用通常是有关于一种植入的医疗装置,本发明的一些应用特别是有关于一种相变材料的使用。
背景技术:
热疗是一种治疗癌症的方法,其向癌症患者的组织施加热量,以杀死组织内的癌细胞。热疗通常用于治疗癌症患者与结合其他疗法,如放射治疗和化学疗法联合治疗。
瓦式效应描述了大多数癌细胞主要通过糖酵解产生能量,随后进行乳酸发酵的观察,而不是像大多数健康细胞一样氧化丙酮酸。瓦式效应导致癌细胞比健康细胞(其他条件不变的情况下)消耗超过葡萄糖量的20倍以产生能量。
当将固体材料加热至其熔点时,材料承受相变至其液态。在相变过程中,材料会积聚一定量的热量,这就是所谓的熔化潜热,或是融合的焓变。当发生相变时,材料的温度保持相对恒定。
技术实现要素:
根据本发明的一些实施例,向患有癌症的受试者施用多个纳米粒子。所述纳米粒子通常具有以下特征:
(1)相对于健康细胞,多个纳米粒子优先与癌细胞结合。
(2)相对于受试者组织的能量吸收,多个纳米粒子优先吸收传递给受试者身体的能量。
(3)多个纳米粒子阻止癌细胞周围的健康组织被加热到大于一指定温度的一温度。
(4)多个纳米粒子在形状上至少部分地自我调节,多个纳米粒子被配置为可伸长为一椭圆体,例如穿过解剖屏障中具有大于最小阈值尺寸的一尺寸的一间隙,例如,对应于对多个纳米粒子施加的渗透压及/或流体压力。
需注意的是,通常多个纳米粒子将不会变得伸长到为一精确的几何椭圆形状,而是当最大程度地延长时将大致呈现为一椭圆形状。
一加热装置通常与向受试者施用的多个纳米粒子一起使用。加热装置作为一能量传递单元,其向受试者的身体传递能量,导致至少部分的癌细胞变热,使得加热的细胞变得损伤或破裂,导致细胞死亡。
因此,根据本发明的一些实施例,提供了用于患有癌症的受试者共同使用的装置,所述受试者的一身体包含多个癌细胞和多个非癌细胞,以及用于与被配置在所述受试者的身体的至少一部分,所述装置包括:
一纳米粒子,包括:
一内芯,包含一相变材料,所述相变材料被配置为通过承受一相变而吸收熔化潜热,所述相变选自于由固体转至液体以及凝胶转至液体所组成的群组,所述相变发生在一相变温度介于42℃至80℃之间;
一外层,设置在所述内芯周围,所述外层包括:
至少一种金属的多个纳米球;以及
一物质的多个分子,相对于非癌细胞优先与癌细胞结合;
其中所述纳米粒子具有一体积为至少65,000立方纳米;
其中所述纳米粒子可拉伸地构成一椭圆体,使得当所述纳米粒子最大拉伸时:
由所述椭圆体定义的多个半轴的每一个皆大于5纳米,并且
所述椭圆体的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,所述相变材料被配置为在一相变温度介于42℃和50℃之间承受所选择的相变。
依据部分实施例,所述相变材料被配置为在一相变温度介于50℃和60℃之间承受所选择的相变。
依据部分实施例,所述相变材料被配置为在一相变温度介于60℃和80℃之间承受所选择的相变。
依据部分实施例,所述纳米粒子被配置为对应于所述受试者的身体内的流体压力而变长。
依据部分实施例,所述纳米粒子被配置为对应于所述受试者的身体内的渗透压而变长。
依据部分实施例,所述纳米粒子被配置为通过可拉伸为一椭圆体而被阻止穿过所述受试者的一血脑屏障,使得即使当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴的每一个大于5纳米。
依据部分实施例,所述纳米粒子被配置为能够通过可拉伸为一椭圆体而穿过所述受试者的肝脏,使得当所述纳米粒子最大限度地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,所述纳米粒子被配置为能够通过可拉伸为一椭圆体而穿过所述受试者的多个腺体,使得当所述纳米粒子最大限度地伸长时,所述椭圆体的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,所述纳米粒子被配置为能够通过可拉伸为一椭圆体而穿过所述受试者的单核吞噬细胞系统,使得当所述纳米粒子最大限度地伸长时,所述椭圆体的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,所述纳米粒子被配置为能够通过可拉伸为一椭圆体而穿过所述受试者的脾脏,使得当所述纳米粒子最大限度地伸长时,所述椭圆体的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,所述相变材料被配置为通过吸收熔化潜热而防止所述纳米粒子被加热到大于所述相变温度的一温度。
依据部分实施例,所述纳米粒子可拉伸为一椭圆体,使得当所述纳米粒子最大限度地拉伸时,由所述椭圆体定义的每个半轴皆大于10纳米。
依据部分实施例,所述纳米粒子可拉伸为一椭圆体,使得当所述纳米粒子最大限度地拉伸时,所述椭圆体的所述多个半轴中的至少两个小于25纳米。
依据部分实施例,所述至少一种金属的所述多个纳米球被配置为使得所述纳米粒子相对于所述受试者的组织优先地从所述加热装置吸收能量。
依据部分实施例,所述至少一种金属的所述多个纳米球包括多个金纳米球。
依据部分实施例,所述物质的所述多个分子相对于非癌细胞优先与癌细胞结合且包括多个葡萄糖分子。
依据部分实施例,所述物质的所述多个分子相对于非癌细胞优先与癌细胞结合且包括一葡萄糖衍生物的多个分子。
依据部分实施例,所述物质的所述多个分子相对于非癌细胞优先与癌细胞结合且包括一葡萄醣类似物的多个分子。
依据部分实施例,所述物质的所述多个分子相对于非癌细胞优先与癌细胞结合且包括一抗体的多个分子。
依据部分实施例,所述纳米粒子还包括设置在所述内芯和所述外层之间的多个聚合物链,所述外层通过所述多个聚合物链结合到所述内芯。
依据部分实施例,所述聚合物链包含聚醚胺链。
依据部分实施例,所述纳米粒子还包括围绕所述外层设置的多个聚合物链。
依据部分实施例,所述聚合物链包含聚醚胺链。
依据部分实施例,所述多个聚合物链被配置为至少部分地覆盖至少所述外层免于受来自所述受试者的一单核吞噬细胞系统的吞噬细胞影响。
依据部分实施例,所述纳米粒子被配置为与一感应射频加热装置共同使用,并且其中所述多个纳米球被配置为由所述感应射频加热装置加热。
依据部分实施例,所述纳米粒子被配置为与以一指定频率传输射频能量的一感应射频加热装置共同使用,并且其中所述纳米球具有与所述指定频率对应的一谐振频率。
依据部分实施例,所述多个纳米球的每一个具有一直径介于1纳米至10纳米之间。
依据部分实施例,所述多个纳米球的每一个具有一直径介于3纳米至7纳米之间。
依据部分实施例,所述多个纳米球的每一个与所述外层的所有其它所述纳米球之间分开一最小间隔为0.3纳米至2纳米。
依据部分实施例,:所述多个纳米球的每一个与所述外层的所有其它所述纳米球之间分开一最小间隔为0.5纳米至1.5纳米。
依据部分实施例,所述内芯具有一体积为50,000立方纳米至270,000立方纳米。
依据部分实施例,所述内芯具有一体积为85,000立方纳米至145,000立方纳米。
依据部分实施例,所述纳米粒子的一体积为110,000立方纳米至700,000立方纳米。
依据部分实施例,所述纳米粒子的一体积为180,000立方纳米至525,000立方纳米。
依据部分实施例,:所述相变材料包括一有机相变材料。
依据部分实施例,所述相变材料包括石蜡。
因此,根据本发明的一些实施例,更提供了一种与患有癌症的一受试者共同使用的方法,所述受试者的一身体包含多个癌细胞和多个非癌细胞,所述方法包括步骤:
提供多个纳米粒子,所述多个纳米粒子的每一个包括:
内芯,包含一相变材料,所述相变材料被配置为通过承受一相变而吸收熔化潜热,所述相变选自于由固体转至液体以及凝胶转至液体所组成的群组,所述相变发生在一相变温度介于42℃至80℃之间;
一外层,设置在所述内芯周围,所述外层包括:
至少一种金属的多个纳米球;以及
一物质的多个分子,其相对于非癌细胞优先与癌细胞结合;
其中所述纳米粒子具有一体积为至少65,000立方纳米;
其中所述纳米粒子可拉伸地构成一椭圆体,使得当所述纳米粒子最大拉伸时:
由所述椭圆体定义的多个半轴的每一个皆大于5纳米,并且
所述椭圆体的所述多个半轴中的至少两个小于30纳米;以及
将所述多个纳米粒子施用于所述受试者。
依据部分实施例,所述方法更包括:在将所述多个纳米粒子施用于所述受试者后,使用一加热装置将所述受试者的身体的至少一部分加热至所述相变材料的所述相变温度。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述纳米粒子被配置为因应于所述受试者的身体内的流体压力而变长。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述纳米粒子被配置为因应于所述受试者的身体内的渗透压而变长。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:避免所述多个纳米粒子穿过所述受试者的一血脑屏障,由于所述多个纳米粒子的每一个可伸长成一椭圆体,使得即使当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴的每一个皆大于5纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:促进所述多个纳米粒子通过所述受试者的多个腺体,由于所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:促进所述多个纳米粒子通过所述受试者的一单核吞噬细胞系统,由于所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:促进所述多个纳米粒子通过所述受试者的一肝脏,由于所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴的至少两个小于30纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:促进所述多个纳米粒子通过所述受试者的一脾脏,由于所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于30纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用多个纳米粒子,所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于25纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用多个纳米粒子,所述多个纳米粒子的每一个可伸长成一椭圆体,使得当所述纳米粒子最大地伸长时,所述椭圆体定义的所述多个半轴中的至少两个大于10纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的所述外层的所述金属的所述多个纳米球包括多个金纳米球。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,相对于非癌细胞优先与癌细胞结合的所述物质包括葡萄糖。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,相对于非癌细胞优先与癌细胞结合的所述物质包括一葡萄糖衍生物。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,相对于非癌细胞优先与癌细胞结合的所述物质包括一葡萄醣类似物。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,相对于非癌细胞优先与癌细胞结合的所述物质包括一抗体。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:因应于所述受试者的身体的部分的加热,由于所述多个纳米粒子的内芯的相变材料吸收熔化潜热而防止所述纳米粒子被加热到大于所述相变温度的一温度。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:由于所述金属的所述多个纳米球吸收所述加热装置的能量,使所述多个纳米粒子相对于所述受试者的组织优先地从所述加热装置吸收能量。
依据部分实施例:
将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述相变材料被配置为在一相变温度介于42℃和50℃之间;以及
将所述受试者的身体的至少一部分加热至所述相变材料的相变温度,包括将所述受试者的身体的至少一部分加热至一温度为42℃至50℃之间。
依据部分实施例:
将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述相变材料被配置为在一相变温度介于50℃和60℃之间;以及
将所述受试者的身体的至少一部分加热至所述相变材料的相变温度,包括将所述受试者的身体的至少一部分加热至一温度为50℃至60℃之间。
依据部分实施例:
将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述相变材料被配置为在一相变温度介于60℃和80℃之间;以及
将所述受试者的身体的至少一部分加热至所述相变材料的相变温度,包括将所述受试者的身体的至少一部分加热至一温度为60℃至80℃之间。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个包括设置在所述内芯和所述外层之间的多个聚合物链,所述外层通过所述多个聚合物链结合到所述内芯。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述多个聚合物链包含聚醚胺链。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子中的每一个包括围绕其外层设置的多个聚合物链。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述多个聚合物链包含聚醚胺链。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:由于所述多个聚合物链被设置于所述多个纳米粒子中的每一个的所述外层,因此至少部分地覆盖所述多个纳米粒子的至少所述外层免于受来自所述受试者的一单核吞噬细胞系统的吞噬细胞的影响。
依据部分实施例,加热所述受试者的身体的所述部分的步骤包括:通过引导感应射频向所述多个纳米球加热,以加热所述受试者的身体的所述部分。
依据部分实施例,引导感应射频向所述多个纳米球加热的步骤包括:以一指定频率传输射频能量,所述纳米球具有与所述指定频率对应的一谐振频率。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,每个所述多个纳米粒子的每个所述多个纳米球的具有一直径介于1纳米至10纳米之间。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述多个纳米球的每一个具有一直径介于3纳米至7纳米之间。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,每个所述多个纳米粒子的每个所述多个纳米球与所述外层的所有其它所述纳米球之间分开一最小间隔为0.3纳米至2纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,每个所述多个纳米粒子的每个所述多个纳米球与所述外层的所有其它所述纳米球之间分开一最小间隔为0.5纳米至1.5纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述内芯具有一体积为50,000立方纳米至270,000立方纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个的所述内芯具有一体积为85,000立方纳米至145,000立方纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个具有一体积为110,000立方纳米至700,000立方纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的每一个具有一体积为180,000立方纳米至525,000立方纳米。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的所述内芯的所述相变材料包括一有机相变材料。
依据部分实施例,将所述多个纳米粒子施用于所述受试者的步骤包括:对所述受试者施用所述多个纳米粒子,所述多个纳米粒子的所述内芯的所述相变材料包括石蜡。
因此,根据本发明的一些实施例,更提供了一种方法,所述方法包括步骤:
合成一纳米粒子为具有至少65,000立方纳米的一体积,并且可拉伸地构成一椭圆体,使得当所述纳米粒子最大伸长时:
由所述椭圆体定义的多个半轴的每一个大于5纳米,并且
所述椭圆体的所述多个半轴的至少两个小于30纳米;
其中所述合成通过以下方式进行:
提供一内芯,所述内芯包含一相变材料,所述相变材料被配置为通过承受一相变而吸收熔化潜热,所述相变选自于由固体转至液体以及凝胶转至液体所组成的群组,所述相变发生在一相变温度介于42℃至80℃之间;及
将一外层结合到所述内芯,所述外层包括:
至少一种金属的多个纳米球;以及
一物质的多个分子,相对于非癌细胞优先与癌细胞结合。
依据部分实施例,提供所述内芯的步骤包括:提供所述内芯,所述内芯的相变材料具有介于42℃和50℃之间的一相变温度。
依据部分实施例,提供所述内芯的步骤包括提供所述内芯,所述内芯的相变材料具有介于50℃和60℃之间的一相变温度。
依据部分实施例,提供所述内芯的步骤包括提供所述内芯,所述内芯的相变材料具有介于60℃和80℃之间的一相变温度。
依据部分实施例,合成所述纳米粒子的步骤包括:合成可因应于流体压力延伸的所述纳米粒子。
依据部分实施例,合成所述纳米粒子的步骤包括:合成可因应于渗透压延伸的所述纳米粒子。
依据部分实施例,合成所述纳米粒子的步骤包括:将所述纳米粒子合成为可拉伸地构成一椭圆体,使得当所述纳米粒子最大限度地伸长时,所述椭圆体定义的所述多个半轴的每一个皆大于10纳米。
依据部分实施例,合成所述纳米粒子的步骤包括将所述纳米粒子合成为可拉伸地构成一椭圆体,使得当所述纳米粒子最大限度地伸长时,所述椭圆体定义的所述多个半轴中的至少两个小于25纳米。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:将所述外层与所述内芯结合,所述外层包括多个金纳米球。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:将所述外层与所述内芯结合,相对于非癌细胞优先与癌细胞结合的所述物质包括葡萄糖。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:将所述外层与所述内芯结合,相对于非癌细胞优先与癌细胞结合的所述物质包括一葡萄糖衍生物。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:将所述外层与所述内芯结合,相对于非癌细胞优先与癌细胞结合的所述物质包括一葡萄糖类似物。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:将所述外层与所述内芯结合,相对于非癌细胞优先与癌细胞结合的所述物质包括一抗体。1.依据部分实施例,将所述外层结合到所述内芯的步骤包括:通过多个聚合
物链将所述外层与所述内芯结合。
如权利要求89所述的方法,其特征在于:将所述外层结合到所述内芯的步骤包括:通过多个聚醚胺链将所述外层与所述内芯结合。
依据部分实施例,合成所述纳米粒子的步骤包括:结合多个聚合物链至所述外层,使所述多个聚合物链设置为围绕所述外层。
依据部分实施例,结合多个聚合物链至所述外层的步骤包括:结合多个聚醚胺聚合物的链至所述外层。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:结合一外层至所述内芯,所述外层的所述多个纳米球的每一个具有一直径介于1纳米至10纳米之间。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:结合一外层至所述内芯,所述外层的所述多个纳米球的每一个具有一直径介于3纳米至7纳米之间。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:结合一外层至所述内芯,所述外层的所述多个纳米球的每一个与所述外层的所有其它所述纳米球之间分开一最小间隔为0.3纳米至2纳米。
依据部分实施例,将所述外层结合到所述内芯的步骤包括:结合一外层至所述内芯,所述外层的所述多个纳米球的每一个与所述外层的所有其它所述纳米球之间分开一最小间隔为0.5纳米至1.5纳米。
依据部分实施例,提供所述内芯的步骤包括:所述相变材料包括提供一内芯,所述内芯具有一体积为50,000立方纳米至270,000立方纳米。
依据部分实施例,提供所述内芯的步骤包括所述相变材料包括:提供一内芯,所述内芯具有一体积为85,000立方纳米至145,000立方纳米。
依据部分实施例,合成所述纳米粒子的步骤包括:合成一体积为110,000立方纳米至700,000立方纳米的所述纳米粒子。
依据部分实施例,合成所述纳米粒子的步骤包括:合成一体积为180,000立方纳米至525,000立方纳米体积的所述纳米粒子。
依据部分实施例,提供包含所述相变材料的所述内芯的步骤包括:提供一内芯,所述内芯包含一有机相变材料。
依据部分实施例,提供包含所述有机相变材料的所述内芯的步骤包括:提供包含石蜡的一内芯。
为让本发明的上述内容能更明显易懂,下文特举优选实施例,并配合所附图式,作详细说明如下:
附图说明
图1a-1b是根据本发明部分实施例的患有癌症的一受试者,多个纳米粒子已被施用于所述受试者并已经与包含癌细胞的肿瘤结合的示意图;
图2a是根据本发明部分实施例当作为例示性目的时,所示纳米粒子为球形,所述纳米粒子的一横截面示意图;
图2b-2c是根据本发明部分实施例中所述纳米粒子为伸长结构,且所述纳米粒子成形为椭圆体的所述纳米粒子的各个横截面的示意图;以及
图3是根据本发明部分实施例向小鼠施用本文所述的纳米粒子的实验结果示意图。
具体实施方式
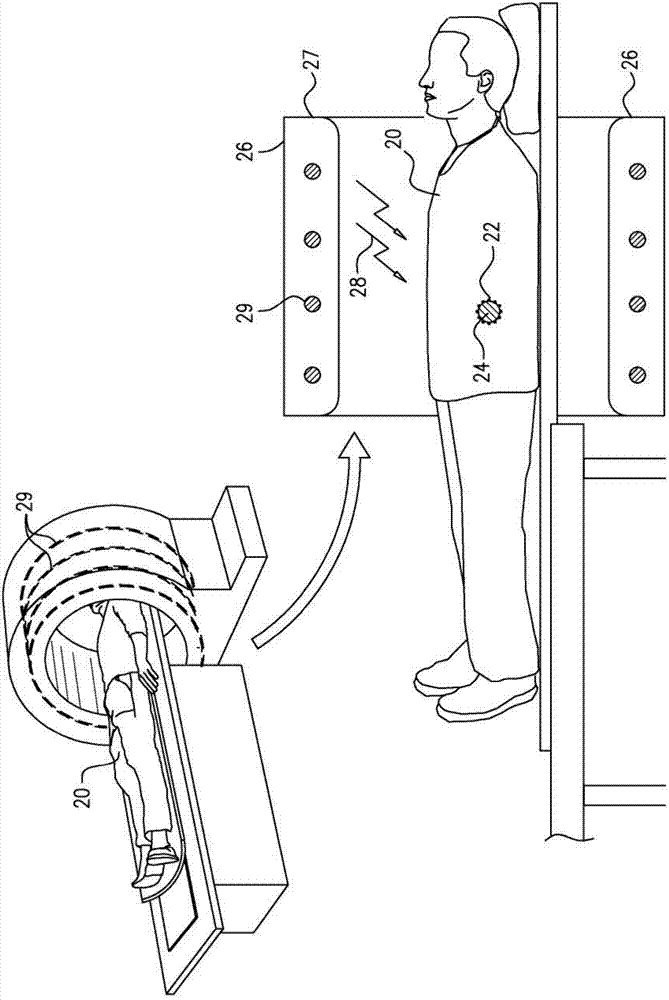
现在参考图1a-1b,其是患有癌症的一受试者20的示意图,根据本发明部分实施例,多个纳米粒子22已被施用于所述受试者,并且已经聚集在含有多个癌细胞的一肿瘤24上。如图1b所示,一加热装置26通常与向受试者施用的多个纳米粒子一起使用。所述加热装置将能量(由箭头28例示性地标示)传递到所述受试者的身体,使至少部分的癌细胞变热,使得加热的细胞变得损伤或破裂,导致细胞死亡。加热装置作为一能量传递单元。
如下列所述,所述纳米粒子通常具有以下特征:
(1)相对于健康细胞,多个纳米粒子优先与癌细胞结合。
(2)相对于受试者组织的能量吸收,多个纳米粒子优先吸收传递给受试者身体的能量。
(3)多个纳米粒子阻止癌细胞周围的健康组织被加热到大于一指定温度的一温度。
(4)多个纳米粒子在形状上至少部分地自我调节,多个纳米粒子被配置为可伸长为一椭圆体,例如穿过解剖屏障中具有大于最小阈值尺寸的一尺寸的一间隙,例如,对应于对多个纳米粒子施加的渗透压及/或流体压力。
需注意的是,通常多个纳米粒子将不会变得伸长到为一精确的几何椭圆形状,而是当最大程度地延长时将大致呈现为一椭圆形状。
依据部分实施例,与所述纳米粒子共同使用的加热装置26是一rf发射器,其通过感应射频加热来加热所述纳米粒子。图1b显示加热装置内的患者身体。如图1b所示的例子所示,所述加热装置(例如rf发射器)可以包括形状像一mri扫描仪的一壳体27,使得受试者的整个身体或者受试者的身体的整个部分(例如所示出的受试者的躯干)设置在所述壳体内。线圈29螺旋围绕壳体内部并且在受试者的身体的大致方向上传递能量。
可替换地或另外地,加热装置26可以包括设置在受试者的身体的相对侧(例如受试者的上方和下方)对应的传输和接收电极(例如电极板)。对于这样的应用,加热装置通常被配置为通过将电磁能从传输电极传输到接收电极来产生通过受试者的身体的至少一部分的电磁场。
更可替换地或另外地,加热装置26以不同于rf能量的形式差异地构成及/或传输能量至受试者的身体。例如,加热装置可以容纳在一便携式外壳中,并且外壳可以被指定尺寸为使得能量指向受试者的身体的特定部分。加热装置可以传输声波或超声波能量,及/或可以传输不同范围的电磁能量,例如光能、红外线能、uv能或微波能。根据本发明部分实施例,加热装置可以使用焦耳加热、磁加热、电磁加热、电泳加热及/或感应加热。
现在参考图2a,其是根据本发明部分实施例的纳米粒子22的横截面示意图。为了说明的目的,图2a示出了当纳米粒子构成球形时纳米粒子的横截面。并参考图2b和2c,其是所述纳米粒子为伸长结构,且所述纳米粒子成形为椭圆体的所述纳米粒子的各个横截面的示意图。需注意的是,为了说明的目的,纳米粒子的各个构成的相对尺寸在图2a-2c中未示出。
如图所示,纳米粒子22通常包括作为一相变材料的一内芯30。一外层32围绕所述内芯设置,所述外层包括至少一种金属的多个纳米球34。应注意的是,所述外层通常不是一连续层,而是所述多个纳米球的每一个与相邻的所述多个纳米球之间存在多个间隔,将如下文进一步详细描述。对于部分实施例,定义了相应的多个疏水端部和亲水端部的多个聚合物链36设置在所述内芯30和所述外层32之间,使得疏水芯结合到内芯内的相变材料上,亲水端部键合到第一外层的多个纳米球。对于部分实施例,如图所示,多个聚合物链37围绕外层32的外侧设置。
如图2a的放大部分所示,通常,一物质的多个分子38相对于非癌细胞优先与癌细胞结合到多个所述纳米球34。一般来说,多个葡萄糖分子及/或葡萄醣类似物的多个分子或葡萄糖衍生物的多个分子(例如氟脱氧葡萄糖和/或d-葡萄糖)被用作相对于非癌细胞优先与癌细胞结合的物质。一般来说,二十多倍的葡萄糖(或葡萄醣类似物或葡萄糖衍生物)分子可能与癌细胞结合如同与健康细胞结合。癌细胞对葡萄糖分子的优先摄取是基于瓦式效应,如前述在背景技术中所描述的,并且如kim等人,癌症研究;2006;“癌症分子的嗜糖和瓦式效应”66:(18),2006年9月15日,其通过引用并入本文。(癌细胞优先吸收葡萄糖分子的原理构成了某些正子断层扫瞄影像流程的基础。)对于部分实施例,使用葡萄糖(或葡萄醣类似物或葡萄糖衍生物),因为葡萄糖甚至被吸收到厌氧组织中,并且癌变组织通常是厌氧的。进一步来说,葡萄糖、葡萄醣类似物和葡萄糖衍生物与实体瘤和血液肿瘤结合。对于部分实施例,使用相对于非癌细胞优先与癌细胞结合的不同类型的分子(例如抗体、药物及/或激素)。
对于部分实施例,将多个纳米粒子系统地(例如口服及/或通过静脉注射)施用于受试者,并且纳米颗粒被配置为优先与癌细胞结合,这是因为纳米粒子包括的所述物质相对于非癌细胞优先与癌细胞结合。以这种方式,多个纳米粒子通常聚集在癌性肿瘤(例如图1a所示的肿瘤24)附近,并与肿瘤的细胞结合。对于部分实施例,即使癌症已经转移,多个纳米粒子聚集在一起并与转移的癌细胞结合。
通常,所述外层32包括至少一种金属的多个纳米球34。通常,纳米球34包括贵金属如钌、铑、钯、银、锇、铱、铂及/或金。对于部分实施例,纳米球34是顺磁金超原子纳米球。对于部分实施例,包括两种或多种金属或金属和非金属的混合物的合金被使用于纳米球34。
如上所述,所述外层32通常不是一连续层,而是所述多个纳米球的每一个与相邻的所述多个纳米球之间存在多个间隔。通常,所述多个纳米球的每一个的直径大于1纳米(例如大于3纳米)及/或小于10纳米(例如小于7纳米),例如在1纳米至10纳米之间,或在3纳米和7纳米之间。进一步来说,当纳米粒子22处于其球形构型(图2a)时,所述多个纳米球的每一个和相邻的纳米球之间的一间隔s大于0.3纳米(例如,大于0.5纳米),及/或小于2纳米(例如,小于1.5纳米),例如在0.3纳米和2纳米之间,或在0.5纳米和1.5纳米之间。纳米球之间的间隔允许纳米球相对于彼此移动,这有助于纳米粒子的具有自调节形状的特性。相反地,如果将所述外层32形成为一连续的金属层,则外层将是相对刚性的。纳米球之间的间隔通常不大于本文以上所述的最大间隔,以便防止受试者的单核吞噬细胞系统(即受试者的网状内皮系统)的吞噬细胞穿透外层32并破坏聚合物链36及/或内芯30的相变材料。
如上所述,加热装置26通常用于对受试者的身体传输能量(例如,rf能量)。例如,加热装置可以引导感应射频对受试者的身体加热(并且因此对多个纳米球)。对于部分实施例,加热装置以纳米球34的一共振频率及/或纳米球相对于受试者组织具有高能量吸收的一频率将能量引导到受试者的身体,使得纳米球相对于受试者的组织(例如受试者的健康组织)优先吸收来自加热装置的能量。多个纳米球吸收的能量用来加热多个纳米球。由于多个纳米粒子22通常聚集在癌细胞附近并与癌细胞结合,并且纳米球优先吸收向受试者传输的能量,癌细胞相对于受试者的健康细胞会优先被加热。
由于多个纳米粒子22聚集在癌细胞附近并与癌细胞结合,所以被加热装置加热的所述受试者的身体的区域内癌细胞的平均热通量密度(即,每单位面积的热量)通常比在被加热装置加热的区域内部的健康细胞的平均热通量密度大得多(例如两倍以上、大于5倍、大于10倍以上及/或大于20倍以上)。结果,加热装置对受试者的身体(或其部分)的加热通常是为了损害受试者的身体(或加热部分)中的癌细胞,而非实质上损伤其中的健康细胞。
纳米粒子22通常包括内芯30,其包括一相变材料。一般来说,在被加热到相变材料的一相变温度时,相变材料被配置为承受一从固体转至液体、从固体转至凝胶或从凝胶转至液体的相变。对于部分实施例,加热装置被配置为向受试者的身体传递能量,使得多个纳米粒子22被加热到相变材料的相变温度。通常,由于热被相变材料吸收作为熔化潜热,一旦相变材料已经被加热到相变温度之后,多个纳米粒子和在附近的多个纳米粒子的温度实质上保持基本恒定。进一步而言,由于热量作为熔化潜热而被相变材料吸收,加热装置不会将上述聚集体加热至大于相变温度的温度。
一般来说,加热装置被配置为将纳米粒子加热至纳米粒子的相变温度,但是通过实现纳米粒子的一相变来防止纳米粒子被加热超过纳米粒子的相变温度。对于部分实施例,能量通过加热装置被引导到受试者的身体(或其一部分)一段时间,使得相变材料吸收热量,而不需要内芯30内的相变材料的全部分子改变相位。以这种方式,在能量传输的整个持续时间内,热量持续地被内芯内的相变材料吸收为熔化潜热。例如,加热装置可以使用已知技术感测所述聚集体的一温度,并且响应于所感测的温度而停止传输能量(例如,响应于感测到的温度超过相变温度,这将指示热量不再被吸收作为熔化潜热)。可替代的或另外的,加热装置响应于能量的传输持续时间而停止能量的传输,即,在一指定期间之后所述装置停止传输能量。
对于部分实施例,在治疗所述受试者期间,加热装置以一间歇方式传输能量,所述装置在所述装置的on周期传输能量和在所述装置的off周期不传输能量或相对于on周期期间所述装置传输一减少的能量。对于部分实施例,加热装置被配置为使得所述装置的on周期和off周期的相对持续时间,使纳米粒子加热到纳米粒子的相变温度,但是以上述方式避免纳米粒子被加热到超过纳米粒子的相变温度。
一般来说,所述相变材料的选择是使得所述相变温度是癌细胞将被实质损坏(例如受伤或破裂)的一温度,但是周围组织中的健康细胞基本上将不会被损坏。(注意,通常一些健康的细胞可能至少部分地被损坏。)由于相变材料将纳米粒子的温度保持在相变温度,所以纳米粒子的加热可能会损害纳米粒子附近的癌细胞,但基本上将不会损伤附近的健康细胞。
对于部分实施例,纳米粒子加热对癌症的影响对应于表1,其出现在由thomsen撰写的题为“雷射-组织相互作用的光热和光机械效应的病理分析”(photochemphotobiol.1991jis;53(6):825-35)的一文中,其通过引用并入本文:
表1:加热对细胞的组织病理学影响
一般来说,如上所述,将癌细胞所在的受试者的身体的区域加热到所述相变材料的相变温度。对于部分实施例,使用具有大于42℃及/或小于80℃(例如42-80℃)的相变温度的相变材料。例如,相变材料可以具有大于42℃及/或小于50℃(例如42-50℃)、大于50℃及/或小于60℃的相变温度(例如50-60℃)或大于60℃及/或小于80℃(例如60-80℃)。
对于部分实施例,出现在表2及/或表3中的一种或多种相变材料(其从zalba等人,应用热力学工程,23(3),2003年2月,第251-283页)作为所述内芯30的相变材料。
表2:石蜡颗粒的熔融温度
表3:有机相变材料的熔融温度:
对于部分实施例,将一种或多种以下有机相变材料用于内芯30的相变材料:原油、由费拖合成制备的石蜡、以及具有饱和的、不饱和的、直链的、或支链的碳链颗粒的一有机材料。所述相变材料可以包括例如三月桂酸、甘油三肉豆蔻酸酯、三棕榈酸甘油酯、硬脂酸甘油酯及/或任何合适类型的石蜡或固体石蜡。
对于部分实施例,在内芯30中使用一有机相变材料。例如可以使用石蜡及/或脂肪酸颗粒。对于部分实施例,在内芯30中使用一有机材料,因为有机相变材料在没有实质超冷却的情况下冻结,并能够同步熔融,具有自成核性质,不分离,化学稳定,具有高熔化热,及/或出于不同的原因。对于部分实施例,在内芯30中使用以下一种或多种相变材料:十八烷(cas593-45-3)、月桂酸(cas:143-07-7)、肉荳蔻酸(cas:544-63-8)、棕榈酸(cas:57-10-3)、十七烷酸(cas:506-12-7)、硬脂酸(cas:57-11-4)、花生四烯酸(cas:506-30-9)、山萮酸(cas:112-85-6)、三羟甲基乙烷(cas:77-85-0)、硬脂胺(十八胺)(sigma-74750)、十六胺(十六胺)(sigma-445312)。
根据本发明的各个实施例,选择适用于内芯30的相变材料的选择标准包括相变材料的热力学、动力学和化学性质。对于部分实施例,相变材料被选择为具有指定的热力学性质,例如在期望的操作温度范围内的一熔融温度、每单位体积的高熔化潜热、高比热、高密度、高导热性、相变时体积变化小、工作温度下蒸气压小、及/或共熔。对于部分实施例,所选择的相变材料具有指定的动力学性质,例如高成核速率及/或高速率的晶体生长。对于部分实施例,所选择的相变材料被具有指定的化学性质,例如化学稳定性、相变循环可逆性,而不会在大量相变循环、非腐蚀性之后颗粒退化,及/或无毒性。
对于部分实施例,相变材料具有相对较低的热导率,并且被设置为具有一大的表面积以克服低导热性并增加进入相变材料的热量。
如上所述,并且如图2a-图2b的转变所示,通常,纳米粒子22在形状上至少部分地自我调整,纳米粒子被构造成可伸长为一大致椭圆形状(例如一三轴椭圆形或扁长或旋转形状的扁平椭圆形)。应当注意的是,一般而言,纳米粒子将不会变得细长到呈一精确的几何椭圆形状,而是当最大程度地延长时将呈现大致椭圆形状。
通常,为了使本文所述的癌症治疗是有效的,纳米粒子22需要具有一定的最小体积,至少有以下原因之一:
(1)肿瘤细胞倾向于不能与低于指定体积的粒子结合。
(2)需要一最小体积的金属的多个纳米球34,以便促进多个纳米粒子22优先吸收能量。以这种方式,通过加热装置加热的所述受试者的身体的区域内癌细胞的平均热通量密度基本上大于在被加热装置加热的区域内部的健康细胞的平均热通量密度,如上所述。
(3)要求相变材料的内芯具有一指定最小体积,以使相变材料有效地吸收热量作为熔化潜热,例如防止纳米粒子的温度升高到超过所述相变温度。
一般而言,相变材料的内芯30具有至少一体积为15,000立方纳米,例如至少50,000立方纳米,或至少85,000立方纳米。对于部分实施例,相变材料的内芯30具有至少一体积为400,000立方纳米,例如至少270,000立方纳米,或至少145,000立方纳米。对于部分实施例,相变材料的内芯30具有至少一体积为15,000立方纳米至400,000立方纳米,例如为50,000立方纳米至270,000立方纳米,或为85,000立方纳米至145,000立方纳米。
对于部分实施例,当内芯30成型为球形(为说明的目的,如图2a所示)时,相变材料的内芯30具有一直径为至少30纳米,例如至少45纳米或至少55纳米。对于部分实施例,当内芯30成型为球形时,相变材料的内芯30具有一直径小于90纳米,例如小于80纳米或小于65纳米的一直径。例如,当内芯30成型为球形时,内芯30可以具有30纳米-90纳米,例如45纳米-80纳米或55纳米-65纳米的一直径。
如上所述,一般而言,多个纳米球34的每一个的直径大于1纳米(例如大于3纳米)及/或小于10纳米(例如小于7纳米),例如在1纳米和10纳米之间,或者在3纳米和7纳米之间。多个聚合物链36的每一个的长度通常大于1纳米(例如大于1.5纳米)及/或小于4纳米(例如小于3纳米),例如1纳米-4纳米或1.5纳米-3纳米,当聚合物链最大化时。当聚合物链最大化时,多个聚合物链36的每一个的长度通常大于2纳米(例如大于4纳米)及/或小于10纳米(例如小于8纳米),例如2纳米-10纳米或4纳米-8纳米。
所述纳米粒子22具有一体积为至少65,000立方纳米,例如至少110,000立方纳米,或至少180,000立方纳米。更进一步而言,在其球形结构中,所述纳米粒子具有一体积为小于900,000立方纳米,例如小于700,000立方纳米,或小于525,000立方纳米。对于部分实施例,所述纳米粒子具有一体积为65,000立方纳米至900,000立方纳米,例如110,000立方纳米至700,000立方纳米,或180,000立方纳米至525,000立方纳米。
当在其球形结构中(如图2a所示,为了说明的目的),所述纳米粒子22通常具有一直径为至少50纳米,例如至少60纳米或至少70纳米。进一步而言,在其球形结构中,纳米粒子的一直径小于120纳米,例如小于110纳米,或小于100纳米。对于部分实施例,在其球形结构中,纳米粒子的一直径为50纳米-120纳米,例如60纳米-110纳米,或70纳米-100纳米。(应注意的是,尽管所用术语“纳米粒子”通常被定义为尺寸在1纳米和100纳米之间的粒子,但是本申请的范围包括具有尺寸略大于100纳米的纳米粒子22,例如大于至120纳米,如上所述)。
应注意的是,仅仅为了说明的目的,图2a中示出了纳米粒子22为一个球形结构,并且纳米粒子22的多种尺寸在上文中提供,用于当纳米粒子成球形时。然而,即使纳米粒子在体内没有经受渗透压、流体压力及/或任何其它压力,纳米粒子22在受试者的血液中也不一定呈现球形。相反的,纳米粒子可以呈现例如泪液形状、泡泡形状、椭圆形状及/或可以是无特定形状的。然而,如上所述,纳米粒子22确实具有基本上的一固定体积。此外,纳米粒子通常被配置为在形状上至少可部分自我调整,使得纳米粒子能够穿过具有一尺寸大于一最小阈值尺寸的解剖屏障,例如对应于渗透压及/或流体压力施加在纳米粒子上,如下文进一步详细描述。
一般来说,以下纳米粒子22的特征有助于纳米粒子形状的自我调整:
1)内芯30由诸如石蜡的相变材料制成,其是无特定形状的。
2)多个纳米球34彼此分开一间隔的设置于聚合物链36的端部,使得多个纳米球每一个能够相对于其它多个纳米球移动。
3)聚合物链36和聚合物链37是可变形的,并且可以改变形状,例如从一直线构造到一线圈构造。
一般而言,纳米粒子22全身性的施用于受试者(例如,口服及/或静脉内)。对于部分实施例,为了防止受试者的单核吞噬细胞系统(即受试者的网状内皮系统)的肝脏、脾脏、腺体和/或任何部分从受试者的血液中过滤出纳米粒子,纳米粒子被配置为可伸长(如图2b和2c中例示性地示出)大致成为一椭圆形状,使得椭圆体的多个半轴中的至少两个具有一直径小于30纳米,例如小于25纳米。例如,如图2c所示,纳米粒子sa1的多个半轴的一个通常小于30纳米,例如小于25纳米,并且纳米粒子sa2的多个半轴的第二个半轴通常小于30纳米,例如小于25纳米。
对于部分实施例,即使在其最大伸长构造中(即,其中纳米粒子被拉长成一大致呈椭圆形形状,但不能进一步伸长的构造),纳米粒子22被构造成使得椭圆体的多个半轴的每一个皆大于5纳米,例如大于10纳米。例如,如图2c所示,两个半轴sa1和sa2都大于5纳米,例如大于10纳米。对于部分实施例,以这种方式,防止纳米粒子穿过血脑屏障。如上所述,外层32包括一物质的多个分子,相对于非癌细胞优先与癌细胞结合。与癌细胞优先结合的一些物质(例如抗体、葡萄糖和葡萄醣类似物或衍生物(例如氟脱氧葡萄糖及/或d-葡萄糖))也具有相对于身体其余部分由大脑优先摄取的优势。因此,纳米粒子22通常被配置为即使在其最大伸长构造中,为了防止纳米粒子能够穿过血脑屏障,所述椭圆体的多个半轴的每一个都大于5纳米,例如大于10纳米。
如上所述,一般而言,多个聚合物链36定义相应的疏水端和亲水端,并且设置在内芯30和外层32之间。一般而言,聚醚胺,例如
对于部分实施例,本文描述的方法在成像时应用于受试者,例如,使用计算机断层扫瞄,声波,超音波及/或核磁共振成像技术。对于部分实施例,所述物质施用于受试者,并且如本文所述以能量照射受试者的身体(或其区域)用以被聚集体优先吸收。当受试者的身体被照射时,使用一热敏成像技术(例如,使用核磁共振成像技术)对受试者的身体进行成像以检测受试者的身体(包括癌细胞)的哪些区域已被加热。
实验数据
纳米粒子包括用ppo-peo-ppo/peo(如上所述一般描述)包覆的石蜡,通过使用乳化/溶剂蒸发法制备。将一滴石蜡溶于二氯甲烷的一溶液加入到n,n-甲基双丙烯酰胺(bis)和丙烯酸酯化的三/二嵌段共聚物的一混合物的一水溶液中。使用
将所述混合物进行超声波处理以形成稳定的水包油乳液。一旦液滴中的残余溶剂蒸发,就获得ppo-peo-ppo/peo包覆石蜡的纳米粒子,并以一纳米层结构存在。由于多个单体具有可聚合的功能,因此在高温下使用自由基活化以在自构型的颗粒内开始聚合和交联,使得形成具有充满油的一内芯在内部的一peo-ppo-peo/peo交联的壳结构的纳米粒子。得到的纳米粒子具有多个末端胺基团作为多个小胶体金颗粒的多个附着点。使用四(羟甲基)氯化鏻(thpc)作为一还原剂,将多个附着点作为多个成核点用于聚结一薄金覆盖层。如上所述,将多个金纳米求结合到多个纳米粒子上,使得多个金纳米球的每一个被与所述覆盖层中的所有其它纳米球分离,使得所述覆盖层形成一分段壳体。使用氯金酸和氢氧化铵控制分段壳体厚度。
sh-peg2k-异硫氰酸荧光素酯(fitc)被添加入1-τhio-β-d-葡萄糖钠盐并且将混合溶液加入到包覆石蜡的纳米粒子中。将混合物离心10分钟,然后在轨道振荡器中在一室温下摇动24小时。然后将纳米粒子再离心分离并洗涤。
以上述方式制备纳米粒子,使用纳米粒子对一组小鼠进行实验。将肿瘤细胞皮下注射到所述组小鼠中。每天测量皮下肿瘤的体积。当一指定小鼠的肿瘤体积达到300mm时,向小鼠注射纳米粒子。将小鼠称重,向每克重量小鼠注射一体积为10微升的纳米粒子。在向小鼠施用纳米粒子后,在纳米粒子施用于各个小鼠后的各对应时间将小鼠牺牲。取得每只小鼠的器官,如肝脏和脾脏,以及每只小鼠的肿瘤。称重器官和肿瘤,随后将器官和肿瘤置于酸中,使所有有机物溶解。然后使用电感耦合等离子体质谱(icp-ms)分析每个器官和肿瘤残留的问题,以检测存在于每个器官和肿瘤中的金(来自纳米粒子的金纳米球)含量。以这种方式,确定肝脏和脾脏以及肿瘤的每单位重量组织的金含量。由于即使放置在酸中,来自纳米粒子的金仍保持完整,存在于小鼠的器官和肿瘤中的金的含量表示进入到器官和肿瘤的纳米粒子的体积。
图3是表示上述实验结果的曲线图。虚线示出了在向小鼠施用纳米粒子后在各对应时间牺牲的小鼠的肝脏和脾脏中存在的金含量(微克金,每毫克组织)。实线示出了在向小鼠施用纳米粒子后各对应时间牺牲的小鼠的肿瘤中存的金含量的图。所述图是基于在向小鼠施用纳米粒子后分别于15分钟、30分钟、60分钟、120分钟和240分钟时牺牲小鼠的数据。
如上所述,存在于小鼠的器官和肿瘤中的金含量代表进入器官和肿瘤的纳米粒子的体积。可以观察到,随着时间的推移,存在于肝脏和脾脏中的金含量减少,而存在于肿瘤中的金含量增加。这些结果表示,如本文所述的(a)纳米粒子能够通过肝脏和脾脏,因为纳米粒子在形状上是可自我调整的,并且(b)在癌细胞附近积聚,这是由于纳米粒子优先与癌细胞结合。
对于部分实施例,本文描述的装置和方法与霍夫提交的us2012/0221081中描述的装置和方法结合进行,其通过引用并入本文。
本领域技术人员将理解,本发明不限于上述具体示出和描述的内容。相反的,本发明的范围包括以上叙述的各种方案的组合和子组合,以及本领域技术人员在阅读上述的描述后将不会在现有技术中进行的变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!
- 改性的二氧化硅纳米颗粒及其制备方法和适合页岩气井的钻井液与流程
- 一种二氧化硅纳米孔超级绝热材料的制备方法与制造工艺
- 球状结晶性二氧化硅粒子及其制造方法与制造工艺
- 一种用于储热的载银二氧化硅纳米片及其制备方法与制造工艺
- 包含二氧化硅纳米粒子和官能化硅烷化合物的抗污组合物及其涂布制品的制造方法与工艺
- 一种用于催化柱的多层次二氧化硅粒子的制备方法与制造工艺
- 表面改性复合二氧化硅粒子及包含该表面改性复合二氧化硅粒子的聚酰亚胺薄膜的制造方法与工艺
- 表面修饰的纳米二氧化硅及原油采收用纳米流体的制造方法与工艺
- 多孔二氧化硅系粒子、其制造方法及配合其的化妆料与制造工艺
- 一种LED用改性纳米二氧化硅增强增韧PBT高导热阻燃型塑料及其制备方法与制造工艺
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺