用于在伤口愈合中使用的植物提取物和化合物的制作方法
本发明涉及来源于鼠尾草属的种类(salviaspp)的包含一种或多种丹参酮化合物的植物提取物或所述一种或多种丹参酮化合物,它们用于治疗伤口,特别是慢性伤口或其它得益于抑制皮质醇产生的病症,特别是库欣综合征。
优选的丹参酮化合物包括、但不限于二氢丹参酮(特别是15,16-二氢丹参酮(cas编号87205-99-0))和丹参酮i。
优选的治疗包括治疗慢性伤口(通常定义为需要超过6周才能愈合的伤口)。这类伤口在患有肥胖的患者和患有糖尿病的患者以及卧床不起的患者(褥疮(decubitus)或褥疮(bedsores))以及经过外线束辐射疗法的患者中尤其常见。
慢性伤口无法在有序组的阶段中和可预测量的时间中(大多数伤口所经历的方式)来愈合。慢性伤口显然被阻留在伤口愈合的一个或多个阶段中。相反,在急性创伤中,分子如胶原蛋白的产生与降解之间存在精确的平衡;在慢性伤口中,这种平衡失去,且恶化所起的作用过大。
慢性伤口可能永远不会愈合,或者可能需要数年才能愈合。这些伤口导致患者严重的情绪和身体压力,并对患者和整个卫生保健系统造成重大的财务负担。
急性和慢性伤口处于以不同速率进行愈合的伤口愈合类型范围的相对两端。
绝大多数慢性伤口可以分为三类:静脉溃疡、糖尿病溃疡和压力性溃疡。少数不属于这些类别的伤口可能是由于辐射或缺血等原因导致。
通常发生在腿部的静脉溃疡约占慢性伤口的70%-90%,且主要影响中老年人。它们被认为是由于静脉中存在的防止血液向后流动的瓣膜功能不全引起的静脉高压导致。局部缺血因功能障碍导致,且合并再灌注损伤导致组织损伤,这种损伤产生伤口。
糖尿病性溃疡是慢性伤口的另一个主要原因。由于慢性溃疡,糖尿病患者具有高于一般人群15%的截肢风险率。糖尿病导致神经病变,其抑制伤害感受和疼痛感。因此,患者可能最初不会注意到腿部和足部的小伤口,且由此可能无法预防感染或反复受伤。此外,糖尿病导致免疫损害和对小血管的损害,从而阻止了组织充分氧合,这可能导致慢性伤口。压力在糖尿病性溃疡形成中也起作用。
压力性溃疡通常发生在具有例如瘫痪的病症的人中,而瘫痪抑制通常受到压力的身体部位(例如足跟,肩胛骨和骶骨)的运动。压力性溃疡是由组织上的压力大于毛细血管中的压力而发生的局部缺血导致,且由此限制血液流进入所述区域。需要比皮肤更多的氧和营养物的肌肉组织因延长的压力而表现出最坏的影响。正如在其它慢性溃疡中所示,再灌注损伤会损害组织。
使用众所周知的赋形剂,可以将制剂的提取物和活性化合物配制成药物或化妆品,不过,喷雾制剂、霜剂、水凝胶和浸渍的载体材料例如敷料、纱布和绷带是有利的。
由于本发明的化合物在抑制皮质醇的产生中起作用,因此它们可应用于治疗由皮质醇合成增加引起的疾病,例如库欣综合征。
背景技术:
已知鼠尾草属的种类(salviaspp)的提取物和从其中分离的许多丹参酮化合物具有药用特性(参见,例如journalofmedicinalplantsresearch4,2813-2820,29decemberspecialreview,2010),且申请人自己的专利公开号wo2009050451教导了从鼠尾草属的种类得到的包含确定的丹参酮的提取物的抗微生物活性。
西方世界中约2%的一般人群患有慢性创伤,对患者的生活质量造成严重的不良影响。这也造成了重大的经济负担,近2%的卫生预算用于护理慢性伤口和住院治疗(schreml等人(2010)jamacaddermatol63,866-881;sgonc和gruber(2012)gerontology59,159-164)。尽管这种高发病率和经济负担,但是慢性伤口的处置结果远不能令人满意,且迫切需要新型疗法改善患者的生活质量和降低医疗成本。
对慢性伤口的发病机制具有特异性的活性成分是非常需要的。这类活性化合物必须能够使“错误激活”的调节途径正常化,并且必须没有任何毒性和过敏可能性。
申请人目前已经令人意外地发现,包含丹参酮的鼠尾草属的种类的提取物和从其中分离的许多丹参酮化合物、特别是丹参酮i和二氢丹参酮是cyp11b1的有效抑制剂,且照此可以预期它们可用于治疗病症受益于抑制皮质醇合成的病症,例如治疗伤口,特别是慢性伤口,其原因在于,cyp11b1的抑制有益于加速伤口愈合。
这种治疗应用的原理来自于cyp11b1是在人肾上腺和皮肤中表达的产生皮质醇的酶这一事实(图1),并且已经显示cyp11b1的抑制促进人皮肤外植体中和猪体内的伤口愈合(vukelic等人(2011)jbiolchem286,10265-10275)。
重要地,在涉及皮质醇生物合成的酶的表达方面,啮齿动物和其它低级哺乳动物种类的皮肤不同于人的皮肤。例如,在小鼠中,11β-hsd1在慢性伤口中得到上调。cyp11b1既没有在小鼠和大鼠中的未受伤的皮肤中表达、也没有在创伤后的皮肤中表达(tiganescu等人,jendocrinol221,51-61;dallavalle等人,jsteroidbiochemmolbiol43,1095-1098)。
显著地,申请人已经确定存在于乙醇鼠尾草属提取物中的某些化合物抑制cyp11b。由于cyp11b1是人中的关键靶标,所以它们能够应用于治疗人的伤口,特别是慢性伤口和其它病症。
对例如啮齿类动物或其它低级哺乳动物报告的数据不是用于预测人皮肤中的伤口愈合作用的适合的模型,并且不会导致得出它们具有用于治疗例如慢性伤口或涉及皮质醇产生的相关的病症,例如库欣综合症的用途的结论。
在这方面,皮质醇合成中最重要的酶是cyp11b1。cyp11b1是将无活性糖皮质激素11-脱氧皮质醇转化为高活性皮质醇的酶。cyp11b1在人体皮肤中的表达和活性受到严格地调节,特别是在伤口愈合过程中。受伤后,cyp11b1的表达和活性得到显著地上调,特别是在第二天期间,以便在检查中保持炎症应答,但在受伤后第三天和第四天恢复到对照值,以保护糖皮质激素诱导的角质形成细胞增殖/迁移的抑制和其它对伤口愈合必不可少的重要过程(vukelic等人(2011)jbiolchem286,10265-10275)。然而,在慢性伤口中,cyp11b1的表达保持持久性地升高(us8,802,660b2)。抑制皮质醇的产生由此可能会逆转延长的皮质醇暴露在慢性伤口中的有害作用。
在与vukelic等人(2011)jbiolchem286,10265-10275)使用的相同的离体人皮肤伤口模型中,使用没有11β-hsd1抑制活性的高效cyp11b1抑制剂,申请人已经证实了cyp11b1作为伤口愈合的靶标。与媒介物对照组相比,使用这种cyp11b1抑制剂作为化学探针,他们观察到显著地更快的愈合过程和归因于表皮细胞再生的完全伤口闭合。
因此,cyp11b1的抑制可以被认为是治疗特别是慢性伤口的新颖的、非常富有希望的疗法。此外,环境干燥(也诱导皮肤屏障功能障碍)显著地增加皮肤等效模型中的cyp11b1表达和活性(takei等人(2013)expdermatol22,662-664)。
短波长的uv光(uvb和uvc)是刺激哺乳动物皮肤中皮质醇和皮质酮合成的另一重要环境应激物。显示增加的合成速率是由人皮肤中几种类固醇生成酶的上调介导,包括cyp11b1和11β-羟基类固醇脱氢酶(hsd)1(skobowiat等人(2011)brjdermatol168,595–601;skobowiat等人(2011)amjphysiolendocrinolmetab301,e484–e493)。虽然推定这种生物化学反应在年轻皮肤中是保护性的,但是皮质醇生产的上调仍然存在于老化皮肤中,并且被认为有助于与实足年龄老化和光老化相关的皮肤形态和功能的不良改变(tiganescu等人(2011)jinvestdermatol131,30–36)。因此,预期特别是老化皮肤中的皮质醇合成抑制将减弱不良的年龄依赖性作用,例如失去色调和弹性、脆性增加、干燥度增加、厚度减少以及胞外基质成分例如透明质酸和胶原蛋白的合成减少(tiganescu等人(2011)jinvestdermatol131,30–36)。
cyp11b1也在肠(taves等人(2011)amjphysiolendocrinolmetabol301,e11–e24;fernandez-marcos等人(2011)biochimbiophysacta,1812,947–955)和口腔(peng等人(2011)plosone6:e23452,datawereanalyzedusingtheoncominewebportal(www.oncomine.org))中表达。因此,通过抑制相应上皮细胞中的cyp11b1也可以加速上皮组织和非皮肤的空腔中的损害愈合。
还报道,在与应激相关的抑郁和疲惫的女性中,牙龈的沟槽液中存在显著增加的皮质醇水平,这与更多量的牙菌斑和局部炎症相关(johannsen等人(2006)jperiodontology77,1403-1409)。尽管不知晓何种百分比的皮质醇可能也具有全身来源,但是使用cyp11b1抑制剂可以有效地阻断局部产生,导致牙周健康改善。
鉴定的现有技术包括以下内容:
chinesejournalofclinicalrehabilitation,第9卷,第6期,2005,156-7页。该文件公开了丹参(radixsalviaemilitiorrhizae)在大鼠皮肤上的伤口愈合中的用途。然而,在皮质醇生产中大鼠皮肤表达与人不同的酶,且由此不能认为它可以用于治疗人的伤口。
cn102988370公开了丹参酮i在治疗银屑病中的用途。
cn10282340公开了丹参酮iia在治疗银屑病中的用途。
cn12973575公开了隐丹参酮在治疗银屑病中的用途。
journalofthepharmaceuticalsocietyofjapan,第131卷,第4期,2011581-586页公开了使用鼠尾草(salviaofficinalisl)在治疗小鼠模型中的特应性皮炎中的用途。
chinesejournalofreparativeandreconstructivesurgery,第12卷,第4期,1998,205-208页公开了丹参在具有烧伤皮肤的家兔中的用途。家兔是低级哺乳动物且并不能认为它可以用于治疗人中的伤口。
bmcbiotechnology,第14卷,第1期,2014,74:1-10页公开了表达人成纤维细胞生长因子i的转基因丹参(salviamiltiorrhiza)植物在伤口愈合中的用途。数据(段落连接第3和4页的段落)显示野生型植物提取物无法促进大鼠皮肤的伤口愈合。
biomaterial,第23卷,2002,4459-4462页公开了使用脱乙酰壳聚糖的草药提取物的缓释植入物。还对大鼠测试了体内生物降解。
evidencebasedcomplementaryandalternativemedicine,第2012卷,论文编号927658公开了丹参酮11a抑制角质形成细胞的生长,这是它可用于治疗银屑病的机制。
技术实现要素:
根据本发明的第一个方面,提供了来源于鼠尾草属的种类的植物提取物(其包含一种或多种丹参酮化合物),或者一种或多种丹参酮化合物,所述丹参酮化合物包含cyp11b1抑制量的丹参酮i和/或二氢丹参酮,它们用于治疗伤口或库欣综合征。
最优选地,治疗的伤口是慢性伤口。
优选地,虽然不是主要的,但是鼠尾草属的种类的植物提取物是描述在wo2009050451中并且表征的一种,该对比文件通过引用并入本文。
表现出这些有益特性的提取物可以来源于唇形科(labiatae)的多年生草本丹参(salviamiltiorrhizabunge)的根和根茎。在中药(tcm)中,它也称作丹参。
丹参的化学成分可分为两大类化学物质:
●脂溶性成分;和
●水溶性成分。
对丹参的“活性”化合物的早期研究主要集中在脂溶性化合物上,其中迄今已发现了约40种化合物。
可以将这些化合物进一步分成两组:
●丹参酮(o-醌结构);和
●罗格列酮(o-羟基罗格列酮,对醌型结构)。
丹参酮化合物的大部分是二萜类,其中它们主要是二萜醌类。
已经鉴定了超过40种不同的化合物,包括,例如:丹参酮,隐丹参酮,丹参酮iia,丹参酮iib,甲基丹参酮,羟基丹参酮iia,异丹参酮i,异丹参酮ii,异隐丹参酮,次丹参酮,l-二氢丹参酮i,新丹参酮a、b、c和丹参酚(salviol)。
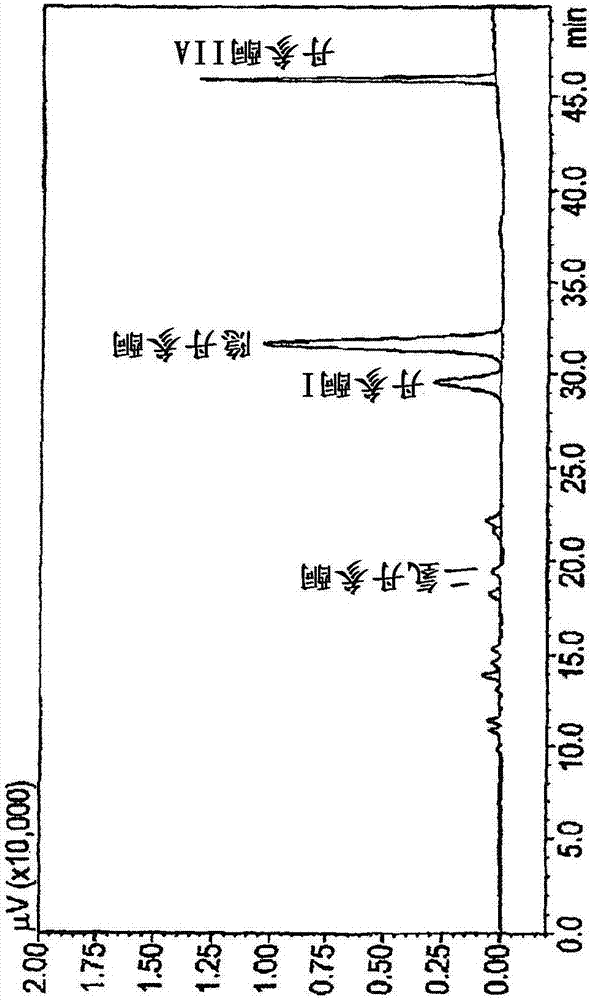
这些化合物中的四种的结构如下所示,因为它们在wo2009050451(本文图2)中公开的提取物中已经以大量(通过hplc色谱法)被特别地鉴定。
优选地,所述提取物包含cyp11b1抑制量的丹参酮i和/或二氢丹参酮(更具体地为15,16-二氢丹参酮i)。
在一个优选的实施方案中,鼠尾草属的种类的植物提取物或一种或多种丹参酮化合物用于治疗慢性伤口,其中这类伤口在糖尿病或肥胖患者群体中是普遍的。
受益于治疗的另外的伤口可以来自褥疮(decubitus)(褥疮(bedsores))、磨损、辐射、烧伤、溃疡或手术干预以及其中免疫系统受损的患者群体。
受益于抑制皮质醇的另一种病症是库欣综合征。
一种示例性的提取物公开在wo2009050451中,其包含
○隐丹参酮;
○二氢丹参酮;
○丹参酮i;和
○丹参酮iia,
其特征在于上述鉴定的丹参酮化合物占选择性纯化的提取物的至少15重量%,且隐丹参酮占选择性纯化的提取物的至少4重量%。
显而易见,可以使用包含可选丹参酮的提取物,或者可以使用包含抑制cyp11b1的一种或多种o-醌类或丹参酮或由它们组成的制剂。
根据本发明的第二方面,提供了包含或基本上由下述组成的药物或化妆品:丹参酮i和/或二氢丹参酮,或者包含下述量的丹参酮i和/或二氢丹参酮的鼠尾草属的种类的提取物,所述量将抑制cyp11b1至少64%、更优选抑制至少81%且仍然更优选抑制至少94%。
本领域技术人员知晓,优选将抑制在于最大化且典型地抑制大于75%一直到(through)80%、85%、90%-95%,一直到96%、97%、98%和99%-100%。
治疗有益性的抑制量是能够将cyp11b1的活性抑制至少60%、更优选至少75%或更多的抑制量。
所述药物或化妆品还包含一种或多种赋形剂。
在一个特别有利的实施方案中,活性成分被装载(carried)在敷料、绷带、纱布或其它载体材料上。
在另一个实施方案中,将活性成分并入用于牙周病应用的产品中,例如漱口剂和牙膏。
根据本发明的第三个方面,提供了治疗伤口或库欣综合征的方法,包括向患者提供治疗有效量的鼠尾草属的种类的植物提取物,或者一种或多种丹参酮化合物(包括丹参酮i和二氢丹参酮)。
优选地,治疗的伤口为慢性伤口。
最优选地,所述丹参酮化合物是丹参酮i和/或15,16-二氢丹参酮i。
仅通过实施例并且参考以下附图和详细描述进一步描述本发明。
附图说明
图1是示例人中类固醇激素的生物合成途径的示意图;和
图2是本发明提取物的hplc色谱图。
发明详述
申请人已经发现,丹参提取物(如wo2009050451中所公开的)以剂量依赖性方式抑制完整细胞中cyp11b1活性。
wo2009050451中公开的提取物是包含选择性纯化的丹参酮化合物的来自鼠尾草属的种类的根的提取物,包含:
○隐丹参酮;
○二氢丹参酮;
○丹参酮i;和
○丹参酮iia,
其特征在于上述鉴定的丹参酮化合物占选择性纯化的提取物的至少15重量%,且隐丹参酮占选择性纯化的提取物的至少4重量%。
然而,尽管wo2009050451的鼠尾草属的种类是丹参(salviamiltiorrhizabunge),但是可以使用另外的鼠尾草属的种类得到包含丹参酮的提取物,例如:白鼠尾草(salviaapiana)、salviaargentea、salviaarizonica、salviaazurea、salviacarnosa、salviaclevelandii、朱唇(salviacoccinea)、墨西哥鼠尾草(salviadivinorum)、salviadorrii、粉萼鼠尾草(salviafarinacea)、salviaforreri、salviafulgens、salviafunerea、胶质鼠尾草(salviaglutinosa)、樱桃鼠尾草(salviagreggii)、深蓝鼠尾草(salviaguaranitica)、西班牙鼠尾草(salviahispanica)、紫绒鼠尾草(salvialeucantha)、灌木鼠尾草(salvialeucophylla)、salvialibanotica、salvialongistyla、琴叶鼠尾草(salvialyrata)、salviamexicana、药用鼠尾草(salviaofficinalis)、龙胆鼠尾草(salviapatens)、salviapolystachya、salviapotus、草地鼠尾草(salviapratensis)、猩红鼠尾草(salviaroemeriana)、南欧丹参(salviasclarea)、苞叶鼠尾草(salviaspathacea)、一串红(salviasplendens)、salviaverticillata、彩苞鼠尾草(salviaviridis)。
因此,wo2009050451中公开的提取物包含至少35重量%的鉴定的丹参酮化合物,其中隐丹参酮至少15重量%(占选择性纯化的提取物)。
实际上,优选地,鉴定的丹参酮化合物占选择性纯化的提取物的至少45重量%,且隐丹参酮占选择性纯化的提取物的至少25重量%。
在一个实施方案中,隐丹参酮占四种所鉴定的丹参酮化合物的至少20%,更优选至少25%,仍然更优选至少40%,且可以高至60%。
类似地,丹参酮iia优选地占四种所鉴定的丹参酮化合物低于55%,仍然更优选低于50%,仍然更优选低于40%,且可以占四种所鉴定的丹参酮化合物的低至20%或更低。
最优选地,所述提取物包含至少1%、仍然更优选至少2%且仍然更优选至少3%或更多的丹参酮i和/或二氢丹参酮。实际上,该提取物可以是高度选择性的提取物,其包含至少5%、更优选至少10%一直到20%、30%、40%、50%、60%、70%、80%和90%的一种或多种优选的化合物丹参酮i和/或二氢丹参酮。
在实施例1中示例的实施方案中,包含选择性纯化的丹参酮化合物的提取物的特征在于它包含四种鉴定的丹参酮化合物,其量为42.89%(±40%,一直到30%-20%):
●隐丹参酮含量为18.95%(±40%,一直到30%-20%);
●二氢丹参酮含量为3.65%(±40%,一直到30%-20%);
●丹参酮i含量为3.82%(±40%,一直到30%-20%);和
●丹参酮iia含量为16.47%(±40%,一直到30%-20%)。
这种包含选择性纯化的丹参酮化合物的提取物的特征在于,它具有基本上图2中所示例的hplc指纹与所示的特征峰。
然而,从实施例3(本文)中显而易见,尽管所述提取物是有效的cyp11b1抑制剂,但是目前较少存在的丹参酮的两种15,16-二氢丹参酮和丹参酮i比目前存在的主要丹参酮,即隐丹参酮和丹参酮iia的活性明显更高,且由此优选使用具有较高含量的15,16-二氢丹参酮或丹参酮i的一种或多种的替代提取物,或者实际上单独或彼此结合地使用分离的化合物(或合成制造的化合物或衍生物)。
类似地,当上述提取物由鼠尾草属的种类的根制备时,包含以下步骤:
●将原料浸入浓乙醇(strongethanol)中足以溶解丹参酮化合物的时间;
●使用渗滤法提取包含丹参酮化合物的级分;和
●真空浓缩期望的级分,并回收乙醇,
可以优选改变该方法以浓缩或优选15,16-二氢丹参酮或丹参酮i。
因此,可以使用wo2009050451中公开的方法的可替代方法学,即使用第一纯化步骤,其包括:
a.将提取物溶于足量水;
b.使期望的部分沉淀出来;
c.弃去水溶液;和
d.采集沉淀。
类似地,当wo2009050451公开第二纯化时,其包括:
e.可以期望在大孔树脂柱(lioayuannewmaterialsltd制造的ab8大孔树脂柱或另一种适合的柱)上的可替代方法学进行分离,该方法学对所述优选化合物具有特异性。
支持权利要求的实验的详细内容如下所述:
实施例1
1.1.提取物溶液的制备
申请人将~10mg的丹参提取物(salviam.bungeextract)(如wo2009050451中所公开的)溶于所需体积的100%乙醇或100%dmso中以获得1%(w/v)的提取物溶液。他们在500μl测定温育体积中测试5μl该溶液(最终乙醇或dmso浓度为1%)。从这种1%的丹参提取物溶液中,他们还用100%乙醇或100%dmso中制备1:10和1:100的稀释液。从这些溶液中,他们在500μl测定温育体积中测试了5μl。
1.2.cyp11b1测定
将表达重组人cyp11b1的v79mzh11b1细胞系在补充有5%胎牛血清(fcs;sigma)、青霉素g(100u/ml)、链霉素(100μg/ml)、谷氨酰胺(2mm)和丙酮酸钠(1mm)的dulbecco改进eagle(dme,sigma))中在37℃、5%co2空气中培养。将细胞置于24-孔细胞培养板上(每孔8×105个细胞),并在每孔1mldme培养基中培养至汇合。在测试当天,除去dme培养基,并向每个孔中加入包含在100%乙醇或100%dmso中的5μl提取物溶液的450μl新鲜dmem。在dmso或乙醇作为溶剂之间在cyp11b1抑制作用方面无显著性差异。以相同的方式、但不使用提取物溶液处理对照孔(接受媒介物或酮康唑(终浓度为50nm)作为参比化合物以验证每次实验)。在co2培养箱中在37℃下60min后,通过加入包含100nm的11-脱氧皮质酮(+0.15μci的[1,2-3h]11-脱氧皮质酮)的50μldmem作为底物启动反应。所有测量一式两份进行。25min后,通过用乙酸乙酯萃取上清液终止酶反应。将样品离心(10,000×g,10min),并将上层相移入新鲜杯中。蒸发乙酸乙酯溶剂,并且将残余物溶于40μl甲醇,且用hplc分析。使用以下公式来确定转化水平和酶抑制百分比。
cyp11b1
结果
结果示于表1中,其显示了丹参提取物在v79mzh11b1细胞中对cyp11b1活性的抑制。提取物溶液在实验的当天由干提取物新鲜制成。
表1.
表1.使用丹参提取物对cyp11b1抑制的测定。在100%乙醇或100%dmso中的实验当天,由干提取物新鲜制备提取物溶液。n表示独立实验的次数。
如上所示的,用100%乙醇和100%dmso制备的终浓度为0.01%的丹参提取物分别将人cyp11b1抑制95.6%和100.0%。从1%提取物溶液中,申请人分别用100%乙醇或100%dmso制备1:10稀释液。从后者这些溶液中,他们在500μl测定体积中测试了5μl。这些提取物溶液(测定中最终提取物浓度为0.001%)将人cyp11b1分别抑制了79.1%和83.1%。从1%提取物溶液中,申请人还分别用100%乙醇或100%dmso制备了1:100稀释液。从后者溶液中,他们在500μl测定体积中测试了5μl。该提取物溶液(测定中最终提取物浓度为0.0001%)分别将人cyp11b1抑制22.6%和16.8%。
来自这些实验的结论是,丹参提取物以0.0001%、0.001%和0.01%的稀释度抑制cyp11b1。
为了检查这种抑制作用不是因毒性引起,在如实施例2所示的用于在cyp11b1筛选测定中使用的温育条件下在相同的细胞系中,进行mtt[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-四唑
实施例2
mtt细胞存活率测定
将v79mzh11b1细胞在24-孔细胞培养板中的1mldme培养基上(每孔8×105个细胞)培养至汇合。在测试当天,除去dme培养基,并向每个孔中加入包含5%fcs的450μl新鲜dme培养基(包含在100%乙醇中的5μl丹参提取物溶液)。将乙醇(1%)和tritonx-100(0.0006%)分别用作媒介物和阳性对照(全部为终浓度)。所有测量一式四份进行。在37℃、5%co2中60min后,向每个孔中加入50μl新鲜dme培养基(+5%fcs)。25min后,用500μl新鲜dme培养基(+5%fcs)替代培养基,即刻向其中加入25μlmtt溶液(5mg/mlpbs,ph7.2)。30min后,除去所有培养基,并将细胞在250μl的0.5%乙酸(v/v)、10%sds(w/v)的dmso溶液中裂解。通过分光光度法在570nm波长处测量甲
结果
0.01%和0.0001%丹参提取物溶液对v79mzh11b1细胞的细胞存活率的影响的测定
在用于cyp11b1筛选测定的(预-)温育条件下,测定了丹参提取物对v79mzh11b1细胞存活率的影响。如表2中所示,0.01%和0.0001%丹参提取物溶液对mtt转化成甲
表2.
表2.mtt毒性测定中丹参提取物对v79mzh11b1细胞存活没有影响。每次实验的当天,由干提取物新鲜制备提取物溶液。将在仅1%乙醇存在下转化成甲
实施例3
考虑到所述提取物的活性,所以申请人使用实施例1中所述的方法学观察所述丹参酮的一些的活性。
v79mzh11b1细胞中测试的丹参酮为:
●丹参酮iia;
●丹参酮i;
●二氢丹参酮i;和
●隐丹参酮。
结果如下表3中所示:
表3.
表3.丹参酮iia、丹参酮i、二氢丹参酮i和隐丹参酮的cyp11b1抑制作用。结果为2次独立实验的平均值±sd。
从结果中显而易见,每种丹参酮显示出抑制活性,其中两种最有效的是二氢丹参酮(在10μm下94%抑制),且丹参酮i(10μm时64%抑制)。
这本身是预料不到的,因为这两种化合物在wo2009050451中公开的提取物中的存在量(分别为3.65%和3.82%)比隐丹参酮和丹参酮iia(分别为18.95%和16.47%)更低。
观察结构,可能的情况是,二氢丹参酮(在10μm下94%抑制)和丹参酮i(在10μm下64%抑制)的增强的活性可以归因于在c4位置上存在甲基(与二甲基相对)基团(grouping)。
考虑到这些结构相关的化合物的活性,很可能丹参酮家族化合物的其它成员(或其衍生物)可以表现出相似(或更好)的cyp11b1抑制活性。
实施例4
在70℃、80℃和90℃下丹参提取物的热稳定性试验
一般地,伤口硬膏(plaster)成分通常短暂地保持在升高的温度(70℃-90℃)下,以减少潜在的残留病菌的数量。因此,重要的是所述提取物/丹参酮的cyp11b1抑制活性应在这些升高的温度下稳定,条件是它们用于术后在伤口周围敷放硬膏的情况。
在70℃、80℃或90℃下处理5min和15min后测定丹参提取物的cyp11b1抑制效力。将丹参提取物溶于100%dmso溶液(浓度为0.05%和0.025%),并在70℃、80℃和90℃下温育5或15min,然后在cyp11b1测定中在0.0005%和0.00025%终浓度下测试。这些浓度选自抑制cyp11b1的提取物的ic50附近。
结果示例在下表4中,其显示了丹参提取物的热稳定性。数据是4次(对照)或2次测量的平均值±sd:
表4.
表4.丹参提取物的热稳定性。数据是4次(对照)或2次测量的平均值±sd。
与对照值(使用在25℃用0.05%和0.025%浓度预处理15min的丹参提取物测定)相比,在70℃、80℃和90℃下的任何预处理中都没有观察到对cyp11b1抑制活性的影响。因此,这些提取物/化合物可以用于其中将伤口置于硬膏中的情况。
实施例5
丹参提取物的变应原性试验
在3位志愿者中,以在100%
从上述实施例可以得出结论,来源于鼠尾草属的种类的包含一种或多种丹参酮化合物的植物提取物或所述一种或多种丹参酮化合物显然是用于治疗受益于皮质醇合成抑制的伤口或其它病症的富有希望的候选物。
另外,申请人已经确定两种具体的活性组分是相当亲脂性的(对于二氢丹参酮i而言,使用acd/logpgalas计算的log为3.57),这启示对表皮的良好穿透性(它对有效抑制表皮表达的靶酶必不可少)。
- 还没有人留言评论。精彩留言会获得点赞!