一种包裹阿霉素的中空硅‑金星核/壳纳米材料的制备方法与流程
本发明属于核/壳结构纳米材料的制备领域,特别涉及一种包裹阿霉素的中空硅-金星核/壳纳米材料的制备方法。
背景技术:
目前,常用的肿瘤治疗方法包括化疗、手术治疗、放疗、光热治疗、生物免疫治疗和基因治疗等。其中,化疗能治疗十多种肿瘤,而且既可杀死有些癌细胞,也能杀死转移的癌细胞,是一种全身治疗性方法。但化疗无特异性,在杀伤肿瘤细胞的同时,对人体正常细胞也有很大的损伤。光热治疗能实现局部的肿瘤治疗,治疗特异性好,治疗时间短而治疗效果明显,无毒无害,但光热治疗无法深入到生物体的深层,缺乏对内部肿瘤治疗的有效手段。因此,不同的肿瘤治疗方法的结合应用可以实现各自优势的互补,达到一个更好的肿瘤治疗效果,如所有肿瘤患者中,超过半数以上人群要不同程度的化疗,化疗与其他疗法相配合,可大大的提高恶性肿瘤的治疗效果,并且有效地控制癌肿的扩散和转移。因而,发展肿瘤的联合治疗手段将成为提高肿瘤治疗效果的一种趋势。
近年来纳米技术在生物医学领域尤其是在癌症的治疗方面得到了较多的研究。通过对纳米材料的合理设计,开发一种能够实现肿瘤联合治疗的新型、多功能纳米材料成为可能。介孔二氧化硅因其尺寸均一,包裹药物能力强和表面易功能化等特点而被广泛研究。He(He Q.et al.Biomaterials.2011,32:7711-7720.)等制备了包裹阿霉素DOX的介孔二氧化硅纳米颗粒,该纳米颗粒具有药物运输和pH响应的药物缓释功能。此外,纳米金星由于结构可控,近红外强吸收等特点而被应用到光热治疗中。Li等(Li J.et al.Biomaterails.2015,38:10-21.)制备了PEI稳定的Fe3O4/纳米金星核壳结构纳米颗粒,更为深入的研究了其在动物体内肿瘤模型中MR/CT成像和光热治疗的功能,结果表明纳米颗粒具有很好的MR/CT成像和光热治疗效果。Li等(Li S.et al.Chem.Commun.2015,51,14338-14341.)制备了中空的纳米金星,利用纳米金星中空结构包裹抗癌药物DOX,在808nm近红外激光照射下对肿瘤具有优异的化疗和光热治疗效果。
检索国内外有关肿瘤联合治疗纳米材料方面的文献和专利结果表明,目前还没有发现包裹DOX的中空硅-金星核/壳纳米材料的制备及其在肿瘤化疗和光热治疗联合治疗应用方面的报道。
技术实现要素:
本发明所要解决的技术问题是提供一种包裹阿霉素的中空硅-金星核/壳纳米材料的制备方法,该方法制备得到的纳米材料具备优异的生物相容性和特异性靶向功能,能应用到肿瘤的治疗中,具有良好的化疗/光热联合治疗效果,为联合治疗纳米材料的开发提供了一种新方法,应用前景广阔。
本发明以制备的中空介孔二氧化硅为核,在其表面负载纳米金星作为壳层,并在纳米金星上修饰含靶向分子RGD多肽的聚乙二醇(HS-PEG-RGD),最后利用中空硅特殊结构包裹抗癌药物阿霉素,得到一种包裹阿霉素的中空硅-金星核/壳纳米材料。本发明制备得到的纳米材料具备对U87MG细胞特异性靶向作用和优异的生物相容性,具有化疗和光热治疗协同增强作用,良好的体内肿瘤治疗效果,为靶向肿瘤治疗的纳米材料的开发提供了一种新方法,应用前景广阔。
本发明的一种包裹阿霉素的中空硅-金星核/壳纳米材料的制备方法,包括:
(1)将中空介孔二氧化硅HMSs溶解于溶剂中,超声分散,加入(3-氨基丙基)二甲基乙氧基硅烷MPTMS,通入氮气保护,在70-80℃油浴中回流6-8h,离心收集,洗涤,得到巯基修饰的中空介孔二氧化硅HMSs-SH;
(2)将步骤(1)中的HMSs-SH溶于水中,超声分散,加入金纳米颗粒Au NPs溶液,室温下搅拌72-96h,离心收集,得到金纳米颗粒负载的中空介孔二氧化硅HMSs/Au种子;
(3)将步骤(2)中的HMSs/Au种子溶于水中,超声分散,加入氯金酸溶液,搅拌1-2min,加入硝酸银溶液和抗坏血酸溶液,继续搅拌0.5-1h,离心收集,洗涤,冷冻干燥,得到中空硅-金星核/壳纳米颗粒HMSs/Au NSs;
(4)将步骤(3)中的HMSs/Au NSs分散在水中,加入含RGD靶向分子的聚乙二醇HS-PEG-RGD水溶液,室温下搅拌12-24h,离心收集,得到修饰了RGD-聚乙二醇的中空硅-金星核/壳纳米材料HMSs/Au-PEG-RGD NSs;
(5)将步骤(4)中的HMSs/Au-PEG-RGD NSs分散在超纯水中,加入盐酸阿霉素DOX·HCl水溶液,室温下避光搅拌24-48h,离心收集,洗涤,冷冻干燥,得到包裹阿霉素的中空硅-金星核/壳纳米材料HMSs/Au-PEG-RGD NSs/DOX。
所述步骤(1)中溶剂为异丙醇,HMSs的异丙醇溶液的浓度为1.0-1.5mg/mL;离心的速度为8500r/min。
所述步骤(1)中HMSs和MPTMS的质量比为1:4-7。
所述步骤(2)中HMSs-SH溶于水中得到的水溶液的浓度为6-7mg/mL;HMSs-SH和Au NPs的质量比为6-10:1。
所述步骤(2)和步骤(3)中离心的速度为5000r/min。
所述步骤(3)中HMSs/Au种子溶于水中得到的水溶液的浓度为1-3mg/mL,氯金酸溶液的浓度为0.2-0.3mmol/mL,硝酸银溶液的浓度为1-3mmol/mL,抗坏血酸溶液的浓度为0.1-0.2mol/mL,HMSs/Au seed溶液、氯金酸溶液、硝酸银溶液和抗坏血酸溶液的体积比为1-2:230-270:2-3:1。
所述步骤(4)中HMSs/Au NSs分散在水中得到的水溶液的浓度为4-6mg/mL,HS-PEG-RGD水溶液的浓度为8-12mg/mL;HMSs/Au NSs和HS-PEG-RGD的质量比为1:2-3。
所述步骤(4)和步骤(5)中离心的速率为8500r/min。
所述步骤(5)中HMSs/Au-PEG-RGD NSs分散在超纯水中得到的水溶液的浓度为1-3mg/mL,DOX·HCl水溶液的浓度为1-3mg/mL;HMSs/Au-PEG-RGD NSs和DOX·HCl的质量比为13-20:1。
所述步骤(5)中HMSs/Au-PEG-RGD NSs/DOX用于制备化疗和光热治疗过程中需要的制剂:HMSs/Au-PEG-RGD NSs/DOX生理盐水溶液对裸鼠U87MG移植瘤具有很好的化疗和光热治疗功能。具体方法包括:将上述HMSs/Au-PEG-RGD NSs/DOX分散在生理盐水中,利用注射器通过瘤内注射将HMSs/Au-PEG-RGD NSs/DOX生理盐水溶液注射到裸鼠肿瘤内,并用808nm的激光在肿瘤处照射5min;在第5天时,再通过瘤内注射到裸鼠肿瘤内,并用808nm的激光在肿瘤处照射5min。
所述SH-PEG-RGD的制备为:
RGD、巯基端聚乙二醇(Mw=5000,SH-PEG-COOH)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐EDC、N-羟基琥珀酰亚胺NHS分别溶于二甲基亚砜中,其中RGD、SH-PEG-COOH、EDC、NHS的摩尔比为1:1:5:5。先将溶于二甲基亚砜的SH-PEG-COOH和EDC搅拌反应30min,再滴加入NHS搅拌反应3h,之后再滴加入溶有RGD的二甲基亚砜搅拌反应36-72h。对反应液进行透析,蒸馏水(6次,2L/次),透析3天,然后冷冻干燥得到RGD修饰的聚乙二醇(SH-PEG-RGD),其中RGD与聚乙二醇的摩尔比为0.41:1。
所述中空介孔二氧化硅的制备方法参见专利CN105561345A。
本发明使用透射电子显微镜(TEM)、核磁共振氢谱(1H NMR)、电势粒径(DLS)、热重分析(TGA)、细胞活力分析(CCK8测试)以及体外、体内化疗和光热治疗表征本发明制备的中空硅-金星核/壳纳米材料及其在肿瘤治疗中的应用潜能。
本发明利用中空硅的空腔和介孔结构,在其内部包裹阿霉素DOX,用于控制DOX的缓释和肿瘤的化疗;纳米金星的近红外吸收特性,能实现其对肿瘤的光热治疗,而光热特性又能促进DOX的定位释放;然后将SH-PEG-RGD修饰到中空硅-金星核/壳纳米颗粒上提高其生物相容性和赋予其特异性靶向功能。从而制备的包裹DOX的中空硅-金星核/壳纳米材料具有化疗和光热治疗协同增强作用,良好的体内靶向肿瘤治疗效果,实现靶向肿瘤的联合治疗,为靶向肿瘤联合治疗的纳米材料的开发提供了一种新方法。
有益效果
(1)本发明采用温和的反应条件和原位还原法制备了包裹阿霉素的中空硅-金星核/壳纳米材料,制备方法简单,成本较低,具有产业化实施的前景;
(2)本发明制备的包裹阿霉素的中空硅-金星核/壳纳米材料具有化疗和光热治疗协同增强作用,为肿瘤联合治疗纳米材料的开发提供了参考;
(3)本发明制备的包裹阿霉素的中空硅-金星核/壳纳米材料同时具有化疗、光热治疗和靶向功能;
(4)本发明所采用的制备工艺可用于制备实现体内化疗和光热治疗为一体的多功能纳米材料,具有很好的潜在实用价值。
附图说明
图1为本发明的反应示意图;
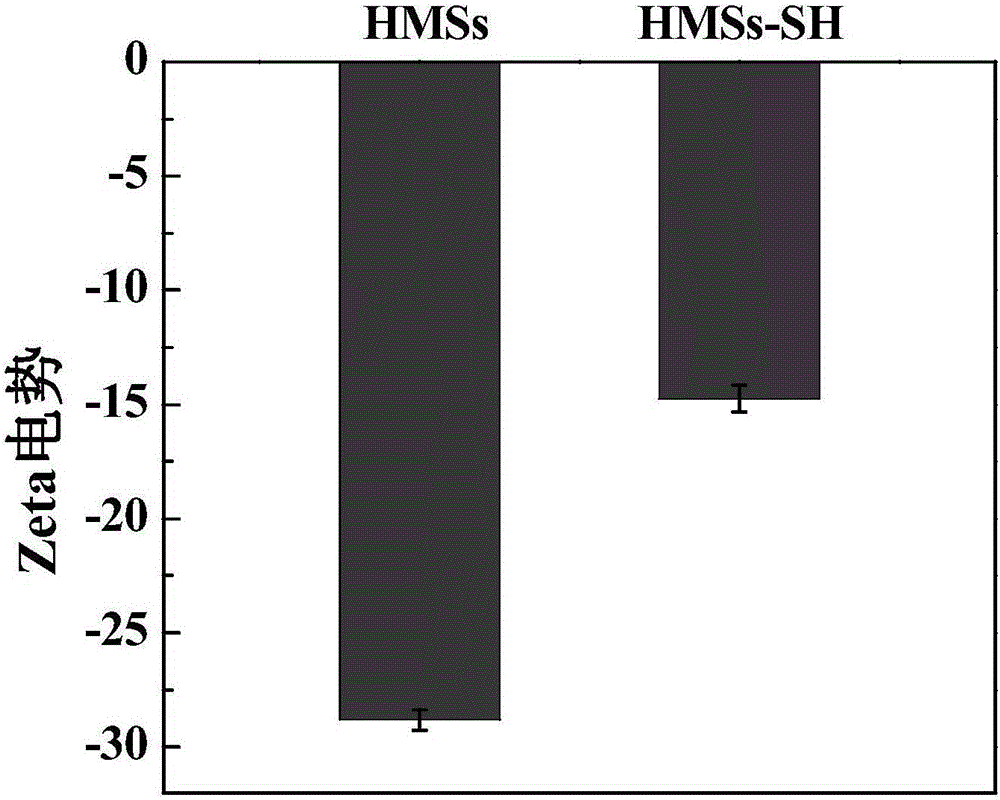
图2为实施例1中的HMSs和HMSs-SH的Zeta电势图;
图3为实施例1中的HMSs-SH(a1-a3)、HMSs/Au seed(b1-b3)和HMSs/Au NSs(c1-c3)颗粒的TEM图;其中,a1-a3、b1-b3和c1-c3分别为不同放大比例;
图4为实施例1中的Au seed、HMSs-SH、HMSs/Au seed和HMSs/Au NSs的紫外光谱图;
图5为实施例1中的HMSs/Au NSs和HMSs/Au NSs-PEG-RGD颗粒的热重分析图;
图6为实施例2中HMSs/Au NSs-PEG-RGD/DOX纳米材料在pH=7.4、pH=5.0和pH=5.0+激光情况下,DOX从HMSs/Au NSs-PEG-RGD/DOX中的累积释放曲线;
图7为实施例3中HMSs/Au NSs-PEG-RGD/DOX纳米材料在不同浓度下的光热温度上升曲线图;
图8为实施例4中HMSs/Au NSs-PEG-RGD在不同浓度下的细胞毒性试验结果;
图9为实施例5中HMSs/Au NSs-PEG-RGD/DOX分别与正常U87MG细胞和自由RGD阻断的U87MG细胞共培养4h后,细胞中的金元素的吞噬量;
图10为实施例6中HMSs/Au NSs-PEG-RGD、HMSs/Au NSs-PEG-RGD+激光、HMSs/Au NSs-PEG-RGD/DOX和HMSs/Au NSs-PEG-RGD/DOX+激光与U87MG细胞共培养12h后的细胞活力;
图11为实施例7中HMSs/Au NSs-PEG-RGD、HMSs/Au NSs-PEG-RGD+激光、HMSs/Au NSs-PEG-RGD/DOX和HMSs/Au NSs-PEG-RGD/DOX+激光(100μL,[Au]=30mM)通过瘤内注射入小鼠肿瘤部位,808nm激光照射时间为5min,记录20天内小鼠肿瘤体积(a)、小鼠体重(b)和80天内小鼠存活率(c)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
制备HMSs/Au-PEG-RGD NSs/DOX纳米材料的具体过程如图1所示。
(1)将100mg中空介孔二氧化硅(HMSs)溶于100mL异丙醇中,并用超声分散,逐滴加入600μL(3-氨基丙基)二甲基乙氧基硅烷(MPTMS)(浓度为0.846g/mL),通入氮气保护,在70-80℃油浴中回流8h,8500r/min下离心收集,用乙醇洗2次,超纯水洗1次,得到巯基修饰的中空介孔二氧化硅(HMSs-SH)。DLS和TEM测试结果表明:中空介孔二氧化硅表面成功修饰了-SH(图2),HMSs-SH的空腔直径有150mm,壳厚为20mm(图3a1-a3)。
(2)将(1)所得产品30mg HMSs-SH溶于5mL水中,并用超声分散,逐滴加入1mL金纳米颗粒溶液(浓度为4mg/mL),室温下搅拌96h,5000r/min下离心收集,用超纯水洗3次,得到金纳米颗粒负载的中空介孔二氧化硅(HMSs/Au seed)。TEM测试结果表明:直径约为10nm的Au seed负载到HMSs-SH表面(图3b1-b3)。
(3)将(2)所得产品HMSs/Au seed溶于11mL水中,并用超声分散,取其中3.8mL HMSs/Au seed滴加入625mL氯金酸溶液(0.2mM)中,搅拌2min,接着加入5mL硝酸银溶液(2mM),并紧接着加入2.5mL抗坏血酸溶液(0.1M),继续搅拌1h,5000r/min下离心收集,用超纯水洗3次,并进行冷冻干燥,得到中空硅-金星核/壳纳米颗粒(HMSs/Au NSs)。TEM和UV-Vis测试结果表明:中空硅表面成功形成纳米金星层(图3c1-c3),且HMSs/Au NSs在810nm处有个强吸收峰(图4)。
(4)将(3)所得产品50mg HMSs/Au NSs分散在10mL超纯水中,滴加入10mL SH-PEG-RGD(10mg/mL),室温下搅拌24h,8500r/min下离心收集,用超纯水洗3次,得到表面修饰了RGD-聚乙二醇的中空硅-金星纳米材料(HMSs/Au NSs-PEG-RGD)。TGA测试结果表明:HMSs/Au NSs表面成功修饰了SH-PEG-RGD,且SH-PEG-RGD所占含量约为60.8%(图5)。
(5)将(4)所得产品10mg HMSs/Au NSs-PEG-RGD分散在10mL水中,滴加入0.67mg的盐酸阿霉素DOX·HCl(1mg/mL),避光下搅拌48h,8500r/min下离心收集,用超纯水洗3次,得到包裹阿霉素的中空硅-金星纳米材料(HMSs/Au NSs-PEG-RGD/DOX)。通过紫外-可见分光光度计定量测试结果表明:HMSs/Au NSs-PEG-RGD对DOX的负载率为98.6±0.65%。
实施例2
取实施例1中(5)所得产品分别用pH=7.4和pH=5.0的缓冲液配置成1mg/mL的溶液,取1mL溶液放入透析袋中并置于含有9mL相应缓冲液的50mL PE管中,将其分成两组(一组试验在808nm激光下照射5min,另一种试验不进行激光照射),之后放入37℃摇床中振荡。然后分别在1h,2h,3h,4h,5h,6h和8h后取透析袋外液体1mL,用紫外-可见分光光度计测定其在480nm处的吸光值,并再向透析袋外加入1mL相应的缓冲液,其中试验组(808nm激光照射组)在激光照射5min后需要在480nm处测一次吸光值。HMSs/Au NSs-PEG-RGD/DOX纳米材料的体外释放曲线测试结果表明:在生理环境(正常组织细胞一般为pH7.4)下,DOX从HMSs/Au NSs-PEG-RGD/DOX纳米材料中释放的释放速率和释放量都较小,而在弱酸性环境(肿瘤细胞一般为酸性)的释放速率和释放量都很大,且激光照射有助于DOX更快更多的从材料中释放出来,能保证对正常组织细胞最小损伤情况下,又有效的促进DOX在肿瘤部位的定位释放,从而达到肿瘤部位的定位治疗(图6)。
实施例3
取实施例1中(5)所得产品用超纯水配制金浓度为20mM的母液,之后梯度稀释为10mM、5mM和1mM的材料,并对一系列浓度材料在808nm激光下进行光热转换性能测试。以超纯水、HMSs和HMSs/Au seed作为空白对照。HMSs/Au NSs-PEG-RGD/DOX纳米材料升温性能测试结果表明:在试验浓度范围内,HMSs/Au NSs-PEG-RGD/DOX纳米材料表现出优异的光热转化效果,且随着纳米材料浓度的增加,温度升高的越明显(图7)。
实施例4
取实施例1中(4)所得产品用无菌生理盐水配置成5mg/mL的母液,之后梯度稀释为4、2、1和0.5mg/mL的材料。取培养好的U87MG胞种于96孔板中,按照0.8万细胞/孔的密度接种,每孔体积100μL。培养过夜后,加入上述各稀释梯度的材料,与细胞共培养24h。每个梯度用培养液稀释10倍,即每孔终浓度分别为500、400、200、100和50μg/mL。每个梯度做5个平行孔,以生理盐水作为空白对照。培养结束后用100μL生理盐水清洗3次,每孔加100μL无血清培养基和10μL CCK8溶液,37℃孵化3h,用酶标仪检测450nm处吸光度值。CCK8法检测细胞活力测试结果表明:HMSs/Au NSs-PEG-RGD纳米材料在此范围内不显示出细胞毒性,表现出良好的细胞相容性(图8)。
实施例5
取实施例1中(5)所得产品HMSs/Au NSs-PEG-RGD/DOX分别用无菌生理盐水配制成金浓度为1mg/mL的母液,之后梯度稀释为0.5和0.25mg/mL的材料。取培养好的U87MG细胞种于24孔板中,按照20万细胞/孔的密度接种,每孔体积为1mL。培养过夜后,将细胞分为两组,一组为正常U87MG细胞,另一组U87MG细胞加入2μM RGD共培养3h(定义为RGD阻断的U87MG细胞)。接着,加入上述各稀释梯度的材料,与细胞共培养4h。每个梯度用培养液稀释10倍,即每孔终浓度分别为100、50和25μg/mL。每个梯度做5个平行孔,以生理盐水作为空白对照。培养结束后用生理盐水清洗3次,再胰酶消化离心后收集细胞,加入2mL王水消化24h,然后通过ICP-OES检测细胞中Au元素的吞噬量。HMSs/Au NSs-PEG-RGD/DOX纳米材料靶向U87MG能力测试结果表明:在研究浓度范围内,正常U87MG细胞对HMSs/Au NSs-PEG-RGD/DOX的吞噬量明显高于RGD阻断的U87MG细胞,即靶向分子RGD的修饰使得HMSs/Au NSs-PEG-RGD/DOX对正常U87MG细胞有特异靶向能力(图9)。
实施例6
取实施例1中(4)所得产品HMSs/Au NSs-PEG-RGD和实施例1中(5)所得产品HMSs/Au NSs-PEG-RGD/DOX分别用无菌生理盐水配制成金浓度为8mM的母液,之后梯度稀释为4mM、2mM和1mM的材料。取培养好的U87MG细胞种于96孔板中,按照0.8万细胞/孔的密度接种,每孔体积100μL。培养过夜后,加入上述各稀释梯度的材料,与细胞共培养12h。每个梯度用培养液稀释10倍,即每孔终浓度分别为0.8mM、0.4mM、0.2mM和0.1mM。每个梯度做5个平行孔,以生理盐水和生理盐水+激光作为空白对照。培养结束后用生理盐水清洗3次,之后将U87MG细胞分成两组(一组试验在808nm激光下照射5min,另一组试验不进行激光照射),接着,用生理盐水清洗2次,每孔加100μL无血清培养基和10μL CCK8溶液,37℃孵化3h,用酶标仪检测450nm处吸光度值。CCK8法检测细胞活力测试结果表明:生理盐水、生理盐水+激光和HMSs/Au NSs-PEG-RGD都没有杀死肿瘤细胞的能力,而HMSs/Au NSs-PEG-RGD+激光和HMSs/Au NSs-PEG-RGD/DOX都具有一定的杀死肿瘤细胞的能力,此外,HMSs/Au NSs-PEG-RGD/DOX+激光具有很强的杀死肿瘤细胞的能力,即化疗和光热治疗能协同增强杀死肿瘤细胞的能力(图10)。
实施例7
取实施例1中(4)所得产品HMSs/Au NSs-PEG-RGD和实施例1中(5)所得产品HMSs/Au NSs-PEG-RGD/DOX分别用无菌生理盐水配制成金浓度为30mM的母液。取100μL HMSs/Au NSs-PEG-RGD或HMSs/Au NSs-PEG-RGD/DOX通过瘤内注射在体重为22g的小鼠肿瘤内,之后将裸鼠分成两组(一组试验在808nm激光下照射5min,另一组试验不进行激光照射),以瘤内注射生理盐水和生理盐水+激光作为空白对照。之后记录20天内小鼠肿瘤体积、小鼠体重和80天内小鼠存活率。小鼠肿瘤部位化疗和光热治疗测试结果表明:HMSs/Au NSs-PEG-RGD+激光对肿瘤细胞具有光热治疗作用,HMSs/Au NSs-PEG-RGD/DOX对肿瘤细胞具有化疗作用,而HMSs/Au NSs-PEG-RGD/DOX+激光具有更突出的肿瘤治疗效果,即化疗和光热治疗能协同增强肿瘤治疗效果(图11)。证明本方法合成的HMSs/Au NSs-PEG-RGD/DOX纳米材料能应用到小动物体内,实现靶向体内肿瘤化疗和光热治疗联合的协同增强治疗。
- 还没有人留言评论。精彩留言会获得点赞!