氢气在用于制备治疗肾纤维化制剂中的用途的制作方法
本发明属生物药理学领域,涉及氢气在制药中的新用途,具体涉及氢气在用于制备治疗肾纤维化制剂中的用途,尤其是氢气在用于制备治疗各种慢性肾病在长期的疾病进行过程中产生的肾小管间质纤维化制剂中的用途。
背景技术:
研究表明,肾纤维化(包括肾小球纤维化、肾间质纤维化、肾血管纤维化)是几乎所有肾脏疾病进展到终末期肾功能衰竭的共同通道和共同病理改变,也是慢性肾病终末期患者完全丧失肾功能的重要原因之一;而目前的干预解决方案仅有定期透析和肾移植;实践显示,所述的干预解决方案尚存在其固有的缺陷,因此,如何逆转肾纤维化对降低致死率和提高患者的生活质量具有重要的意义。
研究表明,肾脏纤维化是肾细胞在病理刺激下进行的一种转分化过程,其纤维化形成的三个阶段即炎症导致细胞因子的释放,纤维母细胞活化和基质的沉淀。现有技术中对肾纤维化的研究着重于阻止肾纤维化形成的这三个阶段,以及纠正相关因素,如感染、残存肾单位的肥大、尿蛋白、高血压、高血糖、高氮质血症及代谢性酸中毒、血液动力学紊乱、细胞免疫、循环因子等的损伤,但实践显示效果均不甚理想,因此,业内认为,理想的药物逆转纤维化的三个阶段中的一个或者多个,将会对病情产生非常积极的影响。
研究显示,氢气是自然界广泛存在的一种气体,氢原子和碳原子被共同认为是组成化合物最多的两种原子。氢气一直被认为是生理惰性气体,但研究发现氢气具有治疗多种疾病的作用,目前,氢气的医学应用研究已为国际医学生物学研究热点。学术界比较公认氢气是一种新型选择性抗氧化和理想的抗炎物质,推测对多种氧化应激和炎症相关疾病可能有治疗作用,如缺血再灌注引起的脑、心、肝、肺和肾损伤,神经退行性疾病,脓毒症,糖尿病等,有研究通过各种动物疾病模型都证明了氢气的抗氧化效果,以及有实验表明,氢气对机体抗炎、抗肿瘤发生、抗凋亡也显现了较理想的效果,通常饮用饱和氢气水(富氢水)是常采用的方式之一,而且氢气具有无毒、渗透性强、无残留等诸多优点,具有较重要的临床应用前景。
基于现有技术的现状,本申请的发明人拟提供氢气在制药中的新用途,具体涉及氢气在用于制备治疗肾纤维化制剂中的用途。
与本发明有关的参考文献有:
1吴兆龙.肾纤维化防治.中国实用内科杂志,1998,18(12):750~752.
2.黄颂敏,刘芳,刘小菁,刘瑞血管紧张素ⅱ及其受体拮抗剂在系膜细胞培养中对结缔组织生长因子表达的影响[期刊论文]-肾脏病与透析肾移植杂志2000(5)。
3.文颖娟,曾富海,董正华排毒双调综合疗法抗大鼠慢性肾功能衰竭肾纤维化的实验研究[期刊论文]-中国中医基础医学杂志2003(4)。
技术实现要素:
本发明的目的是提供氢气在制药中的新用途,具体涉及氢气在用于制备治疗肾纤维化制剂中的用途。尤其是氢气在用于制备治疗各种慢性肾病在长期的疾病进行过程中产生的肾小管间质纤维化制剂中的用途。
本发明进行了动物实验,经对建立的动物模型给予氢气干预后的生化指标检测,离体细胞研究,蛋白印迹实验,免疫组化及数据分析,本发明的实施例中,采用富氢水对建立的动物模型给予氢气干预,结果显示,所述氢气能通过sirt1通路实现对病理环境诱导的纤维化的抑制;所述氢气通过提高sirt1减轻纤维化过程中对肾功能单位的损害,所述氢气进一步可用于制备治疗肾纤维化,尤其是慢性肾衰引起的肾纤维化的药物制剂中。
本发明中,进行了包括以下步骤的干预实验:
(1)小鼠单侧输尿管阻塞手术;
(2)给予动物氢气干预;富氢水;
(3)检测生化指标;
(4)离体细胞研究;
(5)蛋白印迹实验;
(6)免疫组化;
(7)数据分析。
基于现有技术公开的,在某个压力温度等条件下,氢气中的水蒸气含量达到最大,就可以说氢气被水蒸气饱和,通常文献报道的氢气水浓度是0.8mmol/l,0.75mmol/l或者0.6mmol/l;
本发明中,给予动物氢气干预;尤其采用富氢水或饱和的氢气水进行干预,浓度为0.8mmol/l,本发明中应用制氢水机制备氢气,或饱和过饱和的氢气水;所述的过饱和的氢气水水中氢气含量大于等于0.8mmol/l的氢气水;
干预实验结果显示,
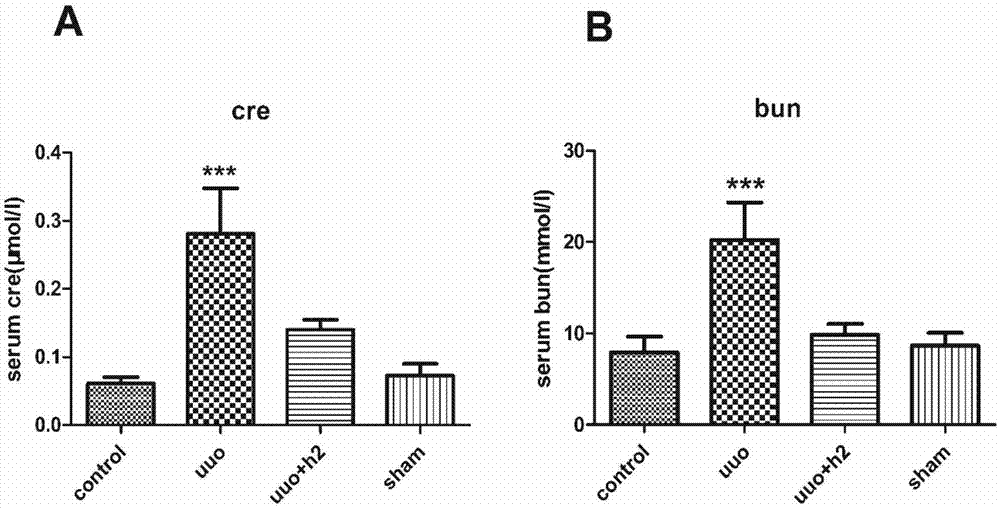
氢气减轻uuo引起的血液尿素氮和肌酐含量的升高,造模后10天取血,用生化试剂盒测肌酐和尿素氮的含量,结果显示,模型组肌酐和尿素氮含量明显升高,而模型组联用氢气则可降低肌酐和尿素氮的含量,差异有统计学意义(如图1所示);
氢气减轻uuo引起的肾小管间质纤维化,造模后10天取肾,做病理切片观察产生的组织病理变化,结果显示,模型组产生了严重的间质纤维化,联用氢气组间质纤维化的程度明显减轻(如图2所示);
氢气降低uuo引起的肾纤维化标志蛋白的含量,造模10天后取肾,用蛋白免疫印迹法检测肾组织中纤维化的标志蛋白含量,结果显示,uuo组的纤维化标志蛋白含量明显高于正常和假手术组,而联用氢气后标志蛋白含量明显下降(如图3所示);
氢气减轻由tgf-β引起的细胞形态的改变,人肾小管上皮细胞(hk-2),在tgf-β的刺激下会发生转分化,由原来的卵圆形变成长梭行,而加入氢气培养基后,则减轻细胞的形态改变(如图4所示);
氢气抗纤维化的作用是通过sirt1通路产生的,hk-2细胞在氢气培养基预处理12小时后,用tgf-β刺激36小时,平行对照组加入sirt1的抑制剂,然后取蛋白,用蛋白免疫印迹的方法检测sirt1和下游纤维化标志蛋白含量,结果显示,氢气的抗纤维化作用是通过sirt1通路发挥作用的(如图5所示)。
本发明提供了氢气在用于制备治疗肾纤维化制剂中的用途,经试验证实实验动物口服富氢气水,可减轻由于单侧输尿管阻塞导致的肾纤维化,减少肾损伤,保护肾功能;所述氢气进一步可用于制备治疗肾纤维化,尤其是慢性肾衰引起的肾纤维化的药物制剂中。
附图说明
图1显示模型组动物的生化指标较正常组和假手术组显著升高,而联用氢气组较模型组明显下降,其中uuo模型组的值与control组和氢气组均有有统计学意义,显示了在富氢气水降低了uuo引起的血肌酐和尿素氮的增加,
a:小鼠实施uuo模型,uuo模型加富氢水组,假手术组,和正常对照组10天后,取血测血肌酐,得出测定值;
b:小鼠实施uuo模型,uuo模型加富氢水组,假手术组,和正常对照组10天后,取血测血肌酐,得出测定值;
数值采用均数+标准差,每组n=8,***p<0.0001。
图2显示模型组动物肾组织切片的纤维化程度明显比正常组和假手术组严重,而治疗组则有较明显的改观,其中显示,假手术组与正常对照组在术后10天时所取得标本中,肾小球大小正常,细胞数量无明显增多,系膜区未见明显增宽、肥厚,肾小球基底膜增厚未见,无断裂、结构完整。间质区炎性浸润及纤维化未见,
uuo模型组肾小球大小基本正常,而系膜细胞数有所增多,系膜区增宽,毛细血管袢开放尚可,基底膜存在一定程度增厚,未见球囊粘连,肾小管萎缩明显,部分基底膜已存在断裂,结构消失,间质区增宽;
富氢水治疗组中,肾小球大小基本正常,系膜细胞数稍增多,系膜区稍增宽,毛细血管袢开放可,基底膜未见明显增厚或球囊粘连,未见明显肾小管萎缩,部分基底膜断裂,较uuo模型组有所减少,结构基本正常,间质区未见明显增宽。
图3显示模型组的纤维化标志蛋白的含量比正常组有较大的偏离,而治疗组则效果更好,富氢气水抑制了uuo引起的肾纤维化标志蛋白α-sma,fibronectin,e-cadherin含量的变化,其中uuo模型组的值与control组和氢气组均有有统计学意义;
b、c:作为成纤维细胞中的标志物α-sma和fibronectin的表达量在uuo组中出现了明显的升高,而在应用富氢水的小鼠中,其升高量与uuo组存在差异,且具有统计学意义,每组组n=8,*p<0.05;
d:作为成纤维细胞中的标志物e-cadherin的表达量在uuo组中出现了明显的升高,而在应用富氢水的小鼠中,其升高量与uuo组存在差异,且具有统计学意义,每组组n=8,*p<0.05。
图4显示药物tgf-β刺激后hk-2细胞形态变化较严重,而氢气组的细胞形态则保持较好,hk-2细胞传代12小时后,氢气组和tgf-β加氢气组用氢气培养基预处理12小时,然后tgf-β组和tgf-β加氢气组加入tgf-β,使终浓度为2.5ng/ml。36小时后拍照;
tgf-β组:tgf-β组中的hk-2细胞慢慢失去其原有的类圆形形态,细胞间连接消失,逐渐变为梭型;
tgf-β加氢气组:在氢水培养基中预培养12小时的hk-2细胞,其增值过程中形态变化过程未出现大量像tgf-β组那样梭型变化大部分与正常组相似,只有少部分出现变型呈梭型状态;
氢气组:一直在氢水培养基培养的hk-2细胞中,细胞形态未发生改变。
图5显示在药物tgf-β刺激后,纤维化标志蛋白含量升高,加入氢气后含量降低,同时加入sirt1抑制剂后,sirt1的含量降低,纤维化标志蛋白含量升高,标志着氢气的抗纤维化作用的降低,每组组n=3,*p<0.05。
具体实施方式
实施例1
材料和方法:甲醇(国药集团化学试剂有限公司),多聚甲醛(国药集团化学试剂有限公司),乙醇(国药集团化学试剂有限公司),细胞培养液:rpmi1640(gibco),胎牛血清(hyclone),pbs磷酸盐缓冲液,胰蛋白酶(上海博光生物科技有限公司),tgf一beta1(r&d),dmso(sigma),pagerulertmprestmnedproteinladder(fermentas)11.mousemonoclonaltoalphamuscleactin(abcam),e-cadhefinrabbitmonoclonalantibody(epitomics),pal-1rabbitmonoclonalantibody(epitomics),hrp标记山羊抗兔igg(h+l),hrp标记山羊抗小鼠igg(h+l)(明睿生物),beta-actinantibody(sigma),bsa(sigma),双氧水(国药集团化学试剂有限公司),苏木素染液(武汉谷歌生物科技有限公司),盐酸,氨水(国药集团化学试剂有限公司),中性树胶(谷歌生物),.组化试剂盒dab显色剂(dako);
主要仪器和设备:超净工作台苏州净化装备有限公司,c02细胞培养箱thermo、冷冻离心机t11ernlo、培养皿coming、illipore水纯化系统millipore、ds凝胶电泳装置biorad,ca、转印装置biorad,ca及高压灭菌锅thermo(usa),载玻片nalgenuncintemational,naperville,il,稳压稳流电泳仪eps300型上海天能科技有限公司,荧光显微镜axiovert40cfl,zeiss,凝胶图像处理系统alphainnotechcorporation,图像分析软件alphainnotechcorporation,倒置显微镜laica,dmil,wetzlar,germany及酶标仪tecansystemsinc,switzerland。
主要实验方法:
进行了包括以下步骤的干预实验:
小鼠单侧输尿管阻塞手术;给予动物富氢水干预,浓度为0.8mmol/l;检测生化指标;离体细胞研究;蛋白印迹实验;免疫组化;数据分析;
建立uuo动物模型,
所有实验经过复旦大学上海医学院动物关爱和使用委员会核准。本发明采用雄性成年balb/c小鼠(复旦大学药学院动物实验中心提供,上海,中国)。
雄性的balb/c小鼠40只,体重20左右,小鼠称重后用2%的戊巴比妥腹腔注射(50mg/kg)麻醉,将小鼠仰卧固定于鼠板上,备皮,消毒,在左侧腹部切口,暴露并分离左侧输尿管,用丝线在靠左肾处双重结扎输尿管,检查手术视野内无持续出血后手术缝合伤口,假手术组除不结扎输尿管外其余和上述操作相同;
组织取材:用2%的戊巴比妥腹腔注射(50mg/kg)麻醉,迅速取出左肾,切开后,一部分置于4%的多聚甲醛中,做常规石蜡包埋、切片,供病理和免疫组化检查,另一部分肾置于.80℃冰箱中备用;
western印迹实验,
将模型肾组织和假手术组相对应的组织经裂解液裂解;将组织在含有蛋白酶抑制剂cocktails的ripa裂解液(millipore,billerica,ma,美国)中匀浆、离心后,用bca蛋白测定法(thermobiomate3s,thermoscientific,美国)检测蛋白浓度;等量的蛋白样品分别经8%、10%或12%的tris-甘氨酸凝胶电泳后,转移到pvdf膜上;使用1xtbst的5%脱脂牛奶室温封闭1小时,一抗4℃孵育过夜,经漂洗后加二抗室温孵育1小时;化学发光剂处理后,用bio-image测定系统(bio-rad,美国)进行扫描和定量分析;使用β-actin作为内参;
免疫组化,
组织切片:(1)小鼠肾脏在4%多聚甲醛中固定48小时以上;(2)乙醇梯度脱水:70%乙醇24小时,80%乙醇12小时,95%乙醇12小时,,100%乙醇1小时,,10o%乙醇1小时,为石蜡渗透至组织内部、包埋组织做必要的准备;(3)-甲苯透明:二甲苯:乙醇(1:1)10分钟,二甲苯i20分钟,二甲苯ii20分钟;(4)浸蜡:石蜡i40分钟,石蜡ii90分钟;(5)石蜡包埋:将融化的石蜡倒入包埋框,而后用加温的镊子将浸蜡的组织块放入,控制温度在56。c;(6)切片:每个标本取10长切片。用经0.1%多聚赖氨酸处理的玻片贴片,烤片过夜后,存于40c冰箱待用;
免疫染色:石蜡切片脱蜡至水:依次将切片放入二甲苯ⅰ15min-二甲苯ⅱ15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min-蒸馏水洗。
1、抗原修复:组织切片置于盛满edta抗原修复缓冲液(ph9.0)的修复盒中于微波炉内进行抗原修复,中火8min至沸,停火8min保温再转中低火7min,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
2、阻断内源性过氧化物酶:切片放入3%过氧化氢溶液(双氧水:纯水=1:9),室温避光孵育25min,将玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min;
3、bsa或者血清封闭:切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内滴加用3%bsa或者10%正常兔血清均匀覆盖组织,室温封闭30min。(一抗是山羊来源用10%正常兔血清封闭,一抗其它来源的用3%bsa封闭);
4、加一抗:轻轻甩掉封闭液,在切片上滴加pbs按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜。(湿盒内加少量水防止抗体蒸发);
5、加二抗:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗(hrp标记)覆盖组织,室温孵育50min;
6、dab显色:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加新鲜配制的dab显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色;
7、复染细胞核:harris苏木素复染3min左右,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,氨水返蓝,流水冲洗;
8、脱水封片:将切片依次放入75%酒精6min-85%酒精6min--无水乙醇ⅰ6min-无水乙醇ⅱ6min-二甲苯ⅰ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片;
9、显微镜镜检,图像采集分析。
血肌酐和尿素氮的测定,
收集血液,4℃13000rpm离心30分钟;收集上清液,加入测定液用分光光度计(thermobiomate3s,thermoscientific,美国)在给定波长测量其光密度值;采用标准品制作标准曲线,按标准曲线计算出光密度值对应的出血量。
数据分析,
数据用平均值±sd表示,采用单因素方差分析后经boneferroni多组比较进行统计分析;采用kruskal–wallistest分析后经dunn多组比较进行行为学数据的统计分析;两组比较时,采用未配对双尾studentt检验。p<0.05视为有统计学差异。
结果显示:
(1)氢气可减轻由uuo引起的血肌酐和尿素氮的含量,图1显示正常组和假手术组的肌酐和尿素氮均处于较低水平,而uuo组则大幅上升,联用氢气的模型组的指标较纯模型组明显下降,表明氢气可改善uuo对肾脏功能的损害;
(2)氢气减轻uuo引起的肾小管间质纤维化,图2显示第10天正常组和假手术组肾小球大小正常,细胞数无增多,系膜区无增宽,毛细血管袢开放良好,基底膜无增厚,未见球囊粘连,肾小管基底膜无增厚断裂,结构完整,间质区未见明显炎性浸润及纤维化。模型组肾小球大小基本正常,系膜细胞数稍增多,系膜区稍增宽,毛细血管袢开放尚可,基底膜无增厚,未见球囊粘连,肾小管明显萎缩,部分基底膜断裂,结构消失,间质区增宽。模型联用氢气组肾小球大小基本正常,系膜细胞数稍增多,系膜区稍增宽,毛细血管袢开放可,基底膜无增厚,未见明显球囊粘连,少量肾小管萎缩,少部分基底膜断裂,结构消失,间质区稍增宽;
(3)氢气降低uuo引起的肾纤维化标志蛋白的含量,图3显示了采用western印迹实验,与假手术组相比,在uuo模型组中,肾组织纤维化的三种标志蛋白均大幅偏离正常值,而uuo联用氢气后可明显改变这种趋势,表明氢气可减缓由uuo引起的肾纤维化。
(4)氢气减轻由tgf-β引起的细胞形态的改变,图4显示了hk-2细胞在tgf-β的刺激下会发生转分化,由原来的卵圆形变成长梭行,而在加入氢气培养基预处理的组内,则可减轻细胞的形态改变,在体外证实氢气的抗纤维化作用;结果还显示,hk-2细胞经过一天的增殖后,细胞间连接逐渐紧密,形态呈典型铺路石样,而加入tgf-β1刺激组中的hk-2细胞慢慢失去其原有的类圆形形态,逐渐变为梭型,继而,细胞间连接消失,细胞呈梭型,同样,在氢水培养基中预培养12小时的hk-2细胞,其增值过程中形态变化过程与正常组未见明显差异,一直在氢水培养基培养的hk-2细胞中,细胞形态未发生改变;
(5)氢气抗纤维化的作用是通过sirt1通路产生,图5显示了采用western印迹实验结果,在加入氢气后,氢气抑制了tgf-β引起的纤维化而产生的是sirt1含量降低的作用,表明氢气对纤维化的抑制作用是通过sirt1发生作用的。
实验结果表明所述的氢气通过sirt1对抗肾纤维化的过程,为保护肾功能提供了新型对策和手段,对于保护患慢性肾脏疾病病人的肾功能和肾脏生理结构具有重要意义。
- 还没有人留言评论。精彩留言会获得点赞!