M1巨噬细胞肿瘤疫苗的制备方法与流程
本发明涉及肿瘤免疫治疗技术领域,特别是M1巨噬细胞肿瘤疫苗的制备方法。
背景技术:
特异性主动免疫疗法治疗肿瘤具有一定的疗效已为许多研究所证实,如何制备出高抗原表达的瘤苗是提高此疗法疗效的关键。目前,处于基础和临床研究阶段的瘤苗主要有修饰的自体肿瘤细胞瘤苗、单一蛋白成分瘤苗或热休克蛋白肽复合体瘤苗及树突状细胞瘤苗等,如专利93112060.8等。修饰的自体肿瘤细胞瘤苗是采用适当的理化因素对肿瘤细胞进行处理以促进细胞表面蛋白质的变构或偶联,或用病毒转染和转基因等手段使肿瘤细胞的异物性增加,以提高肿瘤细胞的免疫原性而制备的瘤苗,肿瘤细胞经处理后虽在一定程度上可增加肿瘤细胞的抗原性,但修饰方法没有从根本上改变肿瘤细胞表面MHC1类分子表达减少,肿瘤特异或非特异性抗原不能表达在细胞表面的弊端,自体修饰肿瘤细胞瘤苗免疫反应的诱发作用不强,临床疗效并不十分理想。
单一蛋白成分瘤苗(如用从黑色素瘤细胞中提取出的MAGE1、MAGE2制备的瘤苗),这些瘤苗不能克服肿瘤的异质性,采用这样的瘤苗治疗只会使免疫系统对实体瘤中表达该抗原肿瘤细胞产生杀伤,而对同一肿瘤中不表达该抗原的肿瘤细胞不会杀伤,单一蛋白成分瘤苗的临床疗效亦不理想。
热休克蛋白肽复合体瘤苗是利用从肿瘤细胞中分离出的热休克蛋白肽复合体制备的肿瘤疫苗,这种蛋白成分的瘤苗可以克服MHCI类分子的限制能够用于同种异体,并能够克服肿瘤的异质性,实验研究表明这种瘤苗具有较好的抑瘤作用,但这种瘤苗的制备成本很高、瘤苗细胞数量少,不便于临床实际应用。
树突状细胞肿瘤疫苗(DC细胞瘤苗)是目前国内外热点研究的肿瘤疫苗,DC细胞瘤苗是利用树突状细胞与肿瘤细或肿瘤细胞内容物混合培养而制备的肿瘤瘤苗,这些肿瘤苗瘤苗虽可克服了肿瘤细胞抗原性弱和不能用于同种异体的弊端,但热休克蛋白肽复合体和DC前体细胞的分离提取比较复杂,且费用较高,不适于临床应用。本项发明是为建立一种有效并便于临床应用的肿瘤疫苗制备方法。
技术实现要素:
本发明的目的在于克服现有技术的不足,本发明提供一种M1巨噬细胞肿瘤疫苗的制备方法。本发明解决其技术问题是采取以下技术方案实现的:M1巨噬细胞肿瘤疫苗的制备方法,包含下列步骤:诱导肿瘤细胞坏死及制备裂解液,进行单核细胞-巨噬细胞的分化培养,进行巨噬细胞的M1极化诱导以及肿瘤细胞裂解液刺激M1巨噬细胞。
优选地,所述制备肿瘤细胞裂解液步骤包含下列步骤:研碎肿瘤组织并进行一次过滤得到滤液;将所述滤液加入到装有Ficoll-Hypaque淋巴细胞分离液的试管中,2000rpm离心20min,吸取单个核细胞层得到肿瘤细胞,将所述肿瘤细胞移入到另一试管中;生理盐水悬浮所述肿瘤细胞,1000rpm离心10min,弃上清,重复三次;用生理盐水将所述肿瘤细胞调成4×107c/mL,37℃、5%CO2条件下放置48小时制得细胞悬液;将所述细胞悬液置于-80℃冰箱25min,取出迅速放入37℃水浴中10min,反复3次;将所述细胞悬液1000rpm离心5min,取上清液,分装到离心管中,-20℃保存。
优选地,所述巨噬细胞的分化培养步骤包含下列步骤:将肝素抗凝血注入离心管中,在4℃下1000rpm离心5min,弃上层血浆得到血细胞;向所述血细胞中加Hank’s液或生理盐水并混匀制成血细胞悬液,将所述血细胞悬液缓慢加入到装有Ficoll-Hypaque的离心管中,在4℃下2000rpm离心20min;取PBMC并将其移入离心管中,加Hank’s液或生理盐水,在4℃下1000rpm离心5min,弃上清,用Hank’s液或生理盐水洗细胞3次;加入无血清培基悬浮所述细胞,将细胞悬液加入培养瓶中,37℃、5%CO2条件下培养2小时;轻轻摇晃培养瓶,吸弃非贴壁细胞。
优选地,所述巨噬细胞的M1极化诱导步骤包含下列步骤:加入含GM-CSF的无血清培基,37℃、5%CO2条件下培养9天;加入含IFN-γ以及肿瘤细胞裂解液的无血清培基,37℃、5%CO2条件下培养3天;轻轻摇晃培养瓶,吸弃培基;用生理盐水冲洗贴壁细胞,刮下贴壁细胞,转至离心管中,补加盐水,4℃下1000rpm离心5min,弃去上清;生理盐水洗细胞并重悬细胞,加入CpG,过滤,将细胞悬液装入冻存管中,封口粘贴标签。
本发明的优点和积极效果是:M1型巨噬细胞是机体病原微生物和坏死组织的主要清理细胞,且具有抗原呈递功能,在特异性免疫反应的诱发和免疫调节过程中起关键作用。采用坏死肿瘤细胞裂解液刺激M1巨噬细胞而制备的M1巨噬细胞肿瘤疫苗,将能够克服肿瘤细胞因表面抗原表达不足、抗原性弱的弊端,具有良好的诱发特异性抗肿瘤免疫反应作用。
附图说明
图1为M1型巨噬细胞程度CD68、CD14分子的表达率;
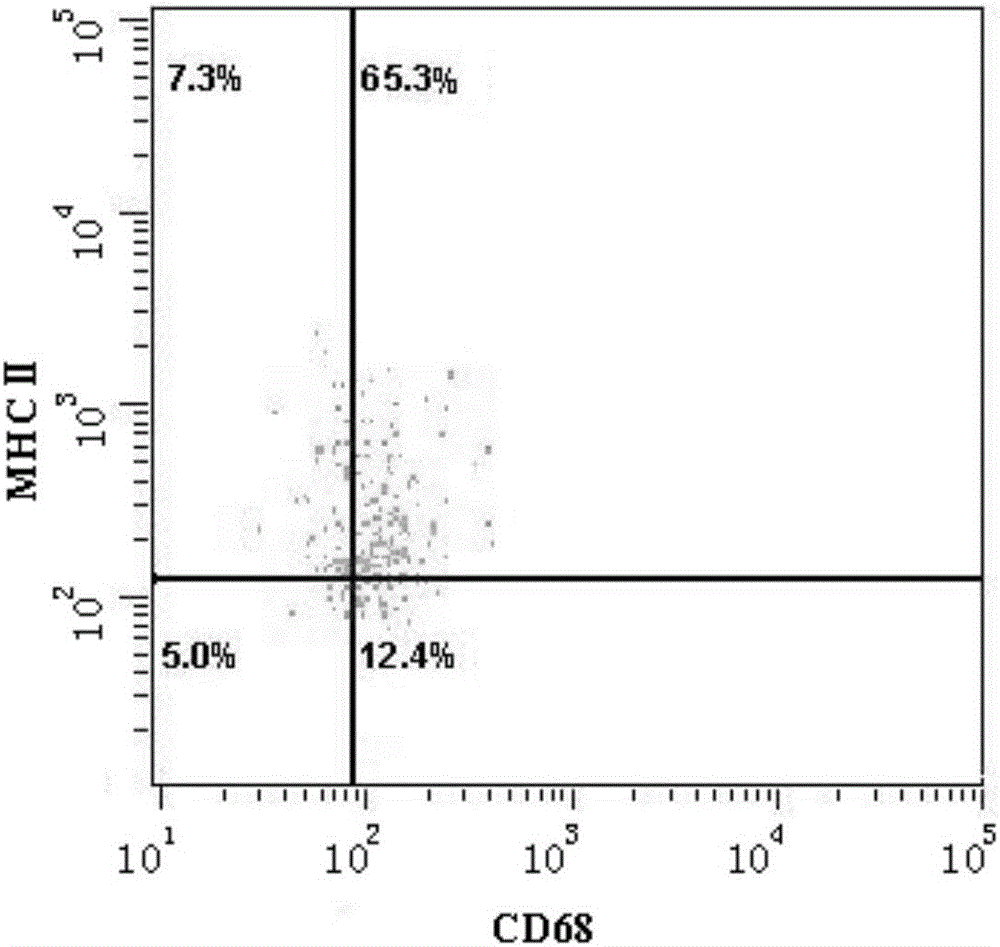
图2为M1型巨噬细胞程度CD68、MHCⅡ分子的表达率;
图3为M1型巨噬细胞程度CD80、CD86分子的表达率;
图4为实验组小鼠的处理流程;
图5为各组小鼠的肿瘤形成率;
图6为各组小鼠的肿瘤体积;
图7为各组小鼠的肿瘤重量;
图8为各组小鼠的肿瘤脾细胞肿瘤杀伤率。
具体实施方式
下面结合附图、通过具体实施例对本发明作进一步详述。以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
实验器材
低温常速离心机(美国,Beckman)、CO2细胞培养箱(日本,Sanyo)、移液器(美国,Thermo)、刻度吸管(美国,Kimble)、25cm2培养瓶(美国,Corning)、15ml离心管(美国,Corning)、50ml离心管(美国,Corning)、细胞刮刀(美国,Corning)、注射器芯(中国,山东威高医用高分子股份有限公司)、培养皿(美国,Corning)、细胞滤器(美国,Corning)、倒置显微镜(日本,Nikon)、冻存管(美国,Corning)。
实验试剂
Ficoll-Hypaque细胞分离液(天津灏洋生物制品科技有限责任公司))、氯化钠注射液(石家庄四药公司)、NaCl(国药泸试)、KCl(国药泸试)、MgSO4·7H2O(天津致远化学有限公司)、MgCl2·6H2O(天津致远化学有限公司)、CaCl2(天津博迪化学有限公司)、Na2HPO4·12H2O(天津市光复科技发展有限公司)、KH2PO4(天津致远化学有限公司)、葡萄糖(国药泸试)、酚红(上海宝曼生物科技有限公司)、肝素钠(上海第一生化药业有限公司)、IFN-γ(北京四环生物制药有限公司)、GM-CSF(北京双鹭药业股份有限公司)、无血清培基(Thermo)、CpG(Peprotech)。
肿瘤细胞裂解液的制备:新鲜肿瘤组织(离体0.5小时内)剪成1mm3方块,洗涤后,采用注射器芯在培养皿中将瘤块研碎,200目滤网过滤,将滤液加入到装有稀释的Ficoll-Hypaque试管中[Ficoll-Hypaque的密度为1.077±0.02):生理盐水=3:1],2000rpm离心20min,吸取单个核细胞层,将肿瘤细胞移入到另一试管中。生理盐水悬浮细胞,1000rpm离心10min,弃上清,重复三次。用生理盐水将细胞调成4×107c/mL,37℃、5%CO2条件下放置48小时,将细胞悬液置于-80℃冰箱25min,取出迅速放入37℃水浴中10min,反复3次。1000rpm离心5min,取上清液,分装到离心管中,-20℃保存。
配置Hank’s液:1.甲液:NaCl 160g、KCl8g、MgSO4·7H2O 2g、MgCl2·6H2O 2g加入到800ml三蒸水,溶解。CaCl2 2.8g溶于100ml三蒸水,溶解后加入到上述800ml溶液中,补足三蒸水至1000ml。2.乙液:Na2HPO4·12H2O 3.04g、KH2PO41.2g、葡萄糖20g加入800ml双蒸水,溶解。加入0.4%酚红溶液100ml,上述二液混合,加三蒸水至1000ml。使用时按甲液1份、乙液1份、三蒸水18份滤过,8磅20min分钟灭菌,4℃保存。
巨噬细胞的分化培养与M1极化诱导:将20ml肝素抗凝血注入50ml离心管中,在4℃下1000rpm离心5min。移弃上层血浆,加Hank’s液或生理盐水至20ml,混匀。将血细胞悬液缓慢加入到装有4ml Ficoll-Hypaque(密度:1.077±0.001)的离心管中,每管10ml,在4℃下2000rpm离心20min,吸取沉淀(PBMC层)细胞并将其移入15ml离心管中。加Hank’s液或生理盐水至15ml,在4℃下1000rpm离心5min,弃上清。Hank’s液或生理盐水洗细胞3次。加入16ml无血清培基悬浮PBMC细胞,将细胞悬液加入到25cm2培养瓶中,每瓶8ml细胞悬液,37℃、5%CO2条件下培养2小时。轻轻摇晃培养瓶,吸弃非贴壁细胞。加入含100ng/mlGM-CSF的无血清培基,每瓶12ml,37℃、5%CO2条件下培养9天。加入含100IU/ml IFN-γ及100μl/ml肿瘤细胞裂解液(制备方法如方法1)的无血清培基,每瓶4ml,37℃、5%CO2条件下培养3天。吸取2ml上清液用于支原体检查(RT-PCR法),然后轻轻摇晃培养瓶,吸弃培基。用生理盐水冲洗贴壁细胞3次,用细胞刮刀刮下贴壁细胞,转至离心管中,补加生理盐水至50mL。4℃下1000rpm离心5min,弃去上清。生理盐水洗细胞3次。1ml生理盐水重悬细胞,加入4mg/ml的0.1mlCpG,200目滤网过滤,将细胞悬液装入到2mL冻存管中,封口,粘贴标签,用于皮下接种。
效果测试:在图5到图8中,A为生理盐水注射组;B为巨噬细胞接种组;C为巨噬细胞肿瘤疫苗接种组。A、B及C组小鼠分别于左后肢皮下接种生理盐水、未经肿瘤刺激的巨噬细胞及巨噬细胞肿瘤疫苗(坏死H22肿瘤细胞刺激M1巨噬细胞而得),0.1ml/只(B组与C组接种的巨噬细胞浓度为2×106/ml,生理盐水稀释),每周1次,连续2次,间隔2周后四组小鼠分别于左前肢皮下接种生长良好的H22肿瘤细胞,0.1ml/只(细胞悬液浓度为2×106/ml,生理盐水稀释),肿瘤细胞接种4周后处死全部小鼠,并分别计算四组小鼠成瘤率,电子天平称量瘤重量,游标卡尺测量肿瘤结节的长度(L)与宽度(W),计算瘤体积。注(:体积=0.5×L×W2)。结果显示巨噬细胞肿瘤疫苗接种组肿瘤细胞攻击后肿瘤成瘤率、瘤体积及瘤重量明显低于未刺激巨噬细胞接种组和生理盐水接种组(P<0.05)。巨噬细胞肿瘤疫苗接种组的脾细胞对肿瘤细胞的杀伤率明显高于未刺激巨噬细胞接种组和生理盐水接种组(P<0.05),表明巨噬细胞肿瘤疫苗在体内能够诱发特异性抗肿瘤免疫反应。
- 还没有人留言评论。精彩留言会获得点赞!