粒径可控的单分散胰岛素/壳聚糖凝胶微球及其制备方法与流程
本发明涉及单分散微球的制备方法,具体来说是粒径可控的单分散胰岛素/壳聚糖凝胶微球及其制备方法。
背景技术:
治疗胰岛素依赖型糖尿病的首选药物胰岛素,临床上主要以针剂形式给药,多数患者终身需要频繁注射胰岛素(通常每天1~4次),伴有多种不良反应:例如低血糖反应、胰岛素浮肿、皮下脂肪萎缩、肥大性脂肪营养不良、注射部位炎症、硬结及耐药性等,给患者带来诸多不便和巨大痛苦。
Mickel C等报道,胰岛素活性分子能透过肠壁吸收入血,小肠的吸收率最高,结肠与直肠也有较高的吸收率。Bendayan M证实胰岛素分子是通过小肠上皮细胞的转运进入肠内环境,再渗透入毛细血管内皮细胞质膜并进入血液循环而发挥作用。
载药缓释微球是一种应用较为广泛的新型给药体系,其以适宜的高分子材料为载体,将药物分散或包埋在其中形成球形载体给药系统,粒径为一到几百微米,可通过口服、注射、吸入等方式进入体内。使用载药缓释微球后,可在较长时间内维持体内有效药物浓度,提高药效并降低药物的不良反应,可以提高用药的有效性、安全性、顺从性,具有重要的临床应用价值。
壳聚糖是一种生物相容性好、低毒的辅料,广泛应用于药物的各种剂型。Valerie D等研究证明,壳聚糖能够打开消化道上皮细胞间的紧密连接,从而促进蛋白多肽类药物在消化道的吸收。将胰岛素制成缓释微球进行肠溶包衣或装入肠溶胶囊口服给药,可以克服胰岛素作为蛋白质在胃肠道内的吸收难以克服酸催化分解、蛋白酶降解以及粘膜穿透性差等屏障、生物利用度低下等缺点,同时又可以克服患者终身需要频繁注射胰岛素带来的不便及产生的多种不良反应。
传统的微球制备技术一般都需要先通过机械搅拌或者超声振荡得到分散的乳滴。这样引入的机械外力是不稳定、不均匀的(如距离搅拌中心或超声发生源远近不同部位受力不同),从而导致得到的乳滴大小、乳滴内部物质含量和浓度不均匀,最终制备的药物载体尺寸不均一,结构差异性大,分散性差。而药物载体的粒径分散性和结构是决定药物体外释放行为的最重要因素。药物载体的尺寸不均一将导致无法精确考察载药微球量与装载药物量、载体粒径与药物释放的关系,且靶向性差,难以安全用于临床疾病的治疗。
由于机械搅拌或震荡有很强的剧烈性,往往还会导致产生的乳滴碰撞、破碎,使其中的药物扩散出去造成损失,因而制备的载体的药物装载率低,还会造成生物活性药物失活。而且传统的搅拌制备乳滴过程耗时较长,乳滴无法及时迅速地被处理为固化的载体,会使乳滴中的药物沉降或积聚到乳滴表面,造成载体对药物的包封率低,在后续的药物释放中表现为突释现象明显和药物释放过快,甚至达不到临床治疗所需的药物缓释的要求。另外,传统的制备过程常常使用乳化剂,还会引入较多的外部不可控因素,使得制备的药物载体质量参差不齐,制备方法重现性差。
微流控液滴技术是在微流控装置上操纵微小体积液体—液滴,液滴体积小,易于操控,可精确控制液体流速,确保制备的液滴大小均一、组成均匀、性质稳定。由于微流控中液滴温和的产生方式,减少或避免了液滴间的碰撞破碎,且每个液滴都被不相容的另一相包围,液滴相互间不接触,避免了样品间的交叉感染。而且在微流控装置上调控流体的流速,可以调控生成液滴的大小。因此利用微流控装置可以调控制备所需大小、粒径均一的单分散液滴,再固化成目标大小、粒径均一的单分散的微球。
技术实现要素:
为了解决上述问题,本发明的目的在于提供一种粒径可控的单分散胰岛素/壳聚糖凝胶微球的制备方法。
本发明的另一目的在于提供一种粒径可控的单分散胰岛素/壳聚糖凝胶微球。
为了实现本发明的目的,本发明提供了一种粒径可控的单分散胰岛素/壳聚糖凝胶微球的制备方法,其步骤如下:配制凝胶浴溶液、分散相溶液和连续相溶液,在微流控装置中控制分散相溶液和连续相溶液的流速和粘度,当分散相溶液与连续相溶液汇合后,获得尺寸均一的胰岛素/壳聚糖溶液液滴,所述液滴通过固化获得粒径可控的单分散胰岛素/壳聚糖凝胶微球。
更具体地,该方法包括以下步骤:
(1)凝胶浴溶液的配制:按比例将胺或氨基醇加入醇中混合均匀,配制成胺或氨基醇体积百分比为20%~55%的凝胶浴溶液;
(2)分散相溶液和连续相溶液的配制:将壳聚糖加入含重量百分比为0.5%~2%的醋酸水溶液中,再加入pH为1.5~3.0的重量百分比为10%~30%的胰岛素溶液,混合均匀,作为分散相溶液;将低极性化合物与醇混合,配制低极性化合物与醇体积比为100:(0~250)的连续相溶液;
(3)调整分散相和连续相的流速与粘度:调整分散相流速为4~30μL·min-1,连续相流速为50~300μL·min-1,分散相粘度为1~500mPa·s,连续相粘度为50~2500mPa·s;
(4)胰岛素/壳聚糖液滴的形成:步骤(2)所得分散相溶液和连续相溶液在微流控装置中汇合后,可获得粒径可控的单分散胰岛素/壳聚糖溶液液滴;
(5)液滴固化成微球:收集步骤(4)所得的液滴于步骤(1)配好的凝胶浴溶液中,液滴可固化或半固化,再加入醛类,于25~60℃进一步固化成粒径可控的单分散胰岛素/壳聚糖凝胶微球。
其中,步骤(1)所述的醇为异戊醇、异辛醇或己醇;胺为三乙胺或三辛胺;氨基醇为三乙醇胺或二乙醇胺。
步骤(2)中所述的低极性化合物为硅油、大豆油或色拉油;所述的醇为异戊醇、异辛醇或己醇中的一种或两种。
步骤(5)所述的醛类是低毒或无毒的戊二醛或香草醛,优选无毒的香草醛,因为使用香草醛制得的胰岛素/壳聚糖凝胶微球降解出的香草醛是无毒的,对人体无害。
所述制备方法还包括步骤(6)胰岛素/壳聚糖水凝胶微球的后处理:将步骤(5)所得的胰岛素/壳聚糖凝胶微球经过过滤或滗析后,残留的有机溶液用有机溶剂洗涤,滤去溶剂,真空干燥6~9h,即得单分散性胰岛素/壳聚糖凝胶微球;所述有机溶剂为烃、卤代烃、醇及酮的一种或几种;所述的烃为戊烷、己烷、石油醚;卤代烃为二氯甲烷、三氯甲烷、四氯化碳;醇为甲醇、乙醇、异丙醇;酮为丙酮或丁酮。
本发明进一步提供了上述制备方法制备的粒径可控的单分散胰岛素/壳聚糖凝胶微球,所述单分散胰岛素/壳聚糖凝胶微球的粒径范围为50~600μm,分散系数CV小于6%;载药率5%~30%,包埋率75%~85%,且具有胰岛素缓释性能,在pH为6.5~7.6的缓冲溶液中37℃下14h累积释药率小于60%。
本发明利用微流控液滴技术制备的单分散胰岛素/壳聚糖凝胶微球表面形态较好,粒径范围为50~600μm,特别是使用香草醛制得的微球降解出的香草醛对人体无害;通过调整毛细管直径及分散相溶液和连续相溶液的流速与粘度,可以方便地对所制备的胰岛素/壳聚糖凝胶微球的尺寸进行调控。
附图说明
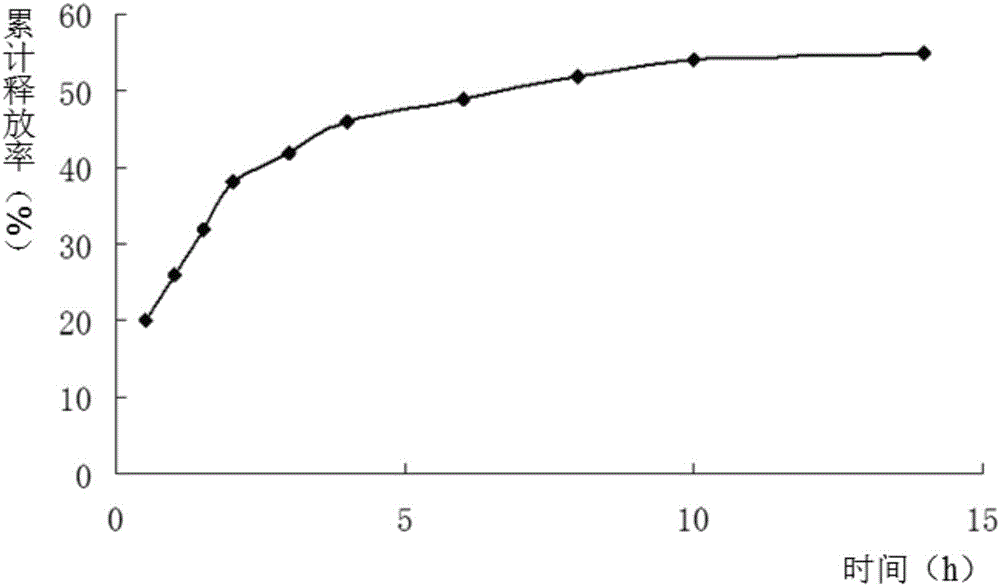
图1是实施例1制备的单分散胰岛素/壳聚糖微球的缓释曲线图。
图2是实施例2制备的单分散胰岛素/壳聚糖微球的缓释曲线图。
图3是实施例3制备的单分散胰岛素/壳聚糖微球的缓释曲线图。
图4是实施例4制备的单分散胰岛素/壳聚糖微球的缓释曲线图。
图5为本发明使用的微流控装置的示意图。
图6为图5的A部放大图。
图中各部件的标记如下:1-1、分散相注射泵;1-2、连续相注射泵;2-1、分散相注射器;2-2、连续相注射器;3、毛细管。
具体实施方式
下面结合具体实施例,进一步阐述本发明相关内容。需要指出的是,这些实施例仅用于说明本发明而不用于限制本发明的范围,而且,在阅读了本发明的内容之后,本领域相关技术人员可以对本发明做出各种改动或修改,这些等价形式同样落入本申请所附权利要求书所限定的范围。
实施例1
粒径可控的单分散胰岛素/壳聚糖凝胶微球的制备方法,具体为:
将5mL三乙醇胺加入到16mL异辛醇中,磁力搅拌混匀,配制成凝胶浴溶液。
将壳聚糖加入含重量百分比为1%的醋酸水溶液中,配成重量百分比为2.5%的壳聚糖溶液;再按重量比为5:1向壳聚糖溶液中加入pH为2.0的重量百分比20%胰岛素盐酸溶液,混合均匀,作为分散相溶液;将异辛醇与硅油按体积比1:1混合均匀,获得连续相溶液。
将上述分散相溶液和连续相溶液分别装入10mL和60mL的注射器2-1、2-2中,置于两台注射泵1-1、1-2上,连接到图5和图6所示的微流控装置中,设置分散相流速为10μL·min-1,粘度200mPa·s,连续相流速为100μL·min-1,粘度560mPa·s,微流控装置中毛细管3的外径/内径为165/98μm,开启微流控装置,制备粒径可控的单分散胰岛素/壳聚糖溶液液滴;收集生成的胰岛素/壳聚糖溶液液滴于装有上述凝胶浴溶液的培养皿中,缓缓搅拌室温下形成凝胶后,加入0.2mL戊二醛(25%)于37℃下固化反应3.0h,液滴即可固化成胰岛素/壳聚糖凝胶微球。经过简单的滗析后,残留的有机溶液用石油醚、氯仿各洗涤2次,再用乙醇洗涤2次后,滤去乙醇,真空干燥,即得单分散胰岛素/壳聚糖凝胶微球。
本实施例制备的胰岛素/壳聚糖凝胶微球呈近圆球形,表面有轻度皱褶,粒径均一,具有单分散性,粒径为85μm,载药率11%,包埋率76%,微球在pH为6.86的混合磷酸盐缓冲溶液中37℃下缓释性能见图1。由图1可见,微球突释程度小,具有缓释特性,37℃下14h累积释药率小于50%。
实施例2
将18mL三乙胺加入到20mL异辛醇中,磁力搅拌混匀,配制成凝胶浴溶液。
将壳聚糖加入含重量百分比为1%的醋酸水溶液中,配成重量百分比为2.5%的壳聚糖溶液;再按重量比为5:1向壳聚糖溶液中加入pH为2.0的重量百分比20%胰岛素盐酸溶液,混合均匀,作为分散相溶液;将异辛醇与硅油按体积比1:1混合均匀,获得连续相溶液。
将上述分散相溶液和连续相溶液分别装入10mL和60mL的注射器2-1、2-2中,置于两台注射泵1-1、1-2上,连接到图5和图6所示的微流控装置中,设置分散相溶液流速为5μL·min-1,粘度200mPa·s,连续相溶液流速为70μL·min-1,粘度560mPa·s,微流控装置中毛细管3的外径/内径为165/98μm,开启微流控装置,制备单分散胰岛素/壳聚糖溶液液滴;收集生成的液滴于装有上述凝胶浴溶液的培养皿中,缓缓搅拌室温下形成凝胶后,加入0.01g香草醛于60℃下固化反应1.5h,液滴即可固化成胰岛素/壳聚糖凝胶微球。经过简单的滗析后,残留的有机溶液用石油醚、氯仿各洗涤2次,再用乙醇洗涤2次后,滤去乙醇,真空干燥,即得单分散胰岛素/壳聚糖凝胶微球。
本实施例制备的单分散胰岛素/壳聚糖凝胶缓释微球呈近圆球形,表面有一定程度皱褶,粒径均一,具有单分散性,粒径为55μm,载药率10%,包埋率75%,微球在pH为7.2的混合磷酸盐缓冲溶液中37℃下缓释性能见图2。由图2可见,微球突释现象不明显,具有缓释特性,37℃下14h累积释药率小于60%。
实施例3
将15mL三乙胺加入到20mL异辛醇中,磁力搅拌混匀,配制成凝胶浴溶液。
将壳聚糖加入含重量百分比为1%的醋酸水溶液中,配成重量百分比为2.5%的壳聚糖溶液;再按重量比为5:1向壳聚糖溶液中加入pH=2.0的重量百分比30%胰岛素盐酸溶液,混合均匀,作为分散相溶液;将异辛醇与硅油按体积比2:1混合均匀,获得连续相溶液。
将上述分散相溶液和连续相溶液分别装入10mL和60mL的注射器2-1、2-2中,置于两台注射泵1-1、1-2上,连接到图5和图6所示的微流控装置中,设置分散相流速为12μL·min-1,粘度270mPa·s,连续相流速为100μL·min-1,粘度420mPa·s,微流控装置中毛细管3的外径/内径为360/225μm,开启微流控装置,制备单分散胰岛素/壳聚糖溶液液滴;收集生成的液滴于装有上述凝胶浴溶液的培养皿中,缓缓搅拌室温下形成凝胶后,加入0.01g香草醛于50℃下固化反应2.0h,液滴即可固化成胰岛素/壳聚糖水凝胶微珠。经过简单的滗析后,残留的有机溶液用石油醚、氯仿各洗涤2次,再用乙醇洗涤2次后,滤去乙醇,真空干燥,即得单分散胰岛素/壳聚糖凝胶缓释微球。
本实施例制备的单分散胰岛素/壳聚糖凝胶缓释微球呈椭球形,粒径为250μm,表面有一定程度皱褶,粒径均一,具有单分散性。微球载药率16%,包埋率82%,微球在pH为6.5的混合磷酸盐缓冲溶液中37℃下缓释性能见图3。由图3可见,微球突释程度较轻,具有缓释特性,37℃下14h累积释药率小于50%。
实施例4
将15mL三乙胺、20mL无水乙醇加入到20mL异辛醇中,磁力搅拌混匀,配制成凝胶浴溶液。
将壳聚糖加入含重量百分比为1%的醋酸水溶液中,配成重量百分比为2.5%的壳聚糖溶液;再按重量比为5:1向壳聚糖溶液中加入pH=2.0的重量百分比20%胰岛素盐酸溶液,混合均匀,作为分散相溶液;将异辛醇与硅油按体积比1:1混合均匀,获得连续相溶液。
将上述分散相溶液和连续相溶液分别装入10mL和60mL的注射器2-1、2-2中,置于两台注射泵1-1、1-2上,连接到图5和图6所示的微流控装置中,设置分散相流速为10μL·min-1,粘度250mPa·s,连续相流速为100μL·min-1,粘度560mPa·s,微流控装置中毛细管3的外径/内径245/98μm,开启微流控装置,制备单分散胰岛素/壳聚糖溶液液滴;收集生成的液滴于装有上述凝胶浴溶液的培养皿中,缓缓搅拌室温下形成凝胶后,加入0.01g香草醛于60℃下固化反应1.5h,液滴即可固化成胰岛素/壳聚糖水凝胶微珠。经过简单的滗析后,残留的有机溶液用石油醚、氯仿各洗涤2次,再用乙醇洗涤2次后,滤去乙醇,真空干燥,即得单分散胰岛素/壳聚糖凝胶缓释微球。
本实施例制备的单分散胰岛素/壳聚糖凝胶缓释微球呈椭球形,粒径为95μm,表面有一定程度皱褶,粒径均一,具有单分散性。微球载药率11%,包埋率78%,微球在pH为7.6的混合磷酸盐缓冲溶液中37℃下缓释性能见图4。由图4可见,微球突释现象不明显,具有缓释特性,37℃下14h累积释药率小于45%。
- 还没有人留言评论。精彩留言会获得点赞!