一种新型高效复合止血海绵及其制备方法与流程
本发明属于医疗止血海绵领域,具体的涉及一种以胶原蛋白和氧化再生纤维素进行交联制备的复合止血海绵及其制备方法。
背景技术:
止血对于口腔颌面外科手术的成功至关重要,尤其对于伴有并发症且经历了正颌外科手术后患者以及具有出血倾向如血小板减少症患者。随着止血方法的发展,很多填塞和缝合方法在临床常用。许多填塞止血材料,包括明胶海绵、甲壳素和壳聚糖海绵被用于手术中,这些材料各有优势和局限性。例如,明胶海绵敷于伤口,材质柔软,压力不足,使止血时间略长,无抗炎作用因此无法控制牙槽内感染。而且它的生物降解速度较快,不适于植入体内。甲壳素和壳聚糖海绵止血作用研究仍处于初期,需要更多论述。因此不断开发新型的、生物相容性好、止血效果快的止血材料是本领域不断研发的课题。
技术实现要素:
本发明的目的是提供一种新型高效复合止血海绵及其制备方法,该复合止血海绵,将氧化再生纤维素及I型胶原蛋白按一定比例进行交联,所制备的止血海绵加速了止血进程,且无生物毒性、促进组织愈合。
本发明采用的技术方案是:一种新型高效复合止血海绵:由胶原蛋白和氧化再生纤维素交联制得;所述的氧化再生纤维素的质量为胶原蛋白质量的0.1-1%。
一种新型高效复合止血海绵的制备方法,方法如下:
1)复合材料Col-ORC的制备:将胶原蛋白海绵(Col)溶于乙酸水溶液中,得到胶原蛋白乙酸水溶液,将适量氧化再生纤维素(ORC)加入到胶原蛋白乙酸水溶液中,常温下,磁力搅拌至粉末分散均匀后,冷冻干燥24-48h,得到胶原蛋白和氧化再生纤维素的复合材料Col-ORC。
优选的,所述的胶原蛋白乙酸水溶液为:每10ml乙酸水溶液加入0.03-0.1g胶原蛋白海绵;按体积百分比,所述的乙酸水溶液的浓度为0.5-1.2%。
优选的,氧化再生纤维素的加入量为胶原蛋白质量的0.1-1%。
2)将复合材料Col-ORC置于体积百分浓度为15-45%的乙醇/MES缓冲液中浸泡30-45min,过滤,弃滤液得过滤物;再按料液比1:2.5-4.5,取过滤物和体积百分浓度为35-45%的乙醇/MES缓冲液,浸泡3-6h后,缓慢添加1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)至浓度为10-20mg/mL,随后再添加N-羟基琥珀酰亚胺(NHS)至浓度为2.25-3.75mg/mL,反应4-8h后,用1M磷酸一氢钠中和过量的EDC和NHS 1-3h,过滤,弃滤液,去离子水洗涤,得交联产物。
3)将交联产物冷冻干燥,得到新型高效复合止血海绵。
上述的新型高效复合止血海绵的制备方法,所述的胶原蛋白海绵的制备方法如下:
1)去脂:将新鲜牛跟腱刮去表面的筋膜、油脂,用蒸馏水浸泡、洗涤,切碎后,放入组织捣碎机中,捣碎匀浆;用质量分数为0.05%-0.2%的碳酸钠溶液浸泡10-18h,过滤,得去脂处理的牛跟腱。
2)提取:取去脂处理的牛跟腱,加入胃蛋白酶和乙酸水溶液,在0-4℃下搅拌3-4天,所得粗提液,离心,取上清液。优选的,胃蛋白酶的加入量为,每100克去脂处理的牛跟腱,加入胃蛋白酶3-5g。
3)盐析:向离心后的上清液中,搅拌下,加入NaCl颗粒至氯化钠的浓度达到2-3M,待沉淀析出后静置12-18h,过滤,得白色粘稠状的沉淀。
4)透析:将白色粘稠状的沉淀用0.1M Tris-HCl溶液溶胀10-18h,之后装入截留分子量为7000-14000的透析袋中,依次采用0.5M、0.3M、0.1M的乙酸溶液作为透析外液,每种浓度分别透析1.5-3天,最后用蒸馏水作为透析外液,透析2-4天,得到透析后的胶原蛋白溶液。
5)干燥:将透析后的胶原蛋白溶液放入容器中,冰箱预冻后,放入冷冻干燥机中,冷冻干燥24-48h,得到胶原蛋白海绵。
本发明的有益效果是:本发明从牛跟腱中提取胶原蛋白溶液后,引入氧化再生纤维素粉末,经无毒交联后,制成不同比例的Col/ORC止血复合材料。通过表面结构观察,理化性能分析,生物安全性和有效性分析,使新型Col/ORC止血复合材料达到更有效的止血,快速体内降解,并且促进组织愈合。
附图说明
图1a是胶原蛋白海绵和不同/氧化再生纤维素含量的复合止血海绵的SEM图;
其中:(A)Control(创尔胶原蛋白海绵),500×,(a)200×;
(B)Col(自制胶原蛋白海绵),500×,(b)200×;
(C)Col-0.25%ORC,500×,(c)200×;
(D)Col-0.5%ORC,500×,(d)200×;
(E)Col-1%ORC,500×,(e)200×。
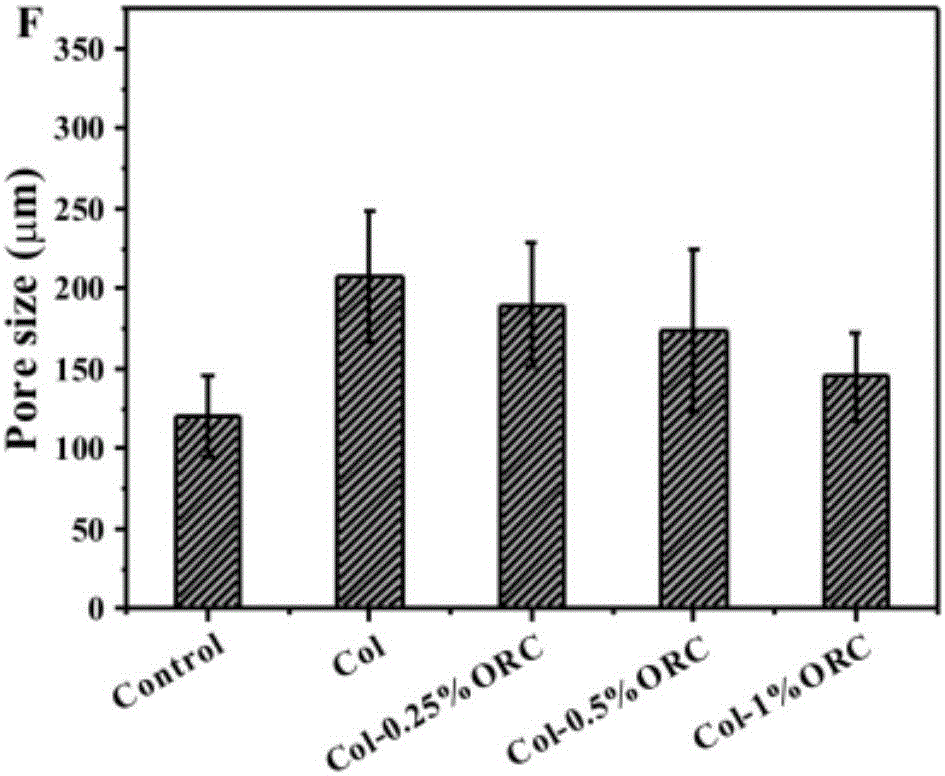
图1b是胶原蛋白海绵和不同/氧化再生纤维素含量的复合止血海绵的孔径分布图。
图2是胶原蛋白海绵和不同/氧化再生纤维素含量的复合止血海绵的红外谱图。
图3是为实施例1-实施例3制备的复合止血海绵对ACC-M细胞的细胞毒性。
图4a是Col与不同含量Col/ORC复合止血海绵拉伸强度对比图。
图4b是Col与不同含量Col/ORC复合止血海绵接触角测定对比图。
图4c是Col与不同含量Col/ORC复合止血海绵孔隙率对比图。
图4d是Col与不同含量Col/ORC复合止血海绵吸水率对比图。
图5是在兔耳动脉和肝损伤模型中,Col和不同含量Col/ORC复合止血海绵的出血量。
图6是不同材料分别植入兔腿部1天,7天,14天和28天后的局部组织病理图(HE染色)。
具体实施方式
实施例1
(一)胶原蛋白海绵的制备
1)去脂:将新鲜牛跟腱刮去表面的筋膜、油脂,用蒸馏水浸泡、洗涤,切碎后,放入组织捣碎机中捣碎匀浆。用质量分数为0.1%的碳酸钠溶液浸泡12h,过滤、得去脂处理的牛跟腱。
2)提取:取上述得到的去脂处理的牛跟腱10g放入三口烧瓶中,加入0.45g的胃蛋白酶和约1000ml的0.3%乙酸溶液。在0-4℃下搅拌3天。将所得粗提液在高速冷冻离心机中离心,转速10000rpm离心20min,取上清液。
3)盐析:向离心后的上清液中,搅拌下,加入NaCl颗粒至氯化钠的浓度达到2-3M,待沉淀析出后静置12-18h,过滤,得白色粘稠状的沉淀。
4)透析:将白色粘稠状的沉淀,用0.1M Tris-HCl溶液溶胀12h,之后装入截留分子量为1万的透析袋中,依次采用0.5M、0.3M、0.1M的乙酸溶液作为透析外液,每种浓度透析2天。最后用蒸馏水作为透析外液,透析3天,得到透析后的胶原蛋白溶液。
5)干燥:将透析后的胶原蛋白溶液放入不锈钢盘中,冰箱预冻,然后放入冷冻干燥机中,冷冻干燥24-48h,得到胶原蛋白海绵(Col),存储于-20℃,备用。
(二)复合止血海绵的制备
1)复合材料Col-ORC的制备:按照每10ml乙酸水溶液(1%v/v)加入0.06g胶原蛋白海绵(Col),配制胶原蛋白乙酸水溶液。取100ml胶原蛋白乙酸水溶液,加入氧化再生纤维素(ORC),氧化再生纤维素(ORC)的加入量为胶原蛋白质量的0.25%,常温下,磁力搅拌至粉末分散均匀后,冷冻干燥24-48h,得到胶原蛋白和氧化再生纤维素的复合材料Col-0.25%ORC。
2)取25mg复合材料Col-0.25%ORC,置于10ml乙醇/MES缓冲液(40%v/v)中,浸泡30min,过滤,弃滤液得过滤物;再按料液比1:3.5,取1mg过滤物和3.5ml乙醇/MES缓冲液(40%v/v),浸泡4h后,缓慢添加EDC至浓度为15mg/mL,随后再添加NHS至浓度为3.75mg/mL,反应4h后,用1M磷酸一氢钠中和过量的EDC和NHS 1h,过滤,弃滤液,用去离子水洗涤30min,得交联产物。
3)将交联产物放入冷冻干燥机中干燥72h,得到ORC含量为0.25%的新型高效复合止血海绵Col-0.25%ORC,存储于-20℃。
实施例2
(一)胶原蛋白海绵的制备:同实施例1
(二)复合止血海绵的制备
1)复合材料Col-ORC的制备:按照每10ml乙酸水溶液(1%v/v)加入0.06g胶原蛋白海绵(Col),配制胶原蛋白乙酸水溶液。取100ml胶原蛋白乙酸水溶液,加入氧化再生纤维素(ORC),氧化再生纤维素(ORC)的加入量为胶原蛋白质量的0.5%,常温下,磁力搅拌至粉末分散均匀后,冷冻干燥24-48h,得到胶原蛋白和氧化再生纤维素的复合材料Col-0.5%ORC。
2)取25mg复合材料Col-0.5%ORC,置于10ml乙醇/MES缓冲液(40%v/v)中,浸泡30min,过滤,弃滤液得过滤物;再按料液比1:3.5,取1mg过滤物和3.5ml乙醇/MES缓冲液(40%v/v),浸泡4h后,缓慢添加EDC至浓度为15mg/mL,随后再添加NHS至浓度为3.75mg/mL,反应4h后,用1M磷酸一氢钠中和过量的EDC和NHS 1h,过滤,弃滤液,用去离子水洗涤30min,得交联产物。
3)将交联产物放入冷冻干燥机中干燥72h,得到ORC含量为0.5%的新型高效复合止血海绵Col-0.5%ORC,存储于-20℃。
实施例3
(一)胶原蛋白海绵的制备:同实施例1
(二)复合止血海绵的制备
1)复合材料Col-ORC的制备:按照每10ml乙酸水溶液(1%v/v)加入0.06g胶原蛋白海绵(Col),配制胶原蛋白乙酸水溶液。取100ml胶原蛋白乙酸水溶液,加入氧化再生纤维素(ORC),氧化再生纤维素(ORC)的加入量为胶原蛋白质量的1.0%,常温下磁力搅拌至粉末分散均匀后,冷冻干燥24-48h,得到胶原蛋白与氧化再生纤维素的复合材料Col-1%ORC。
2)取25mg复合材料Col-0.25%ORC,置于10ml乙醇/MES缓冲液(40%v/v)中,浸泡30min,过滤,弃滤液得产物;再按料液比1:3.5,取1mg过滤物和3.5ml乙醇/MES缓冲液(40%v/v),浸泡4h后,缓慢添加EDC至浓度为15mg/mL,随后再添加NHS至浓度为3.75mg/mL,反应4h后,用1M磷酸一氢钠中和过量的EDC和NHS 1h,过滤,弃滤液,用去离子水洗涤30min,得交联产物。
3)将交联产物放入冷冻干燥机中干燥72h,得到ORC含量为1%的新型高效复合止血海绵Col-1%ORC,存储于-20℃。
实施例4效果实验
1、图1a和图1b为胶原蛋白海绵和不同/氧化再生纤维素含量的复合止血海绵的SEM图。由图1a和图1b可见,Control和Col的表面呈网状结构。当添加氧化再生纤维素短纤维后,呈束状的氧化再生纤维素纤维穿插于胶原蛋白海绵中,导致一部分胶原蛋白网状结构发生断裂。测量不同海绵的平均孔径数据表明,对比其他含氧化再生纤维素短纤维的海绵材料,自制的纯胶原蛋白海绵Col孔径最大,为209μm;而商品胶原蛋白海绵Control最小,为120μm。Col-0.25%ORC,Col-0.5%ORC和Col-1%ORC的孔径大小分别为181.5μm,168.2μm和145.5μm。显然,随着氧化再生纤维素在Col/ORC复合物中含量的增多,材料的孔径逐渐减小。
2、图2为实施例1-实施例3制备的复合止血海绵的红外谱图,由图2可见,3305cm-1处的峰是分子间氢键O-H伸缩振动。-NH一般在3540~3180cm-1有两个弱而尖吸收峰。1632cm-1,1543cm-1以及1235cm-1处的峰分别代表收缩振动在1680~1630cm-1的C=O(酰胺Ⅰ带),收缩振动在1570~1510cm-1的酰胺Ⅱ带,以及收缩振动在1335~1200cm-1的酰胺Ⅲ带。根据化学分子式和FT-IR光谱对ORC官能团的分析表明:1.在3420cm-1处的特征峰-OH的收缩振动,一般在3400~3450cm-1之间出现;2.1728cm-1处的峰代表羧基C=O的收缩振动,C=O通常在3000cm-1左右会有个小峰,在1700cm-1会有强峰;3.1016cm-1处的峰是CH2OH中C-O的收缩振动。对比Col和Col/ORC的FTIR光谱,除了在1728cm-1处轻微的羧基C=O吸收振动外,无新的波峰出现。随着氧化再生纤维素粉末在Col/ORC复合物中含量的增加,1080cm-1处峰的强度和1728cm-1处羧基C=O的峰肩逐渐增加。这表明胶原蛋白和氧化再生纤维素之间发生了特殊的分子间相互作用。1080cm-1处的峰在复合材料里可能是仲醇上C-O伸缩振动,也可能是胶原蛋白里与氨基相连的碳的C-H伸缩振动峰。1724cm-1处的峰是ORC的酯键上C=O伸缩振动特征峰,1314cm-1处的峰可能是亚甲基的弯曲振动,也可能是酯的C-O伸缩振动,而1080cm-1峰在复合材料里可能是仲醇上C-O伸缩振动,在胶原蛋白里则可能是与氨基相连的碳的C-H伸缩振动峰。
3、图3为实施1、实施例2和实施例3制备的复合止血海绵对ACC-M细胞的细胞毒性。以各材料浸提液作用于ACC-M细胞1、3和5天进行MTT实验观察,分组为:Control(阴性对照,商品胶原蛋白海绵),Col,含不同质量分数ORC(0.25%,0.5%和1%)的胶原蛋白复合材料,空白对照(未做任何处理),阳性对照(64g/L苯酚)。结果以随时间变化的相对细胞活性表示,空白对照组细胞培养1天时的细胞活性作为对照,n=6。(*P<0.05和**P<0.01,T-text)。除加入64g/L苯酚的阳性对照组之外,其他材料与ACC-M细胞培养1天和3天时均对细胞无毒性。Col-1%ORC组细胞在培养5天时,相对细胞活性值与空白对照组相比有统计学差异。胶原蛋白材料无毒性是由于提取自牛跟腱的胶原蛋白的生物安全性已被认可,材料的制备过程严格消毒,且未添加有毒化学试剂。而0.1%ORC组对培养5天后的细胞产生轻微毒性,分析原因可能是由于其羧基含量较多,长期的酸性环境下,抑制了对数生长期后细胞的生长。
4、采用实施例1制备的复合止血海绵进行急性全身毒性试验,结果如表1。不论在检测组还是对照组,所有小鼠均未发现死亡情况,且未发现任何急性全身毒性发作病理症状,表1的结果显示所有测试小鼠在24h及72h的体重变化情况。所有小鼠体重均有增加,并未见明显异常反应,说明材料无急性全身毒性。
表1急性毒性试验监测结果
5、图4a-图4d是Col与不同含量的Col/ORC复合止血海绵的拉伸强度对比,接触角测定对比,海绵孔隙率对比,海绵吸水率对比。由图4a-图4d可见,理化性能测试结果显示Col的拉伸强度最大,相比之下,Col-0.25%ORC的拉伸强度小于Col,且随着复合材料中氧化再生纤维素含量的增加,材料的拉伸强度逐渐减小。此结果也与SEM图像数据吻合,束状的氧化再生纤维素纤维穿插于胶原蛋白之间,导致部分胶原网状结构发生断裂。总之,对比其他测试材料,因为Col-0.25%ORC具有突出的孔隙率,表面湿润性以及吸水性,同时在理化性能测试中,Col的拉伸强度最佳,Col-0.25%ORC次之。
6、复合止血海绵的止血性能如表2和图5所示。通过对兔耳动脉损伤模型和肝损伤模型的止血时间和出血量进行评价。由表2和图5可见,在耳动脉损伤模型中,四种材料(Col,Col-0.25%ORC,Col-0.5%ORC和Col-1%ORC)的止血时间明显低于Control组136s的止血时间(P<0.05)。Col-0.25%ORC的止血速度(22.5±3.99s)最快,其次是Col-0.5%ORC,止血时间为30.5±8.29s。图5显示,四种材料(Col,Col-0.25%ORC,Col-0.5%ORC和Col-1%ORC)的出血量明显低于出血量为82.95±2.67g的Control组(P<0.05)。Col-0.25%ORC(36.87±9.07g)和Col-0.5%ORC(33.28±10.08g)的出血量无明显差异。Col-1%ORC和Col的出血量分别是49.18±8.29g和63.92±12.52g。
表2两种创伤模型中Col及不同Col/ORC复合海绵的平均止血时间
7、图6为不同材料分别植入兔腿部1天,7天,14天和28天后的局部组织病理图(HE染色)。图6为具有代表性的每种材料植入体内1、7、14、28天时的组织学图像。经HE染色的材料呈不规则团状或散在的碎片状,颜色为比正常组织深的深紫色或深红色。有些大块材料并未着色,是由于材料的缺失或者切片及染色过程中存在未染色区域。植入1天后,一些未被染色的Col材料在肌肉组织内呈岛状(图6a)。图6b可见真皮内急性炎症反应和散在的Col-ORC材料碎片被多核巨细胞吞噬。图6c可见不规则的Control材料,可能由于部分肌细胞坏死所致。植入7天后,大量炎症细胞浸润,毛细血管出血以及成纤维细胞增生见于肌肉组织内(图6d)。在图6e的顶部,可见炎症细胞围绕在未被染色呈岛状的Col/ORC材料周围。图6f所示,部分坏死的肌纤维被纤维性结缔组织取代,可见不规则Control材料和多核巨细胞。植入14天后(图6g-i),三组均有炎症反应,Col和Col-ORC组可见纤维组织增生。最后,残留的Col-ORC和Control材料分别见于图5h和图6i。另外,Control组仍然存在多核巨细胞。植入28天后,各组肌肉组织内均未见残留的材料碎片(图6j-l)。
由以上结果表明:FT-IR光谱结果表明氧化再生纤维素含有亲水基团,因此具有很强的韧性。氧化再生纤维素粉末可增加胶原蛋白海绵的表面湿润性、吸水性、拉伸强度。总之,对比其他测试材料,因为Col-0.25%ORC具有突出的孔隙率,表面湿润性以及吸水性,同时在理化性能测试中,Col的拉伸强度最佳,Col-0.25%ORC次之。
与Control相比,Col和Col/ORC复合物具有卓越的止血性能。Col-0.25%ORC的止血作用比Col好是由于优越的止血性能包括止血时间以及出血量。Col-0.25%ORC在止血时间上的优势主要归因于两个原因。首先,良好的表面湿润性可以使血液快速浸入具有较大扩散面积的材料表面。其次,Col-0.25%ORC含有羧基亲水基团以及良好的物理性能,从而增加了吸血量并且提供快速止血。
Col-0.25%ORC不仅可以快速吸收血液,还可以通过影响凝血因子直接参与止血过程,该材料的止血效果大幅提升,并可以在植入体内28天后完全降解,对周围组织无明显异常影响。综上所述,此复合材料可以作为止血填充体广泛用于口腔颌面外科手术中,具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!