一种壳聚糖胶原海绵敷料及其制备方法与流程
本发明属于医用敷料领域,具体涉及一种新型壳聚糖胶原海绵敷料及其制备方法。
背景技术:
皮肤是人体重要的屏障组织,具有免疫保护和修复能力。创伤后发生的皮肤屏障缺损可导致许多局部和全身问题。临床上常用生物敷料覆盖创面以暂时替代皮肤的屏障功能。理想的生物敷料应具有以下性能:1.物理性能:透气性、保湿性、机械稳定性、创面贴附性和吸收创面渗液的能力;2.生物性能:生物安全性、生物相容性、防腐抗菌性、可降解性、止血性和促进创面愈合、抑制瘢痕形成的能力。
以纤维素及其衍生物为代表的传统敷料具有吸收渗液能力强,价格便宜等优点,但不具有保湿性、抗菌性等特点,且易粘连伤口,造成换药时再次损伤;自体或异体组织覆盖物具有最佳的皮肤屏障、止血和促进上皮化的功能,但其来源有限、费用较高、难以灭菌储存;以高分子材料为原料,经加工制成薄膜、泡沫、水凝胶等不同性状的敷料,组成稳定,可大量获得,但存在生物降解性有限,易在创口表面残留等问题。
胶原由成纤维细胞合成,是细胞外基质的主要构成蛋白和重要信号分子。其中,I型胶原占皮肤胶原总含量的80-85%,是由2种不同的α链组成的异源三聚体(Gould LJ.Topical Collagen-Based Biomaterials for Chronic Wounds:Rationale and Clinical Application.Advances in wound care.2016,5(1):19-31)。I型胶原中富含甘氨酸、脯氨酸、羟脯氨酸,能较好地吸收渗液,形成凝胶,维持湿润的创面环境。通过整合素识别序列RGD和GFOGER,I型胶原能调节成纤维细胞和角质形成细胞的细胞形态,诱导其粘附、分化和移行(Gautam S,Chou CF,Dinda AK,Potdar,PD,Mishra,NC.Surface modification of nanofibrous polycaprolactone/gelatin composite scaffold by collagen type I grafting for skin tissue engineering.Mater Sci Eng C Mater Biol Appl.2014,34:402-409)。通过与内皮细胞的相互作用,可激活MAP kinase通路,促进新生血管形成(Whelan MC,Senger DR.Collagen I initiates endothelial cell morphogenesis by inducing actin polymerization through suppression of cyclic AMP and protein kinase A.The Journal of biological chemistry.2003,278(1):327-334;Neve A,Cantatore FP,Maruotti N,Corrado A,Ribatti D.Extracellular matrix modulates angiogenesis in physiological and pathological conditions.BioMed research international.2014,2014:756078),还可与创面微环境中过多的蛋白酶和炎症因子相结合,进一步调控伤口愈合的炎症反应和血管生成(冯志凯,刘华.伤口愈合机制的研究进展.中华外科杂志.2012.50:368-372)。体外实验中,I型胶原能促进细胞外基质沉积,促进创面修复(Parenteau-Bareil R,Gauvin R,Cliche S,Gariepy C,Germain L,Berthod F.Comparative study of bovine,porcine and avian collagens for the production of a tissue engineered dermis.Acta Biomater.2011,7(10):3757-3765)。
胶原因其亲水性、生物相容性、可降解性、止血性、促进细胞生长和趋化等特点,被广泛应用于医学生物材料和临床治疗(陈雪,刘娟,杨高云.胶原贴敷料的临床应用.临床和实验医学杂志.2010,09:1823-1824,1827)。单纯的胶原强度低、易降解,在潮湿环境易受细菌侵蚀而变质(柯林楠,冯晓明,王春仁.医用敷料的研究现状与进展.中国组织工程研究与临床.2010,14:521-524),促进受损组织再生能力有限(黄沙,金岩,邓天政,吴红,刘涛,刘建明.复合缓释微球的胶原膜促创面愈合的实验研究.中国修复重建外科杂志.2006,20:161-164)。通过对胶原蛋白进行改性可改善胶原材料的降解率和机械性能。壳聚糖具有良好的生物相容性、可降解性,无明显细胞毒性(Dreifke MB,Jayasuriya AA,Jayasuriya AC.Current wound healing procedures and potential care.Mater Sci Eng C Mater Biol Appl.2015,48:651-662),还具有广谱内源性抗菌、减少创面渗出和促进创伤组织再生、修复、愈合的作用(柯林楠,冯晓明,王春仁.医用敷料的研究现状与进展.中国组织工程研究与临床.2010,14:521-524),是一种较理想的生物医学材料。通过离子键和氢键作用将带正电荷的壳聚糖与带负电荷的胶原分子连接,可提高胶原材料的稳定性、抑菌性和促愈能力(黄沙,金岩,邓天政,吴红,刘涛,刘建明.复合缓释微球的胶原膜促创面愈合的实验研究.中国修复重建外科杂志.2006,20:161-164)。
壳聚糖是甲壳素的脱乙酰产物,可制备成粉末、溶液、水凝胶、涂层、膜状、孔材料、敷料、培养支架、纳米微球等多种应用形式(朱香利.壳聚糖生物医用材料的应用.中外医疗.2013,32:12-14;Lee E,Lee J,Lee IH,Yu M,Kim H,Chae SY,Jon S.Conjugated chitosan as a novel platform for oral delivery of paclitaxel.J Med Chem.2008,51(20):6442-6449)。不同分子量的壳聚糖具有不同的药理作用(张利云,丁仕力,陈璋,杨虎,张梦媛,谈伟强,宣贵达.壳聚糖护肤液保湿和抗菌作用的研究.材料导报.2013,27(1):52-6;杨虎,郑丽君,黄新建,张梦媛,谈伟强.壳聚糖护肤液促进大鼠伤口愈合的研究.中华皮肤科杂志.2011,44(12):891-3)。通常以分子量大于10万道尔顿的为高分子量壳聚糖,分子量小于10万道尔顿的为低分子量壳聚糖。高分子量壳聚糖分子通过形成致密外层膜阻止营养物质进入革兰氏阳性菌细胞,具有较好的抗革兰氏阳性菌作用。低分子量壳聚糖则可进入细胞壁空隙结构,通过干扰细胞新陈代谢抑制革兰氏阴性菌生长(郑连英,朱江峰,孙昆山.壳聚糖的抗菌性能研究.材料科学与工程.2000,18(02):22-4)。此外,壳聚糖在降解过程中氢键作用减弱,晶体结构受到破坏,因而低分子量壳聚糖更易与羟基和氨基等亲水基团形成氢键,具有相对更佳的保湿性能(俞露,文九巴,陶建中.低聚壳聚糖的性质和应用研究.河南科技学院学报,2009,37(4):43-6)。单一分子量的壳聚糖药理作用相对单一,将不同分子量的壳聚糖混合可充分发挥壳聚糖的诸多性能。
结合I型胶原和不同分子量壳聚糖的特点,通过冷冻干燥法制备机械性能稳定、保湿透气性好,抗感染能力强,能快速止血、吸收渗液、促进伤口愈合的新型壳聚糖胶原海绵敷料,将取得更优的促进伤口愈合的治疗效果。
技术实现要素:
本发明的目的是提供一种壳聚糖胶原海绵敷料,通过以下方法制备:将不同分子量壳聚糖混合物溶于醋酸溶液中,制得壳聚糖混合液;将I型胶原溶于醋酸溶液中,制得胶原溶液;再将壳聚糖混合液与胶原溶液按一定重量比例混合;将壳聚糖胶原混合液在-60℃下预冻,然后转至冷冻干燥机中真空冷冻干燥,即得到新型壳聚糖胶原海绵敷料。
具体制备步骤如下:
(1)制备壳聚糖混合液:取壳聚糖混合物,溶于1%醋酸溶液,混合均匀,制得质量浓度为3%的壳聚糖混合液。所用的壳聚糖混合物一般同时包含高分子量和低分子量壳聚糖,均匀混合,重量比范围为2:1~1:2;
壳聚糖混合物由含高分子量和低分子量壳聚糖组成,分子量大于10万道尔顿的为高分子量壳聚糖,低于10万道尔顿的为低分子量壳聚糖;
(2)制备胶原溶液:取I型胶原,溶于1%醋酸溶液,制得质量浓度为1%的胶原溶液;I型胶原主要以牛的肌腱为原料。
(3)将壳聚糖混合液、胶原溶液按7:3的重量比例混合均匀得到壳聚糖胶原混合液;
(4)制备壳聚糖胶原海绵敷料:将壳聚糖胶原混合液在-60℃下预冻4-8小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料;
(5)采用环氧乙烷消毒处理。
本发明提供的一种壳聚糖胶原海绵敷料,是一种结合不同分子量壳聚糖和I型胶原的优势,制备出具有稳定机械性能、抗菌、保湿、止血和促进伤口愈合功能且价格低廉的新型医用敷料。具有以下优点:1)该敷料所需原材料容易获取,成本较低,易于推广,制备的产品具有良好的天然生物活性、生物相容性和可降解性;2)该敷料制备方法简便可行,条件温和,通过离子键和氢键作用将壳聚糖与胶原分子连接,避免了引入化学交联剂带来的毒性残留问题;3)该敷料保留了I型胶原的性能:亲水性、止血性、促进细胞生长和趋化的作用;4)该敷料具有混合壳聚糖的多重性能:广谱抗菌性、保湿性、机械稳定性和促进创面修复的作用;5)该敷料含有酸溶液,为创面提供微酸环境,进一步增强其抗感染能力。
附图说明
图1为制备的新型壳聚糖胶原海绵敷料成品(含3%的壳聚糖)。
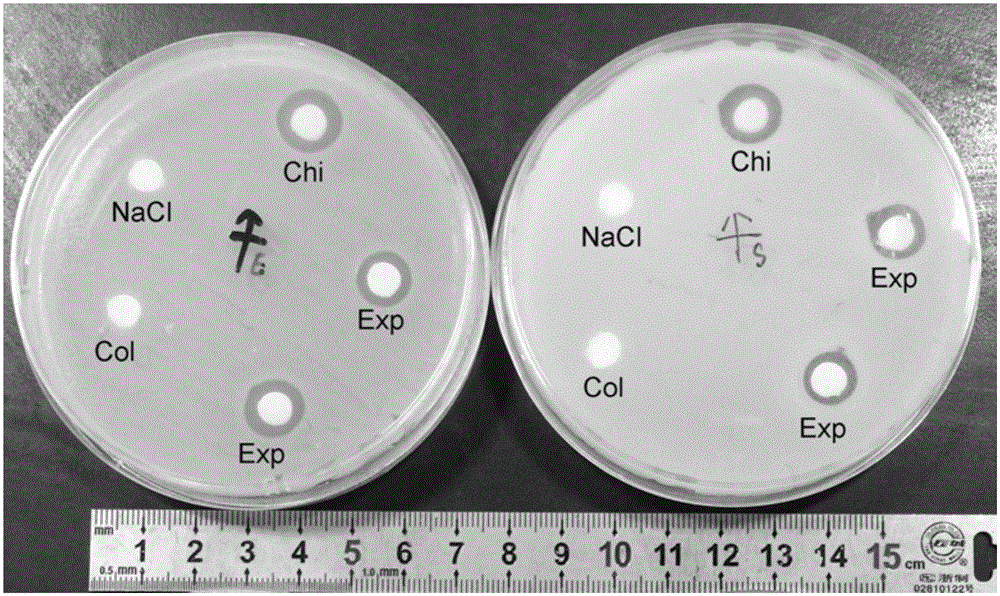
图2为对大肠杆菌(左)和对金黄色葡萄球菌(右)的抗菌作用(Col为胶原海绵敷料组,Exp为壳聚糖胶原海绵敷料组,Chi为壳聚糖海绵敷料组)。
图3为外用各种敷料后大鼠皮肤湿度增加值。
图4为促进伤口愈合实验研究中的大鼠创面模型。
图5为大鼠第3天(上)、7天(中)和14天(下)创面愈合情况(Col为胶原海绵敷料组,Exp为壳聚糖胶原海绵敷料组,Chi为壳聚糖海绵敷料组)。
图6为第3天(上)、7天(中)和14天(下)时壳聚糖海绵敷料组(左)、胶原海绵敷料组(中)、壳聚糖胶原海绵敷料组(右)创面组织HE(×400倍)染色图片。
具体实施方式
本发明结合附图和实施例作进一步的说明。
实施例1 新型壳聚糖胶原海绵敷料的制作
将1.5g高分子量壳聚糖(分子量为80万)、1.5g低分子量壳聚糖(分子量3千)加入97g1%醋酸溶液中,搅拌均匀后制得3%的壳聚糖混合液;将1gI型胶原加入99g1%醋酸溶液中制得1%胶原溶液;将壳聚糖混合液与胶原溶液按7:3的重量比混合;将壳聚糖胶原混合液在-60℃下预冻8小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料(图1),用环氧乙烷消毒。
实施例2 新型壳聚糖胶原海绵敷料的制作
将2g高分子量壳聚糖(分子量为20万和50万各半)、1g低分子量壳聚糖(分子量为5万和10万各半)加入97g1%醋酸溶液中,搅拌均匀后制得3%的壳聚糖混合液;将1gI型胶原加入99g1%醋酸溶液中制得1%胶原溶液;将壳聚糖混合液与胶原溶液按7:3的重量比混合;将壳聚糖胶原混合液在-60℃下预冻8小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料,用环氧乙烷消毒。
实施例3 新型壳聚糖胶原海绵敷料的制作
将1g高分子量壳聚糖(分子量为20万和80万各半)、2g低分子量壳聚糖(分子量为5千和1万各半)加入97g1%醋酸溶液中,搅拌均匀后制得3%的壳聚糖混合液;将1gI型胶原加入99g1%醋酸溶液中制得1%胶原溶液;将壳聚糖混合液与胶原溶液按7:3的重量比混合;将壳聚糖胶原混合液在-60℃下预冻8小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料,用环氧乙烷消毒。
实施例4 新型壳聚糖胶原海绵敷料的制作
将1.5g高分子量壳聚糖(分子量为50万和80万各半)、1.5g低分子量壳聚糖(分子量为3千和1万各半)加入97g1%醋酸溶液中,搅拌均匀后制得3%的壳聚糖混合液;将1gI型胶原加入99g1%醋酸溶液中制得1%胶原溶液;将壳聚糖混合液与胶原溶液按7:3的重量比混合;将壳聚糖胶原混合液在-60℃下预冻4小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料,用环氧乙烷消毒。
实施例5 新型壳聚糖胶原海绵敷料的制作
将2g高分子量壳聚糖(分子量为50万和80万各半)、1g低分子量壳聚糖(分子量为3千和1万各半)加入97g1%醋酸溶液中,搅拌均匀后制得3%的壳聚糖混合液;将1gI型胶原加入99g1%醋酸溶液中制得1%胶原溶液;将壳聚糖混合液与胶原溶液按7:3的重量比混合;将壳聚糖胶原混合液在-60℃下预冻6小时,然后转至冷冻干燥机中真空冷冻干燥24小时,得到壳聚糖胶原海绵敷料,用环氧乙烷消毒。
实施例6 抗菌作用研究
实验方法:
设置实验组(壳聚糖胶原海绵敷料)、壳聚糖对照组(壳聚糖海绵敷料)、胶原对照组(胶原海绵敷料),无菌操作取各组敷料各0.5g,加蒸馏水1ml,配置成0.5g/ml的敷料浸出液。分别用100uL各组敷料浸出液或生理盐水均匀浸润6mm滤纸片。分别培养大肠杆菌、金黄色葡萄球菌至对数期,各自接种100uL含菌数浊度为0.5mcf的菌悬液到相应的琼脂平板,涂布均匀,每种菌重复3块平皿。用无菌镊子将制得的含药滤纸片贴在含菌平皿上,滤纸片之间间隔一定的距离。37℃培养箱培养24h,观察结果。用游标卡尺测量抑菌圈的直径,重复3次取平均值。
实验结果:
大肠杆菌的实验结果(图2左,平板上涂布有大肠杆菌菌落,标记Chi为壳聚糖对照组,Col为胶原对照组,Exp为实验组,NaCl为含生理盐水的滤纸片组):壳聚糖对照组的抑菌圈直径最大,平均为0.800±0.233mm;实验组的抑菌圈直径平均为0.425±0.089mm,抑菌作用较强;胶原对照组和生理盐水滤纸片组无明显抑菌圈出现,无抑菌作用。
金黄色葡萄球菌的实验结果(图2右,平板上涂布有金黄色葡萄球菌菌落,标记Chi为壳聚糖对照组组,Col为胶原对照组,Exp为实验组,NaCl为含生理盐水的滤纸片组:壳聚糖对照组的抑菌圈直径最大,平均为0.912±0.181mm;实验组的抑菌圈直径平均为0.525±0.128mm,抑菌作用较强;胶原对照组和生理盐水滤纸片组无明显抑菌圈出现,无抑菌作用。
实验结果表明:壳聚糖胶原海绵敷料和壳聚糖海绵敷料对创面的常见的金黄色葡萄球菌和大肠杆菌均有良好的抗菌作用。
实施例7 大鼠背部皮肤保湿性能检测
实验方法
将脱毛后大鼠(浙江大学医学院附属第一医院动物实验室提供,体重200~250g,均为雄性)背部统一用温和清洁剂洗净,在恒定环境中静置30min,在大鼠左右背部各画2个2cm x2cm方格,共4个。用数字皮肤水分检测仪检测受试部位,重复3次,得出其平均值作为大鼠背部皮肤初始湿度值。将壳聚糖胶原海绵敷料,壳聚糖海绵敷料,胶原海绵敷料依次贴在受试部位,在25min,50min,75min,100min,125min后分别检测受试部位的湿度值,均重复检测3次,取平均值。将每次每处检测的平均值减去平均初始湿度值即为该时刻该受试部位的湿度增加值。
实验结果 检测结果参见表1,湿度增加随时间变化的曲线参见图3。
表1
表1和图3是各种敷料在25min,50min,75min,100min,125min的大鼠背部皮肤湿度增加的比例及皮肤湿度随时间变化的曲线。从表1和图3中可以看出,壳聚糖胶原海绵敷料组和壳聚糖海绵敷料组的皮肤湿度增加值高于胶原海绵敷料组和空白对照组。
以上实验表明壳聚糖胶原海绵敷料和壳聚糖海绵敷料具有良好的保湿效果。
实施例8 CCK-8法检测新型壳聚糖胶原海绵敷料对细胞的增殖毒性
原理:
Cell counting kit-8简称CCK-8试剂,利用CCK-8试剂检测细胞活性的方法通常称为cck-8法,它是为克服MTT法检测细胞活性稳定性不佳、对于重复性实验结果容易出现较大差异等不足而近年来新出现的细胞活性检测方法。基于WST-8,广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测。WST-8与MTT类似,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的formazan。对于同样的细胞,颜色的深浅和细胞数目在一定范围内呈线性关系。
实验方法:
1)材料浸提液制备将壳聚糖胶原海绵敷料、壳聚糖海绵敷料和胶原海绵敷料,加入10ml培养基置于37℃恒温箱中浸提24h即成材料浸提液。
2)细胞悬液制备取对数生长期的NIH3T3细胞,用DMEM细胞培养液离心稀释吹打成浓度为10x104/ml的均匀单细胞悬液。
3)CCK-8步骤将配置好的单细胞悬液接种于96孔培养板,每孔细胞悬液量为100ul,复种5孔,孔板周围加PBS100ul,保持湿度。放入CO2培养箱中培养。24小时后,细胞已完全贴壁,实验组分别用10%、50%、100%浓度的材料浸提液替换等量(100ul/孔)原培养液,然后置入培养箱中继续培养。同时设立阴性对照孔(不加药物,100%新鲜培养基交换)。24h后将96孔板取出,每孔加入CCK-8试剂,10ul/孔,于CO2培养箱中继续孵育1.5h后,用酶联免疫检测仪测定各组的吸光光度值,取5个孔OD值平均值,检测波长为450nm。按照下列公式计算相对增殖率(Relative growth rate,RGR):RGR=实验组A均值÷阴性对照组A均值×100%。然后根据RGR值按《GB/T 16175-1996。医用有机硅材料生物评价试验方法》中细胞相对增殖率与细胞毒性的分级的关系评定材料的细胞毒性等级。
评分相对增殖率/%
0级≥100
1级75~99
2级50~74
3级25~49
4级l~24
5级0
4)统计学分析数据以均数±标准差表示,所有数据用SPSS19.0软件处理,p<0.05有意义。组间比较采用LSD法的单因素方差分析。实验结果参见表2。
实验结果:
表2
每组进行单因素方差分析比较,结果提示阴性对照、壳聚糖胶原海绵敷料、壳聚糖海绵敷料及胶原海绵敷料对NIH3T3细胞增殖的影响无显著性差异,p>0.05。所以壳聚糖胶原海绵敷料几乎无细胞毒性。
实施例9 新型壳聚糖胶原海绵敷料对大鼠伤口愈合的促进作用
实验方法:
1)实验动物与分组:
清洁级大鼠32只(浙江大学医学院附属第一医院动物实验中心提供),体重200~250g,雄性,随机分为4组,每组8只,A组大鼠左侧创面覆壳聚糖胶原海绵敷料,右侧创面覆壳聚糖海绵敷料;B组大鼠左侧创面覆壳聚糖海绵敷料,右侧创面覆壳聚糖胶原海绵敷料;C组大鼠左侧创面覆壳聚糖胶原海绵敷料,右侧创面覆胶原海绵敷料;D组大鼠左侧创面覆胶原海绵敷料,右侧创面覆壳聚糖胶原海绵敷料。
2)动物创伤模型的建立(图4):
大鼠常规饲养3-5天后,于腹腔内注射2%戊巴比妥钠30~50ml/1000g,麻醉成功后用剪刀剪去背部区域的毛,脱毛膏进一步除去大鼠背部的毛。用外科方法剪去2块直径1.5cm的圆形全层皮肤形成开放创面,深达筋膜。
3)给药方法:
创伤模型建立后,即刻用碘伏棉球消毒止血,在A组大鼠背部,左侧创面覆壳聚糖胶原海绵敷料,右侧创面覆壳聚糖海绵敷料;B组大鼠左侧创面覆壳聚糖海绵敷料,右侧创面覆壳聚糖胶原海绵敷料;C组大鼠左侧创面覆壳聚糖胶原海绵敷料,右侧创面覆胶原海绵敷料;D组大鼠左侧创面覆胶原海绵敷料,右侧创面覆壳聚糖胶原海绵敷料。医用敷贴包扎固定。大鼠单笼饲养,每3天换药1次,直至愈合,伤口处痂皮待其自然脱落。
4)评估创面愈合情况:
(1)肉眼观察创面愈合情况。
(2)创面面积计算:采用透明硫酸膜描记法,每组内随机选取2只大鼠,共8只。分别于给药后0,3,7,14d用半透明纸绘得创面图形,再将图形描至小方格纸上,测定小方格的格数表示创面面积,并记录最终创面愈合时间。创面愈合率=(原始创面面积-未愈合创面面积)÷原始创面面积x100%。愈合时间:创面制作后,以创面愈合率≥95%的天数为创面愈合时间。记录造模后至创面愈合所需时间。创面面积结果参见表3。
(3)创面组织学染色:分别于给药后3、7、14d,每次每组处死2只大鼠,共8只。取创面边缘至创面中心宽约0.5cm的修复组织,4%多聚甲醛液固定,常规脱水透明,石蜡包埋,切片,片厚5μm,行HE染色后用普通光镜观察,行Masson染色并用Image pro plus6.0测量胶原面密度。
5)统计学分析:数据以均数±标准差表示,所有数据用SPSS19.0软件处理,p<0.05有意义。组间比较采用LSD法的单因素方差分析。
实验结果:
1)肉眼观察示:
3天时,壳聚糖胶原海绵敷料组伤口收缩,形成一类圆形凹陷,底部呈暗红或粉红色;壳聚糖海绵敷料组伤口收缩不明显,伤口处形成一类圆形凹陷,底部呈暗红色,质地较硬;胶原海绵敷料组伤口收缩不明显,伤口处为一圆形凹陷,底部呈暗红色;壳聚糖胶原海绵敷料组伤口面积明显小于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.05)(图5上)。
7天时,壳聚糖胶原海绵敷料组伤口收缩,呈圆形或椭圆形,凹陷变浅;壳聚糖海绵敷料组伤口略有收缩,呈类圆形,伤口表面皱缩,部分区域有痂皮覆盖;胶原海绵敷料组伤口稍收缩,呈圆形或椭圆形,凹陷变浅;壳聚糖胶原海绵敷料组伤口面积明显小于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.05)(图5中)。
14天时,壳聚糖胶原海绵敷料组大部分伤口创面愈合率>95%,形成线性瘢痕,部分伤口为粉红色肉芽组织覆盖,底部与周围组织齐平,表面光滑;壳聚糖海绵敷料组伤口收缩明显,呈不规则形,凹陷变浅;胶原海绵敷料组伤口进一步收缩,呈圆形或不规则形,凹陷变浅,底部呈粉红色;壳聚糖胶原海绵敷料组伤口面积明显小于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.05)(图5下)。
2)创面愈合情况参见表3
表3
表3提示各阶段壳聚糖胶原海绵敷料组创面面积均显著小于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.05),表明其能明显促进创面愈合。
3)组织学观察结果:
3天时,壳聚糖胶原海绵敷料组、壳聚糖海绵敷料组和胶原海绵敷料组创面均以白细胞浸润为主,并可见毛细血管芽及新生毛细血管形成,其中壳聚糖海绵敷料组炎症反应最为明显,壳聚糖胶原海绵敷料组和胶原海绵敷料组均可见成纤维细胞增生(图6上)。
7天时,三组炎症反应均有所消退。壳聚糖海绵敷料组仍可见较多炎症细胞,成纤维细胞增生稍混乱;胶原海绵敷料组可见少量新生血管形成,成纤维细胞增生较前明显;壳聚糖胶原海绵敷料组仍可见炎症细胞,但较稀疏,新生毛细血管数量明显增多,成纤维细胞有序增生(图6中)。
14天时,壳聚糖海绵敷料组炎症消退,可见成纤维细胞增生,其间有较大空隙,部分排列不规则,未见上皮化过程;壳聚糖胶原海绵敷料组和胶原海绵敷料组可见毛细血管数量较前增多,部分区域可见成熟血管,成纤维细胞增生规则有序,呈水平方向排列,边缘区域可见正常皮肤的表皮向创面爬行,创面开始上皮化过程(图6下)。
Masson染色结果示术后第3天,壳聚糖海绵敷料组成纤维细胞数量较少,胶原纤维面密度为31733.5±15108.14;胶原海绵敷料组可见成纤维细胞增生,胶原纤维面密度为41833.5±14970.52;壳聚糖胶原海绵敷料组成纤维细胞增生较明显,胶原纤维密度为64757.38±18133.84,显著高于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.05)。
术后第7天,壳聚糖海绵敷料组成纤维细胞数量较前增多,胶原纤维多粗大,排列不规则,面密度为47230.75±13515.17;胶原海绵敷料组成纤维细胞数量较前增多,胶原纤维较正常组织细长淡染,面密度为48758.00±13658.82;壳聚糖胶原海绵敷料成纤维细胞增生明显,胶原纤维形态着色稍接近正常组织,面密度为128114.62±25081.54,显著高于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.01)。
术后第14天,壳聚糖海绵敷料组成纤维细胞增生明显,胶原纤维排列疏松,但较前整齐,多细长淡染,面密度为86216.20±25798.86;胶原海绵敷料组成纤维细胞较前减少,胶原纤维排列整齐,面密度为130332.00±15419.70;壳聚糖胶原海绵敷料成纤维细胞数量减少,胶原纤维数量、着色、形态接近正常组织,面密度为177778.33±27328.06,显著高于壳聚糖海绵敷料组(p<0.01)和胶原海绵敷料组(p<0.01)。
综上,相比于单一壳聚糖海绵敷料和单一胶原海绵敷料,新型壳聚糖胶原海绵敷料具有更好的促进血管形成和促进创面愈合的作用。
- 还没有人留言评论。精彩留言会获得点赞!