一种淋病奈瑟菌‑沙门菌双效疫苗、制备方法及应用与流程
本发明涉及医学微生物学领域,具体涉及以淋病奈瑟菌PorB基因疫苗-沙门菌菌影疫苗为基础的双效免疫增强疫苗的制备及应用。
背景技术:
淋病是一种由淋病奈瑟菌引起的泌尿生殖系统黏膜的急性或慢性化脓性炎症,居我国性传播疾病首位。目前,全球每年约新增加10600万的淋病患者,危害十分严重。随着淋病奈瑟菌耐药菌株不断出现,抗生素治疗越来越困难,但由于对淋病奈瑟菌诱导免疫应答机制缺乏认识,目前仍没有有效的淋病疫苗面世。淋病疫苗的研制仍是淋病防治的重要策略。
淋病奈瑟菌孔蛋白B(PorB)是抗原高度保守的外膜蛋白,具有较强的免疫原性,是淋病疫苗理想的候选抗原。淋病奈瑟菌PorB通过受体TLR2和髓样分化因子88(MyD88)诱导抗原提呈细胞B细胞的增殖及树突细胞的成熟活化,细胞表面高水平表达MHCⅡ和CD86,使孔蛋白PorB成为理想的佐剂。利用淋病奈瑟菌PorB核酸疫苗采用肌肉注射方式接种BALB/c小鼠后,在小鼠血清中能检测到PorB特异性抗体的产生,但抗体水平不高(Zhu W,Thomas C E,Sparling P F.DNA Immunization of mice with a plasmid encoding Neisseria gonorrhea PorB protein by intramuscular injection and epidermal particle bombardment.[J]vaccine,2004,22:660-669)。目前,旨在提高淋病奈瑟菌PorB基因疫苗免疫效果的方法较少,主要以大肠杆菌不耐热肠毒素B亚单位作为佐剂,诱导体液免疫应答和黏膜免疫应答,但免疫应答强度增加不明显(戴志兵等.抗淋病LTB-PorB核酸疫苗与蛋白疫苗联合应用增强免疫应答的研究.分子与细胞免疫学.中国免疫学杂志.2010(26):1059-1068)。
沙门菌属于革兰阴性细菌,能感染人和多种动物,常引起胃肠炎和菌血症,是重要的人畜共患病原体。沙门菌能穿过小肠黏膜层侵入上皮细胞,靶向肠道黏膜的M细胞,通过M细胞的摄取和转运到达黏膜下淋巴组织,诱导机体产生黏膜和系统性免疫应答。在控制沙门菌感染上,尽管传统的灭活疫苗和亚单位疫苗一直在使用,但是免疫效果不理想,也存在一些副作用;减毒苗的使用类似自然感染过程,在机体内可复制增殖,却存在毒力回复和潜在的污染的可能(B.R.Singh.Salmonella vaccines for animals and birds and their future perspective.The Open Vaccine Journal,2009,2:100-112)。目前,研究和开发新的疫苗仍是预防和控制沙门菌感染的重要措施。
细菌菌影是革兰阴性菌通过噬菌体裂解基因的诱导形成不含核酸等胞质内容物的细菌空壳,它保留了天然细菌完整的外膜结构,不仅可作为疫苗诱导相关免疫应答,也可作为DNA、抗原和药物等的递送载体。尽管沙门菌菌影免疫已经在鸡等动物模型中取得了一定的免疫保护效果,但免疫保护效力仍需进一步提高(Nandre RM et al.Enhanced protective immune responses against Salmonella Enteritidis infection by Salmonella secreting an Escherichia coli heat-labile enterotoxin B subunit protein Comparative Immunology,Microbiology and Infectious Diseases,2013,36:537-548)。因此,如何提高沙门菌菌影疫苗的免疫应答水平和免疫保护效果仍需进一步研究。
技术实现要素:
本发明的目的在于提供一种淋病奈瑟菌-沙门菌双效疫苗及其制备方法。该淋病奈瑟菌-沙门菌双效疫苗具有良好的安全性、能同时诱导机体产生和提高针对淋病奈瑟菌和沙门菌的特异性体液免疫应答、黏膜免疫应答,且具有较高的抗体水平。本发明的基本设计理念为:通过借助沙门菌菌影递送载体负载淋病奈瑟菌PorB DNA疫苗;负载菌影疫苗性质稳定,不仅能同时诱导产生针对淋病奈瑟菌和沙门菌的免疫应答,而且显示了互为佐剂的双效免疫增强作用,为今后淋病奈瑟菌和沙门菌的感染机制、疫苗效果的研究奠定了基础;同时,该负载疫苗的研制进一步拓宽了新型疫苗的研究领域,因而具有广阔的市场前景。
本发明的目的还在于提供上述淋病奈瑟菌-沙门菌双效疫苗、及其制备方法的应用。
为了实现上述目的,本发明的技术方案如下:
本发明提供了一种淋病奈瑟菌-沙门菌双效疫苗,其特征在于,包括淋病奈瑟菌PorB DNA疫苗和沙门菌菌影,其中,沙门菌菌影作为递送载体负载淋病奈瑟菌PorB DNA疫苗。
本发明提供了上述淋病奈瑟菌-沙门菌双效疫苗的制备方法,其特征在于,包括以下步骤:
(1)以淋病奈瑟菌基因组为模板,使用上游引物(P1)和下游引物(P2),克隆孔蛋白B基因并构建PorB DNA疫苗:PCR扩增淋病奈瑟菌PorB基因,并将其重组到真核表达载体pVAX1中获得PorB DNA疫苗pVAX1-PorB;大量提取质粒,PBS稀释后冻存备用;其中,PCR扩增引物的核苷酸序列分别如下:
上游引物(P1):CGGGGATCCATGAAAAAATCCCTGATTGCCCTG
下游引物(P2):CCCCTGCAGTTAGAATTTGTGGCGCAGAACGAC;
(2)构建温控表达载体pB-E,并将其转化到沙门菌感受态中获得重组菌SE(pB-E),经温度诱导制得沙门菌菌影疫苗,经真空冷冻干燥制备成菌影冻干粉:可选地,其具体步骤为: 构建出含有噬菌体PhiX174裂解基因E的温控表达载体pB-E,并将其电击转化到沙门菌感受态中获得重组菌SE(pB-E);重组菌SE(pB-E)经28℃振荡培养后转接于新鲜含Kan抗性LB液体培养基继续培养,待细菌OD600数值约0.3~0.4时,迅速升温至42℃诱导以制备沙门菌菌影SE-ghost,裂解完成后,4500rpm,15min离心菌液收集菌影,用冷冻干燥仪进行冻干,获得SE-ghost冻干粉备用;
(3)负载淋病奈瑟菌PorB DNA疫苗的沙门菌菌影双效疫苗的制备:将淋病奈瑟菌PorB DNA疫苗与冻干的沙门菌菌影孵育,加入氯化钙溶液后得到负载的菌影疫苗SE ghost(PorB)。
本发明还提供了上述淋病奈瑟菌-沙门菌菌影双效疫苗、制备方法及其在免疫效力评价方面的应用。
本发明的技术方案达到了如下的有益效果:
(1)本发明提供了一种淋病奈瑟菌-沙门菌双效疫苗,该疫苗中,巧妙地将沙门菌菌影作为载体装载淋病奈瑟菌PorB DNA疫苗,使得该淋病奈瑟菌-沙门菌双效疫苗具有良好的安全性、能同时诱导机体产生和提高针对淋病奈瑟菌和沙门菌的特异性体液免疫应答、黏膜免疫应答,且具有较高的抗体水平;有效地解决了目前尚无有效的淋病疫苗面世的技术问题。
(2)本发明提供了沙门菌菌影SE-ghost的制备方法,裂解效率约99%。沙门菌菌影可作为载体装载核酸有较高的装载效率。将淋病奈瑟菌PorB DNA疫苗与沙门菌菌影冻干粉孵育后得到负载淋病奈瑟菌PorB DNA疫苗的沙门菌菌影SE ghost(PorB)。
(3)使用该方法制备的淋病奈瑟菌-沙门菌双效疫苗中,SE ghost(PorB)可同时诱导出针对淋病奈瑟菌和沙门菌的特异性体液免疫应答(血清IgG抗体)和黏膜免疫应答(IgA抗体),其抗体水平均明显高于单独淋病奈瑟菌PorB DNA疫苗和沙门菌菌影疫苗;且能同时产生针对淋病奈瑟菌和沙门菌的免疫保护效力,显示了互为佐剂的双效免疫增强作用;该负载疫苗的研制进一步拓宽了淋病疫苗、沙门菌疫苗的研究领域,因而具有广阔的市场前景。
附图说明
图1是是重组质粒pVAX1-PorB的酶切鉴定图。。
图2是重组菌裂解效率结果图。
图3SE ghost透射电镜图
图4是SE-ghost(PorB)的制备效果电泳鉴定图。
图5是SE-ghost(PorB)免疫小鼠血清中抗淋病奈瑟菌PorB的IgG抗体水平。
图6是SE-ghost(PorB)免疫小鼠阴道洗液中抗淋病奈瑟菌PorB的IgA抗体水平。
图7是SE-ghost(PorB)免疫小鼠血清补体介导的抗体杀伤淋病奈瑟菌的作用结果。
图8是SE-ghost(PorB)免疫小鼠血清中抗沙门菌的IgG抗体水平。
图9是SE-ghost(PorB)免疫小鼠粪便上清中抗沙门菌的IgA抗体水平。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
1、淋病奈瑟菌PorB DNA疫苗的制备
参照GenBank中淋病奈瑟菌PorB基因的序列,设计合成一对引物:上游引物(P1):CGGGGATCCATGAAAAAATCCCTGATTGCCCTG,下游引物(P2):CCCCTGCAGTTAGAATTTGTGGCGCAGAACGAC。这对引物覆盖整个PorB基因,预期扩增目的片段大小为1.1kb。以淋病奈瑟菌WHO株基因组DNA为模板,PCR扩增出目的基因PorB,序列测定结果表明,PorB大小为1053bp,与GenBank公布的多株淋病奈瑟菌孔蛋白PorB的序列具有100%的同源性。PCR产物经双酶切回收后将其重组到真核表达载体pVAX1中,经PCR和双酶切(图1)鉴定后,获得重组真核表达质粒pVAX1-PorB。大量提取质粒,测得OD260/OD280=1.7-1.8。用0.01M pH 7.2PBS稀释后冻存于-20℃备用。
2、沙门菌菌影的制备
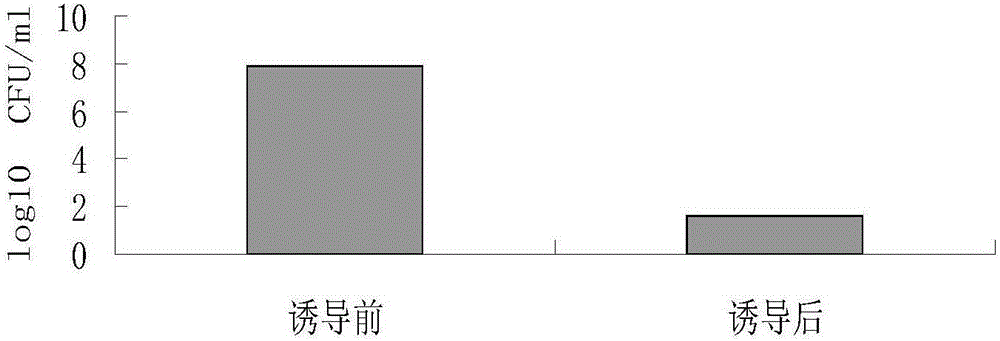
将噬菌体裂解基因E插入到温控表达载体pBV220中制得溶菌质粒p-E,以p-E为模板,为了制备出能在沙门菌中诱导表达的质粒pB-E,本部分采用了PBBR-MCS2克隆载体,将PCR扩增得到的溶菌盒重组到上述克隆载体中并将其转入沙门菌中。重组菌接种于5ml含Kan抗性LB液体培养基中,28℃200rpm振荡培养8-10h。次日以1:500比例转接于2000ml含Kan抗性LB液体培养基,28℃200rpm振荡培养。待细菌培养至OD600值约为0.3~0.4时,迅速升温至42℃诱导表达以制备沙门菌菌影SE-ghost。取诱导前与诱导后菌液经系列稀释后涂布于LB平板上,于37℃培养15小时,通过计数CFU评价裂解效率。结果显示,裂解效率约99%(图2)。取诱导前与诱导后菌液经过戊二醛前固定,四氧化锇后固定,乙醇逐级脱水,依次加入丙酮,丙酮/树脂(1:1)1h,丙酮:树脂(1:2),树脂包埋,制作超薄切片,透射电子显微镜观察。结果显示,诱导前的细菌内部充满内容物,呈现黑色,而诱导后细菌内容物排出,呈现透明的空泡状结构(图3)。大量制备菌影后,经超纯水洗涤3次,用真空冷冻干燥仪进行冻干,获得SE-ghost冻干粉,-70℃保存备用。
3、负载淋病奈瑟菌PorB DNA疫苗的沙门菌菌影双效疫苗的制备
为了优化DNA疫苗负载沙门菌菌影的条件,我们将不同浓度的真核表达质粒pVAX1-PorB与沙门菌菌影孵育。优化后的制备条件是:将5mg沙门菌菌影冻干粉重悬于7mg淋病奈瑟菌PorB DNA溶液中,加入终浓度为25mM CaCl2,置于37℃恒温摇床,220rpm振摇孵育2h,8000rpm离心5min。用超纯水洗涤沉淀3次,4500rpm离心5min,沉淀用PBS悬浮,4℃保存备用。琼脂糖凝胶电泳评价装载效率(图4)。结果表明,淋病奈瑟菌PorB DNA疫苗被成功装载入沙门菌菌影中。
实施例2
本实施例2中对实施例1中所制备而得的淋病奈瑟菌-沙门菌双效疫苗进行了免疫效力评价,其具体步骤如下:
(1)作为淋病疫苗的免疫效力评价:
1)动物分组及免疫:
30只6周龄SPF级BALB/c小鼠,随机分成3组:SE-ghost(PorB)组、pVAX1-PorB组和PBS对照组。小鼠免疫前10h断食和断水,并在免疫前半小时给小鼠灌胃口服100μl的10%碳酸氢钠溶液,灌胃口服免疫3~4h后给水给食。SE-ghost(PorB)组免疫剂量为1×109CFU,pVAX1-PorB为100μg。每两周免疫一次,共免疫3次。
2)免疫小鼠体液免疫应答水平的检测:
三免二周,于小鼠眼静脉丛采血,进行间接ELISA试验。
间接ELISA试验:纯化的重组蛋白PorB作为抗原包被96孔聚苯乙烯酶标板,每孔100μl,4℃包被过夜。次日,用PBST洗涤3次后,每孔加入10%牛血清的封闭液200μl,4℃封闭过夜。待测小鼠血清作为一抗,HRP标记的羊抗鼠IgG作为二抗,将底物缓冲液TMB以80μl/孔加入孔底,使用酶标仪读取各孔450nm处的OD值。结果表明,第三次免疫后,SE-ghost(PorB)组血清IgG抗体水平明显增加,显著高于pVAX1-PorB组(P<0.01)(图5)。研究结果表明,SE-ghost(PorB)诱导小鼠产生抗淋病奈瑟菌PorB的特异性体液免疫应答,且SE-ghost可增强淋病奈瑟菌PorB DNA疫苗的体液免疫应答水平,具有免疫佐剂效应。
3)免疫小鼠黏膜免疫应答水平的检测:
三免二周,收集小鼠阴道洗液,进行间接ELISA试验。
间接ELISA试验:纯化的重组蛋白PorB作为抗原包被96孔聚苯乙烯酶标板,每孔100μl,4℃包被过夜。次日,用PBST洗涤3次后,每孔加入10%牛血清的封闭液200μl,4℃封闭过夜。待测小鼠阴道洗液作为一抗,HRP标记的羊抗鼠IgA作为二抗,将底物缓冲液TMB以80μl/孔加入孔底,使用酶标仪读取各孔450nm处的OD值。结果表明,第三次免疫后,SE-ghost(PorB)组阴道洗液IgA抗体水平明显增加,显著高于pVAX1-PorB组(P<0.01)(图6)。研究结果提示SE-ghost(PorB)诱导小鼠产生抗淋病奈瑟菌PorB的特异性黏膜免疫应答,SE-ghost可增强淋病奈瑟菌PorB DNA疫苗的黏膜免疫应答水平,具有免疫佐剂效应。
4)作为淋病疫苗的免疫效果评价:
血清中补体介导的抗体杀菌活性试验:将淋病奈瑟菌WHO-A作为活菌检测原、各组待检血清用PBS倍比稀释作为抗体、人新鲜血清作为补体,按比例分别加入10%活菌检测原、80%稀释血清和10%补体,充分混匀,37℃孵育30min。将处理后的菌液适当稀释后分别涂布于淋病奈瑟菌FB固体培养基上,37℃5%CO2孵育36h。计数细菌菌落数并计算相对存活率。同时以等量淋病奈瑟菌稀释液涂板为阴性对照。相对存活率=各实验组涂板的菌落数/以等量淋病奈瑟菌涂板的菌落数×100%。结果显示,SE-ghost(PorB)组血清抗体的补体介导的淋病奈瑟菌杀菌作用效果显著高于pVAX1-PorB组(P<0.01)。PBS组血清抗体没有补体介导的杀伤淋病奈瑟菌的作用(图7)。研究结果提示SE-ghost可增强淋病奈瑟菌PorB DNA疫苗的免疫保护效果。
(2)作为沙门菌疫苗的免疫效力评价:
1)动物分组及免疫:
30只6周龄SPF级BALB/c小鼠,随机分成3组:SE-ghost(PorB)组、SE-ghost组和PBS对照组。小鼠免疫前10h断食和断水,并在免疫前半小时给小鼠灌胃口服100μl的10%碳酸氢钠溶液,灌胃口服免疫3~4h后给水给食。SE-ghost组、SE-ghost(PorB)组免疫剂量为1×109CFU。每两周免疫一次,共免疫3次。
2)免疫小鼠体液免疫应答水平的检测:
三免二周,于小鼠眼静脉丛采血,进行间接ELISA试验。
间接ELISA试验:将灭活沙门菌用包被液稀释浓度为5×108CFU/ml包被酶标板,每孔加100μl,4℃包被过夜。用PBST洗涤3次后,每孔加入10%牛血清的封闭液200μl,4℃封闭过夜。待测小鼠血清作为一抗,HRP标记的羊抗鼠IgG作为二抗,每孔加入80μl底物缓冲液TMB,使用酶标仪读取各孔450nm处的OD值。结果显示,在三免后,SE-ghost组、SE-ghost(PorB)组血清IgG抗体水平显著高于PBS组(P<0.01),且SE-ghost(PorB)组血清IgG的抗体水平显著高于SE-ghost组(P<0.01)(图6)。研究结果提示SE-ghost(PorB)灌胃接种小鼠诱导产生抗沙门菌的特异性的体液免疫应答,PorB能显著提高SE-ghost的体液免疫应答水平,具有免疫增强效应。
3)免疫小鼠黏膜免疫应答水平的检测:
三免二周,收集小鼠粪便,进行间接ELISA试验。
间接ELISA试验:将灭活沙门菌用包被液稀释浓度为5×108CFU/ml包被酶标板,每孔加100μl,4℃包被过夜。用PBST洗涤3次后,每孔加入10%牛血清的封闭液200μl,4℃封闭过夜。待测小鼠粪便上清作为一抗,HRP标记的羊抗鼠IgA作为二抗,每孔加入80μl底物缓冲液TMB,使用酶标仪读取各孔450nm处的OD值。结果显示,在三免后,SE-ghost组、SE-ghost(PorB)组黏膜IgA抗体水平显著高于PBS组(P<0.01),且SE-ghost(PorB)组黏膜IgA抗体水平显著高于SE-ghost组(P<0.05)(图9)。研究结果表明,SE-ghost(PorB)接种小鼠诱导产生抗沙门菌的特异性的黏膜免疫应答,PorB能显著提高SE-ghost的黏膜免疫应答水平,具有免疫增强效应。
4)沙门菌感染后各组的保护效力:
于末次免疫后2周,试验鼠灌胃口服1×1010CFU肠炎沙门菌HA2株,每日观察小鼠存活情况,分析疫苗保护效果。结果显示,PBS组小鼠共死亡6只,SE-ghost组小鼠死亡2只,SE-ghost(PorB)组症状较轻,小鼠没有死亡(见表1)。结果表明,淋病奈瑟菌PorB能提高SE-ghost的免疫保护效果,具有免疫增强效应。
表1:SE-ghost(PorB)免疫小鼠抗沙门菌感染的免疫保护试验结果
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!